-
烟酰胺腺嘌呤二核苷酸(NAD)是一种经典辅酶,对线粒体电子转移反应至关重要,在许多生物学功能中起着关键作用[1]。烟酰胺单核苷酸(NMN)是NAD生物合成的关键中间体。NMN在心脑血管疾病、肝肾功能、血管和内皮功能,以及免疫和炎症、衰老等各类疾病治疗方面都具有相当强的潜力[2],常被人称为“万能药”。NMN能够通过口服、静脉注射、腹腔注射(小鼠)等多种给药途径进入体内,通常具有较高的安全性。在急性毒性实验中,小鼠连续7 d给予最大灌胃剂量和饱和浓度的NMN,每天1次,耐受性良好,除血清丙氨酸氨基转移酶略有升高外,其余生物标志物基本保持不变,而相同处理条件下的比格犬,会有轻度的肌酐和尿酸升高[3];在长期给药实验中,小鼠连续12个月给予100和300 mg/kg的NMN,均未出现不良反应[4]。在出血性休克治疗方面,对出血性休克大鼠模型,术前连续5 d的NMN饮水给药和术后静脉推注NMN均能缩短休克复苏时间和提高复苏后的存活率[5]。据报道[6-9],在炎症治疗方面,NMN及相关代谢产物烟酰胺核糖、烟酰胺都具有一定抗炎作用。
内毒素休克是由感染引起的全身炎症反应综合征,会导致各系统衰竭,包括循环系统、呼吸系统、血液系统,损害肝脏和肾脏功能[10]。相关研究显示,最佳的治疗时间在发病6 h内,能够提高患者的生存率,降低病死率[11]。目前临床内毒素休克以药物治疗为主(如血管活性药物、激素、抗菌素等)[12],同时辅以液体复苏、脑神经保护、吸氧等常规治疗。为便于对内毒素休克开展研究治疗,通常使用LPS进行内毒素休克动物造模,LPS是G-菌细胞壁外膜上的主要成分,也叫内毒素,能引起严重的炎症级联反应,是G-菌的主要致病成分之一[13]。
目前,NMN对内毒素休克的治疗作用尚未知。本研究旨在探究NMN对LPS诱导的内毒素休克小鼠模型的死亡率影响,为阐明NMN在内毒素休克治疗方面的作用提供线索。
-
烟酰胺单核苷酸[NMN,纯度≥95%,−25~−15 ℃保存,邦泰生物工程(深圳)有限公司];烟酰胺单核苷酸[NMN~,纯度≥95%,2~8 ℃保存,尚科生物医药(上海)有限公司];脂多糖(LPS,美国Sigma公司);BT25S精密电子天平[赛多利斯科学仪器(北京)有限公司];独立通风系统(上海鸣励实验室科技发展有限公司)。
-
SPF级8周龄雄性C57BL/6J小鼠(西普尔-必凯实验动物有限公司)。实验前在相对洁净的环境下使用独立通风系统,将动物适应性饲养2周。期间动物自由饮水、进食。笼具内温度22~26 ℃、湿度40%~70%,笼内维持正压20~25 Pa,每小时换气次数60~70次,室内明暗交替12 h(8:00~20:00照明)。
-
根据不同实验目的,将C57BL/6J小鼠随机分为给药组和对照组。腹腔注射LPS(10 mg/kg)进行内毒素休克造模,在造模前或者造模后进行NMN腹腔注射给药,给药方式分为单次给药和两次给药方式。具体分成5个实验:①造模后0.5 h给药,剂量为10、30、100、300 mg/kg;②造模前0.5 h给药,剂量为30、100、300、600 mg/kg;③造模后0.5 h和12 h两次给药,每次300 mg/kg;④造模后0.5 h和12 h分别用2种不同厂家的NMN给药,剂量为300 mg/kg;⑤造模前0.5 h用不同厂家的NMN给药,剂量为300 mg/kg。
-
使用Log-rank检验,对给药组和溶剂对照组的生存曲线进行比较,P<0.05为差异有统计学意义,使用GraphPad Prism8软件对数据进行统计分析。
-
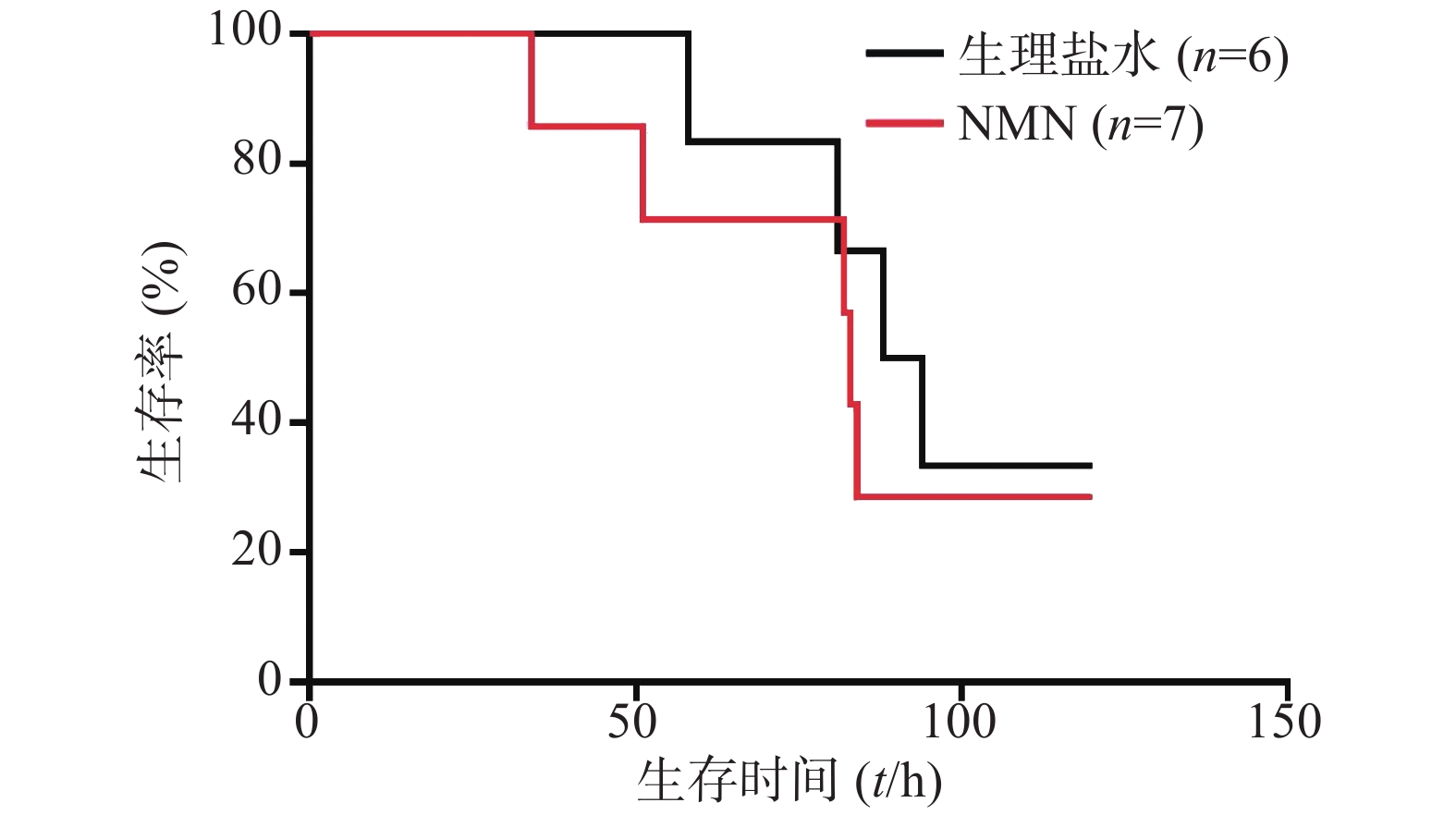
如图1所示,LPS造模后0.5 h给予300 mg/kg NMN组小鼠首次出现死亡的时间比生理盐水组更早,整个观察期间给药组小鼠死亡的总体趋势要稍快于生理盐水组,且在观察末期存活的动物数量略少。但两组生存曲线之间比较无统计学差异(P=0.2161)。因此,LPS造模后0.5 h给予300 mg/kg NMN不具有治疗内毒素休克的作用,甚至有轻微增加内毒素休克死亡率的趋势。
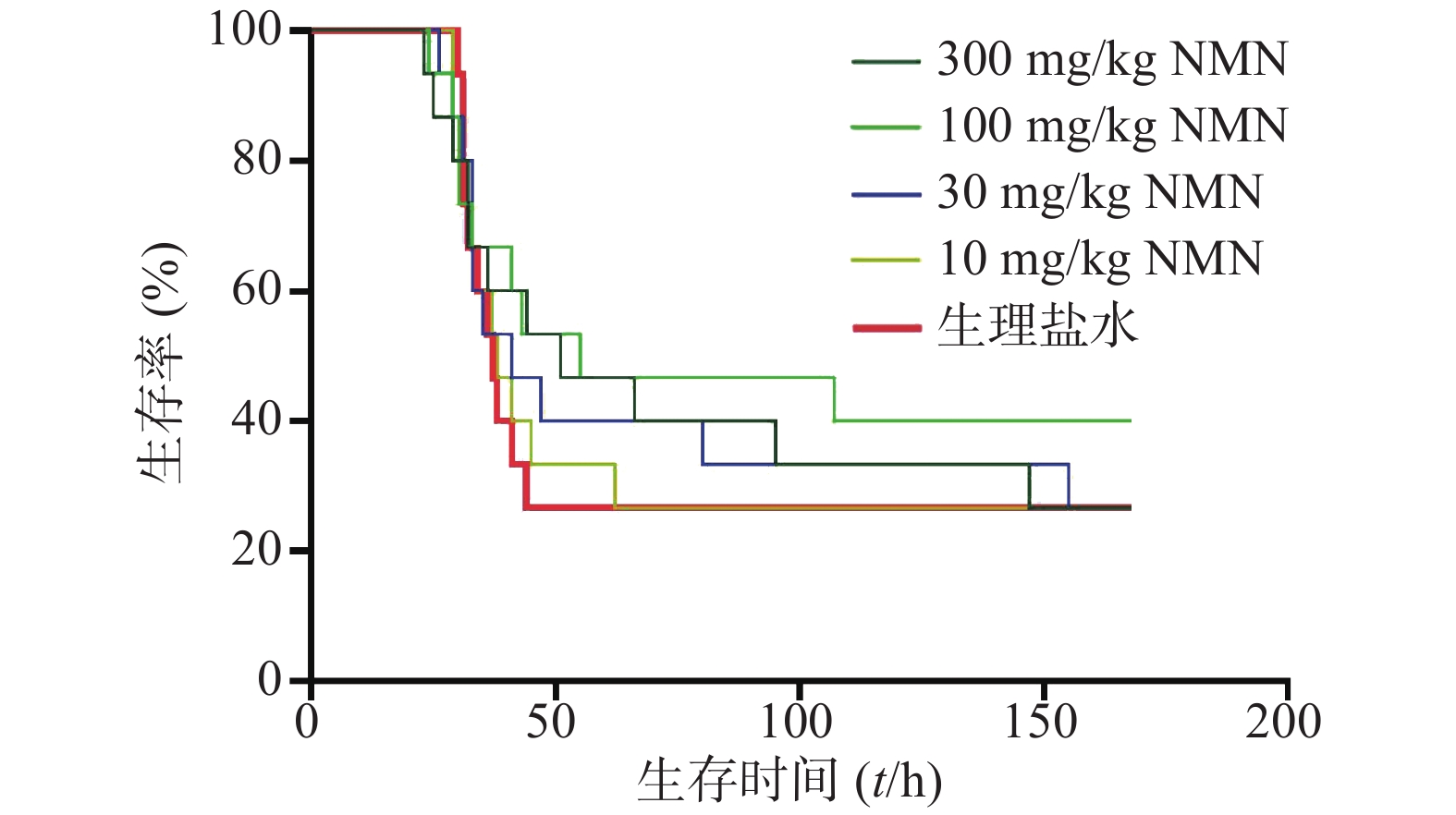
实验进一步考察了LPS造模后0.5 h给予多个不同剂量NMN对内毒素休克死亡率的影响,如图2所示,与生理盐水组相比,10、30、100、300 mg/kg NMN给药组的小鼠首次出现死亡的时间均接近,各组中位生存时间:300、100、30、10 mg/kg给药组分别为51、55、41和38 h,生理盐水组为37 h。整个观察期间NMN给药各组死亡速度较生理盐水组稍缓,其中放缓趋势最明显的是100 mg/kg剂量组,但均不具有统计学意义(P=0.4334),表明小鼠在LPS造模后0.5 h单次给予NMN不能改善内毒素休克死亡率或减缓死亡速度。
-
在LPS造模前0.5 h进行NMN给药。如图3所示,300 mg/kg NMN预防给药组小鼠首次出现死亡的时间稍早于生理盐水组,而2组死亡的总体趋势相近,前者的中位生存时间为83 h,后者为91 h,生存曲线比较无统计学差异(P=0.5946),故LPS造模前0.5 h给予300 mg/kg NMN不能改善内毒素休克小鼠的死亡率,不具有防治作用。
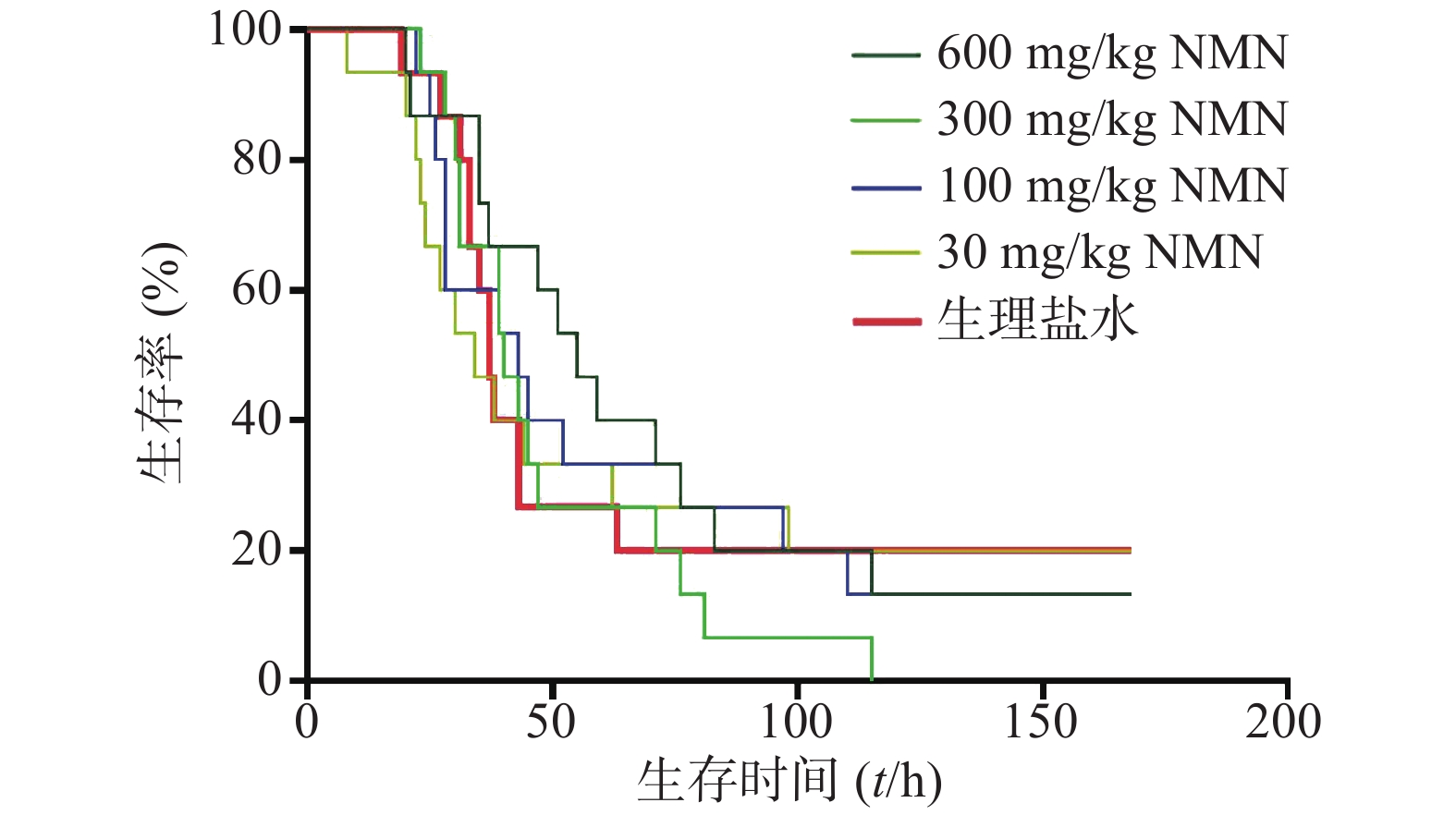
随后又进行多个不同剂量NMN单次预给药实验。如图4所示,NMN 30、100、300、600 mg/kg组与生理盐水组小鼠首次出现死亡的时间均相近,之后各组死亡趋势也类似,各组中位生存时间分别是:NMN给药组30 mg/kg为34 h、100 mg/kg为43 h、300 mg/kg为40 h、600 mg/kg为55 h,生理盐水组为37 h,各组生存曲线也无统计学意义。结果表明,在造模前进行NMN单次预给药对于LPS构建的内毒素休克模型无明显改善生存率的作用。
-
考虑到NMN在体内的代谢速度较快,能够迅速入血进入各个组织器官并代谢为活性分子NAD,而NAD被证明在多种炎症性疾病中具有保护作用,因此,观察NMN的2次给药是否对内毒素休克有治疗效果。
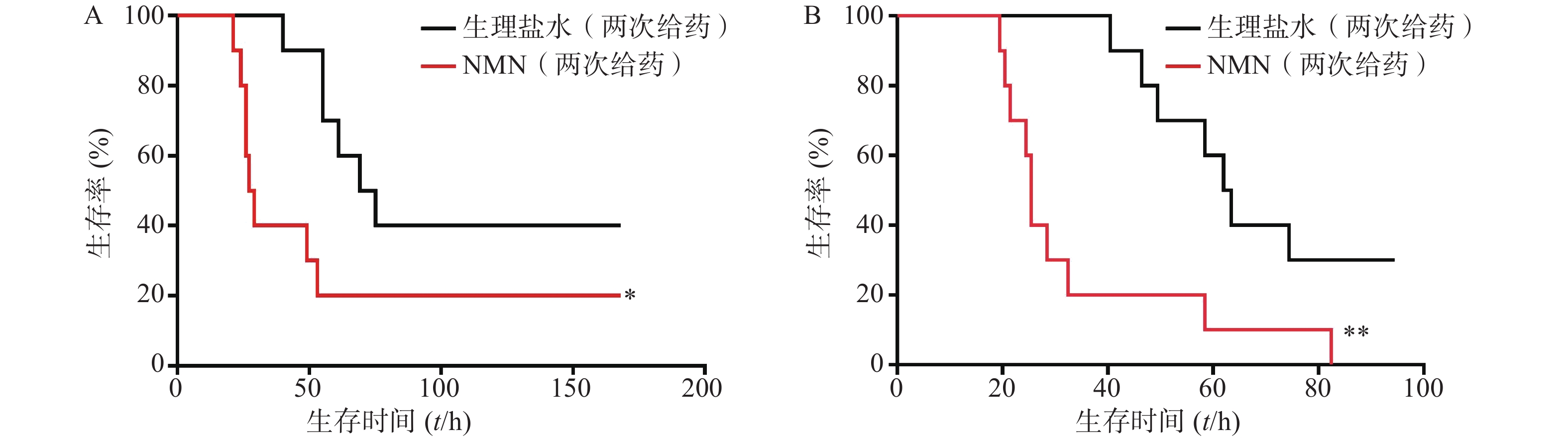
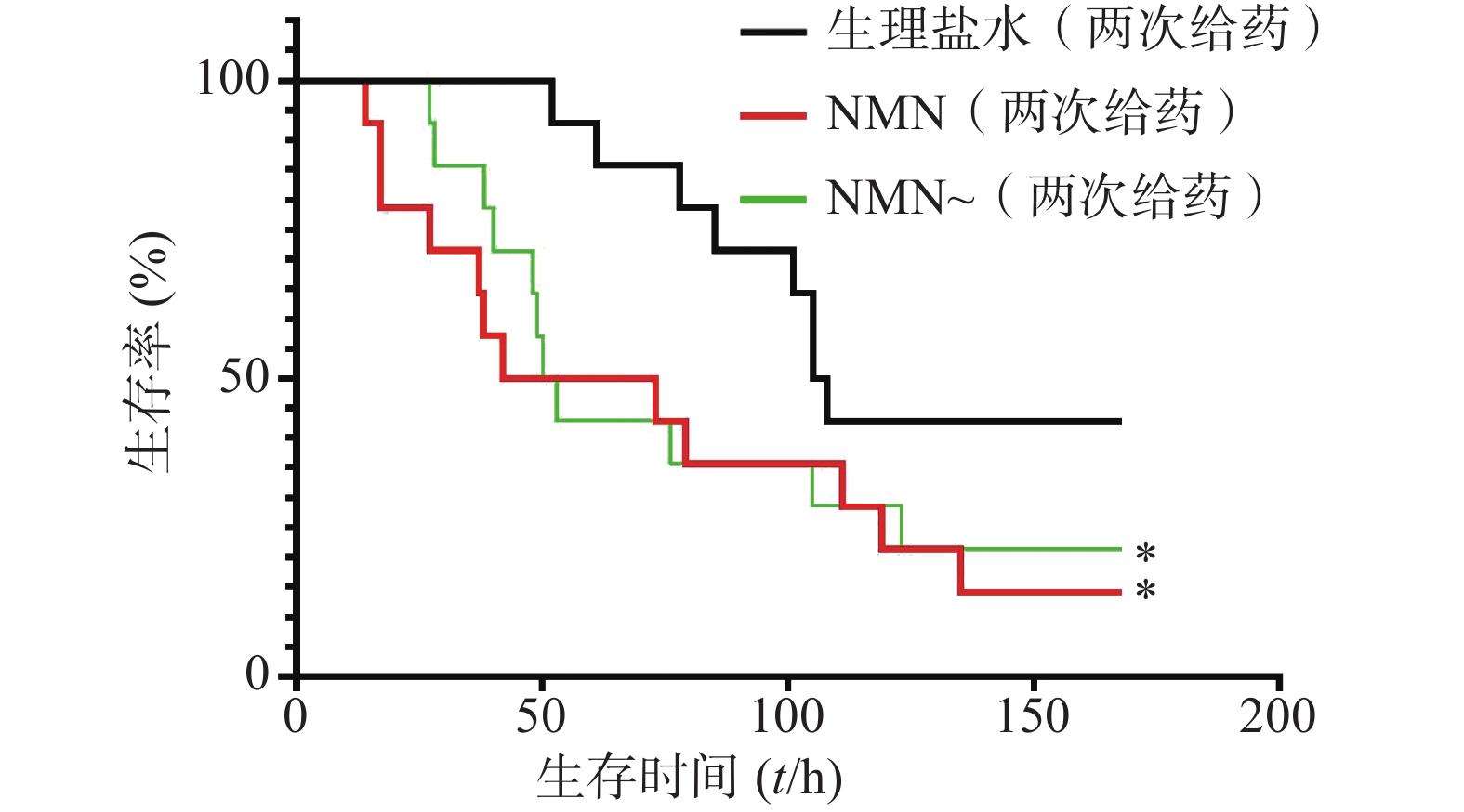
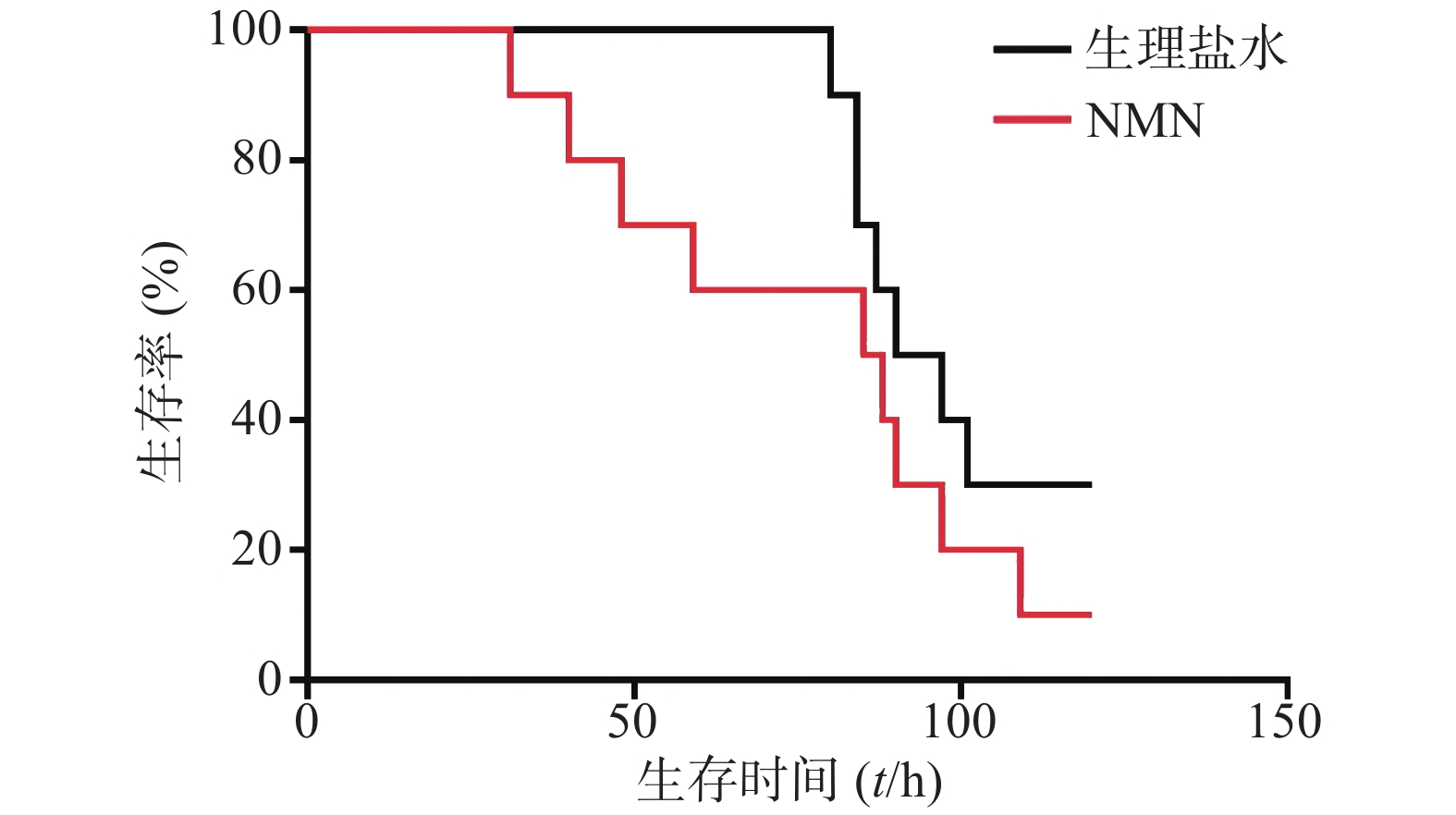
如图5所示,2次重复实验结果均表明,LPS造模后0.5 h和12 h,给予2次NMN(每次300 mg/kg)治疗组小鼠其首次出现死亡的时间早于生理盐水组;之后,NMN治疗组小鼠死亡速度明显快于对照组,且观察末期NMN治疗组小鼠存活率不及对照组一半,2次重复实验的生存曲线间均具有统计学差异(P=0.0404;P=0.0038)。因此,该结果表明,LPS造模后2次NMN给药明显增加小鼠内毒素休克死亡率。
-
不同厂家生产的NMN因药物纯度、杂质成分不同等,可能导致治疗效果有差别。为排除非药物分子本身因素如厂家生产工艺因素,进一步明确上述NMN治疗内毒素休克的作用,接着引入另一厂家生产的NMN(以下均简称NMN~),并同时测试比较两家NMN产品治疗内毒素休克的效果。
实验首先对LPS造模后0.5 h和12 h的2次给予NMN(每次300 mg/kg)增加内毒素休克死亡率的作用进行了验证。如图6所示,NMN给药组和NMN~给药组这2组小鼠首次出现死亡的时间和观察末期小鼠存活数都接近,整个观察期小鼠死亡趋势非常相似,与生理盐水对照组相比,两组都明显加重内毒素休克小鼠的死亡率,与对照组的生存曲线间均有统计学差异(P=0.0499;P=0.0260)。3组中位生存时间分别是:NMN给药组57.5 h、NMN~给药组51.5 h、生理盐水组106.5 h。此外,该结果与上述单个NMN产品连续2次给药效果类似(图5)。因此,两家NMN产品效果基本相同,也进一步证明了LPS造模后0.5 h和12 h的2次给予NMN(每次300 mg/kg)确实可加重内毒素休克病情,加速小鼠的死亡。
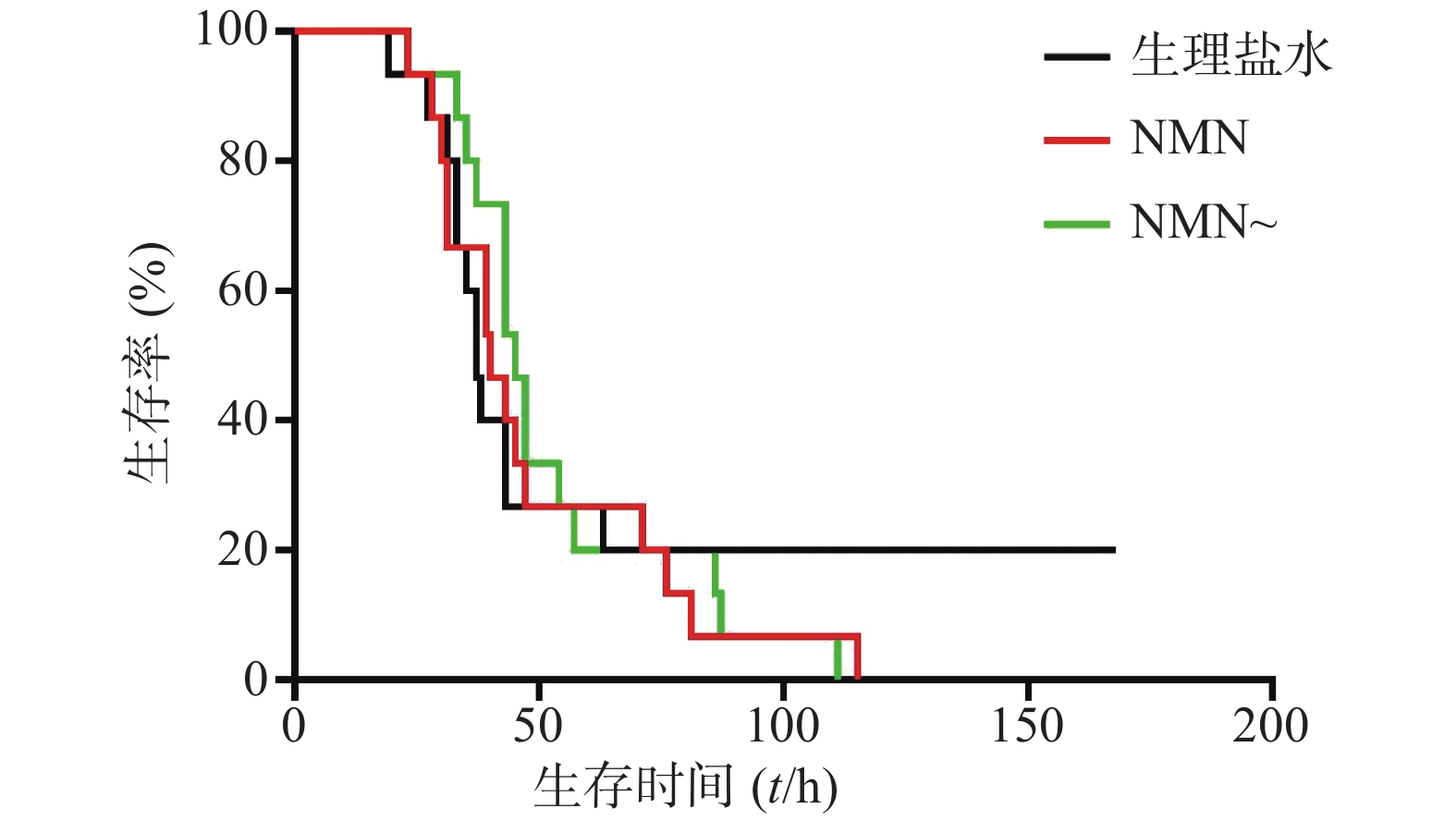
最后,实验又考察了两家NMN产品预防给药效果,即在LPS造模前0.5 h进行NMN或NMN~给药。如图7所示,NMN组、NMN~组、生理盐水组3组小鼠首次出现死亡的时间及之后每组小鼠死亡的速度都相近,直至每组均剩20%小鼠存活(第71小时)。之后,生理盐水组小鼠不再死亡,而NMN组、NMN~组小鼠陆续死亡殆尽。3组中位生存时间分别是:NMN给药组40 h、NMN~给药组45 h、生理盐水组37 h。可见,两家NMN产品作用相似,对LPS所致的内毒素休克无治疗效果,且与生理盐水组比较时均有加重内毒素休克死亡率的趋势,但是均无统计学意义(P=0.6447;P=0.9725)。该结果与上述NMN单次预防给药的实验结果相一致(图3和图4)。
-
目前NMN是保健品领域的开发热点,以抗衰老以及各类疾病治疗作用为目的,在国内外已有不少人开始服用NMN[14]。但是NMN对内毒素休克的作用尚未知,对患有这种疾病的患者能否服用NMN亦不清楚。
根据现有的研究报道,NMN在小鼠疾病模型其腹腔注射给药的有效剂量为10~600 mg/kg[2, 4]。本实验中,我们测试了不同NMN剂量尤其是300 mg/kg时对小鼠内毒素休克的治疗效果,结果显示,小鼠在LPS造模后0.5 h或造模前0.5 h单次给予不同剂量NMN均无明显改善生存率的作用,不具有治疗效果;甚至在LPS造模后两次NMN给药明显增加小鼠内毒素休克死亡率。为排除厂家生产工艺等因素,我们又同时用两个厂家生产的NMN产品进行实验,以重复上述结果,最终再次证明LPS造模后两次给予NMN确实可加速小鼠的死亡,增加死亡率。
因此,本次实验结果表明,NMN在某些疾病尚未证明其安全性的情况下,应谨慎推广,尤其是内毒素休克的患者,应慎用甚至是禁用NMN治疗。
Effect of nicotinamide mononucleotide on mortality of mice with endotoxic shock
-
摘要:
目的 探究烟酰胺单核苷酸(NMN)对脂多糖(LPS)诱导的内毒素休克小鼠死亡率的影响。 方法 将10周龄C57BL/6J雄性小鼠随机分组,均腹腔注射LPS(10 mg/kg)造模。NMN腹腔注射给药,分为3种方式:①造模后0.5 h给药,剂量为10、30、100、300 mg/kg;②造模前0.5 h给药,剂量为30、100、300、600 mg/kg;③造模后0.5 h和12 h两次给药,每次300 mg/kg。观察记录每组小鼠的死亡情况,并绘制生存曲线。 结果 与溶剂对照组相比,造模后0.5 h或造模前0.5 h给予不同剂量NMN,均不能改善小鼠死亡率或延缓死亡时间;造模后0.5 h和12 h两次给予NMN会加速小鼠死亡,增加小鼠死亡率。两个厂家的NMN产品效果类似。 结论 NMN对LPS诱导的内毒素休克小鼠不具有治疗作用,小鼠内毒素休克发生后进行NMN多次给药会增加死亡率。 Abstract:Objective To study the effect of nicotinamide mononucleotide (NMN) on the mortality of the lipopoly-saccharide (LPS)-induced endotoxic shock mouse model. Methods 10-week-old C57BL/6J male mice were randomly divided into groups, and were injected intraperitoneally (i.p.) with LPS (10 mg/kg) to induce endotoxic shock models. NMN was i.p. injected in three ways: (1) 0.5 h after modeling, doses of 10, 30, 100 and 300 mg/kg; (2) 0.5 h before modeling, doses of 30, 100, 300 and 600 mg/kg; or (3) 0.5 and 12 h after modeling, dose of 300 mg/kg each time. The death times of each group were recorded, and the survival curves were drawn. Results Compared with the solvent control group, NMN at different doses given 0.5 h after or before modeling didn’t improve the survival rate or delay the death time of endotoxic shock mice; But when given at 0.5 and 12 h 300 mg/kg after modeling, NMN accelerated the death of mice and increased the mortality of mice. NMN products by two manufacturers showed similar effects. Conclusion NMN has no therapeutic effect on LPS-induced endotoxic shock, and repeated administration of NMN after endotoxic shock will increase the mortality. -
Key words:
- nicotinamide mononucleotide /
- lipopolysaccharide /
- endotoxic shock /
- mortality
-
嘧啶类化疗药物在肿瘤治疗中的地位越来越重要,其代表药物5-氟尿嘧啶及其口服前药卡培他滨更受到了广泛关注,体内二氢尿嘧啶脱氢酶(DPD)是此类药物代谢的限速酶之一[1],前瞻性评价DPD的总体活性有利于提高药物疗效及减少患者的毒副反应,对临床具有重要意义。内源性物质尿嘧啶(U)是体内DPD的天然底物,在此酶的催化下生成二氢尿嘧啶(UH2),并最终通过尿液排出体外。测定血浆中U和UH2的含量,并通过(UH2)/(U)比值计算,可从代谢物的角度评价DPD的活性[2]。临床上常用评价DPD酶活性的方法是测定患者的基因表型,DPD的编码基因DPYD序列中包含了多达7 600个多态位点,使得DPD酶的活性在人群中是高度可变的[3]。不同的突变位点及不同位点的组合给临床检测带来了极大的困难。到目前为止,也只有DPYD*2A的多态性被用于临床实践,用来筛选出5-氟尿嘧啶代谢严重不良的患者,避免严重的毒副反应[4]。单一应用基因的多态性来评价DPD酶的活性在临床上存在一定的困难,基因的多态性并不能直接同下游的酶的活性联系起来,两者并没有完全对等的关系。基因需通过转录、翻译和蛋白的修饰之后才能发挥作用。基因多态联合下游代谢物的含量测定更能准确的评价DPD酶的活性[5]。目前常应用液相色谱-串联质谱联用法对人血浆或干燥唾液中U和UH2浓度进行检测[6-11],但所报道的方法均有一些复杂或难以重现。本研究成功的建立了一种灵敏、高效、准确、重现性好,且能同时测定人血浆中U和UH2浓度的UHPLC-MS/MS方法,为体内DPD总体活性提供更客观有效的评价途径。
1. 材料与方法
1.1 仪器与耗材
1290-6460A超高效液相色谱-串联质谱仪,包含G4220A二元泵、G4226A自动进样器、G1316C柱温箱、MassHunter数据处理工作站(美国Agilent);调速涡旋混合器(美国Labnet);SK7200H超声仪(上海科导超声仪器有限公司);BSA124S-CW分析天平(德国赛多利斯);5810R型低温高速离心机、移液器(德国Eppendorf公司)。
1.2 药品与试剂
尿嘧啶、二氢尿嘧啶和氯尿嘧啶(内标)对照品(纯度>99%,大连美仑生物有限公司);乙酸铵(美国赛默飞世尔科技);甲醇、乙腈、乙酸乙酯、异丙醇(色谱纯,德国默克公司);屈臣氏蒸馏水(广州屈臣氏食品饮料有限公司);牛血清白蛋白(BSA)(上海博光生物科技有限公司);生理盐水(长征医院药学部自制)。
1.3 色谱分离条件
色谱柱为Agilent poroshell 120 SB-Aq-柱(2.1 mm×100 mm,2.7 μm),流动相为5 mmol/L乙酸铵水溶液(A)和乙腈(B),流速为0.3 ml/min,梯度洗脱:0~0.3 min,100% A;0.3~1.0 min,100%~10% A;1.0~2.5 min,10% A;柱温为30 ℃,洗脱时间2.5 min,进样量5 μl。
1.4 质谱分离条件
采用ESI离子源,多重反应监测(MRM)进行一/二级质谱分析,用于定量分析的检测离子为:U[M+H]+ m/z 113.0→40.1,检测模式为正离子模式;UH2[M+H]+ m/z 115.0→55.1,检测模式为正离子模式;氯尿嘧啶(IS)[M-H]- m/z 145.0→42.1,检测模式为负离子模式。雾化温度为300 ℃,雾化气压力为40 psi,干燥气流速为10 L/min,鞘气温度300 ℃,鞘气流速12 L/min,解离电压为4 000 V。
1.5 样本采集
选取8名血浆样品指标正常的成年人,于当日清晨8时空腹状态下静脉采血3 ml, EDTA-3K管抗凝,离心后分离上层血浆, 于−80 ℃冰箱冻存。
1.6 样本预处理
取100 μl样本,加10 μg/ml氯尿嘧啶(IS)10 μl,加乙酸乙酯3 ml,涡旋5 min,1710×g离心10 min,取上层有机相2.7 ml,45 ℃氮气挥干仪挥干,用10%甲醇溶液100 μl复溶,涡旋1 min,取上清液进样分析。
1.7 标准溶液配制
用含有3 %牛血清白蛋白作为空白基质代替血浆配置标准曲线样品。取100 μg/ml的尿嘧啶和二氢尿嘧啶各100 μl,加800 μl水,制成10 μg/ml标准混合液,置于−20 ℃备用。取10 μg/ml标准混合液适量,用3 %牛血清白蛋白稀释制成10、20、50、100、200、500、1000、1500 ng/ml系列浓度样品, 然后按照上述“1.6”项下样品的处理方法配制。
2. 结果
2.1 专属性考察
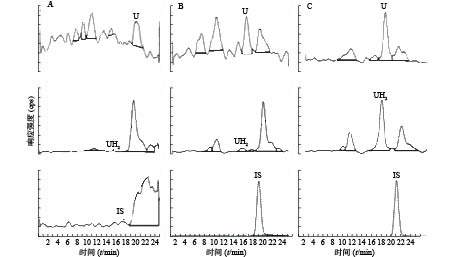
U和UH2的出峰时间以及峰型良好,代替血浆经过前处理后,对待测组分的测定没有干扰,内标对分析物的测定也没有干扰,且能很好分离,结果见图1。
2.2 标准曲线和线性范围
U和UH2的线性范围是10.0~1 500.0 ng/ml,以空白BAS中U和UH2的浓度为横坐标(X),U和UH2与内标化合物氯尿嘧啶的峰面积比为纵坐标(Y),进行最小二乘法加权(权重系数为1/χ2),U和UH2的线性回归方程分别是Y=0.27X+0.0022、Y=0.58X+0.0380,r均>0.990,表明线性关系良好。
2.3 精密度和准确度
取定量下限、低、中、高标准添加血浆样本按照前处理方法进行处理,每个浓度样品平行制备5份进行分析,连续3 d重复操作,根据当天的标准曲线计算当天实测样本浓度,计算样本在低、中和高浓度下的日内、日间精密度和准确度,结果显示,精密度和准确度的偏差均在15%左右。准确度相对偏差在20%范围内时,最低定量下限精密度偏差不大于20%,结果见表1。
表 1 尿嘧啶和二氢尿嘧啶的精密度 (n=5)分析物 标示浓度 (ng/ml) 日内 日间 测定浓度 (ng/ml) 精密度(CV%) 准确性(RE%) 测定浓度 (ng/ml) 精密度(CV%) 准确性(RE%) 尿嘧啶 10 10.2±0.38 3.74 2.58 10.12±0.78 7.70 1.18 20 20.63±1.21 5.87 3.15 19.97±1.35 6.74 −0.16 500 529.73±4.64 0.88 5.95 484.32±35.72 7.37 −3.12 1000 1093.33±25.10 2.30 9.33 1098.25±25.16 2.29 9.82 二氢尿嘧啶 10 10.32±0.71 6.86 3.18 10.28±0.65 6.37 2.77 20 19.98±2.19 10.95 −0.12 19.86±1.85 9.31 −0.72 500 517.51±10.69 2.07 3.50 515.66±10.36 2.01 3.13 1000 1079.83±17.91 1.66 7.98 1080.11±24.50 2.27 8.01 2.4 基质效应和提取回收率
取低、高2个浓度的样本进行基质效应和提取回收率考察,结果显示,U、UH2及内标氯尿嘧啶的基质效应和提取回收率良好,结果均较稳定,结果见表2。
表 2 尿嘧啶和二氢尿嘧啶的基质效应和提取回收率分析物 标识浓度(ng/ml) 基质效应 提取回收率 平均基质效应 CV(%) 平均回收率 CV(%) 尿嘧啶 1000 101.00 6.15 94.98 9.01 20 99.99 3.63 100.01 7.64 二氢尿嘧啶 1000 85.72 2.07 106.47 1.58 20 93.58 4.53 99.54 9.77 2.5 样品稳定性
考察低、高2个浓度的血浆样品经历3次冷冻与解冻循环的稳定性、血浆样品在室温(25 ºC)放置6 h后经样品处理后稳定性和血浆样品经样品处理后室温放置24 h的稳定性,结果显示,3次冻融、6 h室温(25 ºC)条件下和24 h放置自动进样器中的稳定性均符合要求,结果见表3。
表 3 样品的稳定性(RE%)分析物 冻融3次 室温放置6 h 置自动进样器24 h 低 高 低 高 低 高 尿嘧啶 100.71 98.34 93.49 106.60 108.20 107.99 二氢尿嘧啶 92.67 92.64 93.61 107.26 106.97 107.15 2.6 样本检测
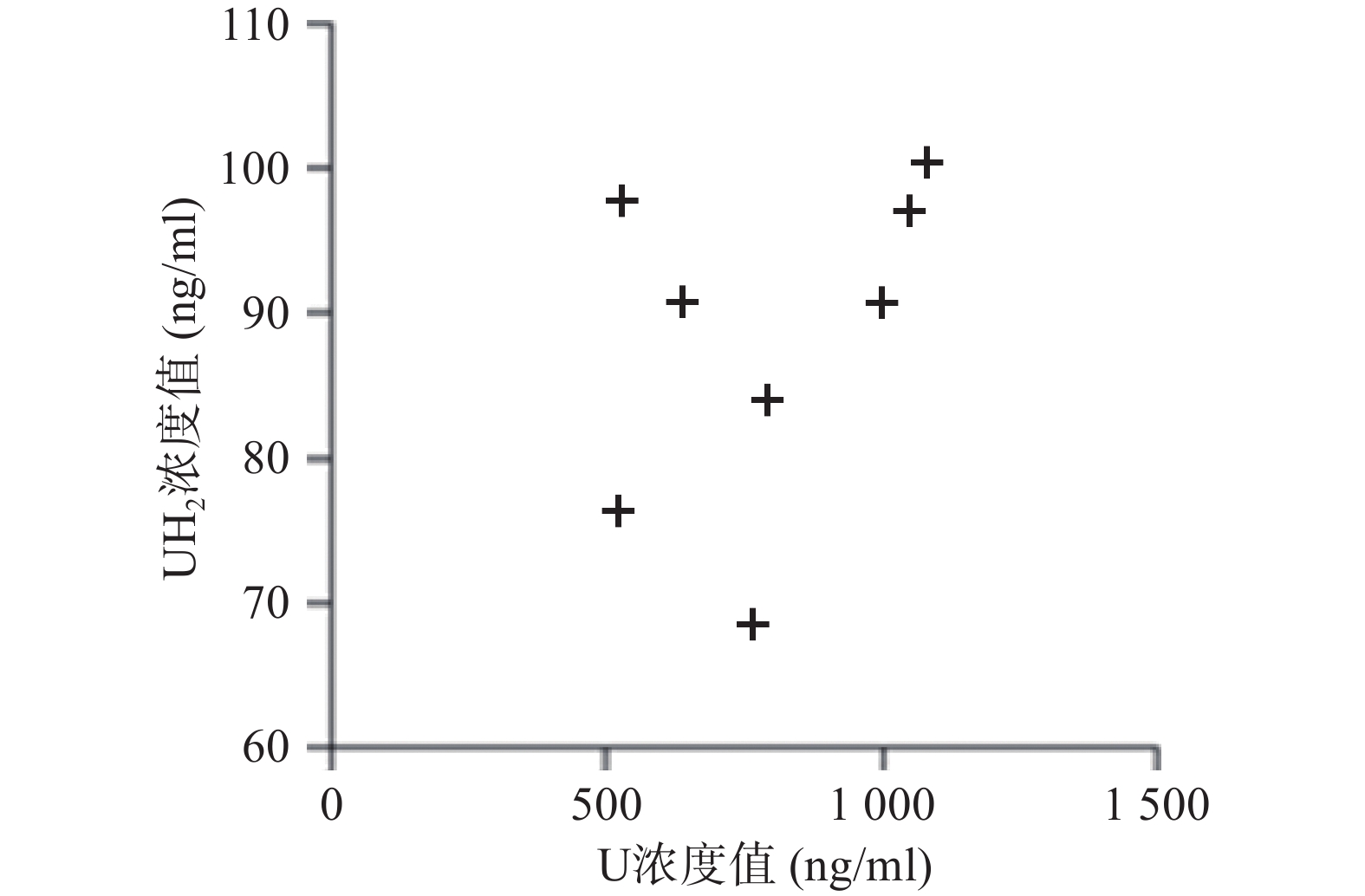
应用本研究所建立的方法,对8名健康成人的血浆样本测定分析,在样本实测过程中, 同时插入已知浓度的随行质控样本(QC样本), 随时监控样本测定的准确度。U和 UH2 浓度测定结果见图2。
3. 讨论
3.1 空白基质的选择
U和UH2是人体内常见的两种物质,且同核酸的代谢密切相关,由于U和UH2均为人体内源性物质,故不能采用人源的基质进行方法学的开发及验证,通过查阅资料,选择了不含U和UH2的3%牛血清蛋白作为基质进行方法学的开发[12]。也有文献报道采用去除U和UH2的人源血浆基质进行方法学实验[9],但基质的来源较珍贵,不适合方法的普及,所以选用3%牛血清蛋白作为替代基质。
3.2 色谱柱的选择
U因其特殊的化学性质,在大部分的色谱柱上均没有保留。U和UH2的LogP值分别为−0.707和−0.840,有较强的亲水性,决定了其不保留的性质。在定量方法的开发过程中,先后采用了Agilent Zorbax SB-C18色谱柱,Agilent Zorbax Eclipse-C18色谱柱,Waters Atlantis T3色谱柱,Waters Xselect色谱柱,Waters Xbridge等色谱柱来进行条件摸索,但上述色谱柱对U和UH2均没有保留。最后,采用Agilent Zorbax SB-Aq对U和UH2进行定量分析,该色谱柱对强极性的化合物有较好的保留效果,同时,兼容100%的起始流动相也对保留产生了良好的结果。
3.3 样本预处理的优化
本研究还分别考察了几种常见的处理方法,包括甲醇和乙腈的蛋白沉淀、Waters Oasis HLB萃取板的固相萃取以及乙酸乙酯,甲基叔丁基醚,二氯甲烷/三氯甲烷,环己烷进行的液液萃取,结果发现乙酸乙酯对U和UH2的萃取效果较好,同时,还分别考察了5%、10%、20%、30%、40%、50%的异丙醇、乙酸乙酯溶液对U和UH2的萃取效果,结果发现,单纯的乙酸乙酯对待测化合物具有较好的提取效率。提取回收率均高于90%,且RSD<10%。另外对3%牛血清蛋白的基质效应进行了考察,结果发现平均基质效应在85%~101%之间,RSD<7%,说明该前处理方法对于基质的清除较为彻底,测定结果稳定,没有明显的基质干扰。
本研究虽重在方法开发,收集的样本数量较少,但从测定的U和UH2浓度分布来看DPD对内源性U的代谢存在个体差异,建议临床应用5-氟尿嘧啶及其卡培他滨筛查DPD总体活性[12-13],后续可进一步扩大样本数量进行深入研究。
4. 结论
本实验建立了一种快速,稳定,高灵敏度的UHPLC-MS/MS方法,可用于测定人体内源性物质U和UH2的含量,从代谢物的角度评价DPD酶的活性,从而协助临床医生制定化疗药物5-氟尿嘧啶及其口服前药卡培他滨合理的用量,以较低的毒副反应获得最大的临床疗效。
-
[1] YOSHINO J, BAUR J A, IMAI S I. NAD+ intermediates: the biology and therapeutic potential of NMN and NR[J]. Cell Metab,2018,27(3):513-528. doi: 10.1016/j.cmet.2017.11.002 [2] HONG W Q, MO F, ZHANG Z Q, et al. Nicotinamide mononucleotide: a promising molecule for therapy of diverse diseases by targeting NAD+ metabolism[J]. Front Cell Dev Biol,2020,8:246. doi: 10.3389/fcell.2020.00246 [3] YOU Y N, GAO Y, WANG H, et al. Subacute toxicity study of nicotinamide mononucleotide via oral administration[J]. Front Pharmacol,2020,11:604404. doi: 10.3389/fphar.2020.604404 [4] MILLS K F, YOSHIDA S, STEIN L R, et al. Long-term administration of nicotinamide mononucleotide mitigates age-associated physiological decline in mice[J]. Cell Metab,2016,24(6):795-806. doi: 10.1016/j.cmet.2016.09.013 [5] SIMS C A, GUAN Y X, MUKHERJEE S, et al. Nicotinamide mononucleotide preserves mitochondrial function and increases survival in hemorrhagic shock[J]. JCI Insight,2018,3(17):120182. doi: 10.1172/jci.insight.120182 [6] MÉNDEZ-LARA K A, LETELIER N, FARRE N, et al. Nicotinamide prevents apolipoprotein B-containing lipoprotein oxidation, inflammation and atherosclerosis in apolipoprotein E-deficient mice[J]. Antioxidants,2020,9(11):1162. doi: 10.3390/antiox9111162 [7] MEHMEL M, JOVANOVIĆ N, SPITZ U. Nicotinamide riboside-the current state of research and therapeutic uses[J]. Nutrients,2020,12(6):1616. doi: 10.3390/nu12061616 [8] KISS T, NYÚL-TÓTH Á, BALASUBRAMANIAN P, et al. Nicotinamide mononucleotide (NMN) supplementation promotes neurovascular rejuvenation in aged mice: transcriptional footprint of SIRT1 activation, mitochondrial protection, anti-inflammatory, and anti-apoptotic effects[J]. Geroscience,2020,42(2):527-546. doi: 10.1007/s11357-020-00165-5 [9] HONG G L, ZHENG D, ZHANG L L, et al. Administration of nicotinamide riboside prevents oxidative stress and organ injury in Sepsis[J]. Free Radic Biol Med,2018,123:125-137. doi: 10.1016/j.freeradbiomed.2018.05.073 [10] 盛杰, 张福琴, 魏萍, 等. 抗菌药物诱导内毒素释放及抗内毒素药物研究进展[J]. 医药导报, 2004, 23(4):252-253. [11] 金泓, 赖旭东, 关信民, 等. 血必净注射液在脓毒血症治疗中的疗效观察[J]. 中医临床研究, 2017, 9(36):71-73. [12] 王洪亮, 章志丹, 黄伟. 拯救脓毒症运动: 脓毒症与感染性休克治疗国际指南(2016)的解读与展望[J]. 中华重症医学电子杂志, 2017, 3(1):26-32. [13] 张含飞, 张金龙, 王振华. 抗内毒素药物的研究进展[J]. 畜牧与饲料科学, 2008, 29(1):57-60. [14] IRIE J, INAGAKI E, FUJITA M, et al. Effect of oral administration of nicotinamide mononucleotide on clinical parameters and nicotinamide metabolite levels in healthy Japanese men[J]. Endocr J,2020,67(2):153-160. doi: 10.1507/endocrj.EJ19-0313 -





 下载:
下载:
 下载:
下载: