-
替考拉宁是一种糖肽类抗生素,临床上主要用于治疗各种严重的革兰阳性菌感染,包括不能用青霉素类和头孢菌素类其他抗生素者。该药的血药浓度与临床疗效密切相关,对于重症感染患者,监测血药浓度可以提高治愈率[1]。临床一般检测其在血浆中的稳态谷浓度,而在不同疾病中,替考拉宁谷浓度需达到对应的目标值才能满足治疗要求,但由于替考拉宁成分复杂,患者在常规剂量使用过程中低于目标谷浓度的发生率很高,因此,对替考拉宁进行血药浓度监测很有必要[2-4]。替考拉宁血浆谷浓度的检测方法目前主要为高效液相色谱(HPLC)法,需要专职人员进行,很多单位尚无条件进行检测。因此,寻找替考拉宁谷浓度的临床预测指标,探讨其与替考拉宁谷浓度的关系,就显得尤为重要。替考拉宁血浆蛋白结合率高,与白蛋白的结合率为 90%~95%,消除半衰期长,除 2%~3% 经肝脏代谢外,大部分以原型经肾脏排泄。肾功能的变化必然对替考拉宁谷浓度产生明显影响,既往研究也显示肌酐清除率会对替考拉宁谷浓度产生明显影响[5-7]。胱抑素C是一种能灵敏反映肾小球滤过率变化的内源性标志物[8],其血中浓度由肾小球滤过率决定,不受炎症反应、肌肉、性别等的影响。本研究主要探讨胱抑素C水平与替考拉宁血浆稳态谷浓度的关系,以期为临床替考拉宁的合理应用提供依据。
-
本研究收集2017年10月−2020年7月在陆军军医大学第一附属医院进行替考拉宁血药浓度监测患者。患者纳入标准:①年龄≥18岁;②住院患者;③替考拉宁谷浓度为稳态谷浓度。排除标准:①孕妇;②未监测肝肾功能者;③血液透析者。本研究经本院伦理委员会批准(批号:KY2020109)。
-
患者每日经静脉滴注给予替考拉宁(给药剂量为200~800 mg,qd,根据患者疗效和不良反应以及血药浓度监测结果对给药剂量进行调整;患者疗程为7~67 d),最早于第6剂(替考拉宁谷浓度达稳态)给药前30 min,用EDTA管采集静脉血4 ml,3 500 r/min室温离心5 min,取出血浆按下述高效液相色谱(HPLC)法测定其谷浓度。替考拉宁对照品溶液:取替考拉宁对照品适量,精密称定(20.00 mg)后置于10 ml棕色量瓶中,用超纯水溶解并稀释至刻度,混匀,即得。哌拉西林钠对照品溶液:取哌拉西林钠对照品(内标)适量,精密称定(15.43 mg)后置于100 ml棕色量瓶中,用甲醇溶解并稀释至刻度,混匀,即得。色谱柱:Diamonsil C18(250 mm×4.6 mm,5 µm);柱温:40 ℃;流动相:0.01 mol/L磷酸二氢钠-乙腈(76∶24,V/V);流速:1.6 ml/min;紫外检测波长为240 nm;进样量:20 µl。取待测血浆0.4 ml,加入50 µl内标甲醇液(150 µg/ ml),涡旋混匀30 s,随后再加入乙腈0.6 ml,涡旋混匀1 min,13 000 r/min,离心5 min,取出上清液0.9 ml加入0.4 ml二氯甲烷,涡旋混匀1 min,13 000 r/min,离心5 min,上清液20 µl进样测定。
空白血浆中加入替考拉宁对照品溶液适量,再依次用空白血浆分别稀释成3.125、6.250、12.50、25.00、50.00、100.0 µg/ml系列浓度,处理后上液相色谱仪测定,记录色谱图,将替考拉宁(TA2-2)与内标的峰面积比值(R)对浓度(C)进行线性回归,得回归方程(n=6):R=0.6821C−2.186×10−2,r=0.9999,线性范围:3.125~100.0 µg/ml,本试验最低定量限为3.125 µg/ml,其5次测量值的RSD为2.57 %。
-
炎症指标、肾功能指标、肝功能指标及其他实验室检查指标均由本院检验科测定。胱抑素C的检测采用胶乳增强免疫比浊法测定。质控品按其说明书进行操作,每天进行一次质控实验。试剂空白吸光度:波长546 nm,光径10 mm,测得吸光度值A≤1.5000。线性范围:0.2~8 mg/L范围内线性相关系数r≥0.995,0.2~2.0 mg/L范围内绝对偏差≤0.2 mg/L,2.0~8 mg/L范围内相对偏差≤10.0%。准确度:相对偏差≤10.0%。分析灵敏度:样本浓度为1.0 mg/L时,吸光度差值为0.0060~0.0600。
-
收集患者的人口统计学资料,包括患者性别、年龄、感染类型和病原菌,给药剂量、给药方式、替考拉宁谷浓度,与替考拉宁谷浓度监测同一时间点的炎症指标降钙素原(PCT),肾功能指标血肌酐和胱抑素C,肝功能相关指标谷丙转氨酶(ALT)、天门冬氨酸氨基转移酶(AST)、总蛋白、白蛋白、胆红素、直接胆红素,以及葡萄糖水平等。
-
采用SPSS 18.0统计软件进行分析。对计数资料行χ2检验;对连续性变量先进行正态分布检验,对不符合正态分布的变量,以中位数(第25百分位数,第75百分位数)表示。不同胱抑素C水平下替考拉宁谷浓度不符合正态分布,行 Mann-Whitney检验;Logistic回归分析替考拉宁谷浓度不达标(<15 µg/ml)的影响因素,以P<0.05为差异有统计学意义。
-
共入组98例患者141个谷浓度,其中男65例、女33例,年龄19~94(52.2±16.2)岁,60岁以上者32例(32.0%)。患者肺部感染57例,粒细胞缺乏伴感染14例,腹腔感染12例,感染性心内膜炎4例,其他11例;感染检出病原菌有耐甲氧西林金黄色葡萄球菌、肺炎克雷伯菌、铜绿假单胞菌、鲍氏不动杆菌、粪肠球菌、大肠埃希菌和嗜麦芽窄食单胞菌等。入组患者的炎症指标PCT的均值为2.09,说明患者的感染程度较重。患者的实验室检查指标情况见表1。
表 1 患者的实验室检查指标
指标 中位数(第25,
第75百分位数)范围 ALT(U/L) 7.60(3.45,22.42) 3.2~339.4 AST(U/L) 21.30(12.50,45.40) 5.4~624.6 总蛋白(g/L) 60.05(54.52,67.28) 42.3~103.8 白蛋白(g/L) 32.00(28.30,35.15) 20.8~43.9 胆红素(mol/L) 19.70(13.10,44.20) 4.8~698.78 直接胆红素(mol/L) 7.00(5.36,9.63) 1.0~437.8 血肌酐(mol/L) 66.04(46.00,98.60) 22.6~482.9 胱抑素C(mg/L) 1.22(0.91,1.94) 0.45~6.37 降钙素原(ng/ml) 0.61(0.26,2.07) 0.02~20.98 注:表中括弧中数据为四分位中位数。 -
患者替考拉宁谷浓度为11.51(8.35,19.07)µg/ml,范围为3.57~41.93 µg/ml,谷浓度<15 µg/ml者95例次(67.38 %)。替考拉宁给药剂量为400 mg时,谷浓度<15 µg/ml的百分比为80.90 %(72/89);替考拉宁给药剂量为800 mg时,谷浓度<15 µg/ml的百分比为42.86 %(18/42);两种给药剂量比较,差异有统计学意义(χ2=19.205,P<0.01)。
-
胱抑素C浓度>1.05 mg/L时,替考拉宁谷浓度明显高于胱抑素C浓度在0.3~1.05 mg/L时(Z=-2.636,P=0.008),见表2。
表 2 不同胱抑素C水平下替考拉宁谷浓度
胱抑素C(mg/L) 替考拉宁浓度(µg/ml) 替考拉宁浓度范围(µg/ml) ≤1.05 8.68(6.34,11.79) 3.57~26.47 >1.05 11.37(8.96,20.52) 3.73~41.93 注:表中括弧中数据为四分位中位数。 -
炎症指标PCT,肝功能相关指标总蛋白、白蛋白、胆红素、直接胆红素和葡萄糖水平与替考拉宁谷浓度不相关(P>0.05)。血肌酐浓度与替考拉宁谷浓度呈正相关(P<0.01),胱抑素C浓度与替考拉宁谷浓度呈正相关(P<0.05),见表3。
表 3 各指标与替考拉宁谷浓度的相关性
指标名称 r值 P值 胱抑素C(mg/L) 0.225 0.036 血肌酐(mol/L) 0.248 0.009 降钙素原(ng/ml) 0.048 0.706 总蛋白(g/L) 0.032 0.746 白蛋白(g/L) 0.140 0.134 胆红素(mol/L) −0.025 0.798 直接胆红素(mol/L) −0.041 0.670 葡萄糖(mmol/L) 0.084 0.426 -
通过纳入替考拉宁谷浓度影响因素如患者性别、年龄、胱抑素C、血肌酐、ALT、AST、白蛋白、总蛋白、胆红素、直接胆红素进行Logistic回归分析,结果显示,替考拉宁谷浓度不达标(<15 µg/ml)的影响因素是患者年龄、胱抑素C和白蛋白水平(P<0.05),见表4。
表 4 替考拉宁谷浓度不达标影响因素的Logistic回归分析
因素 OR值 95%CI P值 胱抑素C 1.529 1.001~2.336 0.049 白蛋白 1.154 1.025~1.299 0.018 年龄 0.952 0.917~0.989 0.012 -
替考拉宁的血药浓度与临床疗效间存在较强的相关性,研究显示,治疗严重感染时,替考拉宁有效血谷浓度不应<10 mg/L,但目前临床使用中却发现其血药浓度达标率普遍偏低[3-4, 9]。2017年,注射用替考拉宁说明书的变更获批,提出重度感染时,替考拉宁谷浓度应达到15~30 mg/L。因此,本研究以替考拉宁谷浓度<15 µg/ml为不达标,而本研究中不达标患者百分比为67.38%,值得引起重视。给予标准负荷剂量6 mg/kg的替考拉宁早期均不能达到目标谷浓度,不论患者肌酐清除率正常与否;给予高负荷剂量10 mg/kg替考拉宁的低肌酐清除率者早期可达目标谷浓度[10-11]。本研究中,替考拉宁给药剂量为800 mg时,其谷浓度达标的百分比明显高于替考拉宁给药剂量为400 mg时,提示临床上应提高替考拉宁负荷剂量的使用率。
近年来研究表明血清胱抑素C能更准确地评价患者肾功能[5]。正常情况下,胱抑素C在血清和血浆中的浓度为0.3~1.05 mg/L。当肾功能受损时,胱抑素C在血液中的浓度会升高。有研究考察了胱抑素C、肌酐清除率和肾小球滤过率3种评价指标对替考拉宁体内代谢的影响,结果显示胱抑素C是影响替考拉宁清除率最显著的协变量[12-13]。因此,本研究考察了胱抑素C水平与替考拉宁谷浓度的关系,结果显示,胱抑素C水平高于正常值上限时,替考拉宁谷浓度明显升高。另外,替考拉宁谷浓度不达标影响因素的Logistic回归分析结果显示,胱抑素C是替考拉宁谷浓度不达标的影响因素。
研究显示,肌酐清除率显著影响替考拉宁的谷浓度[4,7,11],但血肌酐对替考拉宁谷浓度的影响无统计学意义[4]。本研究中,血肌酐浓度越高,替考拉宁谷浓度越高,但血肌酐不是替考拉宁谷浓度不达标的影响因素。有研究显示,白蛋白为影响替考拉宁清除率的主要因素[7]。本研究中,白蛋白水平虽与替考拉宁谷浓度不存在相关性,与相关研究相符[5],但白蛋白是替考拉宁谷浓度不达标的影响因素。另有研究显示,替考拉宁谷浓度与剂量的比值与炎症指标超敏 C 反应蛋白成负相关[6],本研究考察了另一炎症指标PCT与替考拉宁谷浓度的相关性,结果显示PCT与替考拉宁谷浓度不存在相关性。分析原因可能与影响替考拉宁谷浓度的其他因素,如年龄、性别、体重指数、给药剂量和肾功能差异等有关;也可能与PCT和C反应蛋白虽然同是炎症指标,但二者产生的机制,发挥的生理作用和临床预测价值不同有关。
本研究的不足之处:由于每例患者替考拉宁谷浓度监测次数多为1~2次,本研究未考察替考拉宁谷浓度与疗效的相关性,而只是考察了替考拉宁谷浓度的影响因素。终上所述,本研究结果显示,替考拉宁给药剂量为400 mg时,谷浓度不达标<15 µg/ml的百分比明显高于替考拉宁给药剂量为800 mg时,提示临床上应提高替考拉宁负荷剂量的使用率。胱抑素C浓度高于正常值上限时替考拉宁谷浓度明显升高,是替考拉宁谷浓度不达标的影响因素,提示除肌酐清除率外,无条件进行替考拉宁血药浓度监测的单位,可以考虑将胱抑素C作为替考拉宁剂量调整的参考指标。
Study on the relationship between cystatin C level and the plasma trough concentration of teicoplanin
-
摘要:
目的 探讨胱抑素C水平与替考拉宁血浆谷浓度的关系,为临床替考拉宁的合理应用提供依据。 方法 回顾性分析2017年10月至2020年7月我院收治的使用替考拉宁患者的临床资料。考察替考拉宁血浆谷浓度的分布情况,比较不同胱抑素C水平下替考拉宁血浆谷浓度,Logistic回归分析替考拉宁谷浓度不达标(<15 µg/ml)的影响因素。 结果 共入组98例患者,141个谷浓度,其中男65例、女33例,年龄19~94(52.2±16.2)岁。替考拉宁血浆谷浓度为11.51 (8.35,19.07) µg/ml,范围为3.57~41.93 µg/ml,谷浓度<15 µg/ml者95例次(67.38%)。胱抑素C浓度高于正常值上限(>1.05 mg/L)时,替考拉宁谷浓度为11.37 (8.96,20.52) µg/ml,明显高于胱抑素C浓度在正常范围内的8.68 (6.34,11.79) µg/ml(Z=−2.636,P<0.05)。Logistic回归分析显示胱抑素C水平为替考拉宁谷浓度不达标的影响因素(OR=1.529,95% CI=1.001~2.336,P<0.05)。 结论 胱抑素C浓度高于正常值上限时替考拉宁谷浓度明显升高,是替考拉宁谷浓度不达标的影响因素,临床上可以考虑将其作为替考拉宁剂量调整的参考指标。 Abstract:Objective To investigate the relationship between cystatin C level and the plasma trough concentration of teicoplanin, so as to provide a reference for the rational application of teicoplanin in clinical practice. Methods The clinical data of the patients receiving teicoplanin, who admitted to our hospital from October 2017 to July 2020 were retrospectively analyzed. The distribution of teicoplanin concentration, the difference of teicoplanin concentration under different cystatin C level, and influence factors for teicoplanin concentration (<15 µg/ml) were analyzed. Results A total of 98 patients including 65 males and 33 females, aged 19 to 94 (52.2±16.2) years old, with 141 trough concentrations were enrolled. The trough concentration of teicoplanin was 11.51 (8.35, 19.07) µg/ml, and the range was 3.57-41.93 µg/ml. 95 cases (67.38%) had teicoplanin concentration <15 µg/ml. When the concentration of cystatin C was >1.05 mg/L, the trough concentration of teicoplanin were 11.37 (8.96, 20.52) µg/ml, significantly higher than those when the concentration of cystatin C was in normal [8.68 (6.34, 11.79) µg/ml, Z=−2.636, P<0.05]. Logistic regression analysis showed that cystatin C level was the influencing factor for teicoplanin trough concentration does not meet the standard (OR=1.529, 95%CI=1.001-2.336, P<0.05). Conclusion The concentration of teicoplanin is significantly increased when the cystatin C level is higher than the normal. Cystatin C level is the influence factor for teicoplanin trough concentration not meeting the standard. The cystatin C level may be considered as a reference for teicoplanin dosage adjustment in clinical practice. -
Key words:
- teicoplanin /
- infection /
- therapeutic drug monitoring /
- cystatin C
-
药用植物中的次生代谢物是中药药效物质的主要来源,已知的植物次生代谢物生物合成途径有乙酸-丙二酸途径、异戊二烯途径、莽草酸途径等[1],探究植物生物合成的调控因素不仅能提升药材的品质,也为中药有效成分体外合成的工业化提供可能。
植物昼夜节律钟是植物体内应对光照、温度等外界因素随昼夜节律性改变而进化出的一套适应机制[2],对植物生长发育具有不可或缺的作用。大量研究表明,如黄酮类化合物合成的相关结构基因表达,也具有明显的昼夜节律性特点,受昼夜节律钟调控[3-4]。昼夜节律钟的核心部分中央振荡器是MYB蛋白LHY(late elongated hypocotyl)、CCA1(circadian clock associated 1)和伪应答调控蛋白家族(PRRs,pseudo-response regulators)组成,对维持植物昼夜节律的稳定至关重要[5-6]。
PRRs基因都带有2个保守的结构域,氨基端的响应接受结构域(receiver-like domain,RLD),其结构上与磷酸接受域相似,羧基端带有的CCT(Constans/Constans-like/TOC1)结构域,这2个结构域被一个保守程度不高的“可变域”所分隔[7-9]。目前研究发现在CO、CO-like以及TOC1基因中也有带此类结构域,对于植物开花进程有着重要作用[10-11]。
研究表明PRRs家族基因具有增加植物抗逆性,影响植物生物量的积累[12-14],以及调控花发育及衰老等作用[15]。目前对模式植物中PRRs基因的研究较多,如在拟南芥以及水稻中的PRRs基因证明具有调控开花周期的作用[17],但药用植物中PRRs基因的研究则罕见报道。
中药红花(Carthami flos)是菊科植物红花(Carthamus tinctorius L.)的干燥花,有活血化瘀的功效。研究表明,红花主要药效物质为黄酮类化合物,如羟基红花黄色素A(HSYA)、红花素、槲皮素、山奈酚、野黄芩苷[18]等,目前已有对红花黄酮类化合物生物合成的关键基因查尔酮合酶、查尔酮异构酶、糖基转移酶等多种研究[19-20],但调控红花中黄酮类化合物生物合成途径的基因未完全明确。验证昼夜节律钟调控红花中黄酮类化合物的生物合成对提升红花品质意义重大。
本研究依据前期红花转录组数据库基因注释筛选昼夜节律相关基因,并与红花黄酮类化合物的积累量进行相关分析,得到具有调控红花黄酮类化合物生物合成功能的昼夜节律基因,通过qPCR、液质联用(UHPLC-MS)等方法以期阐释PRRs基因的特征与功能,为进一步研究昼夜节律钟调控红花黄酮类化合物的生物合成积累资料。
1. 材料与方法
1.1 材料与仪器
植物材料:云南巍山红花品系(编号ZHH0119),种植于海军军医大学药学院温室,温室条件:恒温25 ℃,昼夜节律为16 h光照/8 h黑暗。仪器与试剂:荧光qPCR仪:ABI7500;Phanta Max Master Mix高保真酶,Trans Top green qPCR super mix,Trans one-step cDNA synthesis super mix逆转录试剂盒(北京全式金公司);Meitler Toledo电子天平(十万分之一量程);高效液相色谱仪:Agilent1290 Infinty LC system; 质谱仪:Agilent 6538 Accurate Mass。
1.2 红花总RNA的提取与cDNA第一链的合成
取用新鲜红花的花冠,根、茎、叶约100 mg研磨成粉。依据Plant Zol说明书提取总RNA,并用紫外分光光度计测定总RNA浓度与质量,样品的A260/A280在1.9~2.1之内可认为符合后续实验要求。将其作为模板逆转录合成cDNA第一链,−20 ℃保存备用。
1.3 红花PRRs基因的筛选与克隆
基于红花转录组数据库,结合基因注释筛选出昼夜节律相关基因,通过红花花冠表达谱获取表达量,与红花代谢组数据库中不同花期黄酮类化合物的积累量进行Pearson分析,获取与黄酮类化合物积累量相关系数r≥0.7的昼夜节律基因进行生物信息学分析,设计引物(表1)进行克隆。PCR产物进行凝胶电泳,回收含有目的条带的凝胶,连接载体后转化大肠杆菌感受态细胞,LBA平板培养,挑取阳性克隆送至上海生工生物工程有限公司测序。
表 1 全长克隆引物引物名称 引物序列 PRR1-F ACCTCAAGGGCCACTGGTTC PRR1-R GTAACAAAAGACTTTCTGAA 1.4 红花PRR1生物信息学分析
在NCBI网站用BLAST在线分析红花PRR1全长序列以及编码蛋白的氨基酸序列进行比对以及同源性分析;在ExPASy在线工具SOMPA得出所编码蛋白的二级结构特征;通过Swiss-Model同源建模预测蛋白三级结构;在ClustalX 2.1软件对其编码蛋白的氨基酸序列与同源蛋白的氨基酸序列进行多重比对分析;使用相邻节点算法(Neighbor-Joining)构建系统进化树,自展分析法(Bootstrap analysis)进行1 000次重复验证进化树可靠性。
1.5 红花PRR1基因表达分布特征分析
以红花根、茎、叶、花4个部位;花冠开花前3 d(Ⅰ期)、开花1 d(Ⅱ期)、开花3 d(Ⅲ期)、开花5 d(Ⅳ期)4个时期[12]以及1 d中8个时间点(6:00、9:00、12:00、15:00、18:00、21:00、0:00、3:00)的花冠第一链cDNA为模板,设计RT-qPCR引物,以Ct60s(KJ634810)作为内参基因,进行qPCR实验,每个样品设3个复孔。
1.6 红花中黄酮类化合物含量测定
取红花Ⅲ期单日内4个时间点(9:00、12:00、15:00、21:00)的花冠烘干至恒重,精密称取5.00 mg置1.5 ml离心管,再加入精密量取的1 ml 60%甲醇,室温放置12 h后超声处理40 min,12 000 r/min,10 min离心取上清液,UHPLC-MS在正、负离子模式下进行检测(表2),参比离子:正离子模式为121.050 9,922.009 8;负离子模式为119.036 3,966.000 7,数据采集与分析使用Agilent MassHunter Analysis4.0软件。以柚皮素、芹菜素、槲皮素、HSYA、山奈酚、红花素、山奈酚-3-O-葡萄糖苷以及野黄芩素为对照品。
表 2 UHPLC-MS分析方法色谱条件 质谱条件 色谱柱:Agilent ZORBAX C18(3.5 μm,2.1 mm ×100 mm) 毛细管电压:3.5 kV 流动相:A:0.1%甲酸-水,B:乙腈 锥孔电压:60 V 流速:0.4 ml/min 离子源温度:350 ℃ 柱温:40 ℃ 碎裂电压:120 V 进样量:0.4 ml 采集范围:50~1 100 m/z 梯度洗脱:0 min,5%B; 4 min,20%B;
6 min, 21% B; 9 min, 26% B; 11 min, 40% B; 15 min, 80% B; 17 min, 95% B1.7 红花PRR1蛋白互作体系研究
1.7.1 红花PRR1蛋白互作网络预测
使用STRING数据库对CtPRR1基因进行蛋白互作网络分析,可信区间设置为0.4。利用Python下的networkX将互作基因进行可视化。
1.7.2 红花酵母双杂cDNA文库构建
将红花cDNA均一化处理得到红花酵母双杂cDNA文库,与载体PGADT7进行同源克隆,产物转化大肠杆菌感受态细胞,涂布LBA平板,37 ℃培养过夜,挑取单克隆菌落进行菌液PCR验证
1.7.3 红花PRR1载体构建与酵母转化
根据PRR1 ORF设计同源引物引入BamHI、XhoI酶切位点。PCR产物经电泳后回收,连接酶切载体pGBKT7转入大肠杆菌,测序验证后完成pGBKT7-PRR1 bait载体的构建。
将pGBKT7-PRR1bait质粒通过PEG/LiAc法转化酵母感受态细胞,涂布SD平板,28 ℃培养,挑取单克隆进行菌液PCR鉴定。将阳性单克隆酵母菌液划线涂布含有X-α-gal和Aba的平板。
1.7.4 酵母双杂文库筛选红花PRR1互作蛋白
将酵母感受态细胞、载体DNA、红花酵母双杂cDNA文库质粒按共转法混合处理后均匀涂布于SD/-His/-Trp/-Ura三缺平板培养,挑取单克隆转移至含有X-α-gal的SD/-His/-Trp/-Ura培养基,扩增阳性质粒用于测序以及酵母双杂验证。
1.8 统计分析
实验结果经SPSS19.0软件处理,计量资料统一表示为(
${{\bar x}} \pm {{s}}$ ),组间比较采用ANOVA分析,以P<0.05为差异具有统计学意义。2. 实验结果
2.1 红花昼夜节律相关基因的筛选
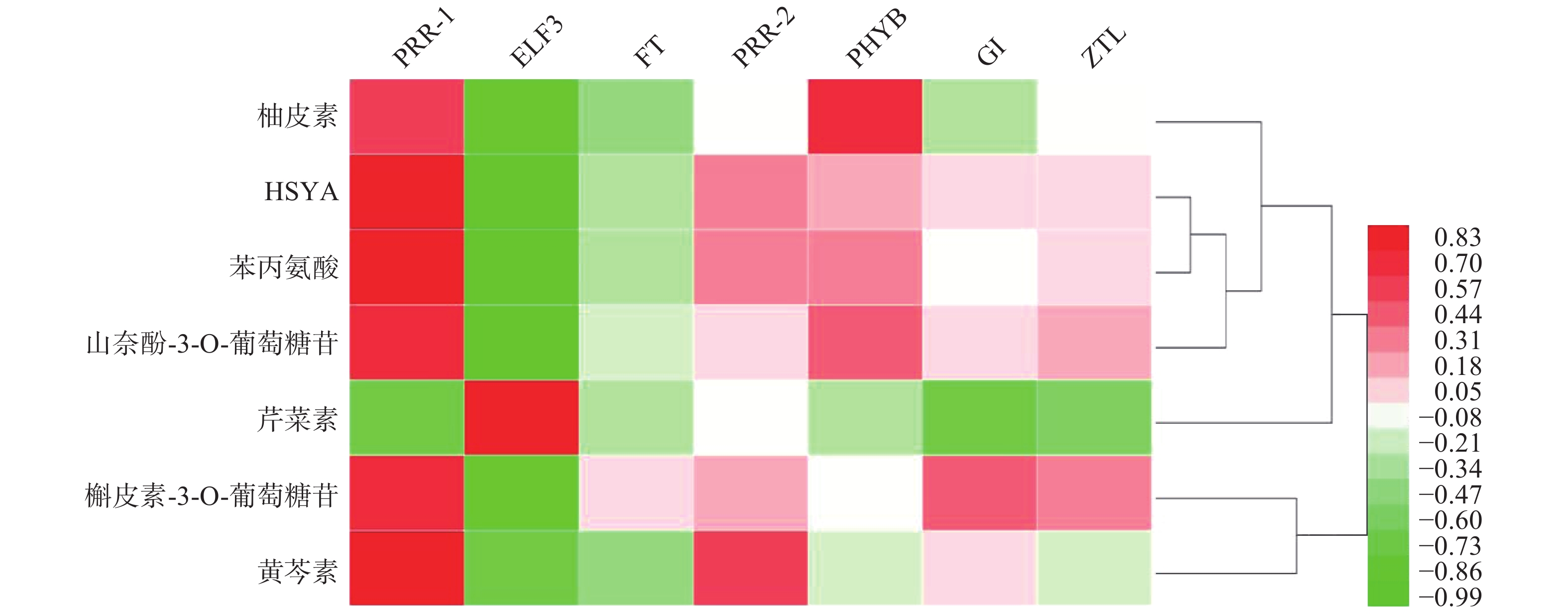
基于红花花冠转录组数据库的基因注释,检索出PRR1、PRR2、ELF3、FT、PHYB、GI、ZTL7个昼夜节律基因,将其在花冠不同时期的表达量与红花代谢组数据库中柚皮素、HYSA、苯丙氨酸、山奈酚-3-O-葡萄糖苷、芹菜素、槲皮苷、野黄芩素、槲皮素-3-葡萄糖苷7个化合物含量进行PEARSON相关性分析,如图1所示,PRR1与红花中主要黄酮类成分的积累量具有良好的相关性(r≥0.7)。
2.2 红花PRR1基因全长克隆与生物信息学分析
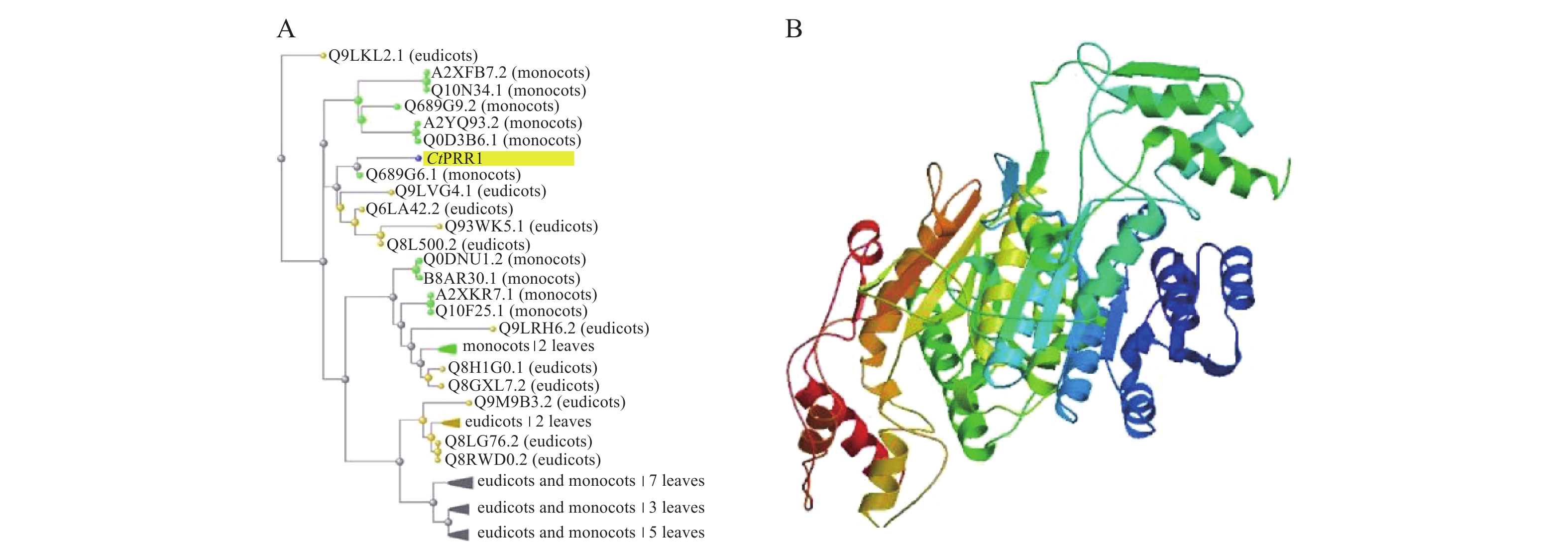
在红花全长转录组数据库中得到的PRR1基因全长序列3 201 bp,ORF FINDER结果显示开放阅读框1 549~2 814 bp,编码421个氨基酸,命名为CtPRR1(GenBank登录号:MW492035),将全长序列进行BLAST,系统发育进化树分析如图2A,CtPRR1氨基酸序列与水稻(Oryza sativa L.)OsPRR73氨基酸序列(A2XFB7.2)同源性最高。Prot-param分析PRR1基因所编码的蛋白质分子式C1900H3039N611O653S15,分子量为45 300,理论pI=8.52,对PRR蛋白质三维结构预测如图2B,Prot Scale分析表明预测PRR1蛋白为亲水性蛋白,无信号肽属非分泌蛋白;蛋白跨膜性分析预测PRR不含有跨膜区域,为非跨膜蛋白。
2.3 CtPRR1基因在红花中的表达特征
qPCR结果表明(图3A)在红花不同部位中,CtPRR1基因在花中的表达量最高,且与根、茎、叶都有显著性差异(P<0.05),对红花花冠Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期的CtPRR1基因的表达情况进行分析,CtPRR1在Ⅰ期花冠中表达含量最低;Ⅱ期表达水平略有上升,与Ⅰ期无显著性差异;Ⅲ期花冠中表达量明显上升,相比Ⅰ,Ⅱ期具有显著性差异,Ⅳ期花冠中的CtPRR1基因表达水平略微下降(图3B),表明CtPRR1基因在Ⅲ期花冠中转录水平最高,CtPRR1在不同时间表达量的变化与红花黄酮类化合物积累量的变化相符[22]。对红花8个时间点的花冠CtPRR1表达量分析发现CtPRR1表达量在日间6:00至18:00逐渐升高,18:00达峰值,晚间21:00至2:00逐渐下降,3:00最低,表达水平在白天与夜晚两个连续的时间周期内呈现昼夜节律性(图3C)。
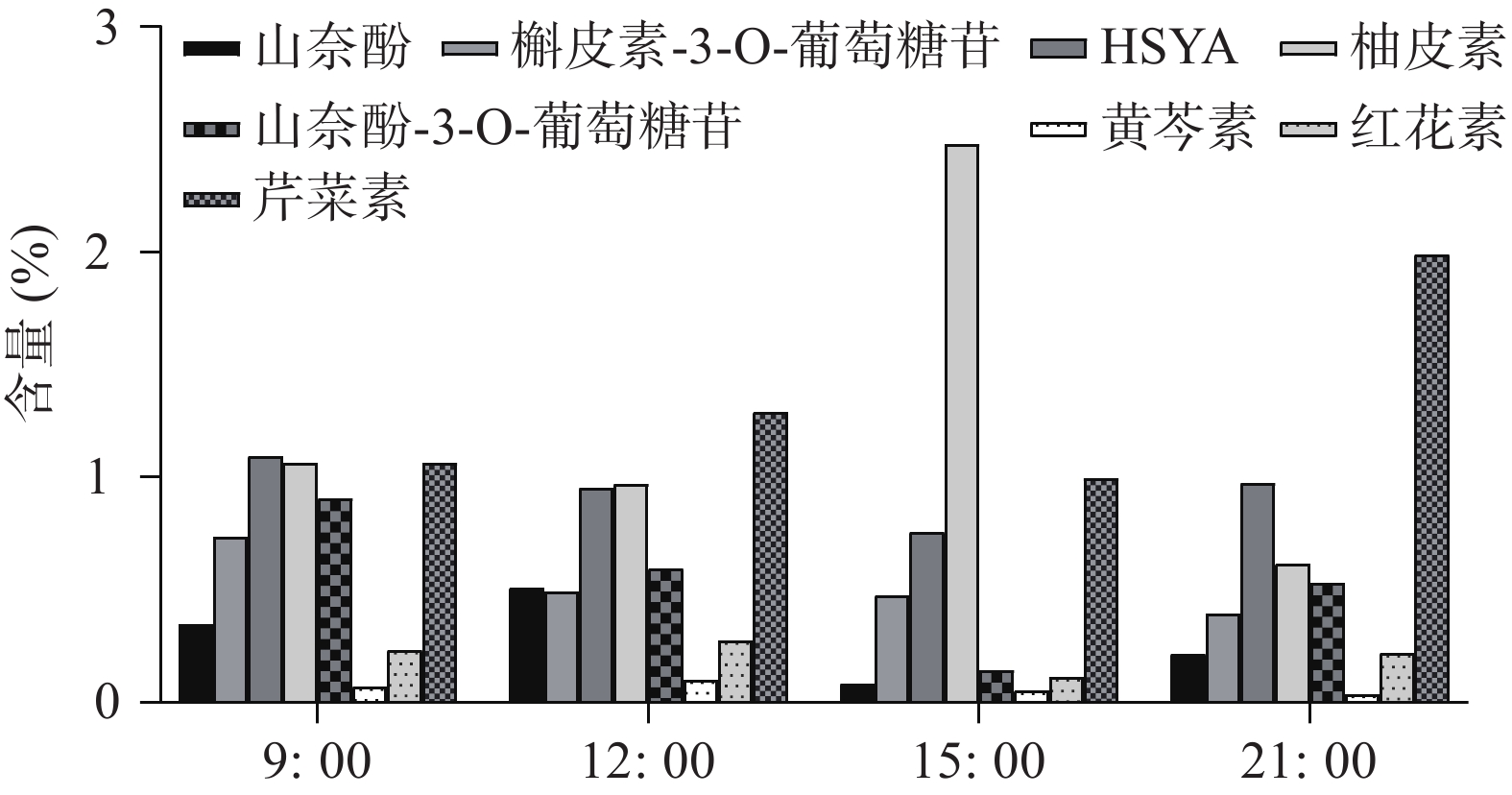
2.4 红花中黄酮类化合物含量测定
UHPLC-MS检测黄酮类化合物在单日内不同时间的含量变化(图4),除柚皮素外的7个化合物在白天含量逐渐降低,而在晚间含量又升至较高的水平,柚皮素则相反在白天升高,晚间下降,但8个化合物含量变化也呈现昼夜节律性,与同时间点CtPRR1的表达量进行PEARSON分析得到红花素(r=−0.9485)、山奈酚(r=−0.9423)、野黄芩苷(r=−0.9504)、HSYA(r=−0.8372)、山奈酚-3-O-葡萄糖苷(r=−0.8792)、柚皮素(r=0.7415)、芹菜素(r=−0.6652)、槲皮素(r=−0.4876),目前研究认为柚皮素在红花黄酮类化合物生物合成途径的上游[20],而CtPRR1与柚皮素呈正相关,与其他化合物呈负相关,说明CtPRR1对整体黄酮类化合物生物合成具有负调控作用而导致柚皮素的积累量增多,进一步说明CtPRR1参与调控红花黄酮类化合物的合成。
2.5 CtPRR1蛋白互作研究
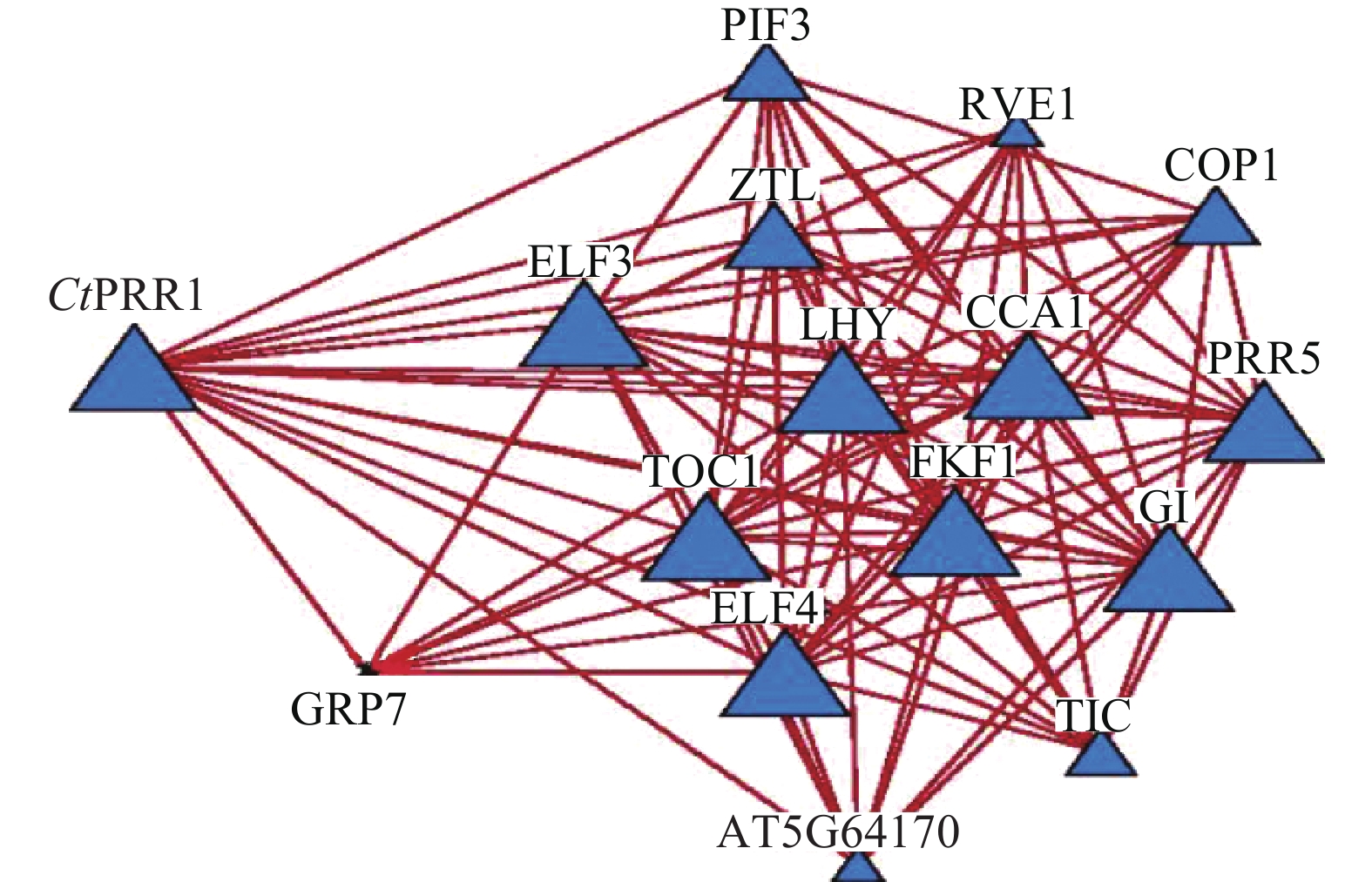
STRING数据库预测红花转录组数据库中CtPRR1的互作蛋白,获得互作蛋白TOC1、PIF3、COP1、ZTL、LHY、ELF4、ELF3、CCA1、GI、PRR5、GRP7、TIC、FKF1、RVE114个,互作关系网络如图5。与PRRs基因共同参与调控植物生长发育,调控植物次生代谢途径。由此获得了较为完善的红花昼夜节律核心元件系统,为进一步探索昼夜节律调控红花次生代谢的分子机制提供了依据。
通过酵母双杂实验发现,转入pGBKT7-PRR bait质粒的酵母细胞在28 ℃生长4 d后情况正常。带有pGBKT7-PRR bait载体的酵母细胞与构建的红花cDNA文库质粒共转后,28 ℃培养2 d后可以观察到蓝色菌斑出现,4 d后出现直径约2 mm的蓝色单克隆菌斑(图6),菌液PCR鉴定为阳性克隆。结果如表3所示,有2个热休克蛋白,3个AP2转录因子,热休克蛋白具有增强植物抗逆性的功能,AP2转录因子广泛参与植物生长发育,调控体内次生代谢。
表 3 酵母双杂筛选互作蛋白序号 蛋白家族名称 预测功能 1 热休克蛋白 广泛参与植物响应外界环境胁迫,生物合成以及生长发育相关的转录调控 2 热休克蛋白 3 AP2转录因子 4 AP2转录因子 5 AP2转录因子 3. 讨论
红花作为常用的活血化瘀中药,对其主要药效物质黄酮类化合物的生物合成途径及调控机制的研究越来越多[20],但目前红花黄酮类化合物生物合成途径及调控机制仍未阐明。
本研究首次克隆了一个PRRs家族基因CtPRR1,生物信息学分析表明其与水稻、拟南芥等其他物种中的PRRs家族基因序列高度相关,说明红花中的PRRs基因具有高度保守性。CtPRR1基因主要在花中表达且开花后第3天时表达量最高,与红花不同花期黄酮类化合物的累积规律一致,存在显著相关。我们认为,CtPRR1调控了红花黄酮类化合物的生物合成。进一步的研究发现,CtPRR1的单日表达量在日间逐渐升高,晚间逐渐下降;随着CtPRR1在单日表达量的升高,芹菜素、槲皮素、HSYA、山奈酚、红花素、山奈酚-3-O-葡萄糖苷以及野黄芩素积累量为白天逐渐降低,晚间逐渐升高。CtPRR1对红花这些黄酮类成分的昼夜节律性积累积起负调节作用;唯CtPRR1与柚皮素的积累量呈正相关,可能与柚皮素处于黄酮生物合成途径的较上游以及参与其他代谢过程并受到其他调控基因的影响有关。
PRRs与CCA1、LHY基因作为昼夜节律系统中的核心元件,对多种植物的昼夜节律钟输出途径中与黄酮合成结构酶基因具有相互作用[22-23],本研究发现红花CtPRR1可能受2个热休克蛋白,3个AP2转录因子的影响对黄酮化合物的积累起负调节作用,丰富了昼夜节律基因调控黄酮类化合物机制的研究资料。
本研究结果为深入研究红花昼夜节律基因对黄酮生物合成途径的调控机制提供了资料。下一步的工作,我们将采用基因过表达以及基因敲除技术结合代谢物分析,进一步验证CtPRR1调控红花黄酮类化合物生物合成的功能及调控网络,为阐明CtPRR1的功能提供重要依据。
-
表 1 患者的实验室检查指标
指标 中位数(第25,
第75百分位数)范围 ALT(U/L) 7.60(3.45,22.42) 3.2~339.4 AST(U/L) 21.30(12.50,45.40) 5.4~624.6 总蛋白(g/L) 60.05(54.52,67.28) 42.3~103.8 白蛋白(g/L) 32.00(28.30,35.15) 20.8~43.9 胆红素(mol/L) 19.70(13.10,44.20) 4.8~698.78 直接胆红素(mol/L) 7.00(5.36,9.63) 1.0~437.8 血肌酐(mol/L) 66.04(46.00,98.60) 22.6~482.9 胱抑素C(mg/L) 1.22(0.91,1.94) 0.45~6.37 降钙素原(ng/ml) 0.61(0.26,2.07) 0.02~20.98 注:表中括弧中数据为四分位中位数。 表 2 不同胱抑素C水平下替考拉宁谷浓度
胱抑素C(mg/L) 替考拉宁浓度(µg/ml) 替考拉宁浓度范围(µg/ml) ≤1.05 8.68(6.34,11.79) 3.57~26.47 >1.05 11.37(8.96,20.52) 3.73~41.93 注:表中括弧中数据为四分位中位数。 表 3 各指标与替考拉宁谷浓度的相关性
指标名称 r值 P值 胱抑素C(mg/L) 0.225 0.036 血肌酐(mol/L) 0.248 0.009 降钙素原(ng/ml) 0.048 0.706 总蛋白(g/L) 0.032 0.746 白蛋白(g/L) 0.140 0.134 胆红素(mol/L) −0.025 0.798 直接胆红素(mol/L) −0.041 0.670 葡萄糖(mmol/L) 0.084 0.426 表 4 替考拉宁谷浓度不达标影响因素的Logistic回归分析
因素 OR值 95%CI P值 胱抑素C 1.529 1.001~2.336 0.049 白蛋白 1.154 1.025~1.299 0.018 年龄 0.952 0.917~0.989 0.012 -
[1] 沈琮, 陈文倩, 张相林. 替考拉宁治疗药物监测进展[J]. 中国医院用药评价与分析, 2019, 19(7):890-894,896. [2] ZHOU L J, GAO Y Q, CAO W, et al. Retrospective analysis of relationships among the dose regimen, trough concentration, efficacy, and safety of teicoplanin in Chinese patients with moderate-severe Gram-positive infections[J]. Infect Drug Resist,2018,11:29-36. doi: 10.2147/IDR.S146961 [3] 何丹, 董娜, 朱怀军, 等. 基于替考拉宁群体药物代谢动力学模型的个体化给药研究进展[J]. 临床药物治疗杂志, 2020, 18(5):38-42. doi: 10.3969/j.issn.1672-3384.2020.05.008 [4] 梁培, 郭晓芳. 重症感染患者替考拉宁血药谷浓度68例次监测分析[J]. 实用药物与临床, 2018, 21(5):553-556. [5] 张荣格, 张瑞霞, 张弋. 替考拉宁的血药浓度监测及影响因素分析[J]. 中国药学杂志, 2019, 54(8):654-658. [6] 吕佩瑜, 邓方斌, 林玮玮, 等. 替考拉宁在中国成人患者中的群体药动学研究[J]. 中国药学杂志, 2020, 55(8):616-622. [7] 李芳, 蔡乐, 毛智, 等. 重症感染患者负荷剂量替考拉宁的血药浓度监测[J]. 临床药物治疗杂志, 2019, 17(11):44-48. doi: 10.3969/j.issn.1672-3384.2019.11.010 [8] DHARNIDHARKA V R, KWON C, STEVENS G. Serum cystatin C is superior to serum creatinine as a marker of kidney function: a meta-analysis[J]. Am J Kidney Dis,2002,40(2):221-226. doi: 10.1053/ajkd.2002.34487 [9] 周丽娟, 刘嘉, 曹巍, 等. 替考拉宁血药浓度监测对肺炎患者用药方案的指导意义探讨[J]. 中国医院药学杂志, 2017, 37(8):771-775. [10] 胡萨萨, 尤海生, 金建霞, 等. 中性粒细胞缺乏伴发热患者应用替考拉宁抗感染的剂量监测及优化[J]. 河北医药, 2019, 41(23):3654-3658. doi: 10.3969/j.issn.1002-7386.2019.23.035 [11] 王冉冉, 马婧, 黄晓会. 重症感染患者替考拉宁血药谷浓度不达标的相关因素分析[J]. 中国药师, 2020, 23(3):494-496. doi: 10.3969/j.issn.1008-049X.2020.03.021 [12] KASAI H, TSUJI Y, HIRAKI Y, et al. Population pharmacokinetics of teicoplanin in hospitalized elderly patients using cystatin C as an indicator of renal function[J]. J Infect Chemother,2018,24(4):284-291. doi: 10.1016/j.jiac.2017.12.002 [13] KOZONO A, HIRAKI Y, ADACHI R, et al. Comparison of predictive accuracy of teicoplanin concentration using creatinine clearance and glomerular filtration rate estimated by serum creatinine or cystatin C[J]. J Infect Chemother,2016,22(5):314-318. doi: 10.1016/j.jiac.2016.01.024 -





 下载:
下载:



 下载:
下载: 

