-
近年来,随着医疗水平和医疗技术的不断发展,越来越多的儿童侵袭性真菌感染被确诊,尤其在免疫缺陷、血液和肿瘤、器官移植以及需要重症和新生儿监护室的患儿中出现较高的发病率[1-3],引起较高的病死率,或产生严重的后遗症[4]。伏立康唑[5]是第二代三唑类抗真菌药物,有着较广谱的抗菌谱。主要推荐作为侵袭性曲霉菌、对氟康唑耐药的念珠菌及其他不常见的侵袭性病原菌的一线治疗药物。血液稳态谷浓度是对伏立康唑在体内药动学的评价指标,与临床疗效及不良反应有着密不可分的关系。监测伏立康唑在儿童患者的血药浓度,对指导临床安全有效用药具有重要意义。
本研究通过收集2019年1月至12月期间68例使用伏立康唑的住院儿童信息,进行血药谷浓度监测,并对临床有效性和安全性进行分析,以期为真菌感染患儿临床用药提供参考。本研究通过医院伦理委员会的审批(批准号:2019-LDYY-036),所有患儿家属均签署知情同意书。
-
本研究收集2019年1月至12月上海市宝山区罗店医院、上海市儿童医院及上海市同济医院住院治疗的真菌感染患儿病例,共收集到有血药浓度监测的病例68例,其中,男38例(56%),女30例(44%),年龄17天至15岁,详见表1。68例患儿中,6例来自新生儿病区,30例PICU,32例血液病区。感染部位涉及肺部、血液、腹腔、中枢、肠道、泌尿道。按照侵袭性真菌感染诊断标准分为确诊、临床诊断和拟诊[6]。本资料中28例患儿为确诊病例,40例患儿为临床诊断病例。所有案例均存在高危因素,并具有影像学变化。确诊病例即连续3次培养检出同一种真菌,确诊为真菌感染。临床诊断病例的1,3-β-D葡聚糖抗原(G试验)和/(或)半乳甘露聚糖(GM试验)阳性。
表 1 患儿一般资料分布情况
年龄 性别 例数(%) 男(%) 女(%) 新生儿 4(11) 2(7) 6(9) 29天~2岁 4(11) 4(13) 8(12) 2~12岁 24(63) 22(73) 46(67) 12~15岁 6(15) 2(7) 8(12) 合计 38(56) 30(44) 68(100) -
纳入标准:诊断为侵袭性真菌感染的儿童;接受伏立康唑治疗或改变剂量后持续用药至少3 d;接受伏立康唑血浆稳态谷浓度监测。排除标准:接受伏立康唑治疗不足3 d;未进行伏立康唑血药浓度监测;肝肾功能不全;缺乏完整的实验室评价指标,不能进行疗效和安全性评价者。
-
注射用伏立康唑(美国辉瑞制药有限公司、晋城海斯制药有限公司),规格:200 mg/瓶,生产批号:Z572301、20210501。应用参考指征:①根据实验室检测结果及药敏试验。②根据临床表现及(G试验)和/(或)(GM试验)阳性,经验性给予抗真菌药物。68例患儿均予以静脉给药,q12h,使用前均告知家长可能的风险并征得家长的同意。
-
研究对象接受伏立康唑治疗或改变剂量后持续用药至少 3 d后检测血清谷浓度。使用全自动二维液相色谱耦合仪LC-100HP(湖南德米特仪器有限公司)进行HPLC法测定药物浓度:血样本采集后静置至自然凝固,4500 r/min离心 5 min,获取血清样本;取 300 μl 血清加入900 μl 乙腈去蛋白溶液,涡旋震荡1 min,15000 r/min离心8 min,待分层完全后,取 1000 μl 上清液加入100 μl 乙腈去蛋白溶液进样,在色谱条件下检测,记录峰面积并计算伏立康唑谷浓度。
-
采用 SPSS 20.0 软件进行统计学分析,计数资料以百分比表示,符合正态分布的计量资料以(
$ \overline{\text{x}}\text{±}\text{s} $ )表示,两样本比较采用独立样本 t 检验,多组间比较采用单因素方差分析,非正态分布以中位数(四分位间距)表示,各组总体水平差异采用 Kruskal-Wallis 法检验,相关性分析采用 Spearman 相关分析,以P<0.05为差异有统计学意义。 -
本案例中28例明确检测到病原菌,其中,10例白色念珠菌,6例热带念珠菌,5例近平滑念珠菌,3例光滑念珠菌,2例曲霉菌,1例挪威假丝酵母菌,1例似平滑念珠菌。伏立康唑治疗真菌感染的患儿,有效58例,有效率85.3%(58/68例),无效10例,无效率14.7%(10/68例)(其中,死亡2例,4例放弃治疗自动出院,4例更换药物)。
-
68 例患儿均静脉给药伏立康唑,使用疗程为7~38 d,平均为(13.2±9.0)d。患儿单次给药剂量3.6~8.0 mg/kg,平均(6.1±1.4) mg/kg。按单次不同给药剂量分为<4.0、4.0~7.0、>7.0 mg/kg 3组。其中,<4.0 mg/kg有6例,有效5例、无效1例;4.0~7.0 mg/kg有44例,有效37例、无效7例;>7.0 mg/kg有18例,有效16例、无效2例,具体见表2。
表 2 伏立康唑用药剂量和疗效的相关性
组别(μg/ml) 例数 有效(%) 无效(%) <4.0 6 5(83.3) 1(16.7) 4.0~7.0 44 37(84.1) 7(15.9) >7.0 18 16(88.9) 2(11.1) 合计 68 58(85.3) 10(14.7) -
根据稳态血清谷浓度值范围分为<1.0、1.0~5.5和>5.5 μg/ml 3组,其中,<1.0 μg/ml有14例,有效10例,无效4例;1.0~5.5 μg/ml有48例,有效44例,无效4例;>5.5 μg/ml有6例,有效4例,无效2例。采用单因素方差分析显示,3组间差异有统计学意义(χ2=5.360, P=0.039),见表3。
表 3 血清谷浓度值与疗效的相关性
组别(μg/ml) 例数 有效(%) 无效(%) χ2 P <1.0 14 10(71.4) 4(28.6) 5.360 0.039 1.0~5.5 48 44(91.7) 4(8.3) >5.5 6 4(66.7) 2(33.3) 合计 68 58(85.3) 10(14.7) -
对68例患儿进行78次谷浓度检测,其中复测10例。复测的病例中,7例为给药剂量上调后复测,3例为给药剂量下调后复测,本研究以第一次谷浓度值为准,复测值不计入其中。不同的给药剂量,检测出不同的谷浓度值。给药<4.0 mg/kg,谷浓度在0.4~3.31 μg/ml (r=0.613,P=0.195);4.0~7.0 mg/kg,谷浓度0.35~7.02 μg/ml (r=0.325,P=0.018);>7.0 mg/kg,谷浓度1.46~12.45 μg/ml (r=0.584,P=0.023),给药剂量与药物浓度之间有相关性,并且3组间谷浓度有统计学差异(F=7.270, P=0.026),见表4。
表 4 伏立康唑给药剂量与谷浓度的关系
组别(mg/kg) 例数 谷浓度(μg/ml)
中位数
(四分位间距)r P F P <4.0 6 1.59(0.40~2.76) 0.613 0.195 7.270 0.026 4.0~7.0 53 1.91(0.93~3.63) 0.325 0.018 >7.0 9 3.31(2.04~5.49) 0.738 0.023 -
给药后按照诺氏评估量表[7]评估患儿发生不良反应与伏立康唑的关联性,68例患儿中有10例存在与伏立康唑很可能有关的药物不良反应,主要表现为轻度肝功能损伤[8],其中,2例总胆红素升高,5例(其中,1例为<2岁)谷丙转氨酶(ALT)升高,3例(其中1例新生儿)谷草转氨酶(AST)升高。本案例中未发现神经毒性(视觉障碍、脑病、神经系统疾病)、皮疹等不良反应。其中,低血清谷浓度组中有1例(7.1%)发生ALT升高,2例(33.3%)发生在高谷浓度组中(1例为总胆红素升高,1例为ALT升高),其余7例(14.6%)发生在目标谷浓度组中。
-
儿童感染的真菌类型中,以念珠菌和曲霉菌最为常见,其他有隐球菌、毛霉菌、镰刀菌等[9]。伏立康唑因其抗菌谱广[10]、耐药率低等优点,被多项指南推荐为临床一线抗真菌药物。
-
由于伏立康唑药代动力学的个体差异性较大,中国药理学会建议进行伏立康唑药物浓度监测和基因型检测的个体化用药[11]。美国感染病学会(IDSA)推荐2~12岁儿童无需使用负荷剂量,可直接给予维持量。本研究中的儿童均静脉使用了维持量,无1例使用负荷量及口服给药。美国FDA推荐如下:2~12岁儿童用药剂量为8 mg/(kg·次),q12h。然而在实际使用过程中,考虑患儿的各器官功能,各项实验室指标,及独特的生理特点等因素,临床给药剂量范围有一定的上下浮动。本研究中伏立康唑的给药范围在3.6~8.0 mg/(kg·次),q12h,分为<4.0、4.0~7.0和 >7.0 mg/kg 3种给药剂量。虽然本研究中部分案例给药剂量稍低,但所测得血药浓度在合理的暴露范围内,并未产生较高的治疗失败结果。本研究的给药剂量可以为伏立康唑的儿童用药剂量提供一些参考,实践证明,结合治疗药物浓度监测不仅能提高有效率,同时还能避免药物不良反应的发生。
-
伏立康唑在各国指南中推荐的谷浓度各不相同,浓度下限的范围是0.5~2 mg/L[12-14],浓度上限范围是4~6 mg/L[15-17],目标浓度是1.0~5.5 mg/L。然而以上是成人的谷浓度参考范围,对于儿童的药物浓度推荐的此类研究却较少。本研究按测得的谷浓度值,分成<1.0、1.0~5.5和 >5.5 μg/ml,分别获得不同的有效率,其中,1.0~5.5 μg/ml的谷浓度范围的临床疗效高于另外2组,并且差异有统计学意义(χ2=5.360, P=0.039)。可见,达到伏立康唑的目标谷浓度有助于提高临床有效率(91.7%),低谷浓度影响了临床疗效(71.4%),但更高的谷浓度却未提高有效率(66.7%),反而容易发生不良反应(33.3%)。由此,为确保疗效,降低不良反应的发生,结合我们的研究结论,1.0~5.5 μg/ml可作为儿童伏立康唑的参考血药浓度范围。
-
伏立康唑在治疗真菌感染过程中最为常见的不良反应为肝毒性、神经毒性(视觉障碍、脑病、神经系统疾病)、皮疹等。 考虑到药物的安全性和有效性数据尚不充分,美国FDA推荐2岁以上儿童使用该药物,然而在小婴儿重症感染时,往往会遇到其他抗生素耐药或无效时,结合临床及实验室检查等,权衡利弊后,选择使用伏立康唑。本研究中有14例(14/68,20.6%)儿童<2岁,但只有2例(1例为新生儿,1例为1岁儿童)发生肝功能的异常,经保肝治疗后恢复。同样有6例儿童的谷浓度>5.5 μg/ml,却有2例因高谷浓度而发生药物不良反应。临床医师根据药物浓度结果及肝损伤指标及时下调给药剂量,未产生严重后果。可见,伏立康唑在2岁以下婴儿中有较高的安全性,结合TDM更能减少不良反应的发生。与Park[18]等做的一项随机对照研究结果较相符合,此外,我们的研究结果如王晓晨[19]等建议的那样,治疗窗较窄的伏立康唑,为确保临床疗效,需设计合理的个体化给药方案。
-
本研究中发现虽然给予合理的伏立康唑药物剂量,但测得的谷浓度仍低于<1.0 μg/ml,上调给药剂量后,复测谷浓度仍未出现明显上升。有研究显示[20]伏立康唑在儿童体内的代谢清除率速度较成人更快,更多的研究提示肝脏细胞色素P450同工酶代CYP2C19[21]对药物在体内的暴露、清除、代谢等起着至关重要的影响。而CYP2C19的基因型对伏立康唑的代谢快慢起到关键的作用,由此可在一定程度上解释合理的给药剂量却产生较低药物暴露量的原因。本研究中伏立康唑的总体安全性尚可,但仍需提醒,临床医师需要评估病情,根据循证医学、病原菌检测及药物敏感实验,结合医学伦理问题,权衡患儿风险及收益,可以谨慎使用。
本研究存在一定的局限性,只监测了伏立康唑的血药浓度,收集了给药剂量、肝肾功能等数据,初步得出了一些结论,并未深入研究目前热门的药物基因对伏立康唑代谢的影响。因样本量小,亦未对2岁以内的儿童进行详细的研究。总之,开展儿童使用伏立康唑的血药浓度监测,对药物的有效性和安全性起到一定的指导意义。
Study on the relationship between blood concentration and efficacy of voriconazole in the treatment of pediatric invasive fungal infection
-
摘要:
目的 探索伏立康唑治疗儿童侵袭性真菌感染的剂量、血药浓度与疗效的相关性。 方法 收集2019年1月至2019年12月,使用伏立康唑治疗的68例儿童侵袭性深部真菌感染病例,采用高效液相色谱法检测伏立康唑的血药谷浓度,统计分析伏立康唑的不同剂量与血药浓度和临床疗效的相关性。 结果 检测显示不同给药剂量的血药谷浓度分别为:<4.0 mg/kg(6例),谷浓度在0.4~3.31 μg/ml (r=0.613,P=0.195);4.0~7.0 mg/kg(44例),谷浓度在0.35~7.02 μg/ml(r=0.325,P=0.018);>7.0 mg/kg(18例),谷浓度在1.46~12.45 μg/ml (r=0.584,P<0.023),3组间差异有统计学意义(F=7.270, P=0.026)。68例患儿中总体有效58例(85.3%),无效10例(14.7%)。上述不同谷浓度的疗效分别为:<1.0 μg/ml组14例,有效10例(71.4%),无效4例;1.0~5.5 μg/ml组48例,有效44例(91.7%),无效4例;>5.5 μg/ml组6例,有效4例(66.7%),无效2例。3组间差异有统计学意义(χ2=5.360, P=0.039)。10例出现不良反应(14.7%),主要为轻度肝功能损伤,不影响治疗,保肝治疗后可恢复。 结论 研究显示伏立康唑治疗儿童侵袭性真菌感染总体安全有效,且存在明显的剂量-血药浓度与疗效的相关性。因此,进一步开展药动学与疗效相关研究,有利于实现理想的个体化治疗。 Abstract:Objective To explore the correlation between dose, blood concentration and efficacy of voriconazole in the treatment of invasive fungal infection in children. Methods 68 children treated with voriconazole during January 2019 to December 2019 were collected. The plasma concentration of voriconazole was assayed by high performance liquid chromatography (HPLC). The correlation between blood concentration and clinical efficacy was statistically analyzed. Results Different drug blood concentrations were obtained with different dosages: <4.0 mg/kg (6 cases) with the trough concentration ranged from 0.4 to 3.31 μg/ml (r=0.613, P=0.195). (4.0 - 7.0) mg/kg (44 cases), ranged from 0.35 to 7.02 μg/ml (r=0.325, P=0.018); >7.0 mg/kg (18 cases), ranged from 1.46 to 12.45 μg/ml (r=0.584, P<0.023). There was a difference between the three groups (F=7.270, P=0.026). The relationship between the drug blood concentration and the therapeutic effect was obvious. In the <1.0 μg/ml group of 14 cases, 10 cases (71.4%) were effective, and 4 cases were ineffective. In the 1.0 - 5.5 μg/ml group of 48 cases, 44 cases (91.7%) were effective, and 4 cases were ineffective. In the >5.5 μg/ml group of 6 cases, 4 cases (66.7%) were effective and 2 cases ineffective. The difference among the three groups was obvious (χ2=5.360, P=0.039). Among the 68 cases, 58 cases (85.3%) were effective, and 10 cases (14.7%) were ineffective. Adverse reactions occurred in 10 cases (14.7%) with mild liver function injury, which did not affect the treatment and recovered with liver protection treatment. Conclusion This study showed that voriconazole was generally safe and effective in the treatment of invasive fungal infections in children. There was a significant dose-blood concentration and efficacy correlation. Further studies on pharmacokinetics and efficacy should be carried out to optimize the individualized treatment. -
Key words:
- voriconazole /
- invasive fungal infection /
- children /
- drug concentration /
- clinical efficacy
-
1. 电离辐射的危害
随着全球经济的高速发展和科技的不断进步,核工业在军事、医疗等领域得到全面发展,但伴随而来的是对从业人员和附近居民造成严重的辐射危害。
辐射是指能量以电磁波或粒子的形式向外传播的现象,可分为电离辐射和非电离辐射。拥有足够高能量而使原子电离的辐射为电离辐射,它包括X射线、α射线、β射线、γ射线等,具有潜在的致癌性。非电离辐射能量较低,不会电离物质而会使物质内粒子运动,包括红外线、紫外线和微波等[1]。
辐射可引起全身性的放射病,几乎所有系统、器官均可发生病理性改变,其中以神经系统、消化系统和造血器官的改变最为明显,会诱发心血管疾病、糖尿病甚至癌突变。辐射对机体的损伤可分为急性和慢性放射性损伤。短时间内接受高剂量的照射,可引起机体的急性损伤,常见于核事故和放射治疗患者。剂量低于1 Gy时少数会出现轻微症状,剂量在1~10 Gy时,会出现造血型急性放射病;剂量超过10 Gy,会出现高致死率[2]。而长期接受超剂量的全身或局部照射,可引起慢性放射病,如皮肤损伤、造血障碍、白细胞减少、生育功能受损等。此外,辐射还能直接导致视力下降、视网膜脱落,诱发孕妇流产、不育、畸胎、儿童发育不足等[3]。
2 抗辐射天然产物的作用机制[4]
抗辐射药物是指在辐射前或后给予药物预防或治疗,可减轻或修复辐射损伤的药物。现有的抗辐射化学合成药物主要包括细胞因子、含硫化合物和激素类药物[5],因其毒副作用较大而应用受限,近年来天然产物因其毒副作用小、多成分多靶点的独特优势受到广泛的关注。目前认为抗辐射天然产物的作用机制主要有以下4个方面。
2.1 防护DNA损伤
辐射损伤可破坏DNA分子的结构与功能,导致DNA碱基破坏、DNA分子间交联、DNA双链或单链断裂、糖基破坏等。此外,辐射还可导致细胞周期改变以及DNA合成抑制,直接影响细胞增殖。抗辐射天然产物可通过减轻或抑制辐射致细胞周期的缩短,避免或修复DNA损伤而起辐射防护作用。
2.2 清除自由基
人体产生的80%自由基是由水分子组成的。辐射可引起水分子生成强活性的氧化自由基,主要包括·OH、
${\rm{O}}^-_2 $ 、H2O2、·NO等,其中,·OH氧化性最强,可导致组织细胞产生脂质过氧化物[6]。人体由于自由基的产生造成的破坏主要有3个方面:破坏细胞膜;使血清抗蛋白酶失去活性;损伤基因导致细胞变异,如自由基和生物大分子的结合,导致DNA主链断裂或碱基破坏,通过氧化性降解使得多糖链断裂,形成脱氢自由基,破坏细胞膜上的多糖结构[7]。现代研究表明,大多数抗辐射天然产物具有清除多种自由基作用,能降低氧化酶活性,抑制细胞过氧化物的产生。2.3 保护免疫系统
辐射主要损伤骨髓、胸腺和脾脏等免疫器官以及淋巴细胞等。崔玉芳等[8]发现辐射对免疫系统的损伤主要表现为两个特点——早期损伤严重和后期恢复缓慢。在辐射早期脾脏T、B淋巴细胞数量迅速减少,丝裂原反应明显降低,而在受照射1年后,小鼠的免疫组织和外周血淋巴细胞凋亡率与正常水平相比仍较高,小鼠T淋巴细胞免疫功能仍未恢复。促进淋巴细胞增殖,抑制胸腺和脾脏细胞凋亡等是抗辐射损伤的有效途径。
2.4 保护造血系统
造血组织是辐射的敏感组织,机体受到辐射后,造血细胞会出现功能低下甚至死亡现象,其中,造血干细胞、粒系祖细胞、红系祖细胞是辐射攻击的主要靶细胞,外周血细胞的数量随着照射剂量的增加而减少,其形态和功能也会随之发生改变[1]。因此,改善造血微环境,促进白细胞增殖,修复骨髓造血功能等有助于保护造血系统,修复辐射损伤。
3. 抗辐射天然产物
3.1 多糖类化合物
天然多糖包括植物多糖、动物多糖和微生物多糖。它们是一类具有免疫调节、抗肿瘤、抗辐射、抗炎、抗疲劳、抗衰老作用的生物大分子[9]。关于多糖的抗辐射作用的机制尚不清楚,一般认为与多糖的抗氧化,对造血系统的保护,引起免疫系统的效应增强以及诱导产生某些细胞因子等作用有关。
3.1.1 植物多糖
研究表明,大多数植物多糖有较为显著的抗辐射作用,能提高辐射诱导损伤的防护能力,改善辐射诱导的氧化损伤。其辅助保护辐射损伤的作用机制复杂,一般推测与其修复DNA损伤、消除自由基、增强免疫功能等有关[10]。张乃珣等[11]研究发现,酸性黑木耳多糖(AAP)和红松球果多酚的联合使用可以有效地清除体内自由基,降低自由基对体内DNA造成的损伤,显著提高对60Co γ射线诱导氧化损伤的防护能力。此外,白海娜等[12]发现原花青素与黑木耳多糖(AAP-4)同样有协同防护辐射诱导氧化损伤的作用。徐俊杰等[13]研究山药多糖对低强度连续微波辐射致小鼠免疫系统功能损伤的保护作用,发现正常动物组与辐射损伤组相比,不同剂量(200、400、800 mg/kg)的山药多糖可提高巨噬细胞的吞噬指数、T淋巴细胞的增殖刺激指数和血清IgG水平,并降低血清IL-4水平。表明山药多糖能明显改善低强度连续微波辐射对小鼠免疫系统的损害。胡淼等[14]报道,预先给药黑大蒜多糖(150~600 mg/kg)可减轻X射线辐射对小鼠免疫器官和全血白细胞、血小板的影响,提高脾脏的代偿性造血增殖能力,提高抗氧化酶水平,具有较好的辐射防护作用。Zhang等[15]发现大黄多糖(RTP)通过调控Nrf2及其下游蛋白HO-1,显著降低细胞凋亡和炎症因子,从而显著改善辐射诱导的肠道损伤。
3.1.2 动物多糖
国内外学者从动物体内提取出不同种类的多糖,尤其是海洋动物,如虾蟹动物的甲壳质、河蚌多糖、鲍鱼多糖等,具有抗肿瘤、抗病毒、抗氧化、抗辐射等生物活性[16]。
3.1.3 微生物多糖
研究发现微生物中,尤其生活在高压、高辐射环境中的藻类,其多糖有着较为特殊的结构与生理特性,大多有较好的抗辐射效果。Kim等[17]在探讨低分子量岩藻多糖(LMF)对中波紫外线诱导的光老化的保护作用时发现,持续15周的中高剂量(2.0、1.0 mg/cm2)LMF治疗可对受到中波紫外线照射的小鼠光老化起到明显的保护作用,可抑制皱纹形成,皮肤水肿以及中性粒细胞在光老化病灶上的聚集。杨凯业等[18]报道称铁皮石斛多糖、褐藻多糖、灵芝多糖、竹荪多糖在50 mg/L的质量浓度下的复合作用可抑制紫外线辐射诱导的皮肤细胞光老化作用。
3.2 多酚类化合物
植物多酚是广泛存在于植物体内的一类次生代谢产物,包括黄酮类、花色苷类和酚酸类。研究表明,多酚类化合物含有多个酚羟基,具有显著的清除自由基能力,能减轻自由基对机体的伤害,从而起到辐射防护作用[19]。
Lekmine[20]等评价用阿尔及利亚南部特有植物Astragalus gombiformis Pomel地上部分制备的丁醇提取物的药理活性,采用防晒系数(SPF)等评价Astragalus gombiformis Pomel的光保护作用和抗氧化能力,结果表明提取物(SPF=37.78±0.85,SPF值>30的皮肤保护产品被认为是有效的紫外线辐射过滤器)具有良好的紫外线吸收能力,推测主要与其中的黄酮类和酚酸类化合物(主要为水飞蓟素、迷迭香酸、槲皮苷和山柰酚)的紫外吸收能力和抗氧化防御能力有关,具有潜在的辐射防护能力。
3.2.1 黄酮类化合物
黄酮类化合物泛指两个具有酚羟基的苯环(A-与B-环)通过中央三碳原子相互连结而成的一系列化合物,其基本母核为2-苯基色原酮。黄酮类化合物是一类从中草药中提取的天然产物,被认为是一种有效的抗氧化剂,可以调控炎症介质的调节酶或转录因子,通过与DNA的相互作用影响氧化应激,增强基因组稳定,具有神经保护和辐射保护作用[21]。
金银花素(5,7-二羟基黄酮)是从蜂胶、蜂蜜和几种植物中提取的一种黄酮类化合物。Mansour等[22]发现给药金银花素(50 mg/kg)可提高受5 Gy红外线照射雄性Wister大鼠大脑中丙二醛(MDA)水平和半胱氨酸蛋白酶-3(caspase-3)活性,这提示金银花素具有辐射致脑损伤的神经保护作用。Kale等[23]通过组织病理评估,显示槲皮素可显著减少辐射诱导的神经元变性和炎症浸润,揭示了槲皮素对辐射致脑损伤的神经保护作用。
Li等[24]证实芹菜素(4′,5,7-三羟基黄酮)能够一定程度上修复UVB诱导的人表皮角质形成细胞(HEKs)的毛细血管扩张性共济失调的异常突变,从而抑制HEKs细胞凋亡和坏死,表明芹菜素对中波紫外线损伤的HEKs具有新型的保护作用。Prasad等[25]报道水飞蓟宾(silibinin)可以防止中波紫外线诱导的胸腺嘧啶二聚体的形成,通过增加抑癌基因p53水平进而促进DNA修复和(或)启动受损细胞的凋亡。
曲克芦丁(TRX)是一种黄酮类化合物,广泛存在于茶叶、咖啡、谷类食品、各种水果和蔬菜中,具有抗辐射作用,Panat[26]对其清除自由基的能力和抗细胞凋亡活性进行了系统的研究。TRX能清除超氧物、NO和其他模型稳定的自由基,从而保护受辐照的细胞。
有些英国科学家研究发现,每天喝两杯绿茶、吃一个橘子,就可以帮助“电脑族”们抵御计算机辐射[27]。而儿茶素类化合物作为茶叶中的主要功能成分,具有显著的抗辐射作用。茶树中儿茶素类化合物主要包括,儿茶素、表儿茶素、没食子儿茶素、表没食子儿茶素、儿茶素没食子酸酯、表儿茶素没食子酸酯、没食子儿茶素没食子酸酯及表没食子儿茶素没食子酸酯8种单体。其中,表没食子儿茶素没食子酸酯生理活性较为突出,具有抗氧化性和抗细胞凋亡活性,可预防不同刺激对组织的损伤。Korystova等[28]研究发现在对辐射诱导的大鼠主动脉损伤的预防作用中,发现红茶比绿茶更加有效,即使浓度低于1 g/100 ml的红茶也能够有效预防红外线对主动脉造成的损伤。红茶中的儿茶素含量明显低于绿茶,但两种茶中的黄酮醇含量几乎相等。儿茶素、表没食子儿茶素和表没食子儿茶素没食子酸酯可增加大鼠主动脉的氧化应激,而黄酮醇可降低辐射诱导的氧化应激。因此,红茶药效的提高是由于儿茶素含量的降低使黄酮醇的正向调节作用更大程度地得到发挥所致。
3.2.2 酚酸类化合物
酚酸类化合物系指具有多羟基的芳香羧酸类化合物,主要以糖、酯以及有机酸的形式存在于植物中,现代研究表明酚酸类化合物能够清除体内多种自由基,具有良好的抗氧化活性和潜在的辐射防护作用。
Milton等[29]报道,鱼腥草细胞培养物的甲醇提取物因细胞产生酚类次生代谢物而具有潜在的光保护作用,结果显示鱼腥草细胞的甲醇提取物(310~2500 g/ml)能够显著提高受紫外线照射的3T3-Swiss白化成纤维细胞活力。提取物的LC-MS化学分析表明,其总酚和总酚酸含量(主要为没食子酸和毛蕊花苷)较高,具有特征的紫外吸收峰(第一和第二波段的峰值分别为294和330 nm),能够抵消紫外线对皮肤的有害影响。
Abozaid等[30]报道肉桂酸纳米颗粒可作为一种辐射诱导胰腺炎的氧化还原信号通路的调节剂,首先用I-精氨酸和γ射线诱导大鼠患急性胰腺炎,口服肉桂酸纳米颗粒(CA-NPs)后,急性胰腺炎的严重程度及血清淀粉酶和脂肪酶水平均降低。同时,胰腺组织的MDA水平显著降低,谷胱甘肽的消耗显著恢复,caspase-3水平降低,可明显改善胰腺组织损伤或凋亡。因此,肉桂酸纳米颗粒对辐射诱导的急性胰腺炎具有较好的治疗潜力。Liu等[31]研究发现姜黄素(Cur)对长波紫外线辐射诱导的人皮肤成纤维细胞(HDFs)光老化具有一定的保护作用。Zhang等[32]发现白藜芦醇通过激活Sirtuin1 (Sirt1,组蛋白去乙酰化酶家族成员之一,可减轻炎症损伤)减轻辐射诱导的小鼠肠道损伤。周瑞芳等[33]研究表明,丹酚酸B可减轻γ射线辐射诱导的造血系统损伤和骨髓细胞的DNA及蛋白质的减少,恢复小鼠免疫系统的辐射损伤,具有显著的抗γ射线辐射作用。
3.2.3 花色苷
花色苷是花青素和糖以糖苷键结合而成的一种化合物,广泛存在于植物的花、果实、茎、叶和根器官的细胞液中,起到保护植物抗氧化的作用。其抗氧化和消除自由基能力可防护不同射线辐射,能够发挥独特的生理效应。
Fernandes等[34]发现花色苷家族成员(矢车菊色苷、锦葵色苷及其衍生色素)具有促进皮肤维持健康的活性,研究表明大部分化合物能够抑制金黄色葡萄球菌和铜绿假单孢菌菌株的生长繁殖,减少HEKs和HDF活性氧的产生,抑制皮肤降解酶的活性且无细胞毒性作用,具有一定的紫外线过滤作用。
Targhi等[35]研究黑桑花色苷对大鼠肝组织和骨髓细胞的辐射防护作用,以 60Co γ射线远距放射(3 Gy和6 Gy)建立大鼠辐射损伤模型,随后腹腔注射200 mg/kg的黑桑花色苷,结果显示黑桑花色苷可降低大鼠肝脏MDA和SOD的水平,降低γ射线照射对大鼠骨髓细胞和肝脏的遗传毒性和细胞毒性,有潜在的辐射保护作用。
3.3 皂苷类化合物
皂苷(saponin)类化合物是苷元为三萜或螺旋甾烷类化合物的一类糖苷,存在于人参、桔梗、刺五加等许多中草药中,在增强免疫、抗肿瘤、抗炎等方面具有显著的生物活性。研究表明人参皂苷的抗辐射机制与清除自由基、抗氧化活性,与其对心血管系统、免疫系统的保护作用以及对细胞凋亡的抑制作用有关[36]。
Wen[37]等研究黄芪甲苷对中波紫外线诱导的大鼠真皮成纤维细胞早衰的抗光老化作用,结果显示黄芪甲苷不仅能通过激活细胞外调解蛋白激酶ERK和丝裂原活化蛋白激酶p38信号抑制中波紫外线诱导的胶原-I的降解,还通过激活细胞自噬增加胶原-I的积累,从而保护中波紫外线诱导的光老化细胞,表明黄芪甲苷在抗光老化治疗中的潜在优势。
Wang等[38]分析柴胡皂苷-d (SSd)对肝癌细胞自噬活性和放射敏感性的影响,SSd通过抑制mTOR磷酸化促进肝癌细胞自噬,增加辐射诱导的肝癌细胞凋亡并且抑制肝癌细胞的增殖,为肝癌的放射增敏治疗提供了一种可能的途径。
Kim等[39]研究知母皂苷A-III(TA-III)对中波紫外线诱导的HEKs和HDF侵袭效应的保护作用时发现,TA-III在非细胞毒性剂量下(50 nmol/L)以剂量依赖的方式抑制中波紫外线诱导的环氧合酶-2(COX-2)、基质金属蛋白酶-9(MMP-9)转录和蛋白表达水平,降低中波紫外线诱导的原代皮肤细胞的侵袭,组织肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)和COX-2在HEKs中的过度表达,表明其具有光保护剂的开发潜力。
3.4 其他
除了上述多糖类、多酚类以及皂苷类化合物,天然产物中的许多其他化合物同样具有良好的辐射防护作用,包括维生素类、蛋白类、无机成分、稀有元素等。
Rostami等[40]研究发现预先摄入硒和维生素E能够对X射线辐射引起的遗传损害起到一定的防护作用。段一凡等[41]报道茶叶籽不饱和脂肪酸对中波紫外线诱导的HEKs损伤具有保护作用。Jaisin等[42]研究发现胡椒碱(10~40 µmol/L)预处理可抑制中波紫外线诱导的炎症信号通路,减弱HEKs的细胞毒性并且抑制其凋亡。这提示胡椒碱的抗炎作用能保护HEKs免受中波紫外线辐射的损伤,可作为一种紫外线辐射诱导皮肤炎症的有效治疗手段。
4. 结语
近年来,国内外越来越重视辐射损伤的防护,抗辐射药物的寻找也变得十分紧迫。而与传统的化学合成药物相比,天然来源的药物具有活性高、选择性强、毒副作用小等优点,作为抗辐射药物有着广阔的开发前景。但是抗辐射天然产物的筛选方法耗时耗力,因此建立高通量、高专属性的抗辐射天然产物筛选方法意义重大。此外,对已有的天然产物进行结构改造,以期获得抗辐射活性更高或毒副作用更小的衍生物以及提高抗辐射天然产物的提取纯化效率等皆是未来抗辐射天然产物研究的重点和难点。
-
表 1 患儿一般资料分布情况
年龄 性别 例数(%) 男(%) 女(%) 新生儿 4(11) 2(7) 6(9) 29天~2岁 4(11) 4(13) 8(12) 2~12岁 24(63) 22(73) 46(67) 12~15岁 6(15) 2(7) 8(12) 合计 38(56) 30(44) 68(100) 表 2 伏立康唑用药剂量和疗效的相关性
组别(μg/ml) 例数 有效(%) 无效(%) <4.0 6 5(83.3) 1(16.7) 4.0~7.0 44 37(84.1) 7(15.9) >7.0 18 16(88.9) 2(11.1) 合计 68 58(85.3) 10(14.7) 表 3 血清谷浓度值与疗效的相关性
组别(μg/ml) 例数 有效(%) 无效(%) χ2 P <1.0 14 10(71.4) 4(28.6) 5.360 0.039 1.0~5.5 48 44(91.7) 4(8.3) >5.5 6 4(66.7) 2(33.3) 合计 68 58(85.3) 10(14.7) 表 4 伏立康唑给药剂量与谷浓度的关系
组别(mg/kg) 例数 谷浓度(μg/ml)
中位数
(四分位间距)r P F P <4.0 6 1.59(0.40~2.76) 0.613 0.195 7.270 0.026 4.0~7.0 53 1.91(0.93~3.63) 0.325 0.018 >7.0 9 3.31(2.04~5.49) 0.738 0.023 -
[1] ALIAGA S, CLARK R H, LAUGHON M, et al. Changes in the incidence of candidiasis in neonatal intensive care units[J]. Pediatrics, 2014, 133(2): 236-242. https://www.ncbi.nlm.nih.gov/pubmed/24446441/. [2] XIA H, WU H, XIA S, et al. Invasive Candidiasis in preterm neonates in China: a retrospective study from 11 NICUS during 2009-2011[J]. Pediatr Infect Dis J, 2014, 33(1): 106-109. https://www.ncbi.nlm.nih.gov/pubmed/24153006/. [3] 戎群芳, 张育才, 朱艳, 等. 儿童重症监护病房侵袭性真菌感染危险因素分析[J]. 中国小儿急救医学, 2011, 18(2): 123-125. http://new.med.wanfangdata.com.cn/Paper/Detail?id=PeriodicalPaper_xejjyx201102008. [4] DRAGONETTI G, CRISCUOLO M, FIANCHI L, et al. Invasive aspergillosis in acute myeloid leukemia: Are we making progress in reducing mortality? [J]. Med Mycol, 2017, 55(1): 82-86. https://www.ncbi.nlm.nih.gov/pubmed/27915304/. [5] DOLTON M J, MCLACHLAN A J. Voriconazole pharmacokinetics and exposure-response relationships: assessing the links between exposure, efficacy and toxicity[J]. Int J Antimicrob Agents, 2014, 44(3): 183-193. https://www.ncbi.nlm.nih.gov/pubmed/25106074/. [6] 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童侵袭性肺部真菌感染诊治指南(2009版)[J]. 中华儿科杂志, 2009, 47(2): 96-98. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zhek200902005. [7] 郑飞跃, 吴燕, 饶跃峰, 等. 诺氏评估量表在药物不良反应评价中的作用及实例分析[J]. 中国药学杂志, 2012, 47(8): 650-652. https://kns.cnki.net/KCMS/detail/detail.aspx?filename=ZGYX201208025&dbname=CJFD&dbcode=CJFQ. [8] 中华医学会肝病学分会药物性肝病学组. 药物性肝损伤诊治指南[J]. 肝脏, 2015, 20(10): 750-767. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=gz201510002. [9] 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童侵袭性肺部真菌感染诊治指南(2009版)[J]. 中华儿科杂志, 2009, 47(2): 96-98. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zhek200902005. [10] PURKINS L, WOOD N, GREENHALGH K, et al. The pharmacokinetics and safety of intravenous voriconazole - a novel wide-spectrum antifungal agent[J]. Br J Clin Pharmacol, 2003, 56(Suppl 1): 2-9. https://www.ncbi.nlm.nih.gov/pubmed/14616407/. [11] 陈恳, 宋再伟, 刘维, 等. 《中国伏立康唑个体化用药指南》推荐意见的外审[J]. 药物流行病学杂志, 2017, 26(2): 143-148. https://kns.cnki.net/KCMS/detail/detail.aspx?filename=YWLX201702016&dbname=CJFD&dbcode=CJFQ. [12] ROBERTS J D, WELLS G A, LE MAY M R, et al. Point-of-care genetic testing for personalisation of antiplatelet treatment (RAPID GENE): a prospective, randomised, proof-of-concept trial[J]. Lancet, 2012, 379(9827): 1705-1711. https://www.ncbi.nlm.nih.gov/pubmed/22464343/. [13] CHAU M M, KONG D C, VAN HAL S J, et al. Consensus guidelines for optimising antifungal drug delivery and monitoring to avoid toxicity and improve outcomes in patients with haematological malignancy, 2014[J]. Intern Med J, 2014, 44(12b): 1364-1388. https://www.ncbi.nlm.nih.gov/pubmed/25482746/. [14] CHEN K, ZHANG X, KE X, et al. Individualized medication of voriconazole: a practice guideline of the division of therapeutic drug monitoring, Chinese pharmacological society[J]. Ther Drug Monit, 2018, 40(6): 663-674. https://www.ncbi.nlm.nih.gov/pubmed/30192314/. [15] PATTERSON T F, THOMPSON G R III, DENNING D W, et al. Practice guidelines for the diagnosis and management of aspergillosis: 2016 update by the infectious diseases society of America[J]. Clin Infect Dis,2016,63(4):e1-e60. doi: 10.1093/cid/ciw326 [16] LAVERDIERE M, BOW E J, ROTSTEIN C, et al. Therapeutic drug monitoring for triazoles: a needs assessment review and recommendations from a Canadian perspective[J]. Can J Infect Dis Med Microbiol, 2014, 25(6): 327-343. https://www.ncbi.nlm.nih.gov/pubmed/25587296/. [17] ULLMANN A J, AGUADO J M, ARIKAN-AKDAGLI S, et al. Diagnosis and management of Aspergillus diseases: executive summary of the 2017 ESCMID-ECMM-ERS guideline[J]. Clin Microbiol Infect,2018,24:e1-e38. doi: 10.1016/j.cmi.2018.01.002 [18] PARK W B, KIM N H, KIM K H, et al. The effect of therapeutic drug monitoring on safety and efficacy of voriconazole in invasive fungal infections: a randomized controlled trial[J]. Clin Infect Dis, 2012, 55(8): 1080-1087. https://www.ncbi.nlm.nih.gov/pubmed/22761409/ [19] 王晓晨, 王思箭, 刘林夕, 等. 伏立康唑个体化给药研究进展[J]. 中国抗生素杂志, 2020, 45(1): 16-25. https://kns.cnki.net/KCMS/detail/detail.aspx?filename=ZKSS202001003&dbname=CJFD&dbcode=CJFQ. [20] LI X, YU C, WANG T, et al. Effect of cytochrome P450 2C19 polymorphisms on the clinical outcomes of voriconazole: a systematic review and meta-analysis[J]. Eur J Clin Pharmacol, 2016, 72(10): 1185-1193. https://www.ncbi.nlm.nih.gov/pubmed/27388292/. [21] MORIYAMA B, OBENG A O, BARBARINO J, et al. Clinical pharmacogenetics implementation consortium (CPIC) guide-lines for CYP2C19 and voriconazole therapy[J]. Clin Pharma-col Ther, 2017, 102(1): 45-51. https://www.ncbi.nlm.nih.gov/ pubmed/27981572/. -





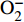
 下载:
下载: 


