-
消痰通腑方应用于治疗胃肠癌前病变患者已有十余年,能够延缓胃肠癌前患者向肿瘤的进展,同时对脓毒症等危重症患者的胃肠功能恢复有较好疗效[1-5]。该方剂由法半夏、生大黄、制大黄、制南星、重楼和黄连六味中药配伍组成,法半夏、制大黄为主药,旨在消痰止呕、泄下通俯之意。半夏乃燥湿化痰、降逆止呕、消痞散结之良药,法半夏为半夏的炮制品,倍其化痰之力;制大黄为生大黄炒制,泻下力缓,能通达肠腑而推陈出新,又不伤正气,两者合用,既燥湿化痰,又缓消积滞,达消痰通腑之功。黄连既能泻脾胃之火,又能燥痰饮之湿。
目前对该方剂的研究集中在药理功效方面,尚无对该方剂化学成分、有效成分的相关研究报道。寻找中药复方的临床药效基础,是长期困扰中医人临床研究的难点。超高效液相色谱四极杆飞行时间质谱法(UHPLC-Q-TOF/MS)是一种简便、快速、高灵敏度的现代分析技术,能够提供化合物的精确分子量、元素组成以及离子碎片信息(MS1和MS),广泛用于中药化学成分的快速分析和鉴别[6-7]。本研究拟采用此方法对消痰通腑方的化学成分开展研究,为其质量标志物筛选和探明药效物质提供实验依据。
-
Agilent 1290 Infinity型超高效液相色谱和 6530型四极杆-飞行时间串联质谱仪(美国安捷伦);CPA255D型1/10万电子天平(德国Sartorius);Eppendorf mini spin离心机、Eppendorf 5430r离心机(德国Eppendorf);Lyovapor L-200冷冻干燥机(瑞士BUCHI);Milli-Q型纯水系统(美国Millipore);SK7200H型超声仪(上海科导超声仪器有限公司)。
甘草酸(批号:F610137)、重楼皂苷I(批号:F278755)、重楼皂苷II(批号:F297228)、重楼皂苷VI(批号:F483230)、薯蓣皂苷(批号:F543583)、重楼皂苷H(批号:F297228)、奎宁酸(批号:F435708)、柠檬酸(批号:F594530)、异佛莱心苷(批号:F109963)、芹糖异甘草苷(批号:F667242)购自上海一飞生物科技有限公司,异佛莱心苷纯度为95%,其余对照品纯度均≥98%;芦荟大黄素(批号:D1226AS)、大黄素甲醚(批号:O1026AS)、大黄酚(批号:D0316AS)、大黄酸(批号:N1107AS)购自大连美仑生物科技有限公司,纯度均≥98%;水为去离子水;甲醇、乙腈、甲酸(质谱纯,德国E. Merck公司);其余试剂均为分析纯。
消痰通腑免煎剂由法半夏、生大黄、制大黄等药物组成。由江阴制药厂生产,长征医院监制,生产批号:20200420。
-
精密称定免煎剂0.5 g,加入70%甲醇50 ml,超声提取30 min,得70%甲醇提取物(简称醇提液);精密称定免煎剂0.5 g,加入70~80°C热水50 ml,搅拌5 min,超声提取30 min得水提液。提取液于3000 r/min离心10 min,取上层溶液1.5 ml置离心管中,再经15000 r/min离心10 min,取上清液过0.22 μm 微孔滤膜,即得。
-
精密称取适量甘草酸、芦荟大黄素等对照品,加甲醇分别制成每1 ml 含对照品1 mg的储备溶液。精密吸取上述储备溶液各10 μl,置于1.5 ml 离心管中混合,涡旋混匀,加入甲醇配制成各对照品浓度分别为10 μg/ml的混合标准溶液。
-
从已有的药材化合物成分分析文献中获取该方剂各味药的成分信息,确保数据库中收录的化合物能够在已发表的文献中检索可得,在基于Agilent自带的defult文档上建立方剂化合物数据库。采用Agilent MassHunter Qualitative Analysis 10.0软件对数据进行分析。
-
Waters ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm),以 0.1% 甲酸水溶液(A)-乙腈(B)为流动相进行梯度洗脱(0~3 min,5 %B;3~15 min,5 %~35 %B;15~30 min,35 %~95 %B),柱温30 °C,流速0.3 ml/min,进样量1 μl,检测波长254 nm。
-
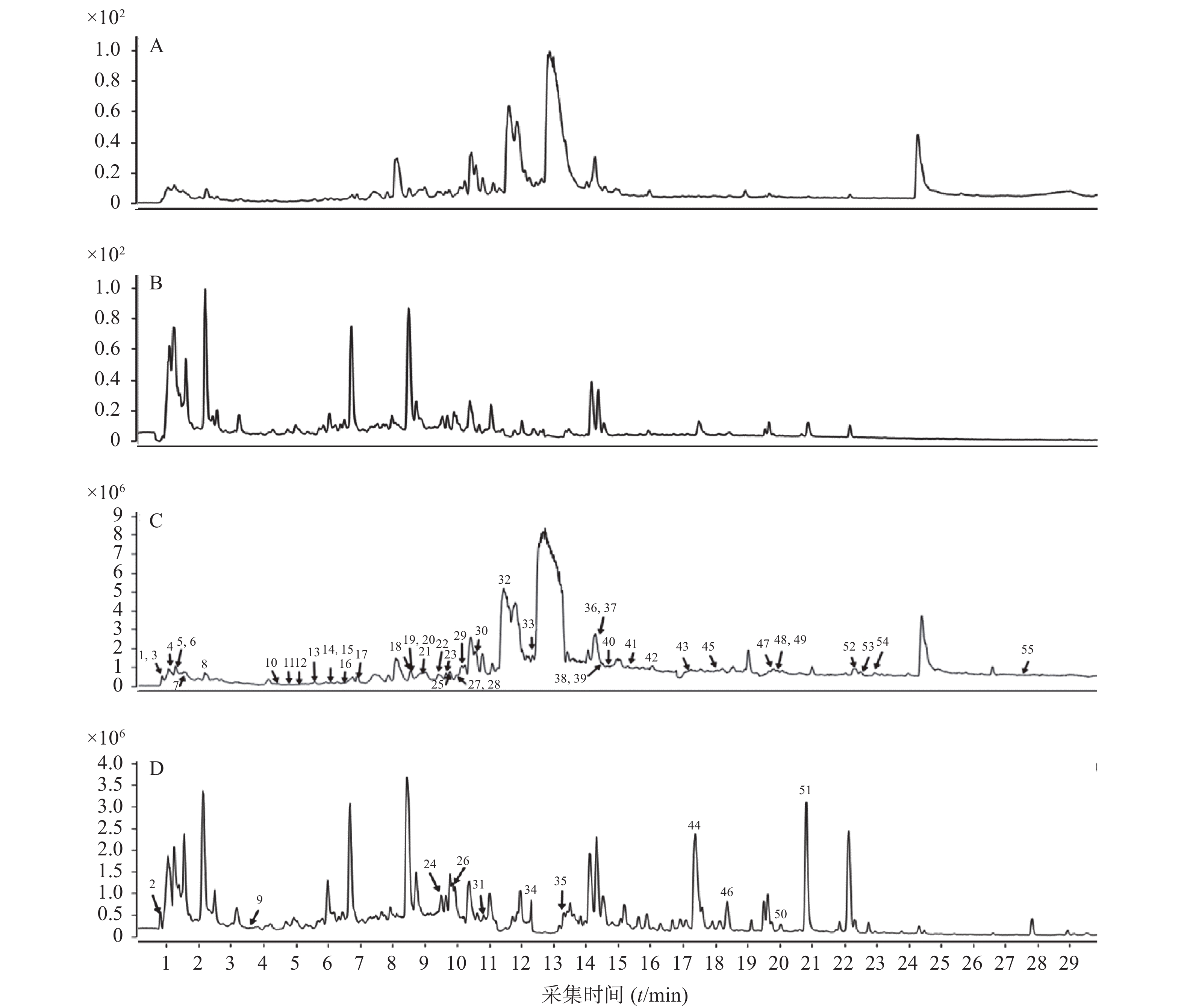
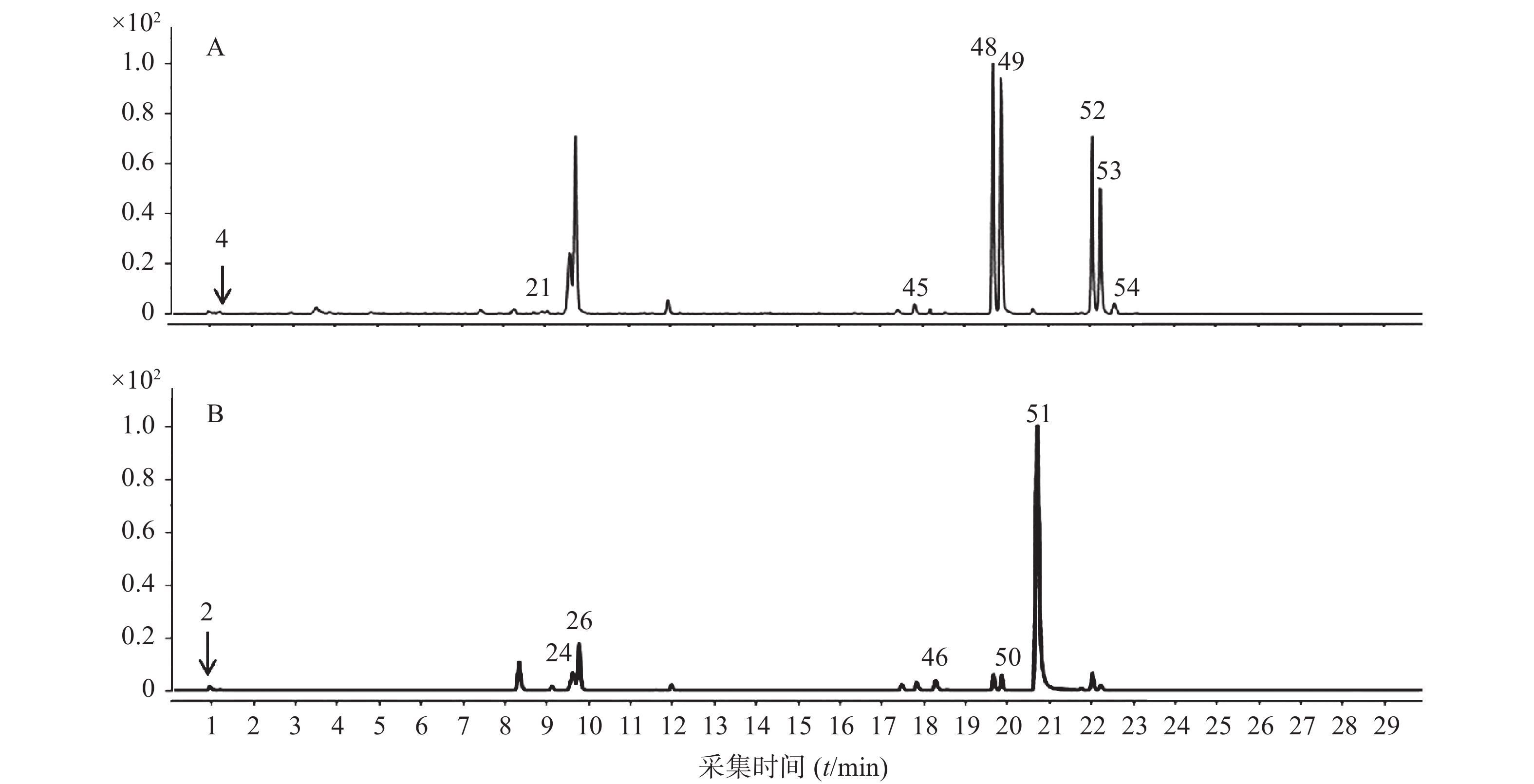
ESI离子源,分别在正、负离子模式下采集数据,采集范围100~1700 m/z。离子源温度350 ℃,毛细管电压3.5 kV(正离子)、4.0 kV(负离子),雾化气压力45 Psi,干燥气流速11 L/min,鞘气流速11 L/min,鞘气温度350 ℃,碎片电压140 V。对照品和消痰通腑方的UHPLC-Q-TOF/MS色谱图分别见图1和图2。
-
在全扫描质谱图中,大多数对照品化合物在正模式下显示[M+H]+离子,或在负模式下显示[M-H]−。由于流动相中存在Na+和甲酸,部分化合物中观察到[M+Na]+和[M+HCOOH-H]−,少许化合物中观察到[M+K]+、[M+NH4]+及[M+CH3COOH-H]−。
化合物的鉴定首先使用 Agilent 10.0软件中的按化学式查找功能,根据精确质量、同位素丰度,以及上述分子离子峰进行鉴定。当有对照品时,通过比较其在图谱上的保留时间和m/z信息与对照品的相关信息进行鉴别。在没有对照品的情况下,主要根据质谱信息(包括化合物二级质谱信息)和参考文献进行初步的鉴定。根据质谱信息和参考文献进行初步鉴定时,通过导入已建立的方剂化合物数据库,利用Agilent 10.0软件进行识别,并结合Massbank、Pubchem、Chemspider等在线数据库进行辅助分析,根据化合物准确分子量及碎片信息进行判断,排除假阳性结果。例如:
化合物1:通过数据库识别到0.906 min的分子离子峰在正负离子模式下分别出现m/z 175.1193 的[M+H]+离子和m/z 173.1036的 [M-H]− 离子,软件自动生成匹配度最高分值的分子式为C6H14N4O2,说明其可能为精氨酸。其次,结合Massbank在线数据库对其二级碎片离子进行查找,发现正离子模式下可识别到158、116碎片离子,负离子模式下可识别到173、131等碎片离子,因此,推断化合物1为精氨酸,结合我们建立化合物数据库信息,判断该化合物来源于黄连或制半夏[8]。
化合物12:通过数据库识别到1.394 min的分子离子峰在正负离子模式下分别出现m/z 333.0878的[M+H]+离子和m/z 331.0672的 [M-H]− 离子,软件自动生成匹配度最高分值的分子式为C13H16O10。其次,化合物产生m/z 169没食子酸的特征碎片离子,而大黄中的简单酚酸类成分基本结构主要是没食子酸、对香豆酸、阿魏酸、对羟基苯丙酸等,因此,推测该化合物为来源于大黄的没食子酸-3-O-β-D-葡萄糖苷[9]。
化合物44:负离子模式下在17.208 min识别到m/z 837.3886的 [M-H]− 离子,软件自动生成匹配度最高分值的分子式为C42H62O17。其次,化合物产生m/z 351的离子峰,为其结构中2 分子的葡萄糖醛酸苷键断裂形成的碎片离子m/z 351[2 × C6H8O6-H]−离子,因此,推断化合物44为甘草皂苷G2,来源于法半夏[10]。
考虑到此中药方剂以水冲服的方式,本研究还同步分析了水提液的化学成分,结果亦参见图2和表1。结果表明,70%甲醇提取物能够识别的化合物比水提液识别的化合物多10个,且化合物的峰面积也较高。与70%甲醇提取方式获得化合物相比,水提液识别的是即将吸收入血的体外化合物群的信息,而70%甲醇提取液识别的则是方剂中更多的化合物的信息,有助于解析其多成分的特征,保证消痰通腑免煎剂所含有的化合物的准确性,也有助于免煎剂生产的质量控制。
表 1 消痰通腑方的鉴定分析结果
序号 质量 相对时间(min) 分子式 m/z(MS1) 部分特征离子峰 m/z (MS2) 差异(Δ ppm) 名称 来源药材 来源文献 1 174.1115 0.906 C6H14N4O2 175.1193 [M+H]+ 175,158,116 −1.01 精氨酸 黄连*,制半夏 [8,11] 174.1113 0.906 173.1036 [M-H]- 173,131 −2.40 2 192.0617 0.965 C7H12O6 191.0552 [M-H]- 191,173,111 −4.71 奎宁酸 黄连 [8] 3 251.1022 0.996 C10H13N5O3 252.1093 [M+H]+ 252,194,137 0.79 脱氧腺苷 重楼,制半夏 [11-12] 4 192.0281 1.189 C6H8O7 230.9906 [M+K]+ 1.73 柠檬酸 黄连 [12] 192.0276 1.168 191.0203 [M-H]- 191,111,103 3.14 5 332.0767 1.394 C13H16O10 333.0878 [M+H]+ 4.61 没食子酸-3-O-β-D-葡萄糖苷 大黄* [13] 332.0746 1.395 331.0672 [M-H]- 271,169 0.30 6 170.0216 1.396 C7H6O5 171.0289 [M+H]+ 171,155,153 0.29 没食子酸 大黄* [13] 170.0216 1.520 169.0143 [M-H]- 125,111 0.42 7 131.0945 1.508 C6H13NO2 132.1018 [M+H]+ 132,86 −0.76 异亮氨酸 天南星,制半夏 [11,14] 131.0939 1.475 130.0869 [M-H]- −3.84 8 165.079 2.273 C9H11NO2 166.0864 [M+H]+ 166,120 0.60 苯丙氨酸 天南星,制半夏 [11,14] 165.0792 2.238 164.0723 [M-H]- 3.66 9 354.0946 3.752 C16H18O9 353.0874 [M-H]- 353,191 −1.13 绿原酸 黄连* [8] 10 204.0899 4.31- C11H12N2O2 205.0973 [M+H]+ 159,146 0.10 色氨酸 黄连*,制半夏 [8,11] 204.0897 4.207 203.0819 [M-H]- 142,116 −0.69 11 326.1026 4.812 C15H18O8 325.0919 [M-H]- 325,235,145 2.86 对香豆酸-O-葡萄糖苷 大黄 [13] 12 452.1327 5.06- C21H24O11 475.1211 [M+Na]+ 0.00 儿茶素-O-葡萄糖苷 /表儿茶素-O-葡萄糖苷 大黄 [13] 452.1319 4.993 451.1239 [M-H]- 451,137 −1.55 13 578.143 5.392 C30H26O12 579.1505 [M+H]+ 0.94 原花青素B2 大黄* [13] 578.1417 5.277 577.1345 [M-H]- 577,289 −1.23 14 290.0797 6.073 C15H14O6 291.0867 [M+H]+ 161 1.37 儿茶素 大黄 [13] 290.0794 5.995 289.0721 [M-H]- 245,203,187 1.04 15 194.0586 6.076 C10H10O4 217.0492 [M+Na]+ 177,145 4.68 阿魏酸 大黄 [13] 16 654.1949 6.449 C33H34O14 653.1871 [M-H]- 653,313,169 −0.77 4-( 4'-羟基苯基) -2-丁酮-O-阿魏酰-没食子酰-葡萄糖苷 大黄 [13] 17 484.0858 6.826 C20H20O14 483.078 [M-H]- 313,169 0.00 没食子酸-O-没食子酰基葡萄糖苷 大黄 [15] 18 164.0470 8.434 C9H8O3 163.0397 [M-H]- 163,155 −2.45 对香豆酸 大黄 [13] 19 564.1492 8.589 C26H28O14 565.1559 [M+H]+ 565,505 1.24 夏佛托苷 天南星 [16] 564.1478 8.556 563.1418 [M-H]- 2.13 20 322.1093 8.578 C19H16NO4+ 323.1163 [M+H]+ 265,189 3.40 格兰地新 黄连 [17] 21 284.0687 8.920 C16H12O5 285.076 [M+H]+ 242 1.05 大黄素甲醚 大黄 [18] 22 564.1871 9.192 C27H32O13 587.1756 [M+Na]+ 356,322 3.58 鼠李糖甘草苷 法半夏 [16] 23 234.0533 9.318 C12H10O5 235.0604 [M+H]+ 222,189 1.28 2-甲基-5-羧甲基-7-羟基色原酮 大黄 [13] 234.0531 9.262 233.0458 [M-H]- 1.29 24 578.1641 9.686 C27H30O14 577.1554 [M-H]- 577,146 −1.55 异佛莱心苷 法半夏 [11] 25 442.0921 9.820 C22H18O10 443.0976 [M+H]+ 393,123 4.81 表儿茶素没食子酸酯 大黄 [13] 442.0901 9.820 441.0824 [M-H]- 0.23 26 550.1704 9.845 C26H18O10 549.1614 [M-H]- 283,239 0 芹糖异甘草苷 法半夏 [10] 27 446.0856 9.912 C21H18O11 469.0733 [M+Na]+ 279,248 −1.71 大黄酸-8-O-β-D-葡萄糖苷 大黄 [15] 446.0848 9.845 445.0772 [M-H]- −0.90 28 478.1471 9.978 C23H26O11 479.1551 [M+H]+ 0.63 异莲花掌苷 大黄 [15] 478.1472 9.922 477.14 [M-H]- 313 −0.42 29 310.1058 10.092 C15H18O7 333.0949 [M+Na]+ 1.20 2-O-桂皮-β-D-葡萄糖苷 大黄 [13] 310.1055 10.002 355.1035 [M+HCOOH-H]- 345 0.00 30 234.0897 10.684 C13H14O4 235.097 [M+H]+ 235 2.13 2-(2′-羟丙基)-5-甲基-7-羟基色原酮 大黄 [13] 234.0895 10.631 233.0822 [M-H]- 1.29 31 862.1953 10.833 C42H38O20 861.1888 [M-H]- 699,654 0.46 番泻苷 B 大黄 [13] 32 320.0893 11.572 C19H14NO4 321.0991 [M+H]+ 292,234 −1.90 黄连碱 黄连 [19] 33 399.1665 12.363 C22H25NO6 422.1598 [M+Na]+ 350,336,292 4.69 秋水仙碱 天南星 [20] 34 462.1161 12.313 C22H22O11 461.1088 [M-H]- 461,331,169 −0.22 桂皮酸-O-没食子酰-葡萄糖苷 大黄 [9] 35 418.1257 13.394 C21H22O9 417.1188 [M-H]- 255,213 −0.72 异甘草苷 法半夏 [10] 36 1048.5438 14.102 C51H84O22 1071.5336 [M+Na]+ 869,577 −0.93 重楼皂苷G 重楼 [21] 1048.5457 14.078 1047.5386 [M-H]- 0.48 37 408.1422 14.182 C20H24O9 431.1314 [M+Na]+ 306,292 0.23 6-甲氧基酸模素-8-O-β-D-葡萄糖苷 大黄 [13] 408.1424 14.112 407.1352 [M-H]- 0.98 38 432.1053 14.372 C21H20O10 455.0942 [M+Na]+ 455,292 −1.54 芦荟大黄素-3-羟甲基-O-葡萄糖苷 大黄 [13] 432.1060 14.317 431.0989 [M-H]- 1.16 39 1046.5283 14.384 C51H82O22 1047.5356 [M+H]+ 415,172 −1.43 polyphylloside III 重楼 [20] 1046.5282 14.852 1091.5286 [M+HCOOH-H]- 0.55 40 416.1109 14.554 C21H20O9 439.0999 [M+Na]+ 439,336 −0.23 大黄酚-8-O-β-D-葡萄糖苷 大黄 [13] 416.1104 14.487 415.1032 [M-H]- −0.72 41 286.048 15.273 C15H10O6 287.0552 [M+H]+ 0.74 木犀草素 黄连* [8] 286.0484 15.216 285.0412 [M-H]- 285,215,199 2.20 42 446.1213 15.932 C22H22O10 469.1104 [M+Na]+ 469,283 −0.21 大黄素甲醚-8-O-β-D葡萄糖苷 大黄 [15] 284.0687 15.865 283.0616 [M-H]- 1.41 43 450.1523 17.150 C22H26O10 473.1413 [M+Na]+ 473,230 −1.06 决明柯酮-O-乙酰基葡萄糖苷 大黄 [15] 450.1528 17.097 449.1469 [M-H]- 3.56 44 838.3969 17.208 C42H62O17 837.3886 [M-H]- 661,351 −3.34 甘草皂苷G2 法半夏 [10] 45 822.4012 17.943 C42H62O16 845.392 [M+Na]+ −3.17 甘草酸 法半夏* [10] 822.4031 17.914 821.3959 [M-H]- 351,193 −0.83 46 284.0328 18.384 C15H8O6 283.0257 [M-H]- 239 3.18 大黄酸 大黄 [18] 47 884.4779 19.643 C15H20O3 907.4652 [M+Na]+ 685,292 −1.10 纤细薯蓣皂苷 重楼 [21] 884.4762 19.622 929.4748 [M+HCOOH-H]- −0.43 48 870.4622 19.768 C44H70O17 893.4502 [M+Na]+ 376,251 −0.34 重楼皂苷H 重楼 [21] 870.4607 19.622 915.459 [M+HCOOH-H]- −0.55 49 854.4664 19.773 C44H70O16 877.4557 [M+Na]+ 877,306 −1.31 重楼皂苷II 重楼 [21] 870.4646 19.750 869.4546 [M-H]- 0.69 50 738.4219 19.932 C39H62O13 783.4170 [M+HCOOH-H]- 783,146 −0.26 重楼皂苷VI 重楼 [21] 51 270.0537 20.820 C15H10O5 269.0460 [M-H]- 225,146 1.86 芦荟大黄素 大黄 [18] 52 868.482 22.136 C45H72O16 891.4746 [M+Na]+ 725,415 3.70 薯蓣皂苷 重楼 [22] 868.482 22.104 913.4809 [M+HCOOH-H]- 0.77 53 854.4668 22.323 C44H70O16 877.4572 [M+Na]+ 196,140 0.43 重楼皂苷I 重楼* [21] 854.4655 22.297 899.4609 [M+HCOOH-H]- −1.07 54 254.0577 22.790 C15H10O4 255.0647 [M+H]+ 196 −1.96 大黄酚 大黄 [18] 55 576.4428 27.329 C35H60O6 599.4282 [M+Na]+ 429,355 6.67 胡萝卜苷 天南星* [23] 576.4374 27.263 621.4349 [M+HCOOH-H]- −2.68 注:*表示在水提液中未检测出的化合物 通过上述分析方法得到55种化合物,其中,精氨酸、奎宁酸、柠檬酸、黄连碱、格兰地新、绿原酸、木犀草素、色氨酸共8个化合物来自黄连;脱氧腺苷、薯蓣皂苷、重楼皂苷G、polyphylloside III、重楼皂苷II、纤细薯蓣皂苷、重楼皂苷H、重楼皂苷VI、重楼皂苷I共9个化合物来自重楼;异亮氨酸、苯丙氨酸、夏佛托苷、秋水仙碱、胡萝卜苷共5个化合物来自天南星;精氨酸、脱氧腺苷、异亮氨酸、苯丙氨酸、色氨酸、鼠李糖甘草苷、异佛莱心苷、芹糖异甘草苷、异甘草苷、甘草皂苷G2、甘草酸共10个化合物来自法半夏;没食子酸-3-O-β-D-葡萄糖苷、没食子酸、对香豆酸-O-葡萄糖苷、儿茶素-O-葡萄糖苷/表儿茶素-O-葡萄糖苷、原花青素B2、儿茶素、阿魏酸、4-( 4'-羟基苯基) -2-丁酮-O-阿魏酰-没食子酰-葡萄糖苷、没食子酸-O-没食子酰基葡萄糖苷、对香豆酸、大黄素甲醚、2-甲基-5-羧甲基-7-羟基色原酮、表儿茶素没食子酸酯、大黄酸-8-O-葡萄糖苷、异莲花掌苷、2-O-桂皮-β-D-葡萄糖苷、2-(2'-羟丙基)-5-甲基-7-羟基色原酮、番泻苷B、桂皮酸-O-没食子酰-葡萄糖苷、6-甲氧基酸模素-8-O-β-D-葡萄糖苷、芦荟大黄素-3-羟甲基-O-葡萄糖苷、大黄酚-8-O-葡萄糖苷、大黄素甲醚-8-O-D葡萄糖苷、决明柯酮-O-乙酰基葡萄糖苷、大黄酸、芦荟大黄素、大黄酚共27个化合物来自生大黄或制大黄,具体参见表1。其中,部分化合物例如精氨酸、脱氧腺苷、异亮氨酸、苯丙氨酸、色氨酸是根茎类化合物的共有化学成分,在黄连、重楼及半夏中均可以检测到,因此,根据化合物的文献检索进行了相应的归属。
-
中药方剂在中医临床实践中形成了以汤剂为主的口服给药方式,药材煎煮制备获得复方时是否会导致化学成分的改变,消痰通腑方免煎剂是否也需要对上述化合物进行检测来确定方剂的质量均未知。再有,中药方剂具有多成分、多靶点、多途径、整合调节的作用特点,因此,有必要对消痰通腑方所含所有药材的化学成分群进行分析,初步确定其化学成分特征,为后期研究和临床应用提供数据参考。
为了实现化合物的高效、快速提取,首先考察了不同的超声提取溶剂(水、70%及100%甲醇溶液)、提取时间(30、45 和60 min)、样品与溶剂的比例(1:5、1:10和1:20),结果表明,以10倍溶剂即50 ml的75%甲醇溶液超声提取30 min为最佳样品制备方法。为了获得分离效果好、总离子流强的色谱图,选择了甲醇-水、乙腈-水、甲醇-水(含0.1%甲酸)和乙腈-水(含0.1%甲酸)流动相体系进行分析。结果表明,乙腈-0.1%甲酸水溶液组成的流动相在正、负离子扫描模式下均表现出良好的分离效果和丰富的信号响应。除此以外,本研究还考察了不同流速(0.3、0.4 和0.5 ml/min)和不同柱温(25、30 和35 ℃)对于分析效果的影响。结果显示,当柱温在30 °C,流速为0.3 ml/min时,色谱峰峰形尖锐、色谱图基线稳定,柱压平稳。
本研究采用的分析方法具有快捷、简便、易行,样品用量小和高通量等特点,且样品前处理简单,所建立的方法可用于快速鉴别消痰通腑方免煎剂的化学成分。所鉴定的化合物中包括多数具有抗炎抗肿瘤等活性的化合物。例如,已有文献表明,重楼皂苷类成分如重楼皂苷I可以通过诱导肿瘤细胞凋亡、抑制肿瘤细胞增殖和转移等发挥抗肿瘤作用[24-25];天南星中的夏佛托苷可以通过诱导自噬激活发挥抗肿瘤细胞增殖作用[26];黄连碱作为黄连中的主要成分之一,具有抗真菌、胃黏膜保护、细胞毒等一些药理活性[27];含大黄的方剂具有辅助放、化疗增敏减毒的功效,所含化合物大黄酸、大黄素甲醚在抗炎、抗肿瘤等方面都具有显著效果[28]。
综上,本研究基于UHPLC-Q-TOF/MS技术开展消痰通腑方免煎剂中的化学成分分析,丰富了全方的物质基础研究,为进一步明确其质量控制标志物和药效物质研究提供了科学依据。
Rapid analysis of chemical components of Xiaotan Tongfu formula based on UHPLC-Q-TOF/MS
-
摘要:
目的 探明消痰通腑方的主要化学成分,为方剂药效物质基础研究和临床治疗提供科学依据。 方法 采用超高效液相色谱四极杆飞行时间质谱法(UHPLC-Q-TOF/MS)对消痰通腑方化学成分进行鉴定,色谱条件为Waters ACQUITY UPLC BEH C18色谱柱(2.1mm×100 mm,1.7 μm),以 0.1%甲酸水溶液-乙腈为流动相进行梯度洗脱,柱温30 °C,流速0.3 ml/min,进样量1 μl,检测波长254 nm;质谱条件为电喷雾离子源(ESI),正、负离子全扫描模式采集质谱数据,根据对照品、自建质谱数据库和在线获得的化合物质谱数据库对色谱峰进行物质鉴定。 结果 初步鉴定出55个化合物,分别来自黄连、重楼、大黄、天南星、法半夏。 结论 本文所建立的UHPLC-Q-TOF/MS方法能系统、准确地鉴别消痰通腑方的化学成分,可为该方剂的质量标志物筛选和有效成分研究提供参考。 -
关键词:
- 超高效液相色谱串联四极杆飞行时间质谱 /
- 化学成分 /
- 消痰通腑方
Abstract:Objective To rapidly explore the chemical components of Xiaotan Tongfu formula, and to provide scientific basis for the basic research and clinical treatment of the formula. Methods Analysis was performed on an Agilent 1290 ultra-performance liquid chromatography system coupled with an Agilent 6530 accurate quality Q-TOF/MS system, by using a Waters ACQUITY UPLC BEH C18 column (2.1 mm × 100 mm, 1.7 μm), with a gradient elution applying 0.1% aqueous formic acid solution and acetonitrile as a mobile phase. The flow rate was 0.3 ml/min. The column temperature was 30°C. The injection volume was 1 μl, and the detection wavelength was 254 nm. Mass spectrometry (MS) data were collected in both positive and negative ESI ion modes. Components in the formula were identified by using the in-house compound database, and comparing the retention time (tR), MS1 and MS2 data with the standard compounds, and the online compound MS database. Results A total of 55 compounds were identified from Coptis coptidis, Pseudomonas solani, Rhubarb, Araceae artemisiae and Pinellia chinensis. Conclusion The established UHPLC-Q-TOF/MS method could systematically and accurately identify the chemical components from Xiaotan Tongfu formula, and provided a reference for the quality marker selection and the research on the active ingredient. -
Key words:
- UHPLC-Q-TOF/MS /
- chemical components /
- Xiaotan Tongfu formula
-
嘧啶类化疗药物在肿瘤治疗中的地位越来越重要,其代表药物5-氟尿嘧啶及其口服前药卡培他滨更受到了广泛关注,体内二氢尿嘧啶脱氢酶(DPD)是此类药物代谢的限速酶之一[1],前瞻性评价DPD的总体活性有利于提高药物疗效及减少患者的毒副反应,对临床具有重要意义。内源性物质尿嘧啶(U)是体内DPD的天然底物,在此酶的催化下生成二氢尿嘧啶(UH2),并最终通过尿液排出体外。测定血浆中U和UH2的含量,并通过(UH2)/(U)比值计算,可从代谢物的角度评价DPD的活性[2]。临床上常用评价DPD酶活性的方法是测定患者的基因表型,DPD的编码基因DPYD序列中包含了多达7 600个多态位点,使得DPD酶的活性在人群中是高度可变的[3]。不同的突变位点及不同位点的组合给临床检测带来了极大的困难。到目前为止,也只有DPYD*2A的多态性被用于临床实践,用来筛选出5-氟尿嘧啶代谢严重不良的患者,避免严重的毒副反应[4]。单一应用基因的多态性来评价DPD酶的活性在临床上存在一定的困难,基因的多态性并不能直接同下游的酶的活性联系起来,两者并没有完全对等的关系。基因需通过转录、翻译和蛋白的修饰之后才能发挥作用。基因多态联合下游代谢物的含量测定更能准确的评价DPD酶的活性[5]。目前常应用液相色谱-串联质谱联用法对人血浆或干燥唾液中U和UH2浓度进行检测[6-11],但所报道的方法均有一些复杂或难以重现。本研究成功的建立了一种灵敏、高效、准确、重现性好,且能同时测定人血浆中U和UH2浓度的UHPLC-MS/MS方法,为体内DPD总体活性提供更客观有效的评价途径。
1. 材料与方法
1.1 仪器与耗材
1290-6460A超高效液相色谱-串联质谱仪,包含G4220A二元泵、G4226A自动进样器、G1316C柱温箱、MassHunter数据处理工作站(美国Agilent);调速涡旋混合器(美国Labnet);SK7200H超声仪(上海科导超声仪器有限公司);BSA124S-CW分析天平(德国赛多利斯);5810R型低温高速离心机、移液器(德国Eppendorf公司)。
1.2 药品与试剂
尿嘧啶、二氢尿嘧啶和氯尿嘧啶(内标)对照品(纯度>99%,大连美仑生物有限公司);乙酸铵(美国赛默飞世尔科技);甲醇、乙腈、乙酸乙酯、异丙醇(色谱纯,德国默克公司);屈臣氏蒸馏水(广州屈臣氏食品饮料有限公司);牛血清白蛋白(BSA)(上海博光生物科技有限公司);生理盐水(长征医院药学部自制)。
1.3 色谱分离条件
色谱柱为Agilent poroshell 120 SB-Aq-柱(2.1 mm×100 mm,2.7 μm),流动相为5 mmol/L乙酸铵水溶液(A)和乙腈(B),流速为0.3 ml/min,梯度洗脱:0~0.3 min,100% A;0.3~1.0 min,100%~10% A;1.0~2.5 min,10% A;柱温为30 ℃,洗脱时间2.5 min,进样量5 μl。
1.4 质谱分离条件
采用ESI离子源,多重反应监测(MRM)进行一/二级质谱分析,用于定量分析的检测离子为:U[M+H]+ m/z 113.0→40.1,检测模式为正离子模式;UH2[M+H]+ m/z 115.0→55.1,检测模式为正离子模式;氯尿嘧啶(IS)[M-H]- m/z 145.0→42.1,检测模式为负离子模式。雾化温度为300 ℃,雾化气压力为40 psi,干燥气流速为10 L/min,鞘气温度300 ℃,鞘气流速12 L/min,解离电压为4 000 V。
1.5 样本采集
选取8名血浆样品指标正常的成年人,于当日清晨8时空腹状态下静脉采血3 ml, EDTA-3K管抗凝,离心后分离上层血浆, 于−80 ℃冰箱冻存。
1.6 样本预处理
取100 μl样本,加10 μg/ml氯尿嘧啶(IS)10 μl,加乙酸乙酯3 ml,涡旋5 min,1710×g离心10 min,取上层有机相2.7 ml,45 ℃氮气挥干仪挥干,用10%甲醇溶液100 μl复溶,涡旋1 min,取上清液进样分析。
1.7 标准溶液配制
用含有3 %牛血清白蛋白作为空白基质代替血浆配置标准曲线样品。取100 μg/ml的尿嘧啶和二氢尿嘧啶各100 μl,加800 μl水,制成10 μg/ml标准混合液,置于−20 ℃备用。取10 μg/ml标准混合液适量,用3 %牛血清白蛋白稀释制成10、20、50、100、200、500、1000、1500 ng/ml系列浓度样品, 然后按照上述“1.6”项下样品的处理方法配制。
2. 结果
2.1 专属性考察
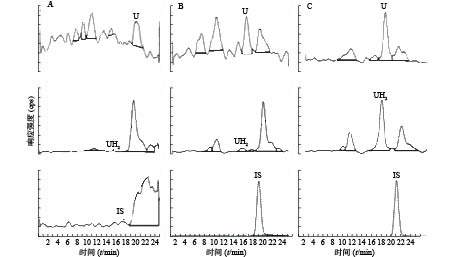
U和UH2的出峰时间以及峰型良好,代替血浆经过前处理后,对待测组分的测定没有干扰,内标对分析物的测定也没有干扰,且能很好分离,结果见图1。
2.2 标准曲线和线性范围
U和UH2的线性范围是10.0~1 500.0 ng/ml,以空白BAS中U和UH2的浓度为横坐标(X),U和UH2与内标化合物氯尿嘧啶的峰面积比为纵坐标(Y),进行最小二乘法加权(权重系数为1/χ2),U和UH2的线性回归方程分别是Y=0.27X+0.0022、Y=0.58X+0.0380,r均>0.990,表明线性关系良好。
2.3 精密度和准确度
取定量下限、低、中、高标准添加血浆样本按照前处理方法进行处理,每个浓度样品平行制备5份进行分析,连续3 d重复操作,根据当天的标准曲线计算当天实测样本浓度,计算样本在低、中和高浓度下的日内、日间精密度和准确度,结果显示,精密度和准确度的偏差均在15%左右。准确度相对偏差在20%范围内时,最低定量下限精密度偏差不大于20%,结果见表1。
表 1 尿嘧啶和二氢尿嘧啶的精密度 (n=5)分析物 标示浓度 (ng/ml) 日内 日间 测定浓度 (ng/ml) 精密度(CV%) 准确性(RE%) 测定浓度 (ng/ml) 精密度(CV%) 准确性(RE%) 尿嘧啶 10 10.2±0.38 3.74 2.58 10.12±0.78 7.70 1.18 20 20.63±1.21 5.87 3.15 19.97±1.35 6.74 −0.16 500 529.73±4.64 0.88 5.95 484.32±35.72 7.37 −3.12 1000 1093.33±25.10 2.30 9.33 1098.25±25.16 2.29 9.82 二氢尿嘧啶 10 10.32±0.71 6.86 3.18 10.28±0.65 6.37 2.77 20 19.98±2.19 10.95 −0.12 19.86±1.85 9.31 −0.72 500 517.51±10.69 2.07 3.50 515.66±10.36 2.01 3.13 1000 1079.83±17.91 1.66 7.98 1080.11±24.50 2.27 8.01 2.4 基质效应和提取回收率
取低、高2个浓度的样本进行基质效应和提取回收率考察,结果显示,U、UH2及内标氯尿嘧啶的基质效应和提取回收率良好,结果均较稳定,结果见表2。
表 2 尿嘧啶和二氢尿嘧啶的基质效应和提取回收率分析物 标识浓度(ng/ml) 基质效应 提取回收率 平均基质效应 CV(%) 平均回收率 CV(%) 尿嘧啶 1000 101.00 6.15 94.98 9.01 20 99.99 3.63 100.01 7.64 二氢尿嘧啶 1000 85.72 2.07 106.47 1.58 20 93.58 4.53 99.54 9.77 2.5 样品稳定性
考察低、高2个浓度的血浆样品经历3次冷冻与解冻循环的稳定性、血浆样品在室温(25 ºC)放置6 h后经样品处理后稳定性和血浆样品经样品处理后室温放置24 h的稳定性,结果显示,3次冻融、6 h室温(25 ºC)条件下和24 h放置自动进样器中的稳定性均符合要求,结果见表3。
表 3 样品的稳定性(RE%)分析物 冻融3次 室温放置6 h 置自动进样器24 h 低 高 低 高 低 高 尿嘧啶 100.71 98.34 93.49 106.60 108.20 107.99 二氢尿嘧啶 92.67 92.64 93.61 107.26 106.97 107.15 2.6 样本检测
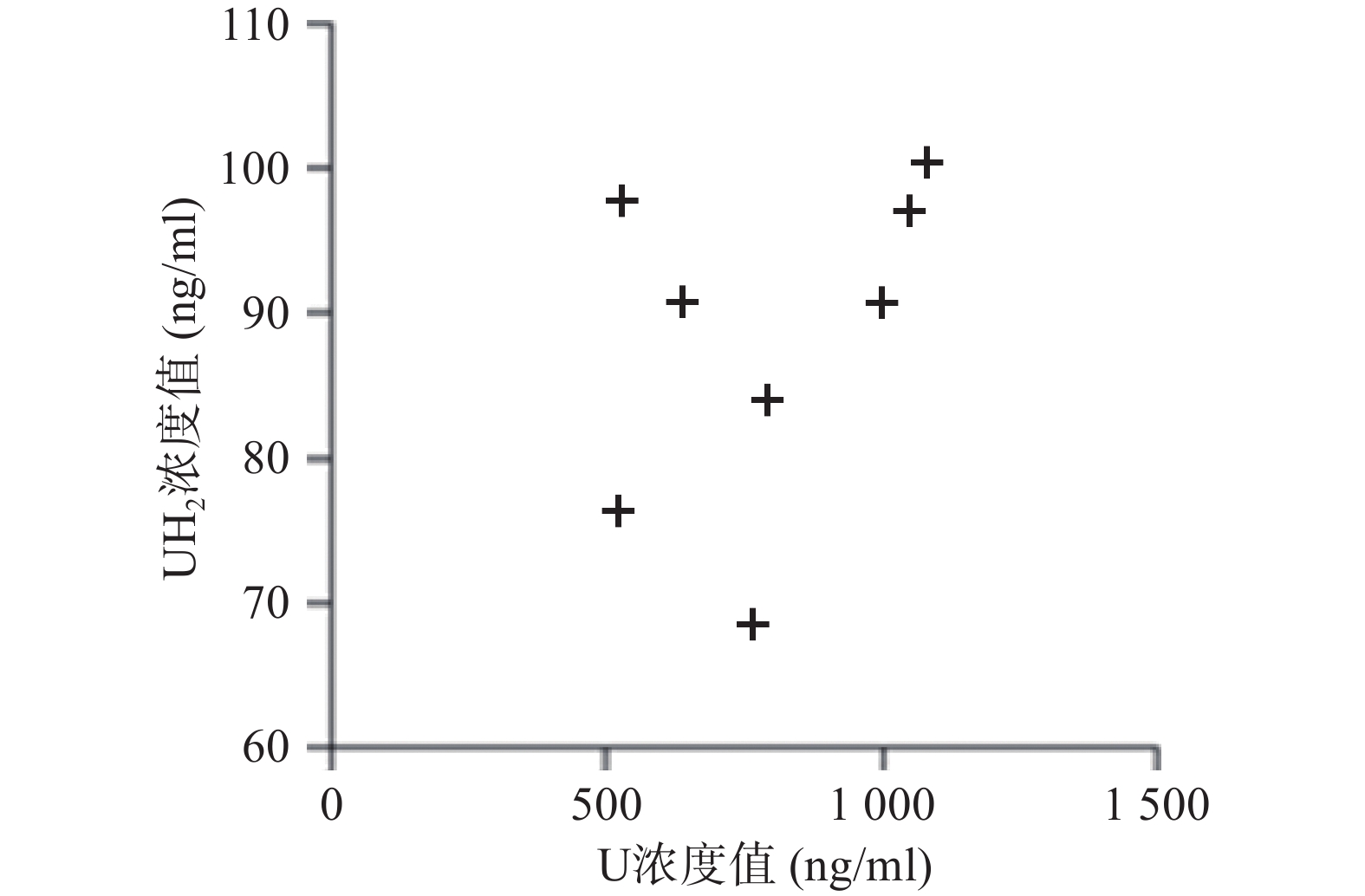
应用本研究所建立的方法,对8名健康成人的血浆样本测定分析,在样本实测过程中, 同时插入已知浓度的随行质控样本(QC样本), 随时监控样本测定的准确度。U和 UH2 浓度测定结果见图2。
3. 讨论
3.1 空白基质的选择
U和UH2是人体内常见的两种物质,且同核酸的代谢密切相关,由于U和UH2均为人体内源性物质,故不能采用人源的基质进行方法学的开发及验证,通过查阅资料,选择了不含U和UH2的3%牛血清蛋白作为基质进行方法学的开发[12]。也有文献报道采用去除U和UH2的人源血浆基质进行方法学实验[9],但基质的来源较珍贵,不适合方法的普及,所以选用3%牛血清蛋白作为替代基质。
3.2 色谱柱的选择
U因其特殊的化学性质,在大部分的色谱柱上均没有保留。U和UH2的LogP值分别为−0.707和−0.840,有较强的亲水性,决定了其不保留的性质。在定量方法的开发过程中,先后采用了Agilent Zorbax SB-C18色谱柱,Agilent Zorbax Eclipse-C18色谱柱,Waters Atlantis T3色谱柱,Waters Xselect色谱柱,Waters Xbridge等色谱柱来进行条件摸索,但上述色谱柱对U和UH2均没有保留。最后,采用Agilent Zorbax SB-Aq对U和UH2进行定量分析,该色谱柱对强极性的化合物有较好的保留效果,同时,兼容100%的起始流动相也对保留产生了良好的结果。
3.3 样本预处理的优化
本研究还分别考察了几种常见的处理方法,包括甲醇和乙腈的蛋白沉淀、Waters Oasis HLB萃取板的固相萃取以及乙酸乙酯,甲基叔丁基醚,二氯甲烷/三氯甲烷,环己烷进行的液液萃取,结果发现乙酸乙酯对U和UH2的萃取效果较好,同时,还分别考察了5%、10%、20%、30%、40%、50%的异丙醇、乙酸乙酯溶液对U和UH2的萃取效果,结果发现,单纯的乙酸乙酯对待测化合物具有较好的提取效率。提取回收率均高于90%,且RSD<10%。另外对3%牛血清蛋白的基质效应进行了考察,结果发现平均基质效应在85%~101%之间,RSD<7%,说明该前处理方法对于基质的清除较为彻底,测定结果稳定,没有明显的基质干扰。
本研究虽重在方法开发,收集的样本数量较少,但从测定的U和UH2浓度分布来看DPD对内源性U的代谢存在个体差异,建议临床应用5-氟尿嘧啶及其卡培他滨筛查DPD总体活性[12-13],后续可进一步扩大样本数量进行深入研究。
4. 结论
本实验建立了一种快速,稳定,高灵敏度的UHPLC-MS/MS方法,可用于测定人体内源性物质U和UH2的含量,从代谢物的角度评价DPD酶的活性,从而协助临床医生制定化疗药物5-氟尿嘧啶及其口服前药卡培他滨合理的用量,以较低的毒副反应获得最大的临床疗效。
-
表 1 消痰通腑方的鉴定分析结果
序号 质量 相对时间(min) 分子式 m/z(MS1) 部分特征离子峰 m/z (MS2) 差异(Δ ppm) 名称 来源药材 来源文献 1 174.1115 0.906 C6H14N4O2 175.1193 [M+H]+ 175,158,116 −1.01 精氨酸 黄连*,制半夏 [8,11] 174.1113 0.906 173.1036 [M-H]- 173,131 −2.40 2 192.0617 0.965 C7H12O6 191.0552 [M-H]- 191,173,111 −4.71 奎宁酸 黄连 [8] 3 251.1022 0.996 C10H13N5O3 252.1093 [M+H]+ 252,194,137 0.79 脱氧腺苷 重楼,制半夏 [11-12] 4 192.0281 1.189 C6H8O7 230.9906 [M+K]+ 1.73 柠檬酸 黄连 [12] 192.0276 1.168 191.0203 [M-H]- 191,111,103 3.14 5 332.0767 1.394 C13H16O10 333.0878 [M+H]+ 4.61 没食子酸-3-O-β-D-葡萄糖苷 大黄* [13] 332.0746 1.395 331.0672 [M-H]- 271,169 0.30 6 170.0216 1.396 C7H6O5 171.0289 [M+H]+ 171,155,153 0.29 没食子酸 大黄* [13] 170.0216 1.520 169.0143 [M-H]- 125,111 0.42 7 131.0945 1.508 C6H13NO2 132.1018 [M+H]+ 132,86 −0.76 异亮氨酸 天南星,制半夏 [11,14] 131.0939 1.475 130.0869 [M-H]- −3.84 8 165.079 2.273 C9H11NO2 166.0864 [M+H]+ 166,120 0.60 苯丙氨酸 天南星,制半夏 [11,14] 165.0792 2.238 164.0723 [M-H]- 3.66 9 354.0946 3.752 C16H18O9 353.0874 [M-H]- 353,191 −1.13 绿原酸 黄连* [8] 10 204.0899 4.31- C11H12N2O2 205.0973 [M+H]+ 159,146 0.10 色氨酸 黄连*,制半夏 [8,11] 204.0897 4.207 203.0819 [M-H]- 142,116 −0.69 11 326.1026 4.812 C15H18O8 325.0919 [M-H]- 325,235,145 2.86 对香豆酸-O-葡萄糖苷 大黄 [13] 12 452.1327 5.06- C21H24O11 475.1211 [M+Na]+ 0.00 儿茶素-O-葡萄糖苷 /表儿茶素-O-葡萄糖苷 大黄 [13] 452.1319 4.993 451.1239 [M-H]- 451,137 −1.55 13 578.143 5.392 C30H26O12 579.1505 [M+H]+ 0.94 原花青素B2 大黄* [13] 578.1417 5.277 577.1345 [M-H]- 577,289 −1.23 14 290.0797 6.073 C15H14O6 291.0867 [M+H]+ 161 1.37 儿茶素 大黄 [13] 290.0794 5.995 289.0721 [M-H]- 245,203,187 1.04 15 194.0586 6.076 C10H10O4 217.0492 [M+Na]+ 177,145 4.68 阿魏酸 大黄 [13] 16 654.1949 6.449 C33H34O14 653.1871 [M-H]- 653,313,169 −0.77 4-( 4'-羟基苯基) -2-丁酮-O-阿魏酰-没食子酰-葡萄糖苷 大黄 [13] 17 484.0858 6.826 C20H20O14 483.078 [M-H]- 313,169 0.00 没食子酸-O-没食子酰基葡萄糖苷 大黄 [15] 18 164.0470 8.434 C9H8O3 163.0397 [M-H]- 163,155 −2.45 对香豆酸 大黄 [13] 19 564.1492 8.589 C26H28O14 565.1559 [M+H]+ 565,505 1.24 夏佛托苷 天南星 [16] 564.1478 8.556 563.1418 [M-H]- 2.13 20 322.1093 8.578 C19H16NO4+ 323.1163 [M+H]+ 265,189 3.40 格兰地新 黄连 [17] 21 284.0687 8.920 C16H12O5 285.076 [M+H]+ 242 1.05 大黄素甲醚 大黄 [18] 22 564.1871 9.192 C27H32O13 587.1756 [M+Na]+ 356,322 3.58 鼠李糖甘草苷 法半夏 [16] 23 234.0533 9.318 C12H10O5 235.0604 [M+H]+ 222,189 1.28 2-甲基-5-羧甲基-7-羟基色原酮 大黄 [13] 234.0531 9.262 233.0458 [M-H]- 1.29 24 578.1641 9.686 C27H30O14 577.1554 [M-H]- 577,146 −1.55 异佛莱心苷 法半夏 [11] 25 442.0921 9.820 C22H18O10 443.0976 [M+H]+ 393,123 4.81 表儿茶素没食子酸酯 大黄 [13] 442.0901 9.820 441.0824 [M-H]- 0.23 26 550.1704 9.845 C26H18O10 549.1614 [M-H]- 283,239 0 芹糖异甘草苷 法半夏 [10] 27 446.0856 9.912 C21H18O11 469.0733 [M+Na]+ 279,248 −1.71 大黄酸-8-O-β-D-葡萄糖苷 大黄 [15] 446.0848 9.845 445.0772 [M-H]- −0.90 28 478.1471 9.978 C23H26O11 479.1551 [M+H]+ 0.63 异莲花掌苷 大黄 [15] 478.1472 9.922 477.14 [M-H]- 313 −0.42 29 310.1058 10.092 C15H18O7 333.0949 [M+Na]+ 1.20 2-O-桂皮-β-D-葡萄糖苷 大黄 [13] 310.1055 10.002 355.1035 [M+HCOOH-H]- 345 0.00 30 234.0897 10.684 C13H14O4 235.097 [M+H]+ 235 2.13 2-(2′-羟丙基)-5-甲基-7-羟基色原酮 大黄 [13] 234.0895 10.631 233.0822 [M-H]- 1.29 31 862.1953 10.833 C42H38O20 861.1888 [M-H]- 699,654 0.46 番泻苷 B 大黄 [13] 32 320.0893 11.572 C19H14NO4 321.0991 [M+H]+ 292,234 −1.90 黄连碱 黄连 [19] 33 399.1665 12.363 C22H25NO6 422.1598 [M+Na]+ 350,336,292 4.69 秋水仙碱 天南星 [20] 34 462.1161 12.313 C22H22O11 461.1088 [M-H]- 461,331,169 −0.22 桂皮酸-O-没食子酰-葡萄糖苷 大黄 [9] 35 418.1257 13.394 C21H22O9 417.1188 [M-H]- 255,213 −0.72 异甘草苷 法半夏 [10] 36 1048.5438 14.102 C51H84O22 1071.5336 [M+Na]+ 869,577 −0.93 重楼皂苷G 重楼 [21] 1048.5457 14.078 1047.5386 [M-H]- 0.48 37 408.1422 14.182 C20H24O9 431.1314 [M+Na]+ 306,292 0.23 6-甲氧基酸模素-8-O-β-D-葡萄糖苷 大黄 [13] 408.1424 14.112 407.1352 [M-H]- 0.98 38 432.1053 14.372 C21H20O10 455.0942 [M+Na]+ 455,292 −1.54 芦荟大黄素-3-羟甲基-O-葡萄糖苷 大黄 [13] 432.1060 14.317 431.0989 [M-H]- 1.16 39 1046.5283 14.384 C51H82O22 1047.5356 [M+H]+ 415,172 −1.43 polyphylloside III 重楼 [20] 1046.5282 14.852 1091.5286 [M+HCOOH-H]- 0.55 40 416.1109 14.554 C21H20O9 439.0999 [M+Na]+ 439,336 −0.23 大黄酚-8-O-β-D-葡萄糖苷 大黄 [13] 416.1104 14.487 415.1032 [M-H]- −0.72 41 286.048 15.273 C15H10O6 287.0552 [M+H]+ 0.74 木犀草素 黄连* [8] 286.0484 15.216 285.0412 [M-H]- 285,215,199 2.20 42 446.1213 15.932 C22H22O10 469.1104 [M+Na]+ 469,283 −0.21 大黄素甲醚-8-O-β-D葡萄糖苷 大黄 [15] 284.0687 15.865 283.0616 [M-H]- 1.41 43 450.1523 17.150 C22H26O10 473.1413 [M+Na]+ 473,230 −1.06 决明柯酮-O-乙酰基葡萄糖苷 大黄 [15] 450.1528 17.097 449.1469 [M-H]- 3.56 44 838.3969 17.208 C42H62O17 837.3886 [M-H]- 661,351 −3.34 甘草皂苷G2 法半夏 [10] 45 822.4012 17.943 C42H62O16 845.392 [M+Na]+ −3.17 甘草酸 法半夏* [10] 822.4031 17.914 821.3959 [M-H]- 351,193 −0.83 46 284.0328 18.384 C15H8O6 283.0257 [M-H]- 239 3.18 大黄酸 大黄 [18] 47 884.4779 19.643 C15H20O3 907.4652 [M+Na]+ 685,292 −1.10 纤细薯蓣皂苷 重楼 [21] 884.4762 19.622 929.4748 [M+HCOOH-H]- −0.43 48 870.4622 19.768 C44H70O17 893.4502 [M+Na]+ 376,251 −0.34 重楼皂苷H 重楼 [21] 870.4607 19.622 915.459 [M+HCOOH-H]- −0.55 49 854.4664 19.773 C44H70O16 877.4557 [M+Na]+ 877,306 −1.31 重楼皂苷II 重楼 [21] 870.4646 19.750 869.4546 [M-H]- 0.69 50 738.4219 19.932 C39H62O13 783.4170 [M+HCOOH-H]- 783,146 −0.26 重楼皂苷VI 重楼 [21] 51 270.0537 20.820 C15H10O5 269.0460 [M-H]- 225,146 1.86 芦荟大黄素 大黄 [18] 52 868.482 22.136 C45H72O16 891.4746 [M+Na]+ 725,415 3.70 薯蓣皂苷 重楼 [22] 868.482 22.104 913.4809 [M+HCOOH-H]- 0.77 53 854.4668 22.323 C44H70O16 877.4572 [M+Na]+ 196,140 0.43 重楼皂苷I 重楼* [21] 854.4655 22.297 899.4609 [M+HCOOH-H]- −1.07 54 254.0577 22.790 C15H10O4 255.0647 [M+H]+ 196 −1.96 大黄酚 大黄 [18] 55 576.4428 27.329 C35H60O6 599.4282 [M+Na]+ 429,355 6.67 胡萝卜苷 天南星* [23] 576.4374 27.263 621.4349 [M+HCOOH-H]- −2.68 注:*表示在水提液中未检测出的化合物 -
[1] 石变. 消痰通腑方对脓毒症患者胃肠功能及炎症反应的影响[D]. 上海: 第二军医大学, 2012. [2] 刘煊, 矫健鹏, 周昱岐, 等. 从痰论治结直肠癌癌前病变探析: 魏品康教授临证经验撷英[J]. 上海中医药大学学报, 2014, 28(6):1-3. [3] 刘煊, 顾雨芳, 孙昱玮, 等. 消痰通腑方对结直肠癌前病变小鼠IL-6、AICD表达的影响[J]. 上海中医药杂志, 2015, 49(4):78-82. [4] 刘煊, 顾雨芳, 修丽娟, 等. 消痰通腑方对结直肠癌前病变模型小鼠结直肠黏膜上皮NF-κB/IL-6/STAT3和AICD蛋白表达水平的影响[J]. 上海中医药杂志, 2016, 50(12):70-75. [5] 石变, 李秋荐, 修丽娟, 等. 消痰通腑颗粒对脓毒症患者胃肠功能障碍的影响研究[J]. 中国中西医结合消化杂志, 2019, 27(1):1-5,10. [6] 张纪红, 吴卫东, 刘建庭, 等. 基于UPLC-Q-TOF/MS技术活血止痛胶囊化学成分的快速分析[J]. 中草药, 2020, 51(12):3139-3146. doi: 10.7501/j.issn.0253-2670.2020.12.004 [7] YANG N, DONG Y Q, WU M F, et al. Establishing a rapid classification and identification method for the major triterpenoids of Alisma orientale[J]. Phytochem Anal,2020,31(3):384-394. doi: 10.1002/pca.2907 [8] 郝艺铭, 霍金海, 王涛, 等. UPLC-Q-TOF/MS技术分析黄连中非生物碱类成分[J]. 中药材, 2020, 43(2):354-358. [9] 王晴, 卢志威, 刘月红, 等. UPLC-Q-TOF/MSE结合诊断离子过滤方法快速分析大黄中酚类成分[J]. 中国中药杂志, 2017, 42(10):1922-1931. [10] 杨彬, 王媛, 田梦, 等. 基于UPLC-Q-TOF-MS/MS研究法半夏中甘草化学成分[J]. 中国实验方剂学杂志, 2017, 23(3):45-49. [11] LEE J Y, PARK N H, LEE W, et al. Comprehensive chemical profiling of Pinellia species tuber and processed Pinellia tuber by gas chromatography-mass spectrometry and liquid chromatogramphy atmospheric pressure chemical ionization-tandem mass spectrometry[J]. J Chromatogr A,2016,1471:164-177. doi: 10.1016/j.chroma.2016.10.033 [12] 周浓, 张杰, 潘兴娇, 等. HPLC法同时测定重楼属药用植物中10种核苷和碱基[J]. 中草药, 2016, 47(16):2927-2932. doi: 10.7501/j.issn.0253-2670.2016.16.026 [13] 曹瑞, 窦志华, 倪丽丽, 等. HPLC指纹图谱、Q-TOF/MS定性及多成分定量相结合的大黄饮片质量评价研究[J]. 中草药, 2019, 50(5):1100-1110. doi: 10.7501/j.issn.0253-2670.2019.05.012 [14] 王星, 池玉梅, 康安. 超高效液相色谱-串联质谱法定性和高效液相色谱法定量分析天南星中氨基酸成分[J]. 色谱, 2014, 32(12):1326-1332. [15] 李丹丹, 张慧, 李思雨, 等. 基于HPLC指纹图谱及UPLC-Q-TOF-MS法的3种不同来源大黄差异成分研究[J]. 中国药房, 2019, 30(23):3240-3245. [16] 王琴霞. 天南星和虎掌南星饮片质量标准及其有机酸部位的研究[D]. 南京: 南京中医药大学, 2014. [17] 陈军辉, 赵恒强, 李文龙, 等. 高效毛细管电泳-电喷雾飞行时间质谱联用分析黄连中的生物碱[J]. 化学学报, 2007, 65(23):2743-2749. doi: 10.3321/j.issn:0567-7351.2007.23.016 [18] 刘月红, 黄政海, 董玲, 等. 高效液相色谱法同时测定大黄中14种成分的含量[J]. 中国中药杂志, 2017, 42(23):4514-4519. [19] ZHAO H, ZHOU S, ZHANG M, et al. An in vitro AChE inhibition assay combined with UF-HPLC-ESI-Q-TOF/MS approach for screening and characterizing of AChE inhibitors from roots of Coptis chinensis Franch[J]. J Pharm Biomed Anal,2016,120:235-240. doi: 10.1016/j.jpba.2015.12.025 [20] 穆丽莎. 天南星抗癌有效部位制备工艺及质量控制研究[D]. 北京: 北京中医药大学, 2014. [21] 王本伟, 张洁瑾, 李悦悦, 等. HPLC-TOF/MS鉴别大鼠给药重楼提取物后尿液中甾体皂苷类成分[J]. 第二军医大学学报, 2013, 34(4):421-424. [22] 王本伟, 赵亮, 张海, 等. 加速溶剂萃取-HPLC-TOF/MS法同时测定重楼中6种甾体皂苷类成分[J]. 第二军医大学学报, 2012, 33(5):549-552. [23] 满薇. 天南星科植物虎掌南星的化学成分及天南星的质量控制研究[D]. 长春: 长春中医药大学, 2012. [24] 朱燕, 谢丽, 杨觅, 等. 重楼抗肿瘤作用机制的研究进展[J]. 癌症进展, 2015, 13(2):164-166. [25] HE J, YU S, GUO C, et al. Polyphyllin I induces autophagy and cell cycle arrest via inhibiting PDK1/Akt/mTOR signal and downregulating cyclin B1 in human gastric carcinoma HGC-27 cells[J]. Biomed Pharmacother,2019,117:109189. doi: 10.1016/j.biopha.2019.109189 [26] KIM P S, SHIN J H, JO D S, et al. Anti-melanogenic activity of schaftoside in Rhizoma Arisaematis by increasing autophagy in B16F1 cells[J]. Biochem Biophys Res Commun,2018,503(1):309-315. doi: 10.1016/j.bbrc.2018.06.021 [27] 张志辉, 邓安珺, 于金倩, 等. 黄连碱药理活性研究进展[J]. 中国中药杂志, 2013, 38(17):2750-2754. [28] 袁向飞, 谢俊木子, 谭晓华. 大黄及其有效成分抗肿瘤的研究进展[J]. 中国中西医结合外科杂志, 2018, 24(3):363-366. doi: 10.3969/j.issn.1007-6948.2018.03.030 -





 下载:
下载:
 下载:
下载: