-
乳腺癌是多发于女性中的恶性肿瘤性疾病,威胁着广大女性的健康[1-2]。据统计,全球女性癌症中,乳腺癌发病率和致死率均高于肺癌,目前居于首位,2020年约230万人诊断出患有乳腺癌,致死病例约68.5万[3]。先天性因素、膳食、环境、工作、发育成长阶段及雌激素类药物等多种因素都能成为乳腺癌的诱发因素[4-5]。目前,乳腺癌早期诊断普遍使用的是影像学检查(临床乳腺体格检查、超声、乳腺X线摄影、磁共振成像等)[6]以及肿瘤标志物(CEA、CA153、VEGF、TSGF等)临床筛查[7],前者操作复杂且具有一定的组织伤害性[8],后者局限于需多项联合检测且特异性不高[7,9],均难以满足临床需求。尽管手术、化疗技术在不断提高,但是抗肿瘤药物疗效有限,乳腺癌患者预后效果不佳,尤其是晚期复发和转移普遍。因此,寻找乳腺癌细胞早期代谢生物标志物,进行安全灵敏的早期诊断,对于乳腺癌诊疗具有重要意义[10]。
作为继基因组学、转录组学、蛋白质组学的后起之秀,代谢组学以研究不同病理生理或基因突变条件下对机体内源性小分子化合物代谢变化为核心[11]。内源性小分子化合物是基因和蛋白质的下游产物,从分子生物层面实时动态地反映上游基因及外部因素对机体功能的影响[12]。代谢组学采用以高灵敏度、高通量为特征的现代仪器分析技术方法,对机体的内源性小分子化合物进行动态分析[13]。伴随乳腺癌发展,患者机体内与氨基酸、糖类、脂质等代谢有关的小分子代谢物会发生异常变化。利用代谢组学方法,将改变的内源性代谢物作为生物标志物,在此基础上寻找相关代谢途径,合理推测乳腺癌的发病机制,揭示生物标志物与乳腺癌发生发展间的关联,最终帮助乳腺癌的临床诊疗。本文主要综述代谢组学在乳腺癌早期诊断、药理研究与药效评估、疾病进程监测以及预后评估的研究进展。
-
代谢组学以相对分子质量<1000的内源性代谢物为研究对象,研究样本包括血浆、尿液、唾液、脑脊液、细胞以及组织提取液等[14-16],其中,血液和尿液最为常见[17],研究思路为收集生物样品、样品分离、检测鉴定、分析数据、建立模型、获取细胞活动终产物信息,整个过程综合分析优势明显。按照研究目的分类,非靶向代谢组学和靶向代谢组学是两种常见策略[18],前者进行轮廓分析,旨在获得较多的生物体内源性代谢物[12],后者通过靶向分析,希望获得特定的内源性代谢物[19]。
代谢组学目前主流的仪器分析方法为核磁共振法(NMR)和质谱(MS)联用技术,后者主要包括液相色谱-质谱联用法(LC-MS)、气相色谱-质谱联用法(GC-MS)[20],以上分析技术各有其特点。NMR可获取大量的物质结构信息,所得样品分析无偏向、无损伤但灵敏度较低[21]。MS通过有损的离子化分析,提供物质分子量及结构信息,灵敏度更高、扫描速度快[22],常与色谱在线联用以实现分离分析功能。GC-MS灵敏度高但不适用于热稳定性差的样品的分析,LC-MS则克服了GC-MS的劣势,可分析难挥发、热不稳定物质,分离选择性好、效率高,分析时间也随超高液相色谱-质谱联用法(UPLC-MS)的推广得到进一步缩短,因此LC-MS实际应用范围更广[19,23]。近年来质谱成像(MSI)技术发展迅速,随之空间代谢组学作为代谢组学新的补充诞生,解决了传统代谢组学研究代谢物在组织中的空间信息缺失问题[24-26]。
代谢组学的数据分析步骤为数据预处理、数据归一化和数据统计,即通过数据的过滤、补齐、归一化等去除仪器或生物偏差后,利用统计方法处理代谢组数据,其中,统计方法是从高维复杂的数据中提取出有效信息的关键。统计方法按照变量的多少分为单变量统计方法和多变量统计方法。常用的单变量统计方法有t检验、非参数检验、方差分析,主要用于实验-对照类研究中寻找两组间的差异代谢物[27]。多变量分析方法有传统算法和机器算法两类,常用的传统算法有偏最小二乘法判别分析(PLS-DA)[28]及正交偏最小二乘法-判别分析(OPLS-DA)、主成分分析(PAC),以上又称为模式识别方法,适用于构建预测模型[29]。机器算法应用日益广泛[30],目前常用的有随机森林(RF)[31]、支持向量机(SVM)[32]、神经网络(ANNs)[33]等。经以上手段获取具有统计学意义的数据,再与多种生化及代谢的数据库对比,继而对所得物质筛选鉴定,最终寻找到潜在的代谢标志物。
-
Catarina等[34]采用核磁共振氢谱(1H-NMR)分析了40位BC患者和38位对照(CTL)健康志愿者尿液代谢谱,采用K-S非参数检验和t检验及OPLS-DA等模式识别方法,发现BC患者肌酸、甘氨酸、丝氨酸、二甲胺、三甲胺N-氧化物、α-羟基异丁酸酯、甘露醇、谷氨酰胺等代谢物表现出高敏感性和特异性,代谢途径分析表明,差异代谢物出现可能与BC患者甘氨酸、谷氨酸、丁酸、糖酵解、TCA循环、牛磺酸和丙酮酸代谢途径遭到破坏有关。获得的差异代谢物具有作为生物标志物的潜力,可将BC患者与CTL区分,应用于早期诊断。
约1/4乳腺癌细胞都是三阴性乳腺癌细胞(TNBC),其特点是易转移浸润且复发率高[16]。Fang等[35]基于早期发现的40种氨基酸目标化合物,使用亲水作用色谱法-串联质谱(HILIC-MS/MS),对TNBC、非TNBC及正常的乳腺上皮细胞36种细胞内和34种细胞外小分子物质进行代谢组学分析。运用Mann–Whitney U检验或Kruskal–Wallis检验及OPLS-DA模式识别方法研究,发现与正常细胞相比,两种乳腺癌细胞氨基酸代谢库均明显扩大;与非TNBC相比,TNBC细胞内谷氨酸、β-丙氨酸、天冬氨酸、谷胱甘肽、N-乙酰丝氨酸和N-乙酰甲硫氨酸代谢明显增加(变化倍数>2,P<0.01, VIP>1),TNBC对细胞外谷氨酰胺、丝氨酸、β-丙氨酸和赖氨酸摄取显著增加,对谷氨酸和L-半胱氨酸-谷胱甘肽排泄升高(P<0.01,VIP>1)。研究结果表明,TNBC细胞具有独特的氨基酸代谢特征,对其量化分析可为TNBC患者提供更多新的早期治疗目标靶点。
Daniele等[36]使用液相色谱-四级杆飞行时间质谱(LC-Q-TOF/MS),对23名BC患者和35名口腔健康妇女唾液进行非靶向代谢组学分析,使用t检验、卡方检验等单因素统计方法,对比METLIN数据库,鉴定出乳腺癌组中有31种化合物上调(P<0.05),其中,患者与健康人群相比,发现7种寡肽(H-Arg-Arg-Ser-OH,H-His-Lys-(Ala-Ser)-OH or (Gly-Thr)-OH,H-Ala-Lys-Phe-Trp-OH or H-Gly-Lys-Thr-Ser-OH or H-Arg-Arg-Ser-Ser-OH,H-Phe-Ile-Gln-Arg-OH,H-Glu-Phe-Gln-Arg-OH or H-Ile-Lys-Gln-Trp-OH,H-Phe-Lys-Lys-Trp-OH or H-Phe-Gln-Arg-Tyr-OH,H-Phe-Phe-Gln-Trp-OH)和6种甘油磷脂(PG14∶2、PA32∶1、PS28∶0、PS40∶6、PI31∶1、PI38∶7)表达上调,表现出明显的代谢差异,说明唾液代谢物有望区分乳腺癌患者和健康人群,适用于早期诊断。
依据不同亚型乳腺癌患者的代谢物差异性可以用于乳腺癌诊断甚至个性化治疗。Leticia等[37]采集了4种常见LA型、LB型、HER2+型和TN型乳腺癌患者和健康对照组的血浆样本,利用非靶向超高液相色谱-高分辨质谱(HPLC-HRMS)代谢组学方法进行分析,通过单变量非参数Wilcoxon秩和检验区分乳腺癌患者和健康受试者的数据差异,多变量PAC和PLS-DA评价统计模型质量,初步确定了4种乳腺癌分子亚型中变化显著的代谢物:LA,TN和HER2分子亚型患者血浆中L-色氨酸浓度显著降低,可能与L-色氨酸代谢激活芳烃受体帮助癌细胞免疫逃逸有关[38];4种亚型乳腺癌患者磷酸乙醇胺、磷脂血浆浓度降低,提示乳腺癌中脂质代谢差异具有重要意义。上述代谢组学数据表明,色氨酸和部分脂质具有作为乳腺癌诊断的生物标志物潜力,有望推动乳腺癌患者血浆诊断和个性化治疗的发展。
基于以上研究,笔者对代谢组学在乳腺癌早期诊断中发现部分特征代谢物的应用进行归纳总结,见表1。
表 1 代谢组学在乳腺癌早期诊断中发现的特征代谢物
作者 样本来源 技术方法 统计学方法 特征代谢物 Catarina等 尿液 1H-NMR K-S非参数检验和t检验与PAC,PLS-DA和OPLS-DA 肌酸、甘氨酸、丝氨酸、二甲胺、三甲胺N-氧化物、
α-羟基异丁酸酯、甘露醇、谷氨酰胺等Fang等 TNBC、非TNBC及正常的乳腺上皮细胞 HILIC-MS/MS Mann-Whitney U检验或Kruskal-Wallis检验与OPLS-DA 胞内:谷氨酸、β-丙氨酸、天冬氨酸、谷胱甘肽、
N-乙酰丝氨酸、N-乙酰甲硫氨酸
胞外:谷氨酰胺、丝氨酸、β-丙氨酸、赖氨酸谷氨酸、
L-半胱氨酸-谷胱甘肽Daniele等 唾液 UPLC-Q-TOF-MS t检验、卡方检验等 7种寡肽和6种甘油磷脂 Leticia等 血浆 HPLC-HRMS 非参数Wilcoxon秩和检验、PAC、PLS-DA 色氨酸、磷酸乙醇胺、磷脂 综上所述,基于代谢组学,针对不同乳腺癌患者所能提供的研究样品,采用合适的仪器、数据分析方法获取差异显著的内源性小分子代谢物信息,有效减小检查手段对乳腺癌患者造成的机体损伤,并丰富乳腺癌早期诊断方法,使代谢组学成为乳腺癌早期诊断的有力辅助工具。
-
癌细胞无限增殖需要大量的能量和物质基础。癌细胞具有特殊的代谢方式,即在有氧条件下倾向于糖酵解而不是三羧酸循环来产生能量[39],这种新陈代谢重编程称为Warburg效应[40]。一方面,糖酵解中间产物可以合成肿瘤细胞生长所需蛋白质和脂质等生物大分子[41],同时线粒体损伤可限制丙酮酸进入,使更多丙酮酸在胞质内通过无氧氧化释放能量[42]。另一方面,癌细胞可持续摄取营养物质[43]以及通过加强糖异生途径弥补Warburg效应缺陷。基于癌细胞特殊的代谢重编程,通过药物代谢组学分析,监测机体用药后内源小分子代谢物变化有利于乳腺癌药理研究和药效评估。
Ghanem等[44]对经抗坏血酸处理的管腔和基底样乳腺癌细胞,进行了代谢组学分析,结合细胞存活率数据,发现高剂量抗坏血酸使得乳腺癌细胞糖酵解过程中磷酸丙糖途径(PPP)被严重破坏,ATP水平下降,代谢物重新定向积累为脂质小滴,以及磷酸戊糖途径中代谢物和酶活性增加;细胞死亡依赖于抗坏血酸诱导的氧化应激和ROS积累、DNA损伤以及细胞内辅助因子(包括NAD+/NADH)耗竭效应。综上表明,高剂量抗坏血酸通过诱发乳腺癌细胞“氧化还原危机和能量灾难”发挥细胞毒作用。
Arminan等[45]通过NMR技术检测及主成分分析方法分析处理数据,以评估在N-(2-羟丙基)甲基丙烯酰胺-阿霉素共聚物(HPMA-Dox)影响下体外细胞培养模型和体内原位乳腺癌模型的精准抗癌效果,并结合蛋白质表达和流式细胞技术,研究了给药前后原位乳腺癌患者内源性小分子化合物相关生化改变,发现与游离Dox给药相比,用HPMA-Dox进行治疗后,乳腺癌细胞凋亡增加,糖酵解减弱,磷脂水平降低,且HPMA-Dox在体内模型的血液循环时间增加,同时肿瘤储积高、心脏储积低,说明HPMA-Dox药代动力学加强、组织分布得以优化。提示HPMA-Dox可作为一种更精确的抗癌药物模式用于乳腺癌临床治疗。
Panis等[14]将120名单侧乳腺浸润性癌患者随机分为未经化疗组(CA组,n=50)、单剂量短期紫杉醇静脉滴注组(PTX组,n=30)、心脏剖面健康组(CTR组,n=40),采用LC-MS对其血浆样品进行分析后发现,与CA组乳腺癌患者相比,单剂量短期紫杉醇静脉滴注可使患者血浆高密度脂蛋白水平显著降低,过氧化氢水平升高;与CTR组相比,PTX组患者C反应蛋白和肌酸激酶分数明显升高。以上表明单剂量短期紫杉醇静脉滴注就足以引起脂质代谢显著改变,可能导致毒性累积效应,进一步增加乳腺癌患者心脏病发生风险。可见,代谢组学可参与化疗药物给药优化方案研究,提高药物抗癌效果。
左旋肉碱、酰基肉碱和相关酶是癌症代谢网络中的重要介质。以往研究中LC-MS对乳腺癌中左旋肉碱、酰基肉碱的研究都是均质组织分析,缺乏异质性癌症组织中肉碱的空间分布差异[46]。Sun等[47]利用MSI对异种移植小鼠模型和人类癌组织样本及正常组织中的17种肉碱进行成像并开发了高空间分辨率基质辅助激光解吸电离-质谱成像(MALDI-MSI)方法,发现由170个癌症样本和128个正常样本组成的肉碱谱模型能准确区分乳腺癌,L-肉碱和短链酰基肉碱在人类乳腺癌和异种移植小鼠模型中都有显著改变,乳腺癌中由肉碱系统介导的β氧化代谢途径改变,并且首次发现代谢酶CPT2和CRAT在乳腺癌组织中差异表达。证明肉碱代谢在乳腺癌的代谢物和酶水平上都被重新编程。
-
心理神经病症(PN)是指许多乳腺癌患者在化疗期间及化疗之后出现疼痛、疲劳和抑郁症状。Debra等[48]使用液相色谱高分辨率质谱法对19位早期乳腺癌女性化疗前后血清样本分别进行非靶向和靶向代谢组学分析,非靶向分析发现化疗后乳腺癌患者乙酰-L-丙氨酸和硫酸吲哚酚浓度升高,5-氧代-L-脯氨酸浓度降低;色氨酸途径靶向分析表明尿氨酸水平、犬尿氨酸/色氨酸水平升高。t检验和Pearson相关系数进一步揭示上述差异代谢物与PN症状显著相关,促进了早期乳腺癌女性PN症状发展程度生物学机制研究。
研究表明,患者他莫昔芬体内代谢物因多昔芬浓度与雌激素受体α(ERα)阳性乳腺癌复发有关[49],同时他莫昔芬本身和其他代谢物也表现出抗雌激素抗肿瘤活性[50]。Vries等[50]用细胞增殖法测定他莫昔芬、(Z)-因多昔芬、(Z)-4-羟基他莫昔芬、N-去甲基他莫昔芬抗刺激素活性,建立抗雌激素活性评分模型(AAS),采用Cox回归方法研究AAS与复发的关系,证明因多昔芬浓度可作为他莫昔芬和代谢物抗雌激素作用的代替,与乳腺癌复发显著相关。
Kamil等[51]用LC-MS/MS对小鼠原位接种4T1转移性乳腺癌细胞进行血浆代谢组学分析和脂质组学分析,建立PLS-DA模型。结果显示,荷癌小鼠癌细胞早期转移表现为L-精氨酸代谢减弱,精氨酸酶和多胺合成增强;晚期转移表现为精氨酸代谢途径改变,不对称二甲基精氨酸血浆浓度升高,能量代谢重新编程为糖酵解,戊糖磷酸途径加速以及三羧酸循环速率降低,脂质分布模式改变,包括总磷脂酰胆碱减少,与二酯结合的磷脂分数减少以及溶血磷脂增加,以上代谢变化在一定程度上表征了癌症转移进展。
目前,OncotypeDX 21基因表达检测技术常用来评估乳腺癌的复发以指导乳腺癌治疗,但在临床的不确定性和基因组不一致的情况下,许多早期乳腺癌的患者仍然会受到过度治疗[52-54]。McCartney等[55]利用1H-NMR分析了87例内分泌受体阳性、HER2阴性早期乳腺癌(eBC)患者血清,使用RF建立eBC患者复发风险的统计模型。最终根据代谢组学特征进一步细分复发风险,并有效区分了每个Oncotype风险分类:在7例复发中代谢组学分析准确预测了其中的6例,1例复发发生在低风险组,3例发生在中风险组,3例发生在高风险组,成功建立了一种通过血清代谢组学分析进一步完善OncotypeDX基因检测风险评分的方法。
-
乳腺癌在全球发病率日益上升,长期困扰广大女性健康,成为全球医疗卫生领域研究焦点[56]。目前,乳腺癌的早期诊断、药物开发应用以及预后测评等方面还需攻克众多难关,迫切需要新的研究技术的支持。代谢组学以高通量、高灵敏度为特征的技术在乳腺癌领域应用日趋广泛,为乳腺癌潜在代谢标志物的筛选,药物靶点发现、药物潜在作用机制等提供新思路[11]。与其他研究方法相比,代谢组学具有无创取样、研究对象相对简单、检测工作量较小、可实现实时监测、全面综合分析等明显优势。同时,代谢组学作为一门新兴组学,虽然已取得部分进展,但本身发展仍处于探索阶段,应用于临床实践还有所不足:代谢组学研究具有数据维度高的特点,采集与处理过程中可能存在信息丢失、低含量差异代谢物可能被掩盖的问题;数据库不够完善,目前大量未知代谢物的结构鉴定和细胞功能研究困难,对已鉴定出产物的变化机制研究大多仍不明确难以直接指导临床;联用技术操作和数据分析处理的综合性专业人才储备不足等。在精准医疗浪潮推动下,进一步完善代谢组学研究的标准化流程后,利用代谢组学与基因组学、转录组学、蛋白组学以及微生物菌群学[57]对乳腺癌进行多学科技术互补、大数据综合分析,将有利于乳腺癌的早期诊断、发病机制研究以及疾病预后相关诊疗方案的系统优化,为乳腺癌个性化靶向治疗提供更合理的科学指导。
Application of metabonomics in breast cancer
-
摘要: 乳腺癌(BC)是发病率较高的恶性肿瘤性疾病,发现时常处于晚期、预后较差,由于缺乏准确的生物标志物,乳腺癌的早期诊断及治疗仍不理想。代谢组学(metabolomics)是一门采用高通量分析技术来研究机体在不同病理生理刺激或基因突变影响下内源性代谢物动态变化规律的新学科,为乳腺癌生物标志物的筛选、疾病诊疗提供了新途径。主要概述代谢组学并介绍其在乳腺癌早期诊断、药效评价、疾病预后中应用的研究进展。Abstract: Breast cancer is a kind of malignant tumor discovered lately, with a high incidence and a poor prognosis. The shortage of relevant biological biomarkers lead to the unsatisfactory treatment efficacy and the early diagnosis in breast cancer. Metabolomics is a new discipline that uses high-throughput analysis techniques to study the dynamic changes of endogenous metabolites under the influence of different pathological physiological stimulation or gene mutations, which has provided a novel way for biomarker screening and disease diagnosis and treatment. The overview of metabolomics and its applications in breast cancer early diagnosis, drug efficacy evaluation, and disease prognosis were summarized in this review.
-
Key words:
- metabolomics /
- breast cancer /
- biological biomarkers /
- early diagnosis /
- drug efficacy evaluation /
- disease prognosis
-
创伤敷料的应用为伤口的修复愈合提供了保障,各种新型敷料层出不穷,液体创可贴即是近年出现的一种新型液体创伤敷料。相较于传统的绷带创可贴,液体创可贴适用于关节活动处等不规则的伤口,形成的透明薄膜具有方便观察伤口情况以及防水效果好等优势[1]。有报道指出,硝化纤维能用于密封小型伤口甚至保护烧烫伤创面[2]。低含氮量硝化纤维广泛用作成膜材料,具有较好的抑菌效果和稳定性。本课题组以含氮量低的硝化纤维为成膜材料研制了一种新型液体创可贴,前期通过细胞毒性实验与小鼠创伤愈合实验发现其具有良好的生物相容性与促进伤口愈合效果[3-4]。对于液体创可贴相关市售产品,目前尚无统一的质量标准对其进行质量评价,导致产品质量参差不齐。因此有必要建立权威可靠的质量标准,以加强此类产品的质量控制。本文对自制液体创可贴的质量品质与安全性进行考察,并对相关市售产品进行质量检查,以期为液体创可贴与同类产品的进一步开发及质量标准的建立提供参考。
1. 材料
1.1 仪器
AL204型电子天平(上海梅特勒-托利多仪器有限公司);HS-3000A型拉力试验机(上海和晟仪器有限公司);Best-S30FV型纯水/超纯水机(上海芷昂仪器有限公司);NDJ-8S型数字式黏度计(上海精密仪器仪表有限公司);数显千分测厚规(浙江德清盛泰芯电子科技有限公司);岛津LC-20AD/T型高效液相色谱仪(日本岛津株式会社)。
1.2 试药
自制液体创可贴(自制,批号:20210106、20201222、20201130);小林液体创可贴(日本小林株式会社,批号:E0002);美愈液体创可贴(太原爱乐医疗器械有限公司,批号20200901);伤口一抹得(天津一抹得医疗用品有限公司,批号:2020111011);3M液体敷料(3346E,美国3M Health Care);苯甲醇对照品(99.9 %,中国食品药品检定研究院,批号:190019-201903);苯扎氯铵对照品(中国食品药品检定研究院,批号:100549-201805);利多卡因对照品(99.8 %,上海远慕生物科技有限公司,批号:YM-BZ0342);乙酸乙酯(上海联试试剂有限公司,批号:160801);乙腈(色谱纯,国药集团化学试剂有限公司,批号:20200507);乙酸铵(西陇化工股份有限公司,批号:140420);三乙胺(上海科丰化学试剂有限公司,批号:20101026);0.9 %氯化钠注射液(福州海王福药有限公司,批号:200816A43); 2,4-二硝基氯代苯(国药集团化学试剂有限公司,批号:201506181)。
1.3 实验动物
家兔,体重2.0~2.5 kg,雄性;白化豚鼠,体重300~350 g,雌雄各半。皆由上海斯莱克实验动物有限公司提供,生产许可证号:SCXK(沪)2017-0005,实验许可证号:SYXK(闽)2018-0005。动物实验前在联勤保障部队第九〇〇医院动物实验中心环境适应7 d。
2. 方法与结果
2.1 自制液体创可贴及所成薄膜的制备
根据前期研究[3]制备自制液体创可贴及其薄膜,苯甲醇、利多卡因与苯扎氯铵的用量分别为4 %、2 %和0.2 %,同时制备不含这3种成分的液体创可贴空白基质。
2.2 质量控制
2.2.1 性状
本品为具有一定黏稠度的无色或微黄色的透明液体敷料,均匀细腻,涂展性良好,具有一定刺激性气味,成膜之后为无色透明薄膜,具有一定的薄荷清新香味。
2.2.2 检查项
(1)成膜时间:将液体创可贴按10 μl/cm2涂于人手臂皮肤上,以不沾手为成膜标准,记录成膜时间[5]。
(2)舒适性:采用拉力试验机测定所制薄膜的抗张强度与断点伸长百分率[6-7],评价液体创可贴薄膜的机械强度,方法如下:将制备的薄膜裁剪成统一规则长条形,保证边缘光滑,垂直地面夹于拉力试验机受力夹两端,调整试验夹使薄膜处于自然拉伸状态,测量此时两端夹子之间的距离记为L0;以5 mm/min的速度,1 000 N的载荷量运行试验机,当薄膜断裂时立即停止试验,并记下此时的拉力F和两端夹子的距离Lmax;重复其他两个样品,按公式T=F/S计算抗张强度,S为薄膜横截面积,按公式PS(%)=Lmax/L0×100%计算断点伸长百分率,计算至少3个样品的平均值。
(3)防水性:液体创可贴薄膜的防水性能通过24 h前后的水损失率评价,采用倒杯法进行,即采用口径为12 mm的西林瓶,加入5 ml蒸馏水,记录蒸馏水重量MW;将薄膜平整覆盖在西林瓶表面,用封口膜沿着瓶口边缘将薄膜与西林瓶密封,倒置,确保水不会沿着瓶口渗出,并避免水和薄膜之间有气泡;记录初始西林瓶和蒸馏水总重量M0;重复制备5个样品;记录24 h后西林瓶和蒸馏水的总重量M24h,按下式计算水损失率:LR=(M0−M24h)/MW×100%,计算至少3个样品的平均值。
(4)透气性:液体创可贴所成薄膜的透气性以单位时间内通过单位薄膜面积的水蒸气质量即水蒸气透过率(MVTR)进行评价[8]。方法如下:10 ml的西林瓶中加入足量的纯化水,使液面距瓶口5 mm左右,将略大于瓶口的圆形薄膜精确地盖在西林瓶口上,用封口膜沿着瓶口边缘将薄膜与西林瓶密封,记录西林瓶、薄膜和蒸馏水的总重W1,然后置于干燥箱中,24 h后再称量西林瓶、薄膜和蒸馏水的总重W2,按MVTR=(W1−W2)/(s×t)计算水蒸气透过率,至少计算3个样品的平均值。
按上述方法测得3批自制液体创可贴的检测结果如表1。
表 1 液体创可贴质量检测结果(n=3)样品批号 成膜时间(t/s) 伸长率(%) 抗张强度(MPa) 水损失率(%) MVTR(mg/cm2·h) 20201130 92.6±2.35 167.2±3.07 7.04±0.65 1.73±0.25 2.78±0.43 20201222 87.4±4.71 172.5±2.14 6.38±1.21 2.02±0.37 2.35±0.19 20210106 101.7±2.02 165.4±4.93 5.99±2.47 1.86±0.08 1.98±0.84 采用类似方法制得各市售产品的薄膜,按上述4个检查项目对相关市售液体创可贴及其所成薄膜进行质量检测,结果如表2。
表 2 市售产品质量检测结果(n=3)产品
名称成膜时间(t/s) 伸长率(%) 抗张强度(MPa) 水损失率(%) MVTR
(mg/cm2·h)3M 125.7±3.05 — — 2.53±0.84 2.38±0.45 一抹得 194.7±5.13 175.45±2.52 2.89±0.10 0.43±0.01 1.79±0.17 美愈 226.7±4.04 246.89±16.15 2.35±1.00 0.47±0.03 0.58±0.18 小林 114.7±7.77 159.43±3.44 6.89±0.39 0.36±0.05 1.94±0.35 注:“—”表示未检测。 由表2可知市售产品的质量相差较大,与成膜材料及处方成分的性质有一定关系。3 M液体敷料为喷雾型用药,以丙烯酸盐共聚物为成膜材料,异辛烷等为溶剂,所成薄膜过于脆弱,无法测定伸长率和抗张强度,可认为其机械强度较差。
2.2.3 鉴别
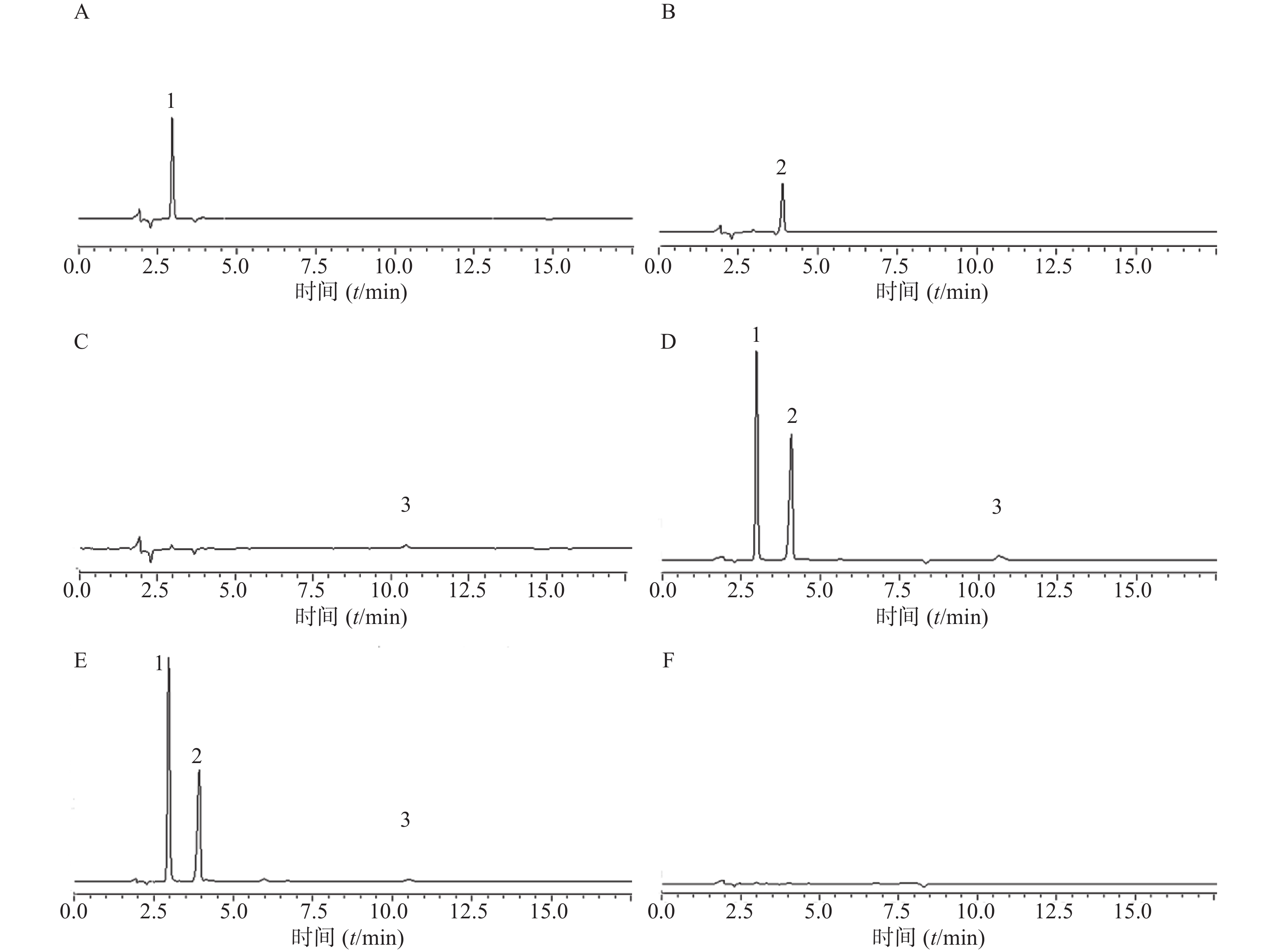
采用HPLC法对自制液体创可贴进行鉴别,即比较供试品溶液与对照品溶液主峰的保留时间。结果如表3,表明液体创可贴的3个主要药效成分的保留时间与其对照品的保留时间一致。
表 3 液体创可贴和对照品的保留时间(t/min)样品 苯甲醇 利多卡因 苯扎氯铵 混合对照品 2.991 4.068 10.678 液体创可贴 2.983 4.080 10.698 2.2.4 含量测定
(1)色谱条件:色谱柱:Welch Ultimate®XB-C18柱(4.6 mm×200 mm,5 μm);流动相:乙腈:5 mmol/L醋酸铵,含1%三乙胺,冰醋酸调节pH至4.8±0.2,体积比为60∶40;检测波长:262 nm;流速:1.0 ml/min;柱温:35℃;进样量:20 μl。
(2)样品溶液的制备:①苯甲醇对照品溶液:精密量取苯甲醇对照品(1 g/ml)10 μl置于25 ml容量瓶中,加乙腈稀释至刻度,摇匀,即得苯甲醇对照品溶液,4℃保存备用。②利多卡因对照品溶液:精密称取利多卡因对照品5 mg置于25 ml容量瓶中,加适量乙腈超声溶解,加乙腈稀释至刻度,摇匀,即得利多卡因对照品溶液,4℃避光保存。③苯扎氯铵对照品溶液:精密量取苯扎氯铵对照品(12.5 mg/ml)50 μl置于25 ml容量瓶中,加乙腈稀释至刻度,摇匀,即得苯扎氯铵对照品溶液,4℃避光保存。④混合对照品溶液:精密量取苯甲醇对照品50 μl、苯扎氯铵对照品400 μl,精密称取利多卡因对照品25 mg置于同一25 ml容量瓶中,加入适量乙腈,超声使利多卡因完全溶解,加乙腈稀释至刻度,振摇混匀,即得混合对照品储备液,4℃保存。精密量取上述储备液1 ml置于10 ml容量瓶,加乙腈稀释至刻度,混匀,即得含苯甲醇200 μg/ml、利多卡因100 μg/ml、苯扎氯铵20 μg/ml的混合对照品溶液。⑤供试品溶液:精密称取自制液体创可贴0.5185 g,置于25 ml容量瓶中,加适量乙腈,超声溶解后加乙腈稀释至刻度,摇匀,经0.22 μm微孔滤膜过滤,即得供试品溶液。⑥阴性对照溶液:精密称取空白基质0.4953 g,置于25 ml容量瓶中,加适量乙腈,超声溶解后加乙腈稀释至刻度,摇匀,经0.22 μm微孔滤膜过滤,即得阴性对照溶液。
(3)专属性试验:取上述对照品溶液、供试品溶液和阴性对照溶液分别按上述色谱条件进样,记录色谱图与相关参数如图1与表4,表明专属性良好。
表 4 系统适应性考察结果成分 保留时间(t/min) 理论塔板数 分离度 对称因子 苯甲醇 2.999 6705 4.670 0.989 利多卡因 4.059 8069 6.482 0.826 苯扎氯铵 10.764 12652 23.794 0.954 (4) 精密度试验:取液体创可贴供试品溶液(批号:20210106)按前述色谱条件连续进样6次,计算各指标成分色谱峰的保留时间与峰面积的相对标准偏差RSD值。苯甲醇、利多卡因与苯扎氯铵保留时间RSD值分别为0.21%、0.38%、0.20%,峰面积RSD值分别为1.39%、2.72%、2.56%,表明仪器精密度良好。
(5)重复性试验:取同一份液体创可贴样品(批号:20210106),同法制备6份供试品溶液,按前述色谱条件进样测定,记录苯甲醇、利多卡因和苯扎氯铵色谱峰的保留时间和峰面积,并计算RSD值。保留时间RSD分别为0.20%、0.14%、0.06% ,峰面积RSD分别为1.52%、1.49%、2.22%,说明方法重复性良好。
(6)稳定性试验:取液体创可贴供试品溶液(批号:20210106)一份,室温放置,分别于0、1、2、4、8、12、24 h取样按前述色谱条件进样测定,计算苯甲醇、利多卡因与苯扎氯铵色谱峰的保留时间与峰面积的RSD值,保留时间RSD分别为0.19%、0.11%、0.43%,峰面积RSD分别为0.62%、0.19%、1.47%,表明供试品溶液在24 h内稳定。
(7)线性关系考察:分别精密量取混合对照品储备液1、2、3、4、5、6 ml置10ml容量瓶中,用乙腈稀释至刻度,配制成苯甲醇浓度为200、400、600、800、1 000、1 200 μg/ml,利多卡因浓度为100、200、300、400、500、600 μg/ml,苯扎氯铵浓度为20、40、60、80、100、120 μg/ml的混合对照品溶液,按前述色谱条件进样测定,以峰面积(Y)对质量浓度(X)进行线性回归,回归方程如表5所示,3种有效成分在一定范围内线性关系良好。
表 5 液体创可贴中3种主药的线性方程成分 回归方程 r 线性范围(μg/ml) 苯甲醇 Y=1325.9X+4755.5 0.999 7 200~1200 利多卡因 Y=2366.9X−11591 0.999 6 100.24~601.44 苯扎氯铵 Y=771.6X+2025.5 0.999 7 20~120 (8)回收率试验:精密称取利多卡因对照品8、10 、12 mg,精密量取苯甲醇对照品16 、20 、24 μl,苯扎氯铵对照品64 、80 、96 μl(相当于标示量的80%、100%、120%),分别置于0.5 g空白基质中,加适量乙腈超声溶解,置于25 ml容量瓶中,加入乙腈至刻度,摇匀,即得低、中、高浓度的溶液,每个浓度平行操作3份,经0.22 μm微孔滤膜过滤后续滤液按前述相同色谱条件进样,记录各目标成分色谱峰面积。根据回归方程计算相应的含量,并计算回收率、平均回收率及RSD值如表6所示,各成分的回收率在95%~105%之间,RSD值均小于2%,表明此方法准确性良好。
表 6 液体创可贴回收率测定结果药物 加入量
(μg/ml)测得量
(μg/ml)回收率
(%)平均回收率
(%)RSD
(%)苯甲醇 640.00 662.13 103.46 103.04 0.35 640.00 658.32 102.86 640.00 657.96 102.81 800.00 817.55 102.19 102.68 0.46 800.00 825.14 103.14 800.00 821.74 102.72 960.00 989.25 103.05 102.89 0.35 960.00 983.76 102.48 960.00 990.18 103.14 利多卡因 320.00 310.25 96.95 96.56 0.40 320.00 307.76 96.18 320.00 308.96 96.55 400.00 387.37 96.84 97.02 0.70 400.00 385.75 96.44 400.00 391.06 97.77 480.00 460.57 95.95 96.63 0.93 480.00 468.73 97.65 480.00 462.18 96.29 苯扎氯铵 32.00 30.76 96.13 96.81 0.80 32.00 31.25 97.66 32.00 30.93 96.66 40.00 38.69 96.73 96.63 1.09 40.00 39.05 97.63 40.00 38.21 95.53 48.00 46.68 97.25 97.11 1.83 48.00 45.73 95.27 48.00 47.43 98.81 (9)含量测定:取不同批次的液体创可贴样品按“(2)”项下方法配制供试品溶液,按前述色谱条件测定,测得3个成分的含量结果如表7。根据《中国药典》2020年版(二部)相关规定,确定本品含苯甲醇、利多卡因和苯甲醇应为标示量的95.0%~105.0%,由表7可知液体创可贴中3种主要成分的含量均符合要求。
表 7 液体创可贴3种主药成分含量测定结果批号 苯甲醇(%) 利多卡因(%) 苯扎氯铵(%) 20201130 99.74±0.23 97.39±0.16 100.57±0.07 20201222 98.92±0.19 97.06±0.35 101.23±0.14 20210106 98.48±0.05 96.59±0.04 96.83±0.12 2.3 安全性研究[9-11]
2.3.1 皮肤刺激性试验
4只健康家兔于试验前24 h在背部脊柱两侧划定呈对称的两块区域,面积均为约3 cm×3 cm。将划定区域的毛发脱净,给药前检查去毛皮肤是否受损伤,剔除受损皮肤。采用自身对照法,一侧为实验组,另一侧为空白组。取自制液体创可贴约0.5 g均匀涂覆于一侧脱毛区域,先用两层纱布和一层玻璃纸覆盖,再用胶布固定;另一侧不涂任何样品作为空白对照,其他操作同实验组。
(1)单次刺激性试验:进行封闭实验,贴敷4 h后除去受试物,用温水清洗给药皮肤表面,在清洗后的1、24、48、72 h在自然光环境下观察皮肤状况。根据表8对皮肤刺激反应评分,以受试动物积分的平均值按表9判断皮肤刺激强度,结果见表10。
表 8 皮肤刺激反应评分表红斑和焦痂 分值 水肿 分值 无 0 无 0 非常轻的红斑,勉强可见 1 非常轻度的水肿,勉强可见 1 明显的红斑 2 轻度水肿(边缘清晰) 2 中度至重度的红斑 3 中度水肿(皮肤隆起约1mm) 3 重度红斑(鲜红色)至轻度焦痂形成(深层损伤) 4 重度水肿(皮肤隆起大于1mm,并超过涂受试物的区域) 4 表 9 皮肤刺激强度平均积分 强度 0.0 ~ 0.5 无刺激性 0.5 ~ 2.0 轻刺激性 2.0 ~ 6.0 中刺激性 6.0 ~ 8.0 强刺激性 表 10 液体创可贴皮肤单次刺激性试验结果时间(t/h) 空白区 受试区 No.1 No.2 No.3 No.4 总积分 平均分 No.1 No.2 No.3 No.4 总积分 平均分 1 0 0 0 0 0 0 0 0 0 0 0 0.00 24 0 0 0 0 0 0 0 0 0 0 0 0.00 48 0 0 0 0 0 0 0 1 0 0 1 0.25 72 0 0 0 0 0 0 0 1 0 0 1 0.25 结果给药区和空白区皮肤均未观察到红斑、充血、水肿等刺激症状,皮肤刺激反应平均分<0.5,表明自制液体创可贴对皮肤无刺激性。
(2)多次刺激性试验:初次给药操作同单次试验,之后每2 d涂抹1次,持续2周。从第2 天开始,每次涂抹前应脱毛,用无刺激性溶剂清除残留受试物1 h后观察皮肤情况,根据表8评分。以平均积分=红斑和水肿积分/(受试动物数×14)计算每天每只兔子平均积分,根据表9判断皮肤刺激强度,结果见表11。
表 11 液体创可贴皮肤多次刺激性试验结果时间(t/d) 空白区 受试区 No.1 No.2 No.3 No.4 总积分 平均分 No.1 No.2 No.3 No.4 总积分 平均分 1 0 0 0 0 0 0.00 0 0 0 0 0 0.00 2 0 0 0 0 0 0.00 0 0 0 0 0 0.00 3 0 0 0 0 0 0.00 0 0 0 0 0 0.00 4 0 0 0 0 0 0.00 0 0 0 0 0 0.00 5 0 0 0 0 0 0.00 0 0 0 0 0 0.00 6 0 0 0 0 0 0.00 0 0 0 0 0 0.00 7 0 0 0 0 0 0.00 0 0 0 0 0 0.00 8 0 0 0 0 0 0.00 0 0 1 0 1 0.25 9 0 0 0 0 0 0.00 0 0 0 0 0 0.00 10 0 0 0 0 0 0.00 0 0 0 0 0 0.00 11 0 0 0 0 0 0.00 0 1 0 0 1 0.25 12 0 0 0 0 0 0.00 0 0 0 1 1 0.25 13 0 0 0 0 0 0.00 0 0 0 0 0 0.00 14 0 0 0 0 0 0.00 0 0 0 1 1 0.25 结果显示空白区皮肤未出现刺激症状,偶有一只家兔受试区在第8、11、12、14 天出现很轻的红斑或水肿,平均积分值<0.5,表明自制液体创可贴多次用药对皮肤无明显刺激性。
2.3.2 皮肤变态反应试验
选用50只健康成年豚鼠进行试验,随机分为3组,其中实验组与阳性对照组各20只,阴性对照组10只。试验前24 h在豚鼠背部左侧约5 cm2区域内脱毛,在试验过程中切忌损伤表皮。
试验分为诱导接触与激发接触,根据文献[10-11]方法依次进行。激发接触24和48 h之后观察皮肤变化,按表8评分,当实验动物出现皮肤反应积分≥2时,判定该动物发生皮肤变态反应,根据表12确定受试物的致敏强度。
表 12 致敏强度分级致敏率(%) 分级 过敏反应强度 0~8 Ⅰ 弱致敏 9~28 Ⅱ 轻度致敏 29~64 Ⅲ 中度致敏 65~80 Ⅳ 强致敏 81~100 Ⅴ 极强致敏 实验组给药为自制液体创可贴;阳性对照为2,4-二硝基氯代苯;阴性对照在诱导接触时进行与实验相同的处理但不涂任何样品,激发接触时给予自制液体创可贴。
结果观察到实验组与阴性对照组豚鼠皮肤均未见红斑、水肿等过敏症状,而阳性对照组激发接触后24 h均出现明显过敏症状,如表13所示,自制液体创可贴致敏率为0,无皮肤变态反应发生。
表 13 液体创可贴对豚鼠皮肤变态反应结果组别 动物数
(n)观察时间
(t/h)皮肤反应
强度评分阳性
动物数致敏率
(%)0 1 2 3 4 实验组 20 24 20 0 0 0 0 0 0 48 20 0 0 0 0 0 0 阳性对照组 20 24 4 2 12 2 0 14 70 48 2 3 14 1 0 15 75 阴性对照组 10 24 10 0 0 0 0 0 0 48 10 0 0 0 0 0 0 2.3.3 组织病理学考察
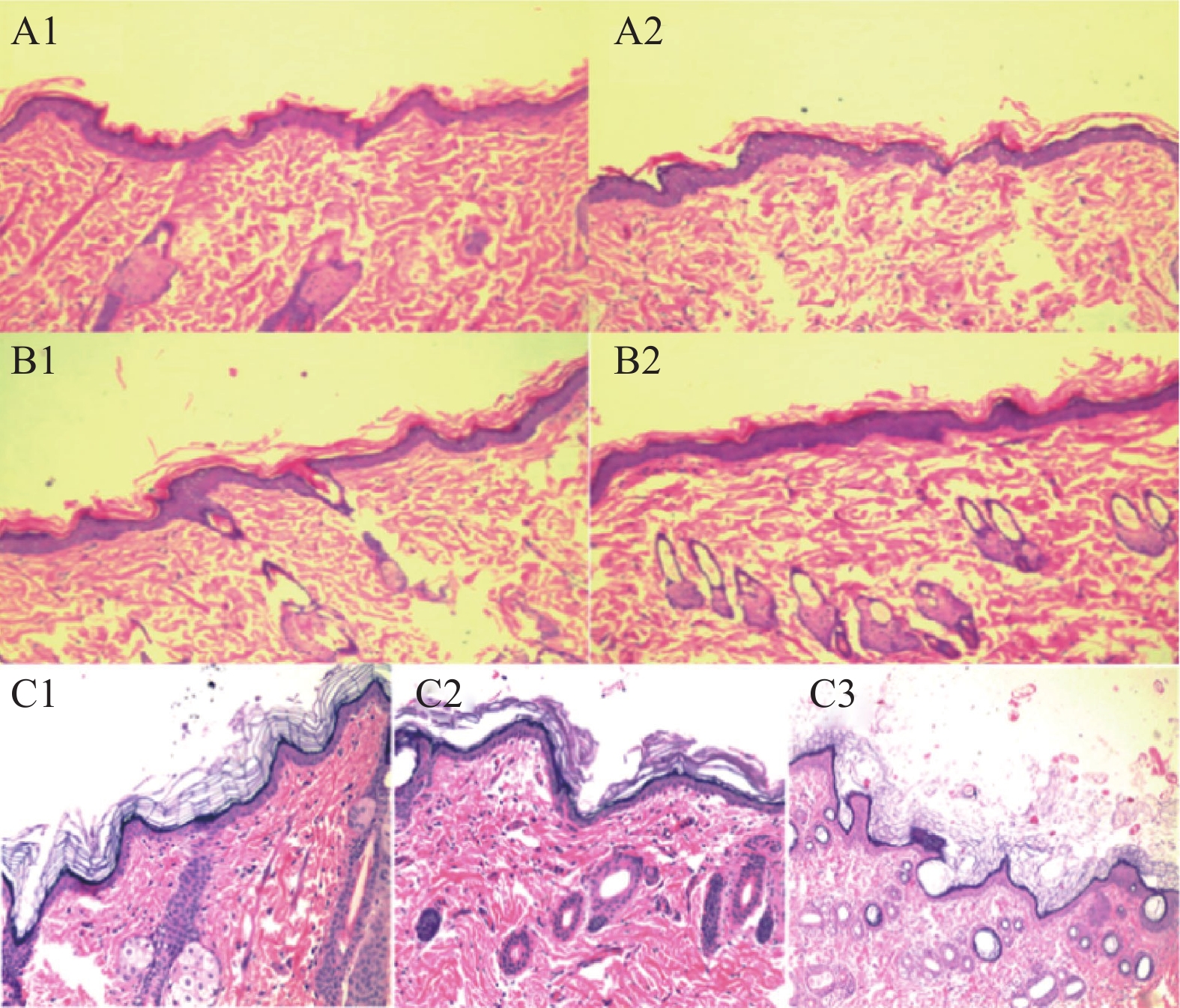
在皮肤刺激性和变态反应试验之后,取各组皮肤进行HE染色切片观察。如图2所示,刺激性试验和变态反应试验中使用液体创可贴后,动物皮肤结构完整,与空白组正常皮肤组织基本一致。
3. 讨论
液体创可贴属于新型的药械产品,目前尚无相关国家标准及行业标准对其质量进行统一控制。本研究根据《中华人民共和国医药行业标准YY/T 0471.3-2004接触性创面敷料试验方法》及《中国药典》(2020年版)涂膜剂等相关标准对液体创可贴的质量进行了较全面的考察,结合市售产品考察结果,制定本品的质量标准如下:成膜时间应不大于5 min,断点伸长百分率不低于130%,抗张强度不低于3 MPa, 水损失率不得高于3.5%,MVTR(水蒸气透过率)不得小于0.6 mg/(cm2·h),相关功能性成分含量应为标示量的95.0%~105.0%,其他如装量、鉴别等项目应符合相关规定。此质量标准适用于大部分涂抹型液体创可贴产品,可为同类产品的质量控制提供一定参考。
关于HPLC法测定自制液体创可贴的含量,通过紫外扫描发现苯甲醇、利多卡因和苯扎氯铵在210 nm处具有最大吸收波长,初步采用210 nm作为检测波长,发现液体创可贴中其他成分产生的杂峰对目标成分的测定存在干扰。另外,因为采用醋酸铵缓冲溶液为流动相,其在酸性条件下形成醋酸浓度远高于苯扎氯铵,在210 nm处有强吸收,会掩盖苯扎氯铵的紫外吸收,导致其无法出峰。同时因供试品中苯甲醇和利多卡因的浓度是苯扎氯铵的20倍和10倍,为保证3种药物能准确测定,选择相关报道常用的苯扎氯铵第2个吸收峰波长262 nm作为检测波长。
苯甲醇、利多卡因和苯扎氯铵这3种物质被同时测定的方法尚未见报道,参考有关文献[12-14],最初尝试几个能同时测定多个成分中含上述3种成分之一的方法,均无法满足能同时测定这3个物质。后考虑到苯扎氯铵是季铵盐类阳离子表面活性剂,以纯水-乙腈或甲醇为流动相时苯扎氯铵成分吸收较小,且峰形杂乱。最终参考文献[15-16]方法选择乙酸铵缓冲液-乙腈为流动相,以l%三乙胺改善色谱峰拖尾问题,用冰醋酸调节流动相pH为4.8,苯扎氯铵能得到较好分离并且峰形良好。关于流动相比例,首先以高比例的水相梯度洗脱苯甲醇和利多卡因,发现基线太不稳定使后续出峰的苯扎氯铵峰形无法辨认计算,后采用等度洗脱并不断调整至醋酸铵缓冲液-乙腈比例为40∶60,能在20 min内使三者得到满足要求的分离。苯扎氯铵主要由n-C12H25、n-C14H29与n-C16H33 3种正烷烃基取代二甲基苄基氯化铵组成的同系物组成[16]。因为液体创可贴中苯扎氯铵与另2个成分浓度相差太大,苯扎氯铵中2种同系物(n-C14H29与n-C16H33取代物)含量则更低,无法同时测定,因此本文只以1个峰对苯扎氯铵定量。
安全性试验结果显示自制液体创可贴对皮肤没有明显的刺激性,无变态反应发生,该制剂应用安全。综上所述,本研究对自制液体创可贴的质量品质与安全性进行了考察,从性状、鉴别、检查和含量测定4个方面建立了自制液体创可贴的质量控制方法,并对相关市售产品进行了检查,检查方法简便可靠,含量测定方法准确灵敏,可用于液体创可贴的质量控制,为液体创可贴质量标准的建立提供了一定参考依据。
-
表 1 代谢组学在乳腺癌早期诊断中发现的特征代谢物
作者 样本来源 技术方法 统计学方法 特征代谢物 Catarina等 尿液 1H-NMR K-S非参数检验和t检验与PAC,PLS-DA和OPLS-DA 肌酸、甘氨酸、丝氨酸、二甲胺、三甲胺N-氧化物、
α-羟基异丁酸酯、甘露醇、谷氨酰胺等Fang等 TNBC、非TNBC及正常的乳腺上皮细胞 HILIC-MS/MS Mann-Whitney U检验或Kruskal-Wallis检验与OPLS-DA 胞内:谷氨酸、β-丙氨酸、天冬氨酸、谷胱甘肽、
N-乙酰丝氨酸、N-乙酰甲硫氨酸
胞外:谷氨酰胺、丝氨酸、β-丙氨酸、赖氨酸谷氨酸、
L-半胱氨酸-谷胱甘肽Daniele等 唾液 UPLC-Q-TOF-MS t检验、卡方检验等 7种寡肽和6种甘油磷脂 Leticia等 血浆 HPLC-HRMS 非参数Wilcoxon秩和检验、PAC、PLS-DA 色氨酸、磷酸乙醇胺、磷脂 -
[1] WILKINSON L, GATHANI T. Understanding breast cancer as a global health concern[J]. Br J Radiol,2022,95(1130):20211033-20211036. doi: 10.1259/bjr.20211033 [2] CAO W, CHEN H D, YU Y W, et al. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020[J]. Chin Med J (Engl),2021,134(7):783-791. doi: 10.1097/CM9.0000000000001474 [3] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA A Cancer J Clin,2021,71(3):209-249. doi: 10.3322/caac.21660 [4] LI A H, SHEN Z, SUN Z F, et al. Occupational risk factors and breast cancer in Beijing, China: a hospital-based case-control study[J]. BMJ Open,2022,12(2):e054151-e054159. doi: 10.1136/bmjopen-2021-054151 [5] 徐文斌, 龚乘丙, 李尧, 等. p53 codon 72基因多态性与中国女性乳腺癌发生风险关系的系统评价与Meta分析[J]. 医学新知, 2022, 32(1):23-32. [6] 周星彤, 沈松杰, 孙强. 中国乳腺癌筛查现状及进展[J]. 中国医学前沿杂志(电子版), 2020, 12(3):6-11. [7] 王柏田, 王笑峰. 血清肿瘤标记物联合动态检测在乳腺癌诊断和监控治疗中的应用价值[J]. 中国医学创新, 2021, 18(3):6-11. [8] YANG L Q, WANG Y, CAI H S, et al. Application of metabolomics in the diagnosis of breast cancer: a systematic review[J]. J Cancer,2020,11(9):2540-2551. doi: 10.7150/jca.37604 [9] 程柳柳, 李俊. 乳腺癌早期诊断技术[J]. 国际肿瘤学杂志, 2013, 40(6):453-455. doi: 10.3760/cma.j.issn.1673-422X.2013.06.017 [10] BLACK E, RICHMOND R. Improving early detection of breast cancer in sub-Saharan Africa: why mammography may not be the way forward[J]. Global Health,2019,15(1):3-14. doi: 10.1186/s12992-018-0446-6 [11] NICHOLSON J K, LINDON J C, HOLMES E. 'Metabonomics': understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica,1999,29(11):1181-1189. doi: 10.1080/004982599238047 [12] SAIGUSA D, MATSUKAWA N, HISHINUMA E, et al. Identification of biomarkers to diagnose diseases and find adverse drug reactions by metabolomics[J]. Drug Metab Pharmacokinet,2021,37:100373-100389. doi: 10.1016/j.dmpk.2020.11.008 [13] KIM K J, KIM H J, PARK H G, et al. A MALDI-MS-based quantitative analytical method for endogenous estrone in human breast cancer cells[J]. Sci Rep,2016,6:24489-24496. doi: 10.1038/srep24489 [14] PANIS C, BINATO R, CORREA S, et al. Short infusion of paclitaxel imbalances plasmatic lipid metabolism and correlates with cardiac markers of acute damage in patients with breast cancer[J]. Cancer Chemother Pharmacol,2017,80(3):469-478. doi: 10.1007/s00280-017-3384-8 [15] SILVA C L, OLIVAL A, PERESTRELO R, et al. Untargeted urinary 1H NMR-based metabolomic pattern as a potential platform in breast cancer detection[J]. Metabolites,2019,9(11):269-286. doi: 10.3390/metabo9110269 [16] BAI X P, NI J, BERETOV J, et al. Triple-negative breast cancer therapeutic resistance: where is the Achilles' heel? Cancer Lett,2021,497:100-111. doi: 10.1016/j.canlet.2020.10.016 [17] ZHANG A H, SUN H, WANG X J. Serum metabolomics as a novel diagnostic approach for disease: a systematic review[J]. Anal Bioanal Chem,2012,404(4):1239-1245. doi: 10.1007/s00216-012-6117-1 [18] MAMAS M, DUNN W B, NEYSES L, et al. The role of metabolites and metabolomics in clinically applicable biomarkers of disease[J]. Arch Toxicol,2011,85(1):5-17. doi: 10.1007/s00204-010-0609-6 [19] JOHNSON C H, IVANISEVIC J, SIUZDAK G. Metabolomics: beyond biomarkers and towards mechanisms[J]. Nat Rev Mol Cell Biol,2016,17(7):451-459. doi: 10.1038/nrm.2016.25 [20] BEGLEY P, FRANCIS-MCINTYRE S, DUNN W B, et al. Development and performance of a gas Chromatography−Time-of-flight mass spectrometry analysis for large-scale nontargeted metabolomic studies of human serum[J]. Anal Chem,2009,81(16):7038-7046. doi: 10.1021/ac9011599 [21] ZHANG T L, ZHANG A H, QIU S, et al. Current trends and innovations in bioanalytical techniques of metabolomics[J]. Crit Rev Anal Chem,2016,46(4):342-351. doi: 10.1080/10408347.2015.1079475 [22] TEAV T, GALLART-AYALA H, VAN DER VELPEN V, et al. Merged targeted quantification and untargeted profiling for comprehensive assessment of acylcarnitine and amino acid metabolism[J]. Anal Chem,2019,91(18):11757-11769. doi: 10.1021/acs.analchem.9b02373 [23] 金丹, 刘萌萌, 郭咸希, 等. 代谢组学技术在糖尿病中的应用研究进展[J]. 中国药师, 2021, 24(3):542-547. doi: 10.3969/j.issn.1008-049X.2021.03.028 [24] ALEXANDROV T. Spatial metabolomics and imaging mass spectrometry in the age of artificial intelligence[J]. Annu Rev Biomed Data Sci,2020,3:61-87. doi: 10.1146/annurev-biodatasci-011420-031537 [25] GEIER B, SOGIN E M, MICHELLOD D, et al. Spatial metabolomics of in situ host-microbe interactions at the micrometre scale[J]. Nat Microbiol,2020,5(3):498-510. doi: 10.1038/s41564-019-0664-6 [26] SHARIATGORJI R, NILSSON A, FRIDJONSDOTTIR E, et al. Spatial visualization of comprehensive brain neurotransmitter systems and neuroactive substances by selective in situ chemical derivatization mass spectrometry imaging[J]. Nat Protoc,2021,16(7):3298-3321. doi: 10.1038/s41596-021-00538-w [27] CHONG J, WISHART D S, XIA J G. Using MetaboAnalyst 4.0 for comprehensive and integrative metabolomics data analysis[J]. Curr Protoc Bioinformatics,2019,68(1):e86-e214. [28] PORTO-FIGUEIRA P, PEREIRA J A M, CÂMARA J S. Exploring the potential of needle trap microextraction combined with chromatographic and statistical data to discriminate different types of cancer based on urinary volatomic biosignature[J]. Anal Chim Acta,2018,1023:53-63. doi: 10.1016/j.aca.2018.04.027 [29] RAMAUTAR R. Capillary electrophoresis-mass spectrometry for clinical metabolomics[J]. Adv Clin Chem,2016,74:1-34. [30] CHEN T L, YOU Y J, XIE G X, et al. Strategy for an association study of the intestinal microbiome and brain metabolome across the lifespan of rats[J]. Anal Chem,2018,90(4):2475-2483. doi: 10.1021/acs.analchem.7b02859 [31] 谭起龙, 邓魁, 李康, 等. 随机森林回归分析方法在代谢组学批次效应移除中的应用[J]. 中国卫生统计, 2020, 37(5):667-671. [32] LI M, GUO Y, FENG Y M, et al. Identification of triple-negative breast cancer genes and a novel high-risk breast cancer prediction model development based on PPI data and support vector machines[J]. Front Genet,2019,10:180-192. doi: 10.3389/fgene.2019.00180 [33] ZHOU L, RUEDA M, ALKHATEEB A. Classification of breast cancer Nottingham prognostic index using high-dimensional embedding and residual neural network[J]. Cancers,2022,14(4):934-940. doi: 10.3390/cancers14040934 [34] CATARINA LS, ANA O, ROSA P, et al. Untargeted urinary 1H NMR-based metabolomic pattern as a potential platform in breast cancer detection[J]. Metabolites, 2019, 9(11): 269-286. [35] KOU F, ZHU B J, ZHOU W B, et al. Targeted metabolomics reveals dynamic portrayal of amino acids and derivatives in triple-negative breast cancer cells and culture media[J]. Mol Omics,2021,17(1):142-152. doi: 10.1039/D0MO00126K [36] XAVIER ASSAD D, ACEVEDO A C, CANÇADO PORTO MASCARENHAS E, et al. Using an untargeted metabolomics approach to identify salivary metabolites in women with breast cancer[J]. Metabolites,2020,10(12):506-519. doi: 10.3390/metabo10120506 [37] DÍAZ-BELTRÁN L, GONZÁLEZ-OLMEDO C, LUQUE-CARO N, et al. Human plasma metabolomics for biomarker discovery: targeting the molecular subtypes in breast cancer[J]. Cancers,2021,13(1):147-165. doi: 10.3390/cancers13010147 [38] CHEONG J E, SUN L J. Targeting the IDO1/TDO2−KYN-AhR pathway for cancer immunotherapy - challenges and opportunities[J]. Trends Pharmacol Sci,2018,39(3):307-325. doi: 10.1016/j.tips.2017.11.007 [39] SUN L C, SUO C X, LI S T, et al. Metabolic reprogramming for cancer cells and their microenvironment: beyond the Warburg Effect[J]. Biochim Biophys Acta Rev Cancer,2018,1870(1):51-66. doi: 10.1016/j.bbcan.2018.06.005 [40] FAUBERT B, SOLMONSON A, DEBERARDINIS R J. Metabolic reprogramming and cancer progression[J]. Science,2020,368(6487):112-123. [41] TESLAA T, TEITELL M A. Techniques to monitor glycolysis[J]. Methods Enzymol,2014,542:91-114. [42] CORBET C, FERON O. Cancer cell metabolism and mitochondria: Nutrient plasticity for TCA cycle fueling[J]. Biochim Biophys Acta Rev Cancer,2017,1868(1):7-15. doi: 10.1016/j.bbcan.2017.01.002 [43] COURTNAY R, NGO D C, MALIK N, et al. Cancer metabolism and the Warburg effect: the role of HIF-1 and PI3K[J]. Mol Biol Rep,2015,42(4):841-851. doi: 10.1007/s11033-015-3858-x [44] GHANEM A, MELZER A M, ZAAL E, et al. Ascorbate kills breast cancer cells by rewiring metabolism via redox imbalance and energy crisis[J]. Free Radic Biol Med,2021,163:196-209. doi: 10.1016/j.freeradbiomed.2020.12.012 [45] ARMIÑÁN A, PALOMINO-SCHÄTZLEIN M, DELADRIERE C, et al. Metabolomics facilitates the discrimination of the specific anti-cancer effects of free- and polymer-conjugated doxorubicin in breast cancer models[J]. Biomaterials,2018,162:144-153. doi: 10.1016/j.biomaterials.2018.02.015 [46] GIESBERTZ P, ECKER J, HAAG A, et al. An LC-MS/MS method to quantify acylcarnitine species including isomeric and odd-numbered forms in plasma and tissues[J]. J Lipid Res,2015,56(10):2029-2039. doi: 10.1194/jlr.D061721 [47] SUN C L, WANG F K, ZHANG Y, et al. Mass spectrometry imaging-based metabolomics to visualize the spatially resolved reprogramming of carnitine metabolism in breast cancer[J]. Theranostics,2020,10(16):7070-7082. doi: 10.7150/thno.45543 [48] LYON D E, STARKWEATHER A, YAO Y W, et al. Pilot study of metabolomics and psychoneurological symptoms in women with early stage breast cancer[J]. Biol Res Nurs,2018,20(2):227-236. doi: 10.1177/1099800417747411 [49] SUN Y H, KIM J H, VANGIPURAM K, et al. Pharmacometabolomics reveals a role for histidine, phenylalanine, and threonine in the development of paclitaxel-induced peripheral neuropathy[J]. Breast Cancer Res Treat,2018,171(3):657-666. doi: 10.1007/s10549-018-4862-3 [50] DE VRIES SCHULTINK A H M, ALEXI X, VAN WERKHOVEN E, et al. An Antiestrogenic Activity Score for tamoxifen and its metabolites is associated with breast cancer outcome[J]. Breast Cancer Res Treat,2017,161(3):567-574. doi: 10.1007/s10549-016-4083-6 [51] KUS K, KIJ A, ZAKRZEWSKA A, et al. Alterations in arginine and energy metabolism, structural and signalling lipids in metastatic breast cancer in mice detected in plasma by targeted metabolomics and lipidomics[J]. Breast Cancer Res,2018,20(1):148-161. doi: 10.1186/s13058-018-1075-y [52] SPARANO J A, GRAY R J, MAKOWER D F, et al. Adjuvant chemotherapy guided by a 21-gene expression assay in breast cancer[J]. N Engl J Med,2018,379(2):111-121. doi: 10.1056/NEJMoa1804710 [53] GOLDSTEIN D A, MAYER C, SHOCHAT T, et al. The concordance of treatment decision guided by OncotypeDX and the PREDICT tool in real-world early-stage breast cancer[J]. Cancer Med,2020,9(13):4603-4612. doi: 10.1002/cam4.3088 [54] DINAN M A, WILSON L E, REED S D, et al. Association of 21-gene assay (OncotypeDX) testing and receipt of chemotherapy in the medicare breast cancer patient population following initial adoption[J]. Clin Breast Cancer,2020,20(6):487-494. doi: 10.1016/j.clbc.2020.05.010 [55] MCCARTNEY A, VIGNOLI A, TENORI L, et al. Metabolomic analysis of serum may refine 21-gene expression assay risk recurrence stratification[J]. NPJ Breast Cancer,2019,5:26-31. doi: 10.1038/s41523-019-0123-9 [56] SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2021[J]. CA Cancer J Clin,2021,71(1):7-33. doi: 10.3322/caac.21654 [57] JIANG Y L, CHEN X P, FU S M. Advances in the correlation between intestinal microbiota and breast cancer development[J]. J Cancer Ther,2020,11(12):758-771. doi: 10.4236/jct.2020.1112066 -





 下载:
下载:
 下载:
下载: 

