-
肥胖是一种慢性代谢性疾病,是指由于能量摄入超过消耗,导致体内脂肪积聚过多或分布异常而造成体重增加的一种疾病。肥胖会提高 2 型糖尿病、高血压、血脂异常、心血管疾病和某些癌症的发病率[1-3],降低生活质量并增加死亡风险。减肥手术是最有效的减肥方法[4],但手术有潜在的风险和限制,且无法满足全球范围内患者的医疗需求。改善饮食结构、生活方式以及增加身体活动等短期行为干预也不足以达成长期减肥的目的[5]。因此,药物治疗是中、重度肥胖患者以及有并发症的轻度肥胖患者的首要治疗选择[6]。
多年来,减肥药物有着坎坷曲折的研发历程,获批数量有限且许多已经上市的药物最终因心血管问题等不良反应而撤市,如盐酸氯卡色林(5-羟色胺2C受体激动剂)、西布曲明(抑制去甲肾上腺素和5-羟色胺再摄取)等。因此,全球各大药物监管机构对减肥药物的批准一直非常严格。目前,全球共有8种上市的减肥药物,包括赛利司他(脂肪酶抑制剂)、奥利司他(脂肪酶抑制剂)、复方芬特明-托吡酯(肾上腺素受体激动剂与α-氨基-3-羟基-5-甲基-4-异噁唑丙酸受体拮抗剂)、复方纳曲酮-安非他酮(肾上腺素吸收抑制剂与多巴胺摄取抑制剂)、二甲双胍(单磷酸腺苷活化蛋白激酶激动剂)、苄非他明(肾上腺素受体激动剂)以及最新批准的利拉鲁肽和司美格鲁肽(GLP-1受体激动剂)。然而,这些上市减肥药物的耐受性和安全性也受到挑战,如奥利司他会导致严重的脂肪泻;利拉鲁肽价格昂贵,存在恶心等胃肠道反应,不易推广。匮乏的减肥药物市场亟需基于新靶点的全新减肥药物以应对肥胖日益严峻的发病形势。
ORM(Orosomucoid),也称为α1酸性糖蛋白(AGP),是肝脏急性期反应蛋白[7]。ORM在人体中有2种亚型(ORM1和ORM2),小鼠中有3个亚型(ORM1、ORM2和ORM3),大鼠中仅有1种型。在人和小鼠体内,ORM1的组成水平远高于ORM2(5倍),并且只有ORM1可以被急性期刺激诱导。ORM具有转运药物、调节免疫、维持毛细血管屏障等功能[8]。团队前期研究发现,ORM具有能量代谢的调节作用,循环中的ORM可以作用于下丘脑的瘦素受体,激活JAK2-STAT3通路,抑制摄食、降低体重、改善胰岛素抵抗[9]。本团队进一步以ORM为靶点,筛选到了一个靶向上调内源性ORM的全新小分子化合物HMS-01,在瘦素缺陷的ob/ob肥胖小鼠和高脂喂食的肥胖小鼠上,均展示了良好的减肥效果,在国家重大新药创制资助下,已经进入到临床前研究阶段。这些研究均提示,ORM是一个治疗肥胖的全新潜在靶点[9], 靶向上调内源性ORM的小分子有可能发展为新型减肥药物。
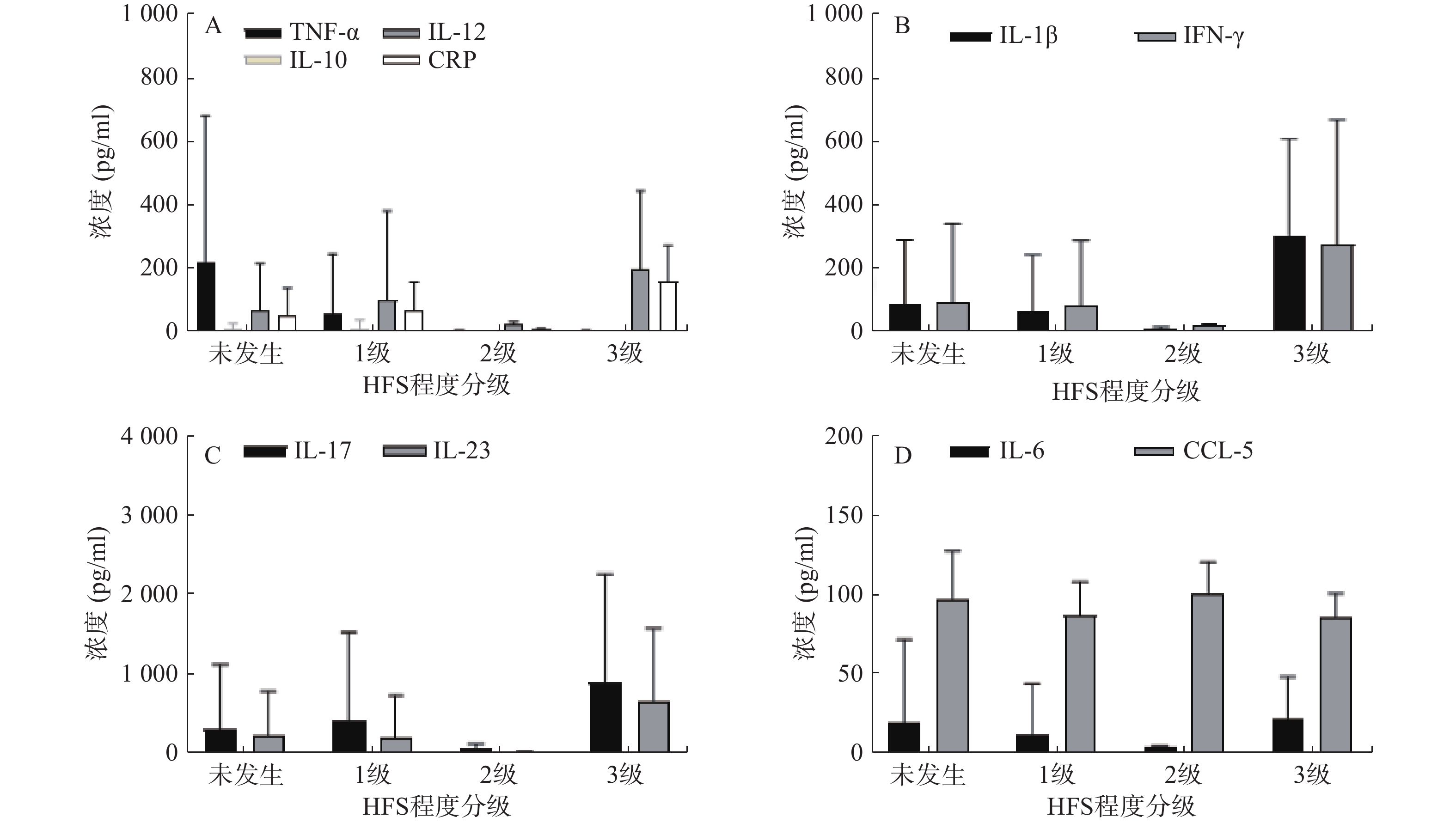
然而,新的减肥药物研发面临高投入、低回报的困境,传统新药研发需要消耗10~15年的时间,以及约25亿美元的投入,而达到Ⅲ期临床试验最后阶段的药物中有 50% 最终无法被批准上市[10],每一次失败都会消耗大量的时间与资源。药物重定位是一种药物发现和开发的策略,旨在重新评估已经开发或研究的药物,以寻找其在新的疾病领域或治疗应用中的潜在价值。该策略的目的是最大化已有药物的利用,降低新药开发的时间和成本。本研究利用基因重组技术构建了含有ORM1启动子上游2 000个碱基对序列的荧光素酶报告基因,由于ORM主要由肝脏合成,通过血液分泌至全身发挥作用,于是选用AML12小鼠正常肝细胞构建了稳定表达LV-ORM1 启动子-LUC-PURO的细胞株,从而建立了一个以ORM为靶点的药物筛选平台和评价体系,用于高通量筛选上市药物库中靶向ORM的药物,为药物重定位发现潜在减肥药物奠定基础。
-
AML12小鼠正常肝细胞、HEK-293T上皮细胞、载体pGL4.20[luc2/Puro] 与pHBLV-CMV-MCS-EF1-puro、慢病毒包装辅助质粒pMD2.G和psPAX2均为实验室保存;DH5α感受态细胞(天根生化科技有限公司);ORM1 启动子基因序列来自NCBI数据库(NC_000070.7)。
-
Veriti™ 96 孔快速热循环仪(Thermo Fisher Scientific公司,美国);移液器、低温高速台式离心机(EPPENDORF公司,德国);电热恒温培养箱(上海跃进医疗器械有限公司);琼脂糖凝胶电泳仪、多功能水平电泳槽(上海天能科技有限公司);电热恒温水浴锅(上海一恒科技有限公司);倒置生物显微镜(重庆光电仪器总公司);全波长多功能酶标仪(BMG,德国)。
-
PCR引物和基因合成(生工生物工程股份有限公司);RNA提取试剂盒RNAeasy™动物RNA抽提试剂盒(上海碧云天生物技术有限公司);限制性内切酶KpnI、限制性内切酶Hind Ⅲ、限制性内切酶AgeI、限制性内切酶ApaI、限制性内切酶ClaI、限制性内切酶BamHI、转染试剂Lipofectamine 3000试剂盒(Thermo Fisher Scientific公司,美国);高保真聚合酶phanta Max-Super-Fidlity DNA polymerase(南京诺唯赞生物科技股份有限公司);PCR试剂盒2X Pro Taq 预混液、反转录试剂盒Evo M-MLV 反转录试剂预混液、SYBR Green Pro Taq HS 预混型 qPCR 试剂盒(湖南艾科瑞生物工程有限公司);琼脂糖凝胶 DNA 纯化回收试剂盒、质粒小提试剂盒(天根生化科技有限公司);HB-infusionTM 无缝克隆试剂盒(汉恒生物科技有限公司);转染试剂polybrene(Sigma,美国);Firefly-Glo萤光素酶报告基因检测试剂盒(大连美仑生物技术有限公司);FDA 上市药物库(陶术生物科技有限公司);测序由赛业生物科技有限公司完成。
-
提取小鼠新鲜的肝组织,使用RNAeasy™动物RNA抽提试剂盒提取总RNA,反转录为cDNA,用作PCR模板,保存于−20 ℃冰箱。
-
根据同源重组引物设计原则和参考小鼠ORM1(NC_000070.7)基因组序列设计引物(选取起始位点上游2 000个碱基对),采用同源重组法设计引物,上游引物加入KpnI酶切位点,下游引物加入Hind Ⅲ酶切位点,引物序列见表1。产物进行琼脂糖凝胶电泳,使用琼脂糖凝胶DNA回收试剂盒回收目的基因。
表 1 ORM1 启动子基因引物序列
引物名称 引物序列(5′—3′) ORM1-F GGGGTACCGTTCTCAGCATGTTGCATAAAT ORM1-R CCAAGCTTGCTGAGGGCACTCAGAGC 注:F: 正向引物; R: 反向引物。 -
将PCR产物与载体质粒pGL4.20 [luc2 Puro](插入位点选择AgeI与ApaI)于37 ℃双酶切5 h,用同源重组酶将目的片段与载体质粒连接。使用DH5α感受态细胞将重组质粒进行转化后,接种于含有嘌呤霉素抗性的固体平板,用涂布器将重组质粒涂抹均匀,倒置37 ℃恒温箱培养12~16 h。将筛选出来的阳性克隆进行测序,随后进行菌液扩增和质粒抽提纯化。对提取的质粒进行浓度检测和A260/280检测,把质粒保存于−20 ℃冰箱。构建成功的重组载体命名为 pGL4.20-ORM1 启动子。根据Lipofectamine 3000试剂盒说明书,分别将pGL4.20-ORM1 启动子和pGL4.20转染至AML12小鼠正常肝细胞中,使用地塞米松(DXMS)来验证报告基因的有效性和可行性。
-
以pGL4.20-ORM1 启动子重组质粒为模板,设计引物,引物序列见表2。产物进行琼脂糖凝胶电泳,使用琼脂糖凝胶DNA回收试剂盒回收目的基因。
表 2 LV-ORM1 启动子-LUC-PURO基因引物序列
引物名称 引物序列(5′—3′) LV-ORM1
启动子-LUC-PURO-FGGACAGCAGAGATCCAGTTTATCGATGTTCTCAGCATGTTGCATAAATT LV-ORM1
启动子-LUC-PURO-RGAGCGATCGCAGATCCTTAGGATCCTTACACGGCGATCTTGCCGCCCTT 注:F: 正向引物; R: 反向引物。 将PCR产物与载体质粒pHBLV-CMV-MCS-EF1-PURO(插入位点选择ClaI与BamHI)于37 ℃双酶切5 h,用同源重组酶将目的片段与载体质粒连接。使用DH5α感受态细胞将重组质粒进行转化后,接种于含有嘌呤霉素抗性的固体平板,用涂布器将重组质粒涂抹均匀,倒置37 ℃恒温箱培养12~16 h。将筛选出来的阳性克隆,送赛业生物科技有限公司进行测序。测序成功之后,进行菌液扩增和质粒抽提纯化。对提取的质粒进行浓度检测和A260/280检测,把质粒保存于−20 ℃冰箱。构建成功的重组载体命名为LV-ORM1 启动子-LUC-PURO。同样方法构建LV-LUC-PURO作为对照载体。
-
提前传代HEK-293T细胞用于转染,将慢病毒包装辅助质粒pMD2.G 10 μg、psPAX2 5 μg和LV-ORM1 启动子-LUC-PURO 10 μg以及转染试剂75 µl混匀后静置,在室温下温育15 min后缓慢滴加至293T细胞中,于37 ℃、5% CO2细胞培养箱中培养。转染后16 h更换含10 % 胎牛血清 FBS的新鲜完全培养基。转染后 48 h和72 h,分别收集两次病毒上清液(48 h收集后置换新鲜完全培养基),将两次收集的上清液混合,进行离心浓缩和病毒管分装,−80°C冰箱保存。
-
将生长状态良好的HEK-293T细胞消化计数后稀释至 1×105个/ml, 加入96孔板,100 µl/孔,为每个病毒准备6个孔。放入37°C 、5% CO2 培养箱中培养。将病毒进行3倍梯度稀释,共6个稀释度,接种于293T细胞,继续培养48 h后,在荧光显微镜下观察结果。在观察结果前6 h需更换新鲜10% FBS完全培养基,从孔中吸出80 µl培养基,然后加入80 µl新鲜10 % FBS完全培养基,放入37°C、5% CO2 培养箱中培养。6 h后荧光显微镜下观察结果,荧光或活细胞百分比在10%~50% 的孔计算病毒滴度。目的病毒命名为LV-ORM1 启动子-LUC-PURO。同样方法,阴性对照病毒命名为LV-LUC-PURO。
-
将AML12小鼠正常肝细胞在含有10% FBS、1% ITS(10 µg/ml胰岛素+5.5 µg/µl转铁蛋白+5 ng/ml硒)、1% 双抗以及40 ng/ml DXMS的DMEM 培养基,于37 ℃、5% CO2饱和湿度的细胞培养箱内培养。AML12细胞在10 cm培养皿中细胞长满以后,用0.25%胰蛋白酶消化,离心收集细胞后稀释成密度为1.5×105个/ml的细胞悬液,接种于6孔板,每孔2 ml,使得第2天细胞的融合率在60% 左右,利于感染。设置实验组LV-ORM1 启动子-LUC-PURO和阴性对照组LV-LUC-PURO,为促进病毒的感染效率,首先,感染时弃原有培养基,添加含5% FBS的新鲜培养液2 ml,其次,添加助感染试剂polybrene,使其最终浓度为7 μg/ml。设置2个(10/20)感染复数(MOI)组,感染24 h后换新鲜完全培养基。在感染48 h后,观察慢病毒颗粒感染效率,倒置荧光显微镜下观察荧光比例以确定最佳感染效率,最终选定MOI=20的分组进行后续实验。
待细胞融合率达60% 时,用嘌呤毒素(0.8 μg/ml)浓度处理48 h,然后换新鲜的嘌呤毒素培养基继续处理,细胞密度超过80%时则进行传代处理,后续每隔2~3 d更换含嘌呤毒素培养基扩大培养,经过反复挑取抗药性细胞后获得的稳定转染细胞,命名为LV-AML12-ORM1 启动子-LUC-PURO。同样方法,阴性对照细胞株命名为LV-AML12-LUC-PURO。
-
使用TRIzol试剂提取组织总RNA,使用反转录试剂盒将其逆转录成cDNA,然后进行PCR扩增,采用2–ΔΔCT分析目的基因的相对表达量,引物序列见表3。
表 3 qPCR引物设计序列
引物名称 引物序列(5′—3′) Luciferase-F CGCACATATCGAGGTGGACA Luciferase-R GCAAGCTATTCTCGCTGCAC mGapdh-F GTCAAGGCCGAGAATGGGAA mGapdh-R CTCGTGGTTCACACCCATCA 注:qPCR: 实时荧光定量聚合酶链式反应; mGapdh:小鼠甘油醛-3-磷酸脱氢酶; F: 正向引物; R: 反向引物。 -
使用二甲基亚砜(DMSO)和DXMS来验证LV-AML12-ORM1 启动子-LUC-PURO作为药物筛选工具的有效性和可行性。将LV-AML12-ORM1 启动子-LUC-PURO稳转细胞株培养于96孔黑色侧壁透明底板,用10 μmol/L DXMS处理12 h,同时用0.1% DMSO作为溶剂对照组。参照荧光素酶报告基因检测试剂盒说明书,加入80 µl检测溶液,细胞充分裂解后在酶标仪中检测荧光素发光值。
为了评估本高通量细胞筛选平台的精确性和稳定性,使用Z′因子作为度量标准,Z′因子是高通量筛选中常用来评估和验证的主要统计参数之一:
$$Z^{\prime}=1-\frac{3 \sigma_{\mathrm{DMSO}}+3 \sigma_{\mathrm{DXMS}}}{\left|\mu_{\mathrm{DMSO}}-\mu_{\mathrm{DXMS}}\right|}$$ 式中σDMSO和σDXMS分别为阴性对照组和阳性对照组的标准差,μDMSO和μDXMS分别为阴性对照组和阳性对照组的平均值。若0.5<Z′≤1,则认为此筛选模型具有良好的精确性与稳定性。
-
基于对美国食品药品监督管理局(FDA)批准的药物库的筛选,选用陶术生物的FDA上市药物库,筛选可靶向升高ORM的药物。
-
实验数据使用软件 GraphPad Prism 9 进行作图和分析。两组间比较用t检验,以 P<0.05 为差异具有统计学意义。
-
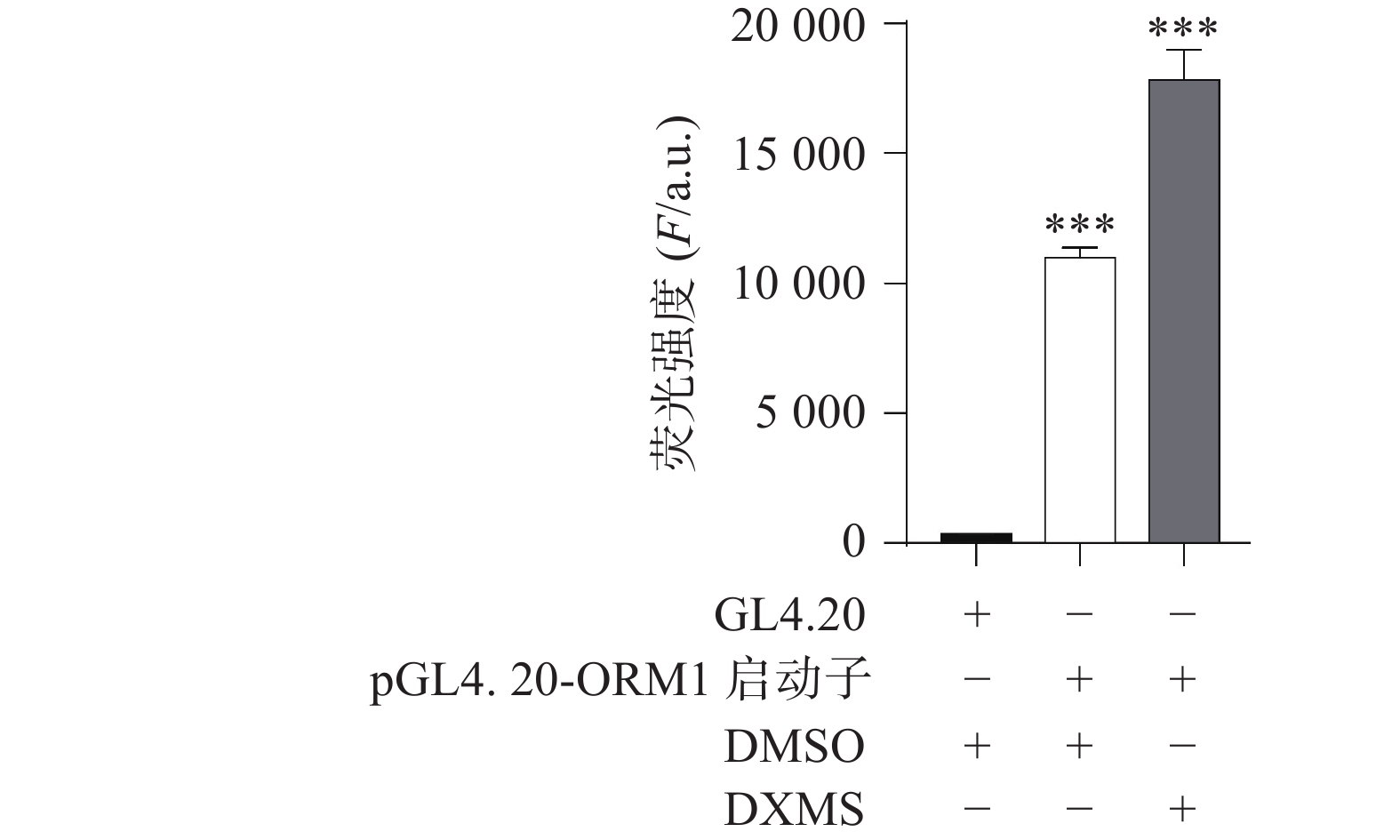
测序结果表明ORM1的启动子基因插入正确,如图1所示,序列信息无误。根据Lipofectamine 3000试剂盒说明书转染AML12细胞,使用荧光素酶报告基因试剂盒和酶标仪检测发光值,如图2所示,荧光素成功导入报告基因pGL4.20-ORM1 启动子中,并且可以被DXMS激活,证明该启动子的转录活性可用于稳转细胞株的构建。
-
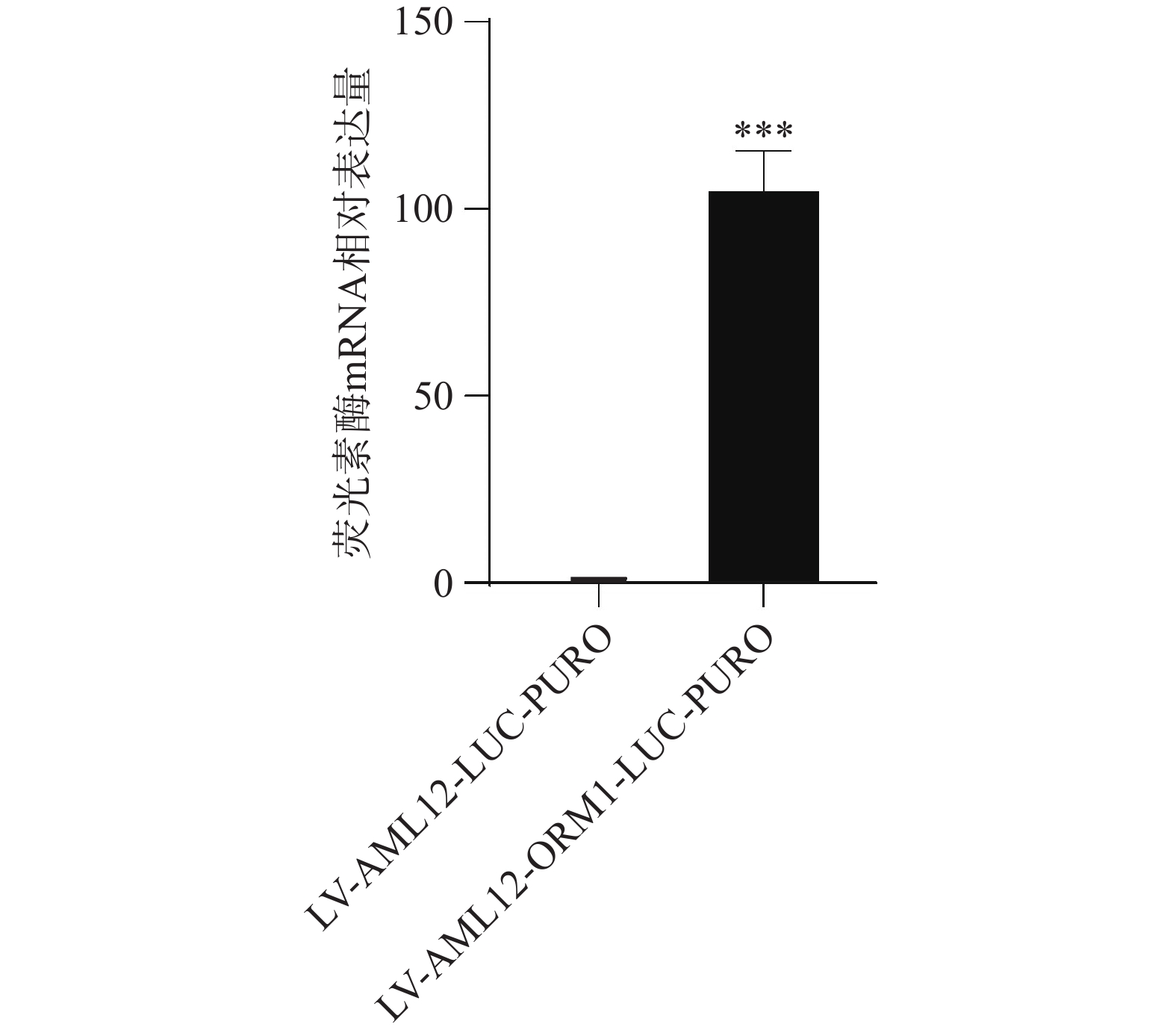
采用qPCR分别对稳转细胞株LV-AML12-LUC-PURO与LV-AML12-ORM1 启动子-LUC-PURO进行荧光素 mRNA水平检测,如图3所示,其中,荧光素基因在LV-AML12-ORM1 启动子-LUC-PURO稳转细胞中的相对表达量是对照组LV-AML12-LUC-PURO的104.06倍。
-
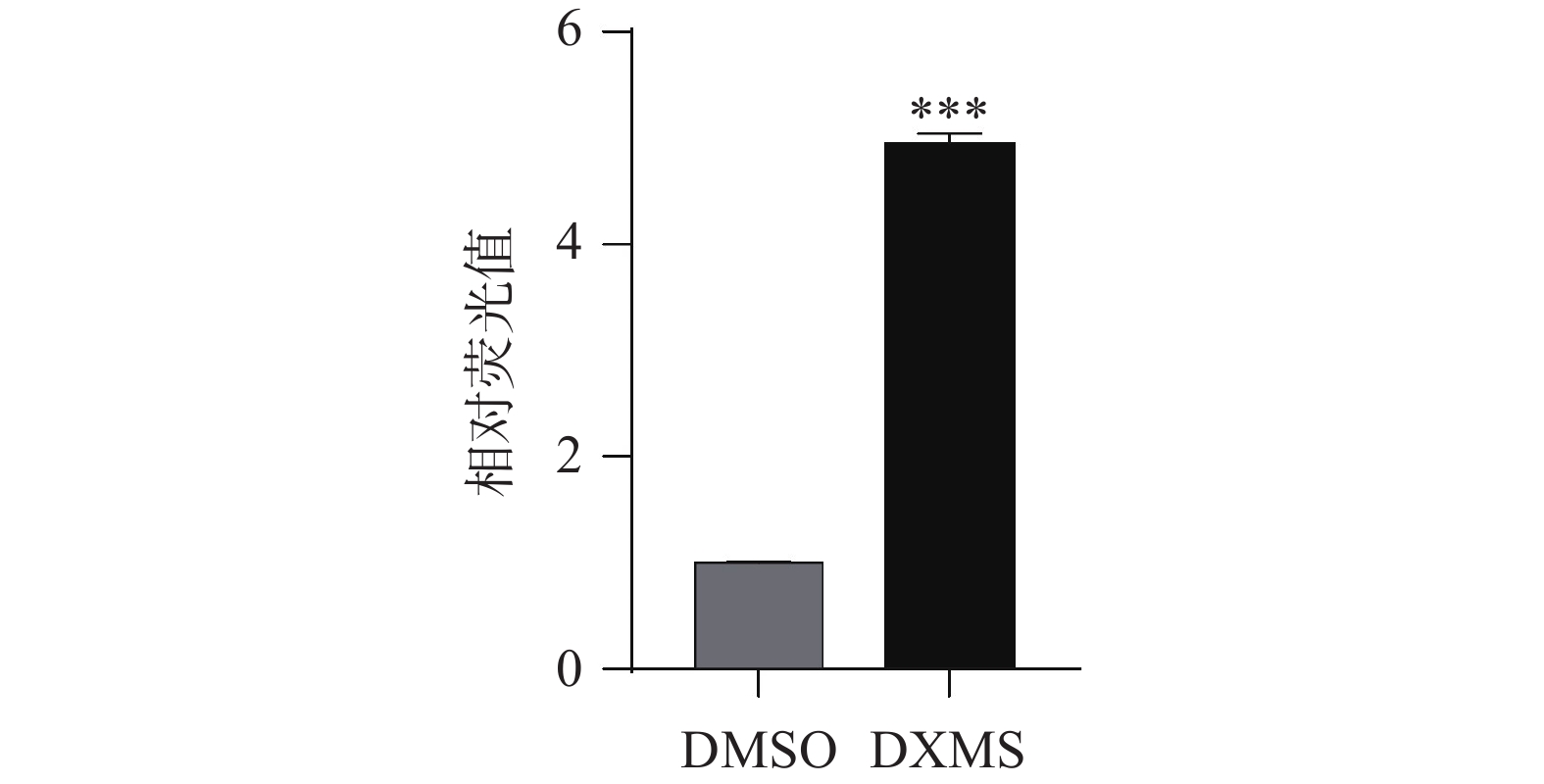
使用荧光素酶报告基因试剂盒和酶标仪检测发光值,如图4所示。DXMS的发光值是DMSO对照组的4.95倍。通过计算数据得Z′=0.77,说明此筛选平台可以作为一种高通量筛选的稳定方法。
-
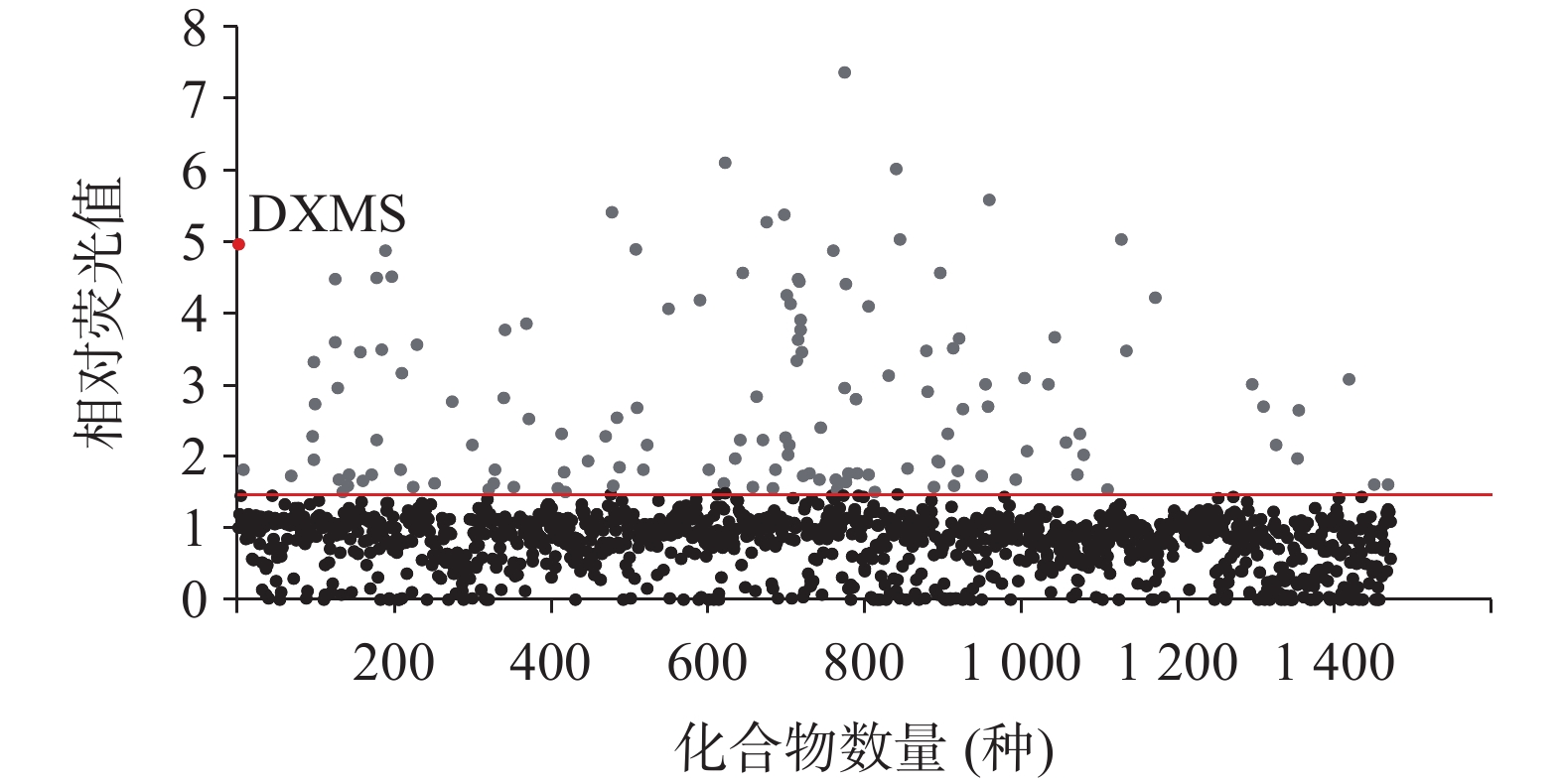
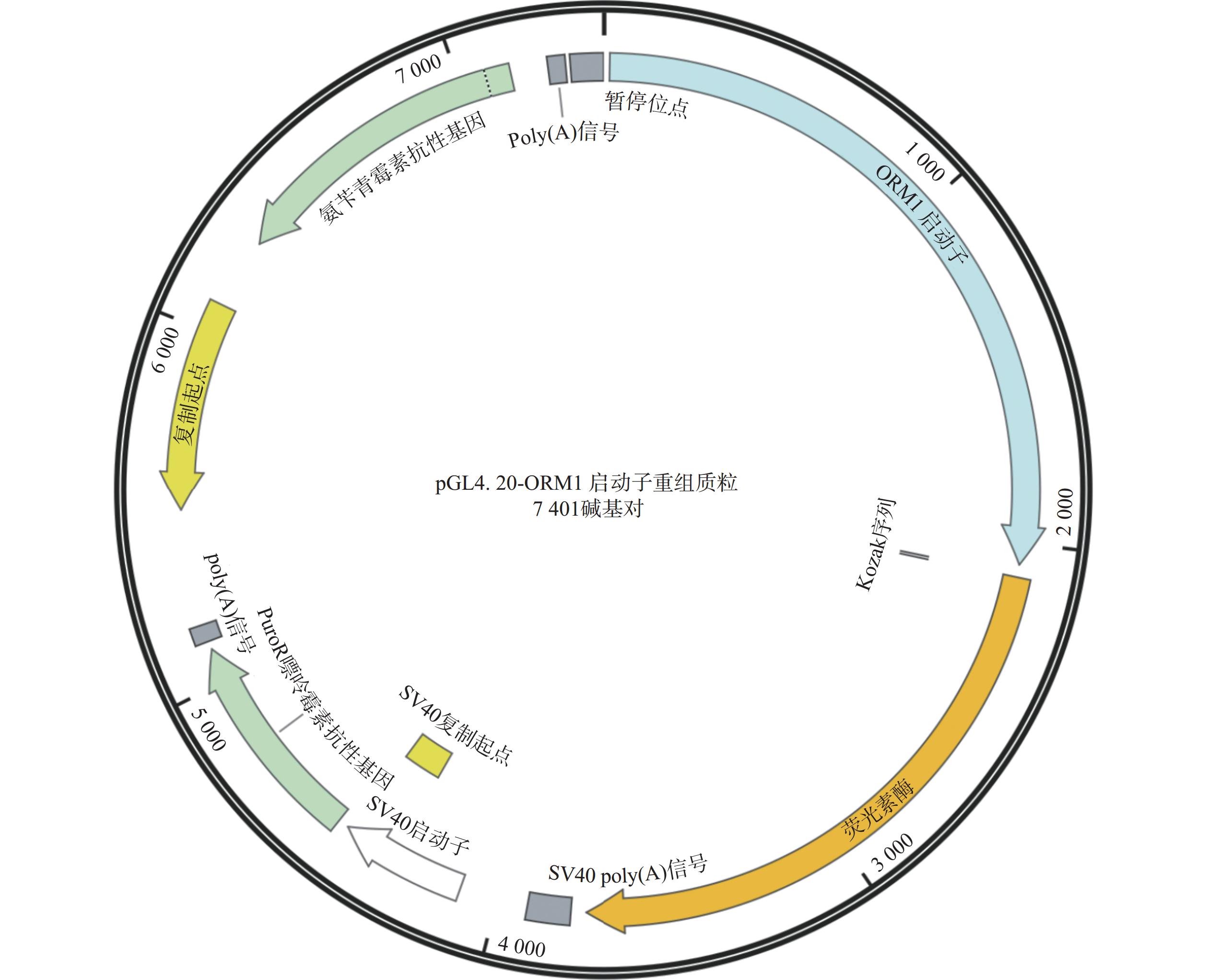
通过对陶术生物的FDA上市药物库1 470种化合物筛选,以30 μmol/L的较高浓度初筛,将荧光值比率>1.5的135种化合物作为初步命中的化合物,如图5所示。这135种药物中包含40种糖皮质激素类药物,但由于长期服用糖皮质激素易出现向心性肥胖,这与减肥的初衷相悖,所以将这些药物排除。之后将剩余的95种药物进行30、10、1 μmol/L浓度的复筛,避免单一浓度筛选实验出现假阳性。根据复筛结果,42种化合物呈现出量效关系的趋势,如图6所示,这些化合物的类别可分为抗肿瘤药(图6A)、抗生素(图6B)、抗炎药(图6C)、抗病毒药(图6D)以及其他药物(图6E~G)。
-
本课题组基于药物重定位的方法,通过构建带有ORM启动子的稳转细胞株作为高通量筛选平台,Z′因子的值为0.77,证明此细胞筛选平台可作为一种高通量筛选的稳定方法。经过初筛和复筛后,筛选出42种小分子药物,这些药物可能是潜在的以ORM作为靶点并能发挥减肥作用的药物。中国科学院上海生命科学研究院和上海中医药大学通过合作研究这种高通量化合物筛选发现的方式,成功发现舒尼替尼作为一种新的激活褐色脂肪组织(BAT)的小分子,是治疗肥胖等相关代谢性疾病的潜在药物[11]。
本课题组下一步将对这42种小分子药物进行体内验证实验,拟使用各个药物临床实验的安全范围内的剂量,在高脂饮食(HFD)小鼠模型中给药,观察药物能否显著抵抗高脂饮食诱导的肥胖,肝脏组织和血清中ORM的含量是否被上调,以及在ORM敲除的肥胖小鼠上观察药物的效应是否消除,从而确定其ORM靶点效应。
综上所述,本课题组为ORM靶向药物提供了一个快速细胞筛选平台,并从FDA上市药物库中筛选出了靶向上调ORM的潜在治疗肥胖的药物,为下一步减肥作用的观察奠定了基础。对这些药物及其潜在机制的研究可能会为减肥药物的发现和脂肪功能的新调节途径提供新的线索。
Establishment of a high-throughput screening platform based on drug repurposing targeting alpha-1-acid glycoprotein and discovery of potential weight loss drugs
-
摘要:
目的 α1酸性糖蛋白(ORM)是减肥药物研发的新靶点。基于药物重定位,拟从已上市药物的化合物库中寻找可以靶向ORM的潜在减肥药物。 方法 构建pGL4.20-ORM1 启动子重组质粒,验证后利用慢病毒载体构建稳定表达ORM1 启动子-LUC-PURO的AML12细胞株,利用该细胞株对上市药物库中化合物进行高通量筛选,通过酶标仪对细胞的荧光值进行表征。 结果 对1 470种化合物进行初筛和复筛,发现42种化合物可以提高ORM1启动子表达,可用于进一步的减肥效应评估。 结论 通过慢病毒载体成功构建了LV-AML12-ORM1 启动子-LUC-PURO稳定表达细胞株,为高效、稳定筛选靶向ORM的减肥药物奠定了基础。 Abstract:Objective Alpha-1-acid glycoprotein (ORM) was a new target for the development of weight loss drugs. To search for potential weight loss drugs that could target ORM from the compound library of already marketed drugs based on drug repurposing. Methods The pGL4.20-ORM1 promoter recombinant plasmid was contructed and validated, and then a lentiviral vector was utilized to establish stable AML12 cell lines expressing ORM1 promoter-LUC-PURO. This cell line was employed for high-throughput screening of compounds from the marketed drug library, and the luminescence value of the cells was characterized by enzyme marker. Results Primary screening and secondary screening of 1 470 compounds identified 42 compounds that increased ORM1 promoter expression and could be used for further weight loss effect assessment. Conclusion This study successfully constructed LV-AML12-ORM1 promoter-LUC-PURO stable expression cell lines using lentiviral vectors, laying a foundation for efficient and stable screening of weight loss drugs targeting ORM. -
Key words:
- drug repurposing /
- ORM /
- high-throughput screening /
- obesity /
- weight loss drugs
-
结直肠癌,又称大肠癌,好发于大肠黏膜,是常见消化系统恶性肿瘤,早期症状不明显不易发现,晚期则表现贫血、体重减轻等。由于现代生活节奏加快及各种不良饮食、作息、环境和遗传等因素的影响,使得我国的发病率逐年增加[1]。据《中国肿瘤登记年报》内容显示:2015年我国肿瘤登记地区结直肠癌发病率和病死率分别为17.1/10万和7.9/10万,发病率男女性别比和城乡比分别为1.5和1.4,病死率分别为1.6和1.4。与年报数据接近的《中国死因监测数据集》显示,2017年我国结直肠癌病死率为6.9/10万[2]。虽然,目前已有各种化疗、外科手术、中医治疗等诊治方法,但是仍然存在早期诊查率低、预后差等问题,患者术后5年的生存率仍没有得到较大的改善,故针对结直肠癌的诊疗研究亦成为现在的热点[3]。
卡培他滨(Cap)是结直肠癌辅助化疗及一线治疗药物,通常与多西他赛、奥沙利铂、爱必妥等联合应用,常见结直肠癌化疗方案是联合奥沙利铂。Cap是前体药,体内转化成氟尿嘧啶,并在肿瘤组织中代谢为5-氟尿嘧啶,从而抑制核苷酸的合成,发挥抗肿瘤作用。肿瘤组织中5-氟尿嘧啶的浓度是血液中的100倍以上,靶向性好,不良反应轻微,且大部分患者都可耐受[4]。手足综合征(HFS)是服用Cap后出现的常见药物不良反应,多为1~2级,少数达到3级。临床主要表现为进展性症状变化,早期症状主要发生在手掌和足底,出现不同程度的瘙痒,指尖、手掌和足底充血,之后会持续发展为手掌和足底的暗红和肿胀,随后产生水泡,最终发展为脱皮,极大影响患者用药依从性及生存质量,成为后期持续治疗效果不佳的严重因素之一[5]。Cap导致HFS的发病机制尚不清楚,但病理特征表现为不同程度的细胞点片坏死、轻度的海绵状水肿、血管扩张、表皮与真皮交界处有炎性渗出。有研究表明[6-8],显微镜镜下观察到血管舒张和水肿,类似于炎症反应,而炎症发生时,活跃的炎症因子主要有白介素类中的IL-1β、IL-6、IL-10、IL-12、IL-17、IL-23,肿瘤坏死因子(TNF-α)、干扰素(IFN-γ)、C-反应蛋白(CPR)以及趋化性细胞因子(CCL-5)。因此,本研究对出现HFS的结直肠癌患者血浆中的主要炎症因子进行考察,推测其中涉及到的炎症因子,建立炎症因子含量变化与HFS发生的相关性,为Cap发生HFS的防治提供一定参考。
1. 材料和方法
1.1 一般资料
选取2018年9月至2019年2月海军军医大学附属长征医院普外科接受卡培他滨化疗方案的35例结直肠癌患者作为本次研究对象。纳入标准:①年龄≥18周岁;②经临床确诊为结直肠癌的患者;③接受了以Cap为基础的化疗;④预计生存期≥3个月,无主要器官的功能障碍;⑤有化疗指证,包括心肝肾等脏器功能正常,骨髓造血功能正常;⑥治疗前病情评估应有完整的体格检查和实验室检查,包括全血细胞计数、生化功能检查等;⑦生活质量:首次出现先写中文名(KPS)评分≥60分;⑧自愿签署知情同意书。排除标准:①孕、哺乳期患者;②5年内患过其他恶性肿瘤者;③经临床确定,对FU类药物过敏或严重代谢不良的患者;④有严重感染的患者;⑤经临床确定,患有其他会影响实验结果的恶性疾病;⑥不符合纳入标准,未按规定用药,无法判断疗效,或资料不全等影响疗效或安全性判断者。HFS事件评价标准:根据美国卫生及公共服务部2009年出版的常见不良反应事件评价标准4.0(CTCAE v4.0)分级,1级:轻微皮肤改变或皮肤炎(红斑、水肿、角化过度、不痛);2级:皮肤改变(剥落、水泡、出血、肿胀、角化过度),疼痛,影响工具性日常生活活动;3级:重度皮肤改变(剥落、水泡、出血、水肿、角化过度),疼痛,个人自理能力受限。自患者服用Cap后进行临床观察,直到患者出现HFS后停止,收集患者出现HFS时的血液样本,采用EDTA-3K抗凝管采集血样,储存于−80 ℃冰箱冻存。本研究经过海军军医大学附属长征医院伦理委员会批准,35例患者基本信息及HFS信息见表1。
表 1 患者一般资料及HFS分级情况例数 性别 年龄(岁) 肿瘤部位 HFS分级 男 女 均值 中位数 直肠 结肠 未发生 1级 2级 3级 35 23 12 55.9 61 14 21 12 16 3 4 (65.7%) (34.3%) — — (29.9%) (70.1%) (34.2%) (45.7%) (8.5%) (11.4%) 1.2 仪器和耗材
Human IL-6 ELISA kit试剂盒、 Human IL-1β ELISA kit试剂盒、Human IL-10 ELISA kit试剂盒、Human IL-12p70 ELISA kit试剂盒、Human IL-17/IL-17A ELISA kit试剂盒、Human IL-23 ELISA kit试剂盒、Human IFN-γ ELISA kit试剂盒、Human CRP ELISA kit试剂盒、Human TNF-α ELISA kit试剂盒以及Human RANTES ELISA kit试剂盒均购自国润医疗供应链服务(上海)有限公司。酶标仪(Biotek,型号:800TSI)购自美国伯腾仪器(北京代表处)有限公司。37 ℃孵箱(型号:FYL-YS-151L,温度:0 ℃~100 ℃)由北京福意电器有限公司提供。
1.3 炎症因子指标检测方法
参照试剂盒说明书测定35例结直肠癌患者服用卡培他滨后血浆中各炎症因子包括白介素类中的IL-1β、IL-6、IL-10、IL-12、IL-17、IL-23, TNF-α,IFN-γ,CPR和CCL-5含量水平。将血液样本4 000 r/min离心15 min, 收集血浆样本,按照试剂盒说明书测定各炎症因子的含量。
1.4 统计学方法
使用 Microsoft Excel 软件进行统计结果分析,采用Graphpad Prism 8.3.0作图。
2. 结果
2.1 标准曲线
IL-23标准曲线的浓度为2 000、1 000、500、250、125、62.5、31.25 pg/ml;IFN-γ、IL-17、TNF-α、IL-12标准曲线的浓度为1 000、500、250、125、62.5、31.25、15.6 pg/ml;CCL-5、IL-1β的标准曲线的浓度为500、250、125、62.5、31.25、15.6、7.8 pg/ml;IL-6、CRP的标准曲线的标准品浓度为200、150、50、25、12.5、6.25、3.125 pg/ml;IL-10的标准曲线的浓度为50、25、12.5、6.25、3.125、1.56、0.78 pg/ml。各炎症因子标准曲线呈现良好线性关系,可为样本的检测提供阳性对照,见表2。
表 2 炎症因子线性范围及标准曲线炎症因子 线性范围pg/ml 标准曲线 r IL-23 0~2 000 Y=594.66X−23.268 0.994 8 IFN-γ 0~1 000 Y=384.31X+7.9709 0.999 3 IL-17 Y=1379X−12.849 0.997 9 TNF-α Y=352.02X+5.7229 0.999 7 IL-12 Y=448.55X+8.5172 0.994 6 CCL-5 0~500 Y=168.42X−12.215 0.997 2 IL-1β Y=206.82X−4.5823 0.999 6 IL-6 0~200 Y=67.278X−6.6851 0.996 7 CRP Y=90.523X -3.228 0.990 5 IL-10 0~50 Y=27.541X−0.403 0.997 5 2.2 样本实测
35例服用Cap后未发生与发生各级HFS的两类结直肠癌患者,其血浆中各炎症因子含量水平见表3。结果显示,不同级别的HFS各炎症因子含量存在一定的差异性,提示Cap诱发HFS会导致血浆中不同炎症因子相互作用发生级联反应。其中,TNF-α 的含量水平在发生HPS呈整体下调状态,且明显低于未发生者的含量水平。其余炎症因子含量水平变化则无规律可循(图1)。
表 3 不同分级HFS患者中的各炎症因子含量测定结果(pg/ml,$\bar x $ ±s)炎症因子 未发生 1级 2级 3级 浓度平均值 标准差 浓度平均值 标准差 浓度平均值 标准差 浓度平均值 标准差 IL-1β 83.64 203.67 60.98 180.17 8.96 5.03 303.17 303.50 IL-6 19.57 52.35 12.29 31.84 4.68 0.34 22.60 25.96 IL-10 8.280 17.19 10.53 26.67 0.17 0.11 0.10 0.03 IL-12 67.80 148.40 99.40 282.18 22.87 9.42 195.11 250.89 IL-17 316.96 807.82 413.09 1118.61 76.79 46.93 905.52 1361.64 IL-23 218.06 566.46 190.55 542.33 12.11 5.95 663.67 911.80 IFN-γ 89.87 248.25 77.82 209.39 17.36 5.01 274.05 392.16 CRP 52.99 85.03 65.77 91.81 6.91 3.49 157.98 114.55 TNF-α 221.01 461.14 58.98 186.95 2.67 2.51 2.64 1.54 CCL-5 98.11 30.01 87.84 20.60 101.78 19.20 85.93 15.49 注:未发生HFS 12例;1级HFS 16例;2级HFS 3例;3级HFS 4例 3. 讨论
随着结直肠癌发病率的上升,Cap的临床应用越来越广泛,其带来的不良反应也急剧增加,其中,HFS严重影响患者生活质量以及用药依从性,更甚者则终止治疗,故必须对Cap诱发HFS进行药学监护[9-10]。临床常见的监护策略主要有减少给药剂量、中断药物治疗以及使用其他药物(如塞来昔布胶囊200 mg,po,bid +尿素乳膏涂抹患处,tid)干预HFS严重程度等方法。肿瘤坏死因子(TNF-α)是机体重要的炎性细胞因子之一,具有多生物学效应及生理病理性功能,且TNF-α在HFS发生的不同程度时血浆中含量有显著变化,推测TNF-α 血浆中含量水平越低发生HFS的程度越严重,并在进行药学监护时具有一定参考价值。
本实验以HFS为主要研究方向,对患者血浆中炎症因子进行检测,结果发现Cap诱发不同程度HFS血浆中的炎症因子含量有一定的差异性。由于临床化疗治疗医生很少让患者的HFS进展到2、3级再进行处理,所以患者例数较少,数据不能支撑比较。但对未发生与1级HFS比较发现,1级HFS患者血浆中IL-1β、IL-6、IL-23、IFN-γ、TNF-α、CCL-5的含量明显低于未发生HFS患者;而IL-10、IL-12、IL-17、CRP血浆中含量明显高于未发生HFS患者,且TNF-α浓度水平变化较为明显。目前,Cap诱发HFS的发生机制尚不清楚,可能是多途径炎症因子相互作用的结果。因此,关注定血浆炎症因子含量水平变化,在一定程度上可以反应Cap诱导HFS的严重程度,通过测定血浆中炎症因子含量的变化,有利于防治Cap诱发HFS情况,并对临床有重要的指导意义。
-
表 1 ORM1 启动子基因引物序列
引物名称 引物序列(5′—3′) ORM1-F GGGGTACCGTTCTCAGCATGTTGCATAAAT ORM1-R CCAAGCTTGCTGAGGGCACTCAGAGC 注:F: 正向引物; R: 反向引物。 表 2 LV-ORM1 启动子-LUC-PURO基因引物序列
引物名称 引物序列(5′—3′) LV-ORM1
启动子-LUC-PURO-FGGACAGCAGAGATCCAGTTTATCGATGTTCTCAGCATGTTGCATAAATT LV-ORM1
启动子-LUC-PURO-RGAGCGATCGCAGATCCTTAGGATCCTTACACGGCGATCTTGCCGCCCTT 注:F: 正向引物; R: 反向引物。 表 3 qPCR引物设计序列
引物名称 引物序列(5′—3′) Luciferase-F CGCACATATCGAGGTGGACA Luciferase-R GCAAGCTATTCTCGCTGCAC mGapdh-F GTCAAGGCCGAGAATGGGAA mGapdh-R CTCGTGGTTCACACCCATCA 注:qPCR: 实时荧光定量聚合酶链式反应; mGapdh:小鼠甘油醛-3-磷酸脱氢酶; F: 正向引物; R: 反向引物。 -
[1] SERAVALLE G, GRASSI G. Obesity and hypertension[J]. Pharmacol Res, 2017, 122:1-7. doi: 10.1016/j.phrs.2017.05.013 [2] ALPERT M A, OMRAN J, BOSTICK B P. Effects of obesity on cardiovascular hemodynamics, cardiac morphology, and ventricular function[J]. Curr Obes Rep, 2016, 5(4):424-434. doi: 10.1007/s13679-016-0235-6 [3] TWIG G, YANIV G, LEVINE H, et al. Body-mass index in 2.3 million adolescents and cardiovascular death in adulthood[J]. N Engl J Med, 2016, 374(25):2430-2440. doi: 10.1056/NEJMoa1503840 [4] WOLFE B M, KVACH E, ECKEL R H. Treatment of obesity: weight loss and bariatric surgery[J]. Circ Res, 2016, 118(11):1844-1855. doi: 10.1161/CIRCRESAHA.116.307591 [5] BLÜHER M. Obesity: global epidemiology and pathogenesis[J]. Nat Rev Endocrinol, 2019, 15(5):288-298. doi: 10.1038/s41574-019-0176-8 [6] SQUADRITO F, ROTTURA M, IRRERA N, et al. Anti-obesity drug therapy in clinical practice: evidence of a poor prescriptive attitude[J]. Biomed Pharmacother, 2020, 128:110320. doi: 10.1016/j.biopha.2020.110320 [7] RUAN Y, XIANG K F, ZHANG H M, et al. Orosomucoid: a promising biomarker for the assessment of exercise-induced fatigue triggered by basic combat training[J]. BMC Sports Sci Med Rehabil, 2022, 14(1):100. doi: 10.1186/s13102-022-00490-6 [8] 徐栋平. 急性期蛋白ORM在缺血性脑卒中的保护作用及其机制研究[D]. 上海: 第二军医大学, 2018. [9] SUN Y, YANG Y L, QIN Z, et al. The acute-phase protein orosomucoid regulates food intake and energy homeostasis via leptin receptor signaling pathway[J]. Diabetes, 2016, 65(6):1630-1641. doi: 10.2337/db15-1193 [10] KORT E, JOVINGE S. Drug repurposing: claiming the full benefit from drug development[J]. Curr Cardiol Rep, 2021, 23(6):62. doi: 10.1007/s11886-021-01484-5 [11] QIU Y, SUN Y M, XU D Q, et al. Screening of FDA-approved drugs identifies sutent as a modulator of UCP1 expression in brown adipose tissue[J]. EBioMedicine, 2018, 37:344-355. doi: 10.1016/j.ebiom.2018.10.019 -





 下载:
下载:
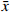
 下载:
下载: