-
夏枯草消瘤合剂由中药夏枯草、牡蛎、生地黄、莪术、苍术、白术组成,是中医肿瘤学专家钱伯文教授的经验方。方中诸药配伍,以达化痰软坚,活血化瘀,补养气血的功效。其临床实验研究已证实,该药配合一线化疗方案治疗中晚期非小细胞肺癌患者,有助于提高患者的生存治疗和减少化疗所产生的毒副作用[1]。由该方制成的合剂在我院临床使用多年,前期研究对于组方中化学成分的研究仍限于迷迭香酸、咖啡酸的稳定性研究[2]。尽管方中一些单味药的化学成分已有报道[3-18],但是整个复方制剂的化学成分未见报道。由于组分的复杂性,复方的成分分析比单味药更具有挑战性,明确夏枯草消瘤方色谱图中各个色谱峰归属对于该复方的质量控制及体内深入研究具有重要意义。
高效液相-高分辨飞行时间质谱(HPLC-TOF/MS)串联技术对于中药复杂体系中化学成分分析和鉴定非常有效。其灵敏度高、操作简便、耗时短,可以在短时间获得化合物准确的相对分子质量,通过与所建立的已知化学成分数据库比对,可以快速的对被测成分进行分析鉴别[19-20]。因此,本文采用HPLC-TOF/MS技术,首次对夏枯草消瘤方中化学成分进行鉴别,并且对各成分进行药材归属,以进一步阐明夏枯草消瘤方的化学物质基础。
-
Agilent 1100系列高效液相色谱仪(美国安捷伦公司),配有在线脱气机、四元泵、自动进样器、柱温箱和二级管阵列检测器;Agilent 6220高分辨飞行时间质谱仪(美国安捷伦公司),配有标准电子喷雾离子源(ESI);分析软件为 MassHunter 数据采集在线工作站和Qualiative Analysis 离线分析软件。
-
咖啡酸(批号:110885-200102,纯度>98.5%)、迷迭香酸(批号:111871-201505,纯度>98.5%)对照品,均购自中国食品药品检定研究院,甲醇和甲酸为色谱纯(Fisher,USA),其余试剂均为分析纯,水为纯水。
夏枯草、生地黄、莪术、麸炒苍术、麸炒莪术、牡蛎、煅牡蛎均由上海中医药大学附属岳阳中西医结合医院中药房提供(见表1)。药材及饮片均经第二军医大学药学院生药学教研室黄宝康教授鉴定。
表 1 药材信息
药材名称 批号 药材来源 夏枯草 180207 上海康桥药业有限公司 生地黄 180302 上海同济堂药业有限公司 莪术 180306 上海虹桥中药饮片有限公司 麸炒白术 2018031001 上海上药华宇药业有限公司 麸炒苍术 180407 上海虹桥中药饮片有限公司 牡蛎 2017102006 上海上药华宇药业有限公司 煅牡蛎 180301 上海同济堂药业有限公司 -
分别精密称取咖啡酸、迷迭香酸对照品3.22、5.68 mg置10 ml量瓶中,加甲醇稀释定容,配成浓度分别为322、568 μg/ml的母液,精密吸取母液 1 ml 置于 10 ml 量瓶,加甲醇定容后,即得对照品溶液。
-
精密称取夏枯草4.2 g、牡蛎8.4 g、煅牡蛎8.4 g、地黄4.2 g、莪术4.2 g、白术(麸炒)2.1 g、苍术(麸炒)2.1 g,以上七味,充分润湿,分别加8倍量与4倍量水煎煮两次,每次煮沸后于85 ℃保温20 min,煎液滤过,合并滤液,滤液浓缩至相对密度1.10以上(80 ℃),离心,取上清液;精密吸取夏枯草消瘤方溶液上清液5 ml,置于50 ml容量瓶中,加甲醇定溶,摇匀,经0.22 μm微孔滤膜滤过,取续滤液,即得夏枯草消瘤方样品溶液。
-
色谱柱:ACE C18(3.0 mm×150 mm),流动相A相为甲醇,B相为水(含0.1%甲酸),梯度洗脱:0~5 min:5%A,5~10 min:5%~15%A,10~30 min:15%~45%A,30~40 min:45%~70%B,40~50 min:70%~90%B;进样量2 μl,流速为0.4 ml/min;柱温为25 ℃;运行时间为50 min。
-
采用ESI离子源,正、负离子模式均进行检测,雾化器为高纯氮气,具体参数如下:正离子模式:毛细管电压3500 V,干燥器温度350 ℃,干燥器流速10L/min,雾化器压力40 psig,碎片电压160 V;参比离子m/z121.9856,1033.9881;扫描范围m/z100-1200。测定样品之前,使用调谐液校准质量轴,以保证质量精度误差小于1×10-6。
-
根据国内外专业数据库中科院化学专业数据库、Pubmed、Chemspider等,以及国内外相关研究文献,收集了夏枯草消瘤合剂方中六味中药化学成分名称及分子式共760个。采用安捷伦“formula-database generator”软件(含各元素精确质量数),根据各成分碳、氢、氧的个数,计算精确相对分子质量、M+H和M-H准分子离子峰相对分子质量的相应的化学成分数据库。
-
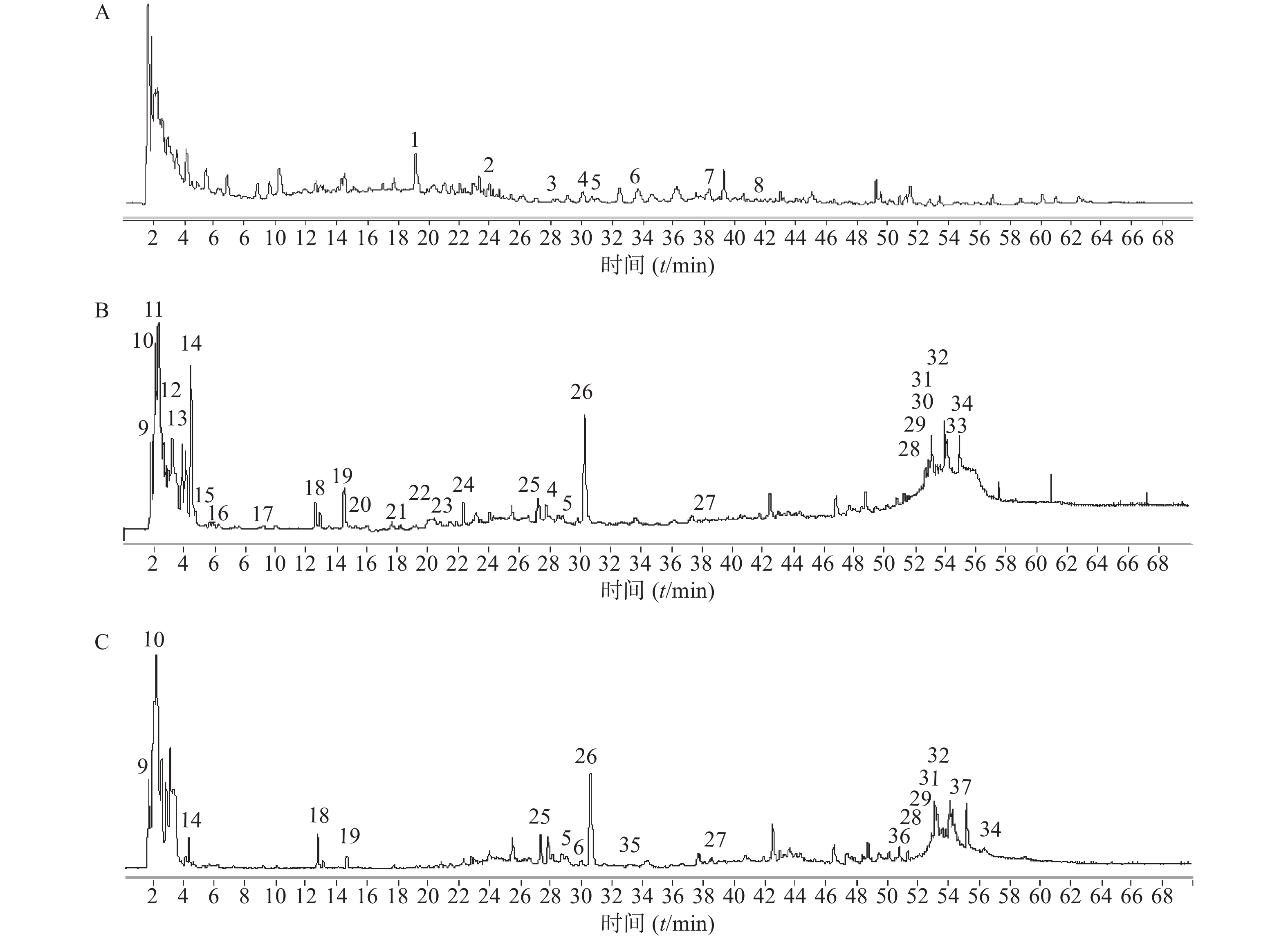
夏枯草消瘤方样品溶液的总离子流图见图1。其中图1A为正离子160 V模式,图1B为负离子160 V模式,图1C为负离子260 V模式。
-
实验中利用已有的2个对照品,在负离子模式、碎片电压160 V条件下,无偏差的鉴别出咖啡酸、迷迭香酸,对照品总离子流图见图2。
-
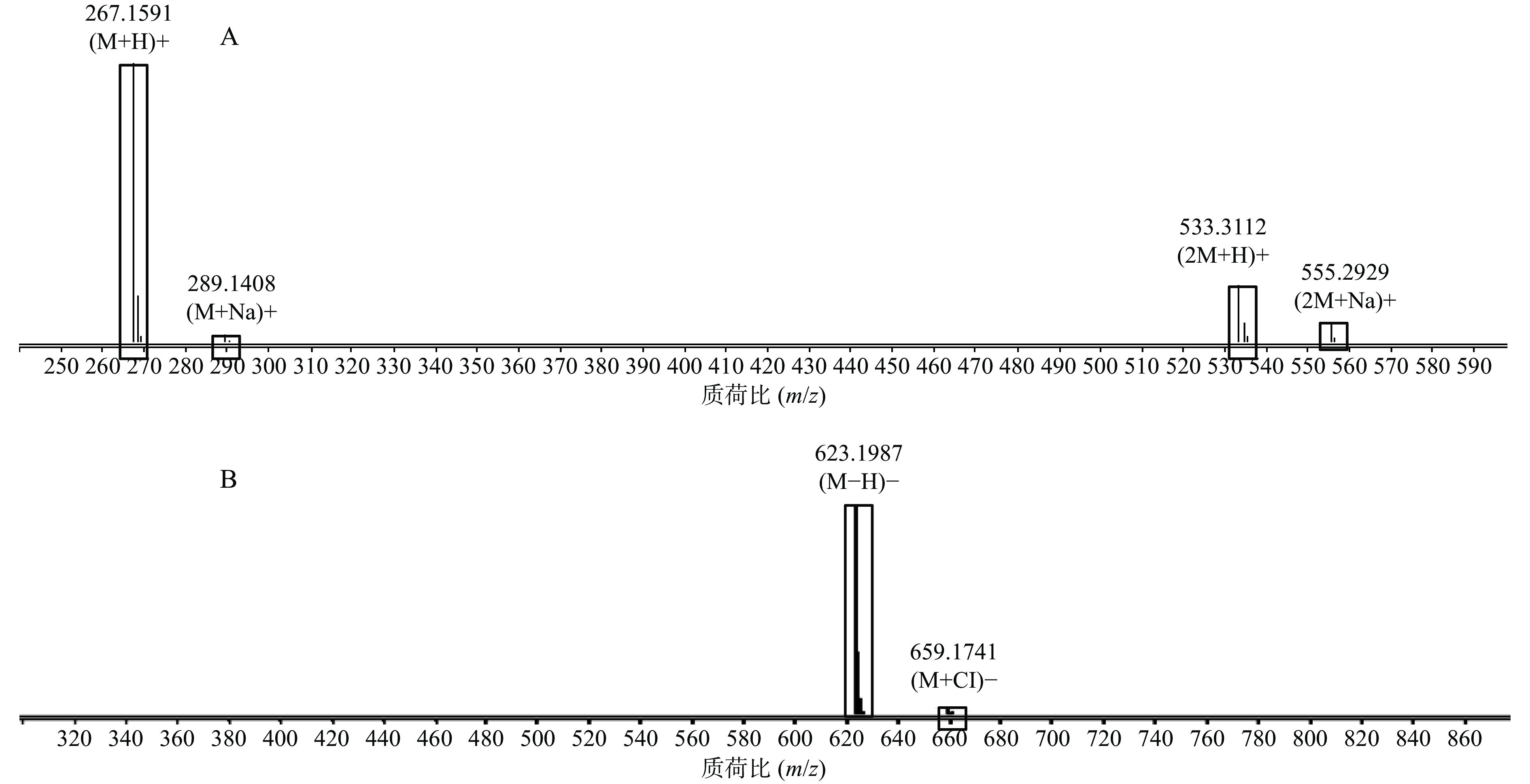
正离子模式下以图1中2号峰疣孢酚为例,说明夏枯草消瘤方色谱峰的鉴别过程。保留时间为24.032 min,色谱图中的准分子离子为267.1591。利用Qualiative Analysis数据分析软件的计算功能计算精确质量数的可能元素组成(5×10−6),并比对数据库中已知化合物的质荷比,初步确定元素组成为C15H22O4,为疣孢酚的(M+H)+。计算该准分子离子的核素分布情况,从图3A可以看出同位素分布的理论值(方框所示)与实际值(方框内峰所示)吻合良好,确定此峰为疣孢酚。同理可得负离子模式下图1中18号峰,地黄苷D的解析过程(图3B)。
-
根据飞行时间质谱测得精确的相对分子质量,比对所建立的数据库,应用Qualiative Analysis 质谱分析软件计算分子组成,将理论值与实测值进行比对,结合上述对照品鉴别结果及相关文献报道,对夏枯草消瘤合剂中药材在正、负离子模式下所得色谱图中色谱峰进行分析,初步鉴别出37个化学成分,结果见表2、表3。对于部分未见区分的同分异构体,后期可考虑调节碎片电压获得化合物的裂解规律进行区分。
表 2 夏枯草消瘤合剂中化学成分的正离子模式鉴别结果
序号 相对时间(min) 化合物 分子式 M+H 实验值(m/z) 理论值(m/z) 误差(×10–6) 来源 1 19.174 7-羟基异喹啉 C9H7NO [M+H]+ 146.060 8 146.052 8 –0.72 地黄. 2 24.032 Verrucarol C15H22O4 [M+H]+ 267.159 1 267.151 8 0.06 莪术 3 28.388 白术内酯Ⅱ C15H20O2 [M+H]+ 233.153 3 233.146 3 1.49 白术. 41) 30.653 芦丁 C27H30O16 [M+H]+ 611.160 8 611.153 4 –0.27 夏枯草 51) 30.703 槲皮素-3-O-β-D-葡萄糖苷 C21H20O12 [M+H]+ 465.102 9 465.095 5 –0.25 夏枯草 61) 33.713 伞形酮 C9 H6 O3 [M+H]+ 163.038 7 163.031 7 1.54 夏枯草 7 38.337 白术内酯Ⅲ C15H20O3 [M+H]+ 249.148 2 249.141 2 2.05 白术 81) 41.969 十四烷基柠檬酸 C20H36O7 [M+H]+ 389.252 9 389.246 1 1.31 白术 注:1)表示正负模式下测得 表 3 夏枯草消瘤合剂中化学成分的负离子模式鉴别结果
序号 相对时间(min) 化合物 分子式 M+H 实验值(m/z) 理论值(m/z) 误差(×10–6) 来源 91) 1.999 精氨酸 C6H14N4O2 (M-H)– 173.104 3 173.111 7 0.56 地黄 101) 2.109 葡萄糖酸 C6H12O7 (M-H)– 195.051 1 195.058 3 –0.23 夏枯草 11 2.789 苹果酸 C4H6O5 (M-H)– 133.014 3 133.021 5 –0.61 夏枯草 12 2.842 柠檬酸 C7H12O6 (M-H)– 191.019 5 191.027 0 1.04 夏枯草 13 3.305 二氢梓醇 C15H24O10 (M+CHO2)– 409.134 8 409.136 9 0.88 地黄 141) 4.441 梓醇 C15H22O10 (M+CHO2)– 407.118 8 407.121 2 2.01 地黄 15 4.724 尿嘧啶核苷 C9H12N2O6 (M-H)– 243.062 2 243.069 5 0.43 地黄 16 5.869 络氨酸 C9H11NO3 (M-H)– 180.066 4 180.073 9 1.28 地黄 17 9.186 鸟苷 C10H13N5O5 (M-H)– 282.084 1 282.091 7 1.12 地黄 181) 12.586 地黄苷D C27H42O20 (M+CHO2)– 731.225 6 731.226 9 –0.57 地黄 191) 14.46 丁香酸 C9H10O5 (M-H)– 197.045 3 197.052 8 1.48 地黄 20 14.562 益母草苷 C15H24O9 (M+Cl)– 383.111 1 383.642 0.88 地黄 21 18.189 原儿茶酸 C7H6O3 (M-H)– 137.024 5 137.031 7 –0.75 夏枯草 22 19.253 2, 3-二氢 -7-甲氧基-4 -甲基 -1H-1,
5 -苯并二氮卓 -2-酮C11H12N2O2 (M-H)– 203.082 5 203.089 9 0.52 苍术 23 21.839 地黄苦苷 C16H26O8 (M-H)– 345.155 3 345.162 8 0.41 地黄 24 22.327 咖啡酸 C9H8O4 (M-H)– 179.035 1 180.049 5 –0.9 白术 251) 27.255 异迷迭香酸苷 C24H26O13 (M-H)– 521.130 8 521.137 3 –1.42 夏枯草 42) 28.487 芦丁 C27H30O16 (M-H)– 609.146 1 609.153 4 0.08 夏枯草 52) 28.61 槲皮素-3-O-β-D-葡萄糖苷 C21H20O12 (M-H)– 463.088 1 463.095 5 0.26 夏枯草 261) 30.296 迷迭香酸 C18H16O8 (M-H)– 359.077 2 359.084 5 0.18 夏枯草 271) 38.237 异地黄苷 C31H40O15 (M-H)– 651.229 1 651.236 7 0.59 地黄 281) 52.394 表莪术酮 C15H28O2 (M-H)– 239.201 4 239.208 9 1.07 莪术 291) 52.687 肉豆蔻酸 C14H28O2 (M-H)– 227.201 7 227.208 9 –0.12 夏枯草 301) 52.748 熊果酸 C30H48O3 (M-H)– 455.353 455.306 3 0.17 夏枯草 311) 53.606 亚油酸 C18H32O2 (M-H)– 279.232 8 279.240 2 0.55 夏枯草 321) 53.911 软脂酸 C16H32O2 (M-H)– 255.233 4 255.240 2 –1.71 夏枯草 33 54.095 油酸 C18H34O2 (M-H)– 281.249 0 281.255 9 –1.43 夏枯草 341) 54.92 硬脂酸 C18H36O2 (M-H)- 283.264 5 283.271 5 –0.93 苍术 35 33.114 6-0-E阿魏酰基筋骨草醇 C25H32O12 (M-H)– 523.181 7 523.189 4 0.73 地黄 36 51.355 麝香草酚 C10H14O (M-H)– 149.097 1 149.104 5 0.28 夏枯草 37 54.305 11-十八烯酸- C18H34O2 (M-H)– 281.248 6 282.225 9 0.09 夏枯草 注:1)表示负模式下碎片电压160V和260V测得;2)表示正负模式下测得。 -
对色谱条件的摸索,考察了甲醇-水、乙腈-水系统,发现甲醇的洗脱效果优于乙腈,且各色谱峰分离效果更好,加入0.1%甲酸可以改善峰型,并提高质谱响应,故采用甲醇-0.1%甲酸水为流动相。由于本组方含有药材较多,组方内所含成分比较复杂,因此选择大梯度洗脱,以期最大程度地得到其中的化合物保留。质谱检测比较了正、负离子两种扫描模式,由于组方中所含多种化合物响应模式各有不同,因此,选择正、负离子两种扫描模式同时进行监测。对于碎片电压的选择,本方中大部分化学成分在160 V时以准分子离子峰形式稳定存在,有少量化学成分在负离子模式下260V时以准分子离子峰形式稳定存在,图谱本底较低,因此选择160 V、260 V的碎片电压可以最大限度地对复方中的成分进行鉴别。
-
本研究运用 HPLC-TOF/MS 技术快速鉴别夏枯草消瘤合剂中37种化学成分,其中正离子模式碎片电压160 V条件下8个;负离子模式碎片电压160 V条件下28个,碎片电压260 V条件下19个;正负离子均有响应4个,负离子模式两种碎片电压下均有响应16个,并对成分进行了药材归属。该方法在传统的植物化学分离提取基础上对色谱峰进一步明确化,为夏枯草消瘤方的质量控制、体内的深入研究及临床应用奠定了良好的基础。
Identification of chemical constituents of Xiakucao Xiaoliu mixture by HPLC-TOF/MS
-
摘要:
目的 应用高效液相-高分辨飞行时间质谱(HPLC-TOF/MS)技术鉴别夏枯草消瘤方的化学成分。 方法 色谱分离采用ACE(3.0 mm×150 mm)色谱柱;流动相为甲醇(A)和0.1%甲酸水(B),梯度洗脱:0~5 min:5%A,5~10 min:5%~15%A,10~30 min:15%~45%A,30~40 min:45%~70%B,40~50 min:70%~90%B;进样量2 μl,流速为0.4 ml/min;柱温为25 ℃。质谱定性采用飞行时间质谱,采用ESI离子源,正、负离子模式共同监测,参比离子m/z 121.9856,1033.9881;扫描范围m/z 100-1200。 结果 共鉴别出夏枯草消瘤方中37种化学成分,正离子模式碎片电压160 V条件下8个;负离子模式碎片电压160 V条件下28个,碎片电压260 V条件下19个;正负离子均有响应4个,负离子模式两种碎片电压下均有响应16个,并对成分进行了药材归属。 结论 建立了一种基于HPLC-TOF/MS技术对夏枯草消瘤方的化学成分进行鉴别的有效方法,为其质量控制及体内的深入研究奠定了基础。 -
关键词:
- 夏枯草消瘤方 /
- 化学成分 /
- 鉴别 /
- 高效液相-高分辨飞行时间质谱
Abstract:Objective To identify the chemical constituents of Xiakucao Xiaoliu mixture by high performance liquid chromatography-high resolution time-of-flight mass spectrometry (HPLC-TOF/MS). Methods The chromatographic separation ACE (3.0mm×150 mm) column was used. The mobile phase was methanol (A) and 0.1% formic acid (B). The gradient elution was: 0-5 min, 5% A; 5-10 min, 5%-15% A; 10-30 min, 15%-45%A; 30-40 min, 45%-70%B; 40-50 min, 70%-90%B. The injection volume was 2 μl. The flow rate was 0.4 ml/min. The column temperature was 25°C. The mass spectrometry was characterized by time-of-flight mass spectrometry, using ESI ion source. The common monitoring was in positive and negative ion mode. The reference ion was m/z 121.9856, 1033.9881. The scanning range was m/z 100-1200. Results A total of 37 chemical constituents were identified in the Xiakucao Xiaoliu mixture, 8 in the positive ion mode fragment voltage of 160 V, 28 in the negative ion mode fragment voltage of 160 V, and 19 in the fragment voltage of 260 V. Both positive and negative ions had 4 responses. The negative ion mode has 16 responses under both fragment voltages. And the ingredients were medicinal. Conclusion An effective method for the identification of the chemical constituents of Prunella vulgaris L. by HPLC-TOF/MS was established, which laid a foundation for its quality control and in-depth study in vivo. -
光动力治疗(PDT)基于光辐照聚集光敏剂的肿瘤组织,由光敏剂诱发光动力反应形成单线态氧(1O2)等活性氧(ROS),通过对肿瘤细胞和肿瘤血管的直接杀伤及激活机体系统免疫反应等多种机制发挥抗肿瘤作用[1-3]。二氢卟吩及菌绿素类光敏剂是PDT新药研究的热点[4-8]。其中,已获批上市的代表药物有他拉泊芬(talaporfin)和帕利泊芬(padeliporfin)等[9, 10]。
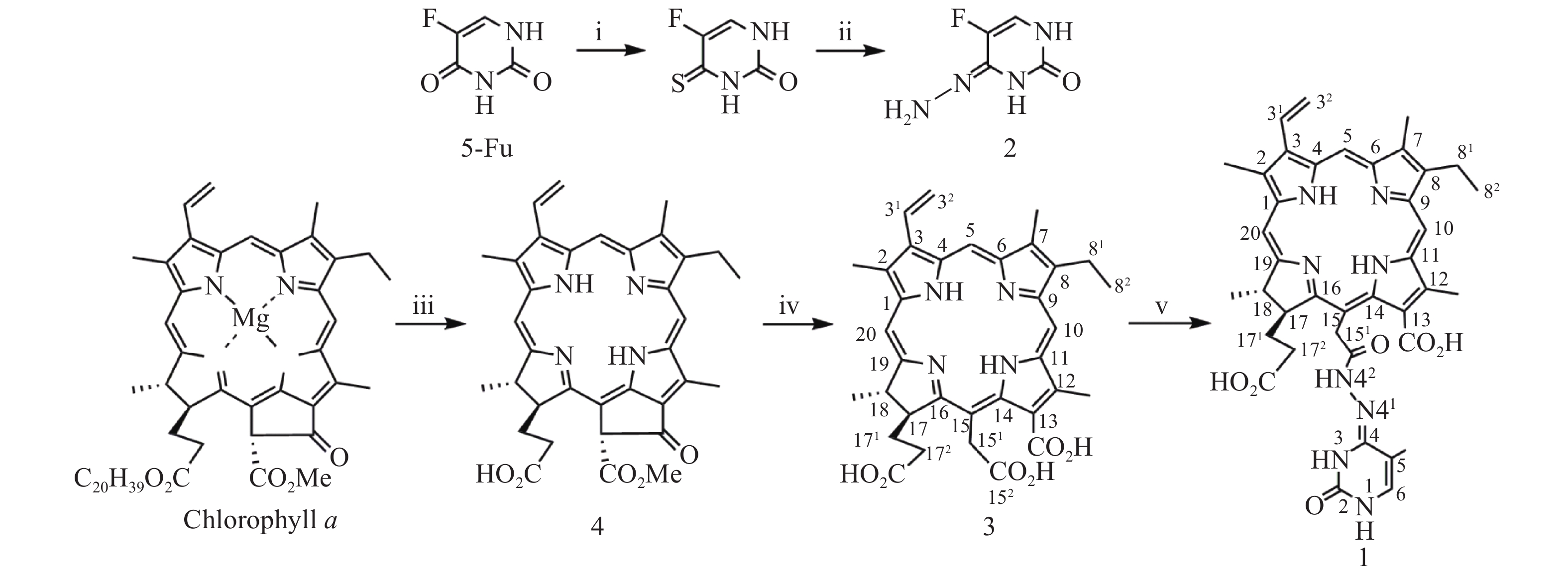
光敏剂作为结构非特异性药物,存在缺乏肿瘤靶向性摄入和明确的作用药靶等缺陷。此外,PDT受制于局部治疗,对浸润较深的肿瘤组织,及已发生转移的肿瘤疗效有限。目前,PDT和化疗联用是克服上述缺陷,提高PDT疗效最为普遍和有效的策略之一。研究表明,抗代谢化疗药物氟尿嘧啶(5-Fu)与PDT联用具有协同抗肿瘤作用[11-13]。据此,我们设想利用在肿瘤微环境下能响应性断裂的连接基团(linker)将光敏剂与化疗药物偶联,希望实现二者在肿瘤组织的靶向释放,从而发挥其PDT和化疗协同抗肿瘤作用。酰腙键是酸敏感化学键,常被用来连接载体,以药物制备智能药物载体。这种药物载体到达肿瘤细胞的内涵体或溶酶体中时,会发生酸性水解将药物有效释放出来。因此,本文针对肿瘤微环境呈弱酸性的特点,采用药物化学最经典的前药设计策略,以脱镁叶绿素a(Phephorbide a)粗提物经酸碱降解制得的二氢卟吩e6(3)[14]为先导光敏剂,通过其152-羧基与抗肿瘤药物5-Fu以酸敏感酰腙键连接,设计合成pH响应型光化疗协同抗肿瘤光敏剂二氢卟吩e6-偕氟尿嘧啶(1),并考察其体外PDT抗肿瘤活性和pH响应性5-Fu释放,及其对黑色素瘤B16-F10和肝癌HepG2细胞的光动力抗癌活性及其作用机制,以期获得高效、低毒的PDT治癌药物候选药物,合成路线见图1。
1. 化学合成
1.1 仪器与试剂
用Bruker MSL-600型核磁共振仪测定1H NMR,CD3OD为溶剂;用API-3000 LC-MS型电喷雾质谱仪测定质谱(ESI-MS);用岛津UV-160型紫外分光光度计测定UV吸收谱;用日立F-7000荧光分光光度计测定荧光发射谱;用Shimazu LC-20AD HPLC仪测定化合物1的相对纯度及其5-Fu的体外释放。色谱柱型号为Waters Xterra C18柱,流动相:乙腈-0.3%乙酸水溶液(80 : 20);流速:1.0 ml/min;检测波长:400 nm(化合物1的相对纯度)或254 nm(5-Fu释放);柱温:30 ℃;进样量:20 μl。柱色谱分离用TELEDYNE ISCO的快速制备色谱Combi Flash@Rf+仪,硅胶H作为固定相。PDT抗癌活性测试使用BWT半导体激光仪(北京凯普林,波长为660 nm);用流式细胞仪(BD Accuri C6,美国)(激发波长:488 nm,发射波长:525 nm)检测受试肿瘤细胞样品的ROS水平、细胞凋亡率和细胞周期阻滞。
二氢卟吩e6(3)按照文献[14]的方法制备;其它实验用材料和化学试剂均为市售商品。
1.2 42-N-(二氢卟吩 e6-152-酰基)-5-氟尿嘧啶-4-腙(1)的合成
取氟尿嘧啶(0.2 g,1.563 mmol)溶于无水吡啶(10 ml),加入五硫化二磷(0.298 g,1.563 mmol),加热回流12 h。反应完毕,减压回收溶剂,残物加乙酸乙酯溶解(100 ml),用0.1 mol/L HCl洗涤(50 ml×2),无水Na2SO4干燥,减压除去溶剂得4-硫代-5-氟尿嘧啶粗品。上述4-硫代-5-氟尿嘧啶粗品加甲醇(10 ml)溶解,于0 ℃下滴加N2H4·H2O(0.316 g,6.252 mmol),室温继续搅拌2 h。反应完毕,减压抽滤,P2O5真空干燥得固体化合物5-氟尿嘧啶-4-腙(2)中间体,直接用于下步反应。取二氢卟吩e6(0.1 g,0.168 mmol)溶于无水DMF(10 ml),加1-乙基-(3-二甲氨基丙基)碳二亚胺盐酸盐(EDC·HCl)(0.035 g,0.183 mmol),室温搅拌反应6 h后再加入中间体2(0.031 g,0.218 mmol),继续搅拌36 h。反应完毕,反应液加入10倍体积量乙酸乙酯,饱和NaCl水溶液洗涤(50 ml×3),无水Na2SO4干燥,减压回收溶剂所得固体经快速制备色谱梯度洗脱分离纯化(流动相为二氯甲烷/甲醇/甲酸=15∶1∶0.1~8∶1∶0.1)得黑色固体1纯品0.048 g,产率39.6%。UV-vis λmax (MeOH, nm) (ε, M−1cm−1):660 (3.15×104), 510 (0.82×104), 402 (8.13×104)。1H-NMR (600 MHz, CD3OD, δ, ppm): 9.79 (s, 1H, 10-CH), 9.73 (s, 1H, 5-CH), 9.07 (s, 1H, 20-CH), 8.19 (dd, J = 18.0, 12.0 Hz, 1H, 31-CH), 7.29 (s, 1H, 5-Fu的6-CH), 6.38 (d, J = 18.0 Hz, 1H, 32-CHB), 6.15 (d, J = 12.0 Hz, 1H, 32-CHA), 5.35 (s, 2H, 151-CH2), 4.65 (m, 2H, 17-CH和18-CH), 3.84 (q, J = 7.5 Hz, 2H, 81-CH2), 3.63 (s, 3H, 12-CH3), 3.53 (s, 3H, 2-CH3), 3.30 (s, 3H, 7-CH3), 2.3~2.0 (m,4H , 171-CH2 和172-CH2), 1.76 (m, 6H¸ 18-CH3和82-CH3)。MS (ESI+) m/z: 723.63 (M+H)+ (100%)。元素分析(C38H39N8O6F,%)计算值:C 63.16, H 5.40, N 15.48;实测值:C 63.34, H 5.38, N 15.43。HPLC测定纯度:95.2%。
2. 体外光理化性质和光生物活性
2.1 化合物1的紫外吸收谱和荧光发射谱
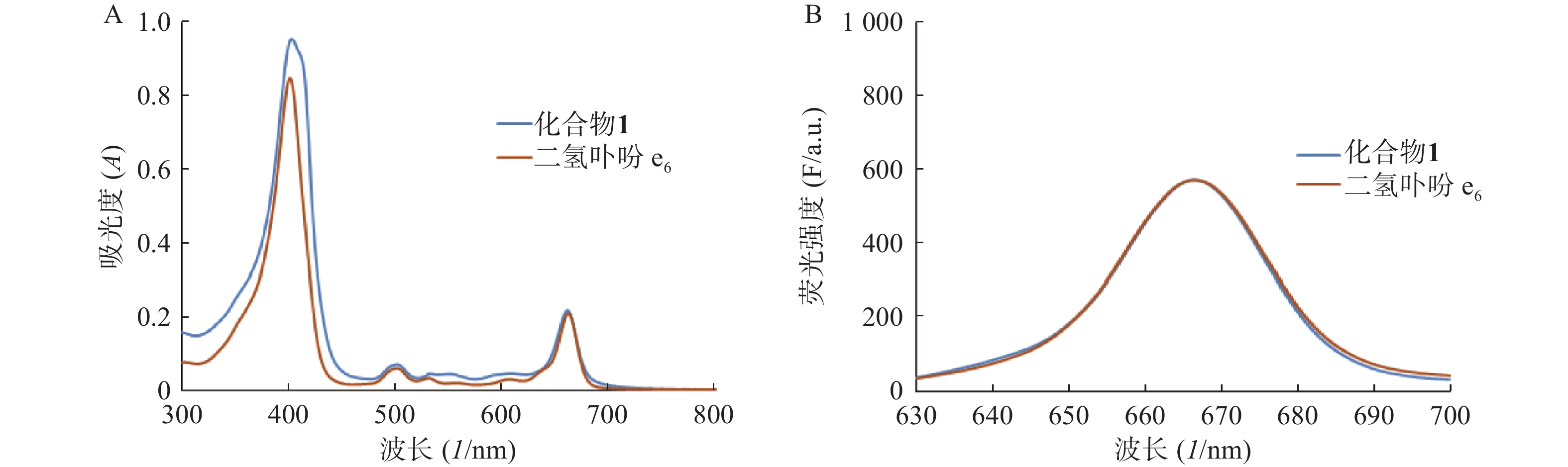
分别测定目标化合物1及其先导化合物二氢卟吩e6(3)的甲醇溶液(10 μmol/L)在300~800 nm处的紫外吸收谱和激发波长为400 nm的荧光发射光谱,结果见图2。
2.2 化合物1的体外pH响应性5-Fu释放
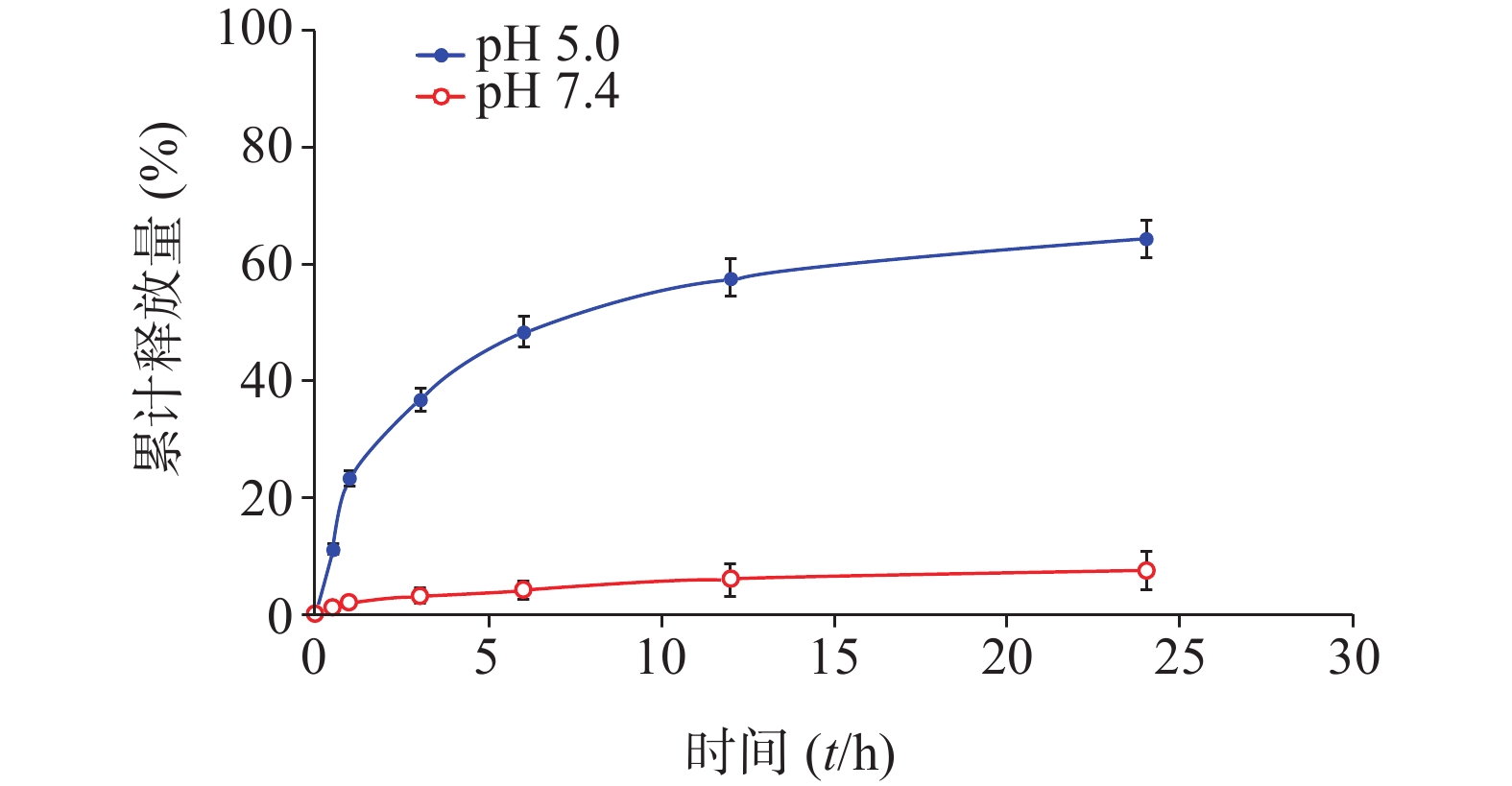
分别配制浓度为50 μmol/L的化合物1的HOAc-NaOAc缓冲液(pH 5.0)和PBS溶液(10 ml),并于0.5、1.0、3.0、6.0、12、24 h时分别取样(500 μl)。其中,HOAc-NaOAc缓冲液(pH 5.0)组取样液用0.1 mol/L氢氧化钠水溶液迅速调节pH值至7.4。每份取样液加PBS稀释至原溶液1/3浓度,微孔滤膜(孔径0.22 μm)过滤,HPLC进样检测;实验重复3次。根据5-Fu的HPLC峰面积-浓度标准曲线分析计算,绘制目标化合物1于弱酸(pH 5.0)中的5-Fu体外释放量-时间曲线,结果见图3。
2.3 化合物1的体外光动力抗癌活性
2.3.1 细胞孵育
2.3.2 细胞暗毒性测试
参照文献[6-8]的方法,每孔5×103个B16-F10细胞或HepG2细胞悬液(100 μl)接种于96孔板上,加入等体积上述细胞培养液孵育24 h;更换含不同浓度待测物的培养液(DMSO浓度小于1%,100 μl),继续避光孵育48 h;再更换含10%(V/V)CCK-8(Beyotime,中国)的RPMI 1640基础培养基(100 μl),继续培养1.5 h,然后用Varioskan Flash全波长酶标仪(Thermo)于波长450 nm处测定每孔的吸光度值,计算各浓度对应的细胞存活率,并拟合得到待测物的肿瘤细胞半数抑制浓度即IC50值。
2.3.3 细胞光毒性测试
每孔5×103个B16-F10细胞或HepG2细胞悬液(100 μl)接种于96孔板上,加入等体积细胞培养液孵育24 h;更换含不同浓度待测物的细胞培养液(DMSO浓度小于1%,100 μl),继续避光孵育24 h;再更换新鲜培养液(100 μl),以波长为660 nm的激光辐照受试细胞样品(光照剂量为10 J/cm2),继续孵育24 h。最后按“2.3.2”项下CCK-8法测定各待测物的肿瘤细胞IC50值。
2.3.4 实验结果
以临床光敏药物他拉泊芬为阳性对照,化合物1及其先导化合物3对肿瘤细胞株的体外PDT抗癌活性结果见表1。
表 1 目标化合物1的体外光动力抗癌活性(IC50,μmol/L)化合物 B16-F10细胞 暗毒/光毒比 HepG2细胞 暗毒/光毒比 暗毒性 光毒性 暗毒性 光毒性 化合物 1 46.84±8.46*, ΔΔΔ 0.73±0.16**, ΔΔΔ 64.2 50.80±6.45**, #, ΔΔΔ 0.90±0.22**, ΔΔΔ 56.4 二氢卟吩e6 69.72±4.69 3.36±0.59 20.8 70.38±10.9 2.75±0.41 25.6 他拉泊芬 254.8±18.8 11.31±3.88 22.5 176.4±28.4 15.47±5.07 11.4 5-Fu 35.80±6.68 NTa − 39.16±2.7 NTa − NTa:未测定;*P < 0.05,**P < 0.01,与二氢卟吩 e6组比较;#P < 0.05,与5-Fu组比较;ΔΔΔP < 0.001,与他拉泊芬组比较。 2.4 化合物1介导的PDT对肿瘤细胞内ROS水平的影响
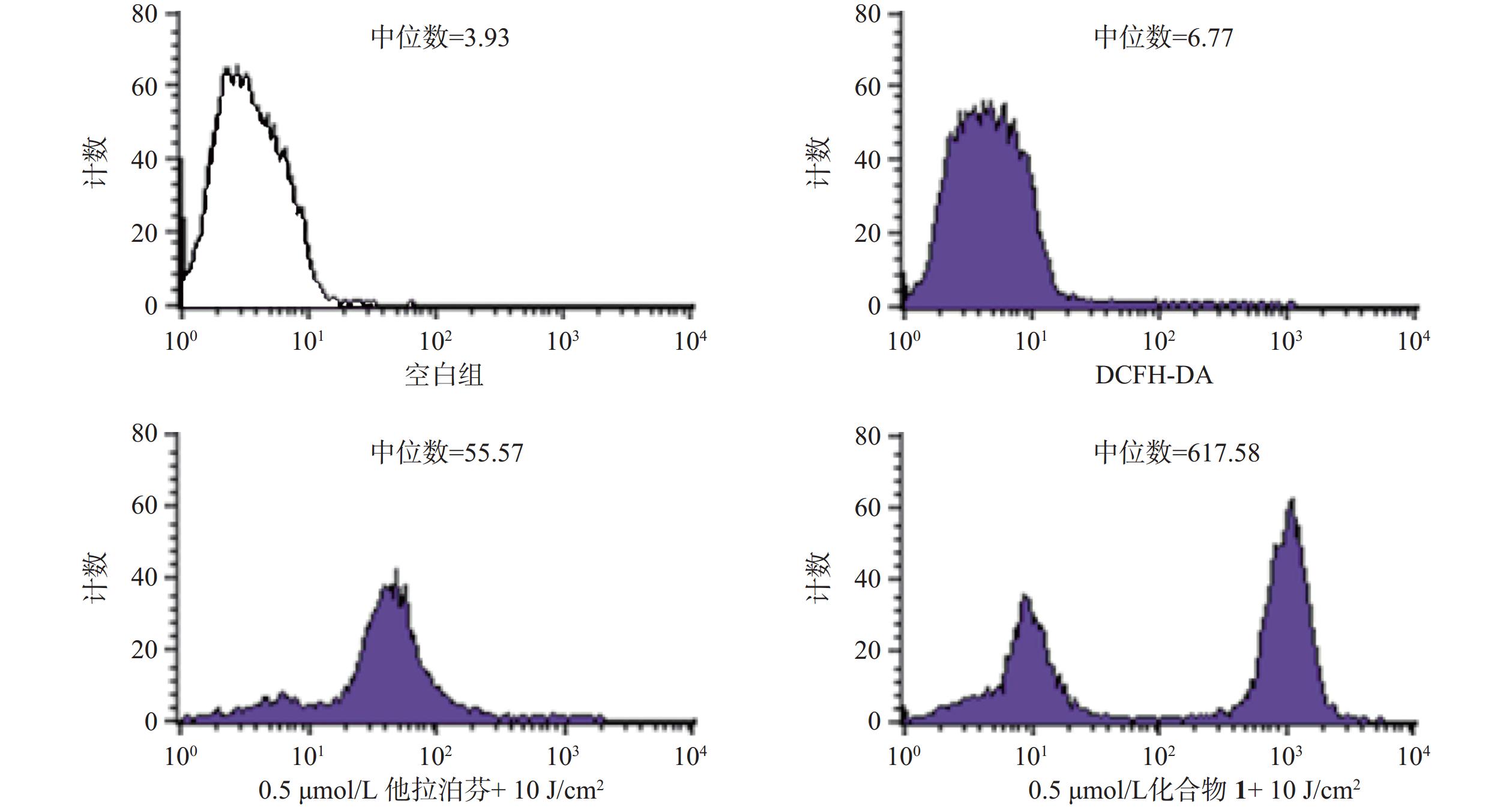
操作步骤如下:a. 每孔3 × 105个B16-F10细胞悬液(2 ml)接种6孔板上,按“2.3.1”项条件避光孵育24 h;b. 分别更换含一定浓度化合物1或他拉泊芬的新鲜培养液(DMSO浓度小于1%,2 ml),继续避光孵育24 h;c. 加入10 mmol/L DCFH-DAROS荧光检测探针(Beyotime,1.5 μl),吹打混匀,继续避光孵育20 min;d. PBS洗涤3次,再加新鲜培养液(2 ml),以660 nm波长的激光辐照(光剂量10 J/cm2)细胞样品,继续避光孵育20 min;e. 收集每孔细胞样品,用流式细胞仪检测各孔细胞ROS水平,结果见图4。
2.5 化合物1介导的PDT对肿瘤细胞凋亡的影响
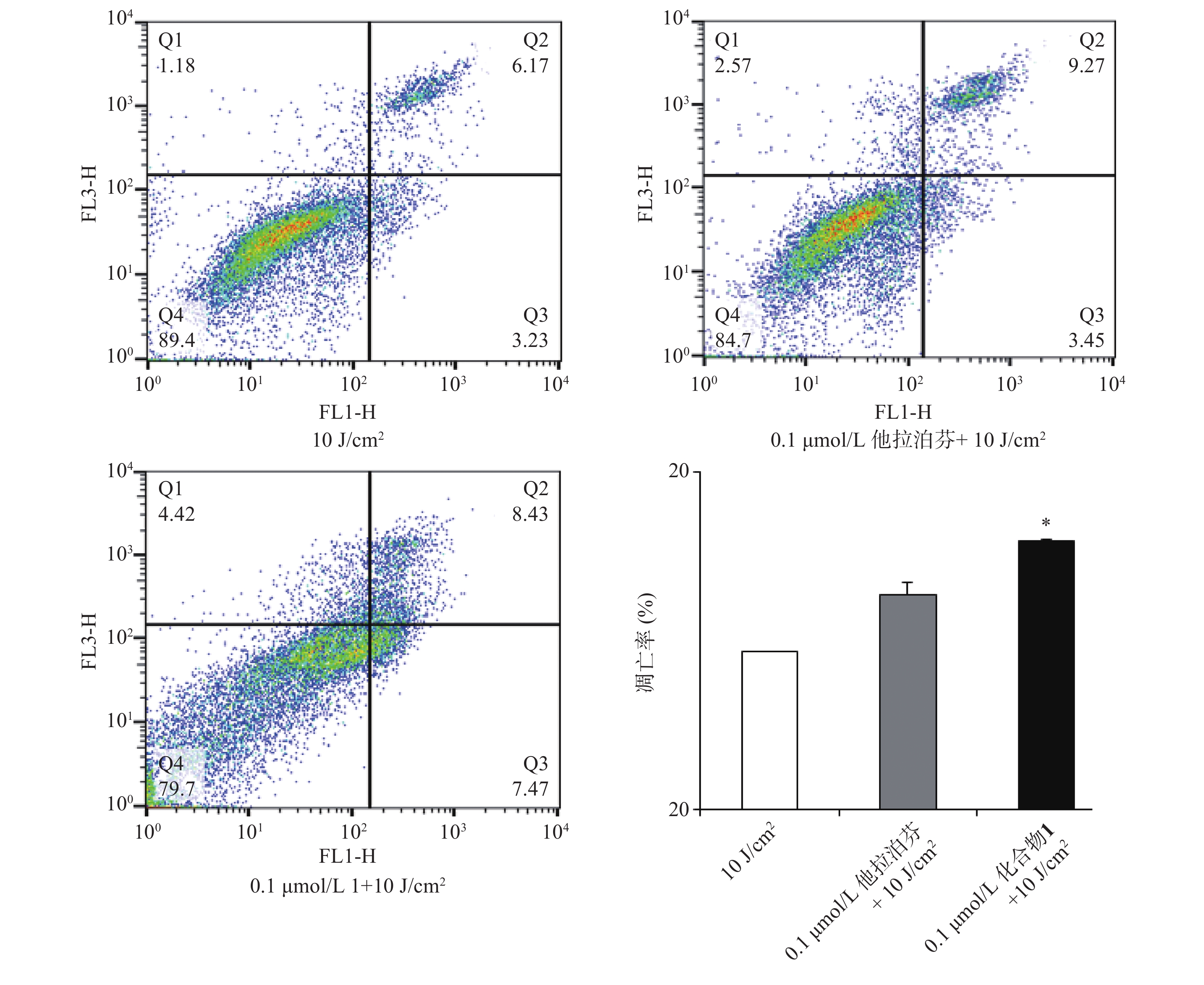
按“2.4”项下操作方法,仅从步骤c开始,更换新鲜培养液(2 ml),用660 nm波长的激光辐照(光剂量10 J/cm2)细胞样品,继续避光孵育20 min;d. 以1 500 r/min离心(5 min)细胞样品,PBS洗涤,再以1 000 r/min离心(5 min)后获取细胞样品;e. 按Annexin V-FITC细胞凋亡检测试剂盒(Beyotime)操作流程操作,结果见图5。
2.6 化合物1介导的PDT对肿瘤细胞周期的阻滞作用
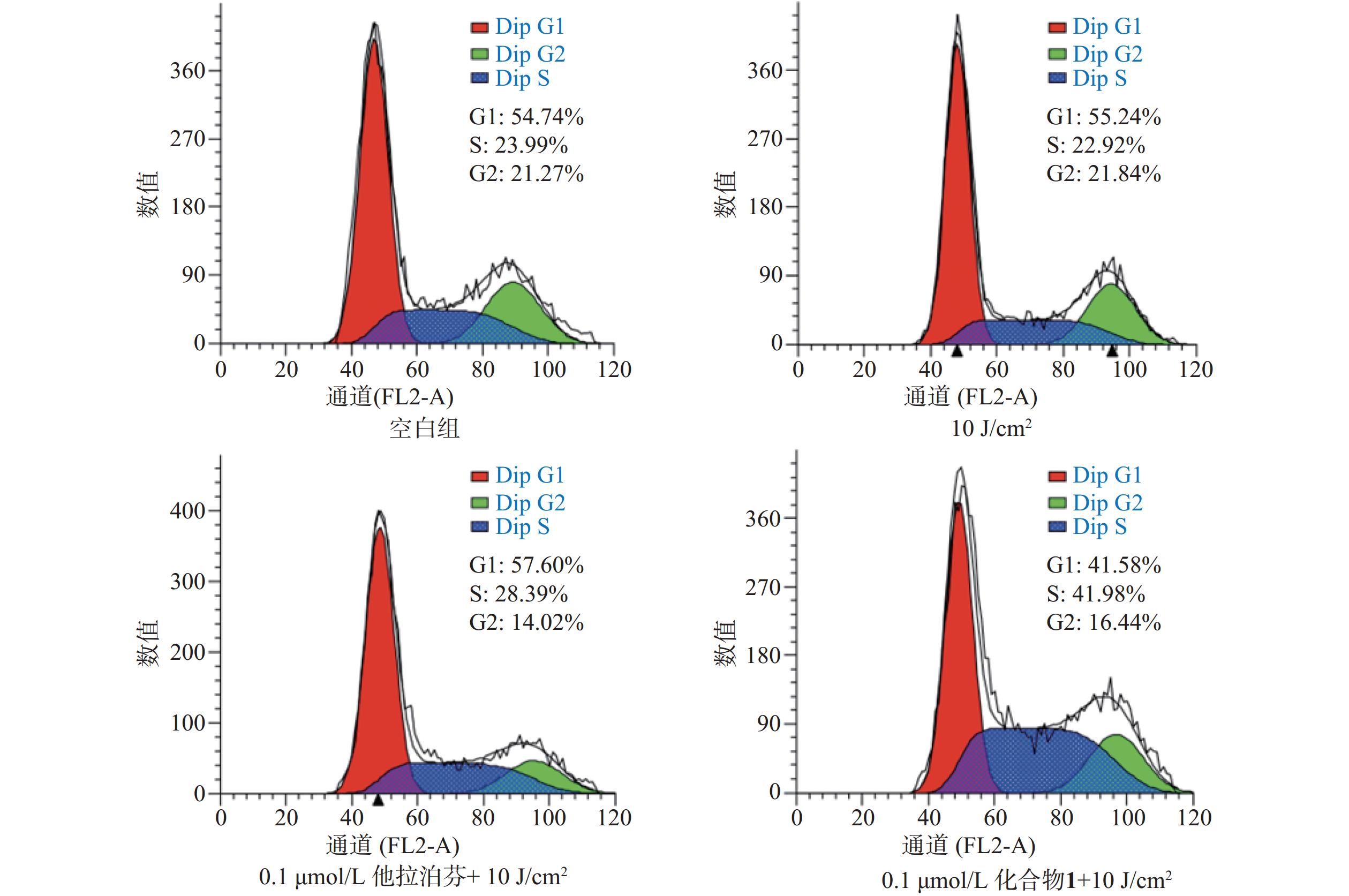
按“2.5”项下操作方法,仅在e步骤中,换以细胞周期阻滞检测试剂盒(Beyotime)的操作流程,每份细胞样品中分别加入染色缓冲液(300 µl)、RNase A(6 µl)和碘化丙啶染色液(15 µl),轻轻混匀,避光孵育20 min后,用流式细胞仪进行细胞周期阻滞检测,结果见图6。
3. 结果与讨论
按文献[14]方法制得的二氢卟吩e6(3)为先导化合物,经1-乙基-(3-二甲氨基丙基)碳二亚胺盐酸盐(EDC·HCl)于无水DMF中催化分子内脱水缩合制得二氢卟吩e6-131,152-酸酐活泼中间体[15],然后直接与中间体2发生酰化反应成功合成得到了光化疗双模抗肿瘤光敏剂二氢卟吩e6-偕氟尿嘧啶(1),反应收率达39.6%,其结构经UV、ESI-MS、1H NMR及元素分析确证。
化合物1在甲醇中最大紫外吸收波长和荧光发射波长(激发波长:400 nm)分别为660 nm和670 nm,与先导物3相一致,表明先导物3以酰腙键偶联5-Fu后,并没有改变其作为光敏剂特有的紫外吸收和荧光发射光谱等光物理特性。此外,化合物1在弱酸(pH 5.0)条件下,能有效释放5-Fu,24 h内累积释放率可达60.3%;但在pH 7.4的条件下较为稳定,24 h内5-Fu累积释放率仅为5%。
体外PDT抗癌活性测试结果显示,化合物1对B16-F10和HepG2细胞株的光毒活性和暗毒/光毒比(治疗指数)均显著优于先导物二氢卟吩e6(3)(P<0.005)和他拉卟吩(P<0.001),其IC50值分别达0.73 μmol/L和0.90 μmol/L。
体外PDT抗癌机制研究提示,化合物1介导的PDT能显著提升B16-F10细胞内ROS水平和诱导B16-F10细胞凋亡,并阻滞肿瘤细胞周期于S期。
总之,二氢卟吩e6-偕氟尿嘧啶(1)具有PDT抗癌活性强、治疗指数(暗毒/光毒比)高且可在肿瘤弱酸环境中有效释放5-Fu等优点,从而实现“单分子”光化疗协同抗肿瘤作用,值得进一步开发研究。
-
表 1 药材信息
药材名称 批号 药材来源 夏枯草 180207 上海康桥药业有限公司 生地黄 180302 上海同济堂药业有限公司 莪术 180306 上海虹桥中药饮片有限公司 麸炒白术 2018031001 上海上药华宇药业有限公司 麸炒苍术 180407 上海虹桥中药饮片有限公司 牡蛎 2017102006 上海上药华宇药业有限公司 煅牡蛎 180301 上海同济堂药业有限公司 表 2 夏枯草消瘤合剂中化学成分的正离子模式鉴别结果
序号 相对时间(min) 化合物 分子式 M+H 实验值(m/z) 理论值(m/z) 误差(×10–6) 来源 1 19.174 7-羟基异喹啉 C9H7NO [M+H]+ 146.060 8 146.052 8 –0.72 地黄. 2 24.032 Verrucarol C15H22O4 [M+H]+ 267.159 1 267.151 8 0.06 莪术 3 28.388 白术内酯Ⅱ C15H20O2 [M+H]+ 233.153 3 233.146 3 1.49 白术. 41) 30.653 芦丁 C27H30O16 [M+H]+ 611.160 8 611.153 4 –0.27 夏枯草 51) 30.703 槲皮素-3-O-β-D-葡萄糖苷 C21H20O12 [M+H]+ 465.102 9 465.095 5 –0.25 夏枯草 61) 33.713 伞形酮 C9 H6 O3 [M+H]+ 163.038 7 163.031 7 1.54 夏枯草 7 38.337 白术内酯Ⅲ C15H20O3 [M+H]+ 249.148 2 249.141 2 2.05 白术 81) 41.969 十四烷基柠檬酸 C20H36O7 [M+H]+ 389.252 9 389.246 1 1.31 白术 注:1)表示正负模式下测得 表 3 夏枯草消瘤合剂中化学成分的负离子模式鉴别结果
序号 相对时间(min) 化合物 分子式 M+H 实验值(m/z) 理论值(m/z) 误差(×10–6) 来源 91) 1.999 精氨酸 C6H14N4O2 (M-H)– 173.104 3 173.111 7 0.56 地黄 101) 2.109 葡萄糖酸 C6H12O7 (M-H)– 195.051 1 195.058 3 –0.23 夏枯草 11 2.789 苹果酸 C4H6O5 (M-H)– 133.014 3 133.021 5 –0.61 夏枯草 12 2.842 柠檬酸 C7H12O6 (M-H)– 191.019 5 191.027 0 1.04 夏枯草 13 3.305 二氢梓醇 C15H24O10 (M+CHO2)– 409.134 8 409.136 9 0.88 地黄 141) 4.441 梓醇 C15H22O10 (M+CHO2)– 407.118 8 407.121 2 2.01 地黄 15 4.724 尿嘧啶核苷 C9H12N2O6 (M-H)– 243.062 2 243.069 5 0.43 地黄 16 5.869 络氨酸 C9H11NO3 (M-H)– 180.066 4 180.073 9 1.28 地黄 17 9.186 鸟苷 C10H13N5O5 (M-H)– 282.084 1 282.091 7 1.12 地黄 181) 12.586 地黄苷D C27H42O20 (M+CHO2)– 731.225 6 731.226 9 –0.57 地黄 191) 14.46 丁香酸 C9H10O5 (M-H)– 197.045 3 197.052 8 1.48 地黄 20 14.562 益母草苷 C15H24O9 (M+Cl)– 383.111 1 383.642 0.88 地黄 21 18.189 原儿茶酸 C7H6O3 (M-H)– 137.024 5 137.031 7 –0.75 夏枯草 22 19.253 2, 3-二氢 -7-甲氧基-4 -甲基 -1H-1,
5 -苯并二氮卓 -2-酮C11H12N2O2 (M-H)– 203.082 5 203.089 9 0.52 苍术 23 21.839 地黄苦苷 C16H26O8 (M-H)– 345.155 3 345.162 8 0.41 地黄 24 22.327 咖啡酸 C9H8O4 (M-H)– 179.035 1 180.049 5 –0.9 白术 251) 27.255 异迷迭香酸苷 C24H26O13 (M-H)– 521.130 8 521.137 3 –1.42 夏枯草 42) 28.487 芦丁 C27H30O16 (M-H)– 609.146 1 609.153 4 0.08 夏枯草 52) 28.61 槲皮素-3-O-β-D-葡萄糖苷 C21H20O12 (M-H)– 463.088 1 463.095 5 0.26 夏枯草 261) 30.296 迷迭香酸 C18H16O8 (M-H)– 359.077 2 359.084 5 0.18 夏枯草 271) 38.237 异地黄苷 C31H40O15 (M-H)– 651.229 1 651.236 7 0.59 地黄 281) 52.394 表莪术酮 C15H28O2 (M-H)– 239.201 4 239.208 9 1.07 莪术 291) 52.687 肉豆蔻酸 C14H28O2 (M-H)– 227.201 7 227.208 9 –0.12 夏枯草 301) 52.748 熊果酸 C30H48O3 (M-H)– 455.353 455.306 3 0.17 夏枯草 311) 53.606 亚油酸 C18H32O2 (M-H)– 279.232 8 279.240 2 0.55 夏枯草 321) 53.911 软脂酸 C16H32O2 (M-H)– 255.233 4 255.240 2 –1.71 夏枯草 33 54.095 油酸 C18H34O2 (M-H)– 281.249 0 281.255 9 –1.43 夏枯草 341) 54.92 硬脂酸 C18H36O2 (M-H)- 283.264 5 283.271 5 –0.93 苍术 35 33.114 6-0-E阿魏酰基筋骨草醇 C25H32O12 (M-H)– 523.181 7 523.189 4 0.73 地黄 36 51.355 麝香草酚 C10H14O (M-H)– 149.097 1 149.104 5 0.28 夏枯草 37 54.305 11-十八烯酸- C18H34O2 (M-H)– 281.248 6 282.225 9 0.09 夏枯草 注:1)表示负模式下碎片电压160V和260V测得;2)表示正负模式下测得。 -
[1] 贺天临, 谢国群, 陈洁, 等. 夏枯草消瘤合剂联合化疗治疗中晚期非小细胞肺癌30例[J]. 上海中医药大学学报, 2015, 29(5):29-32. [2] 朱全刚, 程亮, 顾小燕, 等. HPLC法同时测定夏枯草消瘤合剂中迷迭香酸和咖啡酸的含量[J]. 中医药导报, 2015, 21(20):21-23. [3] 李芳, 林丽美, 李春. 夏枯草化学成分研究概况[J]. 中国实验方剂学杂志, 2011, 17(24):270-274. doi: 10.3969/j.issn.1005-9903.2011.24.075 [4] BAI Y B, XIA B H, XIE W J, et al. Phytochemistry and pharmacological activities of the genus Prunella[J]. Food Chem,2016,204:483-496. doi: 10.1016/j.foodchem.2016.02.047 [5] MENG G, WANG M, ZHANG K J, et al. Research progress on the chemistry and pharmacology of Prunella vulgaris species[J]. OALib,2014,1(3):1-19. [6] 梁杰康, 张琳, 严晓明. HPLC-ESI-MS/MS鉴定夏枯草的主要化学成分[J]. 中国中医药现代远程教育, 2013, 11(14):153-154. doi: 10.3969/j.issn.1672-2779.2013.14.101 [7] 孟正木, 何立文. 夏枯草化学成分研究[J]. 中国药科大学学报, 1995, 26(6):329-331. doi: 10.3321/j.issn:1000-5048.1995.06.003 [8] 王祝举, 赵玉英, 涂光忠, 等. 夏枯草化学成分的研究[J]. 药学学报, 1999, 34(9):679-681. doi: 10.3321/j.issn:0513-4870.1999.09.010 [9] 余茜, 戚进, 刘守金. 夏枯草果穗的化学成分[J]. 中国实验方剂学杂志, 2012, 18(5):107-109. doi: 10.3969/j.issn.1005-9903.2012.05.034 [10] 黄桢, 朱俏峭, 戚进, 等. 地黄的化学成分研究[J]. 海峡药学, 2016, 28(7):34-36. doi: 10.3969/j.issn.1006-3765.2016.07.013 [11] 刘彦飞, 梁东, 罗桓, 等. 地黄的化学成分研究[J]. 中草药, 2014, 45(1):16-22. [12] 冯卫生, 李孟, 郑晓珂, 等. 生地黄化学成分研究[J]. 中国药学杂志, 2014, 49(17):1496-1502. [13] 钟艳梅, 冯毅凡, 郭姣. 基于UPLC/Q-TOF MS技术的白术药材化学成分快速识别研究[J]. 质谱学报, 2015, 36(1):72-77. doi: 10.7538/zpxb.youxian.2014.0058 [14] 李伟, 文红梅, 崔小兵, 等. 白术的化学成分研究[J]. 中草药, 2007, 38(10):1460-1462. doi: 10.3321/j.issn:0253-2670.2007.10.008 [15] 邓爱平, 李颖, 吴志涛, 等. 苍术化学成分和药理的研究进展[J]. 中国中药杂志, 2016, 41(21):3904-3913. [16] 庞雪, 刘玉强, 刘小丹, 等. 苍术麸炒前后活性部位药效比较研究[J]. 中国药房, 2016, 27(10):1308-1311. doi: 10.6039/j.issn.1001-0408.2016.10.04 [17] 吕狄亚. 中药莪术化学成分分析及药代动力学研究[D].上海: 第二军医大学, 2011. [18] 汤敏燕, 孙凌峰, 汪洪武. 中药莪术挥发油化学成分的研究[J]. 林产化学与工业, 2000, 20(3):65-69. doi: 10.3321/j.issn:0253-2417.2000.03.012 [19] ZHAO L, LOU Z Y, ZHU Z Y, et al. Characterization of constituents in Stellera chamaejasme L. by rapid-resolution liquid chromatography-diode array detection and electrospray ionization time-of-flight mass spectrometry[J]. Biomed Chromatogr,2008,22(1):64-72. doi: 10.1002/bmc.897 [20] ZHANG H, GONG C G, LV L, et al. Rapid separation and identification of furocoumarins in Angelica dahurica by high-performance liquid chromatography with diode-array detection, time-of-flight mass spectrometry and quadrupole ion trap mass spectrometry[J]. Rapid Commun Mass Spectrom,2009,23(14):2167-2175. doi: 10.1002/rcm.4123 -





 下载:
下载:
 下载:
下载: