-
手性药物是指药物分子具有手性中心,形成对映异构体,这些对映异构体在生物体内的药理活性、药物代谢及毒性等方面存在显著的差异[1]。有文献[2]对各国药典进行了研究统计,发现欧洲药典对所有手性药物都须明确左旋、右旋手性化合物的有效性;日本药典对大多数手性药物有明确手性构型要求;中国药典未明确要求特定构型的手性药物占比较多,这说明我国手性药物分析和检测仍需完善。二氢吡啶类(DHP)药物是一类常见的钙通道阻滞药,多用于治疗心脑血管疾病。《中华人民共和国药典》(2020年版)收载的DHP类药物中,除硝苯地平外,其他药物母核的C-4位为手性中心;但这些药物中仅左旋氨氯地平被药典收载,药典对其他DHP类药物构型并未作出明确要求。临床上DHP类药物大多以消旋体形式给药,其对映体的药理活性则差别很大。因此对DHP类药物的手性分析及体内过程的探讨,有助于该类药物进一步确认构型要求,降低用药安全隐患。
-
目前,手性药物的分析方法主要为高效液相色谱法(HPLC)和毛细管电泳法(CE),这些方法因其分析手性药物具有快速、分离效果好、检测灵敏度高、可选模式多等特点,应用较广,同时也为生物样品中手性药物的分析提供了技术支撑。
-
HPLC进行手性拆分的方法主要分为3种,包括手性固定相法(CSP)、手性流动相添加剂法(CMPA)和手性衍生化试剂法(CDR)。CSP是通过物理吸附或者化学键合的方法把手性化合物键合到固定相载体上,具有简单、快速、高效的特点。CMPA是在流动相中添加某种手性试剂,该手性试剂与对映体溶质之间通过氢键、离子键、配位键或者空穴的包含作用等相互作用,形成非对映异构体,然后根据非对映异构体自身的稳定性及其在固定相和流动相之间的分配系数不同,从而实现对映体的拆分[3]。该方法的成本低,无需昂贵的手性柱,且分离效果好。CDR是利用手性衍生化试剂与样品反应形成非对映异构体,然后在非手性柱上进行分离。该方法柱效高、价格便宜,但耗时且操作复杂,对手性试剂的纯度、反应过程中的稳定性等要求较高,目前国内外暂无用于拆分DHP类药物的文献报道。
Kang等[4]采用万古霉素手性固定相分离人血浆中的贝尼地平对映体。流动相为甲醇-乙酸-三乙胺(100∶0.01∶0.000 1),柱温45 ℃,流速1 ml/min。血浆中贝尼地平在碱性条件下用乙醚液液萃取后进样分析,(–)-α-和(+)-α-贝尼地平异构体分别在2.4 min和3.4 min洗脱,浓度在0.05~10.00 ng/ml范围内线性关系良好,检测限均为0.05 ng/ml。
Yu等[5]首次采用多糖衍生物手性固定相Chiralcel OD-RH、Chiralpak IB和Chiralpak IC柱对尼莫地平、西尼地平、尼卡地平、尼索地平、非洛地平和乐卡地平等6种DHP类药物进行对映体分离比较。其中,键合型手性柱溶剂相容性强、色谱分离效率高、重现性好、手性识别能力更广泛,分离效果好于涂布型手性柱。在Chiralpak IC柱上,流动相为正己烷-异丙醇(90∶10)时,尼莫地平、西尼地平、尼卡地平和尼索地平分离度分别为10.25、6.49、2.20和1.71;只有非洛地平和乐卡尼地平未分离,效果远好于Chiralpak IB柱,说明Chiralpak IC柱中氯代苯基产生的偶极作用增大了手性拆分的几率,适合用于DHP类药物的拆分。
Sun等[6]在前人研究的基础上使用Chiralpak IC柱在标准正相洗脱模式、非标准洗脱模式和反相洗脱模式下对17种DHP结构类似物进行了对映体分离,并考察了醇改性剂、添加剂及温度的影响,发现标准正相洗脱模式对DHP对映体分离的整体效果较好,反相洗脱模式可以作为互补,分离正向模式下不能分离的化合物,证明了Chiralpak IC柱在DHP对映体分离中的广泛溶剂通用性,将不同洗脱模式组合可以针对多种类似物达到更好的分离效果。另外结合对映体分离结果和热力学研究发现,氢键、π-π相互作用、偶极-偶极相互作用、改性剂的浓度、极性在对映体分离中起了重要作用,而碱性添加剂的微小变化对对映体分离没有影响。
Deng等[7]制备了一系列壳聚糖2-硫脲衍生物作为手性固定相,通过比较不同对映体的分离结果,发现其对DHP类钙离子拮抗剂表现出独特的手性识别特性。为进一步探究其机制,将壳聚糖衍生物(Thio-1c, 1e)与尼索地平、尼莫地平、西尼地平外消旋体进行了分子对接,发现壳聚糖硫脲衍生物的2-[3-(甲硫基)丙基硫脲]取代基是分离DHP类钙离子拮抗剂的关键因素。
宫丽等[8]在纤维素键合OJ手性柱上对尼群地平的两个对映异构体进行了拆分,选用不同比例的正己烷-无水乙醇作为流动相,通过溶质计量置换保留模型考察了置换剂无水乙醇强度对拆分的影响,并通过改变流动相中三乙胺浓度及柱温,考察对保留与拆分的影响。溶质计量置换保留模型公式为Logk’=LogI-ZLog[D],式中k’为容量因子,LogI和Z为常数,分别表征对映体分子对固定相亲合势和与固定相接触面积,[D]为流动相中置换剂的浓度,公式含义为溶质的容量因子的对数与流动相中置换剂的浓度对数之间有线性关系。通过改变流动相中无水乙醇浓度可以计算出LogI和Z值,进而便可以通过公式考察手性固定相的拆分能力、流动相体系中置换剂对拆分的影响方式和程度等,确定色谱条件。发现以正己烷-无水乙醇(90∶10)时,在0~0.25 mol/L范围内,拆分效率及各对映体的保留值均随三乙胺浓度的增高而降低;保持柱温在20℃~30℃可以改善和提高拆分效果。
除了以上的CSP外,CMPA也有应用,表1总结了DHP类药物的手性HPLC分析方法。
表 1 DHP类药物的HPLC手性分析方法
药品 方法 固定相 流动相 保留时间(t/min) 分离度 参考文献 马来酸
氨氯地平CMPA Kromasil-Cl8柱 含20 mmol/L SBE-β-CD的10 mmol/L
磷酸盐缓冲液-乙腈(75∶25)28.45,30.38 2.08 [10] 西尼地平 CSP ChiralcelOD-H
手性柱正己烷-正丁醇(92.5∶7.5) — 1.88 [11] 马尼地平 CSP ChiralcelOD-H
手性柱正已烷-异丙醇
(95∶5)— 1.58 [11] 苯磺酸
氨氯地平CMPA Agilent Eclipse XDB-C18 含20 mmol/L SBE-β-CD的10 mmol/L
磷酸二氢钾溶液-甲醇(60∶40)15.050,18.032 2.1 [12] 尼莫地平
尼群地平CSP Co-MOF-74-L-Tyr手性柱 正已烷-异丙醇
(98∶2)— 2.45
2.63[13] 注:“—”表示未提及;CMPA:手性流动相添加剂法;CSP:手性固定相法。 -
CE是近几十年迅速发展并广泛使用的一种微分离技术,以高压电场为驱动力,毛细管为分离通道,根据样品中各组分之间的淌度和分配行为上的差异而实现分离。通常在缓冲液中添加手性识别试剂之后,以毛细管区带电泳(CZE)、胶束电动毛细管电泳(MEKC)和毛细管电色谱(CEC)为主要的几种分离模式来进行分析,实现快速、高效、低耗的手性药物分析。
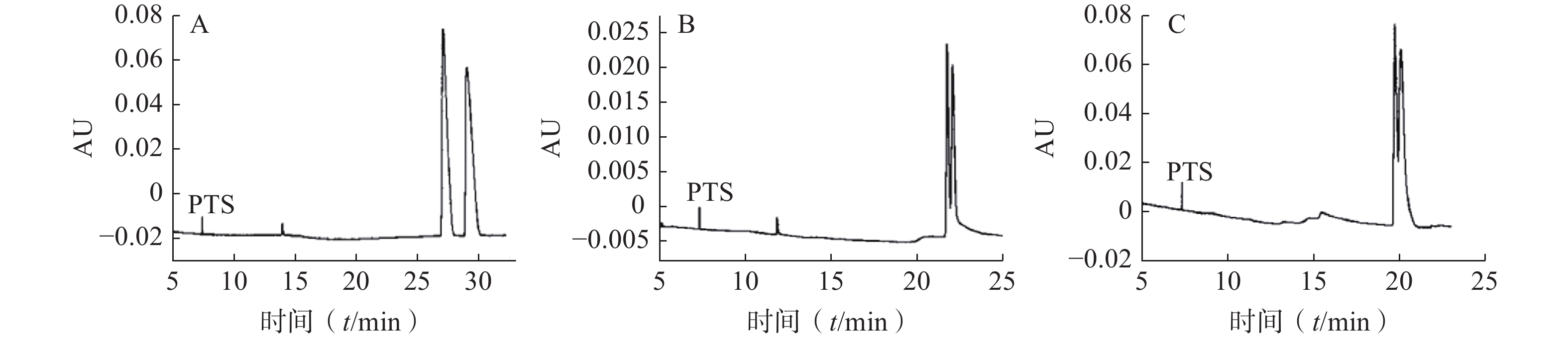
蔡诚等[9]采用毛细管区带电泳模式,以高磺化环糊精(HS-CD)为手性识别试剂,考察了手性试剂的类型、浓度及缓冲溶液pH值等对分离度的影响,确定了拆分尼卡地平、尼莫地平和尼群地平对映体的最佳条件为:运行缓冲溶液为50 mmol/ml三乙胺磷酸盐溶液(pH 2.5);温度:25 ℃;电压:15 kV。其中盐酸尼卡地平对映体在HS-γ-CD手性选择剂存在下获得基线分离,尼莫地平和尼群地平对映体分别在HS-β-CD和HS-α-CD手性选择剂存在下获得部分分离(图1)。对其分离机理进行了初步探讨,发现低pH值条件下叔胺类药物与高磺化环糊精之间存在一定的静电引力作用,对手性对映体的拆分起着决定性的作用。

图 1 尼卡地平、尼莫地平和尼群地平的手性对映体拆分电泳图[13]
Van Eeckhaut等[14]采用电动色谱法研究了尼莫地平、尼索地平和尼群地平的分离和同时对映体分离。以胆盐作为手性表面活性剂时可实现这些DHP衍生物的非手性分离,其中尼莫地平和尼索地平对映体能够分开但无法实现基线分离;十二烷基硫酸钠与中性环糊精混合的十二烷基胶束则无法实现对映体分离;而用羧甲基-β-环糊精在pH值为5.0的条件下则可实现尼索地平和尼莫地平的基线对映体分离。条件优化过程显示,缓冲液类型对尼索地平的手性分离影响较大;有机溶剂会降低尼莫地平对映体分离度,而甲醇或乙醇则增加了尼索地平对映体拆分;温度对尼索地平的对映体分辨率影响几乎无影响,而在较低温度下尼莫地平对映体分辨率提高,推测这可能与二者在醇中的溶解度有关,溶解度增加会导致手性识别能力降低。
聂桂珍等[15]采用甲基丙烯酸缩水甘油酯原位聚合物基质,将磺丁基醚-β-环糊精(SBE-β-CD)修饰到毛细管内壁,制备了开管电色谱柱,开管电色谱柱无须烧塞,操作与电泳同样便利。通过固定相和流动相中SBE-β-CD的协同作用,优化手性添加剂浓度、pH值、施加电压、温度及有机调节剂含量等条件,实现了10种DHP类药物对映体较好的拆分。优化的流动相组成为20 mmol/L NaH2PO4(pH 4.0),含4.0 mmol/LSBE-β-CD,乙腈的体积分数为10%~25%,施加电压15~25 kV,温度为15 ℃,电动进样2 kV×5 s,检测波长为236 nm。基于色谱分离数据探讨得知,氢键、静电、位阻和包结等多种作用对上述手性分离均有贡献。
Ma等[16]以组氨酸、2-甲基咪唑和Co2+为原料,功能化NH2-β-环糊精(NH2-β-CD)制备了一种新型的用于手性分离的开管毛细管柱。表征表明,与NH2-β-CD@capillary相比,NH2-β-CD@His-ZIF-67@毛细管包膜柱对手性分子的分辨能力显著提高。NH2-β-CD@His-ZIF-67@毛细管柱实现了氨氯地平的基线分离,分离度1.70。
Ren等[17]以第二代大环内酯类抗生素伽米霉素(Gam)作为CE中对映体分离的新型手性选择剂,系统地研究了影响对映体分离的因素,包括背景电解质(BGE)的组成、Gam的浓度、有机溶剂的种类和比例、外加电压等。在分析物中,氨氯地平对映体的分离度(Rs)高达15.65,据称这是该药在CE研究中报道的Rs最高值(除了使用分子印迹聚合物技术)。
-
药动学主要研究机体对药物处置的动态变化,包括药物在机体内的吸收、分布、代谢及排泄过程。药物的代谢与人的年龄、性别、个体差异和遗传因素等有关。在人体的手性环境中,手性药物对映体与生物大分子间相互识别、相互作用的立体选择性导致了他们在吸收、分布、代谢和排泄过程中存在差异,引起一系列药动学参数的不同[18],包括生物利用度(F)、血药浓度-时间曲线下面积(AUC0~∞)、达峰浓度(cmax)、表观分布容积(Vd)、消除半衰期(t1/2)、血浆蛋白结合率等。
药动学参数差异与其药效学密不可分。手性药动学的研究可以帮助了解药物在体内立体选择性的过程,更好地评价药物的疗效或毒性,便于开发出单一对映体的药物。目前对DHP类药物手性药动学研究比较明确的是氨氯地平,且临床已经出现了采用单一左旋氨氯地平给药来提高高血压的治疗效果,而其他该类药物如非洛地平、西尼地平等,手性药动学研究仍需加强。
立体选择性药动学研究需要体内手性药物分析方法作为支撑。不同的生物样品如血浆、血清、尿液、组织,以及不同的前处理方法,可能存在影响对映体分离检测的干扰;另外由于给药剂量等原因,DHP类药物的血药浓度往往较低,前处理方法的纯化富集能力和对映体色谱分析时的灵敏度需要重点关注。目前对于生物样品,主要的前处理方法为液-液萃取(LLE)、蛋白沉淀法(PPT)和固相萃取法(SPE)等。其中PPT无法实现对分析物的纯化和富集,检测灵敏度也欠佳,而LLE分离富集效果好,目前应用最多。
-
氨氯地平作为长效钙通道阻滞药,临床上广泛用于治疗高血压和心绞痛。其中左旋氨氯地平(S-AML)有扩张血管的作用,具备长效、高效且不良反应少的优点;而右旋氨氯地平(R-AML)不仅几乎无效,还易引起面部潮红、肢端水肿、头痛、头昏等不良反应。
Wang等[19]采用液相色谱串联质谱法(LC-MS/MS)测定大鼠血浆中氨氯地平对映异构体。前处理采用LLE,50 μl血浆样品加入400 μl乙酸乙酯涡旋提取,以卡马西平为内标,使用CHIRALCEL OZ-RH柱,乙腈-水(10 mmol/L乙酸铵∶0.5%氨溶液=95∶5)进行分离,血浆中对映体的最低定量限为0.937 5 ng/ml。18只大鼠随机分为3组,分别灌胃R-AML、S-AML和rac-AML(氨氯地平外消旋体),测定相应的血药浓度,并计算对映体间主要动力学参数。大鼠给药rac-AML后,R-AML的cmax和AUC0~∞分别为(53.08±10.42) μg/ml和(751.58±166.20) h·μg/ml,均显著低于S-AML的cmax和AUC0~∞,即(75.29±9.27) μg/ml和(1 083.42±248.54) h·μg/ml,而tmax和t1/2并无统计学差异,表明大鼠体内氨氯地平具有立体选择性处置差异;有研究表明[20]R-AML在大鼠肝细胞中的代谢程度较S-AML大,说明氨氯地平的代谢具有立体选择性,这也是体内S-AML血药浓度更高的原因。将单一对映体给药和消旋体给药对比发现,两者S-AML药动学参数和血浆药物浓度没有统计学上的显著差异,但是给药消旋体后R-AML各项参数却有明显降低,这说明氨氯地平的立体选择性代谢可能存在竞争性,消旋体给药后R-AML的代谢会抑制S-AML。
房晶等[21]研究健康男性人体中氨氯地平对映体的立体选择性药动学,1 ml血浆采用Oasis HLB 96孔固相萃取板进行前处理,以氯氮䓬为内标,在CHIRAL-AGP柱上用10 mmol/L乙酸铵缓冲液-异丙醇(98∶2)进行手性对映体分离,最低定量限达0.10 ng/ml。健康男性口服给药5 mg后,不同时间点S-AML和R-AML的血浆浓度比值为1.29~1.60(P<0.05),S-AML的cmax为(3.19±0.50) ng/ml,较R-AML的(1.99±0.27) ng/ml明显升高(P<0.05),S-AML和R-AML的AUC0~∞分别为(195.48±39.20) h·ng/ml和(140.45±18.00) h·ng/ml,t1/2分别为(38.10±4.75)h和(32.54±6.58)h,差异均具有统计学意义(P<0.05),说明S-AML是健康男性体内的优势对映体。除了氨氯地平在代谢上的立体选择性外,与血浆蛋白的结合率也可能是其手性差异的原因,S-AML相较于R-AML,与人血清白蛋白的结合更强,从而在血浆中浓度更高[22]。
-
贺浪冲等[23]通过联用非手性与手性色谱法,研究尼莫地平及其对映体在大鼠体内药动学及组织分布的立体选择性特征。0.2 ml血浆或0.5 ml组织匀浆样品经过碱化后用正己烷-乙酸乙酯(50∶50)LLE,取上清液挥干后用甲醇0.25 ml复溶,进样100 μl进入ODS柱测定尼莫地平总浓度,同时收集该组分再进行LLE,进一步消除干扰后注入Chiralcel OJ柱,以正己烷-无水乙醇(85∶15)为流动相测定尼莫地平对映体比例。非手性与手性色谱的离线联用测定结果显示,血浆及组织匀浆液中尼莫地平对映体线性关系、最低检测限、精密度和准确度均满足分析要求,每种对映异构体的定量下限确定为5 ng/ml。大鼠体内S-(–)-尼莫地平清除较慢,在血液循环中的浓度水平较高;主要效应器官心脏、大脑、小脑中,S-(–)-尼莫地平的浓度高于R-(+)-尼莫地平,在主要消除器官肾脏、脾脏和肝脏中R-(+)-尼莫地平浓度高于中S-(–)-尼莫地平的浓度,说明尼莫地平对映体在大鼠体内药动学及组织分布存在着立体选择性差异。
Isse等[24]使用LC-MS/MS,测定人体血浆中尼莫地平对映异构体含量。前处理的所有操作均在避光条件下进行,以避免分析物的光降解。将300 µl血浆与50 µl硝苯地平(50 ng/ml)混合后,向样品中加入200 µl氢氧化钠(1 mol/L)并涡旋混合,随后向样品中添加4 ml己烷和乙醚(1∶1)并涡旋混合,在室温下以2 000 r/min离心10 min。将有机层转移到洁净的试管中,并通过真空浓缩器进行干燥。残留物用125 µl流动相(甲醇∶水=75∶25)复溶,将40 µl体积的复溶样品注入LC-MS/MS。使用(S, S)-Whelk O1柱,流动相(甲醇∶水=75∶25)进行分离。实验结果显示,该方法灵敏度高、选择性强,可在1.5~75 ng/ml浓度范围内,准确测定尼莫地平对映异构体含量。由于人体肝脏对S-(–)-尼莫地平的代谢能力更强,因此口服给药后,人体血浆中R-(+)-尼莫地平浓度更高。
-
依福地平是新一代DHP类药物,旨在抑制T型和L型Ca2+通道,临床上作为外消旋体给药,其R(–)构型被证明在降压中具有较好的肾保护作用。Liu等[25]研究开发并验证了一种可靠的LC-MS/MS方法用于测定人血浆中依福地平对映异构体,并成功用以表征依福地平的立体选择性药动学。0.5 ml血浆样品通过碱化后用正己烷-二氯甲烷-异丙醇(20∶10∶1)LLE,取上清液挥干后用50%水∶乙腈150 μl 复溶,进样20 μl进入CHIRALPAK ID色谱柱上优化手性分离。每种对映异构体的定量下限确定为0.100 ng/ml。该方法成功应用于口服40 mg盐酸依福地平片后健康受试者体内立体选择性药动学研究。依福地平对映体药动学参数cmax、MRT0~t和MRT0~∞的S(+)/R(–)比值分别为1.15、0.92和0.86,表明依福地平对映体在人体内药动学不存在明显立体选择性差异,开发R(–)构型单一对映体药物将使得具有高血压性肾损伤病人获益。
马尼地平属于新型的DPH类长效钙通道拮抗剂,兼有L型和T型钙双通道阻滞作用,临床上作为外消旋体给药,其R构型无降压作用[26]。Adireddy等[27]采用了一种灵敏、选择性的LC-MS/MS分析方法,测定人体血浆中马尼地平的对映体选择性并应用于健康人体的药动学研究。取500 μl血浆样品,采用固相萃取,以100 ng/ml的R-(–)-马尼地平d4和S-(+)-马尼地平d4混合稀释液为内标,甲醇、水进行预处理,碳酸氢铵缓冲液和水洗涤,乙腈洗脱后氮气吹蒸,流动相溶解后取10 μl进样。由2 mmol/L碳酸氢铵和乙腈(15∶85,v/v)组成的等度流动相,在Chiralpack IC-3 C18柱上对R-(–)-马尼地平和S-(+)-马尼地平进行色谱分离,最低定量限达0.05 ng/ml。健康受试者在禁食条件下口服20 mg后,各药动学参数与该药物的公开评估报告基本一致,表明该分析方法的灵敏度足以达到要求。
-
手性药物的对映体虽然具有相似的理化性质,但在体内手性环境中具有高度的立体选择性,手性药物的临床疗效是药物体内过程和生物活性立体选择性的综合结果。
目前除氨氯地平已采用单一对映体给药外,其他DHP类药物还是以消旋体给药,其研究主要集中在手性分析及拆分机理上,仅极个别的药物如尼卡地平、尼莫地平等进行了手性药动学研究,发现部分对映体在生物体内药动学及组织分布存在着立体选择性差异;部分药物如非洛地平、西尼地平等的类似研究还需进一步加强。这主要是因为DHP类药物手性分析条件较为复杂,不仅是手性固定相和手性添加剂的选择,添加剂的浓度、pH值、温度及有机调节剂含量等条件的改变都会对拆分结果产生较大影响。特别是应用到体内分析时,需要考虑原有的拆分方法是否能够满足高灵敏的检测,样品处理是否能够消除内源性干扰对手性分离系统的影响,分析周期是否符合大批量样品测定,因此亟待开发出适合生物样品中DHP类药物手性分析的HPLC或CE方法,为揭示药物或候选化合物可能的立体选择性代谢途径,最大限度地发挥药效和降低毒副作用,以及进一步的结构改造及临床用药提供更为合理的建议。
Advances in chiral analysis and stereoselective pharmacokinetics of dihydropyridine calcium antagonists
-
摘要: 手性药物与安全有效用药的关系密切,大多数二氢吡啶类药物具有手性碳原子,以消旋体入药,进入体内后产生立体选择性处置特征,可能影响用药的安全有效。该研究围绕该类药物手性拆分及药动学特点,综述了近年来该类药物的手性高效液相色谱法(HPLC)和手性毛细管电泳法(CE)方法选择规律及体内分析应用;列举并比较了该类药物间的立体选择性药动学研究情况,发现该类药物部分具有明显的立体选择性差异,体内药效和毒性也随之不同。Abstract: Chiral drugs are closely related to the safety and effectiveness of drug use. Most dihydropyridine drugs have chiral carbon atoms, which are used as racemes and produce stereoselective disposal characteristics after entering the body, and may affect the safety and effectiveness of drugs. Therefore, based on the chiral resolution and pharmacokinetic characteristics of this class of drugs, the selection rules of chiral HPLC and CE methods and in vivo analysis applications of this class of drugs in recent years were reviewed. The stereoselective pharmacokinetics of this class of drugs were listed and compared. It was found that some of these drugs had obvious differences in stereoselective pharmacokinetics, and the pharmacokinetics and toxicity in vivo were also different.
-
Key words:
- Dihydropyridines /
- Chiral resolution /
- HPLC /
- CE /
- Pharmacokinetics
-
图 1 尼卡地平、尼莫地平和尼群地平的手性对映体拆分电泳图[13]
A.尼卡地平;B.尼莫地平;C.尼群地平;PTS:1,3,6,8-芘四磺酸四钠盐
表 1 DHP类药物的HPLC手性分析方法
药品 方法 固定相 流动相 保留时间(t/min) 分离度 参考文献 马来酸
氨氯地平CMPA Kromasil-Cl8柱 含20 mmol/L SBE-β-CD的10 mmol/L
磷酸盐缓冲液-乙腈(75∶25)28.45,30.38 2.08 [10] 西尼地平 CSP ChiralcelOD-H
手性柱正己烷-正丁醇(92.5∶7.5) — 1.88 [11] 马尼地平 CSP ChiralcelOD-H
手性柱正已烷-异丙醇
(95∶5)— 1.58 [11] 苯磺酸
氨氯地平CMPA Agilent Eclipse XDB-C18 含20 mmol/L SBE-β-CD的10 mmol/L
磷酸二氢钾溶液-甲醇(60∶40)15.050,18.032 2.1 [12] 尼莫地平
尼群地平CSP Co-MOF-74-L-Tyr手性柱 正已烷-异丙醇
(98∶2)— 2.45
2.63[13] 注:“—”表示未提及;CMPA:手性流动相添加剂法;CSP:手性固定相法。 -
[1] 淡美俊, 郝鹏, 赵怡, 等. 手性药物液相色谱分析的概念、技术与发展[J]. 中国科技术语, 2016, 18(3):62-64. doi: 10.3969/j.issn.1673-8578.2016.03.015 [2] 章伟光, 张仕林, 郭栋, 等. 关注手性药物: 从“反应停事件”说起[J]. 大学化学, 2019, 34(9):1-12. doi: 10.3866/PKU.DXHX201904021 [3] 徐雄, 宁卫红, 瞿志荣, 等. HPLC手性流动相添加剂及其用于药物对映体拆分中的影响因素[J]. 生物化工, 2018, 4(5):150-155. doi: 10.3969/j.issn.2096-0387.2018.05.044 [4] KANG W, LEE DJ, LIU KH, et al. Analysis of benidipine enantiomers in human plasma by liquid chromatography-mass spectrometry using a macrocyclic antibiotic (Vancomycin) chiral stationary phase column[J]. J Chromatogr B, 2005, 814(1):75-81. doi: 10.1016/j.jchromb.2004.10.006 [5] YU J, TANG J, YUAN X W, et al. Evaluation of the chiral recognition properties and the column performances of three chiral stationary phases based on cellulose for the enantioseparation of six dihydropyridines by high-performance liquid chromatography[J]. Chirality, 2017, 29(3-4):147-154. doi: 10.1002/chir.22690 [6] SUN J Y, GÖZDE GÜNDÜZ M, ZHANG J Y, et al. Direct enantiomeric resolution of seventeen racemic 1, 4-dihydropyridine-based hexahydroquinoline derivatives by HPLC[J]. Int J Mol Sci, 2019, 20(10):2513. doi: 10.3390/ijms20102513 [7] DENG H, WU X, ZHANG L, et al. Synthesis and application of chitosan thiourea derivatives as chiral stationary phases in HPLC[J]. Carbohydr Polym, 2022, 296:119888. doi: 10.1016/j.carbpol.2022.119888 [8] 宫丽, 贺浪冲, 任文艳, 等. 尼群地平对映体在Chiralcel OJ柱上的拆分特性研究[J]. 中国药业, 2006, 15(3):23-24. doi: 10.3969/j.issn.1006-4931.2006.03.019 [9] 蔡诚, 王园朝, 邓飞. 尼卡地平、尼莫地平和尼群地平毛细管电泳手性拆分研究[J]. 杭州师范大学学报(自然科学版), 2012, 11(2):122-125. [10] 周采菊, 刘瑛. HPLC手性流动相添加剂法拆分马来酸氨氯地平[J]. 中国现代应用药学, 2009, 26(9):757-759. [11] 李成平, 曾怀超, 鲁琳, 等. 二氢吡啶钙拮抗剂马尼地平和西尼地平对映体的手性拆分研究[J]. 药物分析杂志, 2010, 30(4):661-663. [12] 刘志辉. 手性流动相添加剂法测定苯磺酸左旋氨氯地平片的含量及其右旋杂质[J]. 中国药师, 2015, 18(9):1516-1518. doi: 10.3969/j.issn.1008-049X.2015.09.025 [13] MA X, GUO Y, ZHANG L, et al. Crystal morphology tuning and green post-synthetic modification of metal organic framework for HPLC enantioseparation[J]. Talanta, 2022, 239:123143. doi: 10.1016/j.talanta.2021.123143 [14] VAN EECKHAUT A, DETAEVERNIER M R, MICHOTTE Y. Separation of neutral dihydropyridines and their enantiomers using electrokinetic chromatography[J]. J Pharm Biomed Anal, 2004, 36(4):799-805. doi: 10.1016/j.jpba.2004.08.024 [15] 聂桂珍, 李来生, 程彪平, 等. 磺丁基醚-β-环糊精修饰毛细管电色谱拆分地平类药物对映体[J]. 高等学校化学学报, 2014, 35(7):1414-1422. doi: 10.7503/cjcu20140099 [16] MA M X, ZHANG J, ZHANG X C, et al. Zeolitic imidazolate framework-67-modified open-tubular column with cyclodextrin for enantioseparation in capillary electrochromatography[J]. ELECTROPHORESIS, 2022, 43(13-14):1415-1422. doi: 10.1002/elps.202100299 [17] REN S, ZHANG Q, XUE S, et al. Use of gamithromycin as a chiral selector in capillary electrophoresis[J]. J Chromatogr A, 2020, 1624:461099. doi: 10.1016/j.chroma.2020.461099 [18] 王娅莉, 王乐, 赵铭. 手性药物的药动学[J]. 河北化工, 2005, 28(4):11-13. [19] WANG L, LIU W, ZHANG Z, et al. Validated LC-MS/MS method for the determination of amlodipine enantiomers in rat plasma and its application to a stereoselective pharmacokinetic study[J]. J Pharm Biomed Anal, 2018, 158:74-81. doi: 10.1016/j.jpba.2018.05.037 [20] SUCHANOVA B, SISPERA L, WSOL V. Liquid chromatography-tandem mass spectrometry in chiral study of amlodipine biotransformation in rat hepatocytes[J]. Anal Chimica Acta, 2006, 573-574:273-283. doi: 10.1016/j.aca.2006.05.065 [21] 房晶, 信长颖, 李金银, 等. 氨氯地平对映体在健康男性人体的立体选择性药动学研究[J]. 中国临床药理学杂志, 2016, 32(9):810-812,830. [22] MADDI S, YAMSANI M R, SEELING A, et al. Stereoselective plasma protein binding of amlodipine[J]. Chirality, 2010, 22(2):262-266. doi: 10.1002/chir.20738 [23] 贺浪冲, 王嗣岑. 非手性与手性色谱法研究尼莫地平及其对映体在大鼠体内的药动学及组织分布(英文)[J]. 药学学报, 2003, 38(8):603-608. doi: 10.3321/j.issn:0513-4870.2003.08.011 [24] ISSE F A, LE T, MAHMOUD S H. Enantioselective assay of nimodipine in human plasma using liquid chromatography-tandem mass spectrometry[J]. Biomed Chromatogr, 2021, 35(2):e4971. doi: 10.1002/bmc.4971 [25] LIU M, DENG M, ZHANG D, et al. A chiral LC-MS/MS method for the stereospecific determination of efonidipine in human plasma[J]. J Pharm Biomed Anal, 2016, 122:35-41. doi: 10.1016/j.jpba.2016.01.039 [26] 马美玲, 刘玉海, 陈东, 等. 马尼地平对映异构体的手性拆分及其盐酸盐的药效学研究[J]. 中国药学杂志, 2018, 53(11):888-893. [27] ADIREDDY V, BIMIREDDY B P K, PONNERI V. Enantioselective determination of R-(–)-manidipine and S-(+)-manidipine in human plasma by a sensitive and selective chiral LC-MS/MS assay[J]. Biomed Chromatogr, 2017, 31(12):e4027. doi: 10.1002/bmc.4027 -




 下载:
下载: