-
衰老是导致老年性骨质疏松症(SOP)的主要致病因素,其通过促进机体活性氧(ROS)的释放诱导氧化应激,从而降低成骨细胞活性,减少其骨形成[1-2]。D-半乳糖(D-gal)是一种还原糖,当其浓度达到一定水平时,就会诱导机体发生代谢紊乱,释放大量ROS,最终促进衰老相关疾病的发生[3]。同时,过量的D-gal还可诱导骨质变化,类似于SOP和衰老过程中的骨质丢失[4],严重危害了我国中老年人的身体健康。
巴戟天丸(Bajitianwan,BJTW)首载于《古今医统大全》,原方用于治疗老年性记忆减退。本课题组前期研究同样表明,巴戟天丸可显著改善D-gal致衰老大鼠的骨微结构,防治骨丢失,证明其具有明确的抗骨质疏松作用;同时还发现巴戟天丸可改善D-gal大鼠的记忆损伤,提示其具有抗老年性骨质疏松潜力[5],然而其在成骨细胞水平上防治D-gal引发骨丢失的作用及机制尚不明确。因此本研究拟采用D-gal损伤成骨细胞,通过成骨细胞活性、氧化应激水平及关键调控通路检测等方法,探究巴戟天丸体外抗老年性骨质疏松症的作用及机制。
-
成骨细胞:新生24 hWistar大鼠(上海西普尔-必凯实验动物有限公司);胎牛血清(美国Gibco);MTT(上海博光);BCIP/NBT碱性磷酸酯酶显色试剂盒、ALP试剂盒(南京建成);ROS检测试剂盒(上海碧云天);α-MEM培养基(天津灏洋);AKT、p-AKT抗体(美国CST)、Nrf2、HO-1、NQO1抗体(英国Abcam)。
-
采用二次消化法从新生24 hWistar大鼠颅盖骨中分离提取成骨细胞,将原代成骨细胞培养于α-MEM培养基中(10%胎牛血清),置于37 ℃、5% CO2的恒温培养箱中培养,取第3~5代成骨细胞进行后续指标检测。
-
将细胞以5×103个/孔接种于无菌96孔板中,孵育24 h。空白组和模型组更换新的完全培养基,给药组分别加入含不同浓度的BJTW水提物的完全培养液(0.001、0.01、0.1、1、10 μg/ml),4 h后模型组和给药组给予D-gal母液进行干预,使完全培养基中D-gal浓度达到100 mol/L。培养48 h后,采用MTT法测定细胞增殖水平。
-
将细胞以2×104个/孔接种于无菌24孔板中,孵育24 h细胞完全贴壁后,空白组和模型组更换新的完全培养基,给药组分别加入含不同浓度的BJTW完全培养液(0.1、1、10 μg/ml),4 h后模型组和给药组给予D-gal母液进行干预,使培养基中D-gal浓度达到100 mmol/L。培养48 h进行染色,于室温进行避光孵育3 d,洗去工作液后拍照。
ALP活性检测:按照“1.3”项的方法进行给药,细胞培养48 h后,取上清液,根据说明书测定ALP活性。
-
将细胞以2×105个/孔接种于6孔板中,孵育24 h细胞完全贴壁后,根据分组加入含不同浓度的BJTW完全培养液(0.1、1、10 μg/ml),4 h后模型组和给药组加入D-gal母液,使其浓度达到100 mmol/L。培养48 h后,吸弃上清液,参照ROS检测试剂盒说明书,装载稀释后的DCFH-DA探针,37 ℃孵育20 min,用0.25%的胰蛋白酶消化细胞并转移至离心管,空白培养基洗涤3次,用300 ml PBS重新混悬细胞后送往流式细胞仪进行检测。
-
将细胞以2×105个/孔接种于6孔板中,孵育24 h细胞完全贴壁后,根据分组分别加入含不同浓度的BJTW完全培养液(1、10 μg/ml),4 h后模型组和给药组加入D-gal母液,使完全培养基中D-gal浓度达到100 mmol/L。孵育48 h后,吸去上清液,PBS洗涤2次。于冰上对细胞进行裂解提取总蛋白,采用BCA试剂盒对蛋白定量。蛋白变性后,经SDS-PAGE凝胶电泳后转移至PVDF膜进行转膜,室温封闭后,加入相应的一抗(4 ℃环境过夜),1×TBST洗涤3次,加二抗于室温孵育1 h。1×TBST洗涤3次,采用ECL化学发光试剂盒检测。
-
将细胞以1×105个/孔的密度接种于激光共聚焦皿中,根据分组分别加入含不同浓度的BJTW完全培养液(1、10 μg/ml),4 h后模型组和给药组给予D-gal母液进行干预,使培养基中D-gal浓度达到100 mmol/L。于皿中培养48 h后,弃上清液,PBS洗涤2次后,组织固定液固定细胞,30 min后用PBS清洗2次,加入0.5%Triton X-100通透20 min。PBS清洗2次,皿中加入5%BSA工作液,室温封闭1 h。PBS清洗后加入一抗(4 ℃冰箱过夜),PBS洗涤皿底,加入荧光二抗,于室温环境孵育45 min,PBS清洗皿底,加入DAPI染液,避光环境放置20 min,清洗去除多余的染液,激光共聚焦显微镜拍照。
-
实验结果用(
$ \bar{\mathrm{x}} $ ±s)表示。采用SPSS 22.0软件、单因素方差分析(One-Way ANOVA)方法对实验数据进行分析。 -
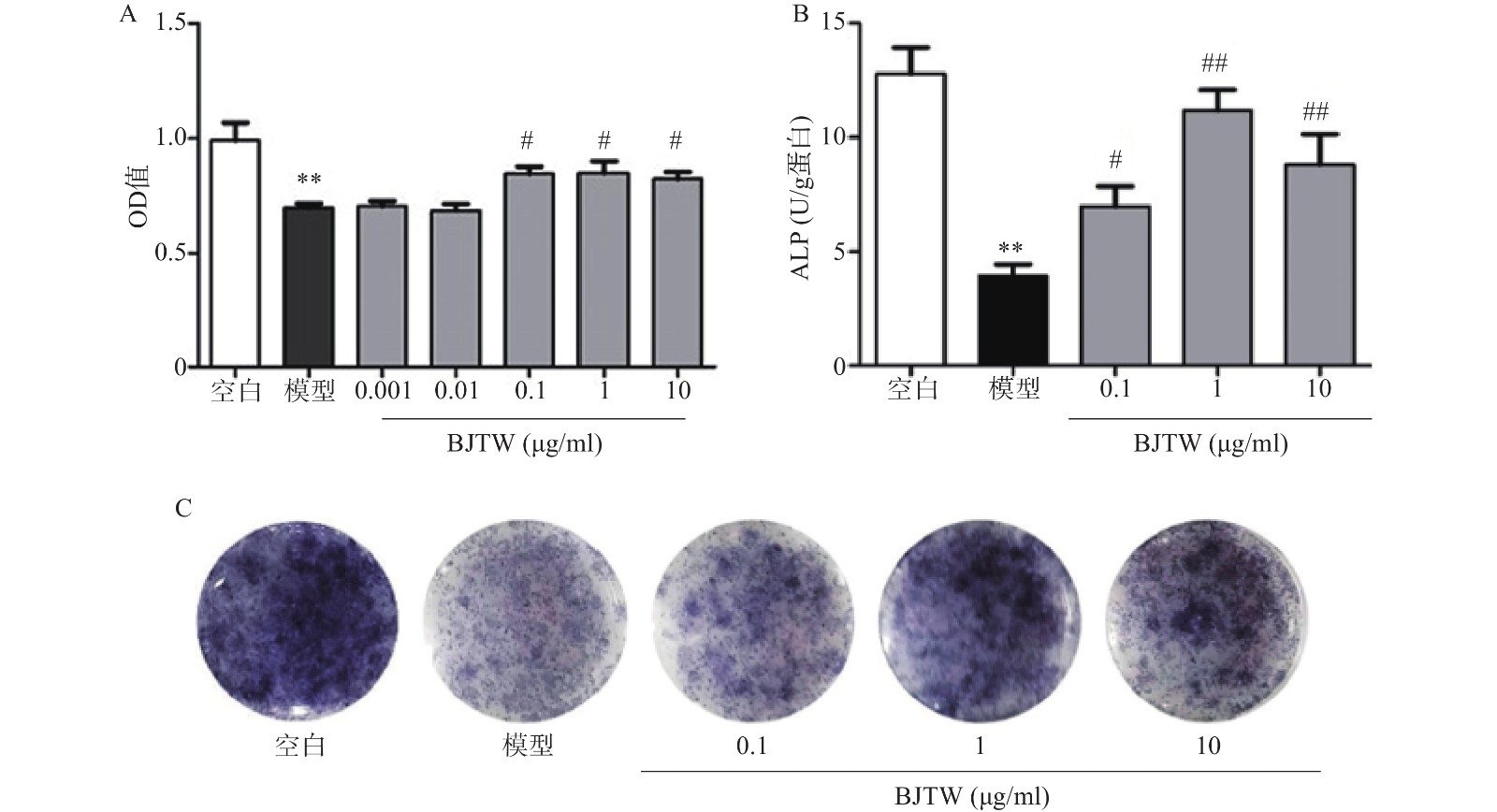
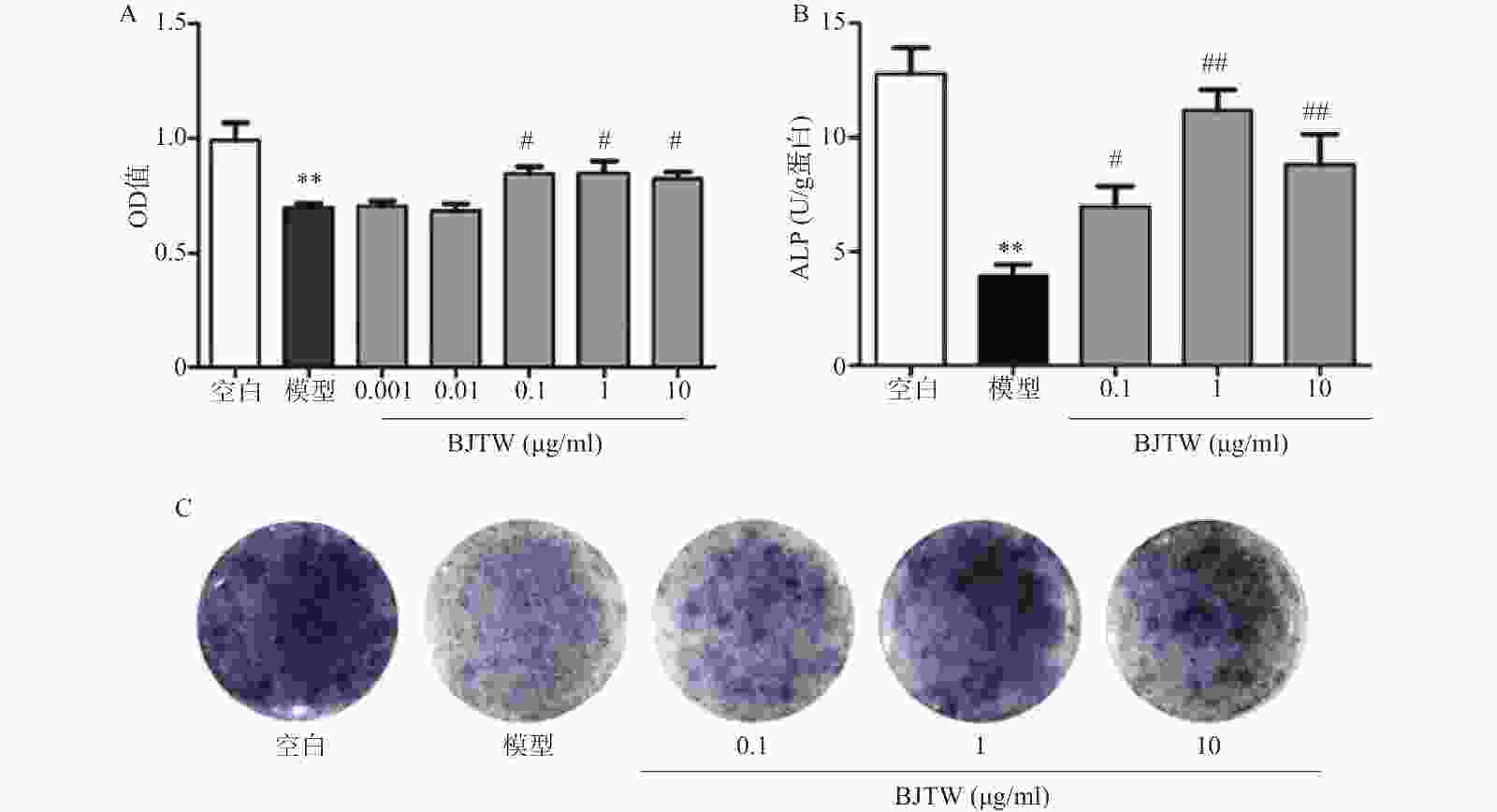
D-gal损伤可显著抑制成骨细胞的增殖;药物干预后,BJTW在0.1、1、10 μg/ml浓度下均能够显著提高成骨细胞的MTT水平,增强D-gal损伤成骨细胞的增殖(图1A)。
-
ALP源自成骨细胞的分泌,能够反映骨形成的能力。对给予D-gal干预的成骨细胞所分泌的ALP的活性进行测定。D-gal损伤成骨细胞后,其ALP活性显著降低;药物干预后,BJTW在0.1、1、10 μg/ml浓度下均可提高D-gal损伤成骨细胞的ALP活性(图1B)。
与此同时,在ALP的催化下,甲苯胺蓝(BCIP)的水解产物会和氯化硝基四氮唑兰(NBT)反应产生不溶的深蓝色至蓝紫色甲瓒结晶。BJTW在0.1、1、10 μg/ml的浓度下均可显著增加培养皿底的甲瓒结晶的颜色深度(图1C),证明其可显著提高D-gal损伤细胞的ALP活性,促进成骨分化。
-
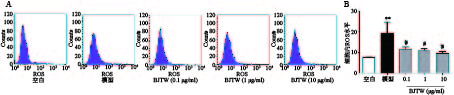
如图2所示,D-gal损伤成骨细胞后,胞内ROS活性显著升高。药物干预后,BJTW在0.1、1、10 μg/ml浓度下均可显著降低D-gal损伤成骨细胞内ROS水平,缓解氧化应激,且该作用呈剂量依赖。
-
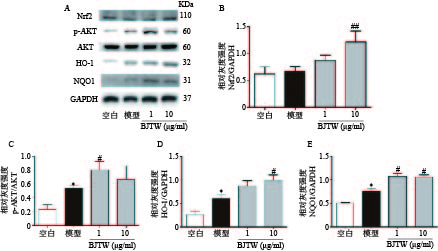
外源性氧化应激会激活细胞内的PI3K/AKT信号通路,使AKT磷酸化水平上升[6]。如图3所示,D-gal损伤成骨细胞后,p-AKT/AKT水平较空白组显著升高;药物干预后,BJTW在1、10 μg/ml浓度下对p-AKT/AKT的水平的促进作用相较模型组表现更为显著。此外,BJTW还可显著促进其下游蛋白Nrf2、HO-1和NQO1的表达,进而激活氧化应激相关PI3K/AKT通路,缓解氧化损伤。
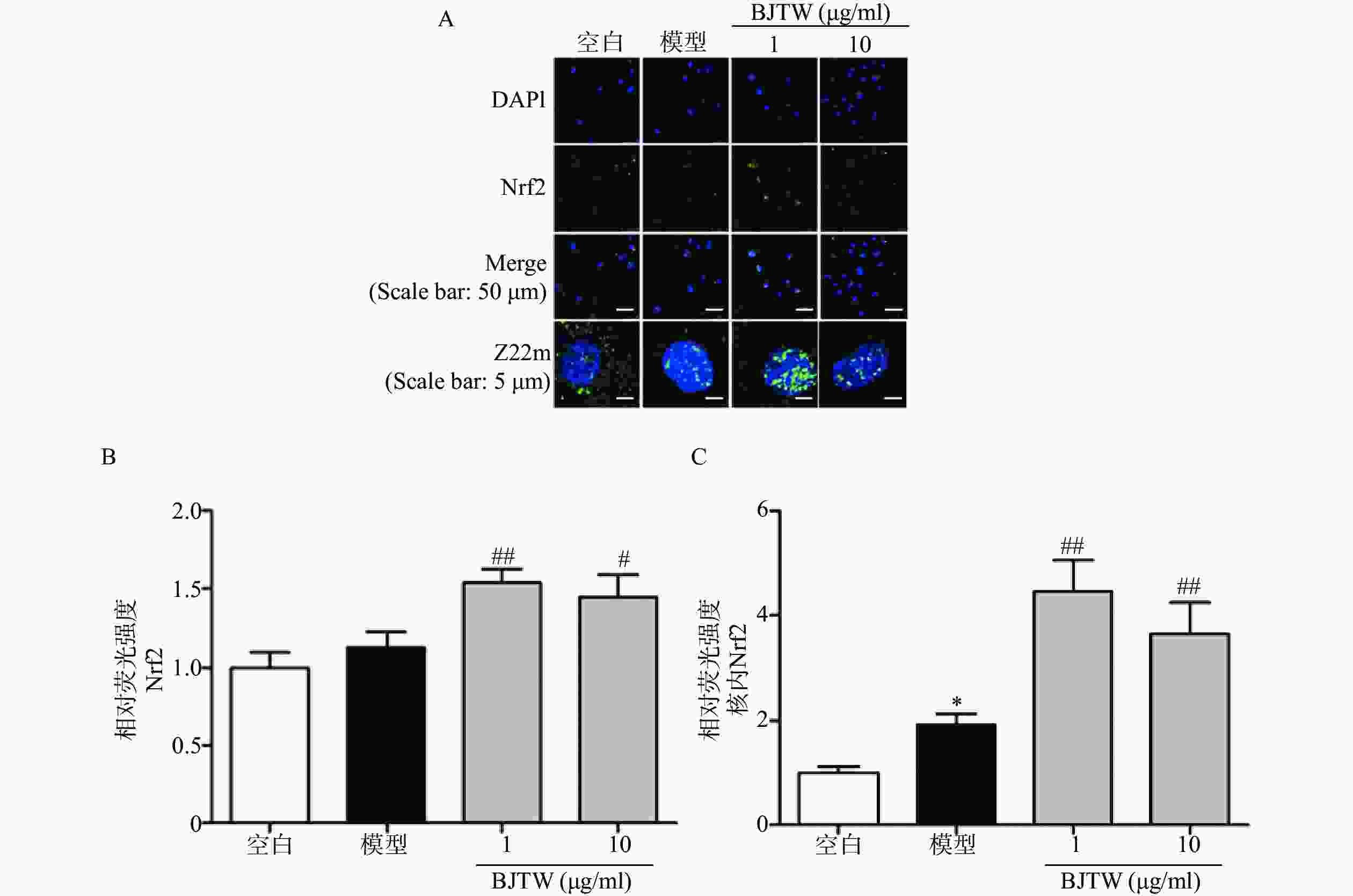
Nrf2通路同样是抗氧化的关键通路,在ROS清除方面发挥重要作用。如图4所示,BJTW可显著促进Nrf2的入核表达(图4),提示BJTW抗氧化、促进骨形成作用与激活Nrf2/AKT通路、促进Nrf2入核有关。
-
成骨细胞主要由骨髓间充质干细胞分化而来,在维持骨稳态和骨重建过程中起着至关重要的作用[7]。与此同时,成骨细胞还是骨形成的主要功能细胞,在骨形成过程中经历增殖、分化、矿化和凋亡四个阶段[8-9]。成骨细胞的增殖水平体现骨形成的强弱,其分泌的ALP是成骨细胞分化阶段的关键酶,可介导骨组织矿化[9-10]。ROS是细胞信号传递和其他生理功能所必需的,然而过多的ROS会导致细胞内的氧化还原反应失衡,扰乱正常的生物功能,导致氧化应激[11-12]。本研究中,D-gal损伤成骨细胞后,细胞的增殖及骨形成指标ALP水平明显降低,细胞内活性氧水平显著上升,而巴戟天丸能够显著促进D-gal损伤成骨细胞的增殖能力和ALP活性,并能显著降低细胞内活性氧水平,表明巴戟天丸可通过抑制胞内ROS释放缓解成骨细胞氧化应激,从而增强成骨细胞的活性,以促进骨的形成。
作为主要的氧化应激调控因子,在骨代谢调控中,Nrf2同样起着重要的作用[13-14]。研究发现,敲除Nrf2基因的小鼠,其股骨的骨密度和骨量显著降低,骨小梁面积减少[15];同时缺失Nrf2会抑制成骨细胞抗氧化酶的表达,提高胞内ROS水平,从而抑制成骨细胞的分化[16]。此外,PI3K/AKT通路作为Nrf2的上游信号通路,在氧化应激调控方面同样起到关键作用[17]。本研究中,药物干预后,巴戟天丸可促进成骨细胞内AKT磷酸化增加,促进Nrf2入核,同时激活下游的HO-1和NQO1的表达,表明巴戟天丸可能通过激活PI3K/AKT和Nrf2信号通路,进而促进通路中相关的蛋白表达,进而增加成骨细胞的抗氧化应激水平,促进骨形成。本研究可为老年性骨质疏松症的临床用药提供一定的实验依据。
Effect and mechanism of Bajitianwan on preventing D-galactose-induced osteoblast bone loss
-
摘要:
目的 研究巴戟天丸防治D-半乳糖(D-gal)损伤成骨细胞骨丢失的作用及机制。 方法 采用新生24 h Wistar大鼠提取的原代成骨细胞,利用D-gal对细胞进行干预,并给予巴戟天丸提取物行药物治疗。分别采用MTT法和碱性磷酸酶试剂盒评价细胞的增殖和分化水平;采用DCFH-DA荧光探针对成骨细胞内活性氧(ROS)水平进行测定。采用Western blotting法对磷酸化蛋白激酶B(p-AKT)、蛋白激酶B(AKT)、血红素氧合酶1(HO-1)、醌NADPH脱氢酶1(NQO1)等氧化相关蛋白的表达进行检测,并采用免疫荧光法测定细胞核因子E2相关因子2(Nrf2)的核内表达水平。 结果 巴戟天丸能显著提高D-gal干预细胞的增殖水平和ALP活性,并显著降低细胞内ROS水平。巴戟天丸能够显著促进细胞AKT蛋白的磷酸化,提高HO-1、NQO1的表达水平,进而激活PI3K/AKT信号通路。此外,巴戟天丸提取物还可显著促进成骨细胞核内Nrf2的表达,激活Nrf2信号通路,促进骨形成。 结论 本研究首次明确了巴戟天丸可防治D-半乳糖损伤引起的成骨细胞骨丢失,其作用机制可能与调控PI3K/AKT和Nrf2信号通路关联的氧化应激有关。 Abstract:Objective To explore the effect and mechanism of Bajitianwan on preventing D-galactose (D-gal)-induced osteoblast bone loss. Methods Osteoblasts isolated from 24 h old Wistar rats were injured by D-gal and intervened with Bajitianwan extract. The osteoblastic proliferation and differentiation were determined by MTT and alkaline phosphatase (ALP), respectively. The cell reactive oxygen species (ROS) levels were detected by DCFH-DA fluorescent probes. The expression of cellular oxidation-related protein nuclear factor erythroid 2-related factor 2 (Nrf2), phosphorylated protein kinase B (p-AKT), protein kinase B (AKT), heme oxygenase-1 (HO-1), and NADPH quinone oxidoreductase 1 (NQO1) were detected by Western blotting. The intranuclear expression of Nrf2 protein was measured by immunofluorescence. Results Bajitianwan extract had significantly increased the osteoblastic proliferation and differentiation, and significantly reduced the intracellular ROS level. Bajitianwan extract had activated the PI3K/AKT pathway via activating the phosphorylation of AKT in osteoblasts, and promoted NQO1 and HO-1 expression. In addition, Bajitianwan had significantly promoted the expression of Nrf2 in the nucleus of osteoblasts, activating Nrf2 signaling pathway, and further promoted bone formation. Conclusion This study confirmed that Bajitianwan could prevent D-gal injured osteoblastic bone loss for the first time. The mechanism might be related to the regulation of oxidative stress associated PI3K/AKT and Nrf2 signaling pathway. -
Key words:
- Bajitianwan /
- D-galactose /
- osteoblast /
- reactive oxygen species /
- Nrf2
-
[1] DOMAZETOVIC V, MARCUCCI G, IANTOMASI T, et al. Oxidative stress in bone remodeling: role of antioxidants[J]. Clin Cases Miner Bone Metab,2017,14(2):209-216. doi: 10.11138/ccmbm/2017.14.1.209 [2] REN X X, LIU H, WU X M, et al. Reactive oxygen species (ROS)-responsive biomaterials for the treatment of bone-related diseases[J]. Front Bioeng Biotechnol,2022,9:820468. doi: 10.3389/fbioe.2021.820468 [3] AZMAN K F, ZAKARIA R. D-Galactose-induced accelerated aging model: an overview[J]. Biogerontology,2019,20(6):763-782. doi: 10.1007/s10522-019-09837-y [4] KOLOSOVA N G, STEFANOVA N A, KORBOLINA E E, et al. The senescence-accelerated oxys rats: a genetic model of premature aging and age-dependent degenerative diseases[J]. Adv Gerontol,2014,27(2):336-340. [5] XU W M, LIU X Y, HE X H, et al. Bajitianwan attenuates D-galactose-induced memory impairment and bone loss through suppression of oxidative stress in aging rat model[J]. J Ethnopharmacol,2020,261:112992. doi: 10.1016/j.jep.2020.112992 [6] 徐武牧. 巴戟天丸抗老年性骨质疏松作用及其制剂工艺研究[D]. 上海: 海军军医大学, 2020. [7] KIM J M, LIN C J, STAVRE Z, et al. Osteoblast-osteoclast communication and bone homeostasis[J]. Cells,2020,9(9):2073. doi: 10.3390/cells9092073 [8] Katsimbri P. The biology of normal bone remodelling[J]. Eur J Cancer Care (Engl),2017,26(6):2017Nov;26(6). [9] 夏天爽, 刘晓燕, 蒋益萍, 等. 啤酒花经抗氧化途径减轻Aβ损伤成骨细胞作用研究[J]. 药学实践杂志, 2021, 39(6):509-514. [10] AN J, YANG H, ZHANG Q, et al. Natural products for treatment of osteoporosis: the effects and mechanisms on promoting osteoblast-mediated bone formation[J]. Life Sci,2016,147:46-58. doi: 10.1016/j.lfs.2016.01.024 [11] AGIDIGBI T S, KIM C. Reactive oxygen species in osteoclast differentiation and possible pharmaceutical targets of ROS-mediated osteoclast diseases[J]. Int J Mol Sci,2019,20(14):3576. doi: 10.3390/ijms20143576 [12] KUDRYAVTSEVA A V, KRASNOV G S, DMITRIEV A A, et al. Mitochondrial dysfunction and oxidative stress in aging and cancer[J]. Oncotarget,2016,7(29):44879-44905. doi: 10.18632/oncotarget.9821 [13] SIM H J, KIM J H, KOOK S H, et al. Glucose oxidase facilitates osteogenic differentiation and mineralization of embryonic stem cells through the activation of Nrf2 and ERK signal transduction pathways[J]. Mol Cell Biochem,2016,419(1-2):157-163. doi: 10.1007/s11010-016-2760-8 [14] 孙晓蕾. 啤酒花及黄腐酚改善铁超载致学习记忆损伤及骨丢失作用研究[D]. 济南: 山东中医药大学, 2021. [15] IBÁÑEZ L, FERRÁNDIZ M L, BRINES R, et al. Effects of Nrf2 deficiency on bone microarchitecture in an experimental model of osteoporosis[J]. Oxidative Med Cell Longev,2014,2014:726590. [16] RANA T, SCHULTZ M A, FREEMAN M L, et al. Loss of Nrf2 accelerates ionizing radiation-induced bone loss by upregulating RANKL[J]. Free Radic Biol Med,2012,53(12):2298-2307. doi: 10.1016/j.freeradbiomed.2012.10.536 [17] SAMAKOVA A, GAZOVA A, SABOVA N, et al. The PI3k/Akt pathway is associated with angiogenesis, oxidative stress and survival of mesenchymal stem cells in pathophysiologic condition in ischemia[J]. Physiol Res,2019,68(Suppl 2):S131-S138. -




 下载:
下载: