-
放线菌是天然药用活性分子的重要源头[1]。然而,近年陆生放线菌来源化合物的重复发现率日趋增高,海洋来源放线菌因其特殊的生长环境和丰富的次生代谢产物越发引起关注[1-2]。
海绵作为代表性的海洋底栖共生生物体,是产生功能分子的重要源头[3]。而越来越多的证据表明共附生微生物是海绵化学多样性的重要来源[4-6]。因此,开展海绵共附生微生物化学成分的研究,寻找新颖的、具有活性功能的小分子化合物显得十分必要。
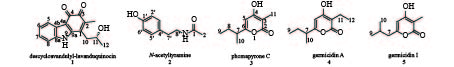
课题组从海绵共附生放线菌Streptomyces sp. LHW2432发酵物中发现了2个生物碱类化合物1和2,以及3个吡喃酮类化合物3~5(图1)。其中,1为新型天然产物,具有抑制耐甲氧西林金黄色葡萄球菌(MRSA)和耻垢分支杆菌的微弱活性,并可作为合成神经细胞保护剂三环咔唑类生物碱的关键前体[7]。
-
Agilent 600 MHz 核磁共振仪(Agilent);Xevo G2-XS QTOF质谱仪(Waters);Acquity UPLC 高效液相色谱仪(Waters);Interchim PuriFlash 450中压色谱仪(Interchim);ODS(YMC,C18,21.2 mm × 250 mm,5 μm);XBridge C18半制备型液相色谱柱(Waters, XBridge Prep C18,10 mm × 250 mm,5 μm);C18制备型液相色谱柱(Phenomenex,Luna C18,21.2 mm × 250 mm,5 μm);N-1000型旋转蒸发仪(上海爱郎);SK5200H型超声仪(上海科导);振荡培养箱(上海知楚);培养箱(上海博远)。色谱级溶剂(Merk);分析纯试剂(上海化学试剂公司);氘代试剂(Cambridge Isotope Laboratories)。
-
TSBY培养基:胰蛋白胨大豆肉汤(30 g/L)、酵母提取物(5 g/L)、蔗糖(100 g/L)、消泡剂(1 ml/L);SFM培养基:低温黄豆饼粉(20 g/L)、琼脂(20 g/L)、甘露醇(20 g/L),pH 7.2~7.4;MH培养基(Solarbio®):MH肉汤(22 g/L);PDA培养基:马铃薯(200 g/L)、琼脂(20 g/L)、葡萄糖(20 g/L)。
-
链霉菌LHW2432分离自南海海绵(红色指状,种属未鉴定,本实验室编号1524),经16S rRNA基因序列(1376 bp)比对,与Streptomyces purpurascens相似度达99.42%,鉴定为链霉菌。
指示菌蕈状芽胞杆菌(Bacillus mycoides)、耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus CICC10201)、耻垢分支杆菌(Mycobacterium smegmatis mc2155)、大肠杆菌(Escherichia coli)和白色念珠菌(Candida albicans)均取自上海交通大学医学院仁济医院药学部海洋药物研究中心菌种库。
-
将LHW2432接种于SFM平板,30 ℃培养5 d,挑取单菌落接种于装有10 ml TSBY培养基的100 ml三角瓶中(加有不锈钢弹簧),30 ℃,220 r/min培养3 d,作为一级种子液;一级种子液以1∶20(V/V)接种于装有150 ml TSBY培养基的500 ml三角瓶中(加有不锈钢弹簧),30 ℃,220 r/min培养3 d,该发酵液作为二级种子液,继续同样条件的发酵,最终得到12 L发酵液。用等体积乙酸乙酯萃取发酵液3次,萃取液浓缩悬干后得到11.3 g浸膏。
-
通过正相硅胶柱色谱分离粗浸膏,二氯甲烷-甲醇洗脱梯度:150∶1、100∶1、80∶1、50∶1、25∶1、15∶1、5∶1、1∶1,共得到13个馏分A~M。合并F与G馏分(1.91 g干重)后经中压ODS色谱柱继续分离[乙腈-水(0.1%甲酸):5%~95%梯度洗脱,6 h,15 ml/min],得到16个馏分FG1~FG16。
化合物1(3.1 mg)和4(7.7 mg)由FG12(42.3 mg干重)馏分经制备型HPLC分离获得,洗脱条件为:9 ml/min,53%甲醇-水(0.1%甲酸)。
化合物3(9.0 mg)和5(2.1 mg)由FG10(37.4 mg干重)馏分经制备型HPLC分离获得。FG10经洗脱[9 ml/min,42%甲醇-水(0.1%甲酸)]得到化合物3和组分FG10-5(7.5 mg干重);组分FG10-5进一步洗脱得到化合物5,洗脱条件为:3 ml/min,30%乙腈-水(0.1%甲酸)。
化合物2(121 mg)分离自馏分J。J馏分(4.357 g干重)经凝胶柱色谱[流动相:二氯甲烷-甲醇(1∶1)]砍断得到5个亚馏分J1~J5。选取J4(1.112 g干重)再经中压ODS柱色谱[甲醇-水(0.1%甲酸):10%~95%梯度洗脱,2 h,15 ml/min]分离获得化合物2。
-
如表1所示,将200 μl~2 ml过夜生长的5种指示菌的菌液加入水解酪蛋白琼脂培养基(MHA)或马铃薯葡萄糖琼脂培养基(PDA)中(约50 ℃)稀释,摇匀后倒入培养皿中。待凝固后,滴加溶解于3 μl DMSO溶液的样品(约10 μg),设置一个阳性对照和一个DMSO阴性对照,平板于相应条件培养12 h后观察抑菌圈(表1)。
表 1 5种指示菌平板培养条件及遴选的阳性对照药
指示菌 培养条件 阳性药 B. mycoides(蕈状芽胞杆菌) MHA, 37 ℃ 万古霉素 S. aureus(金黄色葡萄球菌) MHA, 37 ℃ 万古霉素 M. smegmatis(耻垢分支杆菌) MHA, 37 ℃ 卡那霉素 E. coli(大肠杆菌) MHA, 37 ℃ 萘啶酮酸 C. albicans(白色念珠菌) PDA, 30 ℃ 两性霉素 -
使用肉汤稀释法进行96孔板实验[8]。样品和阳性对照药分别设置3个平行组,先将过夜培养的指示菌用MH肉汤培养基进行1 000倍稀释后加入96孔板,每孔50 μl。第1列至第10列样品浓度依次为128、64、32、16、8、4、2、1、0.5、0.25 μg/ml。加样后37 ℃培养18 h,通过分光光度计(A600)检测菌液澄清度。最后,根据实验结果调整测试药物浓度梯度,重复实验。
-
化合物1:红棕色固体。ESI-MS m/z 270.1133 [M+H]+(calcd for C16H16NO3,270.112 5),提示其相对分子质量为269,推测该化合物结构中含有一个N原子,结合1H-NMR和13C-NMR确定其分子式为C16H15NO3,计算其不饱和度为8。1H-NMR在低场区显示出4个芳烃质子信号δH 7.85 (1H,m)、7.51 (1H,m)、7.23 (2H,dd,J = 6.0,3.1 Hz),高场区显示2个甲基质子信号δH 1.92 (3H,s)和1.25 (3H,d,J = 6.1 Hz),1个亚甲基质子信号δH 2.77 (2H,m),1个连氧次甲基质子信号δH 3.96 (1H,dt,J = 8.0,6.1 Hz);13C-NMR和DEPT谱,在低场区显示出2个羰基碳信号 (δC 172.8,183.6)、4个芳基次甲基碳信号 (δC 113.4,120.2,123.9,124.1),6个芳基或双键季碳信号 (δC 110.9,125.7,134.8,137.1,139.8,146.5),在高场区显示出2个甲基碳信号 (δC 12.2,23.8)、1个亚甲基碳信号 (δC 37.8) 和1个连氧次甲基碳信号 (δC 65.9);将波谱信号进行归属,1H-NMR (600 MHz,DMSO-d6):δ 7.85 (m,H-5),7.51 (m,H-8),7.23 (dd,J = 6.0,3.1 Hz,H-6,7),3.96 (dt,J = 8.0,6.1 Hz,H-11),2.76 (m,H-10),1.92 (s,H-13),1.25 (d,J = 6.1 Hz,H-12)。13C NMR (151 MHz,DMSO-d6):δ 183.6 (C-3),172.8 (C-4),146.5 (C-9a),139.8 (C-1),137.1 (C-8a),134.8 (C-2),125.7 (C-4b),124.1 (C-7),123.9 (C-6),120.2 (C-5),113.4 (C-8),110.9 (C-4a),65.9 (C-11),37.8 (C-10),23.8 (C-12),12.2 (C-13)。化合物数据与文献[9-10]报道一致,结构鉴定为咔唑-3,4-邻醌生物碱descycloavandulyl-lavanduquinocin。
化合物2:白色无定型粉末。ESI-MS m/z 180.1022 [M+H]+(calcd for C10H14NO2,180.101 9),相对分子质量为179,说明该化合物可能含有一个N原子,结合13C-NMR确定其分子式为C10H13NO2,计算不饱和度为5。1H-NMR中包含4个芳烃质子信号δH 6.97 (2H,m)、6.67 (2H,m),结合13C-NMR中的6个双键碳信号,推断该化合物中含有一个对位二取代的苯环,其中一个碳信号 (δC 155.6) 化学位移值向低场偏移,说明是一个连氧取代的芳基碳原子;归属该化合物的波谱信号,1H-NMR (600 MHz,DMSO-d6):δ 9.20 (brs,1′-OH),7.87 (t,J = 5.5 Hz,1-NH),6.97 (m,H-3′,H-5′),6.67 (m,H-2′,H-6′),3.17 (m,H-8′),2.56 (dd,J = 8.4,6.6 Hz,H-7′),1.77 (s,H-2);13C NMR (151 MHz,DMSO-d6):δ 169.1 (C-1),155.6 (C-1′),129.6 (C-4′),129.5 (C-1′,C-5′),115.1 (C-2′,C-6′),40.6 (C-8′),34.5 (C-7′),22.7 (C-2)。与文献数据[11-12]比对,该化合物被鉴定为N-乙酰酪胺(N-acetyltyramine)。
化合物3:淡黄色固体。ESI-MS m/z 183.1028 [M+H]+(calcd for C10H15O3,183.101 6),提示其相对分子质量为182,结合1H和13C-NMR数据推测其分子式为C10H14O3,不饱和度为4。1H-NMR的低场区显示出一个双键质子信号δH 5.95 (1H,s),高场区显示3个甲基质子信号δH 0.81 (3H,t,J = 7.4 Hz)、1.10 (3H,d,J = 6.9 Hz) 和1.73 (3H,s),1对亚甲基质子信号δH 1.54 (1H,m)、1.44 (1H,m),1个次甲基质子信号δH 2.43 (1H,m);13C-NMR和DEPT谱显示共有10个碳信号,包括4个双键或羰基季碳信号,1个sp2杂化的双键次甲基碳信号,1个sp3杂化的次甲基碳信号,1个sp3杂化的亚甲基碳信号,3个甲基碳信号。如下为化合物的波谱信号归属,1H-NMR (600 MHz,DMSO-d6):δ 5.95 (s,H-5),2.43 (m,H-7),1.73 (s,H-11),1.54 (m,H-8a),1.44 (m,H-8b),1.10 (d,J = 6.9 Hz,H-10),0.81 (t,J = 7.4 Hz,H-9)。13C NMR (151 MHz,DMSO-d6):δ 165.8 (C-2),165.5 (C-4),165.2 (C-6),98.9 (C-5),96.2 (C-3),38.7 (C-7),26.9 (C-8),17.7 (C-10),11.3 (C-9),8.5 (C-11)。结合比对文献[13]核磁谱图数据,该化合物鉴定为phomapyrone C。
化合物4:棕色固体。ESI-MS m/z 197.1181 [M+H]+(calcd for C11H17O3,197.1172),提示其相对分子质量为196,结合1H和13C-NMR数据推测其分子式为C11H16O3,不饱和度为4。比较化合物4和3的核磁数据,发现4的1H-NMR低场区存在一个双键质子信号δH 5.95 (1H,s),13C-NMR 低场区存在4个双键或羰基季碳信号 (δC 165.8,165.2,164.7,102.5)、1个双键次甲基碳信号 (δC 98.8),这些核磁数据与化合物3的吡喃-2-酮单元的数据基本一致,提示其存在一个相同的骨架结构。化合物4和3的结构不同之处在于,化合物4的1H和13C -NMR数据中多一个亚甲基信号 (δH 2.26,δC 16.2)。其信号具体归属如下:1H-NMR (600 MHz,DMSO-d6):δ 5.93 (s,H-5),2.42 (m,H-7),2.26 (q,J = 7.4 Hz,H-11),1.55 (m,H-8a),1.44 (m,H-8b),1.10 (d,J = 6.9 Hz,H-10),0.94 (t,J = 7.4 Hz,H-12),0.81 (t,J = 7.4 Hz,H-9)。13C NMR (151 MHz,DMSO-d6):δ 165.8 (C-2),165.2 (C-4),164.7 (C-6),102.5 (C-3),98.8 (C-5),38.7 (C-7),26.8 (C-8),17.6 (C-10),16.2 (C-11),12.6 (C-12),11.4 (C-9)。以上数据与文献[14]基本一致,故被鉴定为germicidin A。
化合物5:棕色固体。ESI-MS显示[M+ H]+分子离子峰m/z 183.1021(calcd for C10H15O3,183.101 6),确定其相对分子质量为182,结合1H和13C-NMR数据确定其分子式为C10H14O3,不饱和度为4。该化合物氢谱存在一个双键质子δH 5.95 (1H,s) 信号,碳谱存在4个季碳信号 (δC 165.8,165.2,164.7,102.5)、1个双键次甲基碳信号 (δC 98.8),提示其含有和化合物3一样的吡喃-2-酮骨架结构。化合物5和3的分子量相同,是同分异构体,但其1H和13C -NMR数据中存在特征性的偕甲基信号 [δH 0.88 (H-9,H-10),δC 21.9 (C-9,C-10)]。具体的信号归属如下:1H-NMR (600 MHz,DMSO-d6):δ 5.92 (s,H-5),2.25 (d,J = 7.2 Hz,H-7),1.90 (m,H-8),1.72 (s,H-11),0.88 (d,J = 6.6 Hz,H-9,H-10)。13C NMR (151 MHz,DMSO-d6):δ 165.3 (C-2),165.2 (C-4),161.2 (C-6),101.1 (C-5),95.9 (C-3),41.7 (C-7),26.3 (C-8),21.9 (C-9),21.9 (C-9),8.5 (C-11)。以上数据与文献[15]基本一致,故被鉴定为germicidin I。
-
平板涂布结果显示:化合物1仅对MRSA和耻垢分支杆菌出现中等大小抑菌圈,阳性药物对相应指示菌均产生显著大小抑菌圈,其他化合物未使5种指示菌产生明显抑菌圈。
-
根据初筛结果,以MRSA和耻垢分支杆菌为指示菌,采用微量稀释法,最终确定化合物1对MRSA和耻垢分支杆菌的MIC值分别为100和64 μg/ml。
-
生物碱是一类含氮的天然药用分子,抗癌药紫杉醇、止痛药吗啡和抗疟疾的奎宁类药物均属此类[16]。文献报道,具有脂肪族侧链的三环咔唑生物碱可通过自由基清除作用保护神经细胞[9,17-18],例如lavanduquinocin,neocarazostatins和carquinostatins[7,19-20]。
课题组以一株中国南海海绵共附生链霉菌Streptomyces sp. LHW2432为研究对象,发现了2个生物碱类化合物1和2,以及3个吡喃酮类化合物3~5(图1)。化合物2此前发现于真菌和放线菌中[21-22],具有自由基清除功能[23]。有报道化合物3~5在链霉菌形态分化中具有抑制产孢的功能[24]。化合物1为三环咔唑生物碱类新天然产物,课题组发现其具有抑制MRSA和耻垢分支杆菌的微弱活性。此外,化合物1可作为化学合成药用活性三环咔唑类生物碱的重要前体[9],本研究首次发现了产生化合物1的宿主菌,为通过发酵手段廉价获取该中间体分子提供了可能。
Study on secondary metabolites from sponge-symbiotic Streptomyces sp. LHW2432
-
摘要:
目的 从海绵共附生菌Streptomyces sp. LHW2432的发酵产物中发现药用活性分子。 方法 采用正向硅胶柱、ODS反向柱以及高效液相色谱分离技术,对LHW2432的发酵萃取物进行分离纯化;通过现代波谱技术和文献调研确定化合物结构;利用平板涂布法和微量稀释法,评价化合物对芽胞杆菌、耐甲氧西林金黄色葡萄球菌(MRSA)、耻垢分支杆菌、白色念珠菌和大肠杆菌的抑菌活性。 结果 从LHW2432发酵物中共分离鉴定了5个化合物:descycloavandulyl-lavanduquinocin ( 1 )、N-acetyltyramine ( 2 )、phomapyrone C ( 3 )、germicidin A ( 4 ) 和germicidin I ( 5 )。化合物 1 对MRSA和耻垢分支杆菌的最小抑菌浓度(MIC)值分别为100和64 μg/ml。 结论 从LHW2432菌中分离得到5个化合物,其中,化合物 1 是新天然产物,可作为神经保护活性三环咔唑类生物碱的合成前体,其对G+菌有微弱的抑制活性。 Abstract:Objective To discover the medicinal active molecules from the fermentation extract of sponge-symbiotic Streptomyces sp. LHW2432. Methods Compounds were isolated and purified from the fermentation extract of LHW2432 by silica gel, ODS chromatographic columns, and HPLC. The structures of the compounds were elucidated based on the analyses of modern spectrum technologies and the related literatures research. Through plate coating method and broth microdilution method, the antimicrobial activities were tested by the indicator strains of Bacillus mycoides, methicillin-resistant Staphylococcus aureus (MRSA), Mycobacterium smegmatis, Candida Albicans, and Escherichia coli. Results Five compounds were discovered and their structures were identified as descycloavandulyl-lavanduquinocin ( 1 ), N-acetyltyramine ( 2 ), phomapyrone C ( 3 ), germicidin A ( 4 ), and germicidin I ( 5 ). Compound 1 showed inhibitory activities against MRSA (MIC, 100 μg/ml) and M. smegmatis (MIC, 64 μg/ml), respectively. Conclusion Five compounds were discovered from LHW2432, among which compound 1 was a new natural product and could be used as a precursor of the tricyclic carbazole alkaloids with neuroprotective activity. Moreover, compound 1 showed weak inhibitory activities against gram-positive pathogenic bacteria. -
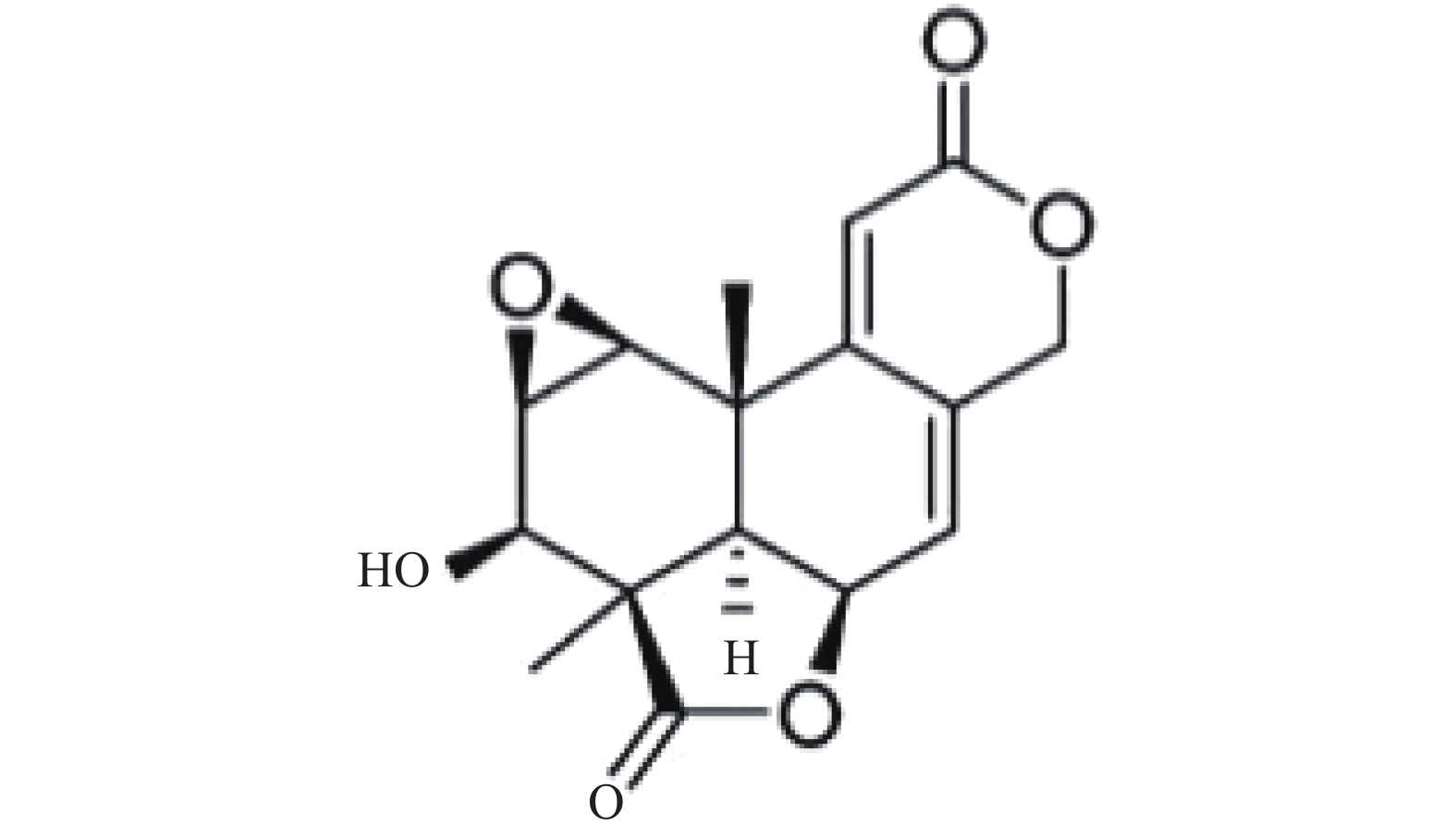
Wentilactone A(WA)是从海洋微生物中分离得到的去甲二萜类小分子化合物,对小细胞肺癌细胞系NCI-H460和NCI-H446细胞的增殖具有抑制作用,可诱导小细胞肺癌细胞系NCI-H446和NCT-H1688细胞凋亡[1]。对小细胞肺癌细胞系NCT-H1688细胞的细胞迁移和集落形成具有抑制作用[2]。WA作为一种有效抗肿瘤候选物,已从制备工艺、理化性质、急性毒性、生殖毒性等方面证明其良好的成药性[3]。遗传毒性安全性实验更是对其临床前研究全面性的补充,为提高临床用药的安全性,为了验证其是否具有遗传毒性,本实验应用微生物回复突变试验(Ames试验)、体外培养CHO细胞染色体畸变试验和小鼠骨髓微核试验方法对WA的遗传毒性进行了系统的研究,为WA的临床前毒性评价提供资料[4]。
1. 材料与方法
1.1 材料
1.1.1 化合物WA
Ames试验用WA(含量:99.9%,批号:20121115,黄色粉末)、体外培养CHO细胞染色体畸变试验用(规格:10 ml,含量:50.8 mg/ml,批号:20130506,黄色澄明溶液)、小鼠骨髓微核试验用WA(规格:10 ml/支:100mg,含量:10.2 mg/ml,批号:20130407,黄色澄明溶液),均由海军军医大学基础医学院生物化学与分子生物学教研室提供。WA的化学结构见图1。
1.1.2 菌株
组氨酸缺陷型鼠伤寒沙门菌(S. typhimurium)TA97、TA98、TA100、TA102和TA1535共5支菌株,复旦大学公共卫生学院环境卫生教研室赠予。实验前对其进行鉴定(R因子和自发回变数鉴定),均符合规定标准。
1.1.3 细胞
中国仓鼠卵巢(CHO)细胞由复旦大学公共卫生学院毒理教研室赠予。
1.1.4 动物
ICR小鼠(SPF级)共60只,每组10只,雌雄各半,5~6周龄,购入时体重16.5~20.8 g,由上海西普尔-必凯实验动物有限公司提供,动物质量合格证号:2008001629237。自购入起3天进行检疫,给药时体重20.3~23.6 g。
1.2 试验方法
按《新药(西药)临床前研究指导原则汇编》[5-6]的设计要求,分别应用Ames试验[7]、体外培养CHO细胞染色体畸变试验[8]和小鼠骨髓微核试验[9]检测WA的遗传毒性。检测终点覆盖了基因突变、染色体畸变和细胞有丝分裂异常。
1.3 实验步骤
1.3.1 Ames实验
根据《药物遗传毒性研究技术指导原则》的要求,应用S. typhimurium TA97、TA98、TA100、TA102和TA1535共5支菌株,设每皿5 000、500、50、5、0.5 μg 5个剂量组。此外,设空白对照、溶剂对照和阳性对照组(具体剂量见表1)。采用标准平板掺入法,使细菌在加和不加代谢活化系统S9的条件下接触受试物,每皿均加入供试品或溶剂对照DMSO 0.1 ml,每个剂量组及对照组均设3个平行皿。并用最低极限的琼脂培养基培养48 h后,先用显微镜观察平皿上的菌苔生长情况,确定受试物无明显的抑菌或杀菌作用,再人工计数每皿回复突变的菌落数,记录原始数据,并计算每组的均值和标准差,与溶剂对照组进行比较,重复实验一次。
表 1 阳性对照品名称及浓度组别 菌株 阳性对照品 溶液终浓度(μg/皿) 加入量(μl/皿) 浓度(μg/ml) -S9组 TA97 敌克松 50 100 500 TA98 敌克松 50 100 500 TA100 甲基磺酸甲酯 1 100 10 TA102 甲基磺酸甲酯 1 100 10 TA1535 4-硝基喹啉-N-氧化物 0.5 100 5 +S9组 TA97 2-氨基芴 10 100 100 TA98 2-氨基芴 10 100 100 TA100 2-氨基芴 10 100 100 TA102 1,8-二羟基蒽醌 50 100 500 TA1535 环磷酰胺 50 100 500 1.3.2 染色体畸变试验
在加和不加代谢活化系统S9的条件下,体外培养的CHO细胞中加入相应浓度的供试品或对照品,反应体系总体积为10 ml。低、中、高剂量组供试品终浓度分别为23.74、47.48和94.96 μg/ml,阳性对照组丝裂霉素C和环磷酰胺的终浓度分别为0.5 μg/ml、60 μg/ml,另设溶剂对照组分别作用于细胞4 h后换液继续培养至24 h,和药物作用细胞24 h后收集细胞。收获细胞前4 h,加入终浓度0.2 μg/ml秋水仙素,培养结束收集细胞,经离心、低渗处理、固定、离心、制片和Giemsa染色,每个剂量组制备2~3张玻片标本。
镜检时每组观察200个染色体中分散良好、数目完整的中期分裂相细胞(若观察到大量染色体畸变细胞,如阳性对照组,分析细胞数可相应减少为至少100个细胞)。计数染色体或染色单体的断裂、缺失及其他类型结构异常的数目(裂隙和核内复制一般不作为畸变类型),记录原始数据计算畸变率。
1.3.3 小鼠骨髓微核实验
检疫期结束后分别按低、中、高组小鼠给药,分别予100、200、400 mg/kg剂量给药,其中高剂量组设两组分别在药物作用24 h和48 h后处死,并设阳性对照组和溶剂对照组。分别在药物作用24 h和48 h后处死小鼠,取股骨骨髓制成骨髓涂片,每只动物制2张涂片,经甲醇固定后用pH6.8的Giemsa染液染色。
每只动物镜检约2000个骨髓嗜多染红细胞(PCE),计数含微核的PCE数(MNPCE),计算微核发生率,同时记录200个PCE计数过程中观察到的正染红细胞(NCE)的数目,并计算PCE/NCE值。
1.4 剂量设计
对于易溶无毒的化合物,细菌实验最高浓度应达到5 mg/皿[10]。Ames试验设每皿5 000、500、50、5、0.5 μg 5个剂量组,每皿均加入相应浓度的供试品溶液0.1 ml,另设空白对照、溶剂对照和阳性对照。在哺乳动物细胞体外遗传实验中,毒性水平应高于50%细胞抑制率或细胞融合率[11]。通过预实验确定供试品的IC50为94.96 μg/ml。染色体畸变试验的低、中、高剂量组为23.74、47.48和94.96 μg/ml,试验时在10 ml的试验体系中分别加入0.1 ml各剂量组的应用液,另设阳性对照组和溶剂对照。ICR小鼠的微核试验采用小鼠经尾静脉注射给药,总剂量分别为100、200、400 mg/kg(单次给药剂量分别为50、100、200 mg/kg,分上、下午两次经尾静脉注射给药),给药容积为20 ml/kg体重;同时设阳性对照组和溶剂对照组。阳性对照组以40 mg/kg体重的剂量腹腔注射环磷酰胺,给药容量为10 ml/kg体重;溶剂对照组给药方式与受试物组相同,以20 ml/kg体重的容积经尾静脉注射生理盐水。
1.5 统计方法
Ames试验结果的评价是以溶剂对照组的回复突变菌落数为基础,与受试物各剂量组相比较。若某剂量组回复突变菌落数为溶剂对照组的2倍以上,呈现可重复性,并在一定的剂量范围内存在着剂量-反应关系,则判断为阳性[12]。染色体畸变试验和小鼠骨髓微核试验均采用卡方检验或方差分析方法研究给药组与对照组之间是否具有统计学意义[13]。
2. 结果与分析
2.1 Ames试验结果
受试物各剂量组和对照组的平皿均可见背景菌苔生长。5支菌株的自发回复突变菌落数以及阳性对照品诱发的回复突变菌落数均在历史参考范围内,并且各菌株阳性对照组的回复突变菌落与空白对照组相比数目显著增加,提示本试验系统符合要求。在最高剂量已达到5 000 μg/皿的受试条件下,未观察到受试物的抑菌现象。各剂量组受试物在加或不加S9时对TA97、TA98、TA100、TA102和TA1535所诱发的回复突变菌落数均与自发的突变菌落数相近,未观察到明显的剂量-反应关系。结果见表2和表3。
表 2 WA对5支菌株的回变菌落数试验结果(个/皿,${\rm{\bar x}}$ ±s)(第1次)组别(μg/皿) TA97 TA98 TA100 TA102 TA1535 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 5 000 36±5 40±4 21±3 21±2 131±26 93±17 177±21 185±25 25±3 14±2 500 36±5 39±8 17±4 20±3 114±22 90±23 195±8 207±7 23±1 19±1 50 39±10 35±5 21±7 21±3 115±21 97±8 196±33 179±18 19±8 16±4 5 41±6 40±3 21±5 22±4 114±15 87±19 195±21 193±8 19±2 14±1 0.5 37±6 39±3 20±3 19±3 128±15 91±12 201±14 205±14 20±6 16±4 空白对照组 40±7 36±5 17±2 19±4 99±17 89±9 213±30 197±34 21±7 19±4 溶剂对照组 40±6 34±1 22±5 26±2 95±8 89±9 193±8 199±29 23±3 14±1 阳性对照组 839±24 841±47 936±56 1 077±55 968±27 1 111±66 1 101±17 1 024±53 342±44 345±13 表 3 WA对5支菌株的回变菌落数试验结果(个/皿,${\rm{\bar x}}$ ±s)(第2次)组别(μg/皿) TA97 TA98 TA100 TA102 TA1535 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 5 000 38±5 34±5 20±5 21±5 128±24 105±26 179±21 189±19 20±4 20±3 500 39±7 34±3 21±2 20±7 108±13 92±28 192±16 187±30 16±3 19±4 50 38±9 30±3 19±3 18±1 117±14 102±5 197±5 196±22 17±3 18±1 5 37±8 29±4 18±2 17±1 111±5 98±33 206±24 191±21 16±1 20±2 0.5 35±6 33±8 24±2 23±3 107±7 97±8 203±6 193±10 15±4 15±4 空白对照组 38±3 41±4 22±3 23±4 96±12 93±8 205±17 186±19 18±2 18±4 溶剂对照组 38±3 37±8 22±3 23±4 98±7 100±12 202±15 197±10 18±2 19±4 阳性对照组 881±18 876±35 900±11 1 077±111 964±113 996±8 1 024±37 1 011±8 392±8 392±22 2.2 染色体畸变试验结果
染色体分析结果显示,阳性对照组能够诱发受试细胞染色体的畸变率明显增高,24 h在+ S9和-S9的情况下染色体畸变率分别为11%和11%,与溶剂对照组相比,均有统计学差异(P<0.05);23.74、47.48和94.96 μg/ml受试物在24 h、+S9条件下染色体畸变率分别为1%、1%和0.5%,24 h、-S9条件下染色体畸变率分别为0%、0.5%和0%;4 h、-S9条件下染色体畸变率分别为0%、0%和0%。综上,受试物各剂量组细胞染色体畸变率均小于5%,与溶剂对照组结果相比,其差异均无统计学意义(P>0.05)。结果见表4~6。
表 4 WA对24 h体外培养CHO细胞的染色体畸变试验结果(+S9)组别 观察细胞数
(个)各类染色体畸变数 畸变细胞数
(个)畸变率
(%)断裂 断片 双着丝粒 三辐体 四辐体 碎片或微小体 环状 多倍体 23.74 μg/ml 200 1 1 0 0 0 0 0 1 2 1 47.48 μg/ml 200 2 2 0 0 0 0 0 0 2 1 94.96 μg/ml 200 0 0 0 0 0 0 0 0 1 0.5 溶剂对照组 200 200 0 0 0 0 0 3 3 3 1.5 阳性对照组 100 9 0 0 1 3 3 0 0 14 14 注:阳性对照组:+S9、环磷酰胺(60 mg/ml);溶剂对照组:DMSO;* P<0.05,与溶剂对照组比较。 表 5 WA对24 h体外培养CHO细胞的染色体畸变试验结果(-S9)组别 观察细胞数
(个)各类染色体畸变数 畸变细胞数
(个)畸变率
(%)断裂 断片 双着丝粒 三辐体 四辐体 碎片或微小体 环状 多倍体 23.74 μg/ml 200 0 0 0 0 0 0 0 0 0 0 47.48 μg/ml 200 1 0 0 0 0 0 0 0 1 0.5 94.96 μg/ml 200 0 0 0 0 0 0 0 0 0 0 溶剂对照组 200 0 0 0 0 0 0 0 0 0 0 阳性对照组 100 4 4 0 0 0 0 4 0 12 12* 注:阳性对照组:-S9、丝裂霉素C(0.5 mg/ml);溶剂对照组:DMSO;*P<0.05,与溶剂对照组比较。 表 6 WA对4 h体外培养CHO细胞的染色体畸变试验结果(-S9/4 h)组别 观察细胞数
(个)各类染色体畸变数 畸变细胞数
(个)畸变率
(%)断裂 断片 双着丝粒 三辐体 四辐体 碎片或微小体 环状 多倍体 23.74 μg/ml 200 0 0 0 0 0 0 0 0 0 0 47.48 μg/ml 200 0 0 0 0 0 0 0 0 0 0 94.96 μg/ml 200 0 0 0 0 0 0 0 0 0 0 溶剂对照组 200 阳性对照组 * P<0.05,与溶剂对照组比较。 2.3 小鼠骨髓微核试验的结果
试验结果经统计学分析表明,WA在100、200、400 mg/kg剂量下未观察到对小鼠骨髓的抑制作用,溶媒对照组和阳性对照组雌、雄性小鼠骨髓PCE微核发生率分别为2.10‰和21.36‰、1.90‰和20.88‰,两组相比差异均有统计学意义(P<0.05),验证了本次试验系统的有效性。WA 100和2 000 mg/kg剂量24 h采样组雌、雄小鼠骨髓PCE微核率分别为1.60‰和1.80‰、1.90‰和1.60‰;400 mg/kg剂量24 h和48 h采样组雌、雄小鼠骨髓PCE微核率分别为2.10‰和2.80‰、2.40‰和1.29‰,与溶媒对照组相比均无显著差异(P>0.05)。结果见表7。
表 7 WA对小鼠骨髓嗜多染红细胞的微核效应试验结果组别 性别 动物数(只) 观察PCE数(个) PCE/NCE(${\rm{\bar x}}$±s) 微核率(${\rm{\bar x}}$±s, ‰) 100 mg/kg 雌 5 10 020 2.40±0.89 1.60±0.96 200 mg/kg 雌 5 10 010 1.63±0.40 1.80±1.31 400 mg/kg (24 h采样) 雌 5 10 016 1.95±0.40 2.10±1.20 400 mg/kg (48 h采样) 雌 5 10 009 1.58±0.44 2.80±1.81 溶媒对照组 雌 5 10 009 2.37±0.69 2.10±1.20 阳性对照组 雌 5 9 095 2.18±0.30 21.36±7.84* 100 mg/kg 雄 5 10 016 1.56±0.30 1.90±1.28 200 mg/kg 雄 5 10 009 1.52±0.28 1.60±0.70 400 mg/kg (24 h采样) 雄 5 10 006 1.40±0.73 2.40±2.01 400 mg/kg (48 h采样) 雄 5 8 802 1.43±0.63 1.29±1.26 溶媒对照组 雄 5 9 029 2.13±0.58 1.90±1.45 阳性对照组 雄 5 10 011 1.62±0.42 20.88±4.94* *P<0.05,与溶剂对照组比较。 3. 讨论
沙门菌回复突变试验(Ames试验)被研究者广为采用,该法的特点是快速、简便、敏感、经济,是经典的测试化学物质或药物致突变性实验[10]。染色体畸变分析是采用中国仓鼠卵巢(CHO)细胞体外培养的方法进行的。CHO细胞在加或不加代谢活化系统的条件下,与受试物接触一定时间后再于收集染色体4 h前用秋水仙碱处理,使细胞的有丝分裂停止在中期相。然后收集细胞,经低渗、固定、涂片和染色后,在显微镜下观察染色体数量和结构的改变,检测受试物的诱变性[7]。微核试验是检测化合物对染色体损伤作用的重要方法。凡能使染色体发生断裂或使染色体和纺锤体联结损伤的化合物,微核试验都可检测[8]。
本研究采用遗传毒性研究经典组合的方法,分别从原核系统到真核系统,从体外试验系统到体内试验系统,体外试验中包含了加与不加代谢活化系统,能检测基因突变、染色体畸变等多个遗传学终点,符合国际标准化的要求[5-6]。
本研究结果显示,本试验条件下,采用标准平板掺入法,WA在每皿5 000、500、50、5、0.5 μg的受试剂量下,加或不加S9时对组氨酸缺陷型鼠伤寒沙门菌均无致突变性;对CHO细胞,在23.74、47.48、94.96 μg/ml 3个剂量组,加或不加S9,于24 h和48 h诱发的细胞染色体畸变率均小于5%,与溶剂对照组结果相比较其差异均无统计学意义(P>0.05),表明WA在受试剂量下无致CHO细胞染色体畸变效应;WA在100、200、400 mg/kg 3个剂量下,对ICR小鼠的微核诱发率与溶剂对照组比较均无显著差异,表明其在受试剂量下对ICR小鼠无致微核效应[14]。上述结果提示WA没有遗传毒性和潜在致癌性。
此前有文献表明WA对小细胞肺癌的增殖有抑制作用,但对于遗传毒性未见报道。本研究对降低WA在研发过程中用于临床试验和疾病治疗的用药风险发挥重要作用。
-
表 1 5种指示菌平板培养条件及遴选的阳性对照药
指示菌 培养条件 阳性药 B. mycoides(蕈状芽胞杆菌) MHA, 37 ℃ 万古霉素 S. aureus(金黄色葡萄球菌) MHA, 37 ℃ 万古霉素 M. smegmatis(耻垢分支杆菌) MHA, 37 ℃ 卡那霉素 E. coli(大肠杆菌) MHA, 37 ℃ 萘啶酮酸 C. albicans(白色念珠菌) PDA, 30 ℃ 两性霉素 -
[1] YANG C F, QIAN R, XU Y, et al. Marine actinomycetes-derived natural products[J]. Curr Top Med Chem,2019,19(31):2868-2918. [2] FENICAL W, JENSEN P R. Developing a new resource for drug discovery: marine actinomycete bacteria[J]. Nat Chem Biol,2006,2(12):666-673. doi: 10.1038/nchembio841 [3] BLUNT J W, CARROLL A R, COPP B R, et al. Marine natural products[J]. Nat Prod Rep,2018,35(1):8-53. doi: 10.1039/C7NP00052A [4] THOMAS T, MOITINHO-SILVA L, LURGI M, et al. Diversity, structure and convergent evolution of the global sponge microbiome[J]. Nat Commun,2016,7:11870. doi: 10.1038/ncomms11870 [5] MORI T, CAHN J K B, WILSON M C, et al. Single-bacterial genomics validates rich and varied specialized metabolism of uncultivated <italic>Entotheonella</italic> sponge symbionts[J]. Proc Natl Acad Sci USA,2018,115(8):1718-1723. doi: 10.1073/pnas.1715496115 [6] TIANERO M D, BALAICH J N, DONIA M S. Localized production of defence chemicals by intracellular symbionts of <italic>Haliclona</italic> sponges[J]. Nat Microbiol,2019,4(7):1149-1159. doi: 10.1038/s41564-019-0415-8 [7] CHOSHI T, UCHIDA Y, KUBOTA Y, et al. Lipase-catalyzed asymmetric synthesis of desprenyl-carquinostatin A and descycloavandulyl-lavanduquinocin[J]. Chem Pharm Bull,2007,55(7):1060-1064. doi: 10.1248/cpb.55.1060 [8] Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; approved standard-eighth edition[M]. CLSI document M07-A8. Wayne, PA: Clinical and Laboratory Standards Insitute, 2009. [9] FURUKAWA Y, SAWAMOTO A, YAMAOKA M, et al. Effects of carbazole derivatives on neurite outgrowth and hydrogen peroxide-induced cytotoxicity in Neuro2a cells[J]. Molecules,2019,24(7):E1366. doi: 10.3390/molecules24071366 [10] KOBAYASHI M, TOMITA T, SHIN-YA K, et al. An unprecedented cyclization mechanism in the biosynthesis of carbazole alkaloids in <italic>Streptomyces</italic>[J]. Angew Chem Int Ed Engl,2019,58(38):13349-13353. doi: 10.1002/anie.201906864 [11] GUTIÉRREZ M, CAPSON T L, GUZMÁN H M, et al. Antiplasmodial metabolites isolated from the marine octocoral Muricea austera[J]. J Nat Prod,2006,69(10):1379-1383. doi: 10.1021/np060007f [12] 陈明华, 巫晔翔, 董飚, 等. 链霉菌CPCC 202950的化学成分研究[J]. 中国中药杂志, 2015, 40(7):1320-1324. [13] SOLEDADE M, PEDRAS C, MORALES V M, et al. Phomapyrones: Three metabolites from the blackleg fungus[J]. Phytochemistry,1994,36(5):1315-1318. doi: 10.1016/S0031-9422(00)89658-2 [14] 王聪, 王立平, 范杰, 等. 深海链霉菌<italic>Streptomyces malaysiensis</italic> OUCMDZ-2167来源的细胞毒性产物[J]. 有机化学, 2017, 37(3):658-666. [15] MA M, RATEB M E, YANG D, et al. Germicidins H-J from <italic>Streptomyces sp</italic>. CB00361[J]. J Antibiot,2017,70(2):200-203. doi: 10.1038/ja.2016.100 [16] BUTLER M S, ROBERTSON A A B, COOPER M A. Natural product and natural product derived drugs in clinical trials[J]. Nat Prod Rep,2014,31(11):1612-1661. doi: 10.1039/C4NP00064A [17] SCHMIDT A W, REDDY K R, KNÖLKER H J. Occurrence, biogenesis, and synthesis of biologically active carbazole alkaloids[J]. Chem Rev,2012,112(6):3193-3328. doi: 10.1021/cr200447s [18] KNÖLKER H J, REDDY K R. Isolation and synthesis of biologically active carbazole alkaloids[J]. Chem Rev,2002,102(11):4303-4427. doi: 10.1021/cr020059j [19] KATO S, SHINDO K, KATAOKA Y, et al. Studies on free radical scavenging substances from microorganisms. Ⅱ. Neocarazostatins A, B and C, novel free radical scavengers[J]. J Antibiot,1991,44(8):903-907. doi: 10.7164/antibiotics.44.903 [20] SHIN-YA K, KUNIGAMI T, KIM J S, et al. Carquinostatin B, a new neuronal cell-protecting substance produced by <italic>Streptomyces exfoliatus</italic>[J]. Biosci Biotechnol Biochem,1997,61(10):1768-1769. doi: 10.1271/bbb.61.1768 [21] SOBOLEVSKAYA M P, DENISENKO V A, MOISEENKO A S, et al. Bioactive metabolites of the marine actinobacterium <italic>Streptomyces sp</italic>. KMM 7210[J]. Russ Chem Bull,2007,56(4):838-840. doi: 10.1007/s11172-007-0126-9 [22] 何其伟, 刘吉开, 杜子伟, 等. 齿贝栓菌的化学成分[J]. 安徽中医学院学报, 2011, 30(2):73-76. [23] HEIDARI B, MOHAMMADIPANAH F. Isolation and identification of two alkaloid structures with radical scavenging activity from <italic>Actinokineospora sp</italic>. UTMC 968, a new promising source of alkaloid compounds[J]. Mol Biol Rep,2018,45(6):2325-2332. doi: 10.1007/s11033-018-4395-1 [24] PETERSEN F, ZÄHNER H, METZGER J W, et al. Germicidin, an autoregulative germination inhibitor of <italic>Streptomyces viridochromogenes</italic> NRRL B-1551[J]. J Antibiot,1993,46(7):1126-1138. doi: 10.7164/antibiotics.46.1126 -





 下载:
下载:


 下载:
下载:


