-
胃康颗粒由黄芪、三七等九味中药经微粉化制粒而成,具有通降气机、和胃健运的功效[1],在临床上主要用于治疗慢性胃炎、溃疡性结肠炎、术后残胃炎、胃癌合并上消化道出血等疾病[2-3]。方中黄芪可以补气健脾、固表、利尿脱毒[4],三七可以散瘀止血,消肿定痛[5]。黄芪中所含的黄芪甲苷以及三七中所含的人参皂苷Rb1是胃康颗粒的主要活性成分,也是其含量测定的重要检测指标。《中国药典》2015版中采用HPLC-ELSD法测定黄芪中黄芪甲苷的含量,用高效液相色谱-紫外检测(HPLC-UV)法测定三七中人参皂苷Rb1的含量,无法按药典方法同时测定人参皂苷Rb1和黄芪甲苷。有关文献[6-9]采用HPLC-ELSD法同时测定制剂中三七皂苷R1、人参皂苷Rg1、Re、Rb1、Rd的含量,该方法简便、准确、分离好,灵敏度高,重复性好,无干扰,对建立三七药材及其制剂的质量控制方法有参考价值。陈骁勇[10]、王银[11]等采用HPLC-ELSD分别测定参芪五味子片、益肺清化颗粒中的有效成分的含量,该方法可以同时测定皂苷类成分和黄芪甲苷的含量,简便快捷、结果准确、重复性好。因此,本研究参考相关文献,优化胃康颗粒中人参皂苷Rb1和黄芪甲苷的提取方法,并建立同时测定人参皂苷Rb1和黄芪甲苷含量的方法,作为控制胃康颗粒质量的方法之一。
-
98-1-B型电子调温电热套(天津泰斯特仪器有限公司);RE-2000A旋转蒸发器(上海亚荣生化仪器厂);Agilent 1220高效液相色谱仪、Agilent G4260B型蒸发光散射检测器、Splaris 230 Vac型空气发生器(均为安捷伦科技有限公司产品);BSA223S-CW型电子分析天平(德国赛多利斯)。
-
胃康颗粒(宁夏医科大学自制);黄芪甲苷对照品(批号:110781-201616,纯度为96.9%)、人参皂苷Rb1对照品(批号:110704-201827,纯度为91.2%)均购自中国食品药品检定研究院;甲醇、乙腈为色谱纯;水为娃哈哈水;其他为分析纯。
-
色谱柱:XBridge ®Shield RP18(4.6 mm×250 mm,5 μm);流动相:乙腈-水(32:68,V/V);流速:1.0 ml/min;柱温:30 ℃;进样量:20 μl;蒸发光检测器,漂移管温度为60 ℃,雾化室温度为33 ℃,载气流量为1.7 SLM。
-
综合相关文献及2015版《中国药典》关于测定芪参胶囊中三七皂苷R1和黄芪甲苷含量的方法,初步拟定胃康颗粒的提取方法:取装量差异项下的本品内容物,精密称定,置具塞锥形瓶中,精密加入甲醇,密塞,称定重量,超声处理,取出,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液,回收溶剂至干,残渣加水使溶解,加水饱和的正丁醇振摇提取,合并正丁醇提取液,用浓氨试液洗涤,弃去洗涤液,正丁醇提取液回收溶剂至干,残渣加甲醇使溶解并转移至量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。本研究筛选并优化该提取工艺中的提取方式、提取溶剂、提取料液比、提取时间、正丁醇提取次数和氨水洗涤次数。
-
实验时曾采用相关文献[9]中供试品处理的方法,发现供试品溶液的HPLC图谱在黄芪甲苷处峰形较小,故本研究在保证人参皂苷Rb1含量的前提下,采用相关文献中甲醇超声提取和回流提取两种方式,结果如表1所示,可知回流提取人参皂苷Rb1和黄芪甲苷的含量较高,故综合考虑认为选择回流提取较为适宜。
表 1 不同提取方式对人参皂苷Rb1和黄芪甲苷含量的影响
提取方式 人参皂苷Rb1(mg/g) 黄芪甲苷(mg/g) 超声 1.4443±0.0182 0.1849±0.0049 回流 2.4407±0.0032 0.2463±0.0696 -
皂苷类成分常采用水、甲醇、乙醇作为提取溶剂,因此分别用上述3种提取溶剂,对供试品进行提取并测定含量,结果如表2所示,水的提取效果较差,而以甲醇提取时,人参皂苷Rb1和黄芪甲苷的含量最高,故选择甲醇为提取溶剂。
表 2 不同提取溶剂对人参皂苷Rb1和黄芪甲苷含量的影响
提取溶剂 人参皂苷Rb1(mg/g) 黄芪甲苷(mg/g) 水 0.4566±0.0029 ND 甲醇 2.3946±0.0164 0.2336±0.0397 乙醇 1.3876±0.0158 0.1049±0.0263 -
参照相关文献分别选取1∶3、1∶6、1∶10、1∶20、1∶50的5种料液比进行提取,并测定提取液中人参皂苷Rb1和黄芪甲苷的含量,考察结果如表3所示,人参皂苷Rb1和黄芪甲苷的含量在料液比1∶6时达到峰值,且从节省溶剂的角度考虑,选择料液比1∶6提取较为适宜。
表 3 不同提取料液比对人参皂苷Rb1和黄芪甲苷含量的影响
提取料液比(V∶V) 人参皂苷Rb1(mg/g) 黄芪甲苷(mg/g) 1∶3 2.4385±0.0179 0.1971±0.0065 1∶6 3.1305±0.0354 0.3647±0.0083 1∶10 2.6230±0.0261 0.2259±0.0146 1∶20 1.8379±0.0010 ND 1∶50 0.6474±0.0273 ND -
分别采用0.5、1、1.5、2 h的4种提取时间,对供试品进行提取并测定人参皂苷Rb1和黄芪甲苷的含量,结果如表4所示,随着提取时间的延长,人参皂苷Rb1和黄芪甲苷的含量也随之逐渐上升,不过1.5 h后,人参皂苷Rb1和黄芪甲苷的含量不增反降,考虑可能是因为浸提液受热时间长,破坏了药材成分,从而导致人参皂苷Rb1和黄芪甲苷的含量不增反降,故提取时间选择1.5 h较为适宜。
表 4 不同提取时间对人参皂苷Rb1和黄芪甲苷含量的影响
提取时间(h) 人参皂苷Rb1(mg/g) 黄芪甲苷(mg/g) 0.5 1.9815±0.0591 0.1764±0.0107 1 2.2053±0.0154 0.1951±0.0026 1.5 2.2086±0.0377 0.2184±0.0032 2 0.0806±0.0015 ND -
分别采用正丁醇提取3、4、5、6次,并对提取液测定人参皂苷Rb1和黄芪甲苷的含量,结果如表5所示,正丁醇提取5次时,人参皂苷Rb1和黄芪甲苷的含量较高,但是继续增加正丁醇提取次数,人参皂苷Rb1和黄芪甲苷的含量的增幅不大。综合考虑后续试验及成本等因素,选择正丁醇提取5次较为适宜。
表 5 正丁醇提取次数对人参皂苷Rb1和黄芪甲苷含量的影响
正丁醇提取次数 人参皂苷Rb1(mg/g) 黄芪甲苷(mg/g) 3次 1.6452±0.0234 0.1459±0.0214 4次 1.9642±0.0063 0.1874±0.0209 5次 2.5756±0.0213 0.2379±0.0030 6次 2.4577±0.0178 0.2384±0.0081 -
分别采用氨水洗涤1、2、3次,对供试品进行提取并测定人参皂苷Rb1和黄芪甲苷的含量,结果如表6所示,氨水洗涤2次时,人参皂苷Rb1和黄芪甲苷的含量最高,故选择氨水洗涤2次较为适宜。
表 6 氨水洗涤次数对人参皂苷Rb1和黄芪甲苷含量的影响
氨水洗涤次数 人参皂苷Rb1(mg/g) 黄芪甲苷(mg/g) 1次 2.3970±0.0851 0.2776±0.0201 2次 2.4393±0.0236 0.2875±0.0050 3次 2.1734±0.0009 0.2766±0.0024 -
精密称定黄芪甲苷5 mg和人参皂苷Rb1 4 mg,置10 ml量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得混合对照品溶液。
-
取本品5 g,精密称定,置圆底烧瓶中,精密加入甲醇30 ml,称定重量,回流提取1.5 h,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液20 ml,蒸干,残渣加水20 ml使溶解,加水饱和的正丁醇提取5次,每次20 ml,合并正丁醇提取液,用浓氨试液洗涤2次,每次30 ml,弃去洗涤液,正丁醇液蒸干,残渣加甲醇溶解并转移至5 ml量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
-
分别按处方比例取除黄芪和三七的其余中药饮片,照胃康颗粒的制法制成黄芪阴性样品和三七阴性样品,取黄芪阴性样品4.09 g和三七阴性样品4.55 g,照供试品溶液的制备方法分别制成缺黄芪和缺三七的阴性对照溶液。
-
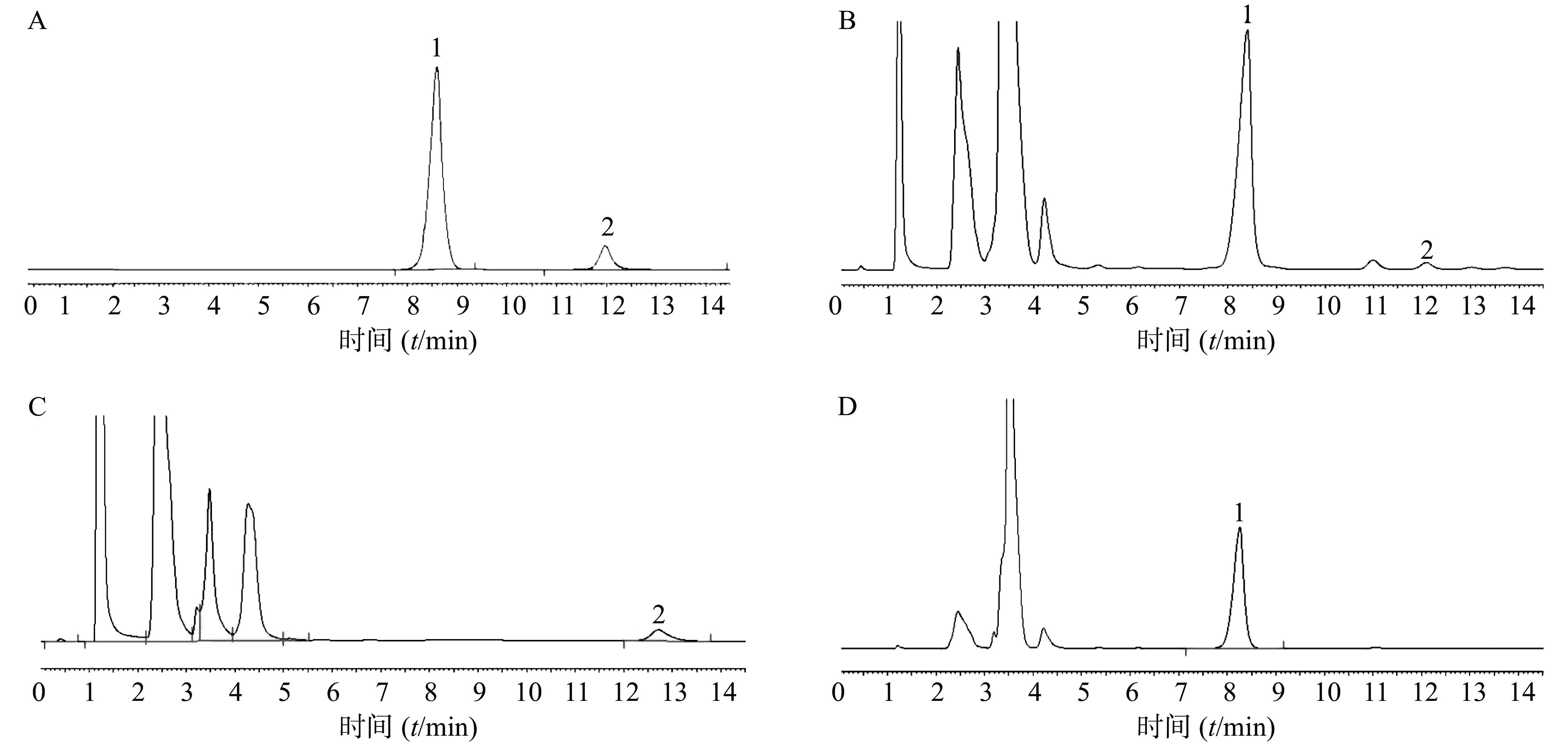
取对照品、供试品和阴性对照品溶液各20 μl,注入液相色谱仪,按“2.1”项下色谱条件测定,人参皂苷Rb1的保留时间约为8 min,黄芪甲苷的保留时间约为12 min,峰形对称尖锐,基线平稳,与其他色谱峰分离良好,阴性样品无干扰,详见图1。
-
精密吸取混合对照品溶液1、3、9、12、15、18、21、24 μl,注入液相色谱仪,测定峰面积积分值。分别以人参皂苷Rb1和黄芪甲苷对照品进样量的对数值为横坐标(X1和X2),峰面积积分值的对数值为纵坐标(Y1和Y2),绘制标准曲线,计算回归方程。得人参皂苷Rb1和黄芪甲苷的回归方程分别为:
Y1 = 1.4444X1 + 4.3621,r=0.9995
Y2 = 1.5656X2 + 3.9467,r=0.9999
结果表明,人参皂苷Rb1在1.70~40.80 μg/ml的浓度范围内、黄芪甲苷在5.03~120.72 μg/ml的浓度范围内,与各自峰面积积分值呈良好的线性关系。
-
取同一供试品溶液,精密吸取20 μl,按上述色谱条件,重复进样6次,记录色谱峰面积,计算人参皂苷Rb1和黄芪甲苷色谱峰面积积分对数值的RSD值分别为0.21%、0.39%,表明该方法日内精密度良好。
取同一供试品溶液,精密吸取20 μl,按上述色谱条件,重复进样2次,连续3 d,记录色谱峰面积,计算人参皂苷Rb1和黄芪甲苷色谱峰的峰面积积分对数值的RSD值分别为0.22%和0.36%,表明该方法日间精密度良好。
-
取本品同一供试品(批号20200112)约5.0 g,共6份,精密称定,照供试品溶液的制备方法制成供试液。按“2.1”项下色谱条件,测定峰面积并计算含量,人参皂苷Rb1和黄芪甲苷的平均含量分别为2.8609和0.2530 mg/g,RSD分别为1.97%和2.89%,表明此法重复性良好。
-
取已知含量的同一批胃康颗粒约5.0 g,共6份,精密称定,分别精密加入一定量的人参皂苷Rb1对照品和黄芪甲苷对照品,按供试品溶液制备方法制备,按“2.1”项下色谱条件测定含量,计算人参皂苷Rb1和黄芪甲苷的加样回收率分别为95.65%和 100.57%,RSD分别为1.06%和0.62%。
-
取3批样品,按建立的方法测定人参皂苷Rb1和黄芪甲苷的含量。分别精密吸取对照品溶液10、20 μl,供试品溶液20 μl,注入液相色谱仪测定,以外标两点法对数方程计算,即得。结果如表7所示,胃康颗粒中人参皂苷Rb1和黄芪甲苷的平均含量分别为2.8630和0.2576 mg/g,RSD分别为0.62%和1.51%。
表 7 3批胃康颗粒的含量测定结果
批号 人参皂苷Rb1(mg/g) 黄芪甲苷(mg/g) 20200112 2.8534 0.2594 20200115 2.8521 0.2531 20200118 2.8836 0.2602 平均值 2.8630±0.0178 0.2576±0.0039 RSD(%) 0.62 1.51 -
皂苷类成分的提取方法有很多,如有机溶剂提取法、超声波提取法等,在生产中由于不同的提取方法,其有效成分的含量也会出现差别,本实验在胃康颗粒的人参皂苷Rb1和黄芪甲苷提取方法筛选和优化过程中,发现超声提取所得供试品溶液的HPLC图谱在黄芪甲苷处峰形较小,而回流提取既可以保证人参皂苷Rb1的含量,又可以改善黄芪甲苷的峰形与含量,且提取效率高、生产成本低。皂苷类成分常采用水、乙醇、甲醇作为提取溶剂,当胃康颗粒以甲醇提取时,人参皂苷Rb1和黄芪甲苷的含量最高,故选择甲醇提取。我们尝试直接测定经甲醇提取后的胃康颗粒,发现色谱图中干扰物质多,故考虑采用正丁醇萃取黄芪甲苷和人参皂苷Rb1,再以氨水洗涤溶解提取浓缩的残渣,且由于黄芪甲苷在碱性环境下存在转化的过程,结合实验结果和药典方法,最终经甲醇提取胃康颗粒后,再选择正丁醇为萃取溶剂、氨试液为洗涤剂,从而除去干扰杂质,并且对氨水洗涤次数以及正丁醇萃取次数进行了考察,最终确定了最佳提取方法。本研究建立的提取方法的最大改进之处在于采用甲醇回流同时提取胃康颗粒中人参皂苷Rb1和黄芪甲苷两种成分,采用该提取方法制备的供试品溶液色谱的杂质峰少,且可提高人参皂苷Rb1和黄芪甲苷的提取含量。
-
三七中所含的皂苷类成分的紫外吸收均为末端吸收,常使用203 nm波长检测,易受噪音和梯度洗脱的影响,灵敏度低,基线噪音大;黄芪中黄芪甲苷的含量多采用ELSD测定。ELSD仅对不挥发成分产生信号,其信号响应值仅取决于被分析物质颗粒的大小和数量,不存在紫外末端吸收的问题,且通过调节漂移管温度、气体流速等参数可以使基线平稳。因此,本研究拟建立同时测定人参皂苷Rb1和黄芪甲苷的含量的HPLC-ELSD法。本实验考察了各个参数对含量测定结果的影响,发现流速为1.0 ml/min、漂移管温度为60 ℃、雾化室温度为33 ℃,载气压力为1.7 SLM时,仪器的灵敏度高,基线噪声小、信号稳定。ELSD的流动相不能使用非挥发性的试剂,可以使用的流动相仅有乙腈-水、甲醇-水。本实验考察了两种流动相对含量测定结果的影响,发现采用甲醇-水作为流动相或乙腈-水梯度洗脱,结果分离效果不好,改用乙腈-水(32∶68,V/V)作为流动相,人参皂苷Rb1和黄芪甲苷的出峰时间适宜,峰形对称,且相邻杂质峰无干扰。本实验建立的HPLC-ELSD法最大的改进之处在于同时测定人参皂苷Rb1和黄芪甲苷的含量,且操作简单,灵敏度、稳定性及重现性很高,是一种值得推广应用的检测制剂中人参皂苷Rb1和黄芪甲苷成分的方法。
-
本研究建立了胃康颗粒中人参皂苷Rb1和黄芪甲苷两种指标性成分的提取方法,该方法采用回流提取同时提取了人参皂苷Rb1和黄芪甲苷两种成分,采用正丁醇萃取和氨水洗涤除去干扰杂质,可大幅缩短提取时间,提高效率,降低能量损耗,节约成本,有效提高了人参皂苷Rb1和黄芪甲苷的提取含量,在大规模生产中也具有可行性。
本研究建立了同时测定胃康颗粒中人参皂苷Rb1和黄芪甲苷含量的HPLC-ELSD法,该方法采用乙腈-水(32∶68,V/V)作为流动相等度洗脱,选择ELSD作为检测器并优化了相关检测参数。该方法操作简便、精密度高、稳定性好,可作为胃康颗粒指标性成分含量测定和质量控制的方法,为胃康颗粒质量标准的建立提供依据。
Detectione of the contents of ginsenoside Rb1 and astragaloside IV in Weikang granules by HPLC-ELSD
-
摘要:
目的 优化胃康颗粒中人参皂苷Rb1和黄芪甲苷的提取方法,并建立其含量测定方法。 方法 以人参皂苷Rb1和黄芪甲苷的含量作为指标,采用单因素考察法对提取工艺进行优化;采用高效液相色谱-蒸发光散射法(HPLC-ELSD),XBridge®Shield RP18(4.6 mm×250 mm,5 μm)为色谱柱;乙腈-水(32:68)为流动相;柱温为30 ℃;漂移管温度为60 ℃,载气流量为1.7 SLM,建立测定胃康颗粒中人参皂苷Rb1和黄芪甲苷含量的方法。 结果 当采用甲醇回流提取1.5 h,正丁醇提取5次,氨水洗涤2次时,人参皂苷Rb1和黄芪甲苷的提取含量较高;建立的HPLC-ELSD法测定人参皂苷Rb1和黄芪甲苷含量,线性关系良好(r > 0.9997),日内日间精密度均小于1%,加样回收率分别为95.65%和100.57%,稳定性和重复性的RSD均小于3%,含量分别为2.8630 mg/g和0.2576 mg/g,RSD分别为0.62%和1.51%。 结论 优化了胃康颗粒中人参皂苷Rb1和黄芪甲苷的提取方法,建立了可靠、准确、重现性好的测定胃康颗粒中人参皂苷Rb1和黄芪甲苷含量的HPLC-ELSD方法。 -
关键词:
- 胃康颗粒 /
- 黄芪甲苷 /
- 人参皂苷Rb1 /
- 含量测定 /
- 高效液相色谱-蒸发光散射法
Abstract:Objective To optimize the extraction method and develop the detection method of ginsenoside Rb1 and astragaloside Ⅳ in Weikang granules. Methods The extraction process of ginsenoside Rb1 and astragaloside Ⅳ in Weikang granules were optimized by single factor investigation, with the contents of ginsenoside Rb1 and astragaloside Ⅳ as optimization indicators. The HPLC-ELSD method was developed for the detection of ginsenoside Rb1 and astragaloside Ⅳ in Weikang granules. Separation was carried out on an XBridge®Shield RP18 column (4.6 mm×250 mm, 5 μm) with a mobile phase consisting of acetonitrile-water(32:68)at the flow rate of 1 ml/min. The column temperature was maintained at 30 ℃. The drift tube temperature was set at 60 ℃, and the carrier gas flow rate was 1.7 SLM. Results The optimized extraction methods of ginsenoside Rb1 and astragaloside Ⅳ in Weikang granules were as the following: methanol reflux extraction for 1.5 h, and n-butanol extraction and ammonia washed for 5 and 2 times, respectively. The HPLC-ELSD method was established to detect the contents of ginsenoside Rb1 and astragaloside Ⅳ. The linear relationship was good (r > 0.9997). The intra-day and inter-day precision was less than 1%. The recovery rates were 95.65% and 100.57%. The stability and repeatability RSD were less than 3%. The contents were 2.8630 mg/g and 0.2576 mg/g. The RSDs were 0.62% and 1.51%, respectively. Conclusion The extraction method of ginsenoside Rb1 and astragaloside Ⅳ in Weikang granules is optimized, and a reliable, accurate and reproducible HPLC-ELSD method for the detection of the contents of ginsenoside Rb1 and astragaloside Ⅳ in Weikang granules is established. -
Key words:
- Weikang granules /
- astragaloside Ⅳ /
- ginsenoside Rb1 /
- content determination /
- HPLC-ELSD
-
紫茶生长于非洲肯尼亚海拔1 500~2 000 m的地区,主要成分为多酚类物质。现代药理研究表明,天然植物中的多酚具有抗肿瘤[1]、抗氧化[2]、抗菌[3]、抗衰老[4]等功效。课题组前期研究发现,紫茶提取物中多酚的纯度不高,直接影响相关制剂的开发。近年来,大孔吸附树脂的应用越来越广泛,尤其是在天然药物有效成分分离和纯化方面具有显著优势[5-8]。本实验以紫茶为研究对象,探索大孔吸附树脂对紫茶总多酚的纯化工艺,以期制备出纯度较高的紫茶总多酚,为其进一步开发利用提供理论依据。
1. 仪器与试药
UV-2550型紫外分光光度计(日本岛津);AUX220型电子分析天平(精度:0.1 mg,日本岛津);HH-2数显恒温水浴锅(江苏金坛市友联仪器研究所)。KQ-500B型超声波清洗器(昆山超声仪器有限公司)。
肯尼亚紫茶(批号:20181030,火烈鸟茶叶有限公司);没食子酸对照品(批号:110831-201605,中国食品药品检定研究院);铁氰化钾(温州市化学用料厂);ADS-17、D101、D301、AB-8、X-5型大孔吸附树脂(安徽三星树脂科技有限公司);氯化铁、盐酸、乙醇等试剂(西陇科学股份有限公司),以上试剂均为分析纯,水为纯化水。5种大孔吸附树脂的物理参数详见表1。
表 1 5种型号大孔吸附树脂物理参数型号 外观 极性 粒径(l/nm) 比表面积(m2/g) 平均孔径(l/μm) ADS-17 白色不透明球状颗粒 氢键 0.3~1.25 90~150 25~30 D101 白色半透明球状颗粒 非极性 0.3~1.25 480~520 25~28 D301 浅黄色半透明球状颗粒 中极性 0.3~1.25 550~600 48~58 AB-8 白色不透明球状颗粒 弱极性 0.3~1.25 480~520 130~140 X-5 白色不透明球状颗粒 非极性 0.3~1.25 500~600 290~300 2. 方法与结果
2.1 紫茶总多酚的含量测定
2.1.1 对照品溶液的制备
精密称取干燥至恒重的没食子酸对照品28.4 mg,置于100 ml量瓶中,加纯化水溶解并稀释至刻度,摇匀制备成母液。精密吸取1 ml母液置10 ml量瓶中,加纯化水稀释至刻度,配制成浓度为28.4 μg/ml的对照品溶液,置于冰箱中2~8 ℃避光保存。
2.1.2 供试品溶液的制备
称取紫茶粉末5.0 g,置于圆底烧瓶中,加入50%乙醇500 ml,加热回流提取30 min,放冷至室温,将药液滤过除去沉淀,滤液用50%乙醇补足减失的重量并稀释至500 ml。精密吸取1 ml稀释液,置于100 ml量瓶中,加水稀释至刻度,即得。
2.1.3 线性关系及方法学考察
分别精密吸取浓度为28.4 μg/ml的没食子酸对照品溶液0.2、0.3、0.5、0.8、1.0和1.2 ml于25 ml量瓶中,依次加入0.1 mol/L FeCl3溶液1.0 ml、1%K3[Fe(CN)6]溶液2.0 ml和0.1 mol/L HCl溶液0.5 ml,用纯化水稀释至刻度,摇匀,于室温下避光放置60 min。以相应试剂为空白,在775 nm处测定吸光度。以没食子酸质量浓度(X,μg/ml)为横坐标,以吸光度(Y)为纵坐标,绘制标准曲线,得回归方程:Y=0.769 9X+0.027 3(r=0.999 7),表明没食子酸浓度在0.227~1.363 μg/ml范围内与吸光度呈良好的线性关系。方法学考察结果表明,专属性良好,平均回收率为100.28%,RSD为2.09%;精密度和重复性试验的RSD小于3%。显示本方法准确可靠。
2.2 大孔吸附树脂的预处理
取5种不同型号的大孔吸附树脂在95%乙醇中浸泡24 h,使其充分溶胀,将浸泡后的树脂装柱,用95%乙醇以5 ml/min的体积流量冲洗,直至流出液澄清,之后用2倍体积的4%盐酸溶液浸泡3 h,用纯化水以5 ml/min的体积流量冲洗至中性,再用2倍体积的5%氢氧化钠溶液浸泡3 h,用纯化水以5 ml/min的体积流量冲洗至中性,最后用95%乙醇浸泡保存,临用时以5 ml/min体积流量的纯化水冲洗至中性。
2.3 静态吸附行为考察
2.3.1 大孔吸附树脂的筛选
取预处理后的ADS-17、D101、D301、AB-8、X-5型大孔吸附树脂约1 g,精密称定,共5份,置于50 ml具塞磨口锥形瓶中。加入质量浓度为50 μg/ml(以多酚含量计)的紫茶总多酚提取液20 ml,在30 ℃水浴的条件下振荡吸附24 h。吸附结束后,滤过,取续滤液按照“2.1”项下方法测定总多酚的含量,计算各树脂在30 ℃下对紫茶总多酚的吸附量和吸附率。然后,将上述吸附饱和的大孔树脂取出,用纯化水清洗后,分别加入70%乙醇20 ml,在30 ℃水浴的条件下振荡24 h,进行静态解吸,计算其解吸率,结果见表2。计算公式如下:
表 2 不同类型大孔树脂对紫茶总多酚的静态吸附率和解吸率树脂型号 吸附量(μg/g) 吸附率(%) 解吸量(μg/g) 解吸率(%) ADS-17 554.9 68.98 459.0 82.72 D101 621.6 77.74 341.4 54.93 D301 817.4 100.00 107.4 13.14 AB-8 701.8 82.20 598.2 86.73 X-5 727.8 89.90 600.8 81.13 吸附量=(C0−C1)V1/M
吸附率=(C0−C1)/C0
解吸量= C2 V2/M
解吸率=C2 V2/[(C0−C1)V]
其中,C0、C1为吸附前和吸附后吸附液中多酚的质量浓度,C2为解吸附后多酚的质量浓度,V1和V2分别为吸附液和解吸液体积,M为大孔树脂的质量。
由表2结果可知,大孔树脂D301对紫茶总多酚具有较强的吸附效果,其吸附率达到100%,其余4种树脂的吸附率从高到低依次是X-5、AB-8、D101、ADS-17。由此可见,不同类型的树脂对紫茶总多酚的吸附性能各不相同。这可能是由于树脂的内部结构、分子极性以及多酚的溶解度等对树脂吸附多酚能力的影响。多酚由于分子中酚羟基的存在,其分子极性较低,因而在与极性较弱或者非极性的树脂进行吸附时效果更好。采用50%的乙醇进行解吸,可以看出5种树脂的解吸率差异较大,AB-8树脂的解吸效果最好,解吸率达86.73%,X-5树脂次之。综合紫茶总多酚提取液的静态吸附和解吸试验,AB-8型树脂和X-5型树脂对紫茶总多酚的吸附效果和解吸效果均较好,而AB-8型树脂价格相对低廉,从节省成本的角度考虑,优先采用AB-8型树脂对其进行纯化。
2.3.2 静态吸附和解吸曲线的绘制
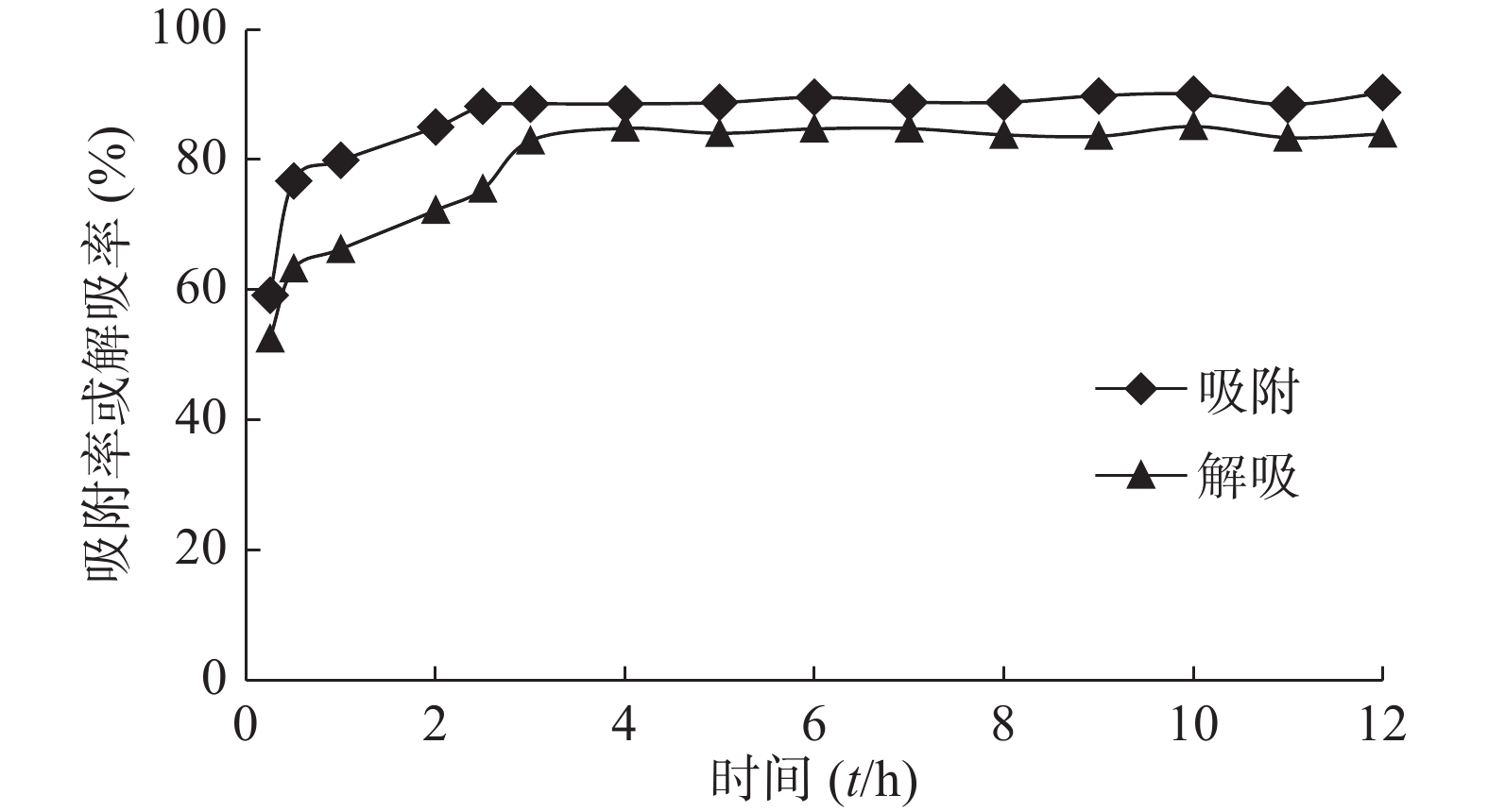
取预处理后的AB-8型大孔吸附树脂约1 g,精密称定,共15份,分别置于50 ml具塞磨口锥形瓶中,加入质量浓度为50 μg/ml的紫茶总多酚提取液20 ml,在25 ℃水浴的条件下振荡吸附12 h,每隔一段时间取出1个磨口锥形瓶,测定其总多酚的质量浓度,计算对应时间的吸附率,绘制静态吸附动力学曲线。然后,采用静态解吸试验的方法处理已吸附结束的树脂,进行静态解吸动力学试验,同样每隔一段时间取出1个磨口锥形瓶,测定其总多酚的质量浓度,计算对应时间的解吸率,绘制静态解吸动力学曲线,结果见图1。
由图1可知,在测定的时间点内,AB-8型大孔吸附树脂对紫茶总多酚的吸附量随着时间的延长而逐渐增多,经过2.5 h以后,树脂对紫茶总多酚的吸附量趋于平衡,对应的吸附率为88.27%。在0~5 h内,树脂的解吸率呈上升趋势,并在4 h达到最大值84.86%,在随后的时间里,解吸率随着时间的延长变化不大。
2.3.3 吸附液pH值对吸附率的影响
取预处理好的AB-8型大孔吸附树脂1 g,精密称定,共7份,分别置于50 ml具塞磨口锥形瓶中,分别加入质量浓度为50 μg/ml并用0.1 mol/L的盐酸和0.1 mol/L的氢氧化钠溶液调节pH值为2、3、4、5、6、7、8的紫茶总多酚提取液,在30 ℃水浴的条件下振荡吸附2.5 h,测定吸附液中紫茶总多酚的质量浓度,计算吸附率,结果见表3。
表 3 pH值对紫茶总多酚吸附率和解吸率的影响pH值 吸附量(μg/g) 吸附率(%) 2 702.4 89.79 3 712.4 90.79 4 700.3 87.77 5 706.3 89.07 6 652.5 85.71 7 641.7 83.19 8 558.4 71.54 由表3可知,吸附液pH值对紫茶总多酚的吸附率有较大影响。在pH值为2时,AB-8型大孔吸附树脂对此质量浓度下的紫茶总多酚吸附率达89.79%。因此,确定上样液的pH值为2。
2.4 动态吸附行为考察
2.4.1 泄露曲线的绘制
取预处理后的AB-8型树脂10 g,精密称定,室温下将质量浓度为250.0 μg/ml(调至pH为2)的紫茶总多酚提取液(供试品溶液用水稀释)以1.0 ml/min体积流量湿法加至树脂柱中,分段收集流出液,流出液每20 ml收集1份,测定吸光度,计算对应的总多酚含量,绘制泄露曲线。当流出液中总多酚的质量浓度达到上样液质量浓度的1/10,达到泄露点,认为此时为最佳上柱体积,结果见图2。在第2份流出液时,紫茶总多酚已经开始泄露,在第3份流出液中,总多酚的质量浓度为26.5 μg/ml,达到上样液质量浓度的1/10,因此选择上柱体积为60 ml,即3 BV。
2.4.2 上样液质量浓度的影响
取预处理好的AB-8型树脂10 g,精密称定,装入1.5 cm×20 cm的层析柱中,共5份,分别加入质量浓度为250、375、500、625、750、1 000 μg/ml的上样液(pH为2)各60 ml(3 BV),以1.0 ml/min的流速上柱,收集流出液,按“2. 1”项下方法测定总多酚含量,计算各质量浓度下的吸附率,确定最佳上样质量浓度。结果显示,各上样质量浓度下的吸附率分别为74.50%、77.56%、69.77%、60.59%、56.73%、43.61%。由此可见,上样液质量浓度对大孔吸附树脂吸附性能有显著影响,在考察范围内吸附率总体呈现出先上升后下降的趋势。当质量浓度小于375 μg/ml时,随着上样液质量浓度增加,动态吸附率呈现上升的趋势;分析原因可能是在此较低的浓度范围内,紫茶多酚有较大的机会与大孔树脂的内表面接触,进而加速扩散至树脂孔道内,形成吸附作用。而当质量浓度大于375 μg/ml时,随着质量浓度继续增加,位于孔道内的紫茶总多酚分子的扩散运动受到抑制,导致树脂对多酚的吸附能力降低。因此,选择上样液质量浓度为375 μg/ml。
2.4.3 上样液体积流量的影响
取预处理的AB-8型大孔吸附树脂10 g,精密称定,以湿法上柱法装入1.5 cm ×20 cm的层析柱中,共4份,轻敲柱壁,使柱内树脂平衡,打开下端阀门,控制体积流量使柱内纯化水流出,在液面距树脂1 cm时,将紫茶总多酚上样液(质量浓度为375 μg/ml,pH为2,上样量为3 BV)分别以1.0、2.0、3.0、4.0 ml/min的体积流量上柱,同时收集下端流出液,测定吸光度,计算吸附率,确定最佳上样体积流量。结果显示,吸附率分别为79.37%、79.78%、72.73%、64.73%,当上样体积流量为2.0 ml/min时,AB-8型大孔吸附树脂对紫茶总多酚的吸附率最大,故选择上样体积流量为2.0 ml/min。
2.4.4 径高比对动态吸附性能的影响
取预处理的AB-8型大孔吸附树脂10 g,精密称定,以湿法上柱法装入1.5 cm ×40 cm的层析柱中,分别设置径高比(柱直径与树脂填充高度比值)为1∶6、1∶9、1∶12、1∶15,将紫茶总多酚上样液(质量浓度为375 μg/ml,pH为2)分别以2.0 ml/min的体积流量上柱,对应的药液上样量分别为3、4.5、6、9 BV,收集下端流出液,测定吸光度,计算吸附率,确定最佳径高比。结果显示,吸附率分别为79.81%、78.37%、76.73%、68.54%。径高比1∶6和1∶9对吸附率影响不大。此后,在考察范围内,随着径高比值的降低,吸附率也呈现下降的趋势,可能是由于树脂层过高导致上样液穿透能力差所致。
2.4.5 洗脱剂体积分数的影响
取预处理后的AB-8型大孔吸附树脂10 g,精密称定,共5份,以湿法缓慢装入1.5 cm×20 cm的层析柱(径高比为1∶6,下同),将质量浓度为375 μg/ml上样液(调节pH为2)3 BV以2.0 ml/min的体积流量通过树脂柱,待吸附饱和后,分别用纯化水及25%、50%、75%、90%乙醇溶液各3 BV以1.0 ml/min的流速进行洗脱,收集洗脱液,测定其吸光度,计算解吸率,确定最佳洗脱剂体积分数。结果:解吸率分别为17.52%、62.96%、91.04%、81.41%、84.67%,由此可见,50%乙醇对紫茶总多酚的解吸作用最强,故选择洗脱剂的体积分数为50%。
2.4.6 洗脱剂用量的影响
取预处理后的AB-8型大孔吸附树脂10 g,精密称定,以湿法缓慢装入1.5 cm×20 cm的层析柱中,将375 μg/ml的上样液(pH为2)3 BV以2 ml/min的体积流量通过树脂柱,待吸附饱和后,用50%乙醇以1.0 ml/min的流速进行洗脱,洗脱溶剂用量分别为1、2、3、4、5 BV,收集洗脱液,测定其吸光度,计算洗脱率,确定最佳洗脱剂用量。结果:解吸率分别为54.68%、83.37%、90.29%、91.48%、91.45%,表明当50%乙醇用量在1~3 BV时,随着用量的增加,对紫茶总多酚的解吸率呈上升的趋势,随后继续增加洗脱剂的用量,解吸率不再增加,表明此时树脂上吸附的总多酚已被充分洗脱,没有必要再增加洗脱剂的用量,故确定洗脱剂的用量为4 BV。
2.4.7 洗脱剂体积流量对洗脱效果的影响
取预处理后的AB-8型大孔吸附树脂约10 g,精密称定,以湿法缓慢装入1.5 cm×20 cm的层析柱中,将375 μg/ml上样液(pH为2)3 BV以2.0 ml/min的体积流量通过树脂柱,待吸附饱和后,用50%乙醇溶液4 BV分别以1.0、2.0、4.0、6.0 ml/min的体积流量进行洗脱,计算解吸率,确定最佳体积流量。结果:对应的解吸率分别为92.47%、93.76%、91.97%、85.18%,表明紫茶总多酚的洗脱率随着洗脱体积流量的加大先升高后减小,故选择最佳洗脱体积流量为2 ml/min。
2.5 最佳工艺的验证
称取4份预处理后的大孔吸附树脂约10 g,精密称定,以湿法缓慢装入1.5 cm×20 cm层析柱中(径高比为1∶6),将紫茶提取物预先用石油醚(60~90 ℃)除去脂溶性色素,参考“2.1.2”项下方法加水稀释以制备浓度为375 μg/ml(pH为2)的紫茶总多酚溶液3 BV(总多酚质量为22.5 mg,质量分数40.2%,干膏56.0 mg),并以2 ml/min体积流量上样,待吸附饱和后,先用3 BV水去除杂质,然后用50%乙醇溶液4 BV以2 ml/min的体积流量洗脱,分别收集洗脱液,按照紫茶总多酚定量测定方法,计算总多酚洗脱量及洗脱率,再将洗脱液水浴蒸干,低温烘至恒重,计算干膏的量;精密称取干膏适量,测定总多酚的含量。结果见表4。
表 4 纯化工艺验证结果编号 加入量
(m/mg)纯化前 洗脱量
(m/mg)洗脱率
(%)纯化后 干膏量(m/mg) 质量分数(%) 干膏量(m/mg) 质量分数(%) 平均质量分数(%) RSD(%) 1 22.5 56.0 40.2 20.8 92.4 29.4 70.7 69.8 1.27 2 21.0 93.3 30.6 68.6 3 20.9 92.8 30.0 69.7 4 20.6 91.6 29.4 70.1 由纯化工艺验证结果可见,经过4次验证试验,50%乙醇洗脱条件下总多酚的平均洗脱率为92.5%,紫茶总多酚干膏量由56.0 mg减少至平均29.9 mg,质量分数从40.2%升至平均69.8%,表明建立的纯化工艺对紫茶总多酚有较好的分离、纯化效果。
3. 讨论
大孔吸附树脂是一种具有多孔立体结构和选择性吸附功能的高分子材料,目前已广泛应用于中药的活性成分如黄酮、皂苷、生物碱及多酚等成分的分离与纯化。其中,目前采用大孔树脂对多酚类成分进行纯化的有天麻总多酚[9]、白簕叶总多酚[10]、过岗龙总多酚[11]、茶梗中茶多酚[12]等,这都提示了大孔树脂精制多酚类有效成分的可行性。影响大孔树脂的分离纯化有多方面的因素,在选择合适的大孔树脂时,应综合考虑各种影响因素,如树脂的极性、比表面积以及上样液的质量浓度、洗脱液浓度等,以获得最佳的分离效果。在利用大孔树脂纯化时,应尽量滤去上样液中的沉淀,这样既能提高总多酚的纯化率,也能提高树脂的使用寿命。本研究中的样品采用50%乙醇提取后用纯化水进行稀释,当样品溶于水中时,由于多酚类物质能被大孔树脂吸附,而色素及多糖等物质不能吸附而被洗脱掉。而在改为乙醇洗脱时,树脂的吸附效果减弱,被吸附的多酚能被乙醇洗脱。
本研究通过对5种不同型号的大孔吸附树脂的吸附和解吸进行考察,确定了AB-8型大孔吸附树脂纯化紫茶总多酚的最佳工艺条件,为该产品的进一步开发奠定了基础。
-
表 1 不同提取方式对人参皂苷Rb1和黄芪甲苷含量的影响
提取方式 人参皂苷Rb1(mg/g) 黄芪甲苷(mg/g) 超声 1.4443±0.0182 0.1849±0.0049 回流 2.4407±0.0032 0.2463±0.0696 表 2 不同提取溶剂对人参皂苷Rb1和黄芪甲苷含量的影响
提取溶剂 人参皂苷Rb1(mg/g) 黄芪甲苷(mg/g) 水 0.4566±0.0029 ND 甲醇 2.3946±0.0164 0.2336±0.0397 乙醇 1.3876±0.0158 0.1049±0.0263 表 3 不同提取料液比对人参皂苷Rb1和黄芪甲苷含量的影响
提取料液比(V∶V) 人参皂苷Rb1(mg/g) 黄芪甲苷(mg/g) 1∶3 2.4385±0.0179 0.1971±0.0065 1∶6 3.1305±0.0354 0.3647±0.0083 1∶10 2.6230±0.0261 0.2259±0.0146 1∶20 1.8379±0.0010 ND 1∶50 0.6474±0.0273 ND 表 4 不同提取时间对人参皂苷Rb1和黄芪甲苷含量的影响
提取时间(h) 人参皂苷Rb1(mg/g) 黄芪甲苷(mg/g) 0.5 1.9815±0.0591 0.1764±0.0107 1 2.2053±0.0154 0.1951±0.0026 1.5 2.2086±0.0377 0.2184±0.0032 2 0.0806±0.0015 ND 表 5 正丁醇提取次数对人参皂苷Rb1和黄芪甲苷含量的影响
正丁醇提取次数 人参皂苷Rb1(mg/g) 黄芪甲苷(mg/g) 3次 1.6452±0.0234 0.1459±0.0214 4次 1.9642±0.0063 0.1874±0.0209 5次 2.5756±0.0213 0.2379±0.0030 6次 2.4577±0.0178 0.2384±0.0081 表 6 氨水洗涤次数对人参皂苷Rb1和黄芪甲苷含量的影响
氨水洗涤次数 人参皂苷Rb1(mg/g) 黄芪甲苷(mg/g) 1次 2.3970±0.0851 0.2776±0.0201 2次 2.4393±0.0236 0.2875±0.0050 3次 2.1734±0.0009 0.2766±0.0024 表 7 3批胃康颗粒的含量测定结果
批号 人参皂苷Rb1(mg/g) 黄芪甲苷(mg/g) 20200112 2.8534 0.2594 20200115 2.8521 0.2531 20200118 2.8836 0.2602 平均值 2.8630±0.0178 0.2576±0.0039 RSD(%) 0.62 1.51 -
[1] 李美丽, 朱西杰, 李卫强, 等. 朱西杰教授治疗残胃炎的临床经验总结[C]//中华中医药学会脾胃病分会第二十五届全国脾胃病学术交流会论文集. 贵阳, 2013: 252. [2] 乔伊娜, 朱西杰, 李卫强. 朱西杰教授治疗溃疡性结肠炎经验总结[J]. 中国民族民间医药, 2017, 26(11):86-88. [3] 安婷婷, 叶景阳, 孔娟, 等. 慢性萎缩性胃炎胃黏膜修复方法临床研究[J]. 山东中医杂志, 2016, 35(11):977-980. [4] 段立军, 孙博航. 黄芪甲苷的研究进展[J]. 沈阳药科大学学报, 2011, 28(5):410-416. [5] 国家药典委员会. 中华人民共和国药典2015年版一部[S]. 北京: 中国医药科技出版社, 2015: 11-12. [6] 杜志谦, 张利静, 夏华玲, 等. HPLC-ELSD法测定特制接骨丸中三七皂苷R1、人参皂苷Rg1、Re的含量[J]. 中医药导报, 2017, 23(7):77-79. [7] 徐鹏, 冯素香, 赵迪, 等. HPLC-ELSD法测定血塞通注射液中三七皂苷R1、人参皂苷Rg1、Re、Rb1、Rd[J]. 中成药, 2013, 35(3):521-524. doi: 10.3969/j.issn.1001-1528.2013.03.021 [8] 付娟, 李家春, 张海弢, 等. HPLC-ELSD法同时测定益心舒片中人参皂苷Rg1、Re、Rb1的含量[J]. 广东药学院学报, 2015, 31(1):62-65. doi: 10.3969/j.issn.1006-8783.2015.01.014 [9] 张春辉, 王友兰, 傅超. HPLC-ELSD同时测定跌打丸中三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1的含量[J]. 中国现代应用药学, 2016, 33(1):91-93. [10] 陈骁勇, 葛玉松. HPLC-ELDS法测定参芪五味子片中黄芪甲苷和酸枣仁皂苷A的含量[J]. 中国药师, 2012, 15(12):1743-1745. doi: 10.3969/j.issn.1008-049X.2012.12.028 [11] 王银, 邱连建. HPLC-ELSD法同时测定益肺清化颗粒中的黄芪甲苷、桔梗皂苷D和麦冬皂苷D的含量[J]. 天津药学, 2018, 30(5):11-13. doi: 10.3969/j.issn.1006-5687.2018.05.004 -





 下载:
下载:

 下载:
下载:


