-
痛风在中医理论中属于“痹证”、“白虎历节”范畴[1]。中医辨证分型主要有湿热蕴结型、寒湿痹阻型、肝肾亏虚型、痰瘀痹阻型、瘀血阻滞型、脾虚湿盛型和寒热错杂型[2],在治疗上主要以泄浊利湿、通络止痛为主[3]。茵连痛风颗粒为上海中医药大学附属岳阳中西医结合医院自制制剂,是著名夏氏外科传人夏涵教授数十年的经典经验方。该制剂由茵陈、连钱草和伸筋草三味中药组成,用于治疗间歇期痛风性关节炎[4]。茵连痛风颗粒的成分多样,前期研究中发现其不同部位群对痛风模型大鼠均有不同程度的抗炎镇痛作用[5],但其作用有效成分和疾病靶标的关系尚不明确,抗炎镇痛作用可能与香豆素[6]、黄酮、有机酸[7]、三萜类、生物碱类以及蒽醌类[8]等成分有关。因此,笔者采用网络药理学方法对茵连痛风颗粒的抗炎镇痛作用机制进行分析,预测茵连痛风颗粒的主要活性成分和潜在靶标部位,以期为该制剂建立临床疗效的质量评估体系提供支持。
-
本研究利用中药系统药理学数据库和分析平台(TCMSP)[9](http://tcmspw.com/tcmsp.php)检索获得茵连痛风颗粒中三味中药的化学成分,通过TCMSP筛选出化学成分对应的数据,预测成分的口服利用度(OB) 和类药性(DL)[10],以OB≥30%且DL≥0.18作为筛选条件,筛选出活性成分,再将其依次输入TCMSP,查找得到潜在的靶点蛋白,并通过Uniprot数据库(https://www.uniprot.org/)[11]匹配蛋白所对应的基因。
-
将茵连痛风颗粒的活性成分及潜在靶点导入Cytoscape 3.7.2软件(http://www.cytoscape.org /),构建并预测茵连痛风颗粒的活性成分及靶点网络。
-
基于OMIM数据库[12]检索抗炎、镇痛相关靶蛋白基因,搜索关键词"pain"、"ache"、"soreness"、"inflammation"、"inflammatory",所有靶标均通过UniProt数据库获取其UniProt ID信息。
-
将OMIM中获取到的蛋白质信息导入STRNG数据库,筛选出蛋白相互作用分值>0.7的高置信数据[13],用Cytoscape 3.7.2构建与抗炎镇痛有关的蛋白质-蛋白质相互作用(PPI) 网络。
-
利用Cytoscape 3.7.2中的Merge功能,将茵连痛风颗粒活性成分-预测靶点网络与抗炎镇痛的PPI网络合并,确定两者共有的潜在作用靶点。通过Cytoscape3.7.2构建茵连痛风颗粒活性成分-潜在靶点网络,并分析茵连痛风颗粒抗炎镇痛的潜在靶点。
-
采用David v6.8数据库(https://david.ncifcrf.gov/home.jsp)[14-16],对与抗炎镇痛相关的茵连痛风颗粒活性成分-潜在靶点网络中的蛋白进行基于基因组百科全书(KEGG)的生物通路富集分析,并利用OmicShare对通路进行可视化,采用Davidv6.8数据库,对与抗炎镇痛相关的茵连痛风颗粒活性成分-潜在靶点网络中的蛋白进行基因本体GO功能富集分析[13]。
-
在TCMSP数据库中搜索“茵陈”、“连钱草”、“伸筋草”三味中药的化学成分,共得到175个化学成分,以OB≥30%且DL ≥0. 18作为筛选条件,删除无对应靶点的成分,共获得23个潜在有效成分(表1),其中,茵陈和连钱草共有成分为槲皮素和β-谷甾醇[17](图1)。
表 1 茵连痛风颗粒23个有效活性成分及其OB及DL值
编号 活性成分 OB(%) DL 来源 YC1 异鼠李素 49.60 0.31 茵陈 A1 β-谷甾醇 36.91 0.75 茵陈 YC2 茵陈黄酮 48.96 0.41 茵陈 YC3 芫花素 37.13 0.24 茵陈 YC4 蓟黄素 30.35 0.30 茵陈 YC5 异茵陈黄酮 57.40 0.41 茵陈 YC6 紫杉醇 46.11 0.33 茵陈 YC7 依帕替丁 42.55 0.37 茵陈 YC8 茵陈色原酮 57.56 0.31 茵陈 YC9 4'-甲基茵陈色原酮 72.18 0.35 茵陈 YC10 脱甲氧基姜黄素 52.33 0.25 茵陈 YC11 茵陈黄酮A 68.32 0.24 茵陈 A2 槲皮素 46.43 0.28 茵陈 LQC1 金合欢素 34.97 0.24 连钱草 LQC2 蒙花苷 39.84 0.71 连钱草 LQC3 丁子香萜 55.38 0.78 连钱草 A1 β-谷甾醇 36.91 0.75 连钱草 LQC4 山奈酚 41.88 0.24 连钱草 LQC5 木犀草素 36.16 0.25 连钱草 A2 槲皮素 46.43 0.28 连钱草 SJC1 谷甾醇 36.91 0.75 伸筋草 SJC2 福莫尼汀 69.67 0.21 伸筋草 SJC3 豆甾醇 43.83 0.76 伸筋草 -
将筛选出的23个茵连痛风颗粒潜在有效成分导入到TCMSP,查找相应的靶点,得到686个潜在靶点蛋白,并利用Uniprot数据库匹配对应基因。将结果导入到Cytoscape 3.7.2软件中进行网络构建,得到茵连痛风颗粒活性成分靶点网络(图2)。该网络包含228个节点、686条边,红色六边形表示茵陈特有的活性成分、紫色六边形表示连钱草特有的活性成分、绿色六边形表示伸筋草特有活性成分、黄色箭头表示两个成分共有的活性成分、粉色菱形表示单味药的作用靶点、湖绿色菱形表示两味药共同的作用靶点、蓝色菱形表示三味药共同的作用靶点。如图2所示,23个茵连痛风颗粒的活性成分均具有多靶点,不同靶点可对应相同成分,不同的成分可对应相同的靶点。
-
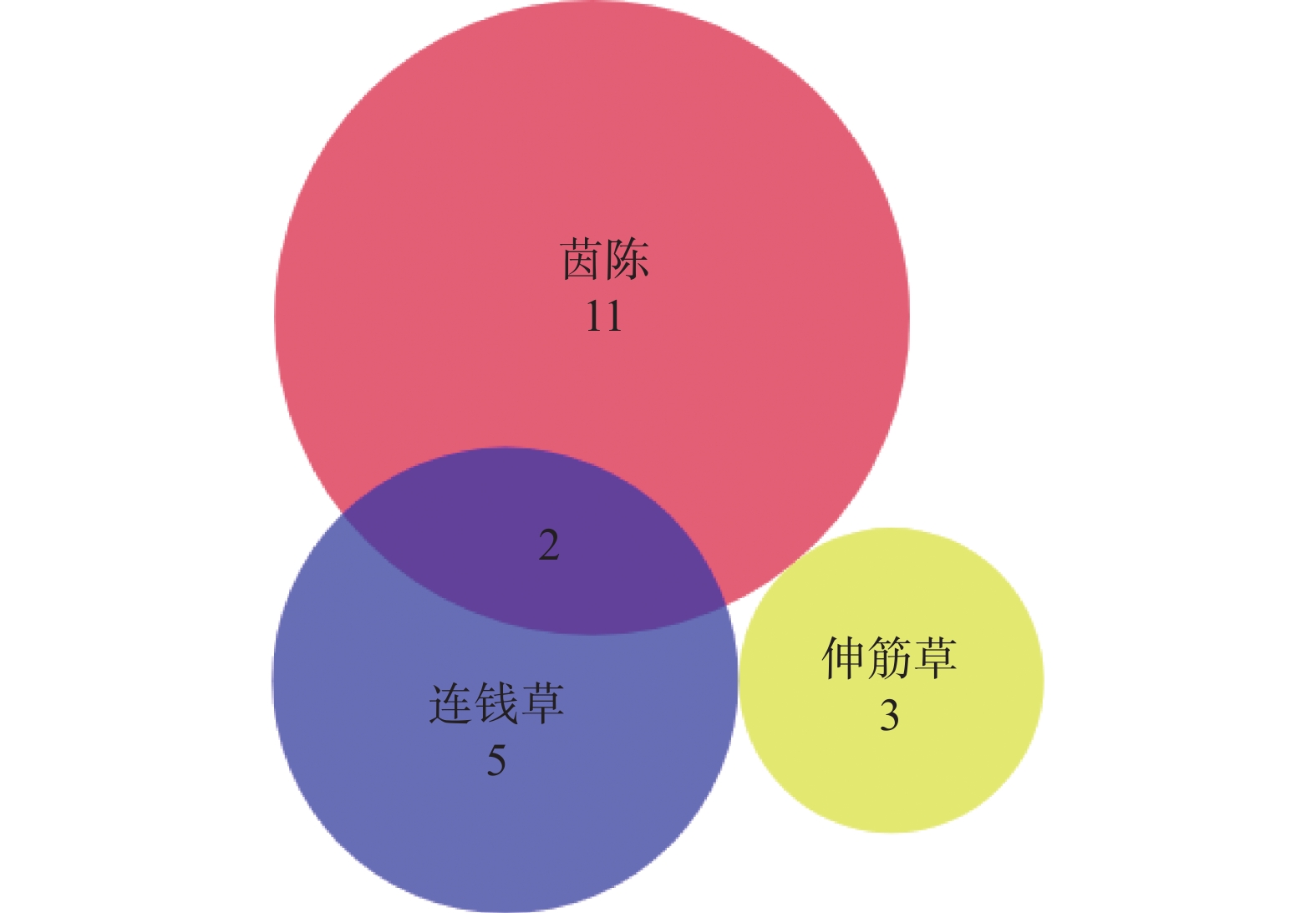
在OMIM数据库检索与抗炎镇痛相关的基因,共检索到286个相关基因靶点。与茵陈活性成分共有32个共同靶基因,与连钱草活性成分共有35个共同靶基因,与伸筋草活性成分共有7个共同靶基因(图3)。
-
将茵连痛风颗粒预测所得的基因与抗炎镇痛相关基因进行映射后得到共有靶基因,输入STRNG数据库进行蛋白-蛋白相互作用分析。在分析过程中,选取物种为Homosapiens,并将蛋白-蛋白互作得分>0.7的基因输入Cytoscape 3.7.2进行网络可视化,共有37个节点,285个连线。应用软件中的NetworkAnalysis plugin对网络图中节点进行统计,分析其在图中的作用,自由度越大,该节点在网络中的生物功能则越多。同时,颜色越深代表该节点自由度较大、生物功能较多(图4)。进一步对与抗炎镇痛潜在靶点网络进行分析,网络中有17个靶点的自由度值大于平均度值15.41,预测可能为茵连痛风颗粒活性成分发挥抗炎镇痛疗效的潜在靶点。
-
利用David平台进行GO功能富集分析,得到了293个GO条目,根据P<0.05筛选出211个GO条目,针对前10条BP分析、CC分析、MF分析绘制直方图(图5)。其中,生物过程条目170条,主要包括炎症反应、基因表达的正调控、IL -6的正调控等;细胞组成条目16个,主要包括I-kappaB/NF-kappaB复合体、细胞质核周区域、GABA-A受体复合物等;分子功能条目25条,主要包括细胞因子活性、酶结合、蛋白质异二聚活性等。
利用David平台的KEGG通路富集分析功能,得到79条信号通路,根据P<0.001筛选出50条信号通路(图6);包括TNF信号通路、NOD受体信号通路、NAFLD、MAPK信号通路、Ras 信号通路、核转录因子B信号通路等。
-
基于上述信息,构建活性成分-靶点-通路图,以全面阐述茵连痛风颗粒抗炎镇痛的作用机制(图7); 图中有112个节点和462条边,绿色菱形代表茵连痛风颗粒活性成分,红色圆形代表潜在靶点,黄色箭头代表信号通路,边代表三者之间的相互作用,节点越大表示其抗炎镇痛的作用越大。
-
茵连痛风颗粒由茵陈、连钱草和伸筋草三味中药组成,茵陈具有清利湿热、利胆退黄的功效;连钱草具有利湿通淋,清热解毒,散瘀消肿的功效;伸筋草具有祛风除湿、舒筋活络的功效。三者合用增强了清热利湿,通络止痛的作用[18]。
本研究通过TCMSP、Uniprot数据库筛选潜在的抗炎镇痛活性成分,得出槲皮素、β-谷甾醇、茵陈色原酮、异鼠李素等23个黄酮类、甾体类成分。这些成分与现有文献报道中关于抗炎镇痛的活性成分相符[19-22]。其中,共有成分槲皮素为黄酮类化合物,有研究表明槲皮素对炎症反应具有良好的抑制作用,对化学刺激疼痛模型和热刺激疼痛模型均有显著的镇痛作用[23]。共有成分β-谷甾醇为甾体类化合物,具有类似于氢化可的松的抗炎活性,其抗炎机制主要是通过局部免疫调节来发挥抗炎作用[24]。
通过OMIM数据库、STRNG数据库及Cytoscape软件构建抗炎镇痛靶标蛋白-蛋白交互网络,揭示茵连痛风颗粒通过多靶点起到抗炎镇痛的作用。本研究共得到PTGS2、TNF、IL-6、IL-10等37个茵连痛风颗粒抗炎镇痛的关键靶点。前列腺素内过氧化物合酶PTGS),又称为环氧合酶(COX),存在两个亚型,即COX-1和COX-2[25]。PTGS2产生炎症性前列腺素,参与炎症的发生,同时与其他预测所得出的靶点都有密切联系[26-27]。TNF[28]、IL-6有致痛和痛觉增敏的作用,IL-10有活性较强的抗炎作用,除具抑制促炎细胞因子的产生外,还能促进其他抗炎因子的产生、下调促炎因子受体的表达[29]。PTGS2等靶点是抗炎镇痛的关键靶点,在炎症反应、基因表达等生物过程中起着至关重要的作用。
KEGG富集结果表明,茵连痛风颗粒抗炎镇痛关键靶点基因显著富集在TNF信号通路、MAPK信号通路、核转录因子B信号通路等。茵陈中的黄酮类成分具有重要的抗炎活性,其潜在的抗炎机制可能与其对NF-κB和MAPK信号通路的抑制有关[6]。研究表明[30],茵陈色原酮通过JNK途径激活转录因子E2相关因子2(Nrf2)及其下游靶标血红素加氧酶1(HO-1)水平,减弱LPS诱导的小胶质细胞炎症反应,也可有效抑制MyD88和Toll/IL-1接头蛋白(TIRAP)介导的信号通路,进而抑制LPS诱导的NF-κB、蛋白激酶B(Akt)和MAPK激活的炎症基因活化,从而发挥抗炎作用。
综上所述,本研究基于网络药理学,对茵连痛风颗粒抗炎镇痛的多成分、多靶点和多信号通路进行相关性研究,初步揭示了茵连痛风颗粒中三味中药的抗炎镇痛分子机制,为进一步开展和实验验证茵连痛风颗粒抗炎镇痛作用机制提供理论依据。
Anti-inflammatory and analgesic activity analysis of Yinlian Tongfeng granules based on network Pharmacology
-
摘要:
目的 通过网络药理学的研究方法探讨茵连痛风颗粒抗炎镇痛作用的可能作用机制。 方法 利用中药系统药理学数据库与分析平台(TCMSP)收集茵连痛风颗粒主要活性成分,预测其作用靶点;利用蛋白质互作网络信息建立药物与抗炎镇痛相关靶基因之间的相互作用关系,进行KEGG与GO功能富集分析。 结果 茵连痛风颗粒中与抗炎镇痛密切相关的靶点共有37个,主要包括前列腺素过氧化物合酶 2(PTGS2)、白介素-6(IL-6)、IL-10、肿瘤坏死因子(TNF)等潜在作用靶点,这些靶点的作用机制主要与调节核转录因子B信号(NF-κB) 等通路相关。 结论 该研究从多维度预测了茵连痛风颗粒多靶点抗炎镇痛的作用机制,为进一步验证该制剂临床作用机制提供理论依据。 Abstract:Objective To explore the anti-inflammatory and analgesic mechanism of Yinlian Tongfeng granules by network pharmacology. Methods Three main active components of Yinlian Tongfeng granules were collected from TCMSP database to predict its effective targets. Based on the network information of active components and targets, the anti-inflammatory and analgesic related targets were established by using protein-protein interaction information. The enrichment analysis of KEGG biological pathway and go function enrichment were carried out to construct the active component-target-signal pathway network and explain the main mechanism of anti-inflammatory and analgesic. Results 37 targets were closely related to anti-inflammation and analgesic effects of Yinlian Tongfeng granules, mainly on Prostaglandin endoperoxide synthase 2(PTGS2), interleukin-6 (IL-6), interleukin-10 (IL-10) and tumor necrosis factors (TNF). The mechanism of action may relate to the regulation of nuclear transcription factor B signaling pathway(NF-κB). Conclusion The study predicted the anti-inflammatory and analgesic mechanism of Yinlian Tongfeng granules, and provided theoretical basis for further verification and interpretation of its mechanism. -
在全球新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)大流行期间,Moderna和BioNTech/辉瑞公司基于脂质纳米颗粒(lipid nanoparticles,LNP)载体的mRNA疫苗获得FDA紧急批准[1,2],迅速地延缓了新型冠状病毒的传播。基于脂质纳米颗粒-mRNA的COVID-19疫苗取得的巨大成功,使得mRNA疫苗技术迅速成为研究的热点,并促进了mRNA疫苗在肿瘤等重大疾病治疗中的研发和应用。
2024年6月,上海交通大学附属瑞金医院沈柏用教授团队披露mRNA肿瘤疫苗研究新进展,在全球范围内首次报道针对KRAS G12V单靶点的mRNA肿瘤疫苗在实体肿瘤中的治疗效果,为传统治疗无法耐受或者耐药的晚期肿瘤患者带来新希望[3]。同时,针对肿瘤抑制性免疫微环境,编码细胞因子的mRNA肿瘤疫苗可以促进效应T细胞的成熟、调控肿瘤微环境,从而提高在实体瘤局部疫苗接种的抗肿瘤疗效。其中,以MEDI1191、mRNA-
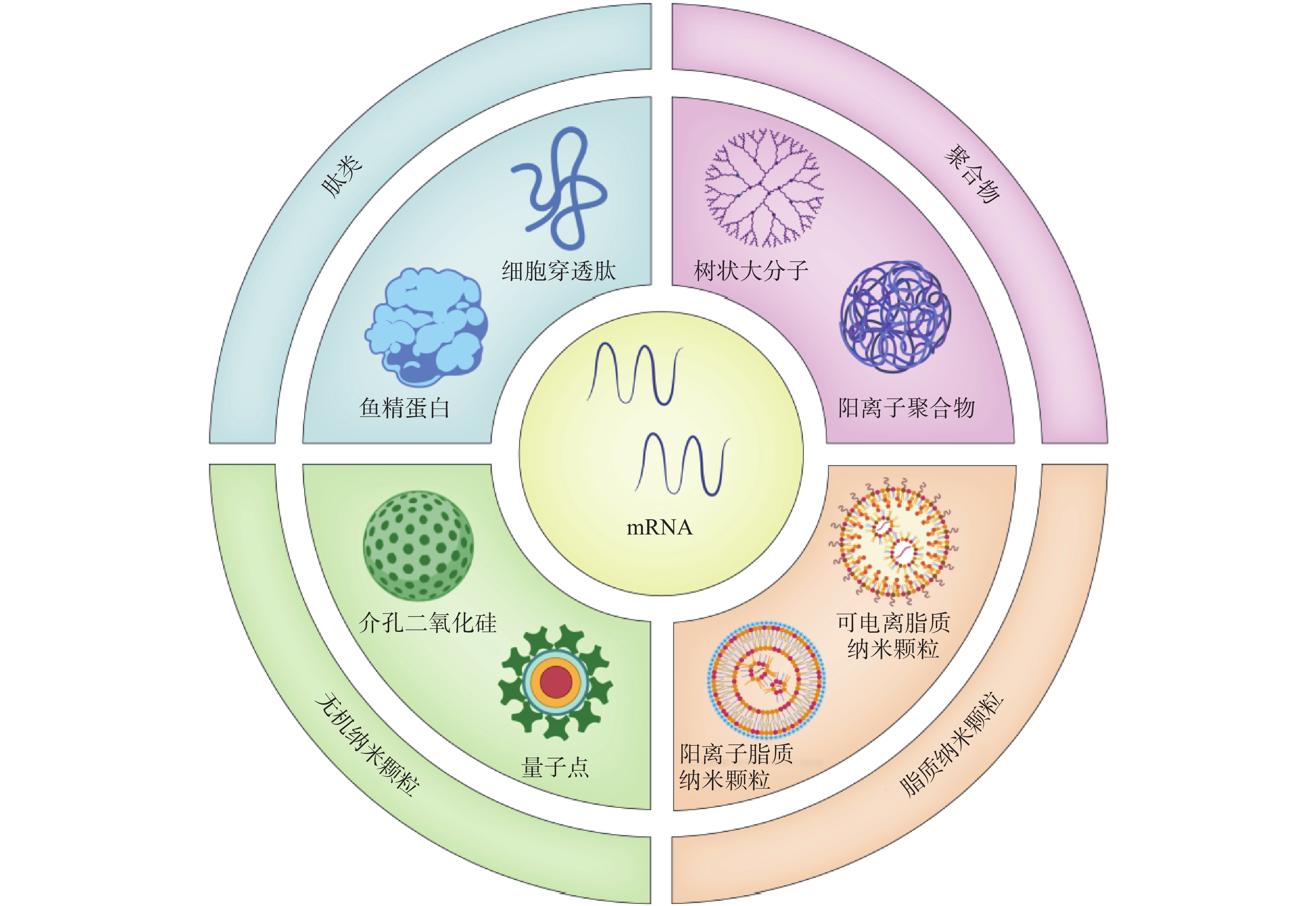
2416 、mRNA-2752 、SAR44100等为代表的 mRNA肿瘤疫苗已进入临床试验阶段。mRNA肿瘤疫苗通过将编码肿瘤抗原的mRNA引入宿主细胞(通常是抗原提呈细胞)的细胞质中表达靶蛋白抗原,然后在抗原提呈细胞表面呈递MHC分子,诱导有效的免疫应答来发挥作用[4,5]。相对于其他类型的治疗性肿瘤疫苗来说,基于mRNA的肿瘤疫苗是一种有前途的策略(图1),其具有如下优势:①与病毒疫苗类似,mRNA肿瘤疫苗能够同时递送多种抗原,引发体液免疫和细胞免疫,增加了肿瘤细胞根除的可能性。②与基于肽的疫苗不同,mRNA肿瘤疫苗不受患者特异性HLA类型的限制。③与基于DNA的肿瘤疫苗相比,mRNA肿瘤疫苗安全且耐受性良好,没有插入宿主基因组的风险[4]。尽管mRNA肿瘤疫苗具有非常广阔的应用前景,但仍然存在以下问题:①mRNA分子在体内非常不稳定,很容易被细胞外的核酸酶降解[6]。②mRNA分子量大且带负电荷,这阻碍了它们通过细胞膜高效递送至靶细胞[7]。因此,推动mRNA药物应用的关键之一是高效的mRNA递送系统的开发。与基于病毒的递送系统相比,非病毒载体在生物安全性和多功能性方面具有重大优势。如基于脂质的纳米颗粒、聚合物纳米颗粒、肽类纳米颗粒和无机纳米粒子,能有效压缩mRNA,使其免受核酸酶的降解[8]。此外,根据靶向器官的生物结构和递送过程中的屏障,非病毒载体可以有目的地进行结构改造,从而更有效地将mRNA递送到身体的特定部位,以提高治疗效果[8]。因此,基于非病毒载体的递送系统的研究已成为mRNA肿瘤疫苗研究领域的热点课题。1. mRNA肿瘤疫苗概况
mRNA肿瘤疫苗的研究发端于 20 世纪 70 年代。1976年,Langer等[9]首次使用了聚合物纳米颗粒和微颗粒作为载体来封装核酸。随后2年,又实现将外源性mRNA通过脂质体递送到宿主细胞,进一步拓展了mRNA技术的应用[10]。1990年,Wolff等[11]将含有氯霉素乙酰转移酶、荧光素酶和β-半乳糖苷酶基因的RNA和DNA表达载体分别注射到小鼠体内骨骼肌中,在所有小鼠体内都检测到了相应蛋白质的表达,为mRNA用作治疗药物的研究奠定了基础。mRNA疫苗的概念可以追溯到1993年,Martinon等[12]在用编码流感病毒蛋白的mRNA免疫的小鼠中观察到细胞毒性T淋巴细胞的诱导,揭示了mRNA作为编码抗原的基因在疫苗研究领域的应用潜能。1995年,Conry 等[13]构建了编码荧光素酶和人癌胚抗原(carcinoem bryonic antigen,CEA)的mRNA剪切体,该mRNA剪切体在体外小鼠成纤维细胞中定向表达CEA, mRNA肿瘤疫苗的概念被首次提出。近年来,COVID-19的流行推动了mRNA疫苗的深入研究和技术的发展,并使mRNA肿瘤疫苗再次受到关注。事实上,COVID-19疫苗的快速发展得益于多年来在临床前和临床试验中以mRNA疫苗作为肿瘤治疗策略的相关研究。因此,mRNA疫苗是未来肿瘤治疗有希望的候选疗法之一。
2. 基于mRNA肿瘤疫苗的非病毒递送系统
由于mRNA存在不稳定性、高免疫原性、递送效率低等问题,开发高效的靶向递送系统是mRNA疫苗亟待解决的问题。mRNA疫苗递送载体主要包括病毒载体和非病毒载体。目前,多数的临床基因治疗试验采用病毒载体。然而,病毒载体存在易于刺激免疫原性反应产生和诱导基因插入突变等问题,其临床安全性一直受到质疑。而包括脂质纳米粒、聚合物、肽类、无机材料在内的非病毒载体,具有强大的基因装载能力、高度的安全性和实用性,且其制备较为简单。因此,非病毒载体在进一步的临床开发和应用中显示出巨大的潜力[14]。
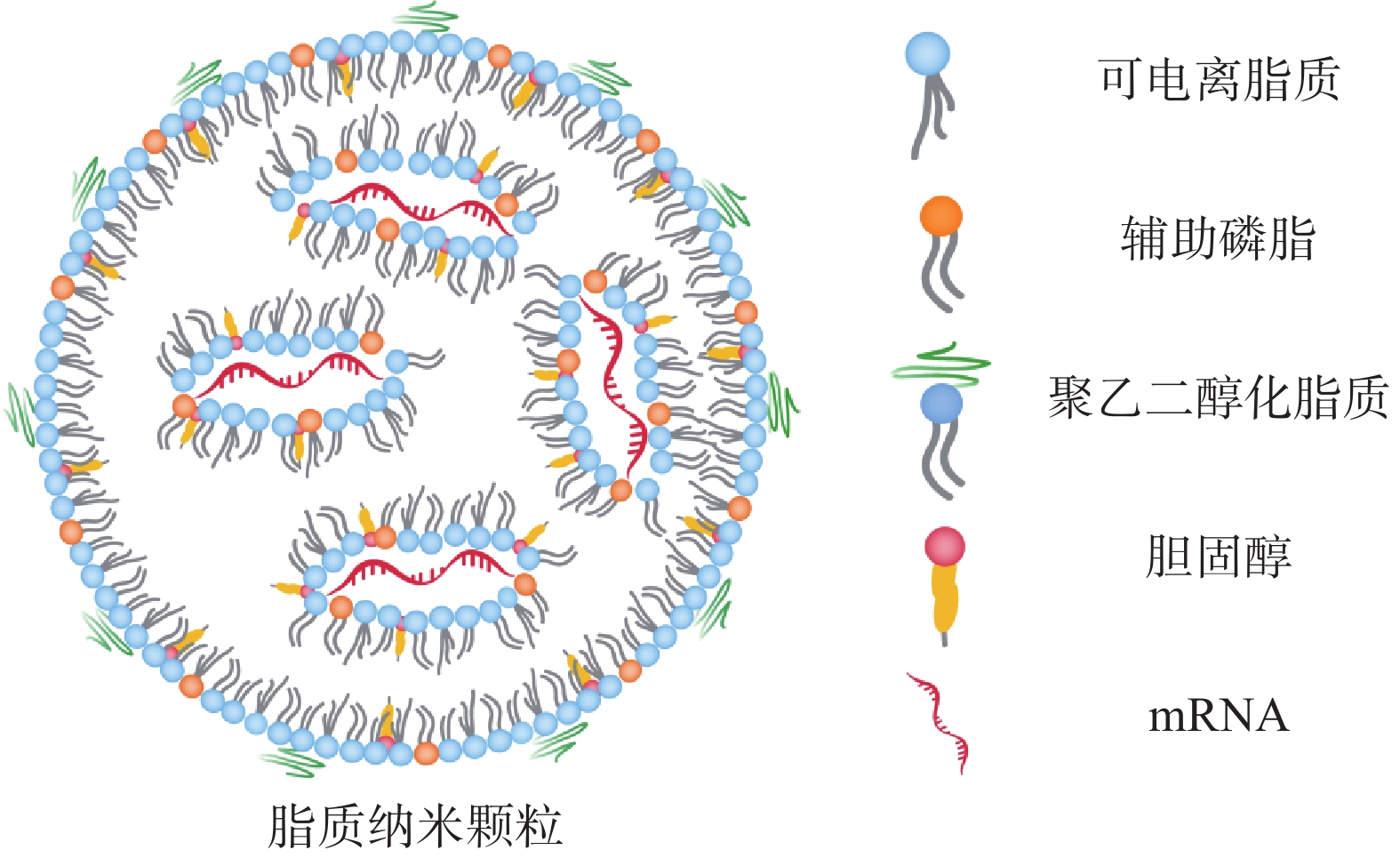
2.1 脂质纳米颗粒(lipid nanoparticles,LNP)
脂质纳米颗粒是一种临床批准的用于核酸递送的多功能平台[15]。截至2023年11月,3种基于LNP的药物(1种siRNA,2种mRNA)已获得美国食品药品监督管理局批准,超过50种候选药物正在临床试验中,用于治疗或预防传染病、肿瘤和遗传性疾病[16]。
LNP脂质壳结构由脂质或类脂材料以及辅助成分(包括胆固醇、辅助磷脂和聚乙二醇化脂质)组成(图2)。这些成分可促进单分散纳米颗粒的形成、提高纳米颗粒的稳定性、实现有效的核酸封装、增加细胞摄取和促进mRNA的内体逃逸。其中,辅助磷脂可以调节 LNP 双分子层的流动性,促进内体逃逸[17];胆固醇通过填充磷脂间的空隙来调节膜的流动性,促进膜融合。聚乙二醇(polyethyleneglycol,PEG)化脂质控制LNP的大小和稳定性,介导LNP的间接靶向能力以及保护LNP免受巨噬细胞介导的清除[18,19];LNP 配方中最重要的成分为阳离子脂质或可电离脂质,在早期的研究中主要使用阳离子脂质,如(2,3-二油酰基-丙基)-三甲基氯化铵[(2, 3-dioleyl-propyl)-trimethyl ammonium chloride, DOTAP]和1,2-双十八烯氧基-3-甲基铵丙烷(1, 2-didecaenooxy-3-methyl ammonium propane, DOTMA)。然而阳离子脂质具有高免疫原性和较强的毒性[20]。
可电离脂质具有pH敏感性,其在酸性条件下带正电荷,在生理pH条件下接近中性[21,22]。这种特性使它们在体内分布时更少地与血清成分相互作用。当可电离脂质纳米粒进入细胞的酸性内体后,它们可以被质子化,从而帮助mRNA逃逸到细胞质中。常用的可电离脂质有1,2-二甲氧基-N,N-二甲基-3-氨基丙烷(DLin-DMA)、N,N-二甲基-2,2-二-(9Z,12Z)-9,12-十八碳二烯-1-基-1,3-二氧戊环-4-乙胺(DLin-KC2-DMA)和4-(N,N-二甲基氨基)丁酸(二亚油基)甲酯(DLin-MC3-DMA)。可电离脂质的结构改变可引起 mRNA递送效率的改变,如Dong等[23]合成了含有不同头部基团的二氨基(DAL)可电离脂质材料,用于包载编码IL-12、IL-27和GM-CSF等细胞因子的mRNA。使用DAL-LNP对携带B16F10黑色素瘤的小鼠进行治疗性疫苗接种,结果显示通过DAL-LNP在瘤内给药IL-12和IL-27 mRNA促进了B16F10黑色素瘤生长的持续抑制,且没有引起明显的毒性。
此外,在LNP的表面进行靶向免疫细胞表面受体的功能性修饰,或与佐剂共同给药,可增强免疫刺激。Shi等[24]将 Pam2Cys(一种可通过 Toll 样受体(TLR)2/6 途径发出信号的简单合成代谢脂氨基酸)引入 LNP,实现了与 mRNA 的共同递送。结果显示,使用由此产生的 mRNA-LNP (Pam2Cys)进行免疫,可通过诱导 IL-12 和 IL-17 等细胞因子改善肿瘤引流淋巴结(tumor-draining lymph nodes,TDLN)的免疫微环境。
2.2 聚合物纳米颗粒(polymer nanoparticles)
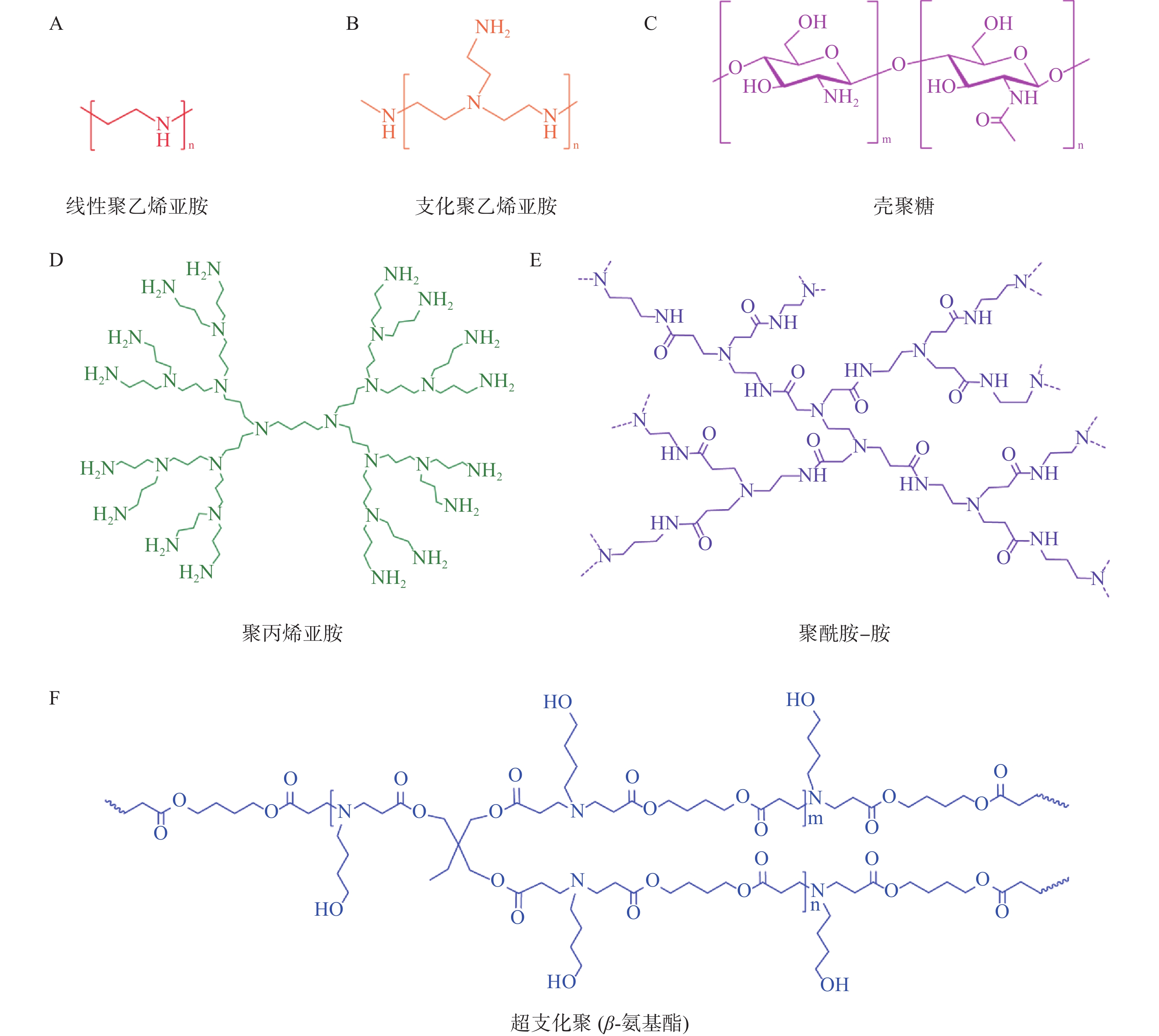
目前常用于mRNA递送的聚合物材料主要有聚乙烯亚胺(polyethyleneimine,PEI)、基于聚酰胺-胺(poly-amindoamine,PAMAM)和聚丙烯亚胺(polypropylenimine,PPI)的树枝状大分子、聚氨基酯(poly β-aminoester,PBAE)、壳聚糖等[25](图3)。与LNP相比,基于聚合物的递送系统具有较高的多分散性、分子量和电荷密度,这导致基于聚合物的递送系统纯度较低、清除率较低且毒性较大。因此,它们在mRNA递送方面的临床应用不如可电离脂质纳米粒广泛。为了提高聚合物材料的转染效率和稳定性,并降低其毒性,人们对其结构进行了改造,包括添加脂质尾部、超支化基团和可生物降解分子[26]。
PEI含有大量的氨基,在生理pH值下可被质子化带正电荷。而mRNA是一种带负电的分子。因此,PEI通过静电相互作用与mRNA紧密地结合形成纳米复合物[27]。此复合物可以有效地压缩mRNA,并在一定程度上保护mRNA免受外界酶的降解[28]。在体内,PEI充当“质子海绵”促进mRNA释放到细胞质。然而,由于高电荷密度和高分子量,PEI具有较大的全身毒性和低生物降解性。用脂肪链修饰的低分子量PEI已被用于mRNA递送以降低毒性,如Peng等[29]合成了一种氟烷烃接枝的聚乙烯亚胺(F-PEI)。结果显示由F-PEI和编码肿瘤抗原的mRNA自组装形成的疫苗,无额外的佐剂,即可诱导树突状细胞成熟并触发有效的抗原呈递,从而引发抗肿瘤免疫反应。
树枝状大分子(dendrimers)是一类具有树枝状结构,由低聚物通过支化单元重复、线性连接而成的大分子,其通常由内核、聚合物主链和树枝单元的侧链组成[30,31]。作为一种阳离子聚合物,树枝状大分子的细胞毒性也需要通过表面改性来降低。England等[32]使用赖氨酸作为位点选择性锚,通过酰胺化反应引入了聚磺酰精氨酸和咪唑基团对PAMAM(P)和赖氨酸(L)树枝状大分子进行了化学改性。实验结果显示,与市售的转染剂jetPEI® 相比,改性的PAMAM树枝状大分子显示出更高的mRNA转染效率。
2.3 肽类纳米粒(peptide-based nanoparticles)
除了基于聚合物和脂质纳米粒的载体外,还可以使用基于肽类的载体递送mRNA。肽类由可生物降解的氨基酸组成,因此其具有高度的生物相容性。鱼精蛋白和细胞穿膜肽(cell-penetrating peptides,CPPs)是两种基于肽的载体,可用于mRNA递送。鱼精蛋白是一种天然的富含精氨酸的阳离子蛋白,可以把带负电的mRNA分子络合成纳米级别的核酸颗粒[33]。此外,鱼精蛋白-mRNA组成的纳米级颗粒还可以进一步制备成脂质纳米颗粒,这种脂质-鱼精蛋白-mRNA(lipid/protamine/mRNA, LPR)的制剂形式,兼有脂质纳米粒和鱼精蛋白的优势[34,35]。Shen等[36]制备了一种由鱼精蛋白/mRNA核和脂质壳组成的mRNA肿瘤疫苗(MVP)。结果显示,MVP 中的mRNA核和脂质壳可充分刺激树突状细胞中I型干扰素和炎症细胞因子的表达,在小鼠结直肠肿瘤和黑色素瘤模型中引起了有效的抗肿瘤免疫。
CPPs是一类由不多于30个氨基酸组成的小分子多肽。CPPs在生理pH值下带正电荷,可以与带负电荷的mRNA形成纳米结构[37]。Men等[38]将肿瘤细胞裂解液引入到DMP纳米颗粒[由DOTAP和(乙二醇)-b-聚(ε-己内酯)(mPEG-PCL)自组装形成]中,并将CPPs修饰在DMP表面,形成CLSV系统。然后将编码IL-22结合蛋白(interleukin-22 binding protein,IL-22BP)的mRNA与CLSV混合形成CLSV/IL-22BP复合物。结果表明,所构建的CLSV达到了激活免疫反应和增强mRNA递送的双重目的,在体外和体内均表现出较强的抑制肿瘤细胞生长的能力。
2.4 无机纳米材料(inorganic nanoparticles,INPs)
无机纳米颗粒是一种多功能纳米平台。虽然INPs的生物相容性不如脂质纳米粒和聚合物,但是INPs可以通过表面功能化修饰,获得具有适当的溶解度和分散性的纳米粒子。并且某些INPs具有磁性和光学性质,可实现对肿瘤的成像和消融[39]。典型的INPs包括金纳米粒子、二氧化硅纳米粒子、氧化铁纳米粒子、量子点等。
常用的INPs是介孔二氧化硅纳米粒子(mesoporous silica, MSN),其具有孔道均匀、高比表面积、大孔容和可生物降解性等优点。Phua等[40]开发了一种介孔二氧化硅纳米颗粒-mRNA (MSN-mRNA)皮下递送系统。结果显示,将编码卵清蛋白和粒细胞巨噬细胞集落刺激因子的裸mRNA和C16@MSNs组成的MSN-mRNA疫苗配方应用于小鼠E.G7-OVA预防性肿瘤模型时,产生了显著的肿瘤抑制作用。其次,INPs还可以与聚合物和脂质纳米粒联合,用于mRNA的递送。Shin等[41]开发了一种基于聚乙烯亚胺修饰的多孔二氧化硅纳米颗粒(PPSN)的递送平台,其携带细胞因子mRNA用于体内局部免疫治疗。结果表明,PPSN在定位mRNA翻译方面明显比美国食品药品监督管理局批准的LNP更有效。该研究显示了PPSN介导的mRNA递送作为肿瘤免疫疗法中基于mRNA治疗的特异性、有效性和安全性平台的潜力。
3. 非病毒递送系统在mRNA肿瘤疫苗中的应用
基于肿瘤的特点编码特异性抗原,使其顺利地被免疫细胞识别以激活免疫应答,是mRNA肿瘤疫苗的核心作用机制。现阶段主要研究的mRNA肿瘤疫苗编码的抗原主要有肿瘤相关抗原(tumor-associated antigen,TAA)、肿瘤特异性抗原(tumor specific antigen,TSA)和免疫调节因子3种类型[42]。通过对非病毒载体和对机体免疫系统的研究不断深入,目前已有多项mRNA肿瘤疫苗进入临床试验。中国进入临床试验阶段的mRNA肿瘤疫苗如表1所示。
表 1 中国进入临床试验阶段的mRNA肿瘤疫苗疫苗登记号 适应证 申办单位 研发阶段 ChiCTR2300071001 EGFR 突变阳性的晚期非小细胞肺癌 苏州艾博生物科技有限公司 探索性研究/预试验 CTR20232018 晚期实体瘤 北京立康生命科技有限公司 Ⅰ期临床 CTR20240438 新诊断的原发性脑胶质母细胞瘤(WHO 4级) 北京启辰生生物科技有限公司 Ⅰ期临床 ChiCTR2300077339 晚期胰腺癌 中国人民解放军总医院 Ⅰ期临床 ChiCTR2300071740 HPV16/18阳性的不可切除的复发性或转移性实体瘤 南阳医学高等专科学校第一附属医院 Ⅰ期临床 ChiCTR2200066118 晚期黑色素瘤 南阳医学高等专科学校第一附属医院 Ⅰ期临床 ChiCTR2200056172 晚期实体瘤 蚌埠医学院第一附属医院 Ⅰ期临床 ChiCTR2000029301 胃癌,食管癌 深圳市新合生物医疗科技有限公司 Ⅰ期临床 ChiCTR1900023000 晚期恶性实体瘤 斯微(上海)生物科技有限公司 Ⅰ期临床 3.1 编码TSA的mRNA肿瘤疫苗
肿瘤特异性抗原是体细胞中的非同义突变产生非自体蛋白[43],仅在肿瘤细胞中表达,而在正常细胞中不表达,因此支持对患者个体肿瘤抗原产生特异性免疫反应[44]。多个编码TSA的mRNA肿瘤疫苗已完成了Ⅰ/Ⅱ期临床试验[45]。BNT 122是BioNTech 和Genentech公司联合研发的一款编码胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)患者的20种新抗原的mRNA疫苗,使用LNP进行静脉注射给药。Ⅰ期临床试验结果显示,在手术切除后的PADC患者中,将BNT 122与化疗和免疫检查点疗法联用时,该mRNA疫苗对延缓PDAC患者的复发具有潜力。目前基于BNT122针对黑色素瘤和结直肠癌的治疗处于Ⅱ期临床试验阶段,针对实体瘤的临床试验即将进行Ⅱ期临床试验[46]。
3.2 编码TAA的mRNA肿瘤疫苗
肿瘤相关抗原是是一种在正常组织中表达但在肿瘤组织中过表达的抗原。具有肿瘤特异性弱、中枢免疫耐受性强、免疫原性弱的特点[47]。目前,利用多种TAA组合开发mRNA疫苗已成为一种趋势。BI
1361849 是Ludwig癌症研究所研发的一款编码NY-ESO-1、MAGE-C2、MAGE-C1、survivin、5T4和MUC1这6种TAA的mRNA疫苗,其使用鱼精蛋白作为载体。Ⅰb期临床研究评估了BI-1361849 联合局部放疗对Ⅳ期非小细胞肺癌(non-small-cell carcinoma,NSCLC)患者的有效性和安全性,结果显示,BI-1361849 具有良好的耐受性和免疫原性。2017年12月,在美国启动了BI-1361849 与 抗程序性死亡配体1 durvalumab和抗细胞毒性T淋巴细胞相关蛋白4(CTLA-4)抗体tremelimumab联用治疗NSCLC的Ⅰ/Ⅱ期临床试验。3.3 编码免疫调节因子的mRNA肿瘤疫苗
免疫调节因子是一类能够刺激或抑制特定免疫细胞功能的分子,包括细胞因子、共刺激因子等[48]。靶向肿瘤微环境实现肿瘤免疫治疗是目前抗肿瘤技术研究的热点。免疫调节因子可以重新激活免疫系统的抗肿瘤免疫反应并重塑积极的免疫微环境[49]。此外,编码免疫调节因子的mRNA疫苗还可作为编码TAA的mRNA疫苗的佐剂。mRNA-2752是Moderna公司研发的一款编码人 OX40L、IL-23 和 IL-36γ 的mRNA疫苗,其使用LNP作为载药系统,通过瘤内注射给药。在Ⅰ期的一项剂量递增研究(NCT03739931)中,mRNA-2752与免疫检查点阻断治疗剂durvalumab共同给药显示出抗肿瘤作用。目前mRNA-2752针对于三阴性乳腺癌、泌尿上皮癌、淋巴瘤和免疫检查点难治性黑色素瘤和非小细胞肺癌的Ⅰ期临床人体耐受性试验正在进行中。
4. 总结与展望
随着分子生物学的发展,mRNA疫苗给肿瘤免疫治疗带来了前所未有的希望。通过对mRNA化学修饰的改进以及开发更高效的非病毒载体递送系统可以提高mRNA肿瘤疫苗的安全性、稳定性和递送效率。基于基因治疗的良好前景,未来mRNA肿瘤疫苗的非病毒递送系统的主要发展方向可能包含以下几个方面:①将不同类型的非病毒载体联用共同递送mRNA疫苗,以结合不同类型载体的优点,实现提高纳米粒子稳定性、生物相容性和降低毒性等目的。②对非病毒载体进行功能化修饰以实现mRNA肿瘤疫苗的靶向性、光响应性、荧光可视性、pH响应性释放等功能。③阐明非病毒载体结构与其功能的关系,以及进入人体后与肿瘤微环境的相互作用机制。目前,正在开展许多基于脂质纳米颗粒、脂质-鱼精蛋白、阳离子脂质复合物和脂质多聚复合物等非病毒递送系统的mRNA肿瘤疫苗的临床试验。相信伴随多组学技术的发展和跨学科的融合,未来肿瘤特异性抗原的筛选将变得越来越精确。随着对非病毒递送系统研究的不断深入,mRNA肿瘤疫苗将在未来的肿瘤治疗中发挥巨大的作用。
-
表 1 茵连痛风颗粒23个有效活性成分及其OB及DL值
编号 活性成分 OB(%) DL 来源 YC1 异鼠李素 49.60 0.31 茵陈 A1 β-谷甾醇 36.91 0.75 茵陈 YC2 茵陈黄酮 48.96 0.41 茵陈 YC3 芫花素 37.13 0.24 茵陈 YC4 蓟黄素 30.35 0.30 茵陈 YC5 异茵陈黄酮 57.40 0.41 茵陈 YC6 紫杉醇 46.11 0.33 茵陈 YC7 依帕替丁 42.55 0.37 茵陈 YC8 茵陈色原酮 57.56 0.31 茵陈 YC9 4'-甲基茵陈色原酮 72.18 0.35 茵陈 YC10 脱甲氧基姜黄素 52.33 0.25 茵陈 YC11 茵陈黄酮A 68.32 0.24 茵陈 A2 槲皮素 46.43 0.28 茵陈 LQC1 金合欢素 34.97 0.24 连钱草 LQC2 蒙花苷 39.84 0.71 连钱草 LQC3 丁子香萜 55.38 0.78 连钱草 A1 β-谷甾醇 36.91 0.75 连钱草 LQC4 山奈酚 41.88 0.24 连钱草 LQC5 木犀草素 36.16 0.25 连钱草 A2 槲皮素 46.43 0.28 连钱草 SJC1 谷甾醇 36.91 0.75 伸筋草 SJC2 福莫尼汀 69.67 0.21 伸筋草 SJC3 豆甾醇 43.83 0.76 伸筋草 -
[1] 邓丰承, 邓允英. 清热祛湿方结合关节镜清理术治疗膝关节痛风性关节炎的疗效分析[J]. 中国处方药, 2018, 16(2):108-109. doi: 10.3969/j.issn.1671-945X.2018.02.077 [2] 孙广瀚, 刘健, 龙琰, 等. 中医药治疗痛风性关节炎的研究进展[J]. 风湿病与关节炎, 2019, 8(8):64-67, 80. doi: 10.3969/j.issn.2095-4174.2019.08.015 [3] 黄艳霞. 中医治疗痛风性关节炎用药规律分析[J]. 湖南中医杂志, 2014, 30(2):111-112. [4] 陈娜, 张明, 王一飞. 茵连痛风颗粒治疗间歇期痛风性关节炎临床观察[J]. 中国中西医结合杂志, 2017, 37(7):883-885. doi: 10.7661/j.cjim.20170427.119 [5] 刘静, 徐玲玲, 徐熠. 痛风颗粒抗痛风有效部位群研究[J]. 中草药, 2013, 44(5):590-594. [6] 刘玉萍, 邱小玉, 刘烨, 等. 茵陈的药理作用研究进展[J]. 中草药, 2019, 50(9):2235-2241. doi: 10.7501/j.issn.0253-2670.2019.09.033 [7] 陈利华, 李欣. 连钱草化学成分及药理作用研究[J]. 亚太传统医药, 2014, 10(15):33-35. [8] 蔡卓亚, 周自桂, 李萍, 等. 伸筋草化学成分及药理作用研究进展[J]. 中草药, 2015, 46(2):297-304. doi: 10.7501/j.issn.0253-2670.2015.02.026 [9] RU J L, LI P, WANG J N, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform,2014,6(1):1-6. doi: 10.1186/1758-2946-6-1 [10] XU X, ZHANG W X, HUANG C, et al. A novel chemometric method for the prediction of human oral bioavailability[J]. Int J Mol Sci,2012,13(6):6964-6982. doi: 10.3390/ijms13066964 [11] ZHANG Y Q, MAO X, GUO Q Y, et al. Network pharmacology-based approaches capture essence of Chinese herbal medicines[J]. Chin Herb Med,2016,8(2):107-116. doi: 10.1016/S1674-6384(16)60018-7 [12] RAPPAPORT N, TWIK M, PLASCHKES I, et al. MalaCards: an amalgamated human disease compendium with diverse clinical and genetic annotation and structured search[J]. Nucleic Acids Res,2017,45(D1):D877-D887. doi: 10.1093/nar/gkw1012 [13] 张思旋, 林茜, 吴嘉瑞, 等. 基于网络药理学的“苍术-黄柏”药对治疗痛风作用机制研究[J]. 中国医院用药评价与分析, 2019, 19(8):927-933. [14] JIAO X, SHERMAN B T, HUANG D W, et al. DAVID-WS: a stateful web service to facilitate gene/protein list analysis[J]. Bioinformatics,2012,28(13):1805-1806. doi: 10.1093/bioinformatics/bts251 [15] HUANG D W, SHERMAN B T, LEMPICKI R A. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J]. Nat Protoc,2009,4(1):44-57. doi: 10.1038/nprot.2008.211 [16] HUANG D W, SHERMAN B T, LEMPICKI R A. Bioinformatics enrichment tools: paths toward the comprehensive functional analysis of large gene lists[J]. Nucleic Acids Res,2009,37(1):1-13. doi: 10.1093/nar/gkn923 [17] HULSEN T, DE VLIEG J, ALKEMA W. BioVenn - a web application for the comparison and visualization of biological lists using area-proportional Venn diagrams[J]. BMC Genomics,2008,9(1):1-6. doi: 10.1186/1471-2164-9-1 [18] 徐熠. 茵连痛风颗粒的质量控制研究及初步药效学评价[D]. 上海: 上海中医药大学, 2011. [19] 李墨娇, 刘杰, 张玉波, 等. 伸筋草的化学成分研究[J]. 中草药, 2015, 46(1):33-37. doi: 10.7501/j.issn.0253-2670.2015.01.008 [20] 刘杰, 李国强, 吴霞, 等. 连钱草的化学成分研究[J]. 中国中药杂志, 2014, 39(4):695-698. [21] 章林平, 孙倩, 王威, 等. 茵陈有效成分的药理作用及其临床应用的研究进展[J]. 抗感染药学, 2014, 11(1):28-31. [22] WANG X, HUANG H, MA X P, et al. Anti-inflammatory effects and mechanism of the total flavonoids from Artemisia scoparia Waldst. et kit. in vitro and in vivo[J]. Biomed Pharmacother,2018,104:390-403. doi: 10.1016/j.biopha.2018.05.054 [23] 黄敬群, 宋扬, 赵鹏, 等. 槲皮素对急性痛风性关节炎的抗炎、镇痛实验研究[J]. 海峡药学, 2013, 25(7):64-67. doi: 10.3969/j.issn.1006-3765.2013.07.029 [24] 李荣华. 痛风康对急性痛风性关节炎的抗炎作用及对TLRs/MyD88通路的影响[D]. 广州: 广州中医药大学, 2011. [25] 郭璐, 夏道宗, 骆叶姣, 等. 基于网络药理学探讨土茯苓治疗痛风的作用机制[J]. 中草药, 2019, 50(6):1413-1418. doi: 10.7501/j.issn.0253-2670.2019.06.023 [26] BAS E, RECIO M C, GINER R M, et al. Anti-inflammatory activity of 5-O-demethylnobiletin, a polymethoxyflavone isolated from Sideritis tragoriganum[J]. Planta Med,2006,72(2):136-142. doi: 10.1055/s-2005-873191 [27] SAKATA C, KAWASAKI T, IWATSUKI Y, et al. Inhibitory effects of ASP6537, a selective cyclooxygenase-1 inhibitor, on thrombosis and neointima formation in rats[J]. Thromb Res,2017,157:72-78. doi: 10.1016/j.thromres.2017.06.038 [28] 李艳华. 四妙君逸软膏对肛肠病术后疼痛模型大鼠血清TNF-α、IL-6和IL-10影响的实验研究[D]. 长沙: 湖南中医药大学, 2012. [29] 崔允强. 补肾强骨方治疗膝关节骨性关节炎的疗效及对患者血清TNF-α、IL-6和IL-10的影响[J]. 黑龙江医药, 2018, 31(4):831-833. [30] KIM J, LIM J, KANG B Y, et al. Capillarisin augments anti-oxidative and anti-inflammatory responses by activating Nrf2/HO-1 signaling[J]. Neurochem Int,2017,105:11-20. doi: 10.1016/j.neuint.2017.01.018 期刊类型引用(1)
1. 王经纬,陈晓颙,袁怡,刘晨曦,胡敏. 基于流变学研究外用半固体制剂质量等同性的应用进展. 药学前沿. 2024(10): 300-309 .  百度学术
百度学术其他类型引用(2)
-





 下载:
下载:
 下载:
下载:








