-
万古霉素是治疗耐甲氧西林金黄色葡萄球菌(MRSA)感染的一线用药,其治疗窗窄,血药浓度与疗效、不良反应及耐药菌株的产生密切相关[1-3]。目前,临床上借助治疗药物监测(TDM)来监测万古霉素稳态谷浓度,以评估临床疗效及不良反应。然而,TDM具有滞后性,不能用于制订给药方案及预测目标浓度;且在万古霉素给药后,如未达治疗窗,则需反复多次监测血药浓度,方能找到合适的给药方案。因此,一些医院引入万古霉素个体化给药系统,用以辅助临床决策万古霉素给药方案,目的是规避TDM的不足。
万古霉素个体化给药系统旨在利用群体药代动力学模型(PPK)模拟个体化给药,国内外已开发的系统有Vancomycin-calculator、TDMS2000、ClinCalc、GlobalRPh.com及JPKD[4-8]等。然而,因建模数据集的人口学特征各有不同,PPK模型对不同人群的模拟性能存在差异[9-10]。由于上述系统主要是以西方国家人群数据计算出的PPK参数模型,在应用于中国人群时,常出现明显误差[11]。
2017年焦正教授团队研发了个体化给药系统Smart Dose,该系统是基于中国人群的万古霉素PPK模型,使用贝叶斯算法,可设计及调整万古霉素的给药方案;适应人群包括使用万古霉素的普通成人以及特殊人群(新生儿、老年人、神经外科患者)等[12]。Smart Dose功能包括制定万古霉素初始方案、万古霉素调整方案及自定义用药方案。本研究将对Smart Dose用于中国人群万古霉素稳态谷浓度的效能预测进行评价,探讨其在万古霉素个体化给药过程中的作用意义。
-
纳入2018年12月至2019年4月海军军医大学(第二军医大学)长海医院接受万古霉素治疗的患者,进行常规TDM监测。收集资料包括:①患者基本信息及用药指征,如姓名、年龄、性别、身高、体重、入出院时间、血常规、血清肌酐值、病原微生物检查、药敏试验结果等;②万古霉素TDM监测方案,如万古霉素血药浓度(谷)、给药方案、给药时间、滴注时长、采血时间等。
纳入标准:①2018年12月至2019年4月在长海医院住院期间使用万古霉素,且至少测定了1次万古霉素谷浓度的患者;②年龄≥18岁;③万古霉素用药量满4个维持剂量;④准确记录给药时间及采血时间;⑤用药前后均进行了肾功能检查。
排除标准:①年龄<18岁;②基本资料及肾功能检查结果缺失的患者;③万古霉素用药量不足4个维持剂量的患者;④给药时间及血药浓度监测采血时间未记录或不准确的患者;⑤行腹膜透析或者血液透析治疗的患者。
-
仪器:ARCHITECTi1000SR全自动免疫分析仪、Abbott离心机(美国雅培公司)。
试药:万古霉素(规格:0.5 g,Eli Lilly Japan KK, Seishin Laboratorie);万古霉素(规格:0.5 g,浙江医药有限公司新昌制药厂);万古霉素校准品(0、5、10、25、50和100 μg/ml);LiquichekTM TDM质控品(批号:27740,美国伯乐),包含Level 1[7.34(6.29–8.40)μg/ml]、Level 2 [21.8(18.2–25.3)μg/ml]和Level 3 [38.8(32.3–45.2)μg/ml]。最低定量限为2.5 μg/ml,允许误差为±24%。
血样采集:患者在万古霉素给药4~5个半衰期,血药浓度达到稳态后,于下一次给药前30 min采集外周静脉血,采用化学发光微粒子免疫分析法(CMIA)测得的万古霉素稳态谷浓度;如调整剂量,则按剂量调整给药3~4个半衰期后,下一次给药前30 min采血复查。
-
Smart Dose万古霉素个体化给药系统是应用R语言中的rjags程序包调用JAGS软件, 实现最大后验贝叶斯法(MAPB)估算;该系统根据患者基本资料(性别、年龄、体重及身高),肾功能检查(肌酐值)及给药方案(给药剂量、给药时间、滴注时间、采血时间)预测万古霉素谷浓度。
将预测浓度分为初始预测浓度和调整预测浓度,初始预测浓度是根据患者年龄﹑性别﹑体重和肌酐、给药方案等参数估算出的初始稳态谷浓度;调整预测浓度是将大于等于一个万古霉素谷浓度实测值代入系统后,测算出新的药动学参数,进而预测得出的后续稳态谷浓度,即调整预测浓度。依据上述方法得出并比较Smart Dose对初始预测浓度和调整预测浓度的预测效能。
Smart Dose系统设置了不同人群模块,根据模块将患者来源分为神经外科患者和非神经外科患者两组,根据现有数据对预测结果进行对比分析,比较不同来源的患者的初始浓度预测效能。
将年龄中位数分为高年龄组(≥59岁)和低年龄组(<59岁);给药前肌酐清除率以中位数分为高清除率组(≥90.97 ml/min)和低清除率组(<90.97 ml/min);谷浓度以中位数分为高浓度组(≥8.16 mg/L)和低浓度组(<8.16 mg/L);根据单日给药剂量不同,分为高剂量组(>1500 mg/d)和低剂量组(≤1500 mg/d);根据中华人民共和国成人体质量判定诊断标准[13],依据BMI指数将患者分为肥胖组(≥28 kg/m2)和非肥胖组(<28 kg/m2);对各组分别进行初始浓度预测值与实测值的比较,探究以上因素对初始预测效能的影响。
-
运用SPSS 21.0软件进行数据统计,对浓度预测值与实测值采用配对t检验及Bland-Altman图进行分析评价;实测值与预测值的差异,采用百分误差(PE)、平均百分比误差(MPE)以及平均绝对百分比误差(MAPE)表示。
$$ \begin{array}{l} PE = \displaystyle\frac{{{C_{pred}} - {C_{cobs}}}}{{{C_{cobs}}}} \times 100\% \\ MPE = \displaystyle\frac{1}{N}\sum\limits_{i = 1}^N {} PE\\ MAPE = \displaystyle\frac{1}{N}\sum\limits_{{\rm{i}} = 1}^N {|PE} | \end{array}$$ -
共纳入71例患者,其中男性患者48例,占总人数的67.6%;送检患者主要为颅内感染20例、肺部感染18例、感染性心内膜炎13例,骨关节置换术后感染7例,腹腔感染6例,其他感染7例;初始给药方案1000 mg,q12 h 50例;500 mg,q8 h 14例;500 mg,q12 h 6例;其他给药方案1例;万古霉素均采取静脉滴注方式给药。基本资料见表1。
表 1 万古霉素抗感染患者人口学统计资料
基本信息参数 例数/占比[n(%)] 中位数(最小值;最大值) 均数($ \bar x$±s) 年龄(a/y) 71(100) 59(18;97) 57.35±19.87 <59 35(49.3) 45(18;58) 40.66±12.63 ≥59 36(50.7) 74(59;97) 73.58±9.24 体重(m/kg) 71(100) 67(38;96) 67.53±13.76 给药前肌酐清除率(ml/min) 71(100) 90.97(27.78;232.07) 100.25±46.51 <90.97 35(49.3) 66.57(27.78;90.18) 64.39±18.11 ≥90.97 36(50.7) 120.52(90.97;232.07) 135.11±38.36 谷浓度(c/mg/L) 71(100) 8.16(1.12;52.54) 10.91±8.71 <8.16 35(49.3) 5.61(1.12;7.86) 5.17±2.00 ≥8.16 36(50.7) 13.80(8.16;52.54) 16.84±9.10 万古霉素日剂量(m/mg) 71(100) 2000(1000;2000) 1767.61±394.89 ≤1500 20(28.2) 1000(1000;1500) 1175.00±244.68 >1500 51(71.8) 2000(2000;2000) 2000.00±0.00 BMI(kg/m2) 71(100) 23.88(14.84;32.87) 24.07±4.09 <28 57(80.3) 22.89(14.84;27.77) 22.58±3.01 ≥28 14(19.7) 29.41(28.96;32.87) 30.11±1.30 注:使用MDRD公式计算CLCR肌酐清除率 -
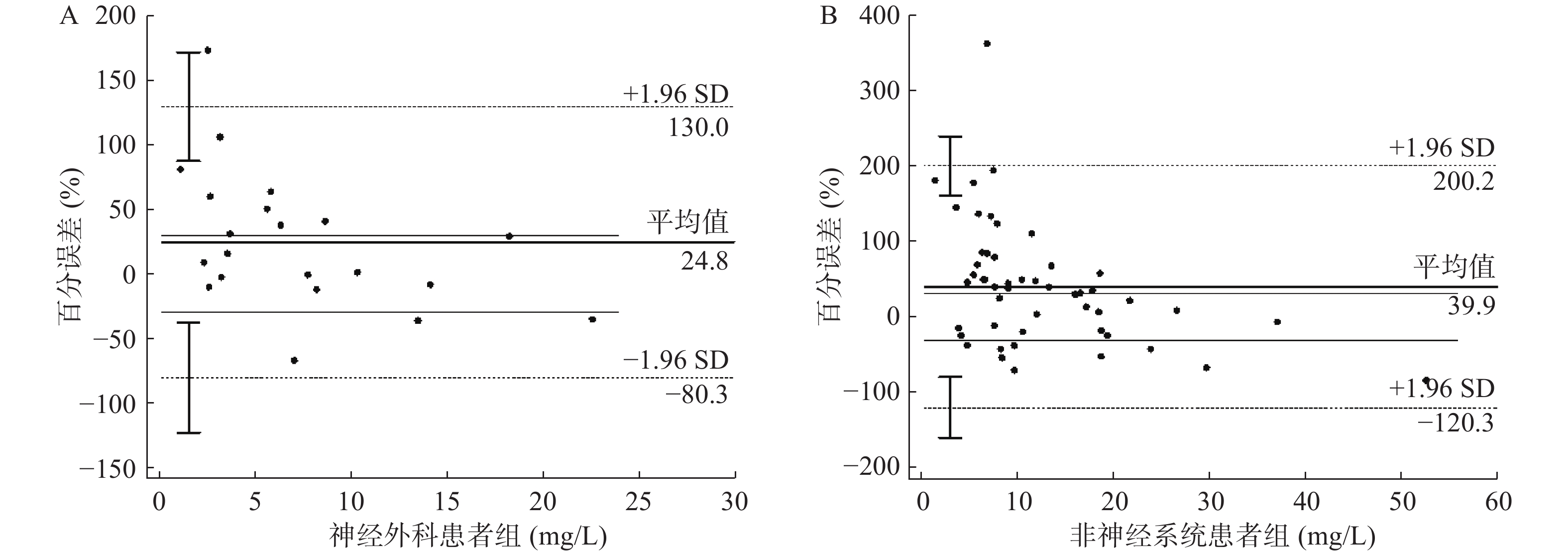
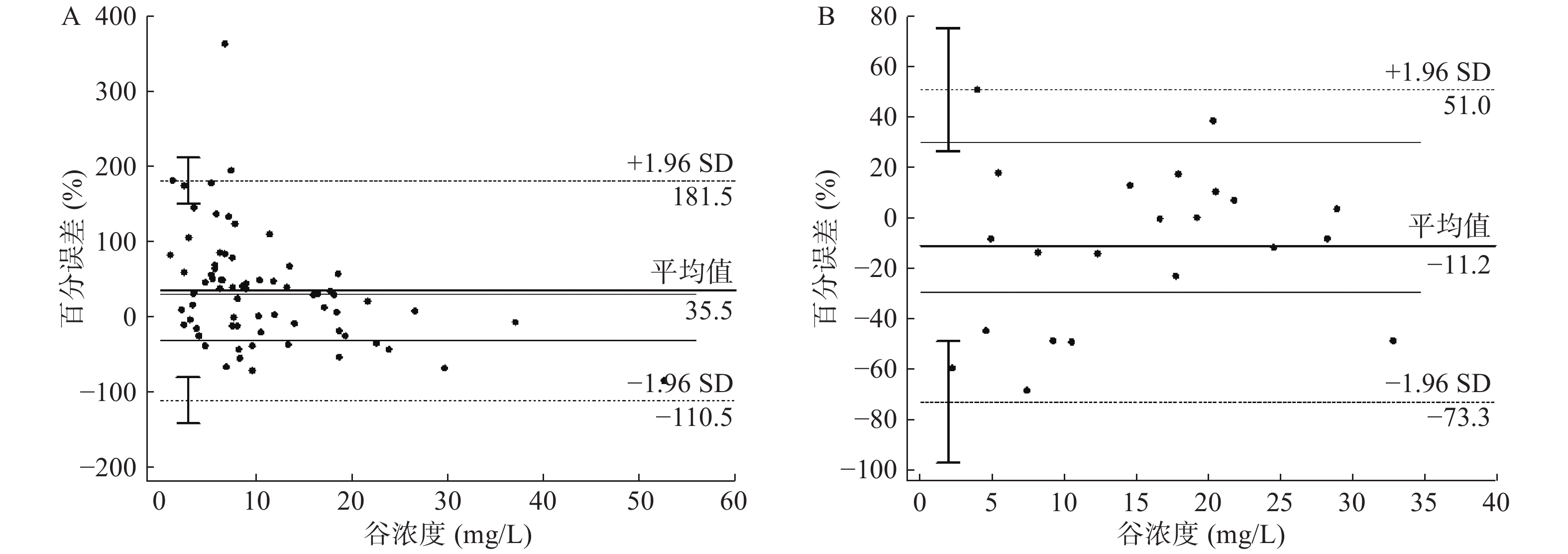
初始预测浓度组纳入71例初始浓度实测值,调整预测浓度组纳入22例调整浓度实测值。结果显示,初始浓度实测值与预测值的百分误差平均值为35.5%,允许的最大误差范围F30=34.3%;调整浓度实测值与预测值的百分误差平均值仅为11.2%,允许的最大误差范围F30=63.6%。初始浓度预测值与实测值误差(PE=35.47±74.49,MPE=35.5%,MAPE=57.9%)和调整浓度预测值与实测值误差(PE=−11.16±31.71,MPE=−11.2%,MAPE=25.4%)之间有差异有统计学意义(P=0.01),调整浓度预测值误差更低,即调整浓度预测值更接近于实测值。Smart Dose预测值与实测值的Bland-Altman图如图1所示;两组预测误差的PE、MPE和MAPE见表2。
表 2 Smart Dose预测万古霉素稳态谷浓度的效能
预测浓度分组 PE(%) MPE(%) MAPE(%) 初始预测浓度 35.47±74.49 0.355 0.579 调整预测浓度 −11.16±31.71 −0.112 0.254 -
神经外科组纳入21例万古霉素初始浓度实测值;非神经外科组纳入50例初始浓度实测值。
Smart Dose预测结果显示,与非神经外科组患者(PE=39.93±81.75,MPE=39.9%,MAPE=64.8%)相比,神经外科组患者(PE=24.84±53.65,MPE=24.8%,MAPE=41.5%)的PE,MPE及MAPE均低于非神经外科患者组,差异有统计学意义(P=0.03),即神经外科组患者的初始浓度预测值更接近于真实值。预测结果的Bland-Altman图如图2所示;两组预测误差的PE、MPE及MAPE见表3。
表 3 Smart Dose针对非神经外科患者组和神经外科患者组初始稳态谷浓度的预测效能
预测浓度分组 PE(%) MPE(%) MAPE(%) 神经外科患者组 24.84±53.65 0.248 0.415 非神经外科患者组 39.93±81.75 0.399 0.648 -
根据年龄中位数分为高年龄组(≥59岁)和低年龄组(<59岁),高年龄组和低年龄组分别纳入36例和35例万古霉素血药浓度初始实测值。将给药前肌酐清除率以中位数分为高清除率组(≥90.97 ml/min)和低清除率组(<90.97 ml/min),分别纳入36例和35例万古霉素血药浓度初始实测值;将谷浓度以中位数分为高浓度组(≥8.16 mg/L)和低浓度组(<8.16 mg/L),分别纳入36例和35例万古霉素血药浓度初始实测值。根据单日给药剂量不同,分为高剂量组(>1500 mg/d)和低剂量组(≤1500 mg/d),分别纳入51例和20例万古霉素血药浓度初始实测值。根据BMI指数将患者分为肥胖组(≥28 kg/m2)和非肥胖组(<28 kg/m2),肥胖组和非肥胖组分别纳入14例和57例万古霉素血药浓度初始实测值。分别比较各组间的PE、MPE、MAPE(见表4)。结果表明,Smart Dose对于高浓度组的初始浓度预测值更准确(P=0.001),对于不同的年龄(P=0.589)、肌酐清除率(P=0.537)、日剂量(P=0.386)、BMI(P=0.760)初始浓度的预测效能相仿。
表 4 Smart Dose对不同情况患者初始稳态谷浓度的预测效能
分组 PE(%) MPE(%) MAPE(%) 高年龄组 58.52±75.42 0.585 0.651 低年龄组 11.76±66.54 0.118 0.491 高清除率组 36.96±69.89 0.370 0.622 低清除率组 33.94±79.95 0.339 0.535 高浓度组 1.66±44.01 0.017 0.363 低浓度组 70.24±83.52 0.702 0.801 高剂量组 33.12±63.19 0.331 0.541 低剂量组 41.45±99.41 0.415 0.676 肥胖组 42.97±49.87 0.430 0.536 非肥胖组 33.63±79.63 0.336 0.590 -
本研究在评价新型万古霉素个体化给药系统Smart Dose临床效用的方向上,针对其预测效能(PE、MPE及MAPE)进行数据分析。根据系统本身模块设置,将所收集数据分为初始预测浓度组与调整预测浓度组,分析结果显示Smart Dose调整预测浓度在PE、MPE及MAPE方面均优于初始浓度预测值,即调整浓度预测值与实测值的接近程度优于初始浓度预测值与实测值[12],提示Smart Dose系统更适合用于调整给药方案;建议患者先进行万古霉素血药浓度的TDM监测,获得一个实测浓度值后,再利用Smart Dose进行浓度调整,其结果会更加接近真实值。这可能因为调整预测浓度带入了前一次实测浓度、准确的滴注时间及采血时间,经过贝叶斯法得到新的药动学参数(表观分布容积、表观清除率)后,再根据给药方案进行预测。国内外多篇文献报道表明,药代动力学结合贝叶斯法能够更为准确地预测万古霉素血药浓度,且准确的给药时间、采血时间、滴注时间能够辅助预测[14-16]。
有研究表明,神经外科术后患者万古霉素的清除率高于非神经外科患者,而万古霉素在患者发生脑膜炎时可以透过血脑屏障进入脑脊液[17-18],可见,神经外科患者在使用万古霉素时自身药动学参数有别于非神经外科患者,Smart Dose系统在研制时亦将二者区分[12]。故本研究将所收集数据分为神经外科患者组和非神经外科患者组,结果发现,Smart Dose对神经外科患者组预测效能(PE、MPE及MAPE)优于非神经外科患者组。这可能与系统本身将神经外科患者药动学参数模板单独建立,区别于普通患者有关。
本研究浓度数据离散程度较大,这可能与样本中存在高龄、自身的肾功能不全的患者有关,部分高龄或ICU患者实验室检查肌酐值普遍偏低[19-20],此时不能单纯以肌酐值来衡量患者的肾功能;危重患者炎症反应、应激反应剧烈,可导致有效血容量不足,临床中可能会采用液体复苏保证有效的循环血量,因此,可能会影响万古霉素的药物分布和消除[20]。此外,老年重症患者肌酐清除率往往成为影响谷浓度的主要因素,降低了年龄及体重的影响,结果出现了一定的偏差[21]。同时,本研究发现高浓度组患者预测准确性较低浓度组高,这可能因为部分谷浓度在限定量以下的患者初始浓度实测值的准确性本身存在偏差,而低浓度患者在应用Smart Dose等个体化给药系统进行稳态谷浓度预测时,极有可能出现绝对误差过大的情形。再者,在TDM监测中,Smart Dose采用的荧光偏振免疫法与本实验的化学微粒发光法测量结果可能存在差异,需要矫正,否则直接使用结果可能出现误差增大的现象[22-23]。因此,临床药师需结合患者本身情况和疾病特点,优化个体药动学参数,以Smart Dose做为辅助手段来为临床合理用药提供依据。
本研究收集样本例数有限,仅Smart Dose关于万古霉素初始给药方案及调整给药方案两个模块进行效能评估,未对自定义给药方案(可用于模拟停药)进行评估。后续将扩大临床研究,完善对万古霉素个体化给药系统Smart Dose的效能评估,为合理应用Smart Dose用于临床万古霉素初始给药方案制定及调整提供科学依据。
Evaluation of Smart Dose's predictive effectiveness on vancomycin blood concentration
-
摘要:
目的 评价个体化给药决策支持系统Smart Dose应用于中国人群治疗药物监测的临床效用。 方法 使用Smart Dose系统预测患者万古霉素谷浓度,分析谷浓度预测值与实测值之间的差异,以评价该系统对于万古霉素血药浓度的预测效能。 结果 Smart Dose调整浓度预测值与实测值之间的差异,平均百分比误差,平均绝对百分比误差小于初始浓度预测值与实测值之间的差异。神经外科组患者初始浓度预测值与实测值的差异比非神经外科组患者小,预测效能优于非神经外科组。高谷浓度组和低年龄组(<59岁)的初始浓度预测值更接近于实测值。不同的BMI对于初始浓度的预测效能相仿。 结论 Smart Dose系统更适合于万古霉素调整浓度的预测。用于初始浓度预测时,神经外科组、高谷浓度及低年龄组的预测值更准确。不同的BMI对于初始浓度预测效能相仿。 Abstract:Objective To evaluate clinical utility of the personalized drug delivery decision support system, Smart Dose, applied to the monitoring of therapeutic drugs in Chinese population. Methods Use Smart Dose system to predict the trough concentration of vancomycin in patients, analyze the difference between the predicted value and the measured value of the trough concentration, and to evaluate the prediction performance of the system for vancomycin blood concentration. Results Smart Dose adjusts the difference between the predicted value of concentration and the measured value, the average percentage error, and the average absolute percentage error is less than the difference between the predicted value of initial concentration and the measured value. The difference between the initial concentration prediction value and the measured value of the neurosurgery group was smaller than that of the non-neurosurgery group, and the prediction efficiency was better than that of the non-neurosurgery group. The predicted initial concentration of the high trough concentration group and the low-age group (<59 years old) are closer to the measured value. The predictive performance of different BMI for the initial concentration is similar. Conclusion Smart Dose system is more suitable for predicting the adjusted concentration of vancomycin; When used for initial concentration prediction, the prediction values of neurosurgery group, high trough concentration, and low age group are more accurate. Different BMI has similar performance in predicting initial concentration. -
Key words:
- vancomycin /
- therapeutic drug monitoring /
- software
-
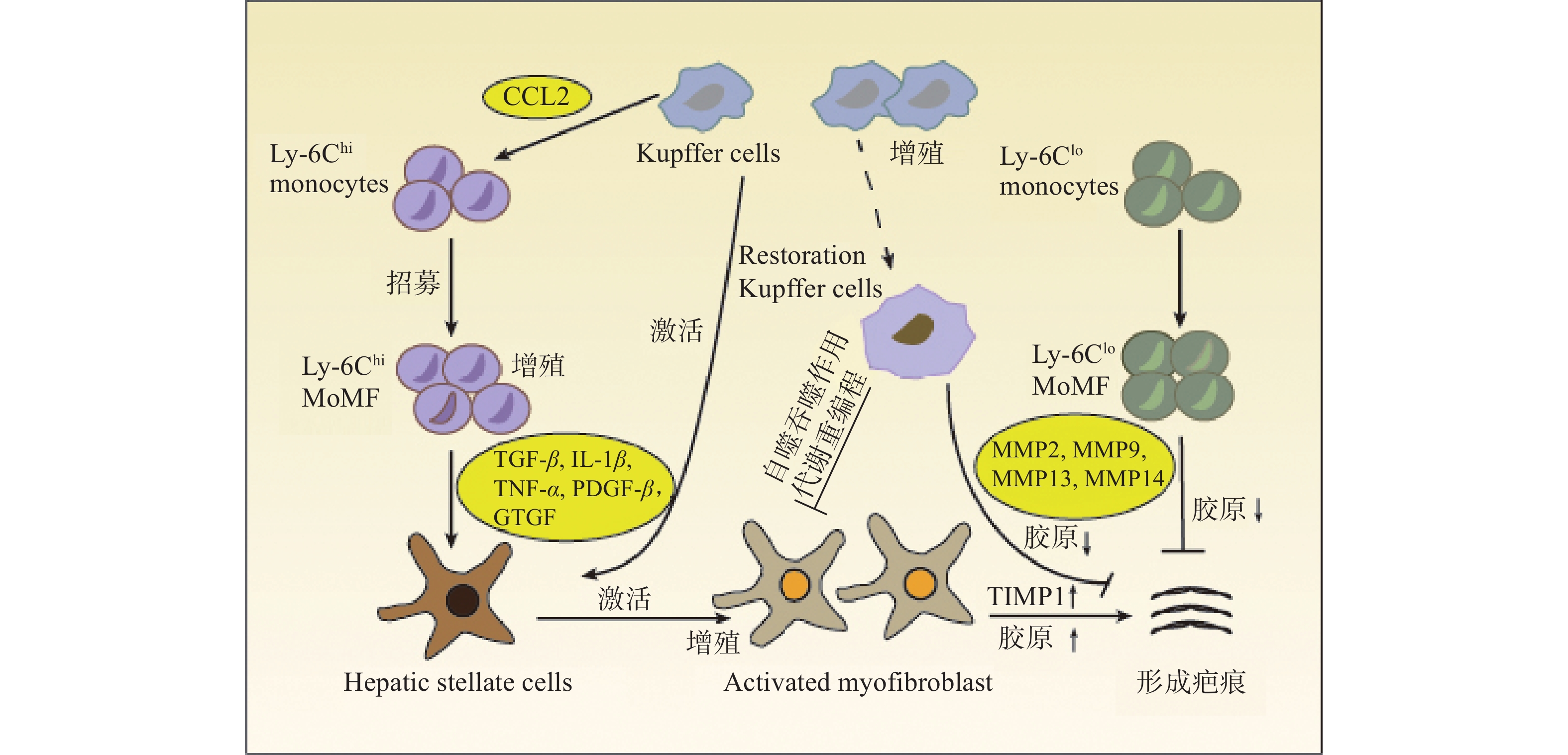
肝纤维化是肝脏对慢性肝损伤的过度修复反应,是一个动态可逆的过程。阻断肝纤维化持续进展是防治肝病向肝硬化甚至肝细胞癌发展的重要策略。目前研究认为,肝星状细胞(HSCs)转化为活化的肌成纤维细胞(MFBs)是细胞外基质 (ECM)的主要来源,也是肝纤维化的主要驱动力[1]。除此之外,大量研究发现,肝巨噬细胞在肝纤维化过程中同样发挥重要作用。
1. 肝巨噬细胞
肝巨噬细胞是肝脏中一个高度异质的非实质细胞群,占肝脏细胞的10%~15%,主要由枯否细胞 (KCs) 和单核细胞衍生的各种浸润巨噬细胞 (MoMFs) 组成,具有显著异质性。巨噬细胞的异质性以多种来源、多种细胞类型特异性标志物和极化表型为特征。此外,肝巨噬细胞具有显著的可塑性,能够快速响应组织环境的变化,呈现不同的细胞表型。肝巨噬细胞被认为是肝脏抵御病原体的第一道防线,参与包括炎症反应、纤维化形成以及纤维化消退在内的肝纤维化所有阶段[2]。因此,肝内巨噬细胞是肝纤维化的核心调控者,肝纤维化治疗的重要靶细胞。
1.1 KCs
KCs是体内最大的常驻巨噬细胞群,包括卵黄囊来源的KCs和骨髓来源的KCs。KCs可以识别内源性细胞碎片和外源性病原体,感知肝脏损伤进而发生活化。因此,KCs对于肝脏稳态的维持、免疫反应的启动和肝损伤的恢复至关重要。
1.2 MoMFs
MoMFs充当免疫反应协调者并补充巨噬细胞群以维持肝脏中的稳态。在小鼠体内,MoMFs分为两个亚群:Ly6Chi和Ly6Clo单核细胞。Ly6Chi单核细胞参与炎症反应并产生促炎作用,而Ly6Clo单核细胞则具有组织修复功能。
2. 肝巨噬细胞在肝纤维化中的作用
在肝损伤早期,损伤或死亡的肝细胞能够释放损伤相关分子模式 (DAMP),并与肝巨噬细胞相互作用,从而促进肝巨噬细胞的活化、极化和募集。活化的肝巨噬细胞能够分泌大量促炎因子和促纤维化细胞因子,参与炎症反应并促进HSCs的活化和纤维化应答[3](图1)。
2.1 肝巨噬细胞与HSCs的相互作用
HSCs位于肝细胞和肝窦内皮细胞之间的窦周间隙,在正常和受损的肝组织中具有不同的生理功能。正常的生理条件下,HSCs被称为静息的HSCs (qHSCs),负责储存肝脏中的维生素A。当肝损伤后,qHSCs被炎症介质激活,进而分化为 MFBs,分泌大量的ECM并产生纤维瘢痕,导致肝纤维化[4]。肝巨噬细胞能够与HSCs相互作用,重塑免疫微环境和ECM,该相互作用对于肝脏炎症应答和纤维化应答至关重要。
肝巨噬细胞能够分泌与HSCs活化有关的各种细胞因子和趋化因子,如转化生长因子β (TGF-β),肿瘤坏死因子α (TNF-α),白细胞介素1β (IL-1β) 和趋化因子配体2 (CCL2) 等。肝巨噬细胞产生的IL-1β和TNF-α能够激活NF-κB信号通路,增强MFBs的增殖[5]。激活素A (ACTA) 是TGF-β超家族成员之一,能够促进KCs中TNF-α和TGF-β1的表达,诱导HSCs转化为促纤维化表型,提高α-平滑肌肌动蛋白 (α-SMA) 表达水平和迁移能力[6]。此外,肝脏在受到丙型肝炎病毒 (HCV) 感染后,肝巨噬细胞能够分泌趋化因子配体5 (CCL5) ,引起HSCs中炎症小体和纤维化标志物α-SMA与TGF-β的激活[7]。
除细胞因子和趋化因子外,肝巨噬细胞还能够产生其他与HSCs串扰的分子。例如,MoMFs能够通过分泌颗粒蛋白激活qHSCs,促进其转化为MFBs,引起ECM的积累和肝纤维化的形成[8]。HMGB1是一种响应组织损伤而产生的DAMP,主要由肝细胞和KCs分泌,研究表明,HMGB1能够与HSCs中的晚期糖基化终末产物受体(RAGE)结合,激活pMEK1/2、pERK1/2和p-c-Jun通路,增加Ⅰ型胶原蛋白的沉积[9]。
此外,HSCs也可作用于肝巨噬细胞,影响其功能。紫藤凝集素阳性Mac-2结合蛋白 (WFA+-M2BP) 是一种肝纤维化的血清指示剂,可由HSCs分泌。据报道,WFA+-M2BP能够促进KCs表达M2BP,而KCs分泌的M2BP反过来又会进一步加强HSCs的激活。由此说明,在肝纤维化的发展过程中,巨噬细胞和HSCs之间存在正反馈调节[10]。
2.2 巨噬细胞极化
巨噬细胞具有显著的异质性,可以在不同的组织微环境中极化成不同的表型,从而发挥不同作用。通常,巨噬细胞极化的表型可以分为经典活化 (M1) 型和选择活化 (M2) 型。M2型可以进一步分为M2a、M2b、M2c和M2d亚型。
在被脂多糖 (LPS) 和干扰素-γ(IFN-γ) 刺激后,M1型巨噬细胞发生活化,分泌大量促炎细胞因子,如IL-1β、TNF-α、诱导型一氧化氮合酶 (iNOS) 等,从而发挥促炎作用。因此,M1型巨噬细胞在肝损伤起始阶段起重要作用,能够释放促炎因子,加剧炎症反应并促进肌成纤维细胞增殖,最终导致肝纤维化[11]。
M2型巨噬细胞的极化主要由白细胞介素4 (IL-4) 和白细胞介素13 (IL-13)等细胞因子诱导发生,能够分泌抗炎因子,如白细胞介素10 (IL-10) 、TGF-β、精氨酸酶1 (Arg-1) 等,具有抑制炎症、促进组织重塑、预防寄生虫感染以及调节免疫等生物学功能。在肝纤维化的发展过程中,M2型巨噬细胞产生抗炎作用,能够促进伤口的愈合和再生。然而,当肝损伤持续存在时,M2型巨噬细胞释放的TGF-β、血小板衍生生长因子 (PDGF) 、血管内皮生长因子 (VEGF) 等生长因子,会促进MFBs的增殖和活化,加重肝纤维化[12]。
调节巨噬细胞极化可以发挥抗肝纤维化作用。脯氨酸-丝氨酸-苏氨酸-磷酸酶相互作用蛋白2 (PSTPIP2) 能够调节STAT1和NF-κB信号通路,抑制M1型巨噬细胞极化,改善肝脏炎症和肝纤维化[13]。白细胞介素22 (IL-22) 能够调节STAT3、Erk、Akt信号通路的传导,促进巨噬细胞从M1型转变为M2型,从而减缓肝纤维化的进展[14]。
此外,肝巨噬细胞和其他细胞群之间的相互作用对肝巨噬细胞的表型转换也至关重要。自然杀伤 (NK) 细胞在调节巨噬细胞极化方面发挥关键作用,研究发现,DX5+NKp46+ NK细胞能够产生IFN-γ促进M1巨噬细胞极化,在预防非酒精性脂肪性肝炎 (NASH) 进展为肝纤维化方面发挥重要作用[15]。中性粒细胞 (PMN) 能够促进巨噬细胞转变为具有肝脏修复功能的巨噬细胞,有助于肝脏炎症和肝纤维化的自发消退[16]。
2.3 肝巨噬细胞的募集和浸润
肝巨噬细胞浸润与慢性炎症和肝纤维化密切相关。在趋化因子和相应受体的介导下,巨噬细胞能够募集到损伤部位,参与炎症和肝纤维化的发展。例如,Ly6Chi MoMFs能够依赖趋化因子受体2 (CCR2) 募集到肝损伤区域,发挥促炎和促纤维化作用。微蛋白 (PSMP) 是一种新型趋化因子,能够促进炎性巨噬细胞的浸润,分泌更多的促炎细胞因子,加剧肝纤维化应答[17]。骨髓细胞上表达的触发受体1 (TREM-1) 可促进KCs的募集和浸润以及促炎细胞因子的产生[18]。
阻碍肝巨噬细胞的浸润与募集有助于肝纤维化的消退。配对免疫球蛋白样2型受体α (PILRα) 是一种抑制性受体,主要在骨髓细胞中表达,在炎症过程中能够抑制肝巨噬细胞与PMN的浸润。研究证实,PILRα能够调节整合素信号传导,阻碍巨噬细胞迁移到受损的肝组织,从而减轻肝脏炎症并缓解肝纤维化[19]。
此外,研究还发现一种新的TREM2+ CD9+瘢痕相关巨噬细胞 (SAMacs) 亚群,其来源于MOMFs,在肝纤维化过程中表现出促纤维化表型[20],可能成为未来肝纤维化治疗的重要靶细胞。
2.4 肝巨噬细胞与肝细胞的相互作用
在肝纤维化进展中,肝细胞能够分泌一系列DAMP和细胞外囊泡 (EVs) ,可与肝巨噬细胞相互作用,诱导巨噬细胞转变为促炎表型。线粒体DNA (mtDNA) 是一种内源性DAMP,能够激活先天免疫反应[21]。肝细胞衍生的mtDNA能够激活NF-κB信号通路,诱导KCs分泌TNF-α和白细胞介素6 (IL-6) ,引起肝脏炎症和纤维化应答[22]。M1型巨噬细胞分泌的EVs能够激活肝细胞中NLRP3炎性体信号通路,而应激的肝细胞可分泌含有微小RNA-192-50 (miR-192-5p) 和血清CD40L配体 (CD40L) 的EVs,促进M1型巨噬细胞极化[23]。因此,肝细胞和巨噬细胞之间通过释放DAMP和EVs相互作用,促进了肝内炎症反应与肝纤维化进展。
2.5 肝巨噬细胞与代谢重编程
细胞代谢重编程是细胞为满足能量需求,通过改变代谢模式促进细胞增殖和生长的机制,包括糖代谢、脂代谢、氨基酸代谢等。
肝巨噬细胞的代谢重编程与巨噬细胞极化紧密联系,影响肝纤维化的进展和消退[24]。c-Rel是NF-κB转录因子家族成员之一,参与巨噬细胞代谢重编程。研究发现,c-Rel能够与6-磷酸果糖激酶-2的启动子结合,诱导巨噬细胞极化和HSCs活化,从而加重炎症反应与肝纤维化[25]。此外,肝脏中铁的代谢失调也与晚期肝纤维化有关。肝内铁的积累能够激活MiT/TFE转录因子,促进M1型巨噬细胞的活化,加重肝纤维化[26]。
膜联蛋白A5是膜联蛋白家族的成员之一,能够与M2型丙酮酸激酶(PKM2)相互作用,将肝巨噬细胞中的糖酵解转换为氧化磷酸化,促进巨噬细胞从M1型转换到M2型,从而改善炎症和肝纤维化[27]。因此,调节肝巨噬细胞的免疫代谢是肝纤维化的潜在治疗策略。
2.6 肝巨噬细胞自噬和吞噬作用
自噬是将机体中异常表达的蛋白质和受损的细胞器转移到溶酶体中进行降解,对细胞稳态的维持、细胞存活、分化和生长至关重要。大量研究证实,巨噬细胞自噬对肝脏具有保护作用。例如,KCs的自噬能够抑制细胞活性氧 (ROS) 介导的白细胞介素1α (IL-1α) 和IL-1β的分泌,从而缓解肝脏炎症和纤维化[28]。日本血吸虫卵抗原 (SEA) 诱导的巨噬细胞自噬能够抑制肝脏病理的发展[29]。白细胞介素7 (IL-7) 能够通过激活AMP活化蛋白激酶 (AMPK) 抑制SEA诱导的巨噬细胞自噬,促进炎症细胞对肝脏的浸润,增强MFBs活性,从而加重SEA感染引起的肝纤维化[30]。此外,LC3相关的吞噬作用 (LAP) 是一种非典型的自噬形式,能够将Ly6Chi MoMFs变为Ly6Clo MoMFs。研究表明,LAP可抑制全身炎症,发挥抗肝纤维化作用[31]。
吞噬作用是细胞摄取较大固体颗粒或大分子复合体的过程。肝巨噬细胞能够通过吞噬和清除肝脏中死亡的细胞调节肝脏炎症和纤维化。在肝损伤中,巨噬细胞能够吞噬坏死的肝细胞,诱导Wnt3a的表达并激活Wnt通路,从而促进肝再生。肝脏巨噬细胞的吞噬作用,减弱了受损肝细胞中线粒体衍生的DAMP的释放,从而抑制肝脏瘢痕的形成[32]。因此,调节肝巨噬细胞的自噬和吞噬功能可成为一种新的抗肝纤维化策略,值得进一步研究。
2.7 其他肝巨噬细胞在肝纤维化中的作用
除了KCs和MoMFs,其他浸润性巨噬细胞群也与肝纤维化有关。SOCS蛋白是巨噬细胞炎症活性的调节因子,在肝纤维化期间,脾巨噬细胞能够通过上调肝巨噬细胞中的SOCS3信号传导来促进CCL2的分泌,从而促进循环单核细胞的浸润,加剧肝纤维化的发展[33]。
2.8 其他机制
肝纤维化的发展与多种细胞和分子机制相关。除肝巨噬细胞外,HSCs、肝细胞、肝窦内皮细胞、胆管细胞和脾细胞也参与了肝纤维化的发展,这些细胞之间的相互作用,能够调控细胞内信号传导,从而影响肝纤维化进展和消退。此外,肝内肝窦的形成和重塑是肝纤维化的关键特征,抑制血管生成也能够减缓肝纤维化的进展。
3. 靶向肝巨噬细胞治疗肝纤维化
肝巨噬细胞在肝损伤、肝纤维化进展和消退中发挥双重作用。目前研究证实,多种药物能够通过调控肝巨噬细胞的功能发挥抗肝纤维化的作用。因此,基于巨噬细胞在肝纤维化中的作用,人们开发了相关的趋化因子抑制剂、细胞通路拮抗剂,期望为肝纤维化提供新的治疗策略。
3.1 临床前研究
3.1.1 巨噬细胞极化的调节
调节巨噬细胞极化可以治疗肝纤维化。例如,槲皮素能够调控Notch1通路,抑制M1型巨噬细胞极化,缓解炎症反应,从而抑制肝纤维化进展[34];壳寡糖能够通过调控JAK2/STAT1和JAK1/STAT6信号通路,抑制巨噬细胞极化为M1型,增加M2型巨噬细胞数量,从而发挥抗肝纤维化作用[35]。此外,研究还发现,在肝纤维化期间,脾切除能够激活ERK1/2信号通路,促进MOMFs转换为抗炎的Ly6CloMOMFs,从而减轻肝脏炎症和肝纤维化应答[36]。
3.1.2 抑制巨噬细胞的募集和浸润
抑制巨噬细胞募集和浸润有助于肝纤维化的消退。姜黄素能够通过抑制KCs的激活减少趋化因子分泌,降低Ly6ChiMOMFs的浸润,从而缓解肝纤维化[37]。鉴于CCL2/CCR2和CCL5/CCR5信号通路在巨噬细胞募集中的关键作用,人们研发出了相关的趋化因子受体拮抗剂,如CCR2拮抗剂RS102895、CCR2/CCR5双拮抗剂 (CVC) 。研究发现,在酒精性肝纤维化模型中,CVC能够明显抑制体内巨噬细胞的募集,展现出较好的的抗纤维化活性[38]。
3.1.3 诱导巨噬细胞自噬
巨噬细胞自噬是一种针对慢性肝损伤和纤维化的保护机制,通过诱导巨噬细胞自噬能够治疗肝纤维化。MJN110是一种单酰基甘油脂肪酶 (MAGL) 抑制剂,在CCl4和BDL诱导的肝纤维化模型中,MJN110的干预能够促使巨噬细胞自噬通量和自噬体生物合成增加、减少肝巨噬细胞数量,从而减缓肝纤维化进展,促进肝纤维化消退[39]。
3.2 临床研究
大多数基于肝巨噬细胞的疗法仅在肝纤维化的动物模型中进行了评估,而相关的临床研究数据较少。CVC是CCR2和CCR5双重拮抗剂,两项临床实验数据显示,CVC在伴有纤维化的NASH中具有显著的抗纤维化作用,并且耐受性良好[40]。此外,有研究人员在人体上进行了自体巨噬细胞治疗的安全性评估实验,结果表明,该疗法在肝硬化患者中是安全可行的,这为未来研究其在肝硬化和其他纤维化疾病中的疗效提供了依据[41]。
4. 结论与展望
肝纤维化是由各种病因所致慢性肝损伤的修复反应,其特征是ECM在肝内的过度沉积。鉴于肝巨噬细胞在调节肝纤维化反应中的关键作用,人们开发出了针对肝巨噬细胞治疗肝纤维化的新策略。基于抑制KCs活化的靶向疗法已被研究,这些疗法主要通过抑制细胞内炎症信号通路,如NF-κB、ASK1、JNK和p38等信号通路,从而治疗肝纤维化[42]。Loomba等人开发了Selonsertib,一种ASK1信号通路的抑制剂,研究证实,Selonsertib对肝细胞代谢和巨噬细胞活化有影响。在一项随机2期试验中,Selonsertib能够降低NASH和肝纤维化患者的肝脏中胶原蛋白含量和小叶炎症程度,并且能够改善肝细胞凋亡和坏死[43]。此外,肝纤维化治疗的重点是减少MoMFs向肝脏的募集。MoMFs向受损肝脏的募集依赖于活化的肝细胞分泌的几种趋化因子,如趋化因子配体1 (CCL1) ,CCL2,CCL5[44]。因此,调节趋化因子的信号传导也是一种治疗策略,这些疗法主要包括针对趋化因子或受体的单克隆抗体、阻止趋化因子结合的受体拮抗剂、适体分子和阻断趋化因子诱导的细胞内信号传导的小分子抑制剂等[5]。研究发现,使用CCR2敲除能够减弱小鼠MoMFs募集,抑制MFBs活化并减轻肝纤维化[45]。此外,MoMFs可分为导致肝脏损伤的Ly6Chi MOMFs和具有肝脏修复功能的Ly6Clo MOMFs。因此,另一种潜在的策略是通过将Ly6Chi MOMFs转换为Ly6Clo MOMFs来恢复正常的肝功能。研究证实,在CCl4诱导的肝纤维化模型和MCD饮食诱导的NASH模型中,CCL2抑制剂mNOX-E36能够抑制Ly6Chi MOMFs的早期流入,同时能够将Ly6Chi MOMFs转换为Ly6Clo MOMFs,促进肝纤维化的消退[46]。
尽管肝巨噬细胞在肝纤维化发病机制中的作用机制和相关治疗策略已经取得了突破性进展,然而,通过巨噬细胞靶向肝纤维化疗法仍然存在局限性。需要解决的问题如下:肝巨噬细胞的这些表型其临床意义是什么,是否有可能对肝巨噬细胞进行基因改造以解决肝纤维化,如何达到只靶向致病表型而不破坏正常的生理表型?此外,大多数关于肝巨噬细胞的作用和潜在机制的研究都是在啮齿动物模型中进行的,由于啮齿动物和人类之间的肝巨噬细胞存有差异,这些发现与人类的相关性仍需要进一步研究。
-
表 1 万古霉素抗感染患者人口学统计资料
基本信息参数 例数/占比[n(%)] 中位数(最小值;最大值) 均数( $ \bar x$ ±s)年龄(a/y) 71(100) 59(18;97) 57.35±19.87 <59 35(49.3) 45(18;58) 40.66±12.63 ≥59 36(50.7) 74(59;97) 73.58±9.24 体重(m/kg) 71(100) 67(38;96) 67.53±13.76 给药前肌酐清除率(ml/min) 71(100) 90.97(27.78;232.07) 100.25±46.51 <90.97 35(49.3) 66.57(27.78;90.18) 64.39±18.11 ≥90.97 36(50.7) 120.52(90.97;232.07) 135.11±38.36 谷浓度(c/mg/L) 71(100) 8.16(1.12;52.54) 10.91±8.71 <8.16 35(49.3) 5.61(1.12;7.86) 5.17±2.00 ≥8.16 36(50.7) 13.80(8.16;52.54) 16.84±9.10 万古霉素日剂量(m/mg) 71(100) 2000(1000;2000) 1767.61±394.89 ≤1500 20(28.2) 1000(1000;1500) 1175.00±244.68 >1500 51(71.8) 2000(2000;2000) 2000.00±0.00 BMI(kg/m2) 71(100) 23.88(14.84;32.87) 24.07±4.09 <28 57(80.3) 22.89(14.84;27.77) 22.58±3.01 ≥28 14(19.7) 29.41(28.96;32.87) 30.11±1.30 注:使用MDRD公式计算CLCR肌酐清除率 表 2 Smart Dose预测万古霉素稳态谷浓度的效能
预测浓度分组 PE(%) MPE(%) MAPE(%) 初始预测浓度 35.47±74.49 0.355 0.579 调整预测浓度 −11.16±31.71 −0.112 0.254 表 3 Smart Dose针对非神经外科患者组和神经外科患者组初始稳态谷浓度的预测效能
预测浓度分组 PE(%) MPE(%) MAPE(%) 神经外科患者组 24.84±53.65 0.248 0.415 非神经外科患者组 39.93±81.75 0.399 0.648 表 4 Smart Dose对不同情况患者初始稳态谷浓度的预测效能
分组 PE(%) MPE(%) MAPE(%) 高年龄组 58.52±75.42 0.585 0.651 低年龄组 11.76±66.54 0.118 0.491 高清除率组 36.96±69.89 0.370 0.622 低清除率组 33.94±79.95 0.339 0.535 高浓度组 1.66±44.01 0.017 0.363 低浓度组 70.24±83.52 0.702 0.801 高剂量组 33.12±63.19 0.331 0.541 低剂量组 41.45±99.41 0.415 0.676 肥胖组 42.97±49.87 0.430 0.536 非肥胖组 33.63±79.63 0.336 0.590 -
[1] 张致平. 抗耐药菌药物研究进展[J]. 中国临床药理学杂志, 2003, 19(1):50-56. doi: 10.3969/j.issn.1001-6821.2003.01.014 [2] 李光辉. 万古霉素临床应用剂量中国专家共识[J]. 中华传染病杂志, 2012, 30(11):641-646. doi: 10.3760/cma.j.issn.1000-6680.2012.11.001 [3] RYBAK M J, LE J, LODISE T P, et al. Executive summary: therapeutic monitoring of vancomycin for serious methicillin-resistant Staphylococcus aureus infections: a revised consensus guideline and review of the American Society of Health-system Pharmacists, the Infectious Diseases Society of America, the Pediatric Infectious Diseases Society, and the Society of Infectious Diseases Pharmacists[J]. Pharmacotherapy,2020,40(4):363-367. doi: 10.1002/phar.2376 [4] FEWEL N P. Vancomycin-calculator[CP/OL]. (2020-06-26) [2016-07-22]. http://Vancomycin-Calculator.com. [5] ANDERSON P. Vancomycin dosing calculator. TDMS2000[CP/OL]. (2020-06-26). http://tdms2000.com. [6] KANE S P. Vancomycin calculator. ClinCalc[CP/OL]. (2020-06-29)[2016-05-21]. http://clincalc.com/Vancomycin/default.aspx. [7] MCAULEY D. Aminoglycoside-vancomycin dosing. GlobalRPh[CP/OL](2020-06-29)[2016-05-21]. http://globalrph.com/aminoglycosides.htm. [8] 何娟, 杨婉花. 基于群体药动学的万古霉素个体化给药模式的建立和临床应用[J]. 中国临床药学杂志, 2015, 24(1):27-31. [9] 凌静, 蒋艳, 胡楠, 等. 免费万古霉素个体化给药软件预测谷浓度的效能评估[J]. 中国医院药学杂志, 2018, 38(22):2328-2331. [10] FEWEL N P. Comparison of open-access vancomycin dosing websites[J]. J Clin Pharm Ther,2017,42(2):128-131. doi: 10.1111/jcpt.12466 [11] 何娜, 闫盈盈, 苏珊, 等. 基于药代动力学方法支持的万古霉素个体化给药现状[J]. 中国临床药理学杂志, 2018, 34(1):63-65, 69. [12] 高玉成, 焦正, 黄虹, 等. 万古霉素个体化给药决策支持系统的研制[J]. 药学学报, 2018, 53(1):104-110. [13] 中华人民共和国国家卫生和计划生育委员会. 成人体重判定: WS/T 428—2013[S]. 北京: 中国标准出版社, 2013. [14] TASA T, METSVAHT T, KALAMEES R, et al. DosOpt: a tool for personalized Bayesian dose adjustment of vancomycin in neonates[J]. Ther Drug Monit,2017,39(6):604-613. doi: 10.1097/FTD.0000000000000456 [15] PAI M P, NEELY M, RODVOLD K A, et al. Innovative approaches to optimizing the delivery of vancomycin in individual patients[J]. Adv Drug Deliv Rev,2014,77:50-57. doi: 10.1016/j.addr.2014.05.016 [16] 陈冰, 杨婉花. 群体药代动力学在万古霉素治疗药物监测的应用[J]. 中国临床药理学杂志, 2011, 27(9):713-717. doi: 10.3969/j.issn.1001-6821.2011.09.018 [17] LIN WU F L, LIU S S, YANG T Y, et al. A larger dose of vancomycin is required in adult neurosurgical intensive care unit patients due to augmented clearance[J]. Ther Drug Monit,2015,37(5):609-618. doi: 10.1097/FTD.0000000000000187 [18] KIM A J, LEE J Y, CHOI S A, et al. Comparison of the pharmacokinetics of vancomycin in neurosurgical and non-neurosurgical patients[J]. Int J Antimicrob Agents,2016,48(4):381-387. doi: 10.1016/j.ijantimicag.2016.06.022 [19] 李青栋, 万献尧, 李缺缺, 等. 重症监护病房内急性肾损伤患者胱抑素C与肌酐估算肾小球滤过率的动态对比研究[J]. 中华全科医师杂志, 2014, 13(3):228-230. doi: 10.3760/cma.j.issn.1671-7368.2014.03.025 [20] 尹燕燕, 朱婧, 姜利. ICU患者万古霉素血药浓度不达标的相关因素分析[J]. 中国医药导报, 2018, 15(21):110-113. [21] 周庆涛, 贺蓓, 沈宁, 等. 肾清除率对老年重症肺炎患者体内万古霉素谷浓度的影响[J]. 中华结核和呼吸杂志, 2016, 39(2):105-109. doi: 10.3760/cma.j.issn.1001-0939.2016.02.006 [22] 程丽静, 赵冠人, 冯端浩. CMIA法与FPIA法检测环孢素A血药浓度的比较研究[J]. 中国药房, 2013, 24(42):3971-3973. [23] CHEN C Y, LI M Y, MA L Y, et al. Precision and accuracy of commercial assays for vancomycin therapeutic drug monitoring: evaluation based on external quality assessment scheme[J]. J Antimicrob Chemother,2020,75(8):2110-2119. -





 下载:
下载:
 下载:
下载: