-
红景天为景天科大花红景天[Rhodiola crenulata(Hook.f.et Thoms.)H. Ohba]的干燥根和根茎[1],是一种多年生草本或亚灌木植物。大部分生长于海拔3 500~5 000 m的石灰岩、花岗岩地冰川、山梁草地或山谷岩石上,享有“高原人参”、“雪山仙草”之美称,被当代医学界誉为“东方神草”,被全球医药界喻为“黄金植物”[2],己被前苏联科学家确定为植物适应原[3]。目前的研究表明,红景天具有抗应激、抗疲劳、抗氧化、抗癌、抗抑郁、保护肝肾、增强机体免疫力和神经保护等作用[4-7]。
目前,国内外对红景天多集中于其药效研究,体内药物含量测定和生物利用度研究又多以大鼠为研究对象。在以往研究的大鼠试验中,不同给药途径和不同剂量下,红景天苷绝对生物利用度(Fabs)结果为32.1%~98%[8-11],范围之大可能和红景天苷在体内的主动转运有关。而主要参与分子主动转运的钠依赖性葡萄糖转运体介导(SGLT1)在肠黏膜中所占的比例极其有限。在有限的肠道转运介导下,剂量不同可能会导致生物利用度研究结果不同。当口服红景天苷剂量大于24 mg/kg时,大鼠肠道出现了饱和吸收过程,且证明此饱和过程与SGLT1相关[12]。由于肠道中SGLT1占比有限,若给药剂量过高,可能会导致药物肠道重吸收较差,进而体现为生物利用度降低。因此,为了更加科学地考察体内生物利用度,合适剂量的选择尤为重要。
关于测定比格犬体内红景天苷含量的分析方法研究报道较少。Mao等[8]建立了测定犬血浆中红景天苷含量的HPLC法,线性范围为0.83~520 μg/ml(r=0.992 6),最低定量下限为0.83 μg/ml。因定量限较高,不足以满足其体内药动学分析。陈帅等[13]应用UHPLC-MS/MS法,采用柱前衍生化的样品处理同时测定了比格犬血浆中的红景天苷和酪醇含量。其中,红景天苷的定量下限为0.02 μmol/L,质量浓度相当于6.01 ng/ml。该方法的样品处理方式为先用乙腈蛋白沉淀法去除基质中的蛋白组分,上清溶液经碱化后孵育进行衍生化,最后用甲基叔丁基醚进行液液萃取,氮气吹干复溶后进样。虽检测限满足体内药动学分析,在批量处理样品时条件苛刻且步骤复杂。且以上研究均未对红景天苷在比格犬体内绝对生物利用度进行评估。
本实验旨在建立准确、快速、灵敏的LC-MS/MS法测定比格犬血浆中红景天苷含量,并对其绝对生物利用度进行研究。血浆样品预处理采用蛋白沉淀,并将验证后的方法应用于临床前药动学研究,包括生物利用度研究,为支持临床药动学试验设计提供依据。
-
Triple quad 5500型三重四极杆串联质谱仪,配备电喷雾电离源(加拿大AB Sciex公司);岛津液相色谱系统(包括DGU-20A3R型脱气机、LC-30AD型二元液相泵、SIL-30AC型自动进样器和CTO-20A型柱温箱,日本岛津公司)。Elma sonic P 300H超声波清洗器(德国埃尔玛公司);XPR6UD5和XPE205型电子分析天平(瑞士梅特勒公司)。
红景天苷(海军军医大学药学院药物分析教研室,含量99.0%,批号:20180901);天麻素(内标,上海同田生物技术有限公司,含量:98.9% 批号:4031921)。甲醇、乙腈、甲酸(均为色谱纯,Sigma-Aldrich公司);超纯水(自制,Millipore纯水仪)。
-
Symmetry RP18色谱柱(Waters公司,100 mm×4.6 mm, 3.5 μm);柱温:40 ℃;流动相:0.1%甲酸溶液,流动相B:含0.1%甲酸和20%乙腈的甲醇溶液;等度洗脱比例为35%流动相B;流速0.4 ml/min,进样量:2 μl。
-
离子源为电喷雾电离源;负离子方式检测;源喷射电压为−4500 V;去溶剂温度为550 ℃;雾化器压力(GS1): 75 psi;辅助气压力(GS2): 60 psi;气帘气体压力为35 psi;入口电压(EP): −10 V;碰撞室出口电压(CXP): −14 V;扫描方式为多反应监测,扫描时间为100 ms。雾化气、气帘气、碰撞气由氮气发生器产生;采用多反应监测(MRM)模式,离子监测通道为:m/z 299.1→118.9(红景天苷),m/z 285.1→122.9(天麻素)。红景天苷和天麻素去簇电压分别为−70和−40 eV,碰撞能量分别为−19和−17 eV。
-
分别精密称取红景天苷对照品2份,用40%乙腈水溶液溶解并定容,获得质量浓度均为0.2 mg/ml的红景天苷储备液2份,分别用于配制标准系列样品和质控样品工作液。按照一定的比例混合,用40%乙腈水溶液稀释,获得红景天苷浓度为:0.2、0.4、2、8、32、80、180 μg/ml的标准系列样品工作液和浓度为0.2、0.6、10、160 μg/ml的质控样品工作液。于4 ℃保存,备用。
-
精密称取天麻素对照品一份,用40%乙腈水溶液溶解并定容,获得质量浓度为0.1 mg/ml的天麻素储备液一份。以40%乙腈水溶液稀释内标储备液获得4 000 ng/ml的内标工作溶液,于4 ℃保存,备用。
-
取标准系列溶液或储备液50 μl至1.5 ml EP管中,加入比格犬空白血浆950 μl,涡旋10 s,获得红景天苷浓度为10、20、100、400、1 600、4 000、9 000、10 000 ng/ml的标准系列样品以及浓度为10、30、500和8 000 ng/ml质控样品。标准系列样品每日新鲜配制,质控样品于−20或−70 ℃保存,备用。
-
精密吸取血浆50 μl,置于Axygen 96孔深孔板中,加入内标50 μl,涡旋1 min,加入450 μl甲醇,涡旋3 min,3000 r/min离心10 min,取出上清液300 μl,氮气吹干,加入10%乙腈200 μl,涡旋3 min后,取2 μl进行LC-MS/MS分析。
-
动物实验部分在上海新冈实验动物场完成。比格犬,体重6~8 kg,雌雄各半;年龄24~30周,给药前禁食12 h,自由饮水,给药后4 h统一进食。
比格犬口服组(n=6,雌雄各半)给予红景天苷原料药15 mg/kg,分别于给药前0.5 h内和给药后即刻、15、30、45 min及1、1.5、2、3、4、5、6、8、10、16、24 h经前肢静脉取血1 ml置于肝素钠抗凝试管中,离心10 min (3 000 r/min,4 ℃)分离血浆,−70 ℃保存待测。
比格犬静脉注射组(n=6,雌雄各半)给予红景天苷原料药1.5 mg/kg,分别于给药前0.5 h内和给药后即刻、2、5、10、20、30、45 min及1、1.5、2、3、4、6、8、12 h经前肢静脉取血1 ml置于肝素钠抗凝试管中,离心10 min(3000 r/min, 4 ℃)分离血浆,−70 ℃保存待测。
-
将所建立并经过验证的方法应用于红景天苷动物药动学研究。所得的血浆浓度-时间数据采用Phoenix WinNonlin 8.1 (美国Pharsight公司)软件,以非房室模型计算药动学参数。绝对生物利用度(Fabs)计算方法见公式(1):
$$ {F_{{\rm{abs }}}}(\text{%} ) = \frac{{{\rm{AU}}{{\rm{C}}_{0 - \infty ({\rm{ po) }}}} \times {\rm{ Dos}}{{\rm{e}}_{{\rm{iv }}}}}}{{{\rm{ AU}}{{\rm{C}}_{0 - \infty ({\rm{ iv }})}} \times {\rm{ Dos}}{{\rm{e}}_{{\rm{po }}}}}} \times 100\;\text{%} $$ (1) 式中:AUC0−∞ (po)为口服给药后AUC0−∞统计值;AUC0−∞ (iv)为静脉注射后AUC0−∞统计值;Dosepo为口服剂量;Doseiv为静脉注射剂量。
-
分别取6个不同来源的比格犬空白血浆样品以及用相应比格犬空白血浆配制的定量下限(LLOQ)样品进行LC-MS/MS分析测定,考察不同来源空白血浆中的内源性物质是否干扰待测物及内标的测定。
结果表明,比格犬空白血浆中的内源性物质不干扰红景天苷的测定,同时内标不干扰待测物的测定,待测物对内标也无影响。
-
在选定的条件下,红景天苷和内标峰形良好,红景天苷的保留时间约为1.6 min,内标的保留时间约为1.2 min,内源性杂质不干扰测定。空白血浆、红景天苷及内标、红景天苷及内标加入空白血浆中的色谱图、比格犬口服1.5 h样品中红景天苷及内标色谱图见图1。
-
取“1.4”项下制备的标准含药血浆样品50 μl,按照“1.5”项下血浆样品前处理方法操作,以每个待测物浓度为横坐标,待测物与内标物的峰面积比值为纵坐标,采用加权(W= 1/X2)最小二乘法进行回归运算,求得的直线回归方程即为标准曲线,相关系数r均>0.998 6。比格犬血浆样品中红景天苷浓度在10~1 0000 ng/ml与峰面积比线性良好,最低定量浓度为10 ng/ml。典型标准曲线方程为:Y = 0.003 48X+0.000 397(r=0.999 1)。
-
取比格犬LLOQ血浆样品(红景天苷质量浓度为10 ng/ml)进行6份样本分析,连续测定3 d并分别根据当日标准曲线求得每份样本的测得浓度。求得该质量浓度红景天苷的日内精密度分别为8.3%,日间精密度为7.3%,准确度(RE)为6.0%。实验结果表明,LC-MS/MS法测定比格犬血浆中红景天苷的定量下限为10 ng/ml。
-
取比格犬低、中、高3个浓度质控样品,按照“1.5”项下操作,每个浓度进行6样本分析并在连续3 d内测试,分别根据当日标准曲线计算每份样本的测得浓度并根据QC样品结果计算本方法日内、日间精密度和准确度。
红景天苷质控(QC)样品的精密度与准确度结果见表1。待测物低、中、高质控样品的日内和日间精密度和准确度均符合生物样品测定相关要求。待测物低、中、高质控样品的日内和日间精密度和准确度均符合生物样品测定相关要求。
表 1 红景天苷精密度和准确度试验结果
浓度(ng/ml) 日内(n=6) 日间(n=18) 准确度(RE/%) 精密度(RSD/%) 准确度(RE/%) 精密度(RSD/%) 10 8.3 10.0 7.3 6.0 30 9.7 −2.0 6.0 −1.3 500 3.3 −3.0 3.4 −0.2 8 000 3.8 −3.5 2.7 −1.5 -
分别取6个不同来源比格犬空白血浆和一份空白溶血血浆50 μl,不加内标溶液(用50 μl 40%乙腈替代内标工作溶液),按照“1.5”项下操作,40 ℃氮气下吹干,加入200 μl由流动相配制的相对应的低、高浓度对照质控溶液和内标溶液,涡流后离心5 min,取2 μl进行LC-MS/MS分析,获得相应峰面积(A)。同时,另取去离子水50 μl代替比格犬空白血浆,按上述方法操作获得相应峰面积(B)。以每一浓度两种处理方法的峰面积比值计算基质效应,公式为A/B×100%,并以分析物和内标的基质效应比值计算内标归一化的常规基质效应和溶血血浆基质效应。
在比格犬常规血浆样品中,红景天苷低、高浓度经内标校正后的基质效应分别为96.3%和96.6%,相对标准差分别为8.4%和4.1%。溶血血浆样品中,低、高浓度经内标校正后的基质效应分别为99.4%和96.7%,相对标准差分别为5.0%和7.0%。
结果表明,待测物红景天苷在本试验选择的色谱和质谱条件下,可忽略基质效应的影响。
-
采用比格犬空白血浆配制的低、中、高3个浓度的血浆样品,按照“1.5”项下操作,每个浓度进行6样本分析。同时另取比格犬空白血浆50 μl,不加内标溶液(用50 μl 40%乙腈溶液替代内标工作溶液),其余按照“1.5”项下操作,于40 ℃氮气下吹干后,加入对应的低、中、高浓度对照质控溶液和内标溶液,涡流5 min,取2 μl进行分析,获得相应峰面积(n=3)。用提取后色谱峰面积与未经提取的色谱峰面积之比计算提取回收率。
比格犬血浆样品经蛋白沉淀处理后,红景天苷在低、中、高浓度的回收率分别为91.8%、94.3%和89.5%。
-
考察了红景天苷储备液和工作溶液室温6 h、比格犬血浆样品室温放置24 h、比格犬血浆样品−20 ℃/−70 ℃经历5次冷冻−解冻循环的稳定性以及比格犬血浆样品−20 ℃/−70 ℃经历22 d冷冻后的稳定性。全血样品室温/湿冰放置2 h、样品处理后自动进样器放置96 h。
结果表明,红景天苷储备液和工作溶液室温至少6 h、血浆样品中在室温放置24 h、−20 ℃/−70 ℃冻存22 d、在−20 ℃/−70 ℃存放条件下反复室温冻融5次,以及样品处理后,在自动进样器放置96 h,红景天苷能够保持良好的稳定性。自全血采集至分离待测血浆样本的室温/湿冰2 h内,红景天苷在全血中保持稳定。
-
本实验考察了血浆浓度超出定量上限的比格犬血浆样品,经空白比格犬血浆稀释后的准确度。取红景天苷的稀释质控样品(比格犬血浆样品红景天苷质量浓度为80 000 ng/ml),用空白比格犬血浆稀释20倍后,按“1.5”项下操作,进行6份样本分析。结果表明,比格犬血浆样品经空白比格犬血浆稀释20倍后测定不影响结果的准确度。
-
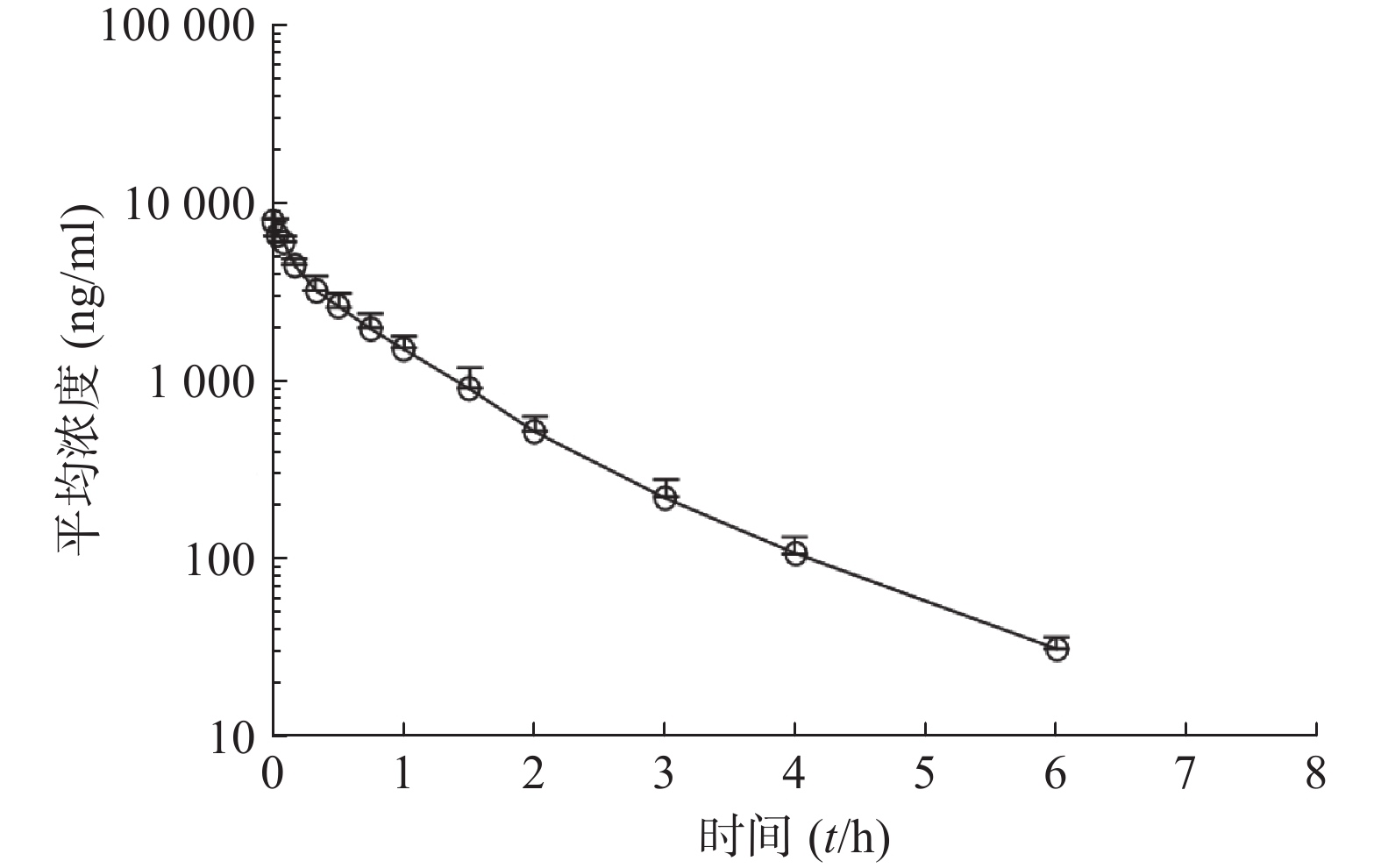
比格犬单剂量口服给药红景天苷15 mg/kg或静脉注射红景天苷1.5 mg/kg后,按“1.6”项下采集的各时间点血浆样品,并按照“1.5”项下操作,进行LC-MS/MS分析,测定红景天苷的比格犬血浆浓度。口服给药红景天苷15 mg/kg和静脉注射红景天苷1.5 mg/kg后的血药浓度-时间数据曲线分别见图2和图3。采用WinNonlin软件以非房室模型计算药动学参数(表2、表3)。
表 2 比格犬口服15 mg/kg红景天苷后血浆药动学参数(
$ \bar x $ ±s, n=6)参数 雄性犬 雌性犬 平均值 AUC0−t(ng·h/ml) 15 976±1 702 25 095±1 527 20 535±5 200 AUC0−∞(ng·h/ml) 16 005±1 703 25 211±1 692 20 608±5 266 MRT0−∞(t/h) 2.20±0.561 2.39±0.055 2.29±0.371 t1/2z(t/h) 1.02±0.108 1.61±0.845 1.31±0.628 CLz(L/h·kg) 0.945±0.105 0.597±0.039 0.771±0.203 Vz(L/kg) 1.39±0.232 1.35±0.613 1.37±0.415 cmax(ng/ml) 7 867±2 978 11 493±3 995 9 680±3 725 F(%) 34.2±4.9 55.2±7.4 43.9±11.2 表 3 比格犬静注1.5 mg/kg红景天苷后血浆药动学参数(
$ \bar x $ ±s, n=6)参数 雄性犬 雌性犬 平均值 AUC0-t(ng·h/ml) 4 735±1 050 4 557±415 4 646±721 AUC0-∞(ng·h/ml) 4 781±1 042 4 602±411 4 691±715 MRT0-∞(t/h) 1.010±0.064 1.030±0.048 1.020±0.052 t1/2z(t/h) 0.933±0.028 1.03±0.174 0.980±0.132 CLz(L/h·kg) 0.325±0.078 0.328±0.028 0.326±0.052 Vz(L/kg) 0.437±0.104 0.487±0.102 0.462±0.096 cmax(ng/ml) 9 000±1 526 9 620±2 037 9 310±1 645 本试验以比格犬单剂量静注给药红景天苷1.5 mg/kg后体内血药浓度-时间曲线下面积AUC0−∞为参比,计算比格犬单次口服给药红景天苷入血的绝对生物利用度。考虑到比格犬动物实验个体差异的特殊性,采用6条比格犬(雌雄各半)单剂量口服给药红景天苷15 mg/kg及6条比格犬(雌雄各半)单剂量静注给药红景天苷1.5 mg/kg后,血浆AUC0-∞的平均值进行比较,得到红景天苷在比格犬体内的绝对生物利用度为(43.9±11.2)%。
-
目前,对红景天苷的药动学研究多集中在小动物种属(大鼠、小鼠),仅有少量在比格犬上的研究,且绝对生物利用度未见文献报道。因此,本实验旨在建立一种快速、专属性强、灵敏度高的LC-MS/MS分析方法,并应用于比格犬体内红景天苷绝对生物利用度的考察。
在前期的方法考察中,血浆提取方法考察了蛋白沉淀法[沉淀试剂考察甲醇、乙腈、甲醇(含0.1%甲酸)和乙腈(含0.1%甲酸)]、液-液萃取法(萃取试剂考察乙酸乙酯、氯仿和异丙醇)。红景天苷在常规液液萃取溶剂中回收率较差。而蛋白沉淀法中基质效应较为明显,红景天苷及其内标天麻素在初始色谱条件下均表现出较强的基质抑制现象。
以往的研究中,并未见药典中针对生物分析方法验证所要求的特殊基质(溶血、高脂血等)基质效应的考察。因高脂血研究不适用于比格犬试验,固本次仅新增对溶血血浆中基质效应的考察。且前期发现在LC-MS/MS检测红景天苷浓度时,溶血血浆在提取后严重抑制了红景天苷的响应,使其无法准确定量。本实验最终采用甲醇作为沉淀试剂,蛋白沉淀后吹干的方式,对提取物进行浓缩,并使用10%乙腈溶液复溶,减少了进样过程中的溶剂效应,从而进一步改善了峰型。同时,通过对色谱柱的筛选和流动相成分的优化,使得原始方法中血浆的内源性共流出组分和待测物及内标在不同时间出峰,很大程度上避免了干扰现象,并显著改善了基质效应。
另外,结合以往对大鼠试验中对红景天苷生物利用度差异和剂量关系的研究,说明本试验在合理的给药剂量下,所呈现的生物利用度数值有着很高的可靠度和参考价值。在较低的给药剂量下,所建立的LC-MS/MS方法,定量范围为10~10 000 ng/ml,能充分满足本实验研究的需要。且此方法的专属性、准确度、精密度、基质效应、稳定性等均符合方法学要求,方法可靠,能够准确测定比格犬血浆中红景天苷的浓度,评价其在比格犬体内的药动学行为。
本研究填补了红景天苷在比格犬体内的绝对生物利用度研究的空白,为以后临床试验中推测人体内暴露量,考察生物利用度提供了参考数据,同时为临床选择给药途径提供了依据。
Absolute bioavailability of salidroside in Beagle dog
-
摘要:
目的 建立比格犬血浆中的红景天苷的HPLC-MS/MS测定方法,研究红景天苷在比格犬体内的绝对生物利用度。 方法 以天麻素为内标,血浆样品经蛋白沉淀后,经Symmetry RP18 (100 mm×4.6 mm, 3.5 μm)柱分离,使用体积分数0.1%甲酸溶液(A)-含0.1%甲酸和20%乙腈的甲醇溶液(B)作为流动相,进行等度洗脱(35% B),流速为0.4 ml/min,柱温40 ℃,进样量2 μl;通过电喷雾电离源(ESI),以多反应监测(MRM)模式进行负离子检测,红景天苷、天麻素的MRM离子对分别为m/z 299.1→118.9、m/z 285.1→122.9。比格犬分别以口服和静注两种给药方式给予红景天苷原料药,在不同时间点取血,样品采用HPLC-MS/MS法测定,研究红景天苷的药动学及绝对生物利用度。 结果 红景天苷的质量浓度在10~10 000 ng/ml内线性关系良好(r>0.998 6),最低定量浓度为10.0 ng/ml。方法回收率为89.5%~91.8%,日内精密度(RSD)<9.7%,日间精密度(RSD)<7.3%。单剂量口服15 mg/kg或静注1.5 mg/kg红景天苷原料药后,cmax分别为(9 680±3 725)和(9 310±1 645)ng/ml;tmax分别为(1.25±0.67)和(0.011±0.017)h,AUC0−t分别为(20 535.4±5 200.0)和(4 646.7±720.5)ng·h/ml,AUC0-∞分别为(20 607.9±5 266.2)和(4 691.6±715.2)ng·h/ml;t1/2分别为(1.31± 0.63)和(0.98 ± 0.13)h。 结论 该方法简便快速、灵敏可靠,可用于红景天苷体内过程研究。红景天苷在比格犬体内的绝对生物利用度为(43.9±11.2)%。 Abstract:Objective To develop a HPLC-MS/MS method for the absolute bioavailability study of salidroside in Beagle dogs. Methods Gastrodin was used as internal standard. Plasma samples were treated by protein precipitation and separated by Symmetry RP18 column (100 mm×4.6 mm, 3.5 μm). 0.1% formic acid in water(A) and 0.1% formic acid in acetonitrile: methanol (20 : 80, V/V) (B) were used as the mobile phase for isocratic elution with 35% mobile phase B. The flow rate was 0.4 ml/min. Column temperature was 40 ℃. Injection volume was 2 μl. By electrospray ionization source (ESI) and multi-reaction monitoring (MRM) mode, the MRM ion pairs of salidroside and gastrodin were identified as m/z 299.1→118.9 and m/z 285.1→122.9, separately. Blood samples were collected at different time points after oral or intravenous administration of salidroside. The harvested plasma samples were analyzed by HPLC-MS/MS method to assess the pharmacokinetics and absolute bioavailability of salidroside. Results Excellent linearity(r>0.998 6) was found in the concentration range of 10−10 000 ng/ml for salidroside and the lowest quantitative concentration was 10 ng/ml. The recovery was 89.5%−91.8%. The intra-day precision (RSD) was less than 9.7%, and the inter-day precision (RSD) was less than 7.3%. After a single oral dose of 15 mg/kg or an intravenous injection of 1.5 mg/kg of salidroside, cmax was (9 680±3725) and (9 310±1 645) ng/ml; tmax was (1.25±0.67) and (0.011±0.017) h, AUC0−t was (20 535.4±5 200.0) and (4 646.7±720.5) ng·h/ml, AUC0−∞ was (20 607.9±5 266.2) and (4 691.6±715.2) ng·h/ml; t1/2 was (1.31±0.63) and (0.98±0.13) h, respectively. Conclusion The LC-MS/MS method established in this study was simple, rapid, sensitive and reliable. It meets the regulatory requirements of biological analysis for pharmacokinetic properties of salidroside in Beagle dogs. The absolute bioavailability of salidroside in Beagle dogs is (43.9±11.2)%. -
Key words:
- salidroside /
- HPLC-MS/MS /
- pharmacokinetics /
- absolute bioavailability
-
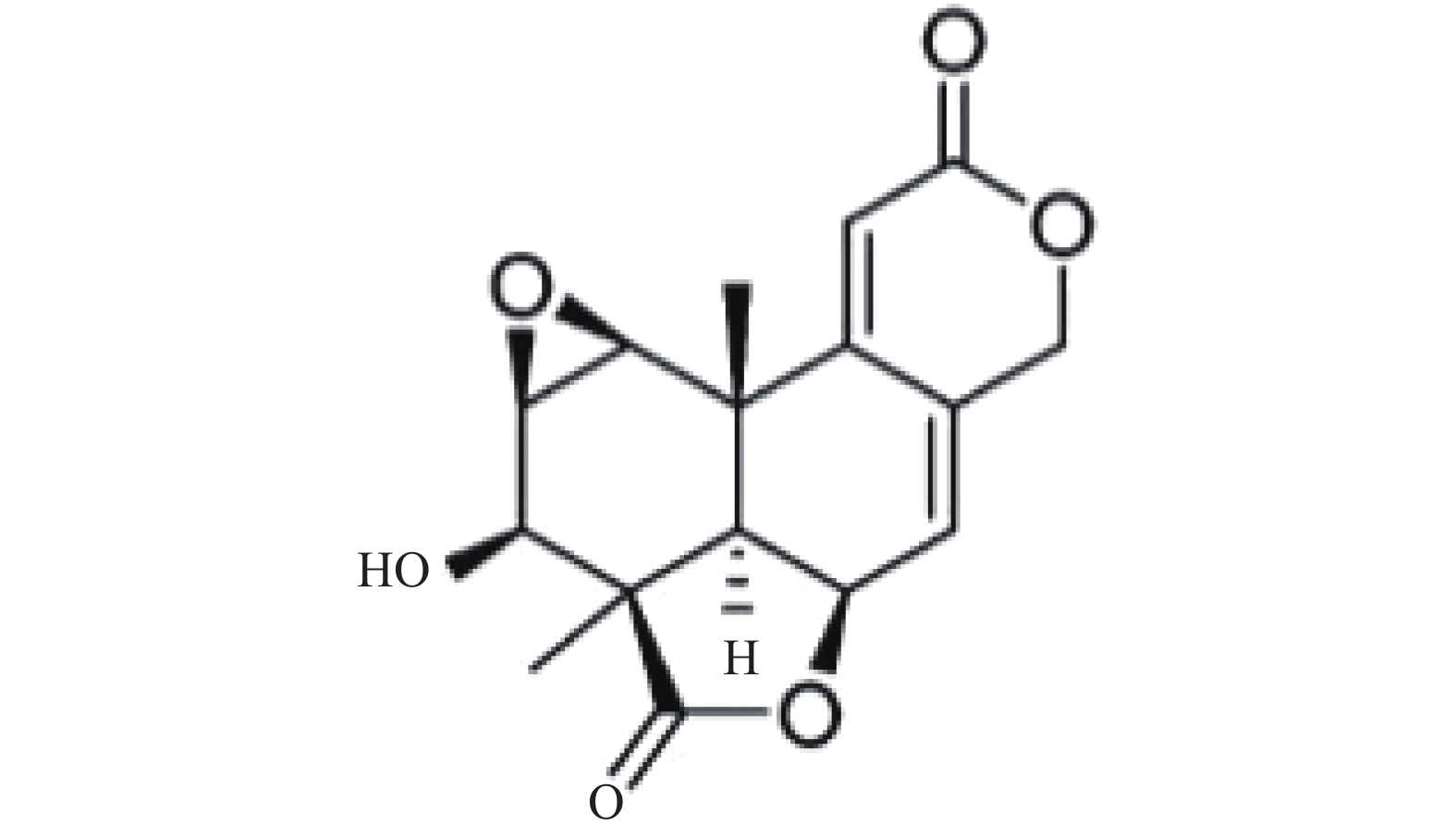
Wentilactone A(WA)是从海洋微生物中分离得到的去甲二萜类小分子化合物,对小细胞肺癌细胞系NCI-H460和NCI-H446细胞的增殖具有抑制作用,可诱导小细胞肺癌细胞系NCI-H446和NCT-H1688细胞凋亡[1]。对小细胞肺癌细胞系NCT-H1688细胞的细胞迁移和集落形成具有抑制作用[2]。WA作为一种有效抗肿瘤候选物,已从制备工艺、理化性质、急性毒性、生殖毒性等方面证明其良好的成药性[3]。遗传毒性安全性实验更是对其临床前研究全面性的补充,为提高临床用药的安全性,为了验证其是否具有遗传毒性,本实验应用微生物回复突变试验(Ames试验)、体外培养CHO细胞染色体畸变试验和小鼠骨髓微核试验方法对WA的遗传毒性进行了系统的研究,为WA的临床前毒性评价提供资料[4]。
1. 材料与方法
1.1 材料
1.1.1 化合物WA
Ames试验用WA(含量:99.9%,批号:20121115,黄色粉末)、体外培养CHO细胞染色体畸变试验用(规格:10 ml,含量:50.8 mg/ml,批号:20130506,黄色澄明溶液)、小鼠骨髓微核试验用WA(规格:10 ml/支:100mg,含量:10.2 mg/ml,批号:20130407,黄色澄明溶液),均由海军军医大学基础医学院生物化学与分子生物学教研室提供。WA的化学结构见图1。
1.1.2 菌株
组氨酸缺陷型鼠伤寒沙门菌(S. typhimurium)TA97、TA98、TA100、TA102和TA1535共5支菌株,复旦大学公共卫生学院环境卫生教研室赠予。实验前对其进行鉴定(R因子和自发回变数鉴定),均符合规定标准。
1.1.3 细胞
中国仓鼠卵巢(CHO)细胞由复旦大学公共卫生学院毒理教研室赠予。
1.1.4 动物
ICR小鼠(SPF级)共60只,每组10只,雌雄各半,5~6周龄,购入时体重16.5~20.8 g,由上海西普尔-必凯实验动物有限公司提供,动物质量合格证号:2008001629237。自购入起3天进行检疫,给药时体重20.3~23.6 g。
1.2 试验方法
按《新药(西药)临床前研究指导原则汇编》[5-6]的设计要求,分别应用Ames试验[7]、体外培养CHO细胞染色体畸变试验[8]和小鼠骨髓微核试验[9]检测WA的遗传毒性。检测终点覆盖了基因突变、染色体畸变和细胞有丝分裂异常。
1.3 实验步骤
1.3.1 Ames实验
根据《药物遗传毒性研究技术指导原则》的要求,应用S. typhimurium TA97、TA98、TA100、TA102和TA1535共5支菌株,设每皿5 000、500、50、5、0.5 μg 5个剂量组。此外,设空白对照、溶剂对照和阳性对照组(具体剂量见表1)。采用标准平板掺入法,使细菌在加和不加代谢活化系统S9的条件下接触受试物,每皿均加入供试品或溶剂对照DMSO 0.1 ml,每个剂量组及对照组均设3个平行皿。并用最低极限的琼脂培养基培养48 h后,先用显微镜观察平皿上的菌苔生长情况,确定受试物无明显的抑菌或杀菌作用,再人工计数每皿回复突变的菌落数,记录原始数据,并计算每组的均值和标准差,与溶剂对照组进行比较,重复实验一次。
表 1 阳性对照品名称及浓度组别 菌株 阳性对照品 溶液终浓度(μg/皿) 加入量(μl/皿) 浓度(μg/ml) -S9组 TA97 敌克松 50 100 500 TA98 敌克松 50 100 500 TA100 甲基磺酸甲酯 1 100 10 TA102 甲基磺酸甲酯 1 100 10 TA1535 4-硝基喹啉-N-氧化物 0.5 100 5 +S9组 TA97 2-氨基芴 10 100 100 TA98 2-氨基芴 10 100 100 TA100 2-氨基芴 10 100 100 TA102 1,8-二羟基蒽醌 50 100 500 TA1535 环磷酰胺 50 100 500 1.3.2 染色体畸变试验
在加和不加代谢活化系统S9的条件下,体外培养的CHO细胞中加入相应浓度的供试品或对照品,反应体系总体积为10 ml。低、中、高剂量组供试品终浓度分别为23.74、47.48和94.96 μg/ml,阳性对照组丝裂霉素C和环磷酰胺的终浓度分别为0.5 μg/ml、60 μg/ml,另设溶剂对照组分别作用于细胞4 h后换液继续培养至24 h,和药物作用细胞24 h后收集细胞。收获细胞前4 h,加入终浓度0.2 μg/ml秋水仙素,培养结束收集细胞,经离心、低渗处理、固定、离心、制片和Giemsa染色,每个剂量组制备2~3张玻片标本。
镜检时每组观察200个染色体中分散良好、数目完整的中期分裂相细胞(若观察到大量染色体畸变细胞,如阳性对照组,分析细胞数可相应减少为至少100个细胞)。计数染色体或染色单体的断裂、缺失及其他类型结构异常的数目(裂隙和核内复制一般不作为畸变类型),记录原始数据计算畸变率。
1.3.3 小鼠骨髓微核实验
检疫期结束后分别按低、中、高组小鼠给药,分别予100、200、400 mg/kg剂量给药,其中高剂量组设两组分别在药物作用24 h和48 h后处死,并设阳性对照组和溶剂对照组。分别在药物作用24 h和48 h后处死小鼠,取股骨骨髓制成骨髓涂片,每只动物制2张涂片,经甲醇固定后用pH6.8的Giemsa染液染色。
每只动物镜检约2000个骨髓嗜多染红细胞(PCE),计数含微核的PCE数(MNPCE),计算微核发生率,同时记录200个PCE计数过程中观察到的正染红细胞(NCE)的数目,并计算PCE/NCE值。
1.4 剂量设计
对于易溶无毒的化合物,细菌实验最高浓度应达到5 mg/皿[10]。Ames试验设每皿5 000、500、50、5、0.5 μg 5个剂量组,每皿均加入相应浓度的供试品溶液0.1 ml,另设空白对照、溶剂对照和阳性对照。在哺乳动物细胞体外遗传实验中,毒性水平应高于50%细胞抑制率或细胞融合率[11]。通过预实验确定供试品的IC50为94.96 μg/ml。染色体畸变试验的低、中、高剂量组为23.74、47.48和94.96 μg/ml,试验时在10 ml的试验体系中分别加入0.1 ml各剂量组的应用液,另设阳性对照组和溶剂对照。ICR小鼠的微核试验采用小鼠经尾静脉注射给药,总剂量分别为100、200、400 mg/kg(单次给药剂量分别为50、100、200 mg/kg,分上、下午两次经尾静脉注射给药),给药容积为20 ml/kg体重;同时设阳性对照组和溶剂对照组。阳性对照组以40 mg/kg体重的剂量腹腔注射环磷酰胺,给药容量为10 ml/kg体重;溶剂对照组给药方式与受试物组相同,以20 ml/kg体重的容积经尾静脉注射生理盐水。
1.5 统计方法
Ames试验结果的评价是以溶剂对照组的回复突变菌落数为基础,与受试物各剂量组相比较。若某剂量组回复突变菌落数为溶剂对照组的2倍以上,呈现可重复性,并在一定的剂量范围内存在着剂量-反应关系,则判断为阳性[12]。染色体畸变试验和小鼠骨髓微核试验均采用卡方检验或方差分析方法研究给药组与对照组之间是否具有统计学意义[13]。
2. 结果与分析
2.1 Ames试验结果
受试物各剂量组和对照组的平皿均可见背景菌苔生长。5支菌株的自发回复突变菌落数以及阳性对照品诱发的回复突变菌落数均在历史参考范围内,并且各菌株阳性对照组的回复突变菌落与空白对照组相比数目显著增加,提示本试验系统符合要求。在最高剂量已达到5 000 μg/皿的受试条件下,未观察到受试物的抑菌现象。各剂量组受试物在加或不加S9时对TA97、TA98、TA100、TA102和TA1535所诱发的回复突变菌落数均与自发的突变菌落数相近,未观察到明显的剂量-反应关系。结果见表2和表3。
表 2 WA对5支菌株的回变菌落数试验结果(个/皿,${\rm{\bar x}}$ ±s)(第1次)组别(μg/皿) TA97 TA98 TA100 TA102 TA1535 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 5 000 36±5 40±4 21±3 21±2 131±26 93±17 177±21 185±25 25±3 14±2 500 36±5 39±8 17±4 20±3 114±22 90±23 195±8 207±7 23±1 19±1 50 39±10 35±5 21±7 21±3 115±21 97±8 196±33 179±18 19±8 16±4 5 41±6 40±3 21±5 22±4 114±15 87±19 195±21 193±8 19±2 14±1 0.5 37±6 39±3 20±3 19±3 128±15 91±12 201±14 205±14 20±6 16±4 空白对照组 40±7 36±5 17±2 19±4 99±17 89±9 213±30 197±34 21±7 19±4 溶剂对照组 40±6 34±1 22±5 26±2 95±8 89±9 193±8 199±29 23±3 14±1 阳性对照组 839±24 841±47 936±56 1 077±55 968±27 1 111±66 1 101±17 1 024±53 342±44 345±13 表 3 WA对5支菌株的回变菌落数试验结果(个/皿,${\rm{\bar x}}$ ±s)(第2次)组别(μg/皿) TA97 TA98 TA100 TA102 TA1535 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 5 000 38±5 34±5 20±5 21±5 128±24 105±26 179±21 189±19 20±4 20±3 500 39±7 34±3 21±2 20±7 108±13 92±28 192±16 187±30 16±3 19±4 50 38±9 30±3 19±3 18±1 117±14 102±5 197±5 196±22 17±3 18±1 5 37±8 29±4 18±2 17±1 111±5 98±33 206±24 191±21 16±1 20±2 0.5 35±6 33±8 24±2 23±3 107±7 97±8 203±6 193±10 15±4 15±4 空白对照组 38±3 41±4 22±3 23±4 96±12 93±8 205±17 186±19 18±2 18±4 溶剂对照组 38±3 37±8 22±3 23±4 98±7 100±12 202±15 197±10 18±2 19±4 阳性对照组 881±18 876±35 900±11 1 077±111 964±113 996±8 1 024±37 1 011±8 392±8 392±22 2.2 染色体畸变试验结果
染色体分析结果显示,阳性对照组能够诱发受试细胞染色体的畸变率明显增高,24 h在+ S9和-S9的情况下染色体畸变率分别为11%和11%,与溶剂对照组相比,均有统计学差异(P<0.05);23.74、47.48和94.96 μg/ml受试物在24 h、+S9条件下染色体畸变率分别为1%、1%和0.5%,24 h、-S9条件下染色体畸变率分别为0%、0.5%和0%;4 h、-S9条件下染色体畸变率分别为0%、0%和0%。综上,受试物各剂量组细胞染色体畸变率均小于5%,与溶剂对照组结果相比,其差异均无统计学意义(P>0.05)。结果见表4~6。
表 4 WA对24 h体外培养CHO细胞的染色体畸变试验结果(+S9)组别 观察细胞数
(个)各类染色体畸变数 畸变细胞数
(个)畸变率
(%)断裂 断片 双着丝粒 三辐体 四辐体 碎片或微小体 环状 多倍体 23.74 μg/ml 200 1 1 0 0 0 0 0 1 2 1 47.48 μg/ml 200 2 2 0 0 0 0 0 0 2 1 94.96 μg/ml 200 0 0 0 0 0 0 0 0 1 0.5 溶剂对照组 200 200 0 0 0 0 0 3 3 3 1.5 阳性对照组 100 9 0 0 1 3 3 0 0 14 14 注:阳性对照组:+S9、环磷酰胺(60 mg/ml);溶剂对照组:DMSO;* P<0.05,与溶剂对照组比较。 表 5 WA对24 h体外培养CHO细胞的染色体畸变试验结果(-S9)组别 观察细胞数
(个)各类染色体畸变数 畸变细胞数
(个)畸变率
(%)断裂 断片 双着丝粒 三辐体 四辐体 碎片或微小体 环状 多倍体 23.74 μg/ml 200 0 0 0 0 0 0 0 0 0 0 47.48 μg/ml 200 1 0 0 0 0 0 0 0 1 0.5 94.96 μg/ml 200 0 0 0 0 0 0 0 0 0 0 溶剂对照组 200 0 0 0 0 0 0 0 0 0 0 阳性对照组 100 4 4 0 0 0 0 4 0 12 12* 注:阳性对照组:-S9、丝裂霉素C(0.5 mg/ml);溶剂对照组:DMSO;*P<0.05,与溶剂对照组比较。 表 6 WA对4 h体外培养CHO细胞的染色体畸变试验结果(-S9/4 h)组别 观察细胞数
(个)各类染色体畸变数 畸变细胞数
(个)畸变率
(%)断裂 断片 双着丝粒 三辐体 四辐体 碎片或微小体 环状 多倍体 23.74 μg/ml 200 0 0 0 0 0 0 0 0 0 0 47.48 μg/ml 200 0 0 0 0 0 0 0 0 0 0 94.96 μg/ml 200 0 0 0 0 0 0 0 0 0 0 溶剂对照组 200 阳性对照组 * P<0.05,与溶剂对照组比较。 2.3 小鼠骨髓微核试验的结果
试验结果经统计学分析表明,WA在100、200、400 mg/kg剂量下未观察到对小鼠骨髓的抑制作用,溶媒对照组和阳性对照组雌、雄性小鼠骨髓PCE微核发生率分别为2.10‰和21.36‰、1.90‰和20.88‰,两组相比差异均有统计学意义(P<0.05),验证了本次试验系统的有效性。WA 100和2 000 mg/kg剂量24 h采样组雌、雄小鼠骨髓PCE微核率分别为1.60‰和1.80‰、1.90‰和1.60‰;400 mg/kg剂量24 h和48 h采样组雌、雄小鼠骨髓PCE微核率分别为2.10‰和2.80‰、2.40‰和1.29‰,与溶媒对照组相比均无显著差异(P>0.05)。结果见表7。
表 7 WA对小鼠骨髓嗜多染红细胞的微核效应试验结果组别 性别 动物数(只) 观察PCE数(个) PCE/NCE(${\rm{\bar x}}$±s) 微核率(${\rm{\bar x}}$±s, ‰) 100 mg/kg 雌 5 10 020 2.40±0.89 1.60±0.96 200 mg/kg 雌 5 10 010 1.63±0.40 1.80±1.31 400 mg/kg (24 h采样) 雌 5 10 016 1.95±0.40 2.10±1.20 400 mg/kg (48 h采样) 雌 5 10 009 1.58±0.44 2.80±1.81 溶媒对照组 雌 5 10 009 2.37±0.69 2.10±1.20 阳性对照组 雌 5 9 095 2.18±0.30 21.36±7.84* 100 mg/kg 雄 5 10 016 1.56±0.30 1.90±1.28 200 mg/kg 雄 5 10 009 1.52±0.28 1.60±0.70 400 mg/kg (24 h采样) 雄 5 10 006 1.40±0.73 2.40±2.01 400 mg/kg (48 h采样) 雄 5 8 802 1.43±0.63 1.29±1.26 溶媒对照组 雄 5 9 029 2.13±0.58 1.90±1.45 阳性对照组 雄 5 10 011 1.62±0.42 20.88±4.94* *P<0.05,与溶剂对照组比较。 3. 讨论
沙门菌回复突变试验(Ames试验)被研究者广为采用,该法的特点是快速、简便、敏感、经济,是经典的测试化学物质或药物致突变性实验[10]。染色体畸变分析是采用中国仓鼠卵巢(CHO)细胞体外培养的方法进行的。CHO细胞在加或不加代谢活化系统的条件下,与受试物接触一定时间后再于收集染色体4 h前用秋水仙碱处理,使细胞的有丝分裂停止在中期相。然后收集细胞,经低渗、固定、涂片和染色后,在显微镜下观察染色体数量和结构的改变,检测受试物的诱变性[7]。微核试验是检测化合物对染色体损伤作用的重要方法。凡能使染色体发生断裂或使染色体和纺锤体联结损伤的化合物,微核试验都可检测[8]。
本研究采用遗传毒性研究经典组合的方法,分别从原核系统到真核系统,从体外试验系统到体内试验系统,体外试验中包含了加与不加代谢活化系统,能检测基因突变、染色体畸变等多个遗传学终点,符合国际标准化的要求[5-6]。
本研究结果显示,本试验条件下,采用标准平板掺入法,WA在每皿5 000、500、50、5、0.5 μg的受试剂量下,加或不加S9时对组氨酸缺陷型鼠伤寒沙门菌均无致突变性;对CHO细胞,在23.74、47.48、94.96 μg/ml 3个剂量组,加或不加S9,于24 h和48 h诱发的细胞染色体畸变率均小于5%,与溶剂对照组结果相比较其差异均无统计学意义(P>0.05),表明WA在受试剂量下无致CHO细胞染色体畸变效应;WA在100、200、400 mg/kg 3个剂量下,对ICR小鼠的微核诱发率与溶剂对照组比较均无显著差异,表明其在受试剂量下对ICR小鼠无致微核效应[14]。上述结果提示WA没有遗传毒性和潜在致癌性。
此前有文献表明WA对小细胞肺癌的增殖有抑制作用,但对于遗传毒性未见报道。本研究对降低WA在研发过程中用于临床试验和疾病治疗的用药风险发挥重要作用。
-
表 1 红景天苷精密度和准确度试验结果
浓度(ng/ml) 日内(n=6) 日间(n=18) 准确度(RE/%) 精密度(RSD/%) 准确度(RE/%) 精密度(RSD/%) 10 8.3 10.0 7.3 6.0 30 9.7 −2.0 6.0 −1.3 500 3.3 −3.0 3.4 −0.2 8 000 3.8 −3.5 2.7 −1.5 表 2 比格犬口服15 mg/kg红景天苷后血浆药动学参数(
$ \bar x $ ±s, n=6)参数 雄性犬 雌性犬 平均值 AUC0−t(ng·h/ml) 15 976±1 702 25 095±1 527 20 535±5 200 AUC0−∞(ng·h/ml) 16 005±1 703 25 211±1 692 20 608±5 266 MRT0−∞(t/h) 2.20±0.561 2.39±0.055 2.29±0.371 t1/2z(t/h) 1.02±0.108 1.61±0.845 1.31±0.628 CLz(L/h·kg) 0.945±0.105 0.597±0.039 0.771±0.203 Vz(L/kg) 1.39±0.232 1.35±0.613 1.37±0.415 cmax(ng/ml) 7 867±2 978 11 493±3 995 9 680±3 725 F(%) 34.2±4.9 55.2±7.4 43.9±11.2 表 3 比格犬静注1.5 mg/kg红景天苷后血浆药动学参数(
$ \bar x $ ±s, n=6)参数 雄性犬 雌性犬 平均值 AUC0-t(ng·h/ml) 4 735±1 050 4 557±415 4 646±721 AUC0-∞(ng·h/ml) 4 781±1 042 4 602±411 4 691±715 MRT0-∞(t/h) 1.010±0.064 1.030±0.048 1.020±0.052 t1/2z(t/h) 0.933±0.028 1.03±0.174 0.980±0.132 CLz(L/h·kg) 0.325±0.078 0.328±0.028 0.326±0.052 Vz(L/kg) 0.437±0.104 0.487±0.102 0.462±0.096 cmax(ng/ml) 9 000±1 526 9 620±2 037 9 310±1 645 -
[1] 国家药典委员会. 中华人民共和国药典(一部)2015年版[S]. 北京: 中国医药科技出版社, 2015. [2] 许大艳. 红景天苷的合成研究[D]. 长春: 长春中医药大学, 2010. [3] KELLY G S. Rhodiola rosea: a possible plant adaptogen[J]. Altern Med Rev,2001,6(3):293-302. [4] 袁瑜, 张良, 李玉锋. 红景天活性成分及药理作用[J]. 食品与药品, 2007(5):54-57. doi: 10.3969/j.issn.1672-979X.2007.05.019 [5] 居瑞军, 李若婧, 周鹏, 等. 红景天苷注射剂的制备及其在大鼠体内药动学研究[J]. 中国药学杂志, 2012, 47(18):1497-1502. [6] NI J, LI Y M, LI W M, et al. Salidroside protects against foam cell formation and apoptosis, possibly via the MAPK and AKT signaling pathways[J]. Lipids Health Dis,2017,16(1):198. doi: 10.1186/s12944-017-0582-7 [7] FAN F F, YANG L, LI R, et al. Salidroside as a potential neuroprotective agent for ischemic stroke: a review of sources, pharmacokinetics, mechanism and safety[J]. Biomedecine Pharmacother,2020,129:110458. doi: 10.1016/j.biopha.2020.110458 [8] MAO Y, ZHANG X R, ZHANG X D, et al. Development of an HPLC method for the determination of salidroside in beagle dog plasma after administration of salidroside injection: application to a pharmacokinetics study[J]. J Sep Sci,2007,30(18):3218-3222. doi: 10.1002/jssc.200700273 [9] 郭娜. 红景天苷及其代谢产物酪醇在大鼠体内的药物代谢动力学研究[D]. 哈尔滨: 东北林业大学, 2012. [10] CHANG Y W, YAO H T, HSIEH S H, et al. Quantitative determination of salidroside in rat plasma by on-line solid-phase extraction integrated with high-performance liquid chromatography/electrospray ionization tandem mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2007,857(1):164-169. doi: 10.1016/j.jchromb.2007.06.029 [11] QI T, GE B K, ZHAO L, et al. Cytosolic β-glucosidase inhibition and renal blood flow suppression are leading causes for the enhanced systemic exposure of salidroside in hypoxic rats[J]. RSC Adv,2018(8):8469-8483. [12] 何聿娴, 刘晓东, 王新廷, 等. 钠依赖性葡萄糖转运体介导红景天苷在大鼠肠中吸收[J]. 中国天然药物, 2009, 7(6):444-448. [13] 陈帅, 夏媛媛, 魏广力, 等. 柱前衍生化结合UHPLC-MS/MS法同时测定Beagle犬血浆中的红景天苷和酪醇[J]. 药学学报, 2017(2):119-124. -





 下载:
下载:



 下载:
下载: