-
在全球范围内,乳腺癌是女性癌症死亡的主要原因,2018年约有210万女性疑似患有乳腺癌,占女性癌症的25%[1]。在我国,乳腺癌在女性肿瘤中发病率居首位,死亡率居第5位,近几十年来乳腺癌负担迅速增长[2]。目前,雌激素敏感的乳腺癌患者主要以内分泌治疗为主,然而,缺乏激素受体的乳腺癌细胞通常使用化疗药物,如紫杉醇和阿霉素[3]。但是,化疗药物对肿瘤细胞和正常细胞均表现出毒性反应,这限制了其临床应用。此外,细胞毒等抗肿瘤药物表现出的细胞耐药性进一步限制其应用。因此,迫切需要寻找毒性较小、效果较好的治疗药物。
五味子乙素(schisandrin B, Sch B)是从五味子中提取的主要活性成分[4]。据报道[5],Sch B可通过抑制NF-κB激活及MAPK/ Erk/p38/c-Jnk信号通路激活而有效减轻炎症反应,NASSER等[6]发现,Sch B可通过抑制PI3K/AKT和STA3/JAK2信号通路磷酸化,从而降低细胞内ROS的产生发挥抗前列腺癌作用,Wang等[7]发现,Sch B可通过TGF-b信号通路靶向miR-101-5p抑制大鼠肝纤维化。Dai等[8]发现,Sch B可通过STAT3的磷酸化和核转位发挥抗乳腺癌活性,但是Sch B 如何影响乳腺癌细胞增殖凋亡能力及具体机制尚不清楚。本研究以Sch B为研究对象,探讨其对人乳腺癌MDA-MB-231细胞凋亡的影响及其作用机制。
-
人乳腺癌细胞株MDA-MB-231(中科院细胞库,目录号:SCSP-5043);甘草查尔酮A(纯度≥98%,批号76296-75-6,上海麦克林生化科技有限公司);CCK-8试剂盒、Annexin V-FITC/PI凋亡试剂盒、JC-1荧光探针、DCFH-DA荧光探针、Hoechst 33342 染色剂、PBS(大连美仑生物);1640培养基、胎牛血清( FBS) (美国HyClone公司);ECL发光液、BCA蛋白定量试剂盒(美国Thermo公司);Bcl-2、Bax、CHOP、GPR78、ATF4、PERK、p-PERK、p-eIF2α、eIF2α、β-actin、二抗(美国 Cell Signaling Technology公司)。
-
人乳腺癌细胞系MDA-MB-231细胞培养于含10%胎牛血清、100 μg/ml链霉素及100 U/ml青霉素的L-15培养基中,置于37 ℃、5% CO2的饱和湿度培养箱培养,细胞2~3 d可传代培养。Sch B药物处理时,首先取生长状态良好的对数期细胞进行实验,细胞分为对照组和药物组,根据细胞存活率检测结果计算IC50,药物组分为Sch B低剂量组剂量(1/2倍IC50),Sch B中剂量组(1倍IC50),Sch B高剂量组(2倍IC50)。
-
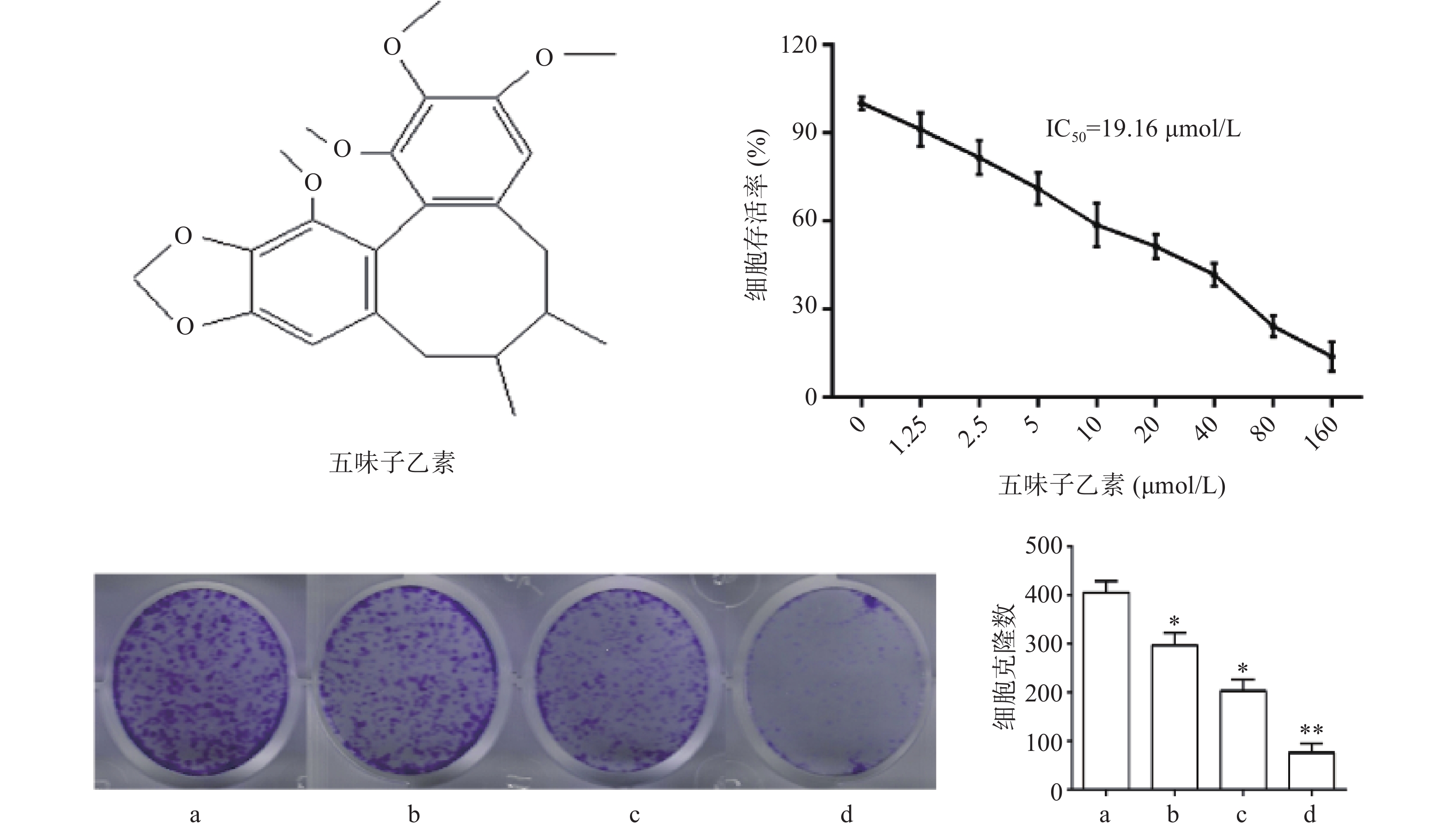
取状态良好的对数期MDA-MB-231细胞,以8×103/100 μl细胞密度接种于96孔板,于37 ℃,5% CO2培养箱培养过夜。将细胞分为空白组(含培养基,不含细胞)、对照组(含培养基,含细胞,不含药物)和药物处理组,药物处理组分别以终浓度为1.25、2.5、5、10、20、40、80、160 μmol/L的Sch B处理细胞24 h,每组3个复孔。24 h后每孔加入CCK-8溶液(10 μl), 于培养箱继续培养1 h,用酶标仪在450 nm处测定吸光度(OD)值,计算细胞存活率,并计算药物IC50值。
细胞存活率=[(OD药物−OD空白)/(OD对照−OD空白)]×100%
细胞克隆形成分析:取生长良好的对数期MDA-MB-231细胞,消化成单细胞悬液,以每孔3×103个细胞接种于6孔板,轻轻摇动使细胞分散均匀,过夜贴壁。分为对照组和药物组,对照组加等体积的培养基,药物组分别加以终浓度为(10、20、40 μmol/L)Sch B培养基,置培养箱中培养14 d。然后用PBS清洗2次,室温下用4%多聚甲醛固定15 min,1%结晶紫染色10 min。显微镜观察克隆形成情况,观察3个视野中克隆数量。
-
将生长良好的对数期MDA-MB-231细胞,以每孔2.5×105个/ml细胞密度接种于6孔板,置培养箱过夜培养。待细胞贴壁后,分别将终浓度为10、20、40 μmol/L的Sch B处理24 h。用不含EDTA胰酶消化细胞,PBS洗涤2次,结合缓冲液(100 μl)重悬细胞,转入流式管,然后再分别加入Annexin V-FITC(5 μl)和PI染液(5 μl),室温孵育15 min(避光),最后加入结合缓冲液(400 μl)混匀,流式仪上机检测,Flow Jo软件处理数据。
-
将生长良好的对数期MDA-MB-231细胞,以1×105个/ml细胞密度接种于12孔板,置培养箱过夜培养。待细胞贴壁后,分别将终浓度为10、20、40 μmol/L的Sch B处理24 h。DCFH-DA染液用PBS 1∶1000稀释成工作液,每孔加入200 μl工作液,37 ℃培养箱中避光孵育30 min,PBS洗涤2次,倒置荧光显微镜拍照,Image J软件检测荧光强度。
-
将生长良好的对数期MDA-MB-231细胞,以2.5×105个/ml细胞密度接种于6孔板,于培养箱过夜培养。待细胞贴壁后,将细胞依次分为对照组和药物组,对照组细胞加等体积培养基,药物组分别加终浓度为10、20、40 μmol/L的Sch B及加或者不加活性氧(ROS)清除剂(NAC)5 mmol/L, 内质网应激抑制剂4-PBA 2 mmol/L处理24 h。用RIPA(含PMSF蛋白酶抑制剂)裂解液提取蛋白,BCA法测定蛋白浓度,加入5×上样缓冲液金属浴(100 ℃)使蛋白变性。20 μg蛋白样品经PAGE凝胶电泳后转至PVDF膜,5%脱脂牛奶封闭1 h,孵育一抗(4 ℃冰箱过夜),1×TBST洗涤3次,二抗室温孵育2 h,采用ECL显影液显色,凝胶成像系统拍照,Image J软件分析。
-
数据采用GraphPad软件进行分析,以
$ \bar{x}\pm s $ 表示。组间比较采用t检验和单因素方差分析,P<0.05表示差异有统计学意义。 -
图1结果显示,与对照组比较,随着药物浓度增大,细胞存活率下降,其IC50为19.16 μmol/L,故选择1/2倍IC50(10 μmol/L),1倍IC50(20 μmol/L),2倍IC50(40 μmol/L)3个剂量进行后续实验。细胞克隆实验结果显示,随着药物浓度增大,细胞克隆形成显著被抑制,且呈现剂量依赖关系,差异具有统计学意义(P<0.05)。
-
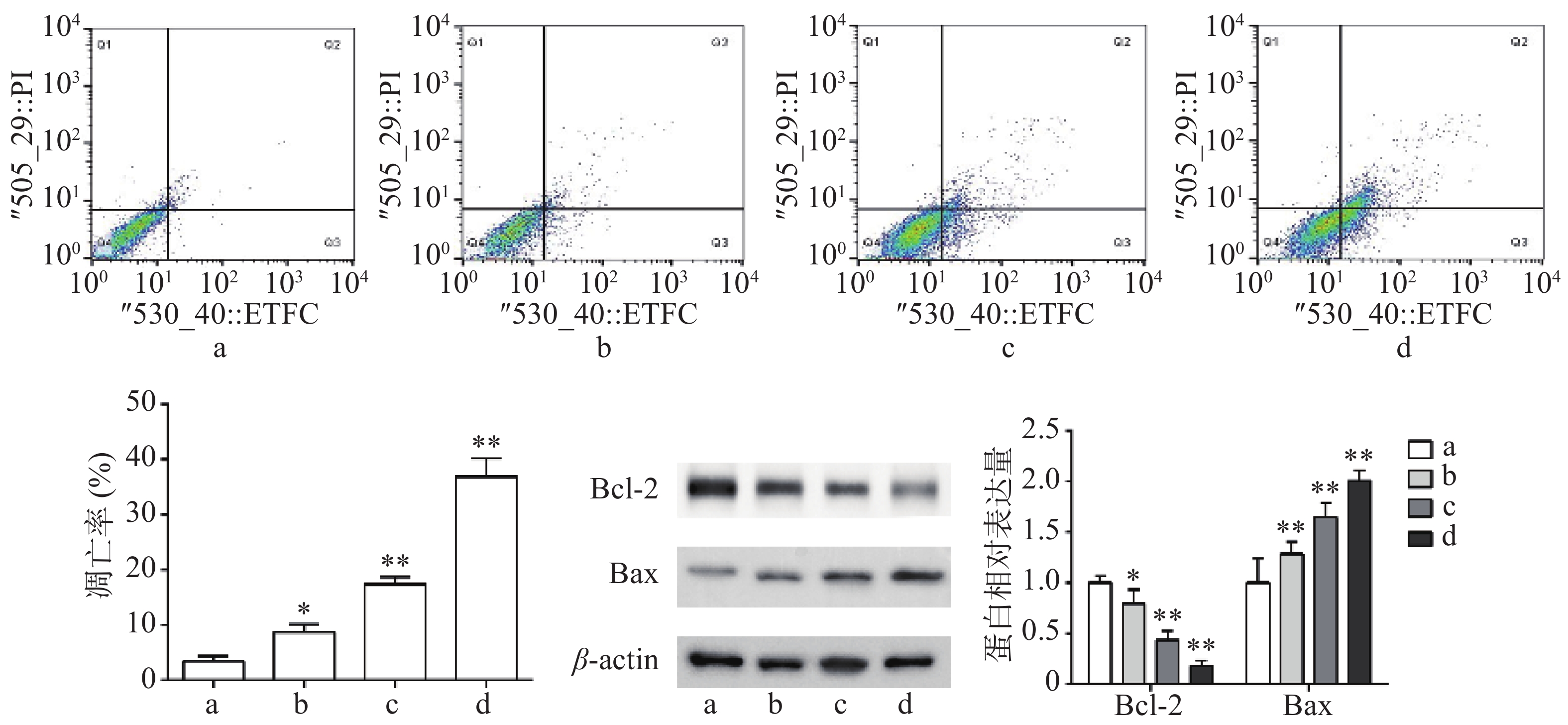
流式细胞术检测结果显示,与对照组比较,Sch B(10、20、40 μmol/L)均可诱导细胞凋亡,且呈剂量依赖,具有统计意义(P<0.05)。Western blot法检测结果显示,与对照组比较,Sch B(10、20、40 μmol/L)使抗凋亡蛋白Bcl-2的表达显著降低,促凋亡蛋白Bax的表达显著升高( P<0.05),结果见图2。
-
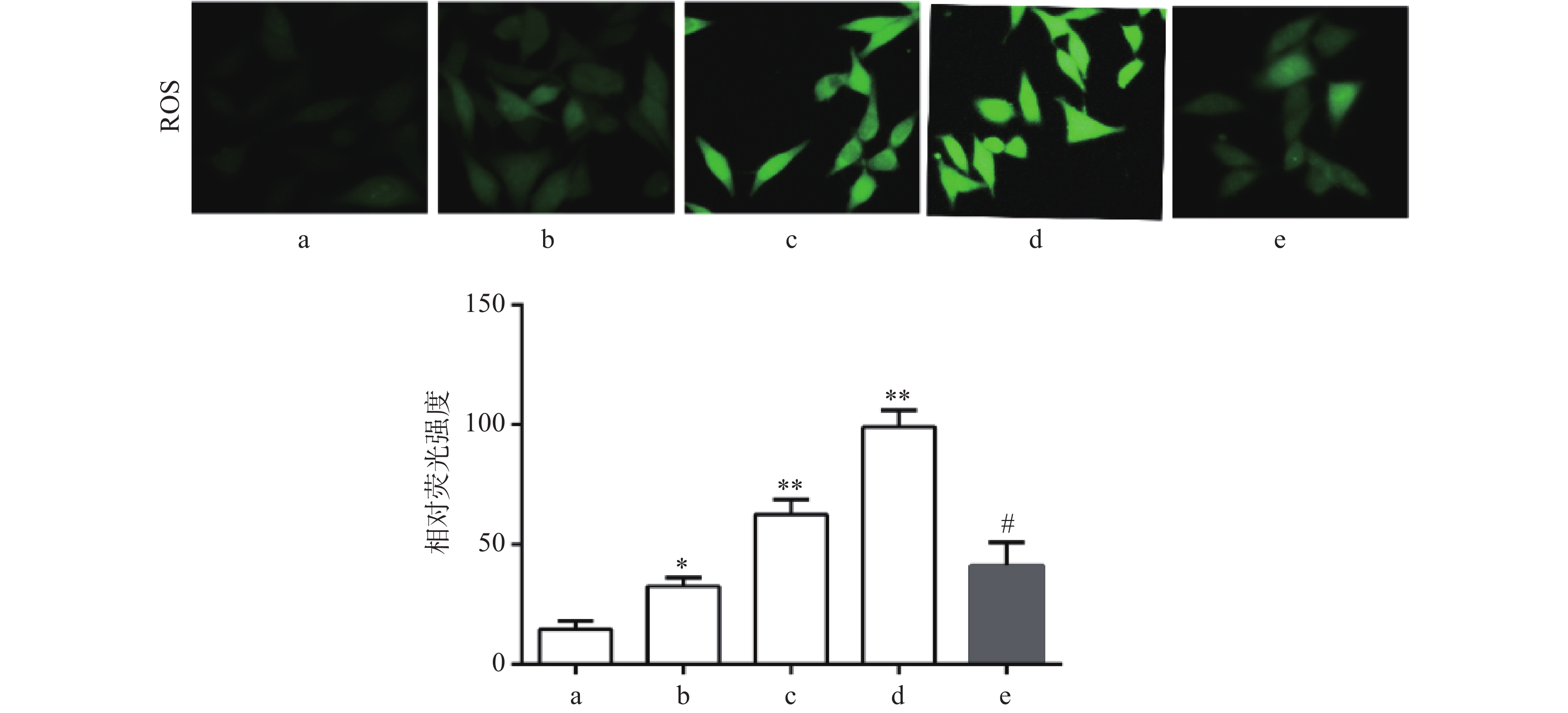
DCF-DA染色结果显示,与对照组比较,Sch B(10、20、40 μmol/L)组绿色荧光逐渐增强,显示细胞内ROS水平增高,且呈剂量依赖,差异有统计学意义(P<0.05),活性氧清除剂NAC(5 mmol/L)预处理2 h可显著抑制由Sch B导致的细胞内ROS增多(P<0.05),结果见图3。
-
异常内质网应激可引起细胞凋亡,Western blot 法检测结果显示,与对照组比较,Sch B(10、20、40 μmol/L)分别使内质网应激相关蛋白CHOP,GPR78,p-eIF2α表达增多且呈剂量依赖,差异有统计学意义(P<0.05),内质网应激抑制剂4-PBA(2 mmol/L)预处理2 h,可显著抑制由Sch B引起的内质网应激,使内质网应激相关蛋白CHOP、GPR78、p-eIF2α表达降低(P<0.05),结果见图4。
-
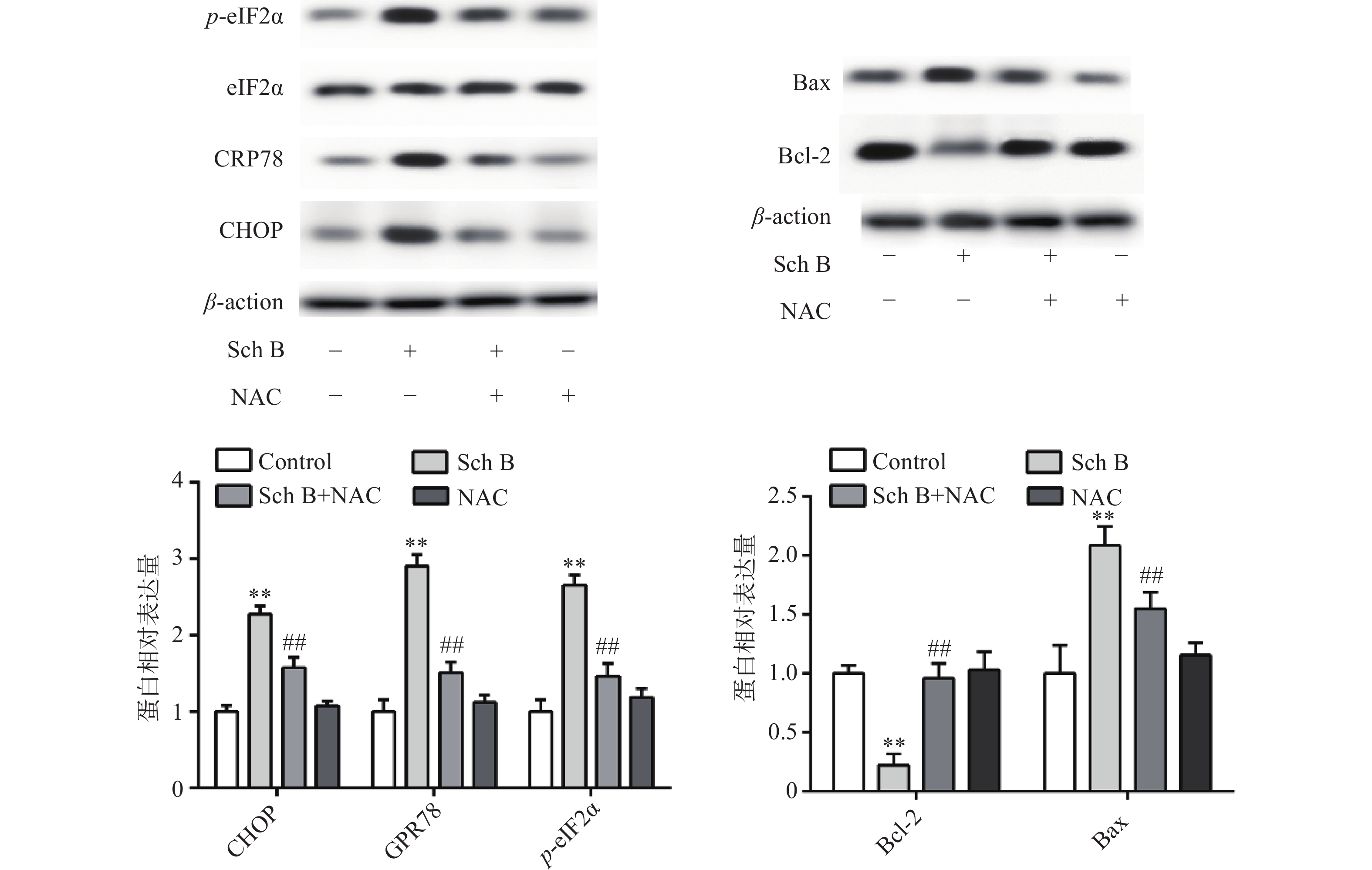
上述结果表明Sch B可以使细胞内ROS升高,Sch B也可以使内质网应激诱导细胞凋亡。为了验证ROS升高与内质网应激之间的联系,MDA-MB-231用ROS清除剂NAC(5 mmol/L)预处理2 h,结果显示,NAC可逆转由Sch B引起的内质网应激,使内质网应激相关蛋白CHOP,GPR78,p-eIF2α显著降低(P<0.05),进一步实验证明, 5 mmol/L NAC可逆转由Sch B引起的细胞凋亡,使抗凋亡蛋白Bcl-2的表达显著升高,促凋亡蛋白Bax的表达显著降低(P<0.05),结果见图5。
-
乳腺癌是临床上特别常见的恶性肿瘤,每年的发病率和死亡率都在增加,其发生发展是一个复杂的病理过程,是不受控制的细胞增殖和抵抗凋亡的结果[9]。尽管癌症研究领域取得了相当大的进展,但由于对化疗耐药和高复发率,乳腺癌的总体生存率仍然不令人满意,因此,大量的研究都集中在发现新的有效的治疗乳腺癌的候选药物中[10]。从植物中提取的天然化合物具有更有效和更少的副作用被认为是抗癌药物的重要来源。
ROS在细胞存活和死亡中起着关键作用。在正常生理条件下,适当水平的ROS有助于细胞存活。然而,过量的ROS会导致细胞损伤和凋亡细胞死亡[11]。ROS作为不良刺激之一,可引起内质网功能障碍,诱导内质网应激,称为ROS介导的内质网应激[12]。在本研究中,MDA-MB-231细胞在与Sch B孵育前先经ROS清除剂NAC预处理。凋亡减轻,ROS生成减少,CHOP,GPR78和p-eIF2a表达下调,内质网应激减轻。这说明Sch B诱导的MDA-MB-231细胞内质网应激依赖性凋亡中,ROS是不可或缺的。
内质网是真核细胞中传导和提供蛋白质折叠环境的细胞器,因为它对刺激的敏感性会导致某种情况发生成为内质网应激,内质网应激被认为是应对内质网稳态失衡的各种细胞生物学生理和病理事件的一种高度保守的细胞防御机制,如抗癌药物诱导的细胞凋亡通路[13]。GPR78是调节内质网应激的关键因子,GPR78的激活增加了真核启动子2 alpha (eIF2α) 51位丝氨酸的磷酸化,从而抑制蛋白的合成,磷酸化的eIF2α促进活化转录因子4 (ATF4)和C/EBP同源蛋白(CHOP) 的表达,CHOP是调节Bcl-2家族蛋白表达的关键促凋亡转录因子[14]。我们发现,Sch B可引起乳腺癌MDA-MB-231细胞内质网应激,CHOP,GPR78和 p-eIF2α蛋白水平呈剂量依赖性增加,当使用内质网抑制剂4-PBA后,内质网应激减轻。
综述所述,Sch B可诱导乳腺癌MDA-MB-231细胞凋亡,其机制可能与增加细胞内ROS水平,使p-eIF2α蛋白激活,GPR78和CHOP表达增多,引发细胞内质网应激有关。本研究可为乳腺癌的辅助治疗提供一定的实验依据。
Schisandrin B induces apoptosis of human breast cancer MDA-MB-231 cells through ROS mediated endoplasmic reticulum stress
-
摘要:
目的 研究五味子乙素对人乳腺癌MDA-MB-231细胞凋亡的影响及其作用机制。 方法 用细胞计数试剂(CCK-8)检测不同浓度五味子乙素对MDA-MB-231细胞存活率的影响;五味子乙素(10、20、40 μmol/L)作用 MDA-MB-231 细胞 24 h,分别用Annexin V-FITC/PI检测细胞凋亡情况;用DCFA-DA荧光探针检测细胞内活性氧(ROS)水平;用Western blot法检测细胞凋亡及内质网应激相关蛋白(Bcl-2、Bax、CHOP、GPR78、PERK、p-PERK、p-eIF2α、eIF2)的表达。 结果 与空白组比较,随着五味子乙素浓度增大,细胞存活率明显降低,其IC50为19.16 μmol/L;与对照组比较,五味子乙素(10、20、40 μmol/L)均能抑制细胞克隆形成(P<0.05),且呈剂量依赖;五味子乙素(10、20、40 μmol/L)均可诱导细胞凋亡(P<0.05),使抗凋亡蛋白BCL-2的表达显著降低,促凋亡蛋白Bax的表达显著升高(P<0.05);五味子乙素(10、20、40 μmol/L)显著升高细胞内ROS水平(P<0.05),且呈剂量依赖;五味子乙素(10、20、40 μmol/L)能够激发内质网应激,使内质网应激相关蛋白CHOP、GPR78、p-eIF2α表达增多(P<0.05),且呈剂量依赖。 结论 五味子乙素可能通过ROS介导内质网应激诱导MDA-MB-231细胞凋亡。 Abstract:Objective To study the effects of schisandrin B (Sch B) on the apoptosis of human breast cancer MDA-MB-231 cells and its mechanism. Methods Cell counting reagent (CCK-8) was used to detect the effect of Sch B on the survival rate of MDA-MB-231 cells. MDA-MB-231 cells were treated with Sch B (10, 20, 40 μmol/L) for 24 hours. The cell death was detected by Annexin V-FITC/PI. The levels of intracellular reactive oxygen species (ROS) were detected by DCFA-DA fluorescent probe. Apoptosis and the expression of endoplasmic reticulum stress related proteins (Bcl-2、Bax、CHOP、GPR78、PERK、p-PERK、p-eIF2α、eIF2) were detected by Western blot. Results Compared with the blank group, the cell survival rate decreased significantly (P<0.01) with the increase of Sch B concentration, and its IC50 was 19.16 μmol/L. Compared with the control group, Sch B groups (10, 20, 40 μmol/L) inhibited cell clone formation in a dose-dependent manner (P<0.05). Sch B groups (10, 20, 40 μmol/L) induced apoptosis (P<0.05), significantly reduced the expression of anti-apoptotic protein Bcl-2 and significantly increased the expression of pro-apoptotic protein Bax (P<0.05). Sch B groups (10, 20, 40 μmol/L) significantly increased the level of intracellular ROS in a dose-dependent manner (P<0.05). Sch B groups (10, 20, 40 μmol/L) stimulated endoplasmic reticulum stress and increased the expressions of endoplasmic reticulum stress-related proteins CHOP, GPR78 and p-eIF2α in a dose-dependent manner (P<0.05). Conclusion Sch B induces apoptosis of MDA-MB-231 cells through ROS mediated endoplasmic reticulum stress. -
Key words:
- schisandrin B /
- breast cancer /
- reactive oxygen species /
- endoplasmic reticulum stress /
- apoptosis
-
临床药物研究需要严格、标准、规范的数据管理[1],众多文献阐述了统计分析前临床试验数据核查的相关问题及改进措施[1-4],然而,对于统计分析所得数据的核查却鲜有报道。本文以生物等效性(BE)研究为例,介绍统计分析数据核查的要点,包括:试验分组的随机数字表、药代动力学(PK)主要参数以及BE的分析计算数据和结果在相应的软件中是否能够重现、与原统计分析报告是否一致。同时,统计专业人员对核查提出的问题进行敏感性分析,并出具相关报告。
1. 资料与方法
1.1 资料来源
本文所使用的数据来自我部于2019-2021年间所接受的18项BE研究统计分析数据核查的结果,所测试的药物分别为抗病毒、抗菌药物以及治疗心脑血管疾病、糖尿病等疾病的药物。
1.2 统计学方法
1.2.1 采用SAS软件运行得出随机数字表
随机指利用SAS软件中的随机化功能,事先给出种子数,进行随机化分组。该方法简便易行、可重复、符合随机化要求[5]。通过SAS系统的“PROC PLAN SEED=种子数”过程实现两组等比例随机化。例如,将001~010这10个数随机分配为A、B两组,种子数设定为20200506,则生成的结果A组为002、003、006、008和009,B组为001、004、005、007和010。核查时,只要采用试验时设定的种子数,则通过SAS运行得到的A组和B组的数据不变。用同样的随机种子,通过SAS程序运行,能够得出相同的随机表。由此证明研究对象进入试验组和对照组机会均等。
1.2.2 采用WinNonlin软件计算主要PK参数、SAS软件进行BE评价
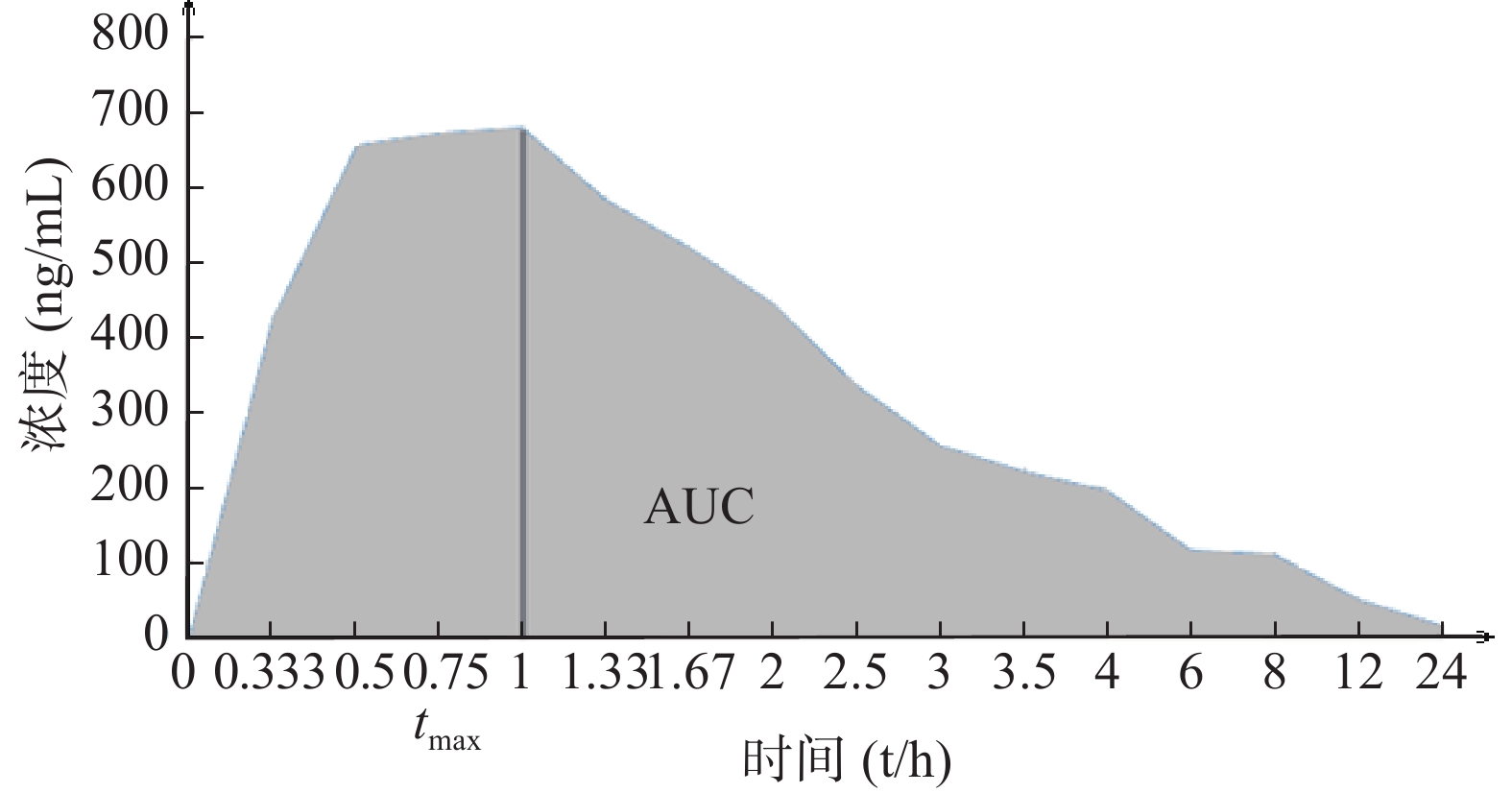
BE指药学等效制剂或可替换药物在相同的试验条件下,给予相同的剂量,其活性成分吸收速度和程度的差异无统计学意义[6]。BE研究给药后,通过测量不同时间点的生物样本(全血、血浆、血清等)药物浓度,得出药物浓度-时间曲线,经过计算得出血药浓度-时间曲线下面积(AUC)、药物达峰浓度(cmax)、达峰时间(tmax)(图1)等PK参数后,再通过统计学分析比较,判断两种制剂是否生物等效。
目前,BE评价方法是置信区间法。当主要PK参数AUC和cmax的几何均值比值的90%置信区间在80%~125%内时,受试制剂吸收的速度和程度与参比制剂相当,视为生物等效[7]。
核查时,首先需要核对申办方提供的统计分析前的原始数据。统计专业人员向核查人员展示数据传输协议(由申办方提供);然后,根据原始样本浓度数据,现场使用WinNonlin 8.1软件处理各组血药浓度测定数据,采用非房室模型计算出主要PK参数,包括AUC0-t、AUC0-∞、cmax,其他数据则使用SAS 9.4软件分析。如果受试制剂与参比制剂的AUC0-t、AUC0-∞和cmax几何均数比值的90%置信区间均落在80%~125%范围内,则两种制剂生物等效;否则,两种制剂不存在生物等效。将核查所得结果和结论与原统计分析报告核对,检查一致性。
2. 结果
2.1 一般情况
18项BE研究的分组随机数字表均可重现;18项研究均符合生物等效的判定标准,且BE评价结果与原统计分析报告一致;其中有13项研究的PK参数与原统计分析报告相同,其余5项研究的PK参数则有差异,见“2.2”项。
2.2 问题及处理结果
有12项研究存在个别样本采样时间偏差,其中,2项研究被要求补充敏感性分析,3项研究的分析数据集被要求进行受试者数据的重新纳入或剔除后,也进行了敏感性分析。
上述5项研究敏感性分析的结果显示:PK参数AUC0-t、AUC0-∞和cmax的几何均值比值的90%置信区间虽在数值上有所变化,但仍然在80%~125%范围内,维持原统计分析报告的BE评价。
3. 讨论
3.1 BE研究中随机化和等效性评价的意义
BE试验通常采用随机交叉等试验设计,随机和盲法因其有效控制偏倚而成为BE试验注册和核查的关键内容[8]。由于随机化即随机分配的优点,随机对照试验被广泛认为是评价新的药物、新的医疗器械或新的治疗方法疗效的最佳设计[9],是评价医学新疗法的金标准[10]。
在过去的二十年里,许多第一代专利药品的专利和上市许可的到期,导致了仿制药的兴起。进行BE研究被认为是确定仿制药与专利药具有相同的有效性和安全性的关键[7]。BE研究在化学药物仿制药的申请、新药评价以及已上市药物的变更申请中,具有不可替代的作用[6, 8, 11]。
3.2 核查发现的问题
3.2.1 采样时间偏差
在药物临床试验方案中,试验期间各个样本采集的时间点有严格规定。由于操作技术、环境及其它因素的影响,可能导致样本采集的时间与计划采样时间有所偏差、且超过了方案允许的偏差范围,这种情况视为超窗[12]。超窗会否影响统计分析的结果,需要通过敏感性分析予以证明。
敏感性分析指通过改变方法、模型、未测量的变量值等考查结果的改变程度,以确定评估方法的稳健性。敏感性分析结果与主要分析结果一致,表明主要分析的结果稳健,反之亦然[13]。对BE研究而言,考查的关键便是生物等效这一评估结果对PK参数的变化是否敏感。
核查发现,有2项BE研究分别存在个别受试者采血时间超窗问题。例如,在某研究中,某受试者计划采血时间为给药后5 min,方案规定的允许偏差范围为30s之内,但实际采血时间为5min32s,即超窗2s。在原统计分析报告中,PK参数按照计划采血时间加2s,即5min2s计算。核查人员要求按照实际采血时间重新计算主要PK参数,即按照5min32s计算,并做敏感性分析,与原统计分析结果进行比较,考查所得结论的一致性。
由此可见,对样本采集的环节进行严格、科学的管理非常重要。另外,无论采样时间是否存在偏差甚至超窗,应尽可能获取所有数据,真实记录采样时间,并做出敏感性分析报告。
3.2.2 受试者数据重新剔除或纳入
临床试验有效性分析应涵盖随机化分组后的所有受试者,而不仅限于实际完成的受试者数据。按照这种意向性治疗原则所做的分析是最好的分析。
BE研究的统计分析集除全分析集(FAS)和安全数据集(SS)外,最主要的数据集为PK参数集(PKPS)和BE集(BES)[14],BES是推断受试制剂和参比制剂是否生物等效的数据集。
在撰写统计报告时,如果剔除了某受试者数据,或者有受试者出现种种事故但没有被剔除,核查时可能被要求重新纳入或剔除受试者的数据,并进行敏感性分析,以考查是否对最终结果造成影响。例如,某BE试验对照组某受试者第二周期无给药后3.50 h、3.75 h、4.00 h、4.25 h、4.50 h及以后共13个时间段的血药浓度数据,原报告将该受试者纳入PKPS与BES,在核查时,将该受试者第二周期剔除PKPS与BES;或者,原报告将类似受试者剔除PKPS与BES,核查时又将该受试者重新纳入PKPS与BES。
需要注意的是,BE研究通常样本量相对较小,受各种原因数据剔除造成数据缺失的影响相对较大,可能对BE统计分析结果的稳健性带来挑战。因此,BE研究须严格质量管理,事先没有规定的不做剔除处理[11]。
4. 结论
统计分析数据是临床研究结果的呈现,是撰写统计分析报告和临床研究报告的依据。为确保临床研究最终结果和结论没有争议,国家药品监督管理局核查中心对药物临床研究的统计分析数据进行核查非常必要。
本文从统计学角度介绍了BE研究统计分析数据现场核查的主要内容,并对相关统计方法、核查发现的问题、原因和对策进行逐一分析和讨论。考虑到BE研究通常样本量较小,采样时间出现偏差、剔除或纳入数据可能影响统计结果的稳健性,因此,敏感性分析在BE研究中尤为重要,用于评估主要分析结果和结论的稳健性。敏感性分析和主要分析结果一致,则补充、巩固和加强研究结论,进一步证实试验药物的有效性和安全性[15-17]。本文建议,BE研究在统计分析计划的制定与统计分析报告的撰写中,对核查的内容、可能涉及敏感性分析的相关问题,特别是敏感性数据集PKPS和BES的调整,应予以充分考虑,以便在数据分析阶段采用多种敏感性分析方法,综合考虑结果的稳健性,为评估不同制剂临床治疗的可替换性提供扎实的研究数据。
-
-
[1] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2018,68(6):394-424. doi: 10.3322/caac.21492 [2] 李贺, 郑荣寿, 张思维, 等. 2014年中国女性乳腺癌发病与死亡分析[J]. 中华肿瘤杂志, 2018, 40(3):166-171. doi: 10.3760/cma.j.issn.0253-3766.2018.03.002 [3] TANG Y, WANG Y, KIANI M F, et al. Classification, treatment strategy, and associated drug resistance in breast cancer[J]. Clin Breast Cancer,2016,16(5):335-343. doi: 10.1016/j.clbc.2016.05.012 [4] 白文宇, 王厚恩, 王冰瑶, 等. 五味子化学成分及其药理作用研究进展[J]. 中成药, 2019, 41(9):2177-2183. doi: 10.3969/j.issn.1001-1528.2019.09.033 [5] RAN J, MA C, XU K, et al. Schisandrin B ameliorated chondrocytes inflammation and osteoarthritis via suppression of NF-κB and MAPK signal pathways[J]. Drug Des Devel Ther,2018,12:1195-1204. doi: 10.2147/DDDT.S162014 [6] NASSER M I, HAN T Y, ADLAT S, et al. Inhibitory effects of Schisandrin B on human prostate cancer cells[J]. Oncol Rep,2019,41(1):677-685. [7] WANG C Q, XU C, FU X L, et al. Schisandrin B suppresses liver fibrosis in rats by targeting miR-101-5p through the TGF-β signaling pathway[J]. Artif Cells Nanomed Biotechnol,2020,48(1):473-478. doi: 10.1080/21691401.2020.1717507 [8] DAI X, YIN C, GUO G, et al. Schisandrin B exhibits potent anticancer activity in triple negative breast cancer by inhibiting STAT3[J]. Toxicol Appl Pharmacol,2018,358:110-119. doi: 10.1016/j.taap.2018.09.005 [9] SOPIK V. International variation in breast cancer incidence and mortality in young women[J]. Breast Cancer Res Treat,2021,186(2):497-507. doi: 10.1007/s10549-020-06003-8 [10] SHAMSI M, PIRAYESH ISLAMIAN J. Breast cancer: early diagnosis and effective treatment by drug delivery tracing[J]. Nucl Med Rev Cent East Eur,2017,20(1):45-48. doi: 10.5603/NMR.2017.0002 [11] D'AUTRÉAUX B, TOLEDANO M B. ROS as signalling molecules: mechanisms that generate specificity in ROS homeostasis[J]. Nat Rev Mol Cell Biol,2007,8(10):813-824. doi: 10.1038/nrm2256 [12] WU W S. The signaling mechanism of ROS in tumor progression[J]. Cancer Metastasis Rev,2006,25(4):695-705. [13] LI Q, LU X H, WANG C D, et al. Antiproliferative and apoptosis-inducing activity of schisandrin B against human glioma cells[J]. Cancer Cell Int,2015,15(1):12. doi: 10.1186/s12935-015-0160-x [14] JHENG J R, HO J Y, HORNG J T. ER stress, autophagy, and RNA viruses[J]. Front Microbiol,2014,5:388. -





 下载:
下载:
 下载:
下载: