-
氧气是生命活动的基本物质,在机体内主要参与能量代谢过程。作为一种至关重要的生命物质,氧气在多个层面影响着机体,甚至可以通过多种渠道影响基因[1]。Kirmes等的研究表明:在缺氧条件下,细胞在全基因组水平上会产生结构变化,染色质会发生聚集现象[2]。机体缺氧时,通过氧化呼吸链产生过多的活性氧簇(ROS),包括超氧阴离子、过氧化氢、羟自由基等。ROS不仅可以直接损伤脂质、蛋白质及核酸等生物大分子,还可以通过Fas/FasL、TNF-α/TNFRl、MAPK等信号通路诱导细胞凋亡[3-4]。目前,针对缺氧的防治,西药主要有碳酸酐酶抑制剂、糖皮质激素、茶碱等,中药较为成熟的有藏药红景天,胡黄连、黄芪等也被认为具有一定的抗缺氧损伤的能力[5]。乙酰唑胺作为FDA认可的唯一一种防治急性缺氧的药物,更多的是用来治疗急性缺氧,且其存在过敏反应、四肢麻木、疲劳、困倦等不良反应,肝肾功能异常的人不宜使用[6-8]。藏药红景天目前已被高原边防部队作为防治高原缺氧的常规药物。大部分学者认为红景天可以通过抑制氧化应激、抗凋亡、保护神经细胞等方式治疗缺氧性损伤,但其主要活性成分的抗缺氧作用机制仍不清楚[9]。作为预防用药,红景天需要提前7~15 d服用,才能较好起到提高抗缺氧能力的作用,疗程较长。目前,针对缺氧的治疗仍以给予高浓度氧气最为直接有效,而对于提高耐缺氧能力,目前尚无安全高效的药物。
毛裂蜂斗菜(Petasites tricholobuson)是菊科蜂斗菜属下的一种,在民间广泛用于消肿止痛、解毒祛瘀,治跌打损伤、毒蛇咬伤等。课题组前期实验已经证明,其醇提取物具有抗炎作用[10-12]。本实验通过观察PTB对小鼠存活时间、血清乳酸脱氢酶(LDH)活性和丙二醛(MDA)含量变化,对脑组织与心脏超氧化物歧化酶(SOD)和还原型谷胱甘肽(GSH)活性变化、脑组织病理变化,以及对大鼠肾上腺嗜铬细胞瘤细胞(PC12)制成糖氧剥夺模型(OGD)后存活率的影响,进一步探讨PTB的抗缺氧能力及可能的作用机制。
-
昆明种小鼠110只,雄性,SPF级,体质量23~25 g,合格证号:SCXK(京)2019-0010(斯贝福生物技术有限公司),饲养于清洁级动物房,人工照明模拟昼夜变化;PC12细胞(美国ATCC细胞库)。
-
蜂斗菜总内酯(自提):经高效液相色谱(HPLC)检测,蜂斗菜总内酯含量为74.8%,其中,内酯B、内酯Ⅲa、内酯Ⅳa的含量分别为13.4%、46.8%、14.6%,各单体成分分子结构式均已明确[13];诺迪康胶囊(规格:0.28 g/粒,西藏诺迪康药业股份有限公司,批号:200402);0.9%氯化钠溶液(500 ml,济民健康管理股份有限公司,批号:S200516E52);LDH试剂盒、GSH试剂盒、总蛋白定量测试盒、MDA试剂盒、SOD测试盒(南京建成生物工程研究所),规格:96T,批号:20210914、20211012、20210603、20211012、20211012;MTT(3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide)(美国Sigma 公司);高糖DMEM培养基、胎牛血清(美国Hyclone公司);混合气体(95%N2,5%CO2)(上海成功气体工业有限公司);CO2气体(海军军医大学热卫系)。
-
全自动酶标仪、1300 SERIES A2型超净台(美国Thermo科技公司);SHIMADZU LC-20高效液相色谱仪(岛津有限公司);Pico17高速离心机(ThermoFisher科技公司);L-420低速离心机(湘仪离心机仪器有限公司);Tissuelyser-48多样品组织研磨机(上海净信实业发展有限公司);DHG.9.23A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);DK-8D型电热恒温水槽(上海一恒科技有限公司)。
-
小鼠适应性饲养3 d,常规进食,自由饮水。根据预实验结果,采用随机数字法将小鼠分为空白对照组、模型组、阳性对照组(诺迪康280 mg/kg)、PTB低剂量组(20 mg/kg)、PTB中剂量组(40 mg/kg)、PTB高剂量组(80 mg/kg),其中空白对照组10只小鼠,其余各组20只小鼠。适应性饲养3 d后,按照小鼠质量10 ml/kg灌胃给药,连续给药3 d,空白对照组和模型组给予等体积的溶剂CMC-Na。本实验过程遵守动物福利、动物保护和伦理原则及相关规定。
-
第3天给药1 h后,除空白对照组外,取其余每组小鼠各10只分别置于125 ml磨口广口瓶中(瓶内放置5 g钠石灰,用于吸附CO2),瓶口涂抹凡士林保证绝对密封,自盖上瓶盖开始计时,以小鼠呼吸心跳停止为小鼠窒息死亡判定依据,记录并统计各组小鼠死亡时间。
-
根据小鼠常压密闭缺氧实验结果,将小鼠最短死亡时间(12 min)设为时间节点。除空白对照组外,将其余5组剩余小鼠分别置于125 ml磨口广口瓶中(瓶内放置5 g钠石灰,用于吸附CO2),瓶口涂抹凡士林保证绝对密封。自盖上瓶盖开始计时,到达时间节点后立即将小鼠取出,眼眶取血,血液样品放置于冰盒中保存。空白对照组于常压未缺氧条件下直接眼眶取血。各组小鼠眼眶取血后,立即脱颈处死,解剖并小心分离出脑组织,于冰盘上快速分离出右侧大脑半球,置4%多聚甲醛固定液中。左侧大脑半球保存在清洁干燥离心管中。脑组织固定后,解剖分离出小鼠心脏,用生理盐水充分灌洗后,用清洁滤纸吸干。所有样品均放置于液氮中临时保存。
-
将各组小鼠右侧大脑半球切片制作成石蜡切片,分别通过脱蜡、染色、分化、封片等步骤,进行HE和尼氏染色。染色切片制作完成后进行显微镜镜检,图像采集分析。
-
将取得的血液样品进行离心处理(4000 r/min,10 min),取上清液进行LDH活性、MDA含量的测定。将取得的心脏、左侧大脑半球称重,按照组织与生理盐水1∶9的比例,低温条件下制成10%的组织匀浆,进行SOD、GSH活性的测定。MDA含量、LDH活性、SOD活性、GSH活性的检测按照试剂盒说明书进行。
-
将PC12细胞置于CO2细胞培养箱内培养(95%空气和5%CO2,37 ℃,饱和湿度),培养基由90%高糖DMEM和10%胎牛血清(FBS)组成,每3 d更换新的培养基。当细胞的生长达到80%~90%汇合度时,对细胞进行传代培养。细胞传代时,先弃去培养瓶内的培养基,用磷酸盐缓冲液(PBS)冲洗2次,加入不含EDTA的胰酶消化细胞,按照1:4的比例进行传代分瓶培养。待细胞生长状态稳定处于对数期生长时进行后续实验。
-
称取适量蜂斗菜总内酯,加入无糖培养基配制成2000 ng/ml的溶液。按照比例,用无糖培养基将液体分别稀释为200 ng/ml和20 ng/ml的溶液。
-
待铺于细胞培养板内的细胞汇合度达到80%且生长状态良好时,将原有培养基弃去,PBS冲洗2次后,模型组加入无糖培养基,给药组加入含有不同浓度PTB(20 、200、2000 ng/ml)的无糖培养基,置于缺氧装置(95% N2,5% CO2)内缺氧2 h后,将该装置移入37 ℃的恒温培养箱继续孵育12 h形成OGD模型。空白对照组照常更换培养基一次,在正常细胞培养环境下培养。
-
将状态良好的细胞以5×104个/ml的密度铺于96孔细胞培养板,MTT法检测细胞存活率。MTT实验检测开始时,在各细胞培养孔中加入20 μl MTT溶液(5 mg/ml, 即0.5%MTT),继续在37 ℃细胞培养箱内孵育4 h。弃细胞上清液,每个细胞孔加入150 μl DMSO溶液,摇床上低速震荡10 min,使沉积在细胞内的结晶充分溶解。在酶标仪490 nm处测量各孔的吸光值(A值)。根据各组所得的A值,计算细胞的存活率,其中,未经OGD处理的空白组细胞的存活率均一化为100%,其余各组细胞的存活率是相对于空白组比值的百分比。细胞的存活率=(A值实验组/ A值空白组)×100%。
-
采用SPSS21.0统计分析软件处理。计量资料数据以(
$\bar{x}$ ±s)表示,组间比较采用单因素方差分析,当P<0.05时,表示差异有统计学意义。 -
常压缺氧条件下,模型组小鼠的平均存活时间为859.5 s。与模型组相比,阳性对照组(诺迪康)小鼠的存活时间延长了131.9 s(P<0.05),PTB低、中、高剂量均能显著延长小鼠的存活时间(P<0.05,P<0.01),结果见表1。
表 1 PTB对常压缺氧小鼠存活时间的影响(n=10,
$\bar x $ ±s)组别 给药剂量(mg/kg) 存活时间(t/s) 模型组 − 859.5±84.56 诺迪康组 280 991.4±140.7* PTB低剂量组 20 1023±142.7** PTB中剂量组 40 980±120.5* PTB高剂量组 80 1055±251.9* *P<0.05,**P<0.01,与模型组比较。 -
与空白对照组相比,模型组的LDH活力明显增高(P<0.01);与模型组相比,阳性对照组(诺迪康)、PTB中、高剂量组LDH活力降低至空白组水平(P<0.05);低剂量组的LDH活力较模型组有所降低,但没有统计学差异(P>0.05),见表2。
表 2 PTB对常压缺氧小鼠血清LDH活力和MDA含量的影响(n=10,
$\bar x $ ±s)组别 给药剂量(mg/kg) LDH(U/L) MDA(nmol/ml) 空白组 − 1052±59.49 67.04±12.63 模型组 − 1280±206.6## 204.3±58.42## 诺迪康组 280 1092±70.16* 132.5±54.02* PTB低剂量组 20 1153±82.80 138.3±32.50* PTB中剂量组 40 1097±100.5* 152.8±48.90* PTB高剂量组 80 1059±187.8* 172.7±60.54 *P<0.05,与模型组比较;##P<0.01,与空白组比较。 与空白对照组相比,模型组的MDA含量显著增高(P<0.01);与模型组相比,阳性对照组(诺迪康)、PTB低、中剂量组MDA含量降低(P<0.05);PTB高剂量组MDA含量有所降低,但没有统计学差异(P>0.05),见表2。
-
在脑组织中,与空白对照组相比,模型组的GSH活力降低(P<0.01);与模型组相比,阳性对照组(诺迪康)的GSH活力有所升高,但是没有统计学差异(P>0.05);与模型组相比,PTB低、中、高3个剂量组的GSH活力均显著升高(P<0.01),见表3。
表 3 PTB对常压缺氧小鼠脑组织和心脏GSH活力的影响(n=10,
$\bar x $ ±s)组别 给药剂量
(mg/kg)脑GSH
(μmol/g•prot)心脏GSH
(μmol/g•prot)空白组 − 44.17±8.672 9.123±2.906 模型组 − 31.99±5.528## 5.772±2.537# 诺迪康组 280 37.47±13.56 8.345±2.336* 低剂量组 20 43.38±10.46** 13.42±3.606** 中剂量组 40 47.57±8.106** 12.07±4.191** 高剂量组 80 50.36±17.18** 12.59±1.820** *P<0.05,**P<0.01,与模型组比较;#P<0.05,##P<0.01,与空白组比较。 在心脏中,与空白对照组相比,模型组的GSH活力降低(P<0.05);与模型组相比,阳性对照组(诺迪康)的GSH活力升高(P<0.05);与模型组相比,PTB低、中、高3个剂量组的GSH活力均显著升高(P<0.01),见表3。
-
在脑组织中,与空白对照组相比,模型组的SOD活力降低(P<0.05);与模型组相比,阳性对照组(诺迪康)的SOD活力变化没有统计学差异(P>0.05);与模型组相比,PTB低、中、高3个剂量组的SOD活力均显著升高(P<0.01),见表4。
表 4 PTB对常压缺氧小鼠脑组织和心脏SOD活力的影响(n=10,
$\bar x $ ±s)组别 给药剂量
(mg/kg)脑SOD
(U/mg•prot)心脏SOD
(U/mg•prot)空白组 − 71.75±19.92 100.7±13.16 模型组 − 58.06±4.552# 85.26±16.80# 诺迪康组 280 56.88±14.44 115.6±15.00** 低剂量组 20 68.98±10.70** 139.7±25.62** 中剂量组 40 80.27±18.47** 124.7±21.92** 高剂量组 80 79.60±21.02** 127.1±12.15** **P<0.01,与模型组比较;#P<0.05,与空白组比较。 在心脏中,与空白对照组相比,模型组的SOD活力降低(P<0.05);与模型组相比,阳性对照组(诺迪康)、PTB低、中、高3个剂量组的SOD活力均显著升高(P<0.01),见表4。
-
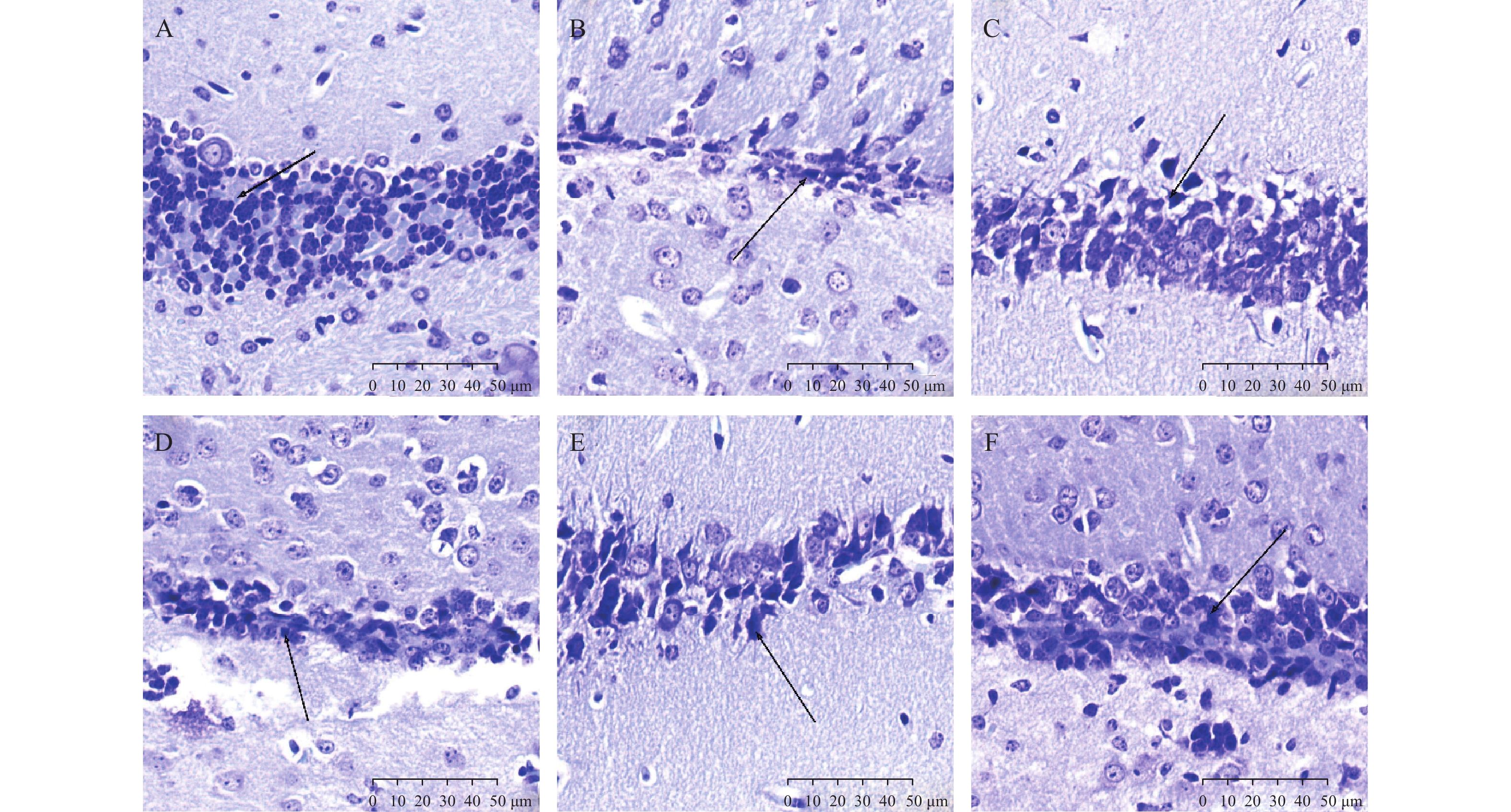
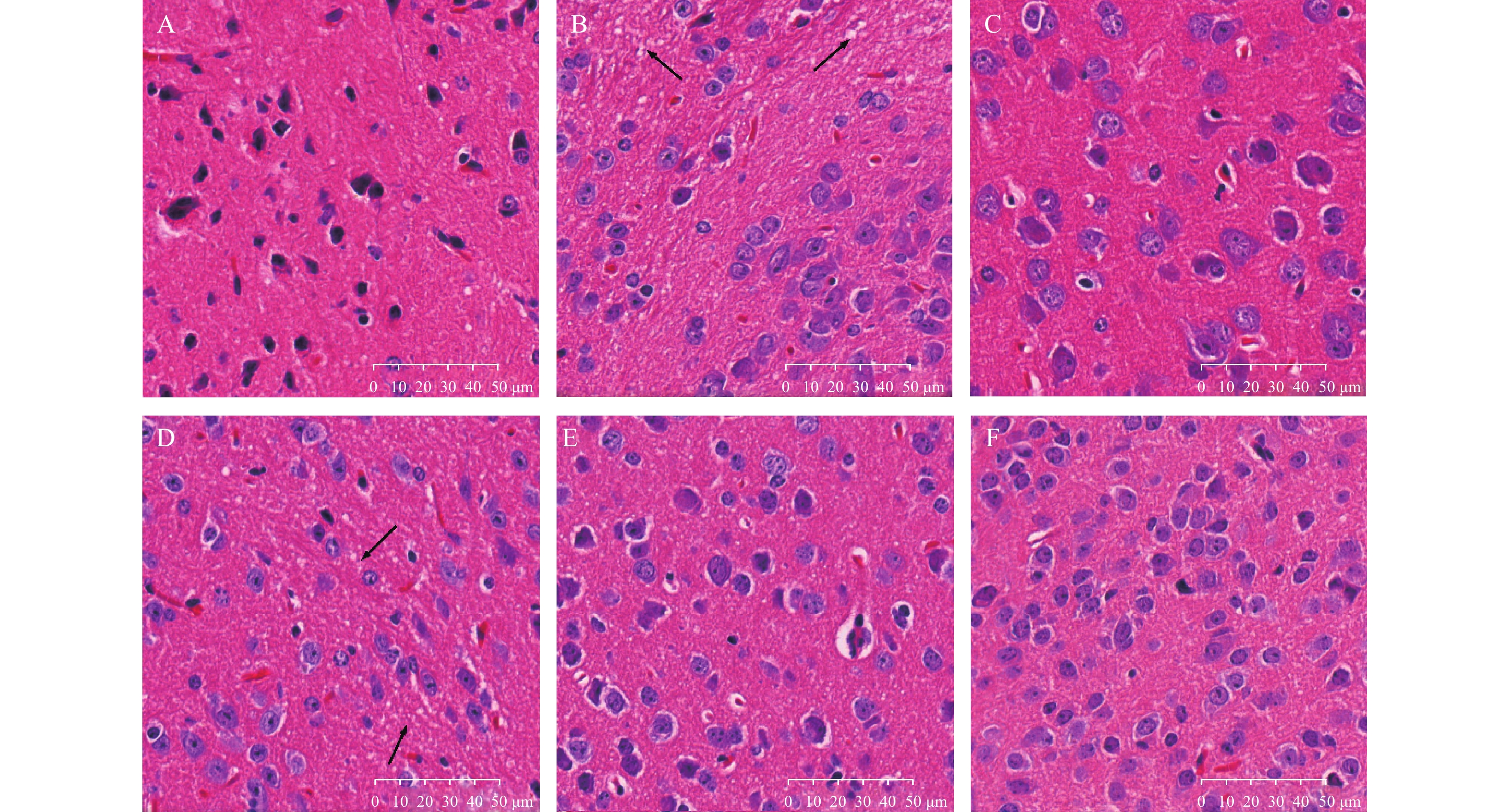
如图1所示,与空白对照组相比,模型组小鼠神经细胞排列明显紊乱,细胞之间存在大量空泡(箭头所示);与模型组相比,阳性对照组及PTB中、高剂量组的小鼠脑组织排列较整齐,细胞间空泡较少,神经纤维束的走行较为整齐统一。
尼氏染色下,与空白对照组相比,模型组海马区尼氏小体(箭头所示)明显减少,海马区细胞排列紊乱;与模型组相比,阳性对照组及PTB各剂量组的尼氏小体明显增加,细胞排列规则,见图2。
-
如表5所示,空白组细胞存活率为100.00%,模型组细胞存活率下降至(37.26±3.80) %,与空白组相比存在非常显著性差异(P<0.001)。PTB在20、200、2000 ng/ml浓度下的细胞存活率分别为(46.08±4.91) %、(52.90±6.85) %、(61.09±3.53) %,各浓度组相对于OGD组均有显著性差异(P<0.01,P<0.001,P<0.001)。
表 5 PTB对常压缺氧的PC12细胞损伤存活率的影响(
$\bar x $ ±s)组别 样本数(个) 给药剂量(ng/ml) 存活率(%) 空白组 3 − 100.00±3.01 模型组 3 − 37.26±3.80### PTB低剂量组 3 20 46.08±4.91** PTB中剂量组 3 200 52.90±6.85*** PTB高剂量组 3 2000 61.09±3.53*** -
缺氧条件下,由于ATP代谢障碍、机体代谢增强、体内Ca2+浓度增加等原因,产生过量的氧自由基。氧自由基通过损伤生物膜、蛋白质、DNA和糖分子,影响细胞信号传导和细胞凋亡,对机体产生损伤[14-15]。
课题组前期通过建立减压缺氧模型,测定实验动物存活率、血糖、肝糖原、肌糖原、ATP、乳酸(LD)、LDH等指标,论证了PTB具有维持血糖稳定,提高机体主要脏器中的糖原以及ATP的含量,减少LD积蓄以及LDH的活性,改善机体能量代谢的作用[13]。本论文采用常压缺氧模型进一步检测了在缺氧条件下,PTB对实验动物体内SOD、GSH、LDH活性、MDA含量、脑组织病理改变、对OGD处理后细胞存活状态等指标的影响,进一步完善了其对缺氧实验动物的保护作用。SOD被认为是抗氧化系统的第一道防线,是一种能够专一清除氧自由基的酶。它通过降低氧化活性部位金属离子的活性,以两步快速反应使
${\rm{O}}^-_2$ 转变为H2O2和O2。H2O2再被过氧化氢酶还原成H2O[16-17]。GSH是一种非酶性抗氧化剂,通过其巯基氧化-还原态的转换,作为可逆的供氢体,和过氧化物及自由基结合,保护细胞膜中含巯基的蛋白质不被破坏[18]。在本实验中,PTB在低、中、高3个剂量下,均能显著增强缺氧小鼠心、脑组织中SOD、GSH的活性,提高机体清除氧自由基的能力,减轻缺氧损伤。脂质过氧化物(LPO)是人体内多聚不饱和脂肪酸和氧自由基结合后形成的。在缺氧条件下,LPO水平升高,机体细胞及细胞膜产生氧化反应,溶解细胞膜表面的磷脂,破坏细胞膜的生理结构[19]。LPO还能和细胞内的DNA、脂质、蛋白质形成复合物,刺激新陈代谢改变,导致细胞内信号传导的紊乱、功能障碍,甚至凋亡。MDA是LPO稳定的终产物[20]。LDH是生物体内氧化还原的重要酶系之一,它能可逆地催化乳酸氧化为丙酮酸。当机体缺氧时,主要参与葡萄糖的无氧代谢。LDH活性的升高是机体无氧酵解程度升高的重要提示之一[21]。在本实验中,PTB中、高剂量组小鼠的血清LDH含量较模型组相比明显降低,说明中、高剂量组小鼠的无氧酵解相对较少,反应出机体缺氧程度较轻。低、中剂量组小鼠的MDA含量较模型组相比明显降低,说明小鼠体内发生脂质过氧化反应相对较低。这说明PTB可以抑制缺氧条件下机体的脂质过氧化反应,改善机体缺氧程度。
行为学实验结果显示,PTB在各剂量下均可延长常压缺氧小鼠在密闭空间下的存活时间。脑组织HE染色和尼氏染色表明,PTB具有保护神经细胞,维持细胞形态及功能的作用。体外实验结果表明,PTB在20、200、2000 ng/ml浓度下均能够提高OGD诱导的PC12细胞损伤存活率,存在一定的剂量依赖性,说明PTB对神经细胞的损伤具有保护作用。
综上所述,蜂斗菜总内酯具有明显的提高小鼠耐缺氧能力的作用,其作用机制可能与清除氧自由基、抑制脂质过氧化反应、保护神经细胞结构和功能有关。相比于藏药红景天,蜂斗菜总内脂的用药量明显减少,可作为抗缺氧的天然药物,进一步研究其作用的通路机制。
Protective effects of the total bakkenolides from Petasites tricholobus on hypoxia mice under normobaric pressure
-
摘要:
目的 探讨蜂斗菜总内酯(PTB)对提高动物耐缺氧能力的作用。 方法 建立小鼠常压缺氧模型和PC12细胞氧糖剥夺模型(OGD),观察PTB对小鼠常压密闭空间下存活时间、血清乳酸脱氢酶(LDH)活性和丙二醛(MDA)含量,对脑组织与心脏超氧化物歧化酶(SOD)和还原型谷胱甘肽(GSH)的活性,以及对脑组织病理变化和细胞存活率的影响。 结果 PTB可以显著提高常压缺氧小鼠在密闭空间下的存活时间,提高机体SOD、GSH的活性,减少脂质过氧化物的产生,降低无氧酵解的程度,保护神经细胞的结构和功能,提高OGD处理后的细胞的存活率。 结论 PTB具有明显的提高小鼠耐缺氧能力的作用,其作用机制可能与清除氧自由基、抑制脂质过氧化反应、保护神经细胞结构和功能有关。 Abstract:Objective To investigate the protective effects of the total bakkenolides from P.tricholobus on improving hypoxia tolerance in mice. Methods Mice normobaric pressure hypoxia model and oxygen glucose deprivation model in PC12 cells were established, and the effects of PTB on survival time, serum lactate dehydrogenase (LDH) activity and malondialdehyde (MDA) content, brain and heart superoxide dismutase (SOD) and reduced glutathione (GSH) activities, brain tissue pathological changes and cell survival were observed. Results The total bakkenolides from P.tricholobus had prolonged the survival time of mice in confined spaces, increased the activity of SOD and GSH, reduced the production of lipid peroxidation, decreased the degree of anaerobic glycolysis, protected the structure and function of neural cells, and improved the survival rate of OGD-treated cells. Conclusion The total bakkenolides from P.tricholobus could promote the hypoxia tolerance in mice which might be related to scavenging oxygen free radicals, inhibiting lipid peroxidation reaction and protecting the structures and functions of nerve cells. -
Key words:
- Petasites.tricholobus /
- anti-hypoxia /
- oxygen free radicals /
- pathological dyeing /
- cell experiment
-
抗真菌感染尤其深部真菌感染是抗微生物感染的重要研究内容,也是全球范围医学研究中面临的严峻挑战。近年来,在免疫力低下和重症监护病房患者中[1],真菌感染发病率和病死率逐年增加,其中在侵袭性念珠菌病中,病死率约为40%[2]。白色念珠菌是真菌感染中最常见的病原体,可以在正常人体的皮肤、口腔、阴道和肠道等部位定植[3]。临床上,多烯类、棘白菌素类、唑类和烯丙胺类药物是治疗真菌感染最常用的药物[4],然而由于白色念珠菌的耐药性、形成生物被膜以及部分药物较大的毒副作用等问题,传统抗真菌药物的应用面临新的挑战[5]。因此,增加现有抗真菌药物的药效,降低其毒副作用,是抗真菌药物研发的重要方向。利用药物新剂型的研究降低其毒副作用是有效的药物研发途径。例如,成功上市的两性霉素B脂质体即可极大降低两性霉素B的肾脏毒性[6]。
醋酸卡泊芬净(CAS)是一种棘白菌素半合成类抗真菌药,作用于真菌细胞的细胞壁,能有效抑制细胞壁中β-1,3-D-葡聚糖的生物合成,是目前白色念珠菌系统性感染治疗中的一线推荐药物。然而,CAS价格昂贵,通过药物合用的方式,维持或增强CAS的治疗效果,降低其使用剂量,可以显著减少患者的用药成本。与此同时,降低药物剂量可以减少CAS的毒副作用。有研究显示,患者在接受高于批准剂量3倍的CAS作用下,高剂量组中65%的患者会出现肝毒性,包括肝酶升高和肝衰竭[7]。我们在前期研究中发现单硬脂酸甘油酯(GMS)与CAS联合用药具有良好的协同作用,增强CAS体外抑菌效果,如两者联用体外抑菌MIC由
0.0625 μg/ml降低到0.0313 μg/ml[8]。然而,GMS与CAS混合使用,由于溶解性差异和药代动力学不同,可能无法在体内同时达到作用部位,共同杀灭真菌,本研究通过制备醋酸卡泊芬净单硬脂酸甘油酯固体脂质纳米粒为上述问题解决提供思路,并发挥体内协同抗菌的效果。固体脂质纳米颗粒(SLNs)以固态天然或合成的类脂如卵磷脂、甘油三酯等为载体,将药物包裹或夹嵌于类脂核中制成的纳米给药系统[9],可以包载亲脂性或者亲水性药物,提高药物的稳定性[10]。具有毒性低生物相容性好、物理稳定性好、体循环中药物不易泄露的特点[11]。通过药物协同增加抑真菌作用,可以减少给药用量与给药次数,提高药物疗效;进而降低抗真菌药物的毒副反应;同时减少真菌耐药性的产生[12]。基于以上研究基础,本研究以单硬脂酸甘油酯作为载体材料制备卡泊芬净固体脂质纳米粒,考察纳米粒对卡泊芬净的协同增效作用。
1. 实验仪器和材料
1.1 菌株
标准菌株白色念珠菌SC5314由美国Georgetown大学William A Fonzi教授赠予。
1.2 实验试剂及仪器
醋酸卡泊芬净(上海源叶)(≥98%);单硬脂酸甘油酯、蛋白胨、葡萄糖、琼脂(上海生工);乙腈、泊洛沙姆188、磷酸、甲醇(中国国药);DMEM高糖培养基、PBS缓冲液(上海泰坦);酵母提取物、营养肉汤(BD公司);RPMI
1640 (美国Gibco)。马尔文粒度电位仪(英国Malvern);透射电子显微镜(日本JEOL);高效液相色谱仪(美国Thermo);超声波细胞粉碎机(宁波新芝生物);高速离心机(德国Hettich);涡旋混合器(日本LTS);电子天平(瑞士MettlerToledo);洁净工作台(上海力申);多功能功能酶标仪(瑞士TECAN)。
1.3 实验动物
ICR小鼠,雌性,体重20~22 g,由苏州华创信诺医药科技有限公司提供,动物许可证号:SCXK(苏)2020-0009。
2. 实验方法
2.1 白色念珠菌培养
将在SDA固体培养基上保存的白色念珠菌单克隆菌株转接到3 ml YEPD培养基,30 ℃,200 r/min,培养18 h,使白色念珠菌处于指数生长的平台期。将活化的菌株转移到离心管中,重悬、离心洗涤3次后加入1 ml pH=7.4 PBS(0.01 mol/L)重悬,备用。
2.2 CAS含量测定
2.2.1 色谱条件
色谱柱:Diamonsil Plus C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈∶0.1%磷酸(35∶65);流速:1 ml/min;检测波长:227 nm;柱温为25 ℃;进样量:20 μl。
2.2.2 方法学验证
专属性考察:取醋酸卡泊芬净标准液、空白SLNs溶液、CAS-SLNs溶液,经0.22 μm滤膜过滤后,按“2. 2. 1”项下色谱方法进样检测。
线性和范围:精密称取CAS并定量配置质量浓度为1、5、10、20、40、50 μg/ml的CAS溶液。按“2.2.1”项下色谱方法进行检测,横坐标为CAS浓度,纵坐标为峰面积,绘制标准曲线。
精密度:日内精密度取5、20、40 μg/ml 3个浓度的CAS溶液各3份,分别检测3次;日间精密度是取低、中、高3个浓度的CAS溶液各3份,每3 d进行检测。
溶液稳定性:同一样品在0、1、2、3、5、8、12 h分别按“2.2.1”项下色谱方法进行检测,计算RSD以考察样品溶液的稳定性。
回收率:取空白SLNs溶液,分别取5、20、40 μg/ml 3个浓度的CAS溶液,超声破乳后,经0.22 μm滤膜过滤后按“2. 2. 1”项下色谱方法进行检测,计算回收率。
2.3 CAS-SLNs的制备和表征
2.3.1 CAS-SLNs的制备
采用熔融法制备醋酸卡泊芬净固体脂质纳米粒(CAS-SLNs):称取处方量的CAS、GMS、卵磷脂(CAS、GMS、卵磷脂摩尔比为1∶20∶5)完全溶解于甲醇中,加热条件下磁力搅拌混合均匀作为油相。配置0.2%泊洛沙姆188溶液,加热至相同温度作为水相。在磁力搅拌条件下(500 r/min),将水相缓慢滴入油相,加热条件下持续搅拌30 min,得到初乳。取初乳超声10 min(250 W,1 S,1 S),4 ℃固化过夜,即得到CAS-SLNs。
2.3.2 CAS-SLNs的表征
马尔文粒度仪测定SLNs的粒径和Zeta电位,磷钨酸负染后透射电镜观察其表面形态。
2.3.3 CAS-SLNs包封率测定
使用低温超速离心法,取所制备的CAS-SLNs溶液于离心管内
15000 r/min下离心2 h,取上清液500 μl于5 ml量瓶内并定容至刻度。另取500 μl未经离心的CAS-SLNs溶液于5 ml量瓶内并定容至刻度,甲醇超声破乳,分别取以上各组溶液经0.22 μm滤膜进样检测并计算载药量和包封率。根据公式(1)计算包封率(EE)、公式(2)计算载药量(DL):$$ \mathrm{E}\mathrm{E}=\frac{{M}_{\text{投药量}-}{M}_{\text{上清液含药量}}}{{M}_{\text{投药量}}}\times 100\text{%} $$ (1) $$ \mathrm{D}\mathrm{L}=\frac{{M}_{\text{实际包载量}}}{{M}_{\text{载药纳米粒}}}\times 100\text{%} $$ (2) 2.4 体外抗真菌活性的测定
2.4.1 CAS-SLNs最低抑菌浓度(MIC)的测定
制备药敏实验板:取96孔板。第1列配置100 μl RPMI1640培养基做空白对照;第12列配置100 μl菌液做阳性对照;第2列加200 μl菌液,分组为CAS、CAS + GMS(CAS与GMS物理混合)、CAS+SLNs(CAS与空白SLNs物理混合)、CAS-SLNs,每组两行,每孔CAS含量浓度为0.313 μg/ml。2~11列进行倍比稀释,最终使得CAS浓度为3.13×10−2 μg/ml、1.57×10−2 μg/ml、7.83×10−3 μg/ml、3.91×10−3 μg/ml、1.96×10−3 μg/ml、9.78×10−4 μg/ml、4.89×10−4 μg/ml、2.45×10−4 μg/ml、1.23×10−4 μg/ml、6.13×10−5 μg/ml、3.06×10−5 μg/ml。30 ℃恒温孵育24 h,用酶标仪在λ=630 nm处测A值。100 μl RPMI 1640培养基做空白对照记为A空白,菌液做阳性对照记为A阳性,加入各实验组记为A实验,MIC定义为使白色念珠菌A630降低80%以上的最小药物浓度。
2.4.2 生物被膜抑制效果的测定
制备生物被膜板:1640培养基调节白色念珠菌浓度为3×106 CFU/ml。取96孔板,第1列加100 μl RPMI1640培养基做空白对照;第2至12列加100 μl菌液,37 ℃培养90 min。
制备药敏板:分组为CAS、CAS+GMS、CAS+SLNs、CAS−SLNs,每组两行,每孔CAS含量浓度为0.313 μg/ml。按“2.4.1”项下倍比稀释得到不同浓度的CAS。
生物被模板孵育90 min后,弃上清液,用PBS清洗,将药敏板中的CAS按浓度梯度分别加入第2至11列,37 ℃培养24 h。倒掉培养基,PBS清洗生物被膜,加入0.4%结晶紫水溶液染色。倒掉染液并用PBS冲洗,加入酒精脱色后,取适量上清至96孔板,用酶标仪在λ=630 nm处,测A值。生物被膜板可在显微镜下观察被膜形成情况。
2.5 体内抗真菌活性的测定
2.5.1 白色念珠菌系统性感染
选择ICR小鼠雌性,6~8 周龄,小鼠尾静脉注射SC5314。注射剂量为1×105 CFU/只。1 d后处死小鼠,收集肾脏组织进行PAS染色切片。小鼠体重检测:将实验动物分为对照组、CAS组、CAS-SLNs组,每组8只。注射白色念珠菌后,分别尾静脉注射生理盐水、CAS、CAS-SLNs,每只200 μl(0.2 mg/kg)。间隔24 h给药,连续给药3次。给药后连续观察20 d,每天记录小鼠体重(g)。
2.5.2 真菌载菌量测定
实验动物造模后随机分为3组:对照组、CAS组、CAS-SLNs组。模型建立后分别尾静脉注射生理盐水、CAS、CAS-SLNs,每只200 μl(0.2 mg/kg)。感染48 h后处死,将肾脏组织称重后置入PBS中研磨成匀浆,将组织匀浆稀释到合适的倍数,接种到SDA平板上,在30 ℃下培养48 h后进行菌落计数。
2.5.3 组织病理学观察
实验动物分为对照组、CAS组、CAS-SLNs组,模型建立后分别尾静脉注射生理盐水、CAS、CAS-SLNs。感染48 h后处死,并取其肾组织进行PAS染色切片,观察白色念珠菌在组织中的感染情况。
2.6 统计学分析
采用GraphPad Prism 8(GraphPad Software, San Diego, CA)计算。两组间数据的比较采用Unpaired Student’s t-test,多组间的数据比较采用One-way ANOVA。P>0.05表示差异不具有统计学意义,P<0.05表示差异显著,P<0.01表示差异非常显著,P<0.001表示差异极其显著。
3. 结果
3.1 CAS含量测定
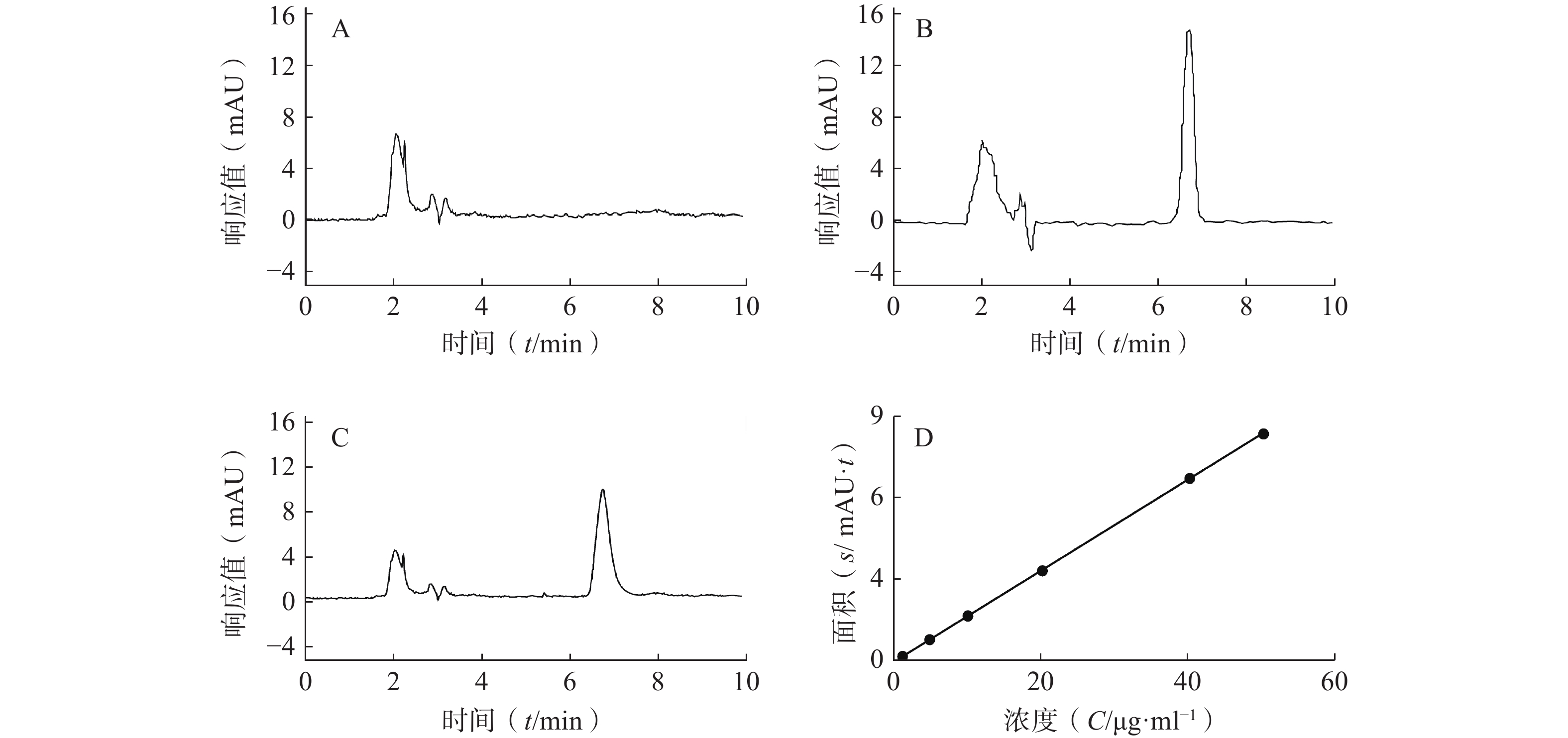
专属性:液相色谱图见图1,CAS出峰位置处无SLNs色谱法干扰,建立方法专属性良好。CAS保留时间为6.8 min,载体对CAS-SLNs测定无干扰。
线性和范围:如图1所示,方法专属性良好,以CAS浓度(C, μg/ml)为横坐标,所测得峰面积(Area)为纵坐标绘制标准曲线,回归方程为A=0.168 7C−
0.038 1 ,R2=0.999 9 ,表明CAS在1~50 μg/ml内线性关系良好。精密度:由表1可知,低、中、高浓度CAS日内精密度和日间精密度RSD值均小于5%,表明所建立方法的精密度满足要求。
表 1 CAS的HPLC方法精密度(Mean±SD, n=3)加样量(μg/ml) 日内精密度 日间精密度 测得量(μg/ml) RSD(%) 测得量(μg/ml) RSD(%) 5 4.79±0.05 1.07 4.79±0.04 0.90 20 19.64±0.17 0.87 19.90±0.26 1.32 40 38.48±0.21 0.55 38.17±0.57 1.49 稳定性:同一样品在12 h以内的RSD为1.88%,表明含量测定供试品溶液的稳定性满足要求。
回收率:由表2可知,样品在低、中、高3个浓度的回收率在95%~115%范围内,且RSD值均小于5%,表明该方法稳定可靠,可用于样品中CAS含量的测定。
表 2 CAS的HPLC方法提取回收率(Mean±SD, n=3)加样量(μg/ml) 测得量(μg/ml) 平均回收率(%) RSD(%) 5 5.29±0.12 105.78±2.41 2.28 20 20.95±0.48 104.76±2.40 2.29 40 43.39±0.59 108.48±1.47 1.35 3.2 CAS-SLNs的表征及包封率
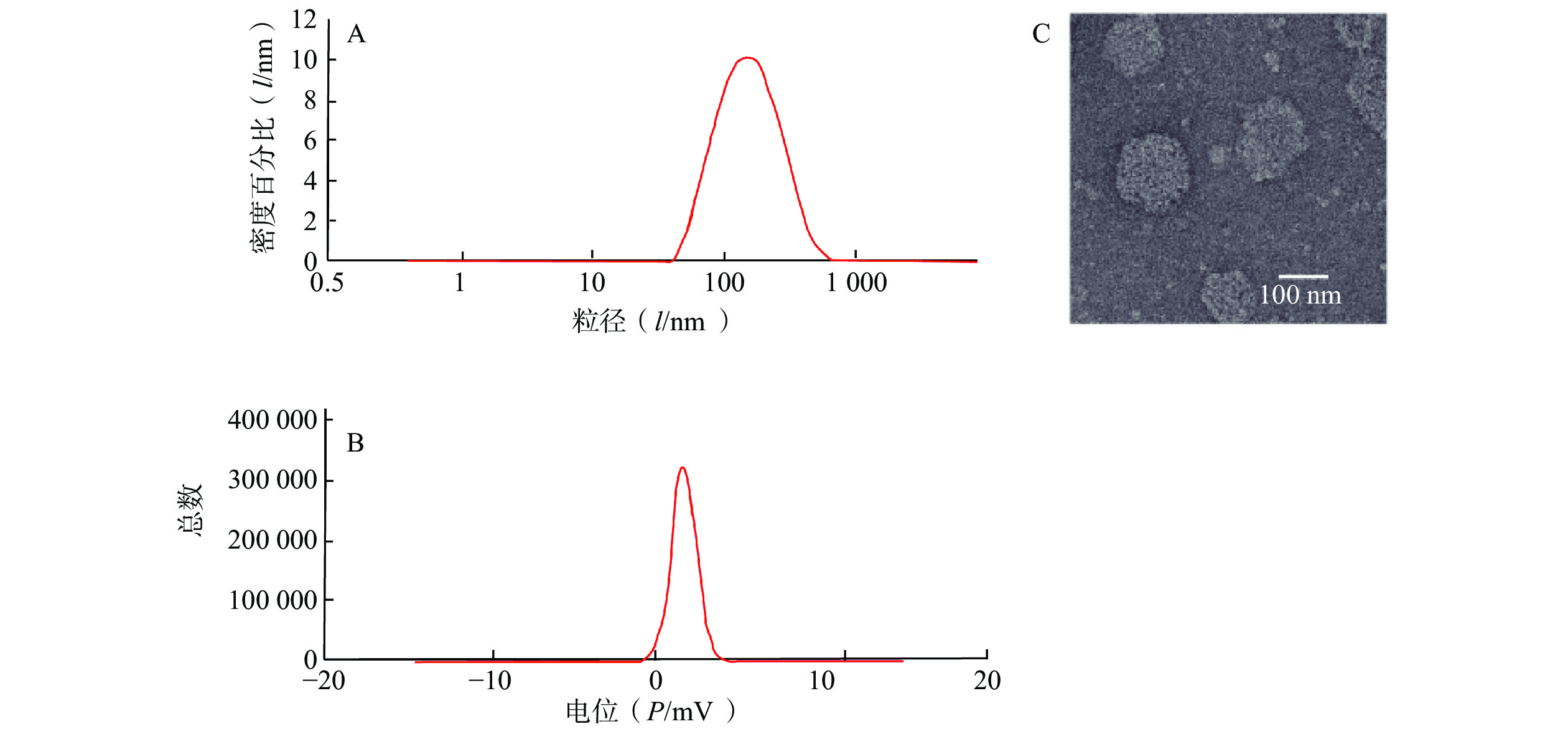
制备CAS-SLNs并对其进行表征。CAS-SLNs的粒径、Zeta电位分别为(135.97±1.73)nm,(19.33±0.37)mV。如图2所示,透射电镜照片显示CAS-SLNs为类圆形粒子,粒径约为120 nm。纳米粒包封率为(67.71±1.74)%,载药量为(7.55±0.68)%。
3.3 CAS-SLNs的体外抑菌效果
3.3.1 CAS-SLNs的最低抑菌浓度(MIC)
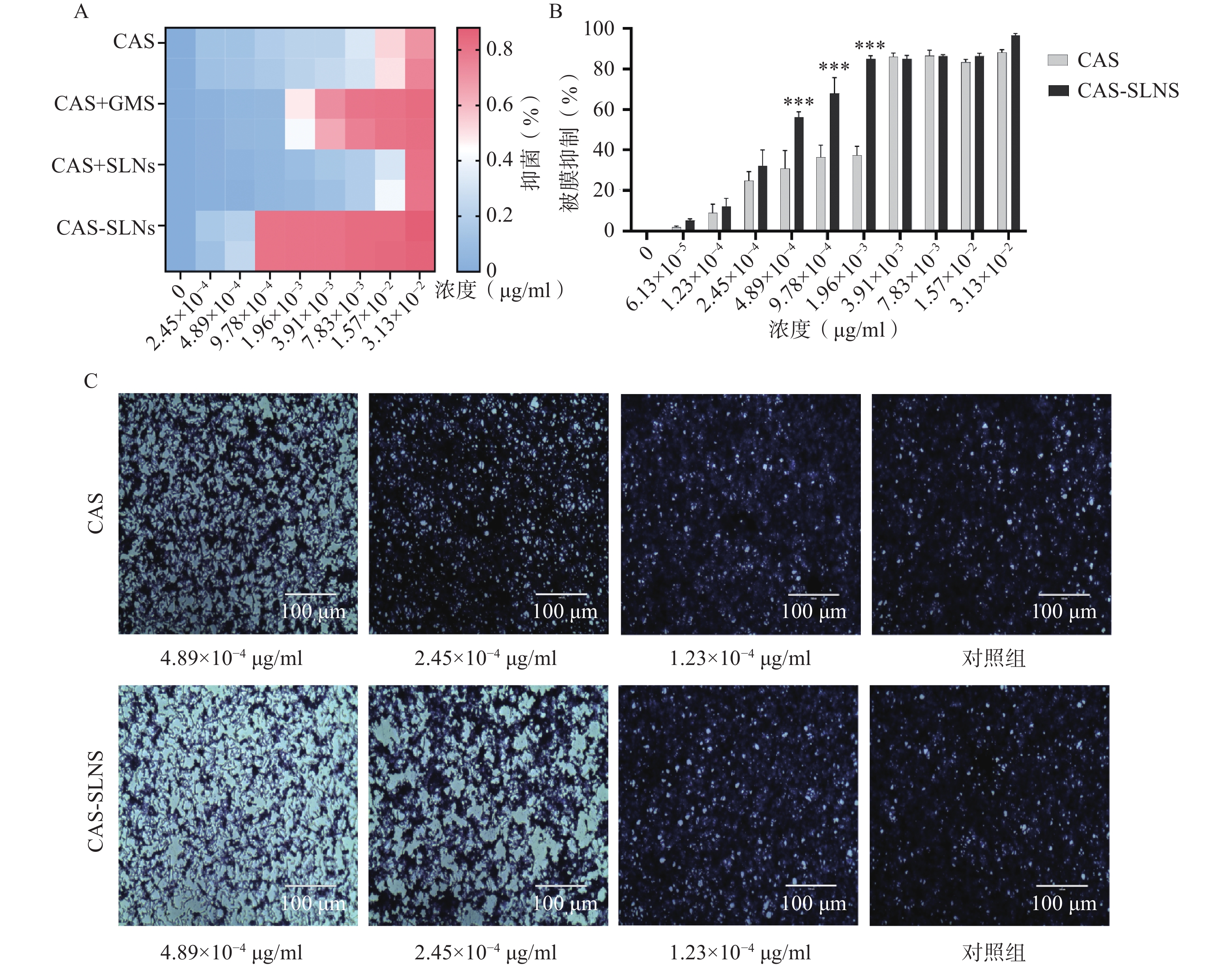
前期本课题组研究表明,GMS可以协同CAS抑制白色念珠菌的生长,因此我们比较了CAS-SLNs与CAS单用以及CAS+GMS合用的体外抗真菌活性。
结果如表3所示,与1 μg/ml的GMS合用后,CAS的MIC从3.13×10−2 μg/ml降低到7.83×10−3 μg/ml,白色念珠菌对CAS的敏感性增加了4倍,表明CAS可以协同GMS抑制念珠菌的生长;而本课题制备的CAS-SLNs MIC为9.78×10−4 μg/ml,这与单用CAS的MIC 3.13×10−2 μg/ml相比,活性增强了32倍,这表明CAS-SLNs可以进一步发挥CAS与GMS的协同作用抑制念珠菌的生长,其抑菌活性性优于CAS和GMS物理混合组。
表 3 微量稀释法检测CAS、CAS+GMS、CAS+SLNs、CAS-SLNs抑制白色念珠菌生长的MIC ( μg/ml)菌株名称 CAS CAS+GMS CAS+SLNs CAS-SLNs C. albicans SC5314 3.13×10−2 7.83×10−3 3.13×10−2 9.78×10−4 3.3.2 CAS-SLNs生物被膜活性测定
菌丝态与酵母态混合形成的被膜是白色念珠菌耐药的重要因素,卡泊芬净单用可以显著抑制白色念珠菌被膜的形成,为了探究CAS-SLNs的优效性,采用结晶紫染色法定量检测了各组药物处理后白色念珠菌生物被膜的形成情况。结果如图3显示,CAS组在1.96×10−3、9.78×10−4、4.89×10−4 mg/ml浓度下的被膜形成抑制率分别为(37.30±4.40)%、(36.50±5.78)%、(30.70±8.96)%,CAS-SLNs组在同等的1.96×10−3、9.78×10−4 、4.89×10−4 mg/ml浓度下,被膜形成的抑制率分别为(85.03±1.59)%、(68.05±7.72)%、(56.12±2.83)%。由此可见CAS-SLNs对生物被膜形成的抑制作用与单用CAS相比显著增强。
3.4 CAS-SLNs的体内抑菌效果
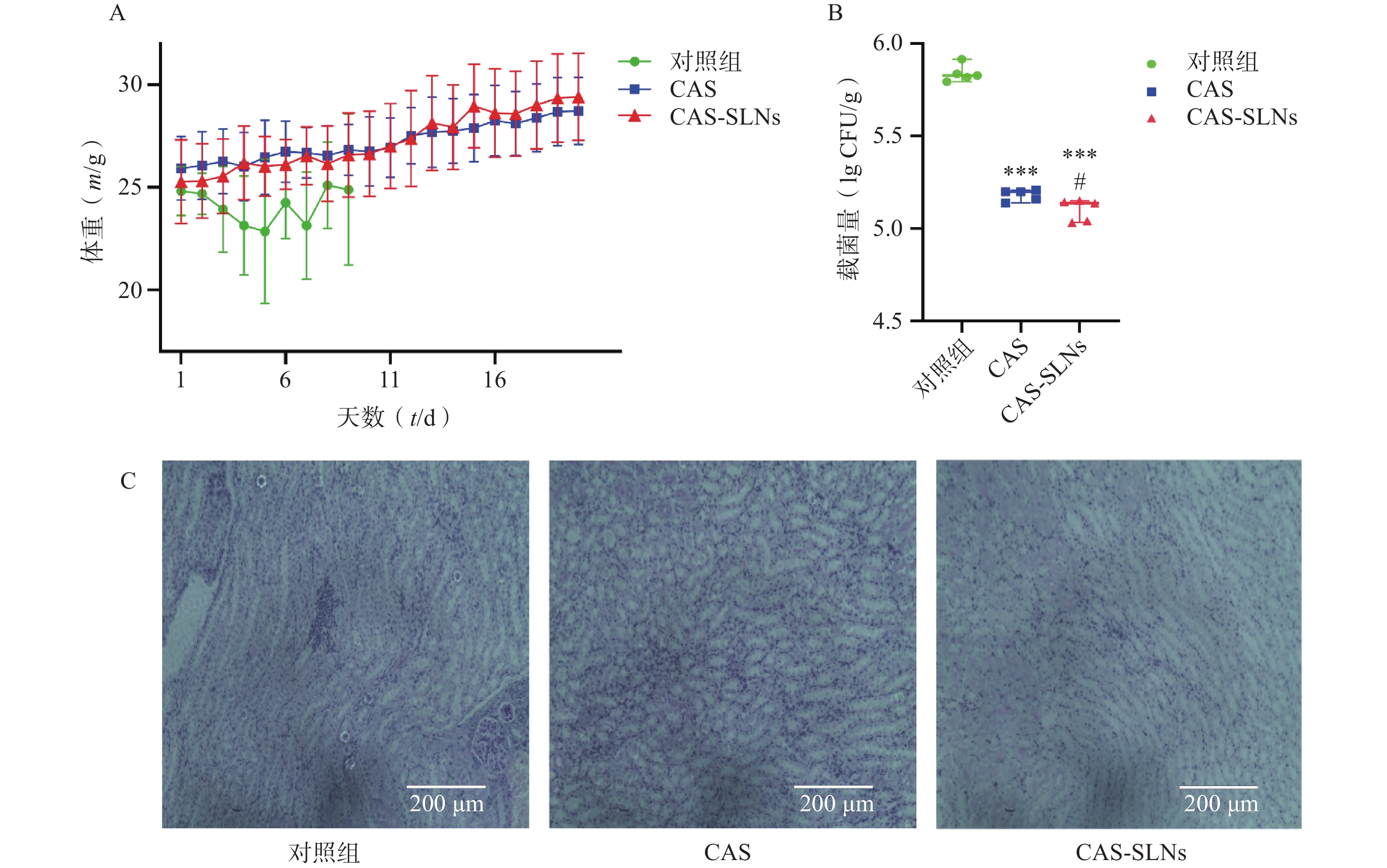
在小鼠系统性白色念珠菌感染模型中,如图4A所示,白色念珠菌感染可以导致小鼠体重的下降,而药物治疗可以恢复小鼠的体重增长。结果显示,CAS组小鼠平均体重由25.93 g增长至28.73 g,增长10.8%;而CAS-SLNs组体重由25.29 g增长至29.43 g,体重增长16.36%;对照组(对照组第10天存活率为0)与CAS-SLNs有非常显著的差异(P<0.01),CAS-SLNs组体重恢复更加显著。此外,CAS-SLNs治疗也可以显著降低小鼠肾脏的载菌量。如图4B所示,对照组、CAS组、CAS-SLNs组的载菌量分别为(5.84±0.05)CFU/g、(5.18±0.03)CFU/g、(5.10±0.06)CFU/g,与对照组肾脏载菌量有极显著差异(P<0.001),CAS-SLNs组与CAS组也有显著性差异(P<0.05)。通过PAS染色,考察小鼠肾脏的白色念珠菌感染情况,如图4C所示,在SC5314感染小鼠48 h后,对照组肾部病理切片经过PAS染色出现大量白色念珠菌。在感染小鼠经过CAS治疗后,白色念珠菌的数量明显下降。而经过同等剂量的CAS-SLNs治疗的感染小鼠肾部组织切片很少发现白色念珠菌的存在。CAS-SLNs作为以GMS为主要材料的载体包载药物CAS,其抗菌效果优于单用CAS,可以在体内发挥CAS与GMS的协同作用,体内抗菌效果显著增强。
4. 讨论
侵袭性真菌感染每年导致超过150万人死亡[13]。由于抗真菌药物耐药性的不断增多,迫切需要新的策略来对抗危及生命的真菌疾病。白念珠菌是念珠菌病的主要病原体,针对念珠菌血症的初始抗真菌治疗,美国传染病学会(IDSA)指南推荐使用棘白菌素类药物[14]。然而,抗真菌药物可能在毒性、感染复发、高成本和出现抗真菌耐药性方面存在局限性,可以采用联合用药的方式克服上述问题[15]。研究结果显示,在替代疗法中同时使用尼可霉素Z和CAS或米卡芬净[16]、以及CAS和氟康唑或伏立康唑的联用可以更好的治疗念珠菌感染[17];此外,宿主防御肽模拟物brilacidin(BRI)也可以作为CAS的增效剂,增强CAS对烟曲霉、白念珠菌、耳念珠菌和固有抗性的新型隐球菌的抗菌活性[18]。我们在前期研究发现CAS与GMS具有较强的协同抗念珠菌活性[8],GMS作为一种惰性的药用辅料,之前已报道过其作为脂质基质制备SLNs发挥协同抗金葡萄球菌和大肠埃希菌的活性[19],但抗真菌活性未有报道。因此,本研究构建了以GMS为主要材料的固体脂质纳米粒作为纳米载体包载CAS。一方面,SLNs骨架材料GMS可以协同CAS发挥抗真菌增效作用,另一方面,本课题所制备的纳米粒为水分散系统,无须有机溶剂,符合临床使用的需要。本研究结果表明CAS-SLNs相对于CAS与GMS物理混合物,MIC从7.83×10−3 μg/ml降低到9.78×10−4 μg/ml,发挥了很好的增效作用,这可能与CAS-SLNs的粒径为纳米级,具有极大的比表面积,容易被真菌摄取有关。在局部微环境中,随着载体基质的降解,药物逐步释放,在局部形成了较长时间的协同抑菌环境,从而增加了药物的抑菌活性。在可能的机制方面,有研究显示,硬脂酸可以激活三酰基甘油合成代谢途径,影响真菌的脂质代谢[20]。而棘白菌素类药物作用于白念珠菌后,白念珠菌脂质代谢的相关基因会发生改变,提示脂质代谢可能在白念珠菌抵御CAS的杀伤过程中十分重要[21]。因此,我们推测CAS-SLNs可能通过改变脂质代谢的途径,提高了CAS的敏感性,具体的信号通路和作用机制需要进一步的通过转录组学、代谢组学等方式深入研究。本研究为后续卡泊芬净的剂型改造提供了新的思路,有望为解决临床卡泊芬净药物治疗成本高的问题提供新的研究方向。
-
表 1 PTB对常压缺氧小鼠存活时间的影响(n=10,
$\bar x $ ±s)组别 给药剂量(mg/kg) 存活时间(t/s) 模型组 − 859.5±84.56 诺迪康组 280 991.4±140.7* PTB低剂量组 20 1023±142.7** PTB中剂量组 40 980±120.5* PTB高剂量组 80 1055±251.9* *P<0.05,**P<0.01,与模型组比较。 表 2 PTB对常压缺氧小鼠血清LDH活力和MDA含量的影响(n=10,
$\bar x $ ±s)组别 给药剂量(mg/kg) LDH(U/L) MDA(nmol/ml) 空白组 − 1052±59.49 67.04±12.63 模型组 − 1280±206.6## 204.3±58.42## 诺迪康组 280 1092±70.16* 132.5±54.02* PTB低剂量组 20 1153±82.80 138.3±32.50* PTB中剂量组 40 1097±100.5* 152.8±48.90* PTB高剂量组 80 1059±187.8* 172.7±60.54 *P<0.05,与模型组比较;##P<0.01,与空白组比较。 表 3 PTB对常压缺氧小鼠脑组织和心脏GSH活力的影响(n=10,
$\bar x $ ±s)组别 给药剂量
(mg/kg)脑GSH
(μmol/g•prot)心脏GSH
(μmol/g•prot)空白组 − 44.17±8.672 9.123±2.906 模型组 − 31.99±5.528## 5.772±2.537# 诺迪康组 280 37.47±13.56 8.345±2.336* 低剂量组 20 43.38±10.46** 13.42±3.606** 中剂量组 40 47.57±8.106** 12.07±4.191** 高剂量组 80 50.36±17.18** 12.59±1.820** *P<0.05,**P<0.01,与模型组比较;#P<0.05,##P<0.01,与空白组比较。 表 4 PTB对常压缺氧小鼠脑组织和心脏SOD活力的影响(n=10,
$\bar x $ ±s)组别 给药剂量
(mg/kg)脑SOD
(U/mg•prot)心脏SOD
(U/mg•prot)空白组 − 71.75±19.92 100.7±13.16 模型组 − 58.06±4.552# 85.26±16.80# 诺迪康组 280 56.88±14.44 115.6±15.00** 低剂量组 20 68.98±10.70** 139.7±25.62** 中剂量组 40 80.27±18.47** 124.7±21.92** 高剂量组 80 79.60±21.02** 127.1±12.15** **P<0.01,与模型组比较;#P<0.05,与空白组比较。 表 5 PTB对常压缺氧的PC12细胞损伤存活率的影响(
$\bar x $ ±s)组别 样本数(个) 给药剂量(ng/ml) 存活率(%) 空白组 3 − 100.00±3.01 模型组 3 − 37.26±3.80### PTB低剂量组 3 20 46.08±4.91** PTB中剂量组 3 200 52.90±6.85*** PTB高剂量组 3 2000 61.09±3.53*** -
[1] 侯春英, 卢多. 氧气对基因组的结构与化学影响[J]. 药学学报, 2020, 55(8):1744-1753. [2] KIRMES I, SZCZUREK A, PRAKASH K, et al. A transient ischemic environment induces reversible compaction of chromatin[J]. Genome Biol,2015,16:246. doi: 10.1186/s13059-015-0802-2 [3] 刘思亮, 李燕, 于巍, 等. 活性氧簇在脑缺血-再灌注损伤中的损伤与保护作用[J]. 现代生物医学进展, 2019, 19(5):969-974. [4] SU L J, ZHANG J H, GOMEZ H, et al. Reactive oxygen species-induced lipid peroxidation in apoptosis, autophagy, and ferroptosis[J]. Oxid Med Cell Longev,2019,2019:5080843. [5] 刘凤英, 马海英. 高原环境脑损伤与药物治疗研究进展[J]. 国际药学研究杂志, 2019, 46(6):418-422. [6] 黄海涛, 李楠. 高原反应的药物预防与治疗[J]. 武警医学, 2017, 28(12):1282-1285. doi: 10.3969/j.issn.1004-3594.2017.12.031 [7] 洪丽, 申宝德, 王镜, 等. 抗高原反应的药物研究进展[J]. 中国医院用药评价与分析, 2021, 21(1):125-128. [8] KAYSER B, DUMONT L, LYASAKOWSKI C, et al. Reappraisal of acetazolamide for the prevention of acute mountain sickness: a systematic review and meta-analysis[J]. High Alt Med Biol,2012,13(2):82-92. doi: 10.1089/ham.2011.1084 [9] 张瑞霞. 红景天治疗缺氧性疾病的相关机制[J]. 中国高原医学与生物学杂志, 2020, 41(2):134-138. [10] 王玉亮, 郭美丽, 张戈, 等. 毛裂蜂斗菜根茎的化学成分及抗炎活性[J]. 第二军医大学学报, 2006, 27(11):1210-1213. doi: 10.3321/j.issn:0258-879X.2006.11.014 [11] 李余先, 王燕, 郭美丽. 蜂斗菜的化学成分研究[J]. 第二军医大学学报, 2010, 31(7):779-781. [12] 谢曜宇, 李余先, 孙一鸣, 等. 蜂斗菜根茎中的一个新倍半萜成分及其抗缺氧活性[J]. 药学学报, 2016, 51(8):1285-1289. [13] 王业晴, 谢曜宇, 张慧, 等. 蜂斗菜总内酯对动物高原缺氧保护作用的研究[J]. 药学实践杂志, 2017, 35(2):116-120,125. doi: 10.3969/j.issn.1006-0111.2017.02.005 [14] 张洁, 袁东亚, 李文华, 等. 氧自由基与高原病研究进展[J]. 医学综述, 2011, 17(22):3384-3386. doi: 10.3969/j.issn.1006-2084.2011.22.009 [15] ZHANG J X, WANG X L, VIKASH V, et al. ROS and ROS-mediated cellular signaling[J]. Oxidative Med Cell Longev,2016,2016:4350965. [16] 袁牧, 王昌留, 王一斐, 等. 超氧化物歧化酶的研究进展[J]. 中国组织化学与细胞化学杂志, 2016, 25(6):550-558. doi: 10.16705/j.cnki.1004-1850.2016.06.015 [17] YOUNUS H. Therapeutic potentials of superoxide dismutase[J]. Int J Heal Sci,2018,12(3):88-93. [18] 袁平戈, 张大志. 还原型谷胱甘肽的作用机制及临床应用[J]. 药品评价, 2006, 3(5):385-390. doi: 10.3969/j.issn.1672-2809.2006.05.022 [19] 黄文杰, 马建林. 脂质过氧化物临床研究进展[J]. 医学新知杂志, 2019, 29(1):78-79,82. [20] GĘGOTEK A, SKRZYDLEWSKA E. Biological effect of protein modifications by lipid peroxidation products[J]. Chem Phys Lipids,2019,221:46-52. doi: 10.1016/j.chemphyslip.2019.03.011 [21] ADEVA-ANDANY M, LÓPEZ-OJÉN M, FUNCASTA-CALDERÓN R, et al. Comprehensive review on lactate metabolism in human health[J]. Mitochondrion,2014,17:76-100. doi: 10.1016/j.mito.2014.05.007 期刊类型引用(5)
1. 黄玉敏. 公立医院医用耗材SPD管理模式研究. 中国物流与采购. 2024(04): 102-103 .  百度学术
百度学术2. 刘引霞,兰欣,李耀明. 基于唯一条码的医院实验室试剂耗材管理流程设计及优化. 电脑知识与技术. 2024(26): 115-117 .  百度学术
百度学术3. 孙斐,潘瑾,周逸帆,孙静,冯靖祎. 医用耗材SPD模式的发展与应用现状. 中国医院建筑与装备. 2024(12): 86-94 .  百度学术
百度学术4. 刘婷,杨永,贺佳彦,陈丽. 医院在医用耗材供应链SPD项目建设与实践中的风险管控. 医学信息. 2023(15): 96-99 .  百度学术
百度学术5. 马晓峰,严刚林,黄蓉. SPD精益化模式优化医用耗材仓储管理的信息化建设. 中国医药导报. 2023(28): 168-171 .  百度学术
百度学术其他类型引用(0)
-





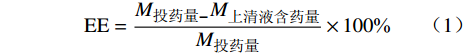

 下载:
下载:
 下载:
下载: