-
氧气是生命活动的基本物质,在机体内主要参与能量代谢过程。作为一种至关重要的生命物质,氧气在多个层面影响着机体,甚至可以通过多种渠道影响基因[1]。Kirmes等的研究表明:在缺氧条件下,细胞在全基因组水平上会产生结构变化,染色质会发生聚集现象[2]。机体缺氧时,通过氧化呼吸链产生过多的活性氧簇(ROS),包括超氧阴离子、过氧化氢、羟自由基等。ROS不仅可以直接损伤脂质、蛋白质及核酸等生物大分子,还可以通过Fas/FasL、TNF-α/TNFRl、MAPK等信号通路诱导细胞凋亡[3-4]。目前,针对缺氧的防治,西药主要有碳酸酐酶抑制剂、糖皮质激素、茶碱等,中药较为成熟的有藏药红景天,胡黄连、黄芪等也被认为具有一定的抗缺氧损伤的能力[5]。乙酰唑胺作为FDA认可的唯一一种防治急性缺氧的药物,更多的是用来治疗急性缺氧,且其存在过敏反应、四肢麻木、疲劳、困倦等不良反应,肝肾功能异常的人不宜使用[6-8]。藏药红景天目前已被高原边防部队作为防治高原缺氧的常规药物。大部分学者认为红景天可以通过抑制氧化应激、抗凋亡、保护神经细胞等方式治疗缺氧性损伤,但其主要活性成分的抗缺氧作用机制仍不清楚[9]。作为预防用药,红景天需要提前7~15 d服用,才能较好起到提高抗缺氧能力的作用,疗程较长。目前,针对缺氧的治疗仍以给予高浓度氧气最为直接有效,而对于提高耐缺氧能力,目前尚无安全高效的药物。
毛裂蜂斗菜(Petasites tricholobuson)是菊科蜂斗菜属下的一种,在民间广泛用于消肿止痛、解毒祛瘀,治跌打损伤、毒蛇咬伤等。课题组前期实验已经证明,其醇提取物具有抗炎作用[10-12]。本实验通过观察PTB对小鼠存活时间、血清乳酸脱氢酶(LDH)活性和丙二醛(MDA)含量变化,对脑组织与心脏超氧化物歧化酶(SOD)和还原型谷胱甘肽(GSH)活性变化、脑组织病理变化,以及对大鼠肾上腺嗜铬细胞瘤细胞(PC12)制成糖氧剥夺模型(OGD)后存活率的影响,进一步探讨PTB的抗缺氧能力及可能的作用机制。
-
昆明种小鼠110只,雄性,SPF级,体质量23~25 g,合格证号:SCXK(京)2019-0010(斯贝福生物技术有限公司),饲养于清洁级动物房,人工照明模拟昼夜变化;PC12细胞(美国ATCC细胞库)。
-
蜂斗菜总内酯(自提):经高效液相色谱(HPLC)检测,蜂斗菜总内酯含量为74.8%,其中,内酯B、内酯Ⅲa、内酯Ⅳa的含量分别为13.4%、46.8%、14.6%,各单体成分分子结构式均已明确[13];诺迪康胶囊(规格:0.28 g/粒,西藏诺迪康药业股份有限公司,批号:200402);0.9%氯化钠溶液(500 ml,济民健康管理股份有限公司,批号:S200516E52);LDH试剂盒、GSH试剂盒、总蛋白定量测试盒、MDA试剂盒、SOD测试盒(南京建成生物工程研究所),规格:96T,批号:20210914、20211012、20210603、20211012、20211012;MTT(3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide)(美国Sigma 公司);高糖DMEM培养基、胎牛血清(美国Hyclone公司);混合气体(95%N2,5%CO2)(上海成功气体工业有限公司);CO2气体(海军军医大学热卫系)。
-
全自动酶标仪、1300 SERIES A2型超净台(美国Thermo科技公司);SHIMADZU LC-20高效液相色谱仪(岛津有限公司);Pico17高速离心机(ThermoFisher科技公司);L-420低速离心机(湘仪离心机仪器有限公司);Tissuelyser-48多样品组织研磨机(上海净信实业发展有限公司);DHG.9.23A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);DK-8D型电热恒温水槽(上海一恒科技有限公司)。
-
小鼠适应性饲养3 d,常规进食,自由饮水。根据预实验结果,采用随机数字法将小鼠分为空白对照组、模型组、阳性对照组(诺迪康280 mg/kg)、PTB低剂量组(20 mg/kg)、PTB中剂量组(40 mg/kg)、PTB高剂量组(80 mg/kg),其中空白对照组10只小鼠,其余各组20只小鼠。适应性饲养3 d后,按照小鼠质量10 ml/kg灌胃给药,连续给药3 d,空白对照组和模型组给予等体积的溶剂CMC-Na。本实验过程遵守动物福利、动物保护和伦理原则及相关规定。
-
第3天给药1 h后,除空白对照组外,取其余每组小鼠各10只分别置于125 ml磨口广口瓶中(瓶内放置5 g钠石灰,用于吸附CO2),瓶口涂抹凡士林保证绝对密封,自盖上瓶盖开始计时,以小鼠呼吸心跳停止为小鼠窒息死亡判定依据,记录并统计各组小鼠死亡时间。
-
根据小鼠常压密闭缺氧实验结果,将小鼠最短死亡时间(12 min)设为时间节点。除空白对照组外,将其余5组剩余小鼠分别置于125 ml磨口广口瓶中(瓶内放置5 g钠石灰,用于吸附CO2),瓶口涂抹凡士林保证绝对密封。自盖上瓶盖开始计时,到达时间节点后立即将小鼠取出,眼眶取血,血液样品放置于冰盒中保存。空白对照组于常压未缺氧条件下直接眼眶取血。各组小鼠眼眶取血后,立即脱颈处死,解剖并小心分离出脑组织,于冰盘上快速分离出右侧大脑半球,置4%多聚甲醛固定液中。左侧大脑半球保存在清洁干燥离心管中。脑组织固定后,解剖分离出小鼠心脏,用生理盐水充分灌洗后,用清洁滤纸吸干。所有样品均放置于液氮中临时保存。
-
将各组小鼠右侧大脑半球切片制作成石蜡切片,分别通过脱蜡、染色、分化、封片等步骤,进行HE和尼氏染色。染色切片制作完成后进行显微镜镜检,图像采集分析。
-
将取得的血液样品进行离心处理(4000 r/min,10 min),取上清液进行LDH活性、MDA含量的测定。将取得的心脏、左侧大脑半球称重,按照组织与生理盐水1∶9的比例,低温条件下制成10%的组织匀浆,进行SOD、GSH活性的测定。MDA含量、LDH活性、SOD活性、GSH活性的检测按照试剂盒说明书进行。
-
将PC12细胞置于CO2细胞培养箱内培养(95%空气和5%CO2,37 ℃,饱和湿度),培养基由90%高糖DMEM和10%胎牛血清(FBS)组成,每3 d更换新的培养基。当细胞的生长达到80%~90%汇合度时,对细胞进行传代培养。细胞传代时,先弃去培养瓶内的培养基,用磷酸盐缓冲液(PBS)冲洗2次,加入不含EDTA的胰酶消化细胞,按照1:4的比例进行传代分瓶培养。待细胞生长状态稳定处于对数期生长时进行后续实验。
-
称取适量蜂斗菜总内酯,加入无糖培养基配制成2000 ng/ml的溶液。按照比例,用无糖培养基将液体分别稀释为200 ng/ml和20 ng/ml的溶液。
-
待铺于细胞培养板内的细胞汇合度达到80%且生长状态良好时,将原有培养基弃去,PBS冲洗2次后,模型组加入无糖培养基,给药组加入含有不同浓度PTB(20 、200、2000 ng/ml)的无糖培养基,置于缺氧装置(95% N2,5% CO2)内缺氧2 h后,将该装置移入37 ℃的恒温培养箱继续孵育12 h形成OGD模型。空白对照组照常更换培养基一次,在正常细胞培养环境下培养。
-
将状态良好的细胞以5×104个/ml的密度铺于96孔细胞培养板,MTT法检测细胞存活率。MTT实验检测开始时,在各细胞培养孔中加入20 μl MTT溶液(5 mg/ml, 即0.5%MTT),继续在37 ℃细胞培养箱内孵育4 h。弃细胞上清液,每个细胞孔加入150 μl DMSO溶液,摇床上低速震荡10 min,使沉积在细胞内的结晶充分溶解。在酶标仪490 nm处测量各孔的吸光值(A值)。根据各组所得的A值,计算细胞的存活率,其中,未经OGD处理的空白组细胞的存活率均一化为100%,其余各组细胞的存活率是相对于空白组比值的百分比。细胞的存活率=(A值实验组/ A值空白组)×100%。
-
采用SPSS21.0统计分析软件处理。计量资料数据以(
$\bar{x}$ ±s)表示,组间比较采用单因素方差分析,当P<0.05时,表示差异有统计学意义。 -
常压缺氧条件下,模型组小鼠的平均存活时间为859.5 s。与模型组相比,阳性对照组(诺迪康)小鼠的存活时间延长了131.9 s(P<0.05),PTB低、中、高剂量均能显著延长小鼠的存活时间(P<0.05,P<0.01),结果见表1。
表 1 PTB对常压缺氧小鼠存活时间的影响(n=10,
$\bar x $ ±s)组别 给药剂量(mg/kg) 存活时间(t/s) 模型组 − 859.5±84.56 诺迪康组 280 991.4±140.7* PTB低剂量组 20 1023±142.7** PTB中剂量组 40 980±120.5* PTB高剂量组 80 1055±251.9* *P<0.05,**P<0.01,与模型组比较。 -
与空白对照组相比,模型组的LDH活力明显增高(P<0.01);与模型组相比,阳性对照组(诺迪康)、PTB中、高剂量组LDH活力降低至空白组水平(P<0.05);低剂量组的LDH活力较模型组有所降低,但没有统计学差异(P>0.05),见表2。
表 2 PTB对常压缺氧小鼠血清LDH活力和MDA含量的影响(n=10,
$\bar x $ ±s)组别 给药剂量(mg/kg) LDH(U/L) MDA(nmol/ml) 空白组 − 1052±59.49 67.04±12.63 模型组 − 1280±206.6## 204.3±58.42## 诺迪康组 280 1092±70.16* 132.5±54.02* PTB低剂量组 20 1153±82.80 138.3±32.50* PTB中剂量组 40 1097±100.5* 152.8±48.90* PTB高剂量组 80 1059±187.8* 172.7±60.54 *P<0.05,与模型组比较;##P<0.01,与空白组比较。 与空白对照组相比,模型组的MDA含量显著增高(P<0.01);与模型组相比,阳性对照组(诺迪康)、PTB低、中剂量组MDA含量降低(P<0.05);PTB高剂量组MDA含量有所降低,但没有统计学差异(P>0.05),见表2。
-
在脑组织中,与空白对照组相比,模型组的GSH活力降低(P<0.01);与模型组相比,阳性对照组(诺迪康)的GSH活力有所升高,但是没有统计学差异(P>0.05);与模型组相比,PTB低、中、高3个剂量组的GSH活力均显著升高(P<0.01),见表3。
表 3 PTB对常压缺氧小鼠脑组织和心脏GSH活力的影响(n=10,
$\bar x $ ±s)组别 给药剂量
(mg/kg)脑GSH
(μmol/g•prot)心脏GSH
(μmol/g•prot)空白组 − 44.17±8.672 9.123±2.906 模型组 − 31.99±5.528## 5.772±2.537# 诺迪康组 280 37.47±13.56 8.345±2.336* 低剂量组 20 43.38±10.46** 13.42±3.606** 中剂量组 40 47.57±8.106** 12.07±4.191** 高剂量组 80 50.36±17.18** 12.59±1.820** *P<0.05,**P<0.01,与模型组比较;#P<0.05,##P<0.01,与空白组比较。 在心脏中,与空白对照组相比,模型组的GSH活力降低(P<0.05);与模型组相比,阳性对照组(诺迪康)的GSH活力升高(P<0.05);与模型组相比,PTB低、中、高3个剂量组的GSH活力均显著升高(P<0.01),见表3。
-
在脑组织中,与空白对照组相比,模型组的SOD活力降低(P<0.05);与模型组相比,阳性对照组(诺迪康)的SOD活力变化没有统计学差异(P>0.05);与模型组相比,PTB低、中、高3个剂量组的SOD活力均显著升高(P<0.01),见表4。
表 4 PTB对常压缺氧小鼠脑组织和心脏SOD活力的影响(n=10,
$\bar x $ ±s)组别 给药剂量
(mg/kg)脑SOD
(U/mg•prot)心脏SOD
(U/mg•prot)空白组 − 71.75±19.92 100.7±13.16 模型组 − 58.06±4.552# 85.26±16.80# 诺迪康组 280 56.88±14.44 115.6±15.00** 低剂量组 20 68.98±10.70** 139.7±25.62** 中剂量组 40 80.27±18.47** 124.7±21.92** 高剂量组 80 79.60±21.02** 127.1±12.15** **P<0.01,与模型组比较;#P<0.05,与空白组比较。 在心脏中,与空白对照组相比,模型组的SOD活力降低(P<0.05);与模型组相比,阳性对照组(诺迪康)、PTB低、中、高3个剂量组的SOD活力均显著升高(P<0.01),见表4。
-
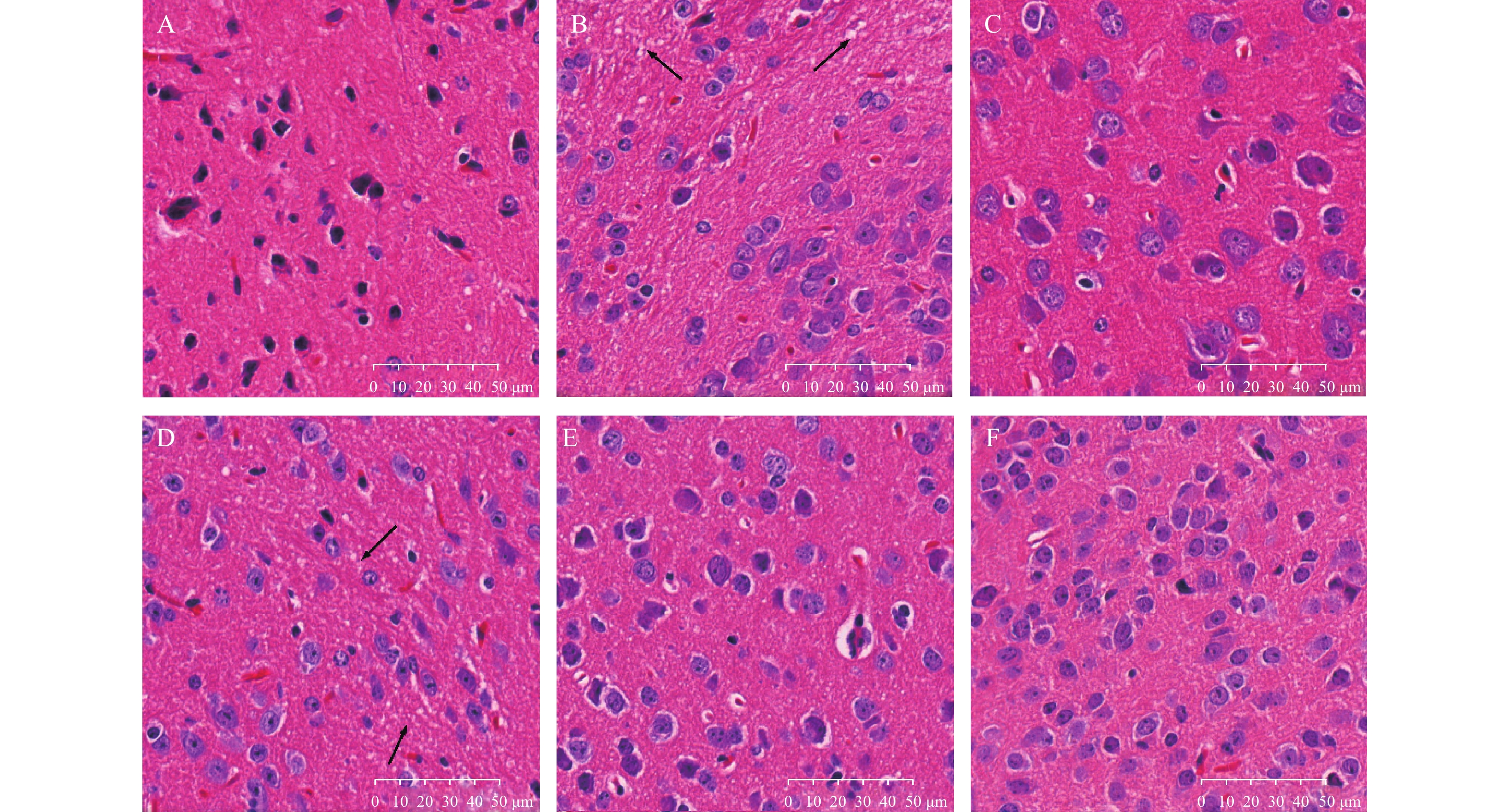
如图1所示,与空白对照组相比,模型组小鼠神经细胞排列明显紊乱,细胞之间存在大量空泡(箭头所示);与模型组相比,阳性对照组及PTB中、高剂量组的小鼠脑组织排列较整齐,细胞间空泡较少,神经纤维束的走行较为整齐统一。
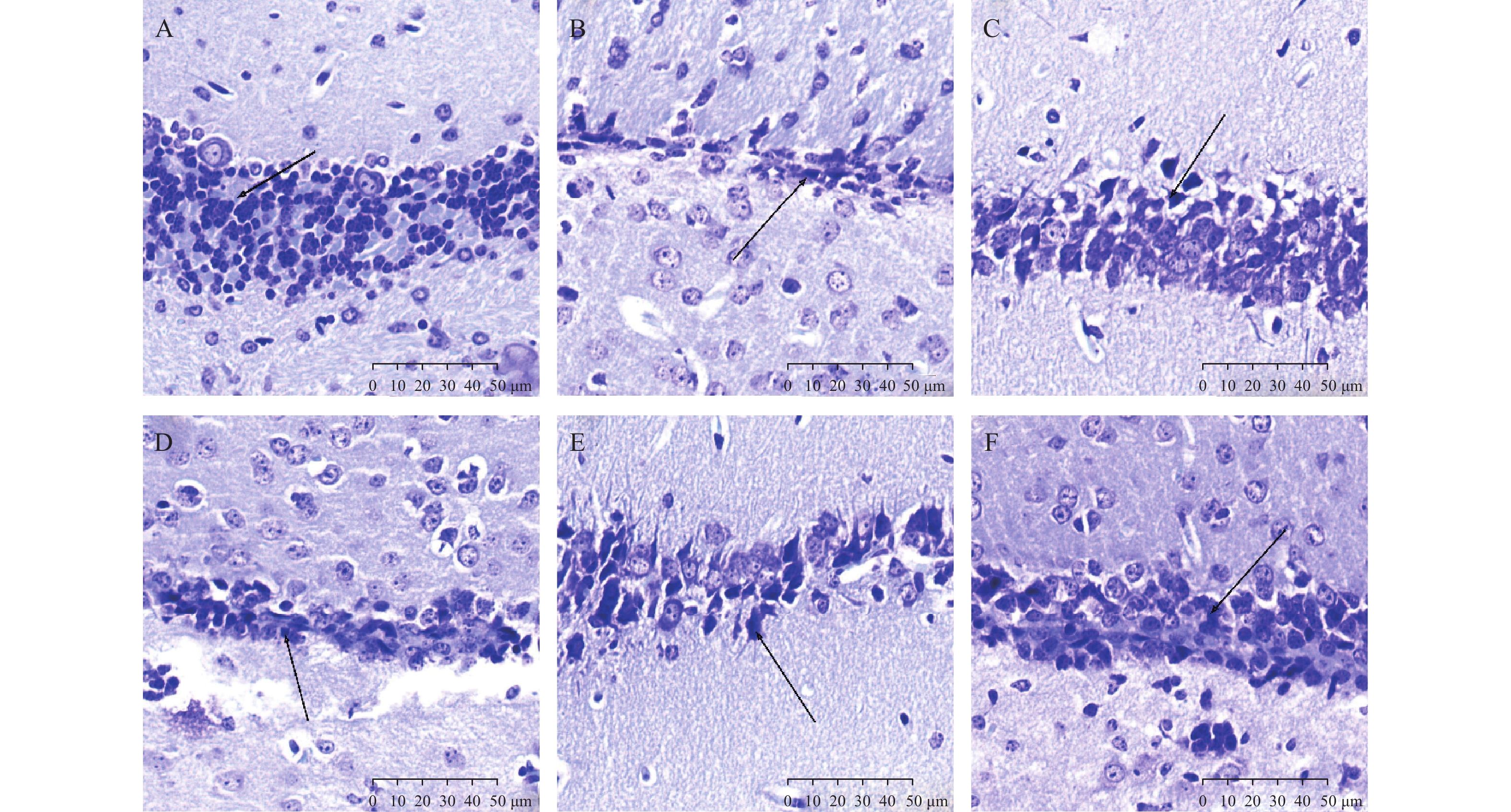
尼氏染色下,与空白对照组相比,模型组海马区尼氏小体(箭头所示)明显减少,海马区细胞排列紊乱;与模型组相比,阳性对照组及PTB各剂量组的尼氏小体明显增加,细胞排列规则,见图2。
-
如表5所示,空白组细胞存活率为100.00%,模型组细胞存活率下降至(37.26±3.80) %,与空白组相比存在非常显著性差异(P<0.001)。PTB在20、200、2000 ng/ml浓度下的细胞存活率分别为(46.08±4.91) %、(52.90±6.85) %、(61.09±3.53) %,各浓度组相对于OGD组均有显著性差异(P<0.01,P<0.001,P<0.001)。
表 5 PTB对常压缺氧的PC12细胞损伤存活率的影响(
$\bar x $ ±s)组别 样本数(个) 给药剂量(ng/ml) 存活率(%) 空白组 3 − 100.00±3.01 模型组 3 − 37.26±3.80### PTB低剂量组 3 20 46.08±4.91** PTB中剂量组 3 200 52.90±6.85*** PTB高剂量组 3 2000 61.09±3.53*** -
缺氧条件下,由于ATP代谢障碍、机体代谢增强、体内Ca2+浓度增加等原因,产生过量的氧自由基。氧自由基通过损伤生物膜、蛋白质、DNA和糖分子,影响细胞信号传导和细胞凋亡,对机体产生损伤[14-15]。
课题组前期通过建立减压缺氧模型,测定实验动物存活率、血糖、肝糖原、肌糖原、ATP、乳酸(LD)、LDH等指标,论证了PTB具有维持血糖稳定,提高机体主要脏器中的糖原以及ATP的含量,减少LD积蓄以及LDH的活性,改善机体能量代谢的作用[13]。本论文采用常压缺氧模型进一步检测了在缺氧条件下,PTB对实验动物体内SOD、GSH、LDH活性、MDA含量、脑组织病理改变、对OGD处理后细胞存活状态等指标的影响,进一步完善了其对缺氧实验动物的保护作用。SOD被认为是抗氧化系统的第一道防线,是一种能够专一清除氧自由基的酶。它通过降低氧化活性部位金属离子的活性,以两步快速反应使
${\rm{O}}^-_2$ 转变为H2O2和O2。H2O2再被过氧化氢酶还原成H2O[16-17]。GSH是一种非酶性抗氧化剂,通过其巯基氧化-还原态的转换,作为可逆的供氢体,和过氧化物及自由基结合,保护细胞膜中含巯基的蛋白质不被破坏[18]。在本实验中,PTB在低、中、高3个剂量下,均能显著增强缺氧小鼠心、脑组织中SOD、GSH的活性,提高机体清除氧自由基的能力,减轻缺氧损伤。脂质过氧化物(LPO)是人体内多聚不饱和脂肪酸和氧自由基结合后形成的。在缺氧条件下,LPO水平升高,机体细胞及细胞膜产生氧化反应,溶解细胞膜表面的磷脂,破坏细胞膜的生理结构[19]。LPO还能和细胞内的DNA、脂质、蛋白质形成复合物,刺激新陈代谢改变,导致细胞内信号传导的紊乱、功能障碍,甚至凋亡。MDA是LPO稳定的终产物[20]。LDH是生物体内氧化还原的重要酶系之一,它能可逆地催化乳酸氧化为丙酮酸。当机体缺氧时,主要参与葡萄糖的无氧代谢。LDH活性的升高是机体无氧酵解程度升高的重要提示之一[21]。在本实验中,PTB中、高剂量组小鼠的血清LDH含量较模型组相比明显降低,说明中、高剂量组小鼠的无氧酵解相对较少,反应出机体缺氧程度较轻。低、中剂量组小鼠的MDA含量较模型组相比明显降低,说明小鼠体内发生脂质过氧化反应相对较低。这说明PTB可以抑制缺氧条件下机体的脂质过氧化反应,改善机体缺氧程度。
行为学实验结果显示,PTB在各剂量下均可延长常压缺氧小鼠在密闭空间下的存活时间。脑组织HE染色和尼氏染色表明,PTB具有保护神经细胞,维持细胞形态及功能的作用。体外实验结果表明,PTB在20、200、2000 ng/ml浓度下均能够提高OGD诱导的PC12细胞损伤存活率,存在一定的剂量依赖性,说明PTB对神经细胞的损伤具有保护作用。
综上所述,蜂斗菜总内酯具有明显的提高小鼠耐缺氧能力的作用,其作用机制可能与清除氧自由基、抑制脂质过氧化反应、保护神经细胞结构和功能有关。相比于藏药红景天,蜂斗菜总内脂的用药量明显减少,可作为抗缺氧的天然药物,进一步研究其作用的通路机制。
Protective effects of the total bakkenolides from Petasites tricholobus on hypoxia mice under normobaric pressure
-
摘要:
目的 探讨蜂斗菜总内酯(PTB)对提高动物耐缺氧能力的作用。 方法 建立小鼠常压缺氧模型和PC12细胞氧糖剥夺模型(OGD),观察PTB对小鼠常压密闭空间下存活时间、血清乳酸脱氢酶(LDH)活性和丙二醛(MDA)含量,对脑组织与心脏超氧化物歧化酶(SOD)和还原型谷胱甘肽(GSH)的活性,以及对脑组织病理变化和细胞存活率的影响。 结果 PTB可以显著提高常压缺氧小鼠在密闭空间下的存活时间,提高机体SOD、GSH的活性,减少脂质过氧化物的产生,降低无氧酵解的程度,保护神经细胞的结构和功能,提高OGD处理后的细胞的存活率。 结论 PTB具有明显的提高小鼠耐缺氧能力的作用,其作用机制可能与清除氧自由基、抑制脂质过氧化反应、保护神经细胞结构和功能有关。 Abstract:Objective To investigate the protective effects of the total bakkenolides from P.tricholobus on improving hypoxia tolerance in mice. Methods Mice normobaric pressure hypoxia model and oxygen glucose deprivation model in PC12 cells were established, and the effects of PTB on survival time, serum lactate dehydrogenase (LDH) activity and malondialdehyde (MDA) content, brain and heart superoxide dismutase (SOD) and reduced glutathione (GSH) activities, brain tissue pathological changes and cell survival were observed. Results The total bakkenolides from P.tricholobus had prolonged the survival time of mice in confined spaces, increased the activity of SOD and GSH, reduced the production of lipid peroxidation, decreased the degree of anaerobic glycolysis, protected the structure and function of neural cells, and improved the survival rate of OGD-treated cells. Conclusion The total bakkenolides from P.tricholobus could promote the hypoxia tolerance in mice which might be related to scavenging oxygen free radicals, inhibiting lipid peroxidation reaction and protecting the structures and functions of nerve cells. -
Key words:
- Petasites.tricholobus /
- anti-hypoxia /
- oxygen free radicals /
- pathological dyeing /
- cell experiment
-
表 1 PTB对常压缺氧小鼠存活时间的影响(n=10,
$\bar x $ ±s)组别 给药剂量(mg/kg) 存活时间(t/s) 模型组 − 859.5±84.56 诺迪康组 280 991.4±140.7* PTB低剂量组 20 1023±142.7** PTB中剂量组 40 980±120.5* PTB高剂量组 80 1055±251.9* *P<0.05,**P<0.01,与模型组比较。 表 2 PTB对常压缺氧小鼠血清LDH活力和MDA含量的影响(n=10,
$\bar x $ ±s)组别 给药剂量(mg/kg) LDH(U/L) MDA(nmol/ml) 空白组 − 1052±59.49 67.04±12.63 模型组 − 1280±206.6## 204.3±58.42## 诺迪康组 280 1092±70.16* 132.5±54.02* PTB低剂量组 20 1153±82.80 138.3±32.50* PTB中剂量组 40 1097±100.5* 152.8±48.90* PTB高剂量组 80 1059±187.8* 172.7±60.54 *P<0.05,与模型组比较;##P<0.01,与空白组比较。 表 3 PTB对常压缺氧小鼠脑组织和心脏GSH活力的影响(n=10,
$\bar x $ ±s)组别 给药剂量
(mg/kg)脑GSH
(μmol/g•prot)心脏GSH
(μmol/g•prot)空白组 − 44.17±8.672 9.123±2.906 模型组 − 31.99±5.528## 5.772±2.537# 诺迪康组 280 37.47±13.56 8.345±2.336* 低剂量组 20 43.38±10.46** 13.42±3.606** 中剂量组 40 47.57±8.106** 12.07±4.191** 高剂量组 80 50.36±17.18** 12.59±1.820** *P<0.05,**P<0.01,与模型组比较;#P<0.05,##P<0.01,与空白组比较。 表 4 PTB对常压缺氧小鼠脑组织和心脏SOD活力的影响(n=10,
$\bar x $ ±s)组别 给药剂量
(mg/kg)脑SOD
(U/mg•prot)心脏SOD
(U/mg•prot)空白组 − 71.75±19.92 100.7±13.16 模型组 − 58.06±4.552# 85.26±16.80# 诺迪康组 280 56.88±14.44 115.6±15.00** 低剂量组 20 68.98±10.70** 139.7±25.62** 中剂量组 40 80.27±18.47** 124.7±21.92** 高剂量组 80 79.60±21.02** 127.1±12.15** **P<0.01,与模型组比较;#P<0.05,与空白组比较。 表 5 PTB对常压缺氧的PC12细胞损伤存活率的影响(
$\bar x $ ±s)组别 样本数(个) 给药剂量(ng/ml) 存活率(%) 空白组 3 − 100.00±3.01 模型组 3 − 37.26±3.80### PTB低剂量组 3 20 46.08±4.91** PTB中剂量组 3 200 52.90±6.85*** PTB高剂量组 3 2000 61.09±3.53*** -
[1] 侯春英, 卢多. 氧气对基因组的结构与化学影响[J]. 药学学报, 2020, 55(8):1744-1753. [2] KIRMES I, SZCZUREK A, PRAKASH K, et al. A transient ischemic environment induces reversible compaction of chromatin[J]. Genome Biol,2015,16:246. doi: 10.1186/s13059-015-0802-2 [3] 刘思亮, 李燕, 于巍, 等. 活性氧簇在脑缺血-再灌注损伤中的损伤与保护作用[J]. 现代生物医学进展, 2019, 19(5):969-974. [4] SU L J, ZHANG J H, GOMEZ H, et al. Reactive oxygen species-induced lipid peroxidation in apoptosis, autophagy, and ferroptosis[J]. Oxid Med Cell Longev,2019,2019:5080843. [5] 刘凤英, 马海英. 高原环境脑损伤与药物治疗研究进展[J]. 国际药学研究杂志, 2019, 46(6):418-422. [6] 黄海涛, 李楠. 高原反应的药物预防与治疗[J]. 武警医学, 2017, 28(12):1282-1285. doi: 10.3969/j.issn.1004-3594.2017.12.031 [7] 洪丽, 申宝德, 王镜, 等. 抗高原反应的药物研究进展[J]. 中国医院用药评价与分析, 2021, 21(1):125-128. [8] KAYSER B, DUMONT L, LYASAKOWSKI C, et al. Reappraisal of acetazolamide for the prevention of acute mountain sickness: a systematic review and meta-analysis[J]. High Alt Med Biol,2012,13(2):82-92. doi: 10.1089/ham.2011.1084 [9] 张瑞霞. 红景天治疗缺氧性疾病的相关机制[J]. 中国高原医学与生物学杂志, 2020, 41(2):134-138. [10] 王玉亮, 郭美丽, 张戈, 等. 毛裂蜂斗菜根茎的化学成分及抗炎活性[J]. 第二军医大学学报, 2006, 27(11):1210-1213. doi: 10.3321/j.issn:0258-879X.2006.11.014 [11] 李余先, 王燕, 郭美丽. 蜂斗菜的化学成分研究[J]. 第二军医大学学报, 2010, 31(7):779-781. [12] 谢曜宇, 李余先, 孙一鸣, 等. 蜂斗菜根茎中的一个新倍半萜成分及其抗缺氧活性[J]. 药学学报, 2016, 51(8):1285-1289. [13] 王业晴, 谢曜宇, 张慧, 等. 蜂斗菜总内酯对动物高原缺氧保护作用的研究[J]. 药学实践杂志, 2017, 35(2):116-120,125. doi: 10.3969/j.issn.1006-0111.2017.02.005 [14] 张洁, 袁东亚, 李文华, 等. 氧自由基与高原病研究进展[J]. 医学综述, 2011, 17(22):3384-3386. doi: 10.3969/j.issn.1006-2084.2011.22.009 [15] ZHANG J X, WANG X L, VIKASH V, et al. ROS and ROS-mediated cellular signaling[J]. Oxidative Med Cell Longev,2016,2016:4350965. [16] 袁牧, 王昌留, 王一斐, 等. 超氧化物歧化酶的研究进展[J]. 中国组织化学与细胞化学杂志, 2016, 25(6):550-558. doi: 10.16705/j.cnki.1004-1850.2016.06.015 [17] YOUNUS H. Therapeutic potentials of superoxide dismutase[J]. Int J Heal Sci,2018,12(3):88-93. [18] 袁平戈, 张大志. 还原型谷胱甘肽的作用机制及临床应用[J]. 药品评价, 2006, 3(5):385-390. doi: 10.3969/j.issn.1672-2809.2006.05.022 [19] 黄文杰, 马建林. 脂质过氧化物临床研究进展[J]. 医学新知杂志, 2019, 29(1):78-79,82. [20] GĘGOTEK A, SKRZYDLEWSKA E. Biological effect of protein modifications by lipid peroxidation products[J]. Chem Phys Lipids,2019,221:46-52. doi: 10.1016/j.chemphyslip.2019.03.011 [21] ADEVA-ANDANY M, LÓPEZ-OJÉN M, FUNCASTA-CALDERÓN R, et al. Comprehensive review on lactate metabolism in human health[J]. Mitochondrion,2014,17:76-100. doi: 10.1016/j.mito.2014.05.007 -





 下载:
下载: