-
类风湿关节炎(RA) 是一种以滑膜关节病变为主的慢性全身性、进行性自身免疫性疾病。疾病最早开始表现是滑膜炎,继而引发骨损伤及侵蚀,直至骨关节畸形及功能障碍[1-2],RA动物模型中广泛使用的是佐剂性关节炎模型和胶原诱导的关节炎模型。佐剂性关节炎又称弗氏佐剂性关节炎,是建立免疫性关节炎动物模型的基本方法[3]。RA发病机制还不明确,目前缺乏理想的治疗方案。临床上治疗RA主要是非甾体类抗炎药、抗风湿药物及糖皮质激素等[4],但往往因为药物的不良反应、价格等因素,难以坚持长期服药。
茵连痛风颗粒是上海中医药大学附属岳阳中西医结合医院院内制剂,由菌陈、连钱草、伸筋草组成,具有清热利湿、通络的功效。其处方是依据沪上著名夏氏外科传人夏涵教授数年临床经验方制成,用于治疗痛风性关节炎,临床具有显著疗效[5]。本实验通过弗氏完全佐剂诱导大鼠关节炎模型,观察茵连痛风颗粒对佐剂性关节炎的影响,为茵连痛风颗粒的临床应用提供科学依据。
-
茵连痛风颗粒(上海中医药大学附属岳阳中西医结合医院药剂科自制,沪药制字:Z05050342,批号:1811001);塞来昔布胶囊(辉瑞制药有限公司,批号:AN8171);弗氏完全佐剂(Sigma 公司); IL-10、IL-4、前动力蛋白(PK1、2)酶联免疫分析试剂盒均购自上海威奥生物科技有限公司。
-
SD 大鼠,雄性,体重(160±10)g,[上海斯莱克实验动物有限责任公司,实验动物生产许可证号:SCXK(沪)2017-0005]。
-
酶标仪(型号:DENLEY DRAGON Wellscan MK3,公司:Thermo);离心机(型号:TGL-168,公司:上海安亭科学仪器厂);数字显示隔水式电热恒温培养箱(型号:PYX-DHS,公司:上海跃进医疗器械厂);自制刻度软尺。
-
将48只SD雄性大鼠适应性饲养1周后,随机分为6组,每组8只。分别为正常组,模型组,塞来昔布阳性组(0.017 g/kg),茵连痛风颗粒高剂量组(15.4 g/kg),茵连痛风颗粒中剂量组(7.7 g/kg),茵连痛风颗粒低剂量组(3.8 g/kg)。除正常组外,其余各组大鼠右后足皮内注射弗氏完全佐剂 0.1 ml/足。注射弗氏完全佐剂后第8天,按照如上剂量灌胃给予相应浓度的受试药品,正常组和模型组给予等体积蒸馏水,每天给药1次,连续给药28 d。
模型鉴定:造模后各组大鼠的皮肤肿胀,皮肤温度及踝关节肿胀度与正常组之间是否有统计学差异,是模型成功与否的判定标准。
-
分别在大鼠给药后7、14、28 d记录大鼠四肢关节病变程度,采用关节炎指数(AI)评分分级法评价大鼠病变程度。关节炎指数分为 5级(0~4分):0分,关节无红肿;l分,单个趾关节明显红肿;2分,发红并(或)肿胀关节>l个;3分,整个足及跖关节明显红肿;4分,严重的关节肿胀或畸形。根据未注射佐剂的余下肢体的病变程度累计积分,计算出AI(各个关节的积分累计起来,即为每只大鼠的 AI)。
-
分别于造模前、给药后1 d、以及每间隔8 d,用刻度软尺测量大鼠右后踝关节周长,并观察各组动物关节病变情况。按照下列公式计算踝关节肿胀率:踝关节肿胀率=(致炎后踝关节周长-致炎前踝关节周长) /致炎前踝关节周长×100% 。
-
末次给药后2 h,于大鼠左足趾皮下注射50 μl 2.5%甲醛,观察1~10 min(第I时相)和10~30 min(第II时相)的行为反应。评分标准:第I时相抬足1次,计1分;第II时相舔足、咬足或抖足1次,计2分。计算30 min内的总得分。
-
末次给药后禁食、禁水12 h,大鼠注射10%水合氯醛(0.3 ml/100 g)进行麻醉,腹主动脉取血,离心取血清,用ELISA 法检测血清中IL-10、IL-4、PK1、PK2含量; 各组大鼠取左侧足掌肉垫,福马林固定,乙醇梯度脱水,石蜡包埋、切片和HE染色,病理组织学观察。
-
采用 SPSS 21.0 统计软件进行分析,实验数据以(
$ \bar x \pm s $ )表示,组间比较采用单因素方差分析。 -
造模前各组大鼠毛色光亮,动作敏捷,精神状态和饮食均良好。模型组大鼠在造模后,自主活动减少、足底局部出现红肿,后期整只爪和关节均有不同程度肿胀,最初表现为足部肿胀,而后肿胀向上到达踝关节,肿胀部位皮肤发红,温度升高。随着时间延长,大鼠食欲减退,毛色暗黄,且运动功能逐渐减退。给予茵连痛风颗粒高、中、低剂量组及塞来昔布阳性组大鼠精神状态有所好转,关节肿胀度、食欲等有不同程度的缓解。表1结果表明,与模型组比较,给药7、14、28 d后,茵连痛风颗粒高、中剂量组和阳性组大鼠关节炎指数显著降低(P<0.01)。
表 1 茵连痛风颗粒对大鼠关节炎指数的影响 (
$ \bar x \pm s $ ,n=8)组别 剂量(g/kg) 给药后关节炎指数 第7天 第14天 第28天 正常组 — 0.00±0.00 0.00±0.00 0.00±0.00 模型组 — 6.37±0.52## 9.63±0.74## 8.38±0.92## 阳性组 0.017 5.63±0.51** 6.50±0.93** 4.38±0.52** 高剂量组 15.4 5.50±0.53** 7.13±0.0.83** 4.13±0.64** 中剂量组 7.7 5.75±0.46** 8.13±0.0.83** 5.63±0.52** 低剂量组 3.8 5.88±0.35* 9.13±0.81 8.13±0.74 *P<0.05,**P<0.01,与模型组比较;##P<0.01,与正常组比较。 -
表2结果显示,与同期正常组比较,模型组在给药第9天时肿胀率达峰值, 17d开始,肿胀逐日减轻,给药第9天开始,阳性组和茵连痛风颗粒高剂量组足肿胀与模型组比较,肿胀明显减轻,有显著统计学差异(P<0.01);在给药第25、28天,茵连痛风颗粒中剂组与模型组有显著性差异(P<0.05),茵连痛风颗粒低剂组无明显差异。结果显示了茵连痛风颗粒对佐剂性关节炎大鼠原发足踝关节肿胀有剂量依赖性抑制作用。
表 2 茵连痛风颗粒对大鼠踝关节肿胀率的影响 (
$ \bar x \pm s $ ,n=8)组 别
踝关节周长(l/cm)给药后踝关节肿胀率(%) 第1天 第9天 第17天 第25天 第28天 正常组 2.24±0.05 2.77±0.71 3.36±1.87 3.56±4.70 3.94±6.89 4.31±7.95 模型组 2.26±0.06 28.75±6.36## 30.09±8.24## 26.51±10.43## 25.44±12.90## 23.31±13.26## 阳性组 2.27±0.08 27.00 ±0.00 22.63±1.77** 20.61±1.45** 19.33±4.31** 18.45±4.67** 高剂量 2.22±0.05 27.54 ±1.03 23.85±1.56** 20.01±0.04** 18.14±1.52** 17.85±2.40** 中剂量 2.24±0.06 28.24 ±0.67 28.68±0.92 25.19±0.88 22.26±1.52* 21.85±2.40* 低剂量 2.28±0.07 29.48 ±0.21 29.49±2.23 26.05±0.99 25.01±0.32 24.10±0.28 *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与正常组比较。 -
与模型组比较,在I时相和II时相,阳性组和茵连痛风颗粒高、中、低剂量组可显著降低甲醛致痛分值(P<0.01),表明茵连痛风颗粒具有很好的镇痛作用(表3)。
表 3 茵连痛风颗粒对大鼠甲醛致痛的影响 (
$ \bar x \pm s $ ,n=8)组 别 剂量 (g/kg) 甲醛致痛分值 1~10 min(Ⅰ时相) 10~30 min(Ⅱ时相) 正常组 — 2.38±0.52 1.38±0.52 模型组 — 33.63±1.41## 14.88±1.64## 阳性组 0.017 11.38±1.06** 3.50±0.93** 高剂量组 15.4 12.13±0.99** 3.25±1.04** 中剂量组 7.7 16.00±1.60** 5.25±0.89** 低剂量组 3.8 19.38±1.19** 6.50±1.20** **P<0.01;与模型组比较; ##P<0.01,与正常组比较。 -
模型组大鼠IL-10,IL-4与正常组相比显著降低(P<0.01),炎性反应较明显;茵连痛风颗粒各组和阳性组均能升高IL-10,IL-4水平。同时,模型组大鼠 PK1、PK2水平与正常组相比显著升高(P<0.01),阳性组和茵连痛风颗粒各组均能降低两者水平,与模型组比较有显著差异 (P<0.01),其中,茵连痛风颗粒高剂量组更明显(表4)。
表 4 茵连痛风颗粒对大鼠血清IL-4、IL-10、PK1、PK2的影响 (
$ \bar x \pm s $ ,n=8)组别 剂量 (g/kg)
IL-4
IL-10
PK1
PK2正常组 — 79.49±4.38 97.07±2.97 491.76±8.56 926.24±25.38 模型组 — 59.89±3.45## 20.99±2.78## 706.31±67.83## 1455.40±147.81## 阳性组 0.017 139.69±13.78** 98.94±6.72** 567.10±20.58** 1099.60±63.63** 高剂量组 15.4 101.45±7.05** 90.36±5.43** 365.49±27.65** 656.07±194.68** 中剂量组 7.7 95.60±4.52** 82.75±8.49** 433.91±22.29** 866.73±21.57** 低剂量组 3.8 72.50±3.09** 78.15±5.47** 529.20±12.79** 1015.51±18.36** **P<0.01,与模型组比较; ##P<0.01,与正常组比较。 -
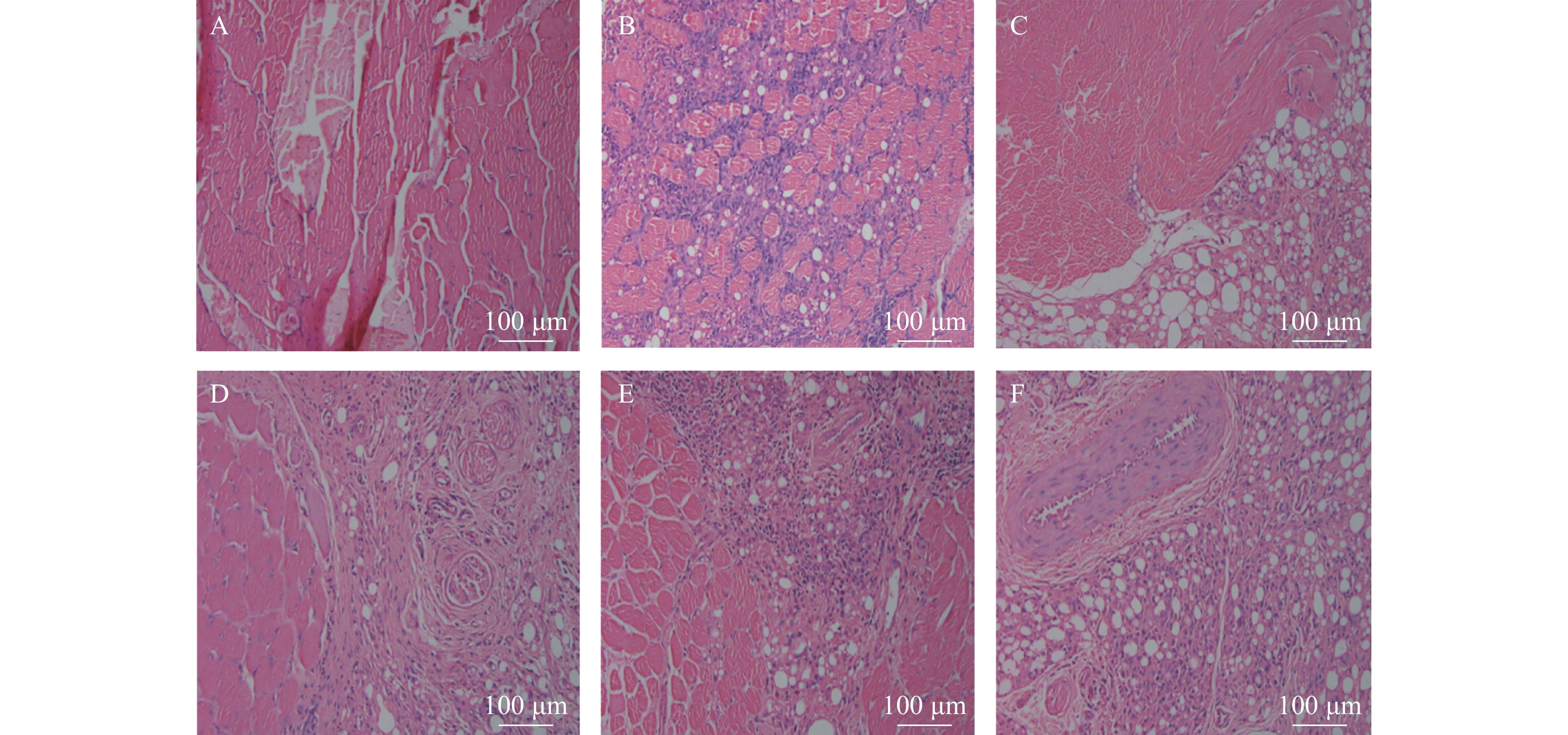
由图1可见,正常对照组足趾肉垫无炎症细胞浸润,而模型组可见大量淋巴细胞浸润。塞来昔布组可见淋巴细胞浸润程度的大幅度降低,而茵连痛风颗粒高、中、低剂量组均可降低淋巴细胞浸润,而以茵连痛风颗粒高剂量组最为显著。
-
类风湿关节炎在中医归属“痹症”范畴,治疗以祛风除湿、散寒通络、扶正固本、清热解毒为主[7]。茵连痛风颗粒有茵陈、连钱草、伸筋草三味药材组成。茵陈作为君药,具有清利湿热、芳香舒脾、透表畅气之效;臣药连钱草,取其消石之功,防止痛风性尿路结石的产生,具有利湿通淋、清热解毒、散瘀消肿之功效;佐药伸筋草具有祛风除湿、舒筋活血之效,为治痹痛拘挛及伤损瘀肿之要药,配伍茵陈可以增强该复方利湿通络的作用。该方配伍符合中医理论对类风湿性关节炎的认识[8]。
弗氏佐剂关节炎动物模型是经典的类风湿关节炎模型,与类风湿性关节炎模型的病因、病症更接近。它能较为真实地反映类风湿关节炎的病理进程,与痛风性关节炎同属中医 “痹证”“白虎历节风”范畴,而且制备方法简便、易重复。常用于关节炎药物的药效评估[9]。IL-4、IL-10细胞因子在类风湿性关节炎患者中,起到十分重要的作用。这类细胞因子与滑膜炎性反应、增生及关节变形有着密切的关系。PK信号通路是近年新发现的调节通路,包括两种结构上关联的小分子肽PK1和PK2及相应的G蛋白偶联受体PK(PKR1和PKR2),PKs及其受体PKRs广泛分布在许多人体组织中。在免疫细胞中参与炎症发生和疼痛传递的重要环节,如PK2参与免疫调节,诱导骨髓细胞分化为单核细胞系和巨噬细胞系,并通过激活单核细胞、巨噬细胞和树突状细胞上的 PKRs,释放IL-1、IL-6、TNF-a等炎性细胞因子,触发和维持炎性疼痛,调节免疫炎症反应[10-11]。研究发现在前动力蛋白信号通路中加入PKRs激动剂可以显著降低IL-10和IL-4生成[12]。损伤组织中释放的PKs是免疫-炎症反应的一种自分泌或旁分泌的调节剂,能够刺激神经元中PKRs而增强伤害性感受器的敏感性,说明PKs信号通路在调节伤害性感受阈方面发挥重要功能,因此阻断PKs信号通路是目前治疗炎性疼痛的新策略[11]。然而,关于PK信号通路在中药镇痛方面的研究报道较少,其干预中药镇痛的具体机制有待进一步研究证实。本实验结果显示,茵连痛风颗粒可明显减轻RA大鼠足踝关节肿胀,按照人和大鼠之间的体表面积换算成大鼠的给药中剂量,并设置高、中、低3个剂量组。以高剂量组改善最为明显,并呈现剂量依赖性。同时,病理结果显示,茵连痛风颗粒高中低剂量组均可降低淋巴细胞浸润,以茵连痛风颗粒高剂量组最为显著。其作用机制可能是通过PK信号通路抑制PK1、PK2分泌,以及促进细胞因子IL-4、IL-10等分泌达到抗类风湿性关节炎的作用。为茵连痛风颗粒作用机制的阐明打下了基础。这些研究结果表明,茵连痛风颗粒对佐剂关节炎具有明显抑制作用,暗示其对类风湿关节炎的治疗前景,作用机制有待进一步研究。
Anti-inflammatory and analgesic study of Yinlian Tongfeng granules on adjuvant arthritis rats
-
摘要:
目的 考察茵连痛风颗粒对佐剂性关节炎大鼠的缓解作用。 方法 建立弗氏完全佐剂模型,48只大鼠随机分为正常组、模型组、茵连痛风颗粒高、中、低剂量组(15.4、7.7、3.8 g/kg),用药物干预后,测定大鼠关节炎指数、踝关节肿胀率、甲醛致痛分值,用ELISA检测IL-4、IL-10、前动力蛋白(PK1,PK2)含量。观察大鼠足趾肉垫病理变化。 结果 与模型组比较,茵连痛风颗粒组可显著抑制大鼠踝关节肿胀,降低甲醛致痛反应(P<0.01),明显升高抑炎因子IL-4、IL-10 含量(P<0.01),降低PK1、PK2含量(P<0.01);缓解足趾水肿和淋巴细胞浸润。 结论 茵连痛风颗粒对佐剂关节炎具有明显抑制作用,暗示其对类风湿关节炎具有一定的治疗前景。 Abstract:Objective To investigate the relieving effect of Yinlian Tongfeng granules on adjuvant arthritis rats. Methods A complete Freund adjuvant model was built for this study. 48 rats were randomly divided into control group, model group, Yinlian Tongfeng granules high, medium and low dose group (15.4g/kg, 7.7g/kg, 3.8g/kg). After the drug intervention, arthritis index, ankle swelling rate, formaldehyde induced pain score were recorded. Elisa method was used to detect IL-4, IL-10 and the content of PK1, PK2. The pathological changes of toe pad in rats were observed. Results Compared with the model control group, Yinlian Tongfeng granules groups significantly inhibited the ankle swelling, reduced the pain reaction caused by formaldehyde (P<0.01), significantly increased the content of anti-inflammatory factors IL-4 and IL-10 (P<0.01), and decreased the content of PK1 and PK2 (P<0.01). Toe edema and lymphocyte infiltration were alleviated. Conclusion Yinlian Tongfeng granules have a significant inhibitory effect on adjuvant arthritis, suggesting that it has a potential therapeutic application for rheumatoid arthritis. -
Key words:
- Yinlian Tongfeng granules /
- adjuvant arthritis /
- rheumatoid arthritis /
- cytokines
-
随着人类预期寿命的延长,人口老龄化问题日趋严重,阿尔兹海默症等神经退行性疾病的发病率也大幅上升[1]。学习记忆障碍作为阿尔兹海默症的主要临床表现之一,贯穿阿尔兹海默症疾病发展的全过程,并呈进行性加重,严重降低患者的生活质量,成为亟待解决的公共卫生问题[2]。海龙(Syngnathus)系为海龙科动物刁海龙Solenognathus hardwickii(Gy)、尖海龙Syngnathoides biaculeatus(Bloch)、拟海龙Syngnathus acus Linnaeus的干燥体,具有温肾壮阳、散结消肿的作用[3]。现代研究表明海龙富含多种脂肪酸、氨基酸以及甾体化合物,具有抗衰老、抗骨质疏松、性激素样等药理作用[4]。DHA作为海龙脂肪酸的重要成分之一,具有促进神经元细胞生长发育、抑制神经炎症及氧化应激的作用[5]。目前尚无治疗阿尔兹海默症的特效药物,海龙在改善学习记忆损伤方面的研究亦属空白。本研究拟探讨海龙对D-半乳糖诱导衰老小鼠学习记忆损伤的保护作用,并测定海龙中DHA含量,初步阐明海龙改善学习记忆损伤的作用机制。
1. 材料
1.1 实验动物
3月龄雄性ICR小鼠,体重(28±2)g,清洁级,购自昭衍(苏州)新药研究中心有限公司,合格证编号:No.202009910;许可证号:SCXK(苏)2008-0006。动物饲养于海军军医大学药学系实验动物中心,室温控制在(24±0.5) ℃,12 h光照/12 h黑暗,自由饮水、饮食。
1.2 试剂与仪器
D-半乳糖、羧甲基纤维素钠(Sigma公司);脂质过氧化物丙二醛(MDA)试剂盒、总超氧化物歧化酶(SOD)试剂盒、BCA蛋白检测试剂盒、蛋白酶磷酸酶抑制剂混合物(上海碧云天生物技术有限公司);AKT、p-AKT、FOXO1、SOD2、GAPDH抗体(CST公司);二十二碳六烯酸(DHA,纯度≥98%)购自上海麦克林生化科技有限公司。
2. 方法
2.1 海龙提取物制备
海龙(购自安徽亳州药材市场)经海军军医大学药学系生药学教研室辛海量教授鉴定为刁海龙。精密称取干燥海龙生药,剪碎,以料液比为1:10的80%乙醇浸泡12 h,80%乙醇冷凝回流提取2次,90%乙醇冷凝回流提取1次,每次回流提取2 h,过滤,合并滤液,减压浓缩干燥为浸膏。
2.2 海龙中DHA含量测定
2.2.1 色谱条件
色谱柱:AcclaimTM120 C18(4.6 mm×250 mm,5 μm);流动相:乙腈-0.05%磷酸水溶液梯度洗脱;流速:0.6 ml/min;柱温:30 ℃;检测波长:203 nm;进样量:20 μl。
2.2.2 样品及对照品制备
精密称定海龙乙醇提取物浸膏,配制成0.04 g/ml(以生药计)乙醇溶液;精密称取DHA对照品,溶解配置成0.5 mg/ml乙醇溶液。供试品溶液及对照品溶液均经0.45 μm微孔滤膜过滤除菌,备用。
2.3 动物分组及处理
将24只小鼠随机分为空白组、模型组、海龙低剂量组、海龙高剂量组,每组6只。对照组腹腔注射生理盐水,其余3组小鼠均腹腔注射D-gal(150 mg/kg),每周3次,复制衰老动物模型。海龙低、高剂量组给药剂量为1、2 g/kg(以生药计),空白组、模型组灌胃CMC-Na溶液,每周灌胃给药6 d。给药体积为0.1 ml/10 g,每周称重1次,给药量随体重变化增减,连续造模给药12周。
2.4 Morris水迷宫测试
水迷宫实验的前1~4 d为定位航行测试,第5天为空间探索实验。定位航行测试:将各组小鼠从水池4个象限放入水中,记录60 s内小鼠从入水至达平台并停留超过3 s所需时间(即逃避潜伏期),测试4 d,观察各组小鼠逃避潜伏期时间变化。空间探索实验:Morris水迷宫测试第5天,移除平台后,将小鼠从原平台对侧象限放入水中,记录小鼠60 s内的活动轨迹,并分析数据。
2.5 小鼠海马组织氧化抗氧化指标检测
水迷宫试验结束后处死小鼠,冰上迅速摘取小鼠海马组织。取部分海马组织加入生理盐水匀浆、离心,收集匀浆上清液,BCA法测定蛋白浓度后调整各样本蛋白浓度至一致,严格按照说明书检测小鼠海马组织匀浆上清液中MDA含量及SOD活性。
2.6 蛋白免疫印迹法检测海马组织AKT/FOXO1/SOD相关蛋白表达
以细胞裂解液制备海马组织匀浆,离心后收集上清液,并以BCA法测定蛋白浓度。海马组织上清液蛋白加热变性后进行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE),PVDF膜转印后,室温下5%脱脂牛奶封闭1 h。一抗(1∶1 000)4 ℃孵育过夜,次日TBST洗膜3次,每次10 min。二抗(1∶10 000)室温孵育1 h后,TBST洗膜3次,每次10 min。ECL化学发光法显影,ImageJ软件对目的条带进行分析。
2.7 统计学分析
实验结果以(
$ \bar x \pm s $ )表示,采用SPSS 21.0软件进行数据分析,选用单因素方差分析法进行组间变量分析,LSD-t法比较组间差异。以 P <0.05表示有显著性差异,以 P <0.01表示有极显著性差异。3. 结果
3.1 海龙中DHA含量测定结果
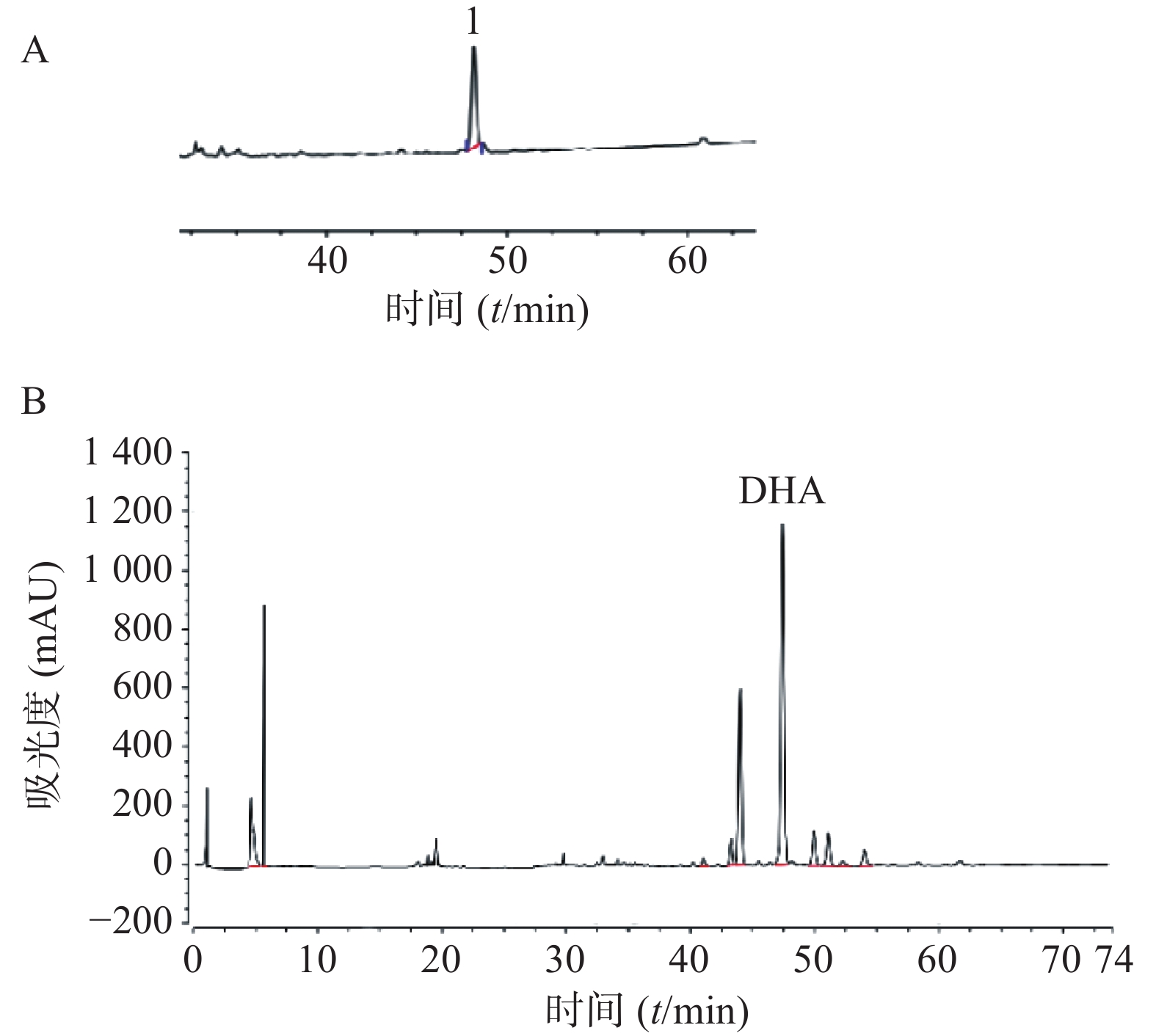
取对照品溶液,按照“2.2.1”项下方法进样测定。以峰面积为纵坐标、对照品浓度为横坐标进行回归处理,得DHA回归方程:Y=1 085.8X+4.799 9,相关系数r=0.999 9,线性范围0.034~0.41 mg/ml;取供试品液,按照“2.2.1”项下方法进样测定,并计得含量为7.761 3 mg/g(以生药计),见图1。
3.2 小鼠Morris水迷宫实验结果
小鼠定位航行实验结果:与空白组相比,模型组小鼠在定位航行实验第4天逃避潜伏期明显延长(P<0.01);与模型组比较,海龙低剂量组、高剂量组小鼠逃避潜伏期均显著缩短(P<0.01),见图2。
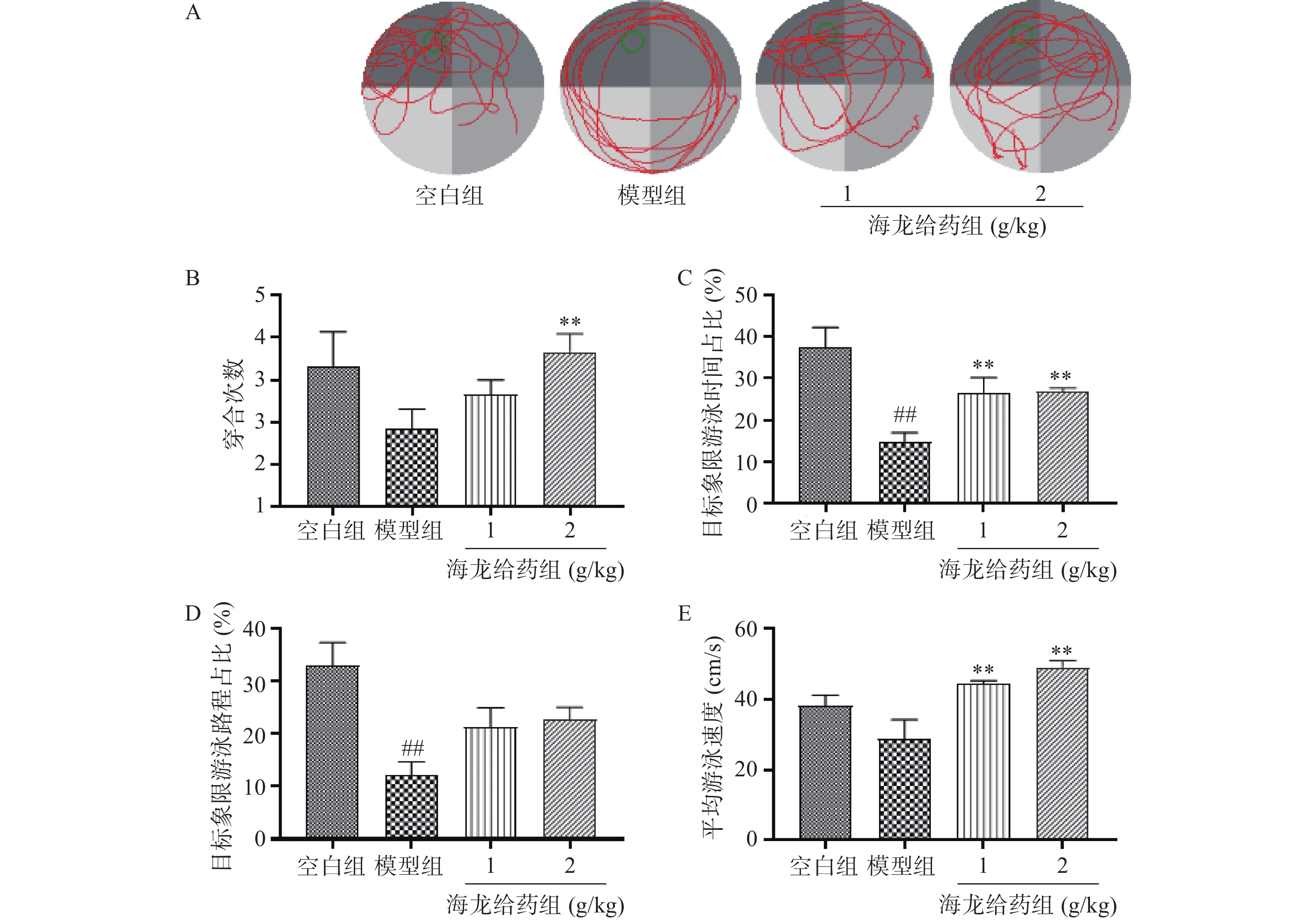
空间探索实验结果:与空白组比较,模型组小鼠目标象限游泳时间占比和游泳路程占比显著降低;与模型组比较,海龙高剂量组穿台次数显著增加(P<0.01);海龙低剂量组、海龙高剂量组目标象限游泳时间占比和游泳速度显著提高(P<0.01),见图3。
3.3 各组小鼠海马组织MDA含量及SOD活力
与空白组相比,模型组海马组织MDA含量显著升高,SOD活力显著降低(P<0.01);与模型组比较,海龙低剂量组、海龙高剂量组海马组织MDA含量显著降低(P<0.01),SOD活力显著升高(P<0.05, P<0.01),且高剂量组小鼠海马组织氧化损伤程度较低,见图4。
3.4 各组小鼠海马组织AKT/FOXO1/SOD蛋白表达
与空白组相比,模型组小鼠海马组织p-AKT/AKT比值、FOXO1、SOD2蛋白表达降低;海龙给药组可显著上调D-gal诱导记忆损伤小鼠海马组织中p-AKT、FOXO1、SOD2蛋白表达,激活AKT/FOXO1/SOD2通路(图5A-C),改善学习记忆损伤小鼠海马组织氧化损伤。
4. 讨论
氧化应激损伤与衰老密切相关。研究发现,氧化应激致机体衰老的主要机制是因过量的ROS导致线粒体损伤、脂质过氧化、抗氧化酶活力降低,进而诱导细胞周期停滞甚至细胞凋亡[6-7];同时自由基也会导致氧化损伤,并且自由基清除酶活力随年龄增长而降低,进一步导致机体氧化损伤加剧[8-9]。海马组织作为负责短时记忆储存转换与空间导航的器官[10],与学习记忆能力密切相关。研究发现[11],过量D-gal可诱导小鼠体内氧化应激加剧,导致海马组织神经元细胞损伤,从而导致动物学习记忆能力降低。本研究发现,经海龙给药干预后,小鼠海马组织MDA含量显著降低,SOD活力显著提高,学习记忆能力显著提高。表明海龙可通过降低海马组织氧化损伤改善D-gal诱导衰老小鼠学习记忆损伤。
PI3K/AKT/FOXO1信号通路是经典的抗氧化通路,能拮抗多种原因引起的氧化应激。AKT信号通过磷酸化活化激活下游mTOR、FOXOs家族蛋白表达[12],从而发挥抗氧化作用。FOXO1作为PI3K/AKT信号通路的重要作用底物,在细胞抗氧化应激反应中发挥重要作用。研究发现,FOXO1激活可以促进其下游抗氧化蛋白SOD2、CAT表达[13]。此外,FOXOs转录因子表达的减少也增加了氧化应激诱导细胞凋亡的易感性[14]。本研究发现,D-gal模型组小鼠海马组织p-AKT/AKT比值、FOXO1、SOD2蛋白表达降低,海龙给药组小鼠海马组织p-AKT/AKT比值、FOXO1、SOD2蛋白表达显著提高。表明海龙可通过激活AKT/FOXO1/ SOD2信号通路改善小鼠海马组织氧化损伤,进而改善D-gal诱导衰老小鼠学习记忆能力。
海龙为海龙科硬骨鱼类,富含多种脂肪酸、氨基酸、甾体类成分。研究发现[15-16],鱼类所含的不饱和脂肪酸类代表成分DHA可促进大脑神经元细胞发育,并通过激活Nrf2/HO-1通路、FOXO3a/SOD通路,促进抗氧化相关蛋白及基因表达,降低活性氧水平,从而减轻神经元细胞氧化及炎症损伤,改善记忆损伤。此外,DHA可通过上调包括小胶质细胞和星形胶质细胞在内的神经胶质细胞AKT、Nrf2、HO-1等氧化应激相关蛋白表达,提高抗氧化酶活性从而抑制细胞凋亡,间接防止神经元细胞损伤[17-18]。本研究通过建立海龙HPLC图谱,发现DHA为海龙主要化学成分之一,约占总成分的47%,推测海龙改善小鼠学习记忆损伤作用可能与其富含DHA有关,其作用机制有待进一步研究。
-
表 1 茵连痛风颗粒对大鼠关节炎指数的影响 (
$ \bar x \pm s $ ,n=8)组别 剂量(g/kg) 给药后关节炎指数 第7天 第14天 第28天 正常组 — 0.00±0.00 0.00±0.00 0.00±0.00 模型组 — 6.37±0.52## 9.63±0.74## 8.38±0.92## 阳性组 0.017 5.63±0.51** 6.50±0.93** 4.38±0.52** 高剂量组 15.4 5.50±0.53** 7.13±0.0.83** 4.13±0.64** 中剂量组 7.7 5.75±0.46** 8.13±0.0.83** 5.63±0.52** 低剂量组 3.8 5.88±0.35* 9.13±0.81 8.13±0.74 *P<0.05,**P<0.01,与模型组比较;##P<0.01,与正常组比较。 表 2 茵连痛风颗粒对大鼠踝关节肿胀率的影响 (
$ \bar x \pm s $ ,n=8)组 别
踝关节周长(l/cm)给药后踝关节肿胀率(%) 第1天 第9天 第17天 第25天 第28天 正常组 2.24±0.05 2.77±0.71 3.36±1.87 3.56±4.70 3.94±6.89 4.31±7.95 模型组 2.26±0.06 28.75±6.36## 30.09±8.24## 26.51±10.43## 25.44±12.90## 23.31±13.26## 阳性组 2.27±0.08 27.00 ±0.00 22.63±1.77** 20.61±1.45** 19.33±4.31** 18.45±4.67** 高剂量 2.22±0.05 27.54 ±1.03 23.85±1.56** 20.01±0.04** 18.14±1.52** 17.85±2.40** 中剂量 2.24±0.06 28.24 ±0.67 28.68±0.92 25.19±0.88 22.26±1.52* 21.85±2.40* 低剂量 2.28±0.07 29.48 ±0.21 29.49±2.23 26.05±0.99 25.01±0.32 24.10±0.28 *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与正常组比较。 表 3 茵连痛风颗粒对大鼠甲醛致痛的影响 (
$ \bar x \pm s $ ,n=8)组 别 剂量 (g/kg) 甲醛致痛分值 1~10 min(Ⅰ时相) 10~30 min(Ⅱ时相) 正常组 — 2.38±0.52 1.38±0.52 模型组 — 33.63±1.41## 14.88±1.64## 阳性组 0.017 11.38±1.06** 3.50±0.93** 高剂量组 15.4 12.13±0.99** 3.25±1.04** 中剂量组 7.7 16.00±1.60** 5.25±0.89** 低剂量组 3.8 19.38±1.19** 6.50±1.20** **P<0.01;与模型组比较; ##P<0.01,与正常组比较。 表 4 茵连痛风颗粒对大鼠血清IL-4、IL-10、PK1、PK2的影响 (
$ \bar x \pm s $ ,n=8)组别 剂量 (g/kg)
IL-4
IL-10
PK1
PK2正常组 — 79.49±4.38 97.07±2.97 491.76±8.56 926.24±25.38 模型组 — 59.89±3.45## 20.99±2.78## 706.31±67.83## 1455.40±147.81## 阳性组 0.017 139.69±13.78** 98.94±6.72** 567.10±20.58** 1099.60±63.63** 高剂量组 15.4 101.45±7.05** 90.36±5.43** 365.49±27.65** 656.07±194.68** 中剂量组 7.7 95.60±4.52** 82.75±8.49** 433.91±22.29** 866.73±21.57** 低剂量组 3.8 72.50±3.09** 78.15±5.47** 529.20±12.79** 1015.51±18.36** **P<0.01,与模型组比较; ##P<0.01,与正常组比较。 -
[1] SZEKANECZ Z, KOCH A E. Successes and failures of chemokine-pathway targeting in rheumatoid arthritis[J]. Nat Rev Rheumatol,2016,12(1):5-13. doi: 10.1038/nrrheum.2015.157 [2] 王海燕, 覃慧林, 张永峰, 等. 木瓜三萜对佐剂性关节炎大鼠关节滑膜组织中Akt, NF-κB和促炎因子的表达影响[J]. 中国实验方剂学杂志, 2017, 23(5):141-146. [3] PETCHI R R, PARASURAMAN S, VIJAYA C, et al. Antiarthritic activity of a polyherbal formulation against Freund's complete adjuvant induced arthritis in Female Wistar rats[J]. J Basic Clin Pharm,2015,6(3):77-83. doi: 10.4103/0976-0105.160738 [4] 姜丹, 吴坚. 中药自拟方联合抗风湿药治疗活动期类风湿关节炎疗效分析与评价[J]. 现代医药卫生, 2016, 32(22):3507-3510. doi: 10.3969/j.issn.1009-5519.2016.22.035 [5] 陈娜, 张明, 王一飞. 茵连痛风颗粒治疗间歇期痛风性关节炎临床观察[J]. 中国中西医结合杂志, 2017, 37(7):883-885. doi: 10.7661/j.cjim.20170427.119 [6] 吕邵娃, 苏红, 于风明, 等. 类叶牡丹提取物对大鼠佐剂性关节炎治疗作用及机制研究[J]. 中药新药与临床药理, 2017, 28(2):164-171. [7] 戴卫波, 吴凤荣, 董鹏鹏, 等. 走马胎对类风湿性关节炎模型大鼠踝关节组织病理学的影响[J]. 中药材, 2017, 40(5):1203-1207. [8] 刘静, 徐玲玲, 徐熠. 痛风颗粒抗痛风有效部位群研究[J]. 中草药, 2013, 44(5):590-594. [9] 罗尚文, 王燕燕, 张学农, 等. 复方鹿角霜浸膏对佐剂性关节炎大鼠的抗炎作用[J]. 中成药, 2018, 40(6):1253-1258. doi: 10.3969/j.issn.1001-1528.2018.06.005 [10] NEGRI L, MAFTEI D. Targeting the prokineticin system to control chronic pain and inflammation[J]. Curr Med Chem,2018,25(32):3883-3894. doi: 10.2174/0929867324666170713102514 [11] FRANCHI S, SACERDOTE P, PANERAI A. The prokineticin system: an interface between neural inflammation and pain[J]. Neurol Sci, 2017, 38(suppl 1): 27-30. [12] FRANCHI S, GIANNINI E, LATTUADA D, et al. The prokineticin receptor agonist Bv8 decreases IL-10 and IL-4 production in mice splenocytes by activating prokineticin receptor-1[J]. BMC Immunol,2008,9:60. doi: 10.1186/1471-2172-9-60 -





 下载:
下载:

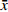

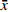

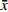
 下载:
下载:







