-
衰老是导致老年性骨质疏松症(SOP)的主要致病因素,其通过促进机体活性氧(ROS)的释放诱导氧化应激,从而降低成骨细胞活性,减少其骨形成[1-2]。D-半乳糖(D-gal)是一种还原糖,当其浓度达到一定水平时,就会诱导机体发生代谢紊乱,释放大量ROS,最终促进衰老相关疾病的发生[3]。同时,过量的D-gal还可诱导骨质变化,类似于SOP和衰老过程中的骨质丢失[4],严重危害了我国中老年人的身体健康。
巴戟天丸(Bajitianwan,BJTW)首载于《古今医统大全》,原方用于治疗老年性记忆减退。本课题组前期研究同样表明,巴戟天丸可显著改善D-gal致衰老大鼠的骨微结构,防治骨丢失,证明其具有明确的抗骨质疏松作用;同时还发现巴戟天丸可改善D-gal大鼠的记忆损伤,提示其具有抗老年性骨质疏松潜力[5],然而其在成骨细胞水平上防治D-gal引发骨丢失的作用及机制尚不明确。因此本研究拟采用D-gal损伤成骨细胞,通过成骨细胞活性、氧化应激水平及关键调控通路检测等方法,探究巴戟天丸体外抗老年性骨质疏松症的作用及机制。
-
成骨细胞:新生24 hWistar大鼠(上海西普尔-必凯实验动物有限公司);胎牛血清(美国Gibco);MTT(上海博光);BCIP/NBT碱性磷酸酯酶显色试剂盒、ALP试剂盒(南京建成);ROS检测试剂盒(上海碧云天);α-MEM培养基(天津灏洋);AKT、p-AKT抗体(美国CST)、Nrf2、HO-1、NQO1抗体(英国Abcam)。
-
采用二次消化法从新生24 hWistar大鼠颅盖骨中分离提取成骨细胞,将原代成骨细胞培养于α-MEM培养基中(10%胎牛血清),置于37 ℃、5% CO2的恒温培养箱中培养,取第3~5代成骨细胞进行后续指标检测。
-
将细胞以5×103个/孔接种于无菌96孔板中,孵育24 h。空白组和模型组更换新的完全培养基,给药组分别加入含不同浓度的BJTW水提物的完全培养液(0.001、0.01、0.1、1、10 μg/ml),4 h后模型组和给药组给予D-gal母液进行干预,使完全培养基中D-gal浓度达到100 mol/L。培养48 h后,采用MTT法测定细胞增殖水平。
-
将细胞以2×104个/孔接种于无菌24孔板中,孵育24 h细胞完全贴壁后,空白组和模型组更换新的完全培养基,给药组分别加入含不同浓度的BJTW完全培养液(0.1、1、10 μg/ml),4 h后模型组和给药组给予D-gal母液进行干预,使培养基中D-gal浓度达到100 mmol/L。培养48 h进行染色,于室温进行避光孵育3 d,洗去工作液后拍照。
ALP活性检测:按照“1.3”项的方法进行给药,细胞培养48 h后,取上清液,根据说明书测定ALP活性。
-
将细胞以2×105个/孔接种于6孔板中,孵育24 h细胞完全贴壁后,根据分组加入含不同浓度的BJTW完全培养液(0.1、1、10 μg/ml),4 h后模型组和给药组加入D-gal母液,使其浓度达到100 mmol/L。培养48 h后,吸弃上清液,参照ROS检测试剂盒说明书,装载稀释后的DCFH-DA探针,37 ℃孵育20 min,用0.25%的胰蛋白酶消化细胞并转移至离心管,空白培养基洗涤3次,用300 ml PBS重新混悬细胞后送往流式细胞仪进行检测。
-
将细胞以2×105个/孔接种于6孔板中,孵育24 h细胞完全贴壁后,根据分组分别加入含不同浓度的BJTW完全培养液(1、10 μg/ml),4 h后模型组和给药组加入D-gal母液,使完全培养基中D-gal浓度达到100 mmol/L。孵育48 h后,吸去上清液,PBS洗涤2次。于冰上对细胞进行裂解提取总蛋白,采用BCA试剂盒对蛋白定量。蛋白变性后,经SDS-PAGE凝胶电泳后转移至PVDF膜进行转膜,室温封闭后,加入相应的一抗(4 ℃环境过夜),1×TBST洗涤3次,加二抗于室温孵育1 h。1×TBST洗涤3次,采用ECL化学发光试剂盒检测。
-
将细胞以1×105个/孔的密度接种于激光共聚焦皿中,根据分组分别加入含不同浓度的BJTW完全培养液(1、10 μg/ml),4 h后模型组和给药组给予D-gal母液进行干预,使培养基中D-gal浓度达到100 mmol/L。于皿中培养48 h后,弃上清液,PBS洗涤2次后,组织固定液固定细胞,30 min后用PBS清洗2次,加入0.5%Triton X-100通透20 min。PBS清洗2次,皿中加入5%BSA工作液,室温封闭1 h。PBS清洗后加入一抗(4 ℃冰箱过夜),PBS洗涤皿底,加入荧光二抗,于室温环境孵育45 min,PBS清洗皿底,加入DAPI染液,避光环境放置20 min,清洗去除多余的染液,激光共聚焦显微镜拍照。
-
实验结果用(
$ \bar{\mathrm{x}} $ ±s)表示。采用SPSS 22.0软件、单因素方差分析(One-Way ANOVA)方法对实验数据进行分析。 -
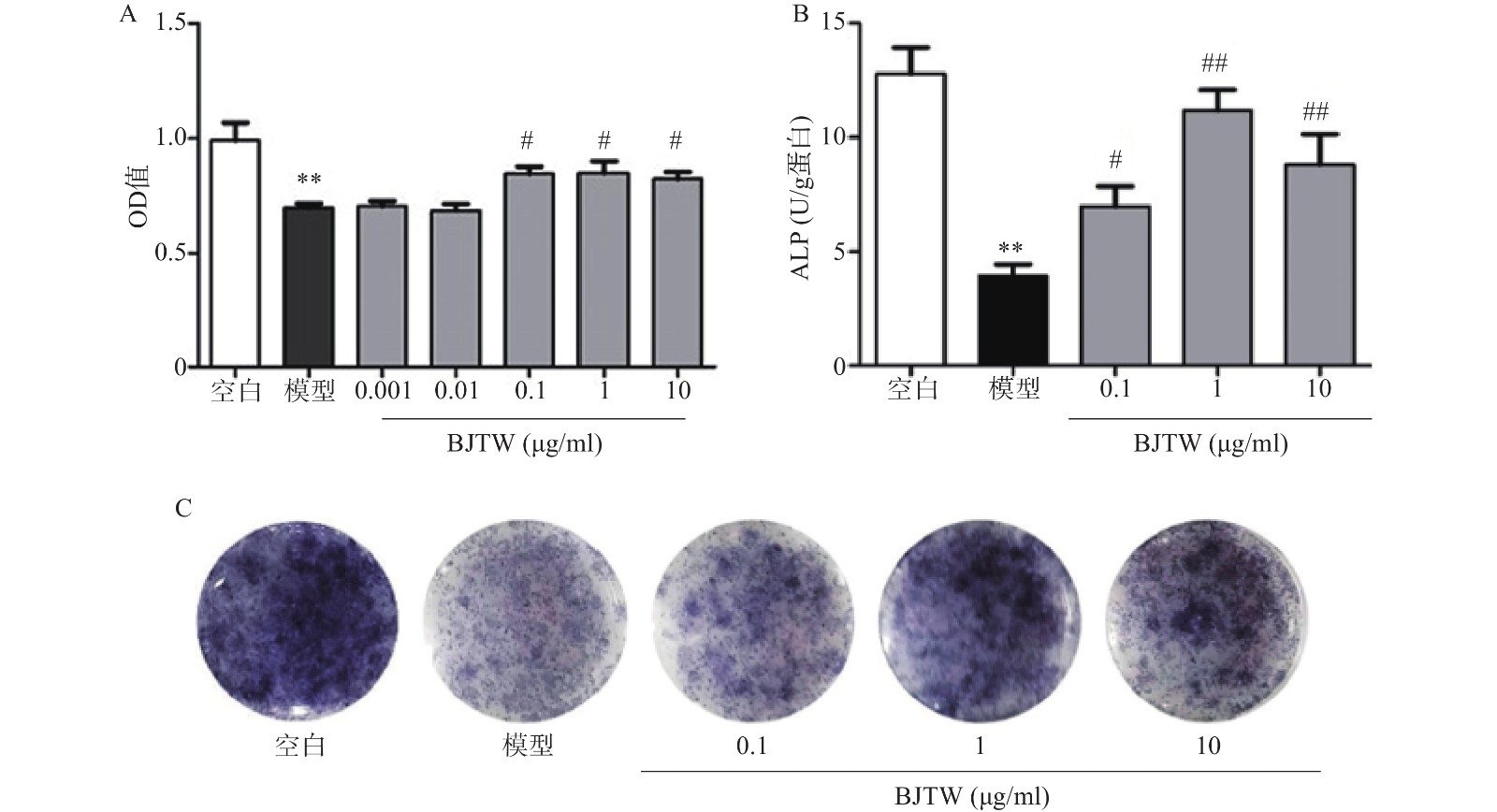
D-gal损伤可显著抑制成骨细胞的增殖;药物干预后,BJTW在0.1、1、10 μg/ml浓度下均能够显著提高成骨细胞的MTT水平,增强D-gal损伤成骨细胞的增殖(图1A)。
-
ALP源自成骨细胞的分泌,能够反映骨形成的能力。对给予D-gal干预的成骨细胞所分泌的ALP的活性进行测定。D-gal损伤成骨细胞后,其ALP活性显著降低;药物干预后,BJTW在0.1、1、10 μg/ml浓度下均可提高D-gal损伤成骨细胞的ALP活性(图1B)。
与此同时,在ALP的催化下,甲苯胺蓝(BCIP)的水解产物会和氯化硝基四氮唑兰(NBT)反应产生不溶的深蓝色至蓝紫色甲瓒结晶。BJTW在0.1、1、10 μg/ml的浓度下均可显著增加培养皿底的甲瓒结晶的颜色深度(图1C),证明其可显著提高D-gal损伤细胞的ALP活性,促进成骨分化。
-
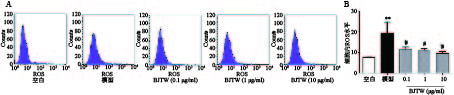
如图2所示,D-gal损伤成骨细胞后,胞内ROS活性显著升高。药物干预后,BJTW在0.1、1、10 μg/ml浓度下均可显著降低D-gal损伤成骨细胞内ROS水平,缓解氧化应激,且该作用呈剂量依赖。
-
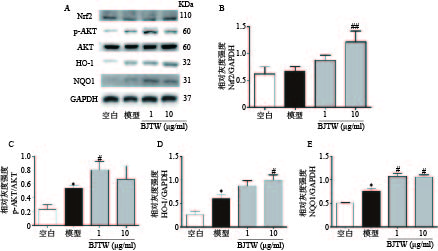
外源性氧化应激会激活细胞内的PI3K/AKT信号通路,使AKT磷酸化水平上升[6]。如图3所示,D-gal损伤成骨细胞后,p-AKT/AKT水平较空白组显著升高;药物干预后,BJTW在1、10 μg/ml浓度下对p-AKT/AKT的水平的促进作用相较模型组表现更为显著。此外,BJTW还可显著促进其下游蛋白Nrf2、HO-1和NQO1的表达,进而激活氧化应激相关PI3K/AKT通路,缓解氧化损伤。
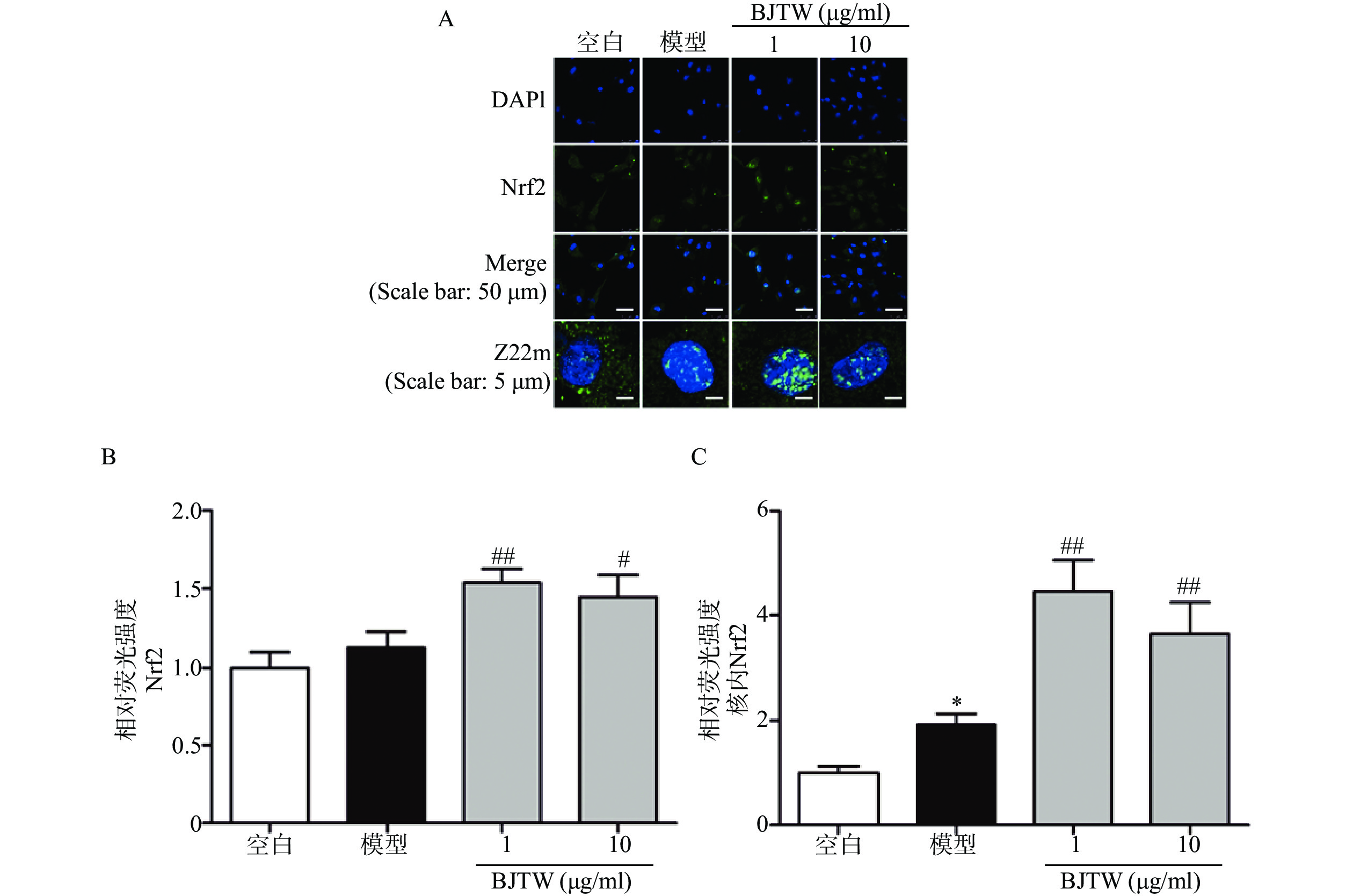
Nrf2通路同样是抗氧化的关键通路,在ROS清除方面发挥重要作用。如图4所示,BJTW可显著促进Nrf2的入核表达(图4),提示BJTW抗氧化、促进骨形成作用与激活Nrf2/AKT通路、促进Nrf2入核有关。
-
成骨细胞主要由骨髓间充质干细胞分化而来,在维持骨稳态和骨重建过程中起着至关重要的作用[7]。与此同时,成骨细胞还是骨形成的主要功能细胞,在骨形成过程中经历增殖、分化、矿化和凋亡四个阶段[8-9]。成骨细胞的增殖水平体现骨形成的强弱,其分泌的ALP是成骨细胞分化阶段的关键酶,可介导骨组织矿化[9-10]。ROS是细胞信号传递和其他生理功能所必需的,然而过多的ROS会导致细胞内的氧化还原反应失衡,扰乱正常的生物功能,导致氧化应激[11-12]。本研究中,D-gal损伤成骨细胞后,细胞的增殖及骨形成指标ALP水平明显降低,细胞内活性氧水平显著上升,而巴戟天丸能够显著促进D-gal损伤成骨细胞的增殖能力和ALP活性,并能显著降低细胞内活性氧水平,表明巴戟天丸可通过抑制胞内ROS释放缓解成骨细胞氧化应激,从而增强成骨细胞的活性,以促进骨的形成。
作为主要的氧化应激调控因子,在骨代谢调控中,Nrf2同样起着重要的作用[13-14]。研究发现,敲除Nrf2基因的小鼠,其股骨的骨密度和骨量显著降低,骨小梁面积减少[15];同时缺失Nrf2会抑制成骨细胞抗氧化酶的表达,提高胞内ROS水平,从而抑制成骨细胞的分化[16]。此外,PI3K/AKT通路作为Nrf2的上游信号通路,在氧化应激调控方面同样起到关键作用[17]。本研究中,药物干预后,巴戟天丸可促进成骨细胞内AKT磷酸化增加,促进Nrf2入核,同时激活下游的HO-1和NQO1的表达,表明巴戟天丸可能通过激活PI3K/AKT和Nrf2信号通路,进而促进通路中相关的蛋白表达,进而增加成骨细胞的抗氧化应激水平,促进骨形成。本研究可为老年性骨质疏松症的临床用药提供一定的实验依据。
Effect and mechanism of Bajitianwan on preventing D-galactose-induced osteoblast bone loss
-
摘要:
目的 研究巴戟天丸防治D-半乳糖(D-gal)损伤成骨细胞骨丢失的作用及机制。 方法 采用新生24 h Wistar大鼠提取的原代成骨细胞,利用D-gal对细胞进行干预,并给予巴戟天丸提取物行药物治疗。分别采用MTT法和碱性磷酸酶试剂盒评价细胞的增殖和分化水平;采用DCFH-DA荧光探针对成骨细胞内活性氧(ROS)水平进行测定。采用Western blotting法对磷酸化蛋白激酶B(p-AKT)、蛋白激酶B(AKT)、血红素氧合酶1(HO-1)、醌NADPH脱氢酶1(NQO1)等氧化相关蛋白的表达进行检测,并采用免疫荧光法测定细胞核因子E2相关因子2(Nrf2)的核内表达水平。 结果 巴戟天丸能显著提高D-gal干预细胞的增殖水平和ALP活性,并显著降低细胞内ROS水平。巴戟天丸能够显著促进细胞AKT蛋白的磷酸化,提高HO-1、NQO1的表达水平,进而激活PI3K/AKT信号通路。此外,巴戟天丸提取物还可显著促进成骨细胞核内Nrf2的表达,激活Nrf2信号通路,促进骨形成。 结论 本研究首次明确了巴戟天丸可防治D-半乳糖损伤引起的成骨细胞骨丢失,其作用机制可能与调控PI3K/AKT和Nrf2信号通路关联的氧化应激有关。 Abstract:Objective To explore the effect and mechanism of Bajitianwan on preventing D-galactose (D-gal)-induced osteoblast bone loss. Methods Osteoblasts isolated from 24 h old Wistar rats were injured by D-gal and intervened with Bajitianwan extract. The osteoblastic proliferation and differentiation were determined by MTT and alkaline phosphatase (ALP), respectively. The cell reactive oxygen species (ROS) levels were detected by DCFH-DA fluorescent probes. The expression of cellular oxidation-related protein nuclear factor erythroid 2-related factor 2 (Nrf2), phosphorylated protein kinase B (p-AKT), protein kinase B (AKT), heme oxygenase-1 (HO-1), and NADPH quinone oxidoreductase 1 (NQO1) were detected by Western blotting. The intranuclear expression of Nrf2 protein was measured by immunofluorescence. Results Bajitianwan extract had significantly increased the osteoblastic proliferation and differentiation, and significantly reduced the intracellular ROS level. Bajitianwan extract had activated the PI3K/AKT pathway via activating the phosphorylation of AKT in osteoblasts, and promoted NQO1 and HO-1 expression. In addition, Bajitianwan had significantly promoted the expression of Nrf2 in the nucleus of osteoblasts, activating Nrf2 signaling pathway, and further promoted bone formation. Conclusion This study confirmed that Bajitianwan could prevent D-gal injured osteoblastic bone loss for the first time. The mechanism might be related to the regulation of oxidative stress associated PI3K/AKT and Nrf2 signaling pathway. -
Key words:
- Bajitianwan /
- D-galactose /
- osteoblast /
- reactive oxygen species /
- Nrf2
-
在全球新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)大流行期间,Moderna和BioNTech/辉瑞公司基于脂质纳米颗粒(lipid nanoparticles,LNP)载体的mRNA疫苗获得FDA紧急批准[1,2],迅速地延缓了新型冠状病毒的传播。基于脂质纳米颗粒-mRNA的COVID-19疫苗取得的巨大成功,使得mRNA疫苗技术迅速成为研究的热点,并促进了mRNA疫苗在肿瘤等重大疾病治疗中的研发和应用。
2024年6月,上海交通大学附属瑞金医院沈柏用教授团队披露mRNA肿瘤疫苗研究新进展,在全球范围内首次报道针对KRAS G12V单靶点的mRNA肿瘤疫苗在实体肿瘤中的治疗效果,为传统治疗无法耐受或者耐药的晚期肿瘤患者带来新希望[3]。同时,针对肿瘤抑制性免疫微环境,编码细胞因子的mRNA肿瘤疫苗可以促进效应T细胞的成熟、调控肿瘤微环境,从而提高在实体瘤局部疫苗接种的抗肿瘤疗效。其中,以MEDI1191、mRNA-
2416 、mRNA-2752 、SAR44100等为代表的 mRNA肿瘤疫苗已进入临床试验阶段。mRNA肿瘤疫苗通过将编码肿瘤抗原的mRNA引入宿主细胞(通常是抗原提呈细胞)的细胞质中表达靶蛋白抗原,然后在抗原提呈细胞表面呈递MHC分子,诱导有效的免疫应答来发挥作用[4,5]。相对于其他类型的治疗性肿瘤疫苗来说,基于mRNA的肿瘤疫苗是一种有前途的策略(图1),其具有如下优势:①与病毒疫苗类似,mRNA肿瘤疫苗能够同时递送多种抗原,引发体液免疫和细胞免疫,增加了肿瘤细胞根除的可能性。②与基于肽的疫苗不同,mRNA肿瘤疫苗不受患者特异性HLA类型的限制。③与基于DNA的肿瘤疫苗相比,mRNA肿瘤疫苗安全且耐受性良好,没有插入宿主基因组的风险[4]。尽管mRNA肿瘤疫苗具有非常广阔的应用前景,但仍然存在以下问题:①mRNA分子在体内非常不稳定,很容易被细胞外的核酸酶降解[6]。②mRNA分子量大且带负电荷,这阻碍了它们通过细胞膜高效递送至靶细胞[7]。因此,推动mRNA药物应用的关键之一是高效的mRNA递送系统的开发。与基于病毒的递送系统相比,非病毒载体在生物安全性和多功能性方面具有重大优势。如基于脂质的纳米颗粒、聚合物纳米颗粒、肽类纳米颗粒和无机纳米粒子,能有效压缩mRNA,使其免受核酸酶的降解[8]。此外,根据靶向器官的生物结构和递送过程中的屏障,非病毒载体可以有目的地进行结构改造,从而更有效地将mRNA递送到身体的特定部位,以提高治疗效果[8]。因此,基于非病毒载体的递送系统的研究已成为mRNA肿瘤疫苗研究领域的热点课题。1. mRNA肿瘤疫苗概况
mRNA肿瘤疫苗的研究发端于 20 世纪 70 年代。1976年,Langer等[9]首次使用了聚合物纳米颗粒和微颗粒作为载体来封装核酸。随后2年,又实现将外源性mRNA通过脂质体递送到宿主细胞,进一步拓展了mRNA技术的应用[10]。1990年,Wolff等[11]将含有氯霉素乙酰转移酶、荧光素酶和β-半乳糖苷酶基因的RNA和DNA表达载体分别注射到小鼠体内骨骼肌中,在所有小鼠体内都检测到了相应蛋白质的表达,为mRNA用作治疗药物的研究奠定了基础。mRNA疫苗的概念可以追溯到1993年,Martinon等[12]在用编码流感病毒蛋白的mRNA免疫的小鼠中观察到细胞毒性T淋巴细胞的诱导,揭示了mRNA作为编码抗原的基因在疫苗研究领域的应用潜能。1995年,Conry 等[13]构建了编码荧光素酶和人癌胚抗原(carcinoem bryonic antigen,CEA)的mRNA剪切体,该mRNA剪切体在体外小鼠成纤维细胞中定向表达CEA, mRNA肿瘤疫苗的概念被首次提出。近年来,COVID-19的流行推动了mRNA疫苗的深入研究和技术的发展,并使mRNA肿瘤疫苗再次受到关注。事实上,COVID-19疫苗的快速发展得益于多年来在临床前和临床试验中以mRNA疫苗作为肿瘤治疗策略的相关研究。因此,mRNA疫苗是未来肿瘤治疗有希望的候选疗法之一。
2. 基于mRNA肿瘤疫苗的非病毒递送系统
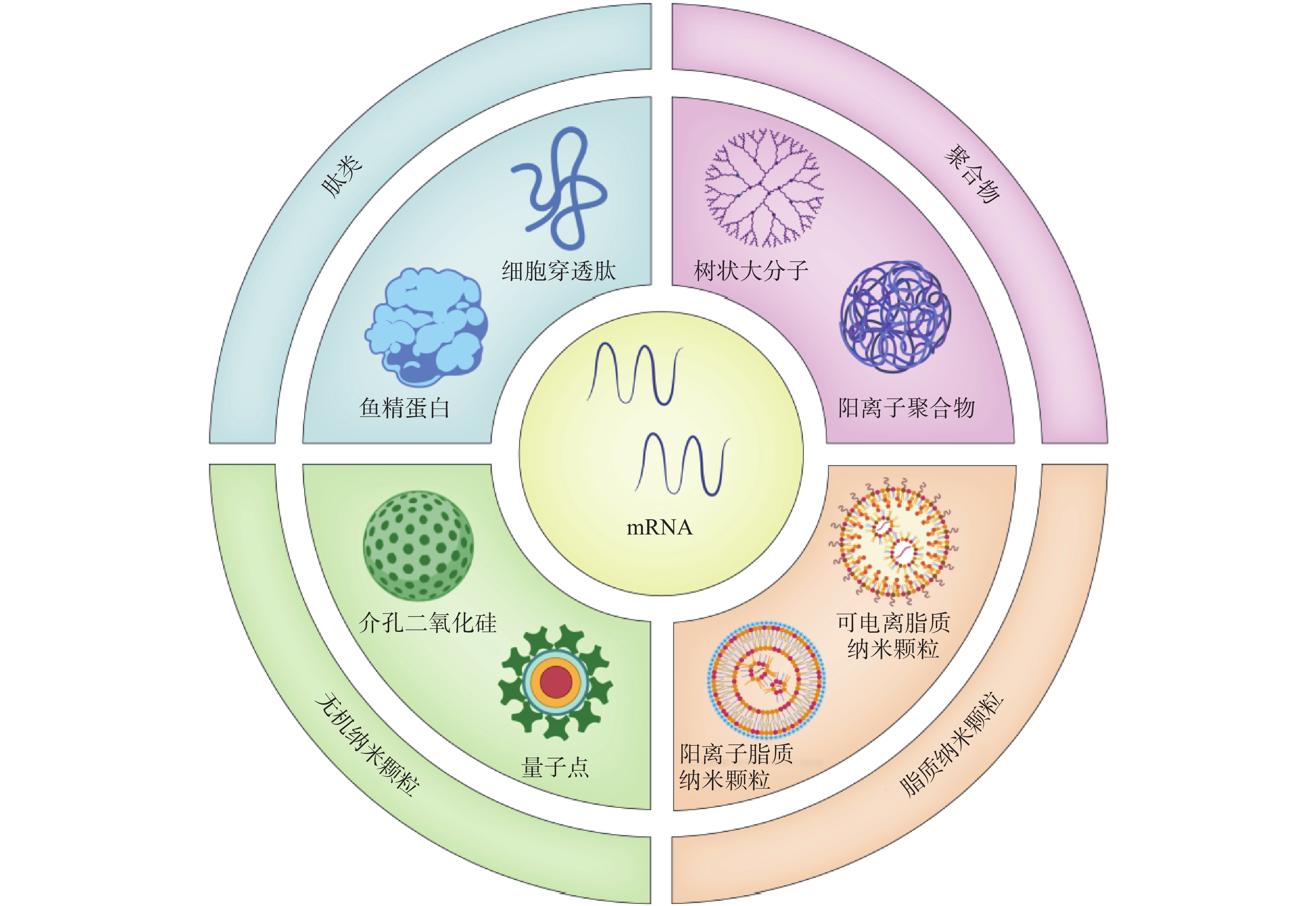
由于mRNA存在不稳定性、高免疫原性、递送效率低等问题,开发高效的靶向递送系统是mRNA疫苗亟待解决的问题。mRNA疫苗递送载体主要包括病毒载体和非病毒载体。目前,多数的临床基因治疗试验采用病毒载体。然而,病毒载体存在易于刺激免疫原性反应产生和诱导基因插入突变等问题,其临床安全性一直受到质疑。而包括脂质纳米粒、聚合物、肽类、无机材料在内的非病毒载体,具有强大的基因装载能力、高度的安全性和实用性,且其制备较为简单。因此,非病毒载体在进一步的临床开发和应用中显示出巨大的潜力[14]。
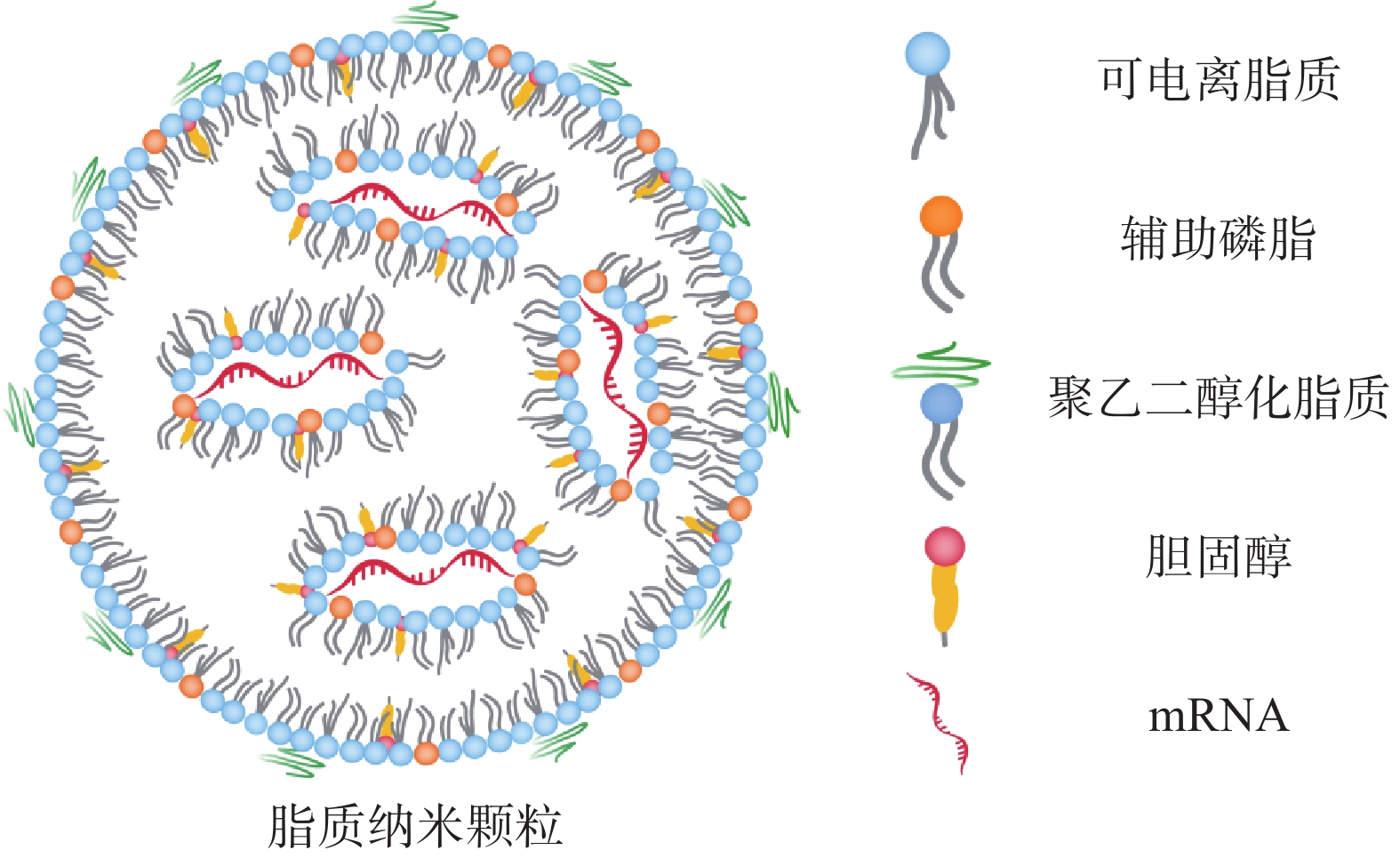
2.1 脂质纳米颗粒(lipid nanoparticles,LNP)
脂质纳米颗粒是一种临床批准的用于核酸递送的多功能平台[15]。截至2023年11月,3种基于LNP的药物(1种siRNA,2种mRNA)已获得美国食品药品监督管理局批准,超过50种候选药物正在临床试验中,用于治疗或预防传染病、肿瘤和遗传性疾病[16]。
LNP脂质壳结构由脂质或类脂材料以及辅助成分(包括胆固醇、辅助磷脂和聚乙二醇化脂质)组成(图2)。这些成分可促进单分散纳米颗粒的形成、提高纳米颗粒的稳定性、实现有效的核酸封装、增加细胞摄取和促进mRNA的内体逃逸。其中,辅助磷脂可以调节 LNP 双分子层的流动性,促进内体逃逸[17];胆固醇通过填充磷脂间的空隙来调节膜的流动性,促进膜融合。聚乙二醇(polyethyleneglycol,PEG)化脂质控制LNP的大小和稳定性,介导LNP的间接靶向能力以及保护LNP免受巨噬细胞介导的清除[18,19];LNP 配方中最重要的成分为阳离子脂质或可电离脂质,在早期的研究中主要使用阳离子脂质,如(2,3-二油酰基-丙基)-三甲基氯化铵[(2, 3-dioleyl-propyl)-trimethyl ammonium chloride, DOTAP]和1,2-双十八烯氧基-3-甲基铵丙烷(1, 2-didecaenooxy-3-methyl ammonium propane, DOTMA)。然而阳离子脂质具有高免疫原性和较强的毒性[20]。
可电离脂质具有pH敏感性,其在酸性条件下带正电荷,在生理pH条件下接近中性[21,22]。这种特性使它们在体内分布时更少地与血清成分相互作用。当可电离脂质纳米粒进入细胞的酸性内体后,它们可以被质子化,从而帮助mRNA逃逸到细胞质中。常用的可电离脂质有1,2-二甲氧基-N,N-二甲基-3-氨基丙烷(DLin-DMA)、N,N-二甲基-2,2-二-(9Z,12Z)-9,12-十八碳二烯-1-基-1,3-二氧戊环-4-乙胺(DLin-KC2-DMA)和4-(N,N-二甲基氨基)丁酸(二亚油基)甲酯(DLin-MC3-DMA)。可电离脂质的结构改变可引起 mRNA递送效率的改变,如Dong等[23]合成了含有不同头部基团的二氨基(DAL)可电离脂质材料,用于包载编码IL-12、IL-27和GM-CSF等细胞因子的mRNA。使用DAL-LNP对携带B16F10黑色素瘤的小鼠进行治疗性疫苗接种,结果显示通过DAL-LNP在瘤内给药IL-12和IL-27 mRNA促进了B16F10黑色素瘤生长的持续抑制,且没有引起明显的毒性。
此外,在LNP的表面进行靶向免疫细胞表面受体的功能性修饰,或与佐剂共同给药,可增强免疫刺激。Shi等[24]将 Pam2Cys(一种可通过 Toll 样受体(TLR)2/6 途径发出信号的简单合成代谢脂氨基酸)引入 LNP,实现了与 mRNA 的共同递送。结果显示,使用由此产生的 mRNA-LNP (Pam2Cys)进行免疫,可通过诱导 IL-12 和 IL-17 等细胞因子改善肿瘤引流淋巴结(tumor-draining lymph nodes,TDLN)的免疫微环境。
2.2 聚合物纳米颗粒(polymer nanoparticles)
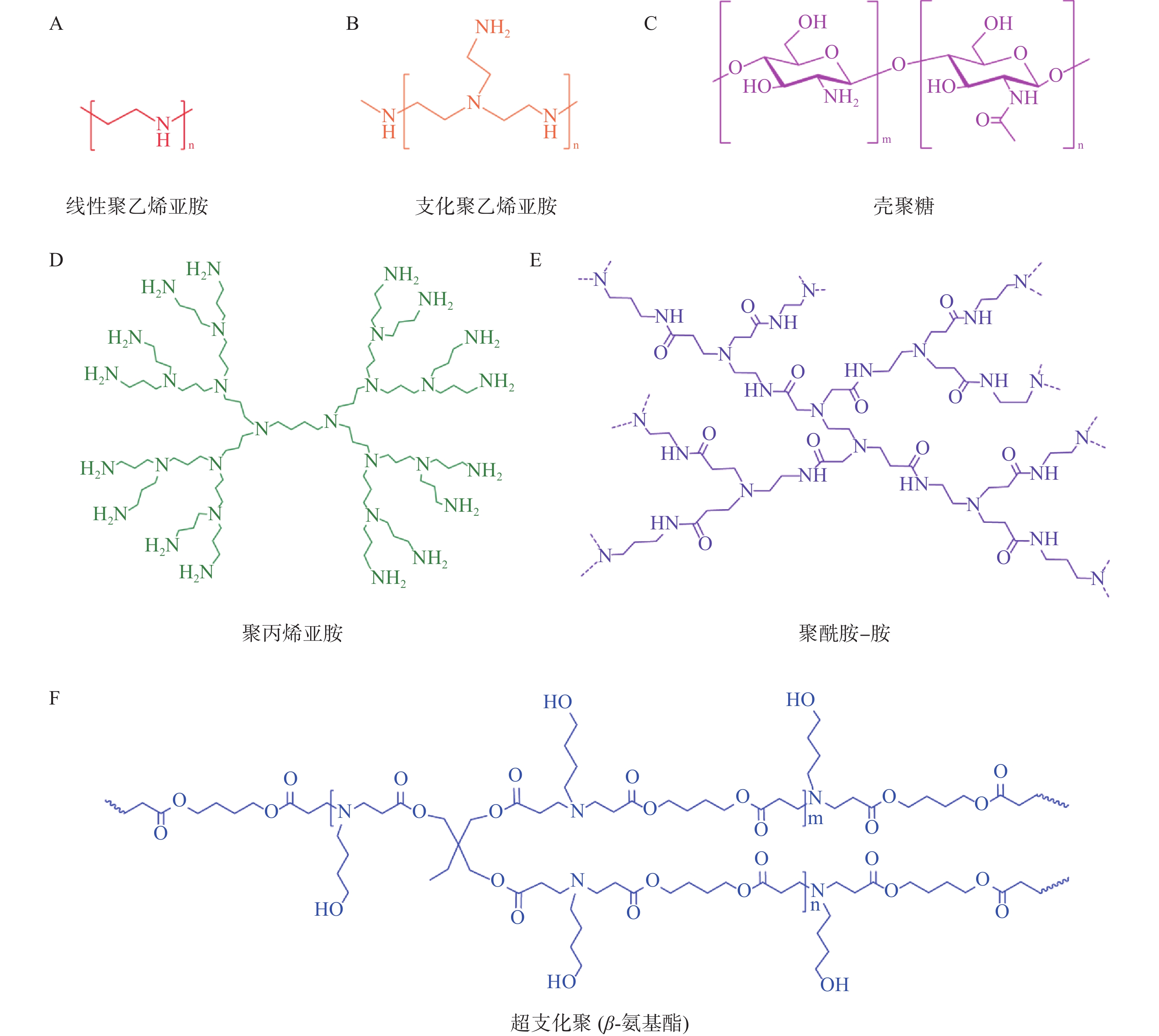
目前常用于mRNA递送的聚合物材料主要有聚乙烯亚胺(polyethyleneimine,PEI)、基于聚酰胺-胺(poly-amindoamine,PAMAM)和聚丙烯亚胺(polypropylenimine,PPI)的树枝状大分子、聚氨基酯(poly β-aminoester,PBAE)、壳聚糖等[25](图3)。与LNP相比,基于聚合物的递送系统具有较高的多分散性、分子量和电荷密度,这导致基于聚合物的递送系统纯度较低、清除率较低且毒性较大。因此,它们在mRNA递送方面的临床应用不如可电离脂质纳米粒广泛。为了提高聚合物材料的转染效率和稳定性,并降低其毒性,人们对其结构进行了改造,包括添加脂质尾部、超支化基团和可生物降解分子[26]。
PEI含有大量的氨基,在生理pH值下可被质子化带正电荷。而mRNA是一种带负电的分子。因此,PEI通过静电相互作用与mRNA紧密地结合形成纳米复合物[27]。此复合物可以有效地压缩mRNA,并在一定程度上保护mRNA免受外界酶的降解[28]。在体内,PEI充当“质子海绵”促进mRNA释放到细胞质。然而,由于高电荷密度和高分子量,PEI具有较大的全身毒性和低生物降解性。用脂肪链修饰的低分子量PEI已被用于mRNA递送以降低毒性,如Peng等[29]合成了一种氟烷烃接枝的聚乙烯亚胺(F-PEI)。结果显示由F-PEI和编码肿瘤抗原的mRNA自组装形成的疫苗,无额外的佐剂,即可诱导树突状细胞成熟并触发有效的抗原呈递,从而引发抗肿瘤免疫反应。
树枝状大分子(dendrimers)是一类具有树枝状结构,由低聚物通过支化单元重复、线性连接而成的大分子,其通常由内核、聚合物主链和树枝单元的侧链组成[30,31]。作为一种阳离子聚合物,树枝状大分子的细胞毒性也需要通过表面改性来降低。England等[32]使用赖氨酸作为位点选择性锚,通过酰胺化反应引入了聚磺酰精氨酸和咪唑基团对PAMAM(P)和赖氨酸(L)树枝状大分子进行了化学改性。实验结果显示,与市售的转染剂jetPEI® 相比,改性的PAMAM树枝状大分子显示出更高的mRNA转染效率。
2.3 肽类纳米粒(peptide-based nanoparticles)
除了基于聚合物和脂质纳米粒的载体外,还可以使用基于肽类的载体递送mRNA。肽类由可生物降解的氨基酸组成,因此其具有高度的生物相容性。鱼精蛋白和细胞穿膜肽(cell-penetrating peptides,CPPs)是两种基于肽的载体,可用于mRNA递送。鱼精蛋白是一种天然的富含精氨酸的阳离子蛋白,可以把带负电的mRNA分子络合成纳米级别的核酸颗粒[33]。此外,鱼精蛋白-mRNA组成的纳米级颗粒还可以进一步制备成脂质纳米颗粒,这种脂质-鱼精蛋白-mRNA(lipid/protamine/mRNA, LPR)的制剂形式,兼有脂质纳米粒和鱼精蛋白的优势[34,35]。Shen等[36]制备了一种由鱼精蛋白/mRNA核和脂质壳组成的mRNA肿瘤疫苗(MVP)。结果显示,MVP 中的mRNA核和脂质壳可充分刺激树突状细胞中I型干扰素和炎症细胞因子的表达,在小鼠结直肠肿瘤和黑色素瘤模型中引起了有效的抗肿瘤免疫。
CPPs是一类由不多于30个氨基酸组成的小分子多肽。CPPs在生理pH值下带正电荷,可以与带负电荷的mRNA形成纳米结构[37]。Men等[38]将肿瘤细胞裂解液引入到DMP纳米颗粒[由DOTAP和(乙二醇)-b-聚(ε-己内酯)(mPEG-PCL)自组装形成]中,并将CPPs修饰在DMP表面,形成CLSV系统。然后将编码IL-22结合蛋白(interleukin-22 binding protein,IL-22BP)的mRNA与CLSV混合形成CLSV/IL-22BP复合物。结果表明,所构建的CLSV达到了激活免疫反应和增强mRNA递送的双重目的,在体外和体内均表现出较强的抑制肿瘤细胞生长的能力。
2.4 无机纳米材料(inorganic nanoparticles,INPs)
无机纳米颗粒是一种多功能纳米平台。虽然INPs的生物相容性不如脂质纳米粒和聚合物,但是INPs可以通过表面功能化修饰,获得具有适当的溶解度和分散性的纳米粒子。并且某些INPs具有磁性和光学性质,可实现对肿瘤的成像和消融[39]。典型的INPs包括金纳米粒子、二氧化硅纳米粒子、氧化铁纳米粒子、量子点等。
常用的INPs是介孔二氧化硅纳米粒子(mesoporous silica, MSN),其具有孔道均匀、高比表面积、大孔容和可生物降解性等优点。Phua等[40]开发了一种介孔二氧化硅纳米颗粒-mRNA (MSN-mRNA)皮下递送系统。结果显示,将编码卵清蛋白和粒细胞巨噬细胞集落刺激因子的裸mRNA和C16@MSNs组成的MSN-mRNA疫苗配方应用于小鼠E.G7-OVA预防性肿瘤模型时,产生了显著的肿瘤抑制作用。其次,INPs还可以与聚合物和脂质纳米粒联合,用于mRNA的递送。Shin等[41]开发了一种基于聚乙烯亚胺修饰的多孔二氧化硅纳米颗粒(PPSN)的递送平台,其携带细胞因子mRNA用于体内局部免疫治疗。结果表明,PPSN在定位mRNA翻译方面明显比美国食品药品监督管理局批准的LNP更有效。该研究显示了PPSN介导的mRNA递送作为肿瘤免疫疗法中基于mRNA治疗的特异性、有效性和安全性平台的潜力。
3. 非病毒递送系统在mRNA肿瘤疫苗中的应用
基于肿瘤的特点编码特异性抗原,使其顺利地被免疫细胞识别以激活免疫应答,是mRNA肿瘤疫苗的核心作用机制。现阶段主要研究的mRNA肿瘤疫苗编码的抗原主要有肿瘤相关抗原(tumor-associated antigen,TAA)、肿瘤特异性抗原(tumor specific antigen,TSA)和免疫调节因子3种类型[42]。通过对非病毒载体和对机体免疫系统的研究不断深入,目前已有多项mRNA肿瘤疫苗进入临床试验。中国进入临床试验阶段的mRNA肿瘤疫苗如表1所示。
表 1 中国进入临床试验阶段的mRNA肿瘤疫苗疫苗登记号 适应证 申办单位 研发阶段 ChiCTR2300071001 EGFR 突变阳性的晚期非小细胞肺癌 苏州艾博生物科技有限公司 探索性研究/预试验 CTR20232018 晚期实体瘤 北京立康生命科技有限公司 Ⅰ期临床 CTR20240438 新诊断的原发性脑胶质母细胞瘤(WHO 4级) 北京启辰生生物科技有限公司 Ⅰ期临床 ChiCTR2300077339 晚期胰腺癌 中国人民解放军总医院 Ⅰ期临床 ChiCTR2300071740 HPV16/18阳性的不可切除的复发性或转移性实体瘤 南阳医学高等专科学校第一附属医院 Ⅰ期临床 ChiCTR2200066118 晚期黑色素瘤 南阳医学高等专科学校第一附属医院 Ⅰ期临床 ChiCTR2200056172 晚期实体瘤 蚌埠医学院第一附属医院 Ⅰ期临床 ChiCTR2000029301 胃癌,食管癌 深圳市新合生物医疗科技有限公司 Ⅰ期临床 ChiCTR1900023000 晚期恶性实体瘤 斯微(上海)生物科技有限公司 Ⅰ期临床 3.1 编码TSA的mRNA肿瘤疫苗
肿瘤特异性抗原是体细胞中的非同义突变产生非自体蛋白[43],仅在肿瘤细胞中表达,而在正常细胞中不表达,因此支持对患者个体肿瘤抗原产生特异性免疫反应[44]。多个编码TSA的mRNA肿瘤疫苗已完成了Ⅰ/Ⅱ期临床试验[45]。BNT 122是BioNTech 和Genentech公司联合研发的一款编码胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)患者的20种新抗原的mRNA疫苗,使用LNP进行静脉注射给药。Ⅰ期临床试验结果显示,在手术切除后的PADC患者中,将BNT 122与化疗和免疫检查点疗法联用时,该mRNA疫苗对延缓PDAC患者的复发具有潜力。目前基于BNT122针对黑色素瘤和结直肠癌的治疗处于Ⅱ期临床试验阶段,针对实体瘤的临床试验即将进行Ⅱ期临床试验[46]。
3.2 编码TAA的mRNA肿瘤疫苗
肿瘤相关抗原是是一种在正常组织中表达但在肿瘤组织中过表达的抗原。具有肿瘤特异性弱、中枢免疫耐受性强、免疫原性弱的特点[47]。目前,利用多种TAA组合开发mRNA疫苗已成为一种趋势。BI
1361849 是Ludwig癌症研究所研发的一款编码NY-ESO-1、MAGE-C2、MAGE-C1、survivin、5T4和MUC1这6种TAA的mRNA疫苗,其使用鱼精蛋白作为载体。Ⅰb期临床研究评估了BI-1361849 联合局部放疗对Ⅳ期非小细胞肺癌(non-small-cell carcinoma,NSCLC)患者的有效性和安全性,结果显示,BI-1361849 具有良好的耐受性和免疫原性。2017年12月,在美国启动了BI-1361849 与 抗程序性死亡配体1 durvalumab和抗细胞毒性T淋巴细胞相关蛋白4(CTLA-4)抗体tremelimumab联用治疗NSCLC的Ⅰ/Ⅱ期临床试验。3.3 编码免疫调节因子的mRNA肿瘤疫苗
免疫调节因子是一类能够刺激或抑制特定免疫细胞功能的分子,包括细胞因子、共刺激因子等[48]。靶向肿瘤微环境实现肿瘤免疫治疗是目前抗肿瘤技术研究的热点。免疫调节因子可以重新激活免疫系统的抗肿瘤免疫反应并重塑积极的免疫微环境[49]。此外,编码免疫调节因子的mRNA疫苗还可作为编码TAA的mRNA疫苗的佐剂。mRNA-2752是Moderna公司研发的一款编码人 OX40L、IL-23 和 IL-36γ 的mRNA疫苗,其使用LNP作为载药系统,通过瘤内注射给药。在Ⅰ期的一项剂量递增研究(NCT03739931)中,mRNA-2752与免疫检查点阻断治疗剂durvalumab共同给药显示出抗肿瘤作用。目前mRNA-2752针对于三阴性乳腺癌、泌尿上皮癌、淋巴瘤和免疫检查点难治性黑色素瘤和非小细胞肺癌的Ⅰ期临床人体耐受性试验正在进行中。
4. 总结与展望
随着分子生物学的发展,mRNA疫苗给肿瘤免疫治疗带来了前所未有的希望。通过对mRNA化学修饰的改进以及开发更高效的非病毒载体递送系统可以提高mRNA肿瘤疫苗的安全性、稳定性和递送效率。基于基因治疗的良好前景,未来mRNA肿瘤疫苗的非病毒递送系统的主要发展方向可能包含以下几个方面:①将不同类型的非病毒载体联用共同递送mRNA疫苗,以结合不同类型载体的优点,实现提高纳米粒子稳定性、生物相容性和降低毒性等目的。②对非病毒载体进行功能化修饰以实现mRNA肿瘤疫苗的靶向性、光响应性、荧光可视性、pH响应性释放等功能。③阐明非病毒载体结构与其功能的关系,以及进入人体后与肿瘤微环境的相互作用机制。目前,正在开展许多基于脂质纳米颗粒、脂质-鱼精蛋白、阳离子脂质复合物和脂质多聚复合物等非病毒递送系统的mRNA肿瘤疫苗的临床试验。相信伴随多组学技术的发展和跨学科的融合,未来肿瘤特异性抗原的筛选将变得越来越精确。随着对非病毒递送系统研究的不断深入,mRNA肿瘤疫苗将在未来的肿瘤治疗中发挥巨大的作用。
-
[1] DOMAZETOVIC V, MARCUCCI G, IANTOMASI T, et al. Oxidative stress in bone remodeling: role of antioxidants[J]. Clin Cases Miner Bone Metab,2017,14(2):209-216. doi: 10.11138/ccmbm/2017.14.1.209 [2] REN X X, LIU H, WU X M, et al. Reactive oxygen species (ROS)-responsive biomaterials for the treatment of bone-related diseases[J]. Front Bioeng Biotechnol,2022,9:820468. doi: 10.3389/fbioe.2021.820468 [3] AZMAN K F, ZAKARIA R. D-Galactose-induced accelerated aging model: an overview[J]. Biogerontology,2019,20(6):763-782. doi: 10.1007/s10522-019-09837-y [4] KOLOSOVA N G, STEFANOVA N A, KORBOLINA E E, et al. The senescence-accelerated oxys rats: a genetic model of premature aging and age-dependent degenerative diseases[J]. Adv Gerontol,2014,27(2):336-340. [5] XU W M, LIU X Y, HE X H, et al. Bajitianwan attenuates D-galactose-induced memory impairment and bone loss through suppression of oxidative stress in aging rat model[J]. J Ethnopharmacol,2020,261:112992. doi: 10.1016/j.jep.2020.112992 [6] 徐武牧. 巴戟天丸抗老年性骨质疏松作用及其制剂工艺研究[D]. 上海: 海军军医大学, 2020. [7] KIM J M, LIN C J, STAVRE Z, et al. Osteoblast-osteoclast communication and bone homeostasis[J]. Cells,2020,9(9):2073. doi: 10.3390/cells9092073 [8] Katsimbri P. The biology of normal bone remodelling[J]. Eur J Cancer Care (Engl),2017,26(6):2017Nov;26(6). [9] 夏天爽, 刘晓燕, 蒋益萍, 等. 啤酒花经抗氧化途径减轻Aβ损伤成骨细胞作用研究[J]. 药学实践杂志, 2021, 39(6):509-514. [10] AN J, YANG H, ZHANG Q, et al. Natural products for treatment of osteoporosis: the effects and mechanisms on promoting osteoblast-mediated bone formation[J]. Life Sci,2016,147:46-58. doi: 10.1016/j.lfs.2016.01.024 [11] AGIDIGBI T S, KIM C. Reactive oxygen species in osteoclast differentiation and possible pharmaceutical targets of ROS-mediated osteoclast diseases[J]. Int J Mol Sci,2019,20(14):3576. doi: 10.3390/ijms20143576 [12] KUDRYAVTSEVA A V, KRASNOV G S, DMITRIEV A A, et al. Mitochondrial dysfunction and oxidative stress in aging and cancer[J]. Oncotarget,2016,7(29):44879-44905. doi: 10.18632/oncotarget.9821 [13] SIM H J, KIM J H, KOOK S H, et al. Glucose oxidase facilitates osteogenic differentiation and mineralization of embryonic stem cells through the activation of Nrf2 and ERK signal transduction pathways[J]. Mol Cell Biochem,2016,419(1-2):157-163. doi: 10.1007/s11010-016-2760-8 [14] 孙晓蕾. 啤酒花及黄腐酚改善铁超载致学习记忆损伤及骨丢失作用研究[D]. 济南: 山东中医药大学, 2021. [15] IBÁÑEZ L, FERRÁNDIZ M L, BRINES R, et al. Effects of Nrf2 deficiency on bone microarchitecture in an experimental model of osteoporosis[J]. Oxidative Med Cell Longev,2014,2014:726590. [16] RANA T, SCHULTZ M A, FREEMAN M L, et al. Loss of Nrf2 accelerates ionizing radiation-induced bone loss by upregulating RANKL[J]. Free Radic Biol Med,2012,53(12):2298-2307. doi: 10.1016/j.freeradbiomed.2012.10.536 [17] SAMAKOVA A, GAZOVA A, SABOVA N, et al. The PI3k/Akt pathway is associated with angiogenesis, oxidative stress and survival of mesenchymal stem cells in pathophysiologic condition in ischemia[J]. Physiol Res,2019,68(Suppl 2):S131-S138. -





 下载:
下载:
 下载:
下载: