-
西红花为名贵药材,来源于鸢尾科植物番红花Crocus sativus L.的干燥柱头。原产于地中海地区、希腊、小亚细亚和伊朗,后经西藏传入国内,故又名藏红花[1]。《本草纲目》中记载番红花“主治心忧郁积、气闷不散,活血,亦治惊悸”[2]。2020版《中国药典》描述西红花具有活血化瘀、凉血解毒、解郁安神的功效[3]。越来越多的现代药理研究表明,西红花具有抗肿瘤、抗血小板聚集与凋亡、抗心血管细胞凋亡、降血脂和降血糖等活性[4–6],在健康和医疗领域具有重要作用。
世界卫生组织国际癌症研究机构(IARC)发布的最新数据,2020年全球癌症新发患者病例数超过1 930万例,癌症死亡患者接近1 000万例[7]。天然活性成分是抗肿瘤药物研发的重要来源[8]。有研究表明,西红花中特有的西红花酸、西红花苷等具有抗肿瘤活性[9],已有学者在西红花治疗结直肠癌、乳腺癌等的抗肿瘤作用方面进行了相关研究[10-11],但其主要活性成分及抗肿瘤作用机制仍需进一步探索。
网络药理学[12]将系统生物学、生物信息学、计算生物学、网络科学和靶向药理学相结合,从系统层次和生物网络的整体角度探讨成分—靶标—通路的相互作用关系,为中药多靶点、多成分、系统性、整体性的作用机制研究提供了有力的技术支撑,从而指导新药研发和临床诊疗。因此,本研究应用网络药理学结合反向分子对接的方法,对西红花的抗肿瘤作用成分及靶点机制进行研究,为深入探索西红花抗肿瘤药效物质基础及作用机制提供参考。
-
利用TCMSP平台获取西红花化学成分,口服生物利用度(oral bioavailability,OB)和类药性(drug-likeness,DL) 是药物筛选的关键参数,一般设置OB≥30%和DL≥0.18的化学成分作为候选药效成分,并结合文献报道[13–15]补充4个西红花化学成分。
-
应用TCMSP平台和PharmMapper[16]工具获取西红花活性成分的作用靶点,并借助UniProt数据库将靶点转换为对应基因。以“tumor”、“cancer”为关键词,在GeneCards(https://www.genecards.org/)、OMIM数据库(https://www.omim.org/)和TTD数据库(http://db.idrblab.net/ttd/)进行检索。将得到的疾病靶点和药物靶点取交集,作为药物作用于疾病的预测靶点。
-
根据预测的西红花药效成分、交集靶点,使用Cytoscape 3.9.1软件建立“成分-靶点”的网络图。
-
将药物疾病交集靶点输入String数据库构建PPI网络进行初步筛选,再将PPI网络导入Cytoscape 3.9.1中,以半数degree为参考标准,选取关键靶点。
-
将筛选获得的37个核心靶点录入Metascape平台(http://metascape.org/gp/index.html),物种设置为人,选择Custom Analysis,设置P<0.01,进行基因本体(gene ontology,GO)功能富集分析及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。
-
将筛选出的西红花主要活性成分通过PubChem下载SDF格式;利用RCSB PDB数据库下载关键蛋白靶点,优先选择有配体、结构相对完整的晶体结构,并采用AutoDock Tools对获取的PDB蛋白分子进行除水、加氢、计算电荷预处理;使用AutoDock Vina进行分子对接,计算结合能;选取最优构象,使用PyMOL软件做出3D结合模式图。
-
通过TCMSP获得70个西红花化学成分,设置OB≥30%且DL≥0.18进行筛选,再添加文献检索相关成分,共获得9个西红花活性成分,见表1。
表 1 西红花活性成分
序号 化合物编号 化合物英文名 中文名 OB (%) DL 1 MOL001389 n-heptanal 庚醛 79.74 0.59 2 MOL001406 crocetin 西红花酸 35.3 0.26 3 MOL000354 isorhamnetin 异鼠李素 49.6 0.31 4 MOL000422 kaempferol 山柰酚 41.88 0.24 5 MOL000098 quercetin 槲皮素 46.43 0.28 6 MOL001405 crocin Ⅰ 西红花苷Ⅰ 2.54 0.12 7 MOL001407 crocin Ⅱ 西红花苷Ⅱ 1.65 0.21 8 MOL000720 safranal 藏红花醛 39.56 0.04 9 MOL001409 picrocrocin 苦番红花素 33.71 0.04 -
将TCMSP平台和PharmMapper获取结果进行整理,并借助UniProt数据库进行靶基因匹配,获得201个潜在靶点。以“tumor”和“cancer”为关键词,在GeneCards、OMIM和TTD数据库进行预测整理,剔除重复,筛选得到5896个潜在疾病靶点。将得到的疾病靶点和药物靶点取交集,共得到可作为药物作用于疾病的179个预测靶点。
-
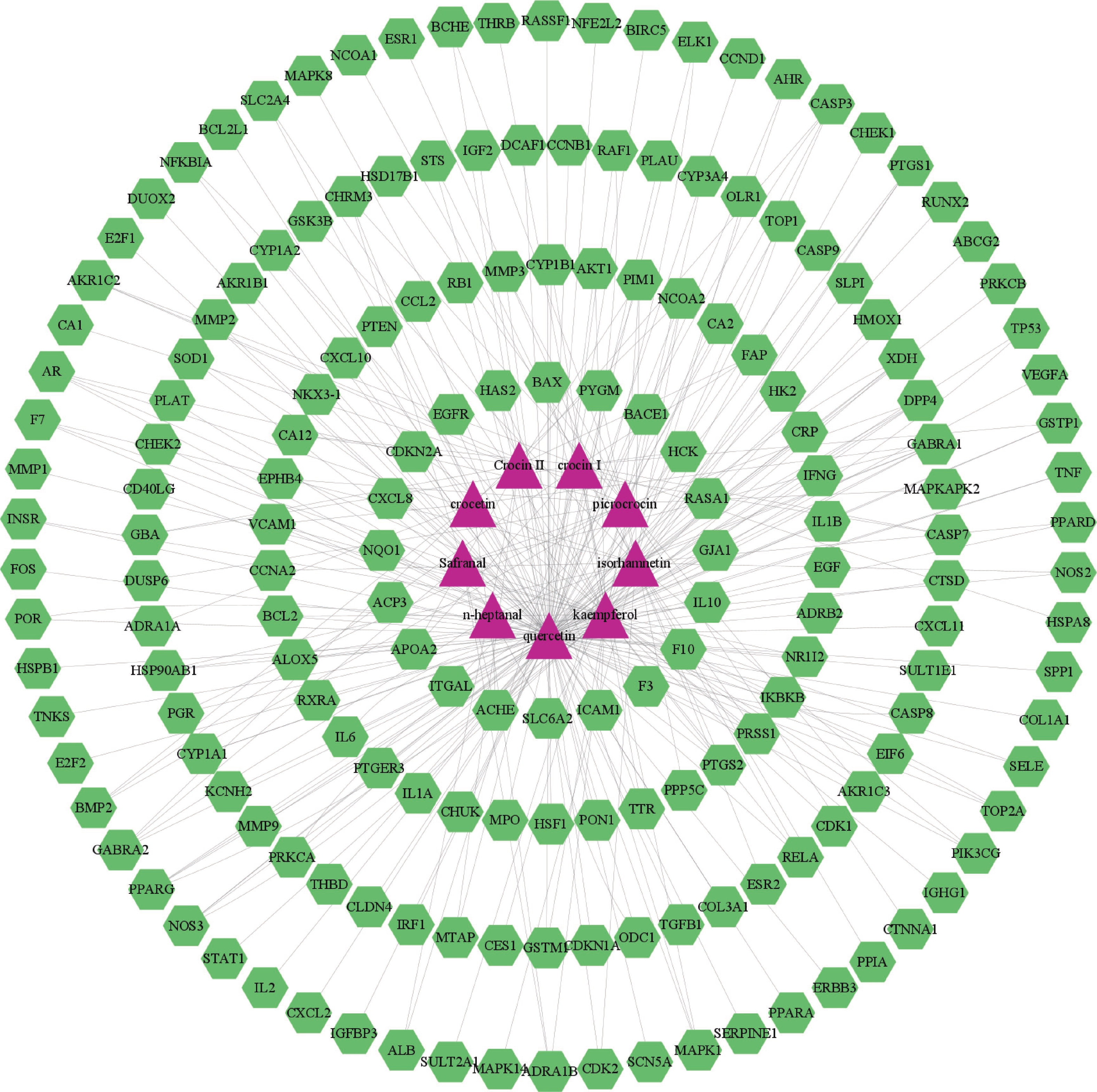
将西红花的9个活性成分与预测到的179个潜在靶点导入Cytoscape 3.9.1软件,构建“药物-活性成分-靶点”网络(图1),网络中绿色代表药物作用于疾病的靶点,蓝色代表西红花活性成分,全图包括189个节点、299条边,其中degree值排名靠前的活性成分为槲皮素、山柰酚、异鼠李素、苦番红花素和西红花苷Ⅰ,这些可能是西红花发挥抗肿瘤作用的潜在活性成分。
-
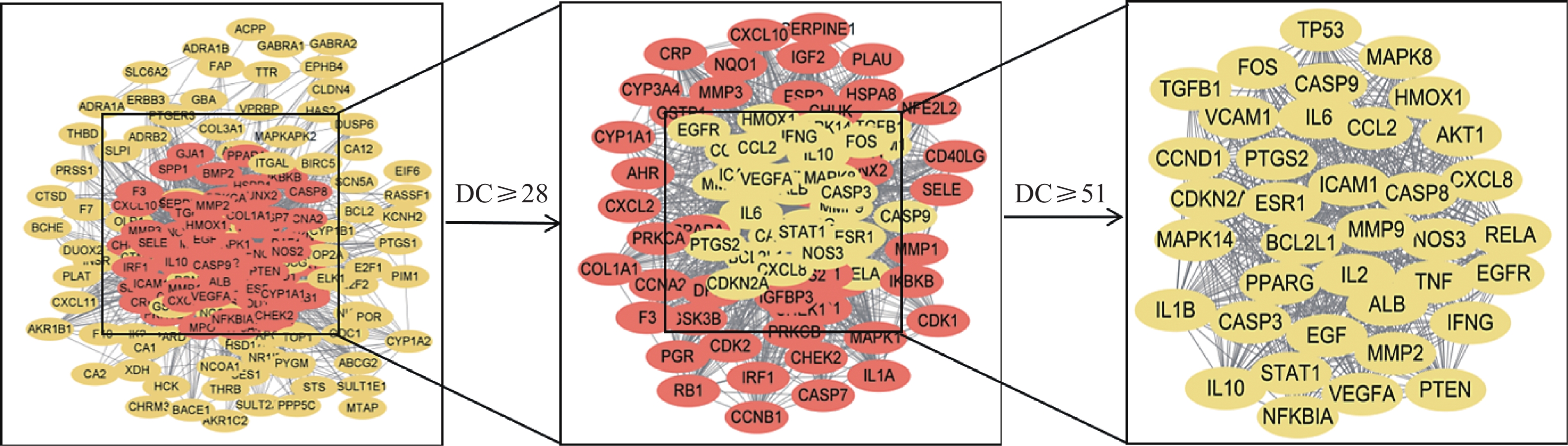
将疾病与活性成分的潜在靶点导入String数据库,采用Cytoscape 3.9.1软件绘制PPI网络图,依据degree值进行排序,以大于半数degree值为标准进行两次筛选,获取核心靶点37个(图2)。度值排名前5的靶点分别为EGF、MMP9、NFKBIA、IL-1B和IL-10,提示这些靶点可能是西红花发挥抗肿瘤作用的关键潜在靶点。
-
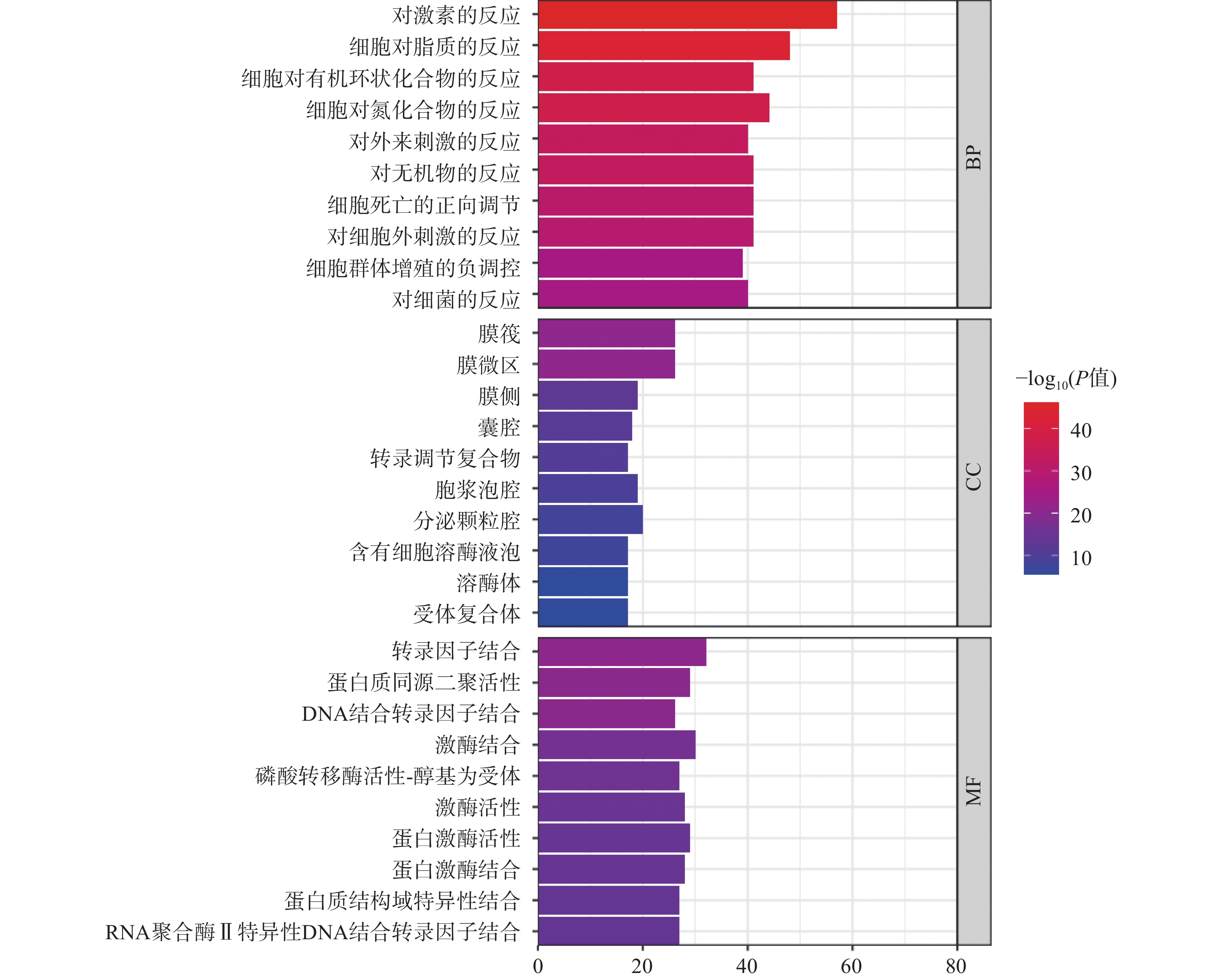
GO分析常用于注释基因和基因产物生物功能,分析包括生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组成(cellular component,CC)三部分。此次GO富集分析共得到BP富集结果193个、CC富集结果83个和MF富集结果123个,选取排名前10的条目绘制GO功能分析图(图3)。如图3所示,BP主要涉及对激素的反应、对脂质的反应、对异源刺激的反应等;CC主要涉及膜筏、膜微区、囊腔、细胞质囊泡腔等;MF主要涉及转录因子结合、DNA结合转录因子结合、RNA聚合酶Ⅱ特异性DNA结合转录因子结合等。通过比较发现,细胞生物过程富集的基因数较多,说明西红花可能主要通过调节生物过程发挥抗肿瘤作用。
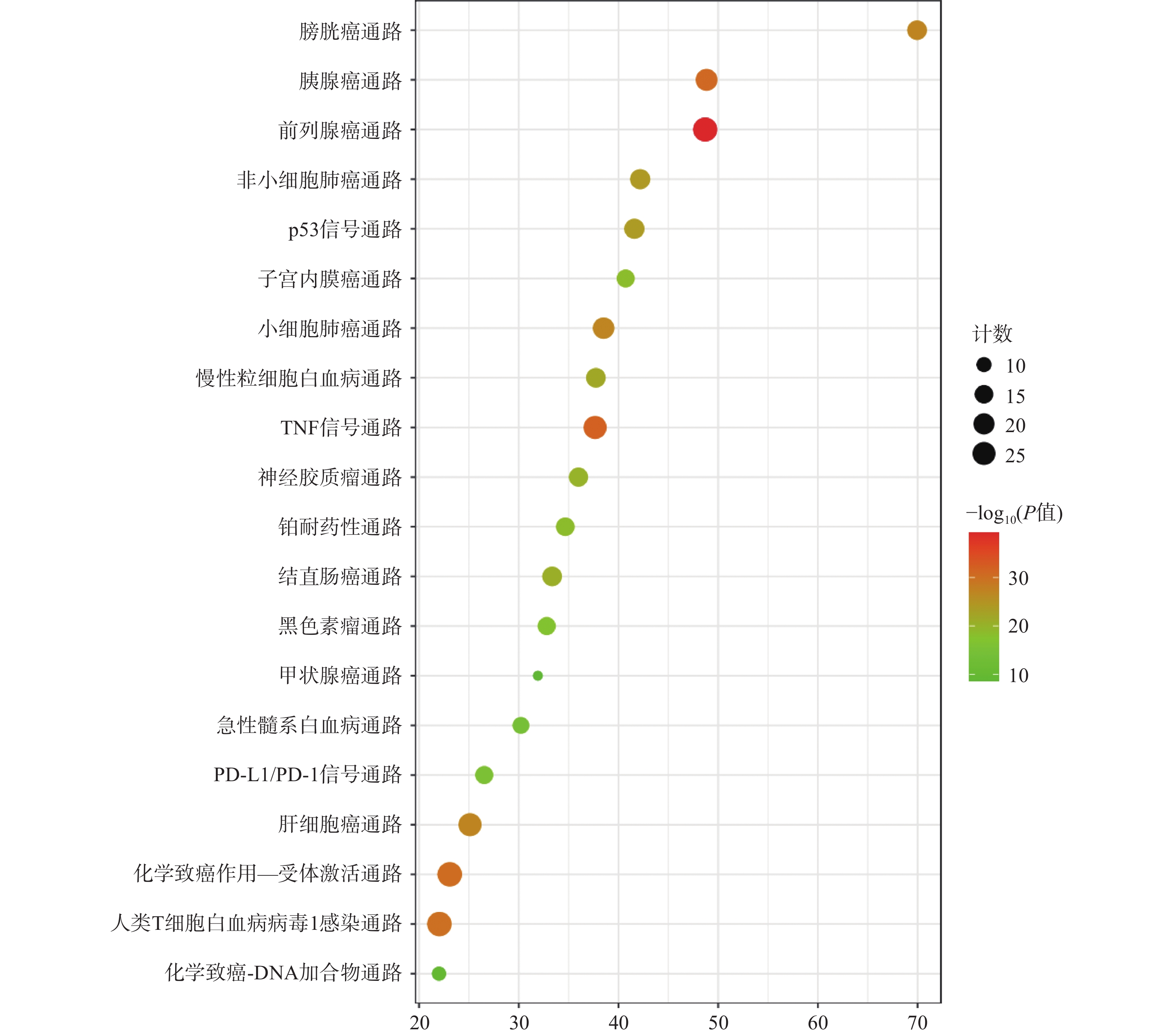
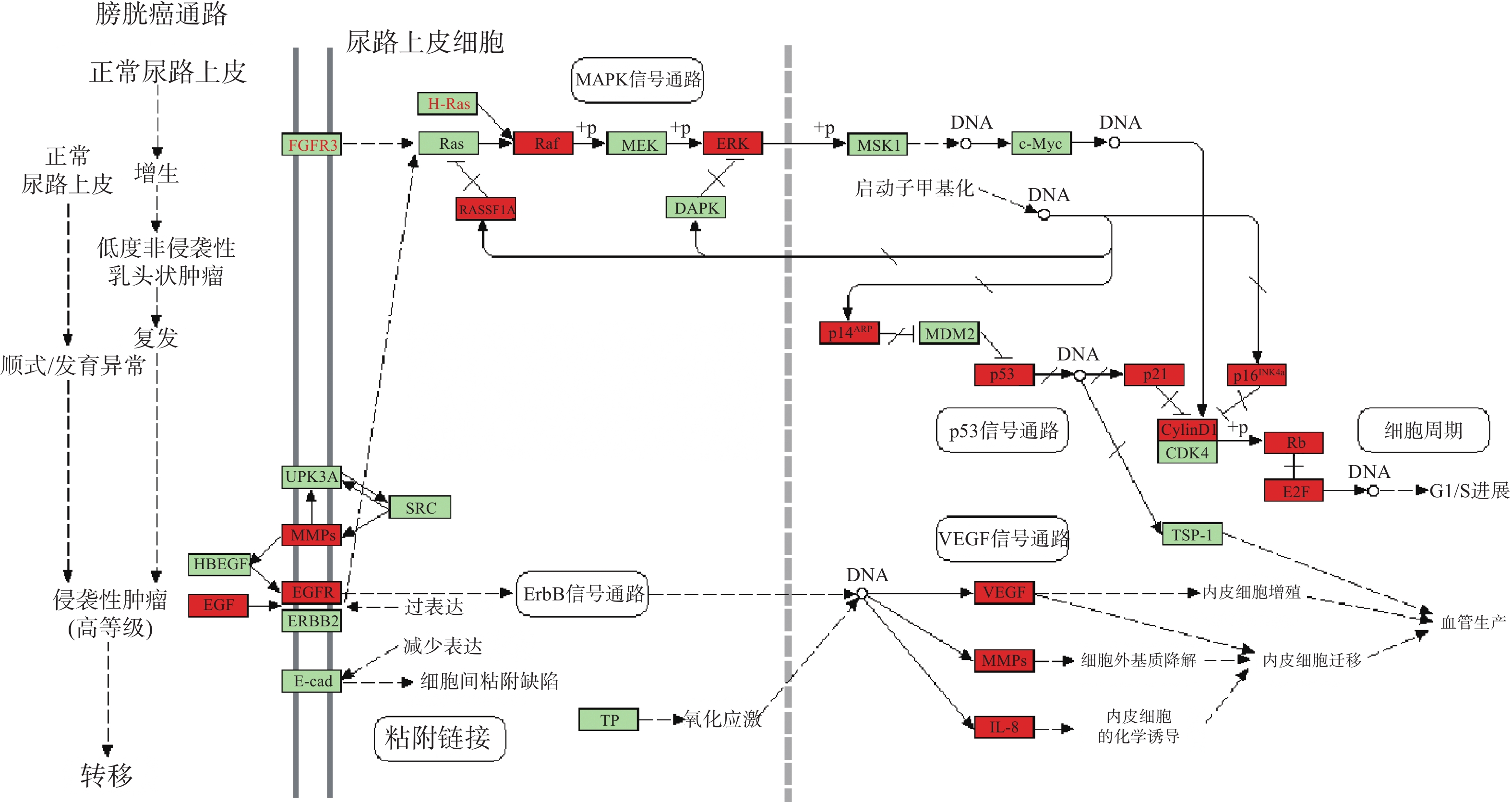
KEGG分析共富集到194条信号通路,其中34条癌症相关通路,并对前20条通路绘制气泡图(图4)。依据KEGG分析,西红花可能通过p53信号通路、TNF通路发挥抗肿瘤作用,可能对膀胱癌、胰腺癌、前列腺癌、非小细胞肺癌等肿瘤具有治疗作用,西红花靶点-通路相互作用网络见图5,红色三角形代表与肿瘤相关的信号通路,蓝色矩形代表关键靶点。其中,西红花通过膀胱癌信号通路调控EGF、MMPs、Raf、VEGF、ERK等基因发挥抗肿瘤作用(图6),红色矩形代表西红花可能干预的关键靶点。
-
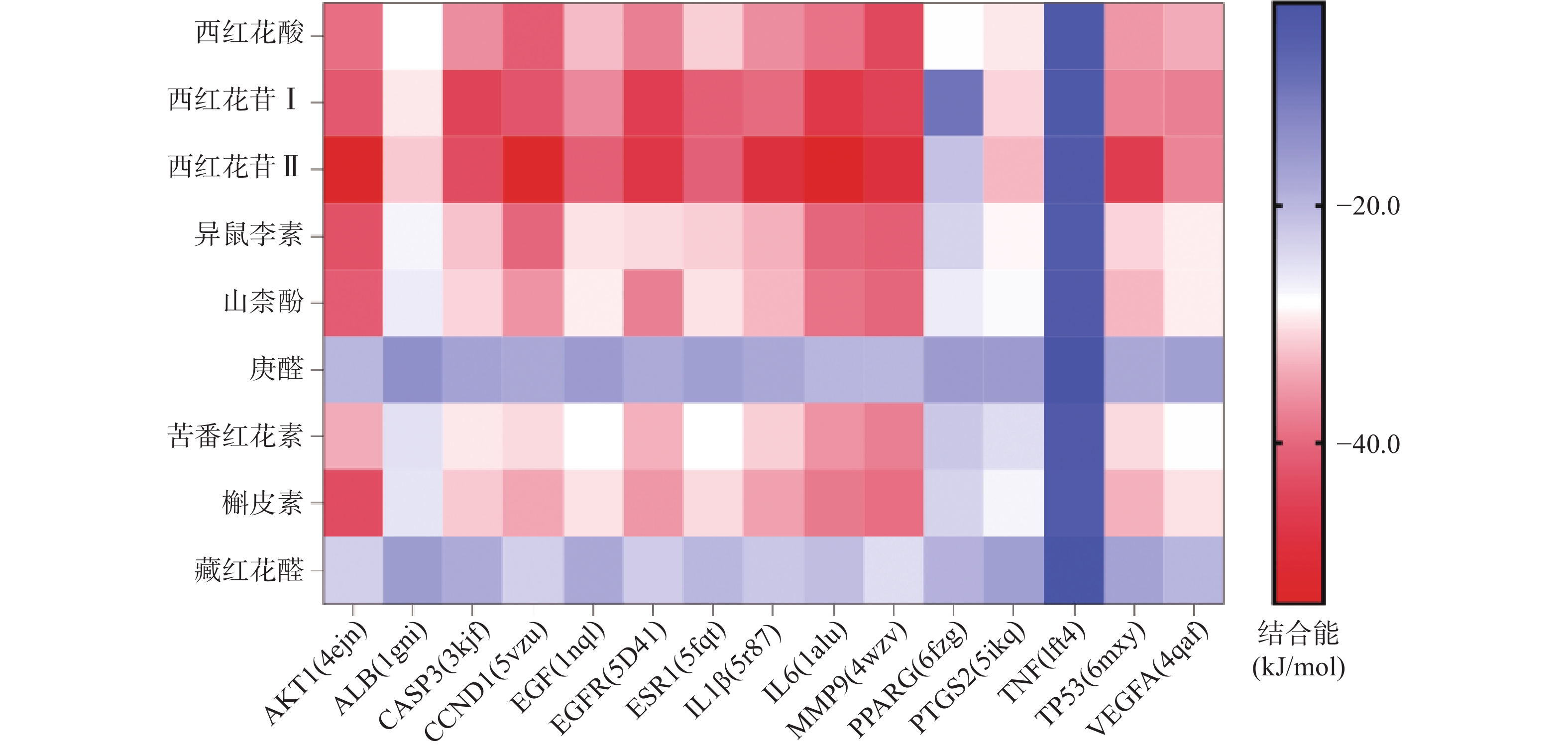
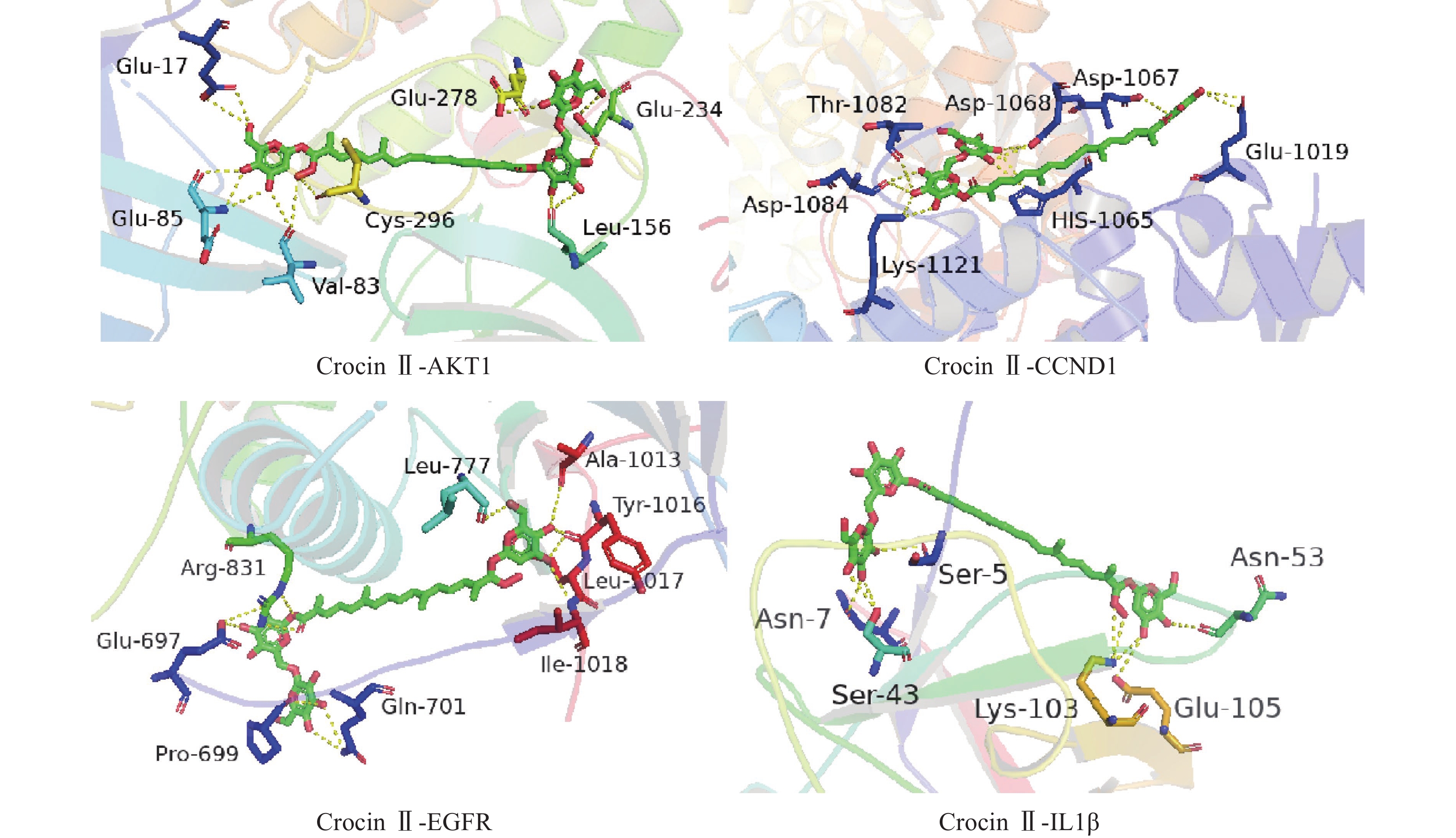
将前15个潜在核心靶点与西红花活性成分进行分子对接。结合能(affinity)<0表明配体分子能够与受体蛋白自发结合,结合能≤−17.78 kJ/mol表明配体与受体有一定的结合活性,结合能≤−20.92 kJ/mol 表明配体与受体有较好的结合活性,结合能≤−29.29 kJ/mol 表明配体与受体有强的结合活性[17],且结合能越低,表明对接的效果越好,结合的构象越稳定[18]。经AutoDock Vina对接,将得到的结合能数据使用热图展示(图7)。本研究结合自由能小于−20.92kJ/mol 的活性成分有102个,占75.6%;小于−29.29kJ/mol 的活性成分有73个,占54.1%,可见这些核心化合物与受体结合活性较高,结构相对稳定。选取结合能力最好的4个组合用Pymol软件进行可视化处理(图8)。
-
肿瘤的发生和发展是多基因、多步骤的结果。中药多成分、多靶点的特点使其在肿瘤治疗方面有独特的优势。大量的临床实践表明,中药在治疗肿瘤中能够改善症状、提高患者生存质量、延长生存期等,有着其他治疗药物及手段不可替代的作用[19-20]。以中药黄芪为例,不仅可以通过Wnt5/β-catenin信号通路抑制肿瘤生长[21],同时具有通过PD-L1下调诱导耐药黑色素瘤的干性抑制和化疗敏感性增强的作用,可以减少化疗药物用量[22],还能充当免疫佐剂,提高患者免疫力,改善生存质量[23]。网络药理学最大的优势在于可以运用系统生物学的分析,为中药多成分、多靶点、多通路的机制研究提供有力的技术支撑[12],其分析理念和技术路径又与中医药治疗疾病的整体观相契合,已用于多种中药和中药复方作用机制的研究,如灯盏细辛、半枝莲等中药和茵陈蒿汤、桃红四物汤等中药复方,利用网络药理学的方法得到治疗机制的详细阐述和证明[24–27],为中药药理作用机制的探索提供了很好的参考。
本研究发现西红花中多种成分,如西红花酸、西红花苷等可与IL-6、AKT1、CCND1、IL-1β、MMP9、EGFR、TP53靶点产生适度结合,提示这些靶点可能是西红花中活性成分发挥抗肿瘤作用的关键靶点。研究发现,AKT1是PI3K-AKT-mTOR信号通路中的重要靶点,被磷酸化激活后可以促进细胞的增殖与存活,与肿瘤细胞的生长密切相关[28]。多项研究表明,通过抑制AKT1可以治疗肺癌、结肠癌、卵巢癌等多种实体癌[29]。EGFR与一些全球发病率和致死率高的癌症发病机制直接或间接相关,包括肺癌、乳腺癌和结直肠癌等[30]。当EGFR过度表达时,细胞表面会出现过量的受体,诱导正常的细胞转化为癌细胞,并为癌细胞持续生存提供条件[31]。CCND1是细胞周期家族的一员[32],公认的原癌基因,在甲状旁腺瘤、乳腺癌、肝癌及食管、肺、头颈部鳞状细胞癌的发生、发展过程中均起着重要作用[33-34]。西红花苷是由西红花酸和龙胆二糖或葡萄糖结合形成的二萜苷类化合物,西红花苷Ⅰ和西红花苷Ⅱ的差别在于分子中糖苷基数目的多少 [35]。西红花酸已具有抗肿瘤作用,以其为苷元形成的西红花苷同样也表现出较好的抗肿瘤活性,其中西红花苷Ⅱ的表现最好。西红花苷可以通过P53途径下调细胞周期蛋白d1和p21的表达,诱导细胞凋亡和细胞周期停滞,从而抑制肿瘤生长[36]。分子对接的结果与GO富集分析、KEGG通路富集分析结果一致,验证了网络药理学分析结果的正确性。
Buyun等学者在肝癌Hep3B和HepG2细胞中使用西红花苷抑制了IL-6对STAT3以及细胞周期蛋白D1的激活,验证了西红花对肝癌细胞的抗增殖,凋亡和阻断入侵作用[37]。在转移性乳腺癌的研究中,Ali等研究人员在体内和体外实验中均证明了西红花苷可以通过VEGF和MMP9下调发挥抗肿瘤作用,而且对乳腺癌的转移扩散有较好的抑制作用[38]。这些研究成果在一定程度上验证了利用网络药理学探究发现的西红花抗肿瘤作用机制的可行性。
综上所述,本研究利用网络药理学结合分子对接技术,探究西红花抗肿瘤作用的活性成分、作用靶点及信号通路。发现西红花抗肿瘤的作用具有多成分、多靶点、多通路、多机制的特点,其中以西红花苷为代表的西红花特有化学成分显示出了良好的抗肿瘤活性,可以在多条肿瘤发生通路中发挥作用,为西红花治疗肿瘤的深入研究提供了理论基础。但这些结果受限于各个数据库信息的片面性,而且只关注了成分,没有考量到成分的含量及其之间是否存在相互作用,预测的结果存在一定的片面性和局限性,需要进一步进行体内、外实验验证。
Anti-tumor mechanism study on saffron by network pharmacology and reverse molecular docking
-
摘要:
目的 运用网络药理学和反向分子对接技术探讨西红花抗肿瘤的作用机制。 方法 通过检索文献和从中药系统药理学数据库(TCMSP)获取西红花的主要化学成分,利用PharmMapper服务器预测西红花活性成分的潜在靶点,通过UniProt数据库将西红花潜在靶点转换为对应的靶标基因,与GeneCards、OMIM和TTD数据库获得的肿瘤相关靶点进行映射分析,得到西红花抗肿瘤的潜在作用靶点。采用Cytoscape软件构建西红花“活性成分-靶点-疾病”相互作用网络,通过String数据库进行蛋白-蛋白相互作用分析,并利用Metascape平台进行GO功能和KEGG通路富集分析。使用AutoDock、Pymol软件对活性成分与关键靶点进行分子对接验证。 结果 共筛选出西红花中槲皮素、山柰酚、异鼠李素、苦番红花素和西红花苷Ⅰ等9个活性成分,可能作用于AKT1、CCND1、MMP9、EGFR、TP53等37个关键靶点,涉及P53信号通路及TNF信号通路等。分子对接显示可通过氢键、疏水作用等产生稳定结合。 结论 初步探讨了西红花抗肿瘤的主要活性成分、关键靶点及通路,提示可通过诱导细胞凋亡等方式发挥抗肿瘤作用,为后续实验验证提供参考依据。 Abstract:Objective To explore the anti-tumor mechanism of saffron (Crocus sativus L.) by network pharmacology and reverse molecular docking techniques. Methods The main chemical components of saffron were obtained by searching published literature and TCMSP database. The potential targets of these components were predicted using PharmMapper server. The corresponding target genes were identified from UniProt database. The underlying anti-tumor targets of saffron were obtained by mapping the disease genes of cancer or tumor with GeneCards, OMIM and TTD databases. Cytoscape software was used to construct the action target network of saffron active components. The protein-protein interaction analysis was performed by String database, and the GO function and KEGG pathway enrichment analysis were performed by Metascape platform. Finally, molecular docking was performed to evaluate the binding of main components with their potential targets. Results A total of 9 active ingredients in saffron including quercetin, kaempferol, isorhamnetin, picrocrocin and crocin I, were identified, which might act on 37 key targets including AKT1, CCND1, MMP9, EGFR, TP53, involved in P53, TNF and other signaling pathways. Molecular docking indicated modest binding potency through hydrogen bonding, and hydrophobic interactions. Conclusion The anti-tumor effect of saffron was evaluated via the network of components-targets-pathways, which might provide a foundation for further research. -
Key words:
- saffron /
- network pharmacology /
- molecular docking /
- anti-tumor mechanism
-
急性心肌梗死经皮冠状动脉介入治疗(PCI)支架术后基本药物治疗包括抗栓、抗心肌缺血治疗、改善患者预后等,其中PCI术后抗栓方案的选择尤其重要[1-2]。对于心脏瓣膜病,特别是瓣膜修补术后的抗栓方案的选择,各国指南推荐不尽相同,国内该领域尚缺乏充足的临床证据[3-4]。对于急性心梗后PCI支架术后合并三尖瓣修补术(瓣环)抗栓方案的选择更是缺乏临床指南或专家共识以指导医师用药。本文就1例心梗合并器质性心脏病行手术治疗患者的抗栓方案进行用药指导,旨在为该类患者抗栓方案的选择提供合适的用药依据。
1. 病例资料
患者,女性,72岁,2019年9月13日无明显诱因突发胸痛,遂于次日入院就诊。既往史:有高血压病史1年,无其他慢性病史,无吸烟、饮酒史。急诊心电图示急性前壁心肌梗死,予阿司匹林肠溶片300 mg嚼服+替格瑞洛片180 mg口服,行急诊PCI术。冠脉造影结果:LAD近段于第一间隔支发出前完全闭塞,TIMI血流0级,植入1枚药物支架至LAD近段。术后收治心血管内科进一步诊治。入院诊断:①急性前壁心肌梗死;②室间隔穿孔;③心功能Ⅳ级(Killip分级);④心源性休克;⑤冠心病;⑥高脂血症。
9月14日考虑患者室间隔穿孔,心梗后机械并发症,立即至导管室行主动脉球囊反搏术+深静脉置管术,后心超检查提示室间隔穿孔(0.75 cm、0.46 cm),左室心尖部附壁血栓形成待排。9月15日患者转入心胸外科监护室。9月17日行室间隔穿孔修补+室壁瘤切除+三尖瓣成形术(爱德华30 mm三尖瓣成形环),术后常规给予阿司匹林联合氯吡格雷抗血小板治疗,依诺肝素钠注射液抗凝治疗,患者恢复良好。9月23日抗栓药物调整为阿司匹林+氯吡格雷+华法林。10月12日患者出现胸闷,伴大汗淋漓,再次收治心胸外科,胸部CT示右侧胸腔积液,行胸腔闭式引流术,常规给予强心、利尿、抗感染、抗栓(阿司匹林肠溶片+氯吡格雷+华法林)等对症支持治疗。10月23日复查CT示积液减少,转老年科继续治疗,抗栓方案为阿司匹林+替格瑞洛片+华法林,另进行调脂稳斑、控制心室率、强心、利尿等治疗。10月25日临床药师查房建议,抗栓药物调整为阿司匹林+氯吡格雷+华法林。11月1日患者无不适主诉,遂带药出院。此后,临床医师和药师电话随访,该患者自诉无不适症状。
2. 抗栓治疗分析及药学监护
该患者首次入院后行PCI术支架植入术,根据《冠心病合理用药指南(第2版)》[2],行PCI的急性冠状动脉综合征患者,应双联抗血小板治疗,疗程12~36个月。2017年ESCDAPT指南[5]推荐,对于行PCI的稳定性冠心病患者,在考虑了缺血风险和出血风险后,可考虑替格瑞洛替代氯吡格雷联合阿司匹林治疗,目前新版指南对于替格瑞洛已为ⅠA类推荐。心血管内科给予阿司匹林联合替格瑞洛抗血小板治疗,同时给予依诺肝素钠抗凝,抗栓方案选择合理。
9月17日转入心胸外科行室间隔穿孔修补+室壁瘤切除+三尖瓣成形术(爱德华30 mm三尖瓣成形环)。术后给予患者抗栓方案:阿司匹林+氯吡格雷+依诺肝素钠抗栓治疗。临床药师查阅指南文献发现,目前国内外只有二尖瓣以及主动脉瓣修补术后抗栓方案的指南,且抗栓药物的推荐意见有很大差别,未明确三尖瓣修补术后抗栓药物选择方案[4-5]。临床药师结合国内用药情况,针对三尖瓣成形术给予华法林抗凝,但考虑患者72岁高龄,三尖瓣瓣膜修补术内膜化速度慢,因此建议国际标准化比值(INR)控制在1.6~2.0,使用6个月。9月23日,调整抗栓方案为阿司匹林+氯吡格雷+华法林。
10月23日,患者转老年科继续治疗,医师考虑患者目前PCI术后1月余,且是心脑血管疾病极高危患者,给予阿司匹林及替格瑞洛抗血小板治疗,同时给予华法林抗凝。临床药师查房指出抗栓方案不合理,《冠心病合理用药指南(第2版)》[2]不推荐替格瑞洛或普拉格雷作为抗血小板药物组成三联抗栓治疗,出血风险极大。替格瑞洛是一种新型强效P2Y12受体拮抗剂,Husted等[6]研究表明,替格瑞洛较氯吡格雷进一步改善ACS患者的预后,总出血、大出血、轻微出血事件发生风险相对较高[7-8]。临床医师采纳,及时停用替格瑞洛。10月25日,抗栓方案改为阿司匹林+氯吡格雷+华法林。药师建议INR控制在1.6~2.0,定期复查凝血酶原时间(PT)和INR(表1)。住院期间,患者情况良好,无出血迹象。
表 1 患者住院期间的凝血酶原时间和国际标准化比值项目 10月24日 10月29日 10月31日 凝血酶原时间(t/s) 16.5 15.1 17.5 国际标准化比值 1.47 1.34 1.56 患者出院需制定合理的用药方案,考虑该患者出院后1~3个月患者栓塞风险大,临床药师建议3联抗栓,4~6个月为减低该高龄患者出血风险暂停氯吡格雷,6个月后暂停华法林使用,7~12个月继续双联抗血小板,1年后患者口服阿司匹林进行冠心病二级预防,临床医师采纳。具体方案见表2。
表 2 患者出院后抗栓药物治疗方案药物 1~3个月 4~6个月 7~12个月 1年后 阿司匹林肠溶片100 mg,qd √ √ √ √ 硫酸氢氯吡格雷片75 mg,qd √ √ 华法林片1.5 mg,qod √ √ 3. 用药教育及健康随访
首先,氯吡格雷为CYP2C19、CYP3A4、CYP3A5的代谢底物,需要避免与奥美拉唑等CYP2C19酶抑制剂合用,以防疗效降低;他汀类药物经CYP3A4途径代谢与氯吡格雷发生相互作用,患者高血脂,临床药师建议选择相互作用更小的瑞舒伐他汀(CYP3A4弱代谢)[9]。其次,阿司匹林与氯吡格雷合用,可通过多种途径干扰正常凝血过程的发生,出血风险可能增加。60岁及以上老年患者表现出比华法林的抗凝作用更大的INR反应,因此老年人在任何有增加出血风险的情况或身体状况下,使用华法林需要进行更频繁的出血监测。阿司匹林还有可能从血浆结合处置换出华法林,两者合用出血风险增加,不良反应以胃肠道出血最为常见。因此,临床药师告知患者服药期间需要定期复查PT和INR,监测有无出血,包括大小便颜色、皮肤浅表出血点、血肿及其他出血现象,如有异常,及时就诊。另外,劝告患者积极控制好高血压、高血脂等危险因素。患者出院后的1年内,临床药师每3个月随访一次,均未发现任何出血及栓塞风险,依从性良好,按原方案给药。
4. 小结和展望
该患者是1例PCI支架术后合并三尖瓣修补术患者,高龄,既往高血压病史,属于血栓高危人群,针对围手术期抗凝和抗血小板药物的选择十分重要。临床药师关注患者抗栓治疗的全过程用药情况,对于医师的不合理抗栓方案及时干预,结合临床指南与患者病情制定最优抗栓方案,确保患者最低栓塞风险和最小出血风险;对于心脏瓣膜病,特别是瓣膜修补术后的抗栓方案的选择,提供了一定参考。该患者入院后,周转科室多且用药复杂,临床药师从关注药物相互作用、积极进行患者教育等多个方面进行药学监护,保证了患者用药安全、合理、有效,体现了临床药师的价值。
-
表 1 西红花活性成分
序号 化合物编号 化合物英文名 中文名 OB (%) DL 1 MOL001389 n-heptanal 庚醛 79.74 0.59 2 MOL001406 crocetin 西红花酸 35.3 0.26 3 MOL000354 isorhamnetin 异鼠李素 49.6 0.31 4 MOL000422 kaempferol 山柰酚 41.88 0.24 5 MOL000098 quercetin 槲皮素 46.43 0.28 6 MOL001405 crocin Ⅰ 西红花苷Ⅰ 2.54 0.12 7 MOL001407 crocin Ⅱ 西红花苷Ⅱ 1.65 0.21 8 MOL000720 safranal 藏红花醛 39.56 0.04 9 MOL001409 picrocrocin 苦番红花素 33.71 0.04 -
[1] 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 2020: 122 [2] 李时珍. 本草纲目[M]. 天津: 天津科学技术出版社, 2019: 368. [3] 国家药典委员会. 中华人民共和国药典-一部: 2020年版[M]. 北京: 中国医药科技出版社, 2020. [4] 邓颖, 郭志刚, 曾兆麟, 等. 藏红花的药理研究进展[J]. 中国中药杂志, 2002, 27(8):565-568. doi: 10.3321/j.issn:1001-5302.2002.08.002 [5] 张娜, 李林森. 藏红花药理作用研究进展[J]. 药物评价研究, 2013, 36(5):394-396. [6] 何美莲, 陈家宽, 周铜水. 番红花化学成分及生物活性研究进展[J]. 中草药, 2006, 37(3):466-470. doi: 10.3321/j.issn:0253-2670.2006.03.054 [7] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2021,71(3):209-249. doi: 10.3322/caac.21660 [8] HUANG M, LU J J, DING J. Natural products in cancer therapy: past, present and future[J]. Nat Prod Bioprospect,2021,11(1):5-13. doi: 10.1007/s13659-020-00293-7 [9] BAI X, MU S, ZHANG W, et al. Mechanism of natural product crocin in the treatment of lung adenocarcinoma targeting TMEM16A ion channel[J]. SCIENTIA SINICA Vitae,2021,51(9):1299-1307. doi: 10.1360/SSV-2021-0268 [10] XU Q X, YU J S, JIA G W, et al. Crocin attenuates NF-κB-mediated inflammation and proliferation in breast cancer cells by down-regulating PRKCQ[J]. Cytokine,2022,154:155888. doi: 10.1016/j.cyto.2022.155888 [11] GÜLLÜ N, KOBELT D, BRIM H, et al. Saffron crudes and compounds restrict MACC1-dependent cell proliferation and migration of colorectal cancer cells[J]. Cells,2020,9(8):1829. doi: 10.3390/cells9081829 [12] World Federation of Chinese Medicine Societies;. 网络药理学评价方法指南[J]. 世界中医药, 2021, 16(4):527-532. doi: 10.3969/j.issn.1673-7202.2021.04.001 [13] 江雪, 刘梦璠, 刘华, 等. 西红花的资源分布及抗肿瘤研究进展[J]. 世界科学技术-中医药现代化, 2021, 23(9):3251-3263. [14] COLAPIETRO A, MANCINI A, D'ALESSANDRO A M, et al. Crocetin and crocin from saffron in cancer chemotherapy and chemoprevention[J]. Anticancer Agents Med Chem,2019,19(1):38-47. doi: 10.2174/1871520619666181231112453 [15] BOLHASSANI A, KHAVARI A, BATHAIE S Z. Saffron and natural carotenoids: biochemical activities and anti-tumor effects[J]. Biochim Biophys Acta BBA Rev Cancer,2014,1845(1):20-30. doi: 10.1016/j.bbcan.2013.11.001 [16] LIU X F, OUYANG S S, YU B, et al. PharmMapper server: a web server for potential drug target identification using pharmacophore mapping approach[J]. Nucleic Acids Res, 2010, 38(Web Server issue): W609-W614. [17] TROTT O, OLSON A J. AutoDock Vina: improving the speed and accuracy of docking with a new scoring function, efficient optimization, and multithreading[J]. J Comput Chem,2010,31(2):455-461. [18] PINZI L C, RASTELLI G. Molecular docking: shifting paradigms in drug discovery[J]. Int J Mol Sci,2019,20(18):4331. doi: 10.3390/ijms20184331 [19] HOU J, SHI K, LIU Y, et al. Effects of traditional Chinese medicine adjuvant therapy on the survival of patients with primary liver cancer[J]. Evid Based Complement Alternat Med,2022,2022:9810036. [20] LIU L, WEI Y, TENG Y, et al. Health-related quality of life and utility scores of lung cancer patients treated with traditional Chinese medicine in China[J]. Patient Prefer Adherence,2022,16:297-306. doi: 10.2147/PPA.S344622 [21] BIAN Y, WANG G, ZHOU J, et al. Astragalus membranaceus (Huangqi) and Rhizoma curcumae (Ezhu) decoction suppresses colorectal cancer via downregulation of Wnt5/β-Catenin signal[J]. Chin Med,2022,17(1):11. doi: 10.1186/s13020-021-00564-6 [22] GONG Q Y, YU H, DING G Q, et al. Suppression of stemness and enhancement of chemosensibility in the resistant melanoma were induced by Astragalus polysaccharide through PD-L1 downregulation[J]. Eur J Pharmacol,2022,916:174726. doi: 10.1016/j.ejphar.2021.174726 [23] 王超楠, 程东岩, 王健, 等. 黄芪及复方黄芪制剂双向免疫调节作用研究进展[J]. 中华中医药学刊, 2021, 39(5):126-129. doi: 10.13193/j.issn.1673-7717.2021.05.031 [24] CHEN Z Q, LIN T, LIAO X Z, et al. Network pharmacology based research into the effect and mechanism of Yinchenhao Decoction against Cholangiocarcinoma[J]. Chin Med,2021,16(1):13. doi: 10.1186/s13020-021-00423-4 [25] ZHAO J, LV C, WU Q L, et al. Computational systems pharmacology reveals an antiplatelet and neuroprotective mechanism of Deng-Zhan-Xi-Xin injection in the treatment of ischemic stroke[J]. Pharmacol Res,2019,147:104365. doi: 10.1016/j.phrs.2019.104365 [26] 杨沙, 段灿灿, 晏仁义, 等. 基于网络药理学的半枝莲抗肿瘤活性成分及整合作用机制研究[J]. 中草药, 2018, 49(15):3471-3482. doi: 10.7501/j.issn.0253-2670.2018.15.003 [27] 王伟军, 段雪云, 汪伟. UPLC-Q-TOF-MS联合网络药理学和实验验证分析桃红四物汤治疗软组织损伤的作用机制[J]. 中国中药杂志, 2021, 46(12):3043-3051. doi: 10.19540/j.cnki.cjcmm.20210311.403 [28] 赵家义, 韩一平. PI3K-AKT-mTOR信号通路抑制剂与肿瘤免疫治疗[J]. 中国肿瘤生物治疗杂志, 2017, 24(12):1424-1430. doi: 10.3872/j.issn.1007-385X.2017.12.015 [29] YAP T A, YAN L, PATNAIK A, et al. First-in-man clinical trial of the oral pan-AKT inhibitor MK-2206 in patients with advanced solid tumors[J]. J Clin Oncol,2011,29(35):4688-4695. doi: 10.1200/JCO.2011.35.5263 [30] WEE P, WANG Z X. Epidermal growth factor receptor cell proliferation signaling pathways[J]. Cancers,2017,9(5):52. doi: 10.3390/cancers9050052 [31] CHENG Y, MA L X, LIU Y, et al. Comprehensive characterization and clinical impact of concomitant genomic alterations in EGFR-mutant NSCLCs treated with EGFR kinase inhibitors[J]. Lung Cancer,2020,145:63-70. doi: 10.1016/j.lungcan.2020.04.004 [32] LIAO Y M, SONG Y, LI Y K, et al. SOX17, β-catenin and CyclinD1 expression in the endometrioid adenocarcinoma and influence of 5-AZA on expression[J]. Cancer Gene Ther,2020,27(3-4):256-263. doi: 10.1038/s41417-019-0135-5 [33] XI J B, SUN Y C, ZHANG M T, et al. GLS1 promotes proliferation in hepatocellular carcinoma cells via AKT/GSK3β/CyclinD1 pathway[J]. Exp Cell Res,2019,381(1):1-9. doi: 10.1016/j.yexcr.2019.04.005 [34] GUO F, XUE J. microRNA-628-5p inhibits cell proliferation and induces apoptosis in colorectal cancer through downregulating CCND1 expression levels[J]. Mol Med Rep,2020,21(3):1481-1490. [35] ALAVIZADEH S H, HOSSEINZADEH H. Bioactivity assessment and toxicity of crocin: a comprehensive review[J]. Food Chem Toxicol,2014,64:65-80. doi: 10.1016/j.fct.2013.11.016 [36] ASHRAFI M, BATHAIE S Z, ABROUN S, et al. Effect of crocin on cell cycle regulators in N-nitroso-N-methylurea-induced breast cancer in rats[J]. DNA Cell Biol,2015,34(11):684-691. doi: 10.1089/dna.2015.2951 [37] KIM B, PARK B. Saffron carotenoids inhibit STAT3 activation and promote apoptotic progression in IL-6-stimulated liver cancer cells[J]. Oncol Rep,2018,39(4):1883-1891. [38] FARAHI A, ABEDINI M R, JAVDANI H, et al. Crocin and Metformin suppress metastatic breast cancer progression via VEGF and MMP9 downregulations: in vitro and in vivo studies[J]. Mol Cell Biochem,2021,476(9):3341-3351. doi: 10.1007/s11010-020-04043-8 -





 下载:
下载:
 下载:
下载: