-
肺结核是我国青藏高原多发病[1]。2000年以来,全国肺结核发病率普遍下降,由峰值96.3/10万降至 59.3/10万。与之相反,肺结核发病率在青海地区呈总体上升趋势,由48.7/10万(2002年)上升至140.3/10万(2018年),远高于全国平均水平[2-5]。肺结核是一种慢性肺部疾病,由结核分枝杆菌引起,其特点是肺部损伤伴有干酪样化、坏死和纤维化,导致空腔形成,该空腔富含氧气和坏死组织物质,因此它成为包括念珠菌在内的多种生物的生长场所[6]。自然界中念珠菌种类众多,但绝大多数的侵袭性念珠菌感染由白念珠菌、热带念珠菌、光滑念珠菌、克柔念珠菌和近平滑念珠菌,这5种最常见的病原体引起[7]。在临床治疗中,高原肺结核患者的特点为:症状重、病程进展快、合并症多;且肺结核与肺部念珠菌感染的症状类似,但肺部念珠菌感染症状更隐匿,易漏诊和延迟治疗,影响患者治疗及预后[8]。该研究选取2020年3月1日至2020年12月31日青海省第四人民医院(本院)3 012例住院肺结核患者为调查对象,分析肺结核合并肺部念珠菌感染分布特点及耐药率,为临床诊疗提供理论依据。
-
调查对象为2020年3月1日至2020年12月31日本院3 012例住院肺结核患者。男性1 895例,占62.92%;女性1 117例,占37.08%;年龄18~94岁,平均(39.30±5.5)岁;患者主要临床症状表现为胸痛、发热、咳痰、咯血、气短及呼吸困难等。
-
①经实验室和影像学检查,检测值均符合中华医学会结核病学分会肺结核的诊断标准及《内科学(第6版)》中肺部感染[9]的诊断标准;②签署知情同意书。
-
①免疫性疾病相关患者;②肺部肿瘤等其他肺部疾病患者。本研究经医院伦理委员会批准,符合伦理规范,同意本研究的开展。
-
收集确诊肺结核患者痰液样本,经过念珠菌培养2次,结果均为念珠菌属阳性感染。采用梅里埃公司VITEK-32-YBC细菌分析系统进行念珠菌鉴定,对检出念珠菌进行药敏试验,结果证明白念珠菌为质控菌株。
-
使用SPSS21.0软件对数据进行统计分析,分析数据结果,率的比较采用χ2检验,以P<0.05为差异有统计学意义。
-
3 012例肺结核患者中合并念珠菌感染的患者为283例,感染率为9.40%,详见表1。
表 1 不同类型肺结核患者念珠菌感染率
肺结核分型 调查例数 感染例数 感染率(%) χ2 P 浸润型 903 38 4.21 44.629 <0.001 纤维空洞型 2 044 242 11.84 血行播散型 65 3 4.62 -
在283例念珠菌感染患者中,白念珠菌占79.86%,见表2。
表 2 肺结核患者痰培养念珠菌构成比
念珠菌 株数 构成比(%) 白念珠菌 226 79.86 光滑念珠菌 35 12.37 热带念珠菌 10 3.53 克柔念珠菌 5 1.77 近平滑念珠菌 2 0.71 其他 5 1.77 合计 283 100.00 -
该研究选取10种抗真菌药物,对白念珠菌、光滑念珠菌、热带念珠菌、克柔念珠菌及近平滑念珠菌进行药敏试验,详见表3。
表 3 肺结核患者感染念珠菌对抗真菌药物的耐药率(%)
抗真菌
药物白色念珠
菌耐药率光滑念珠
菌耐药率热带念珠
菌耐药率克柔念珠
菌耐药率近平滑念珠
菌耐药率两性霉素B 0.87 0.00 0.00 15.23 0.00 氟胞嘧啶 7.36 0.00 0.00 14.78 0.00 制霉菌素 0.01 0.00 0.00 0.00 0.00 咪康唑 0.50 0.00 0.12 0.26 0.00 伊曲康唑 78.35 63.89 0.00 45.63 0.00 伏立康唑 77.06 65.63 7.63 56.36 0.00 氟康唑 81.90 63.33 0.00 100 0.00 酮康唑 0.50 0.00 0.15 0.00 0.00 卡泊芬净 0.00 0.00 0.00 0.00 0.00 米卡芬净 0.00 0.00 0.00 0.00 0.00 -
在该研究调查的3 012例肺结核患者中,念珠菌感染283例,占总数的9.40%,其中纤维空洞型242例,浸润性38例,血性播散型3例。纤维空洞型肺结核对肺部产生慢性破坏,干酪化、纤维化及坏死组织导致肺部空洞形成和支气管扩张,空洞内大量干酪样坏死物质形成,支气管扭曲变形,导致肺组织结构完整性被破坏,局部抵抗力下降,为结核杆菌和包括念珠菌在内的多种真菌提供下行感染的滋生地,即使在结核杆菌被消灭的情况下,念珠菌也经常会定植于肺部空腔并持续破坏已经扩张的支气管,导致纤维空洞型感染为肺结核合并念珠菌菌感染的主要类型[10]。
-
该次调查研究主要针对高海拔地区,秦毅等[1]通过青藏高原疾病流行分析,发现青海地区肺结核的发病率从2002−2018年持续上升,至2018年全省结核病发病率为全国平均水平的2.3倍。肺结核发病率高考虑与藏区自然条件艰苦,医疗条件、经济水平落后,群众防疫宣传教育普及率低,人民防病意识较差,人群总体疫苗接种率较低等因素相关。青藏高原地广人稀,近年来,随着交通状况改善,群众社会交往增多,但该地区海拔高,低气温时间长,春、秋、冬季社会活动多聚集于室内,温暖的室内环境导致结核菌更易通过飞沫传播。该疾病在临床上具有致死率高、传染力强、致病性高、病程长等特点,且易反复发作、难治愈[11]。高海拔地区肺结核治愈率仅有58.3%,仅达到平原地区治愈率的60%[1],且极其容易发生二重感染,尤其以合并念珠菌感染为主。高海拔肺结核合并念珠菌感染的原因主要包括:①肺结核患者处于慢性炎症状态,结核杆菌导致呼吸道黏膜损伤,长期服用抗结核药抑制正常菌群,故会引起菌群紊乱,条件致病菌生长,且高海拔地区慢性支气管炎、肺心病高发,并发症较多,使用广谱抗菌药,更易导致肺部念珠菌感染。肺结核合并咯血等重症患者,临床惯用糖皮质激素治疗,该类药物可以抑制中性粒细胞及巨噬细胞吞噬念珠菌孢子的能力,对免疫过程中的诸多环节有抑制作用,进而引发肺部念珠菌感染[10]。②高海拔地区基础医疗薄弱,患者用药依从性差,而肺部念珠菌感染症状隐匿,患者出现症状反复后才转入本院,导致延迟治疗,错失最佳治疗时机,治疗难度增大,病情控制差,且病情危重,更易导致念珠菌感染,严重影响患者治疗及预后。③该研究资料分析结果显示,肺结核合并念珠菌感染发生率约为9.40%,而相关文献报道发生率为3.95 %[12],考虑肺结核患者机体状况差,能量消耗增加,免疫力低,高海拔地区长期缺氧,气候干冷,天气变化剧烈,温差幅度大,容易快速削弱机体抵抗力,导致习服衰变[13],器官功能进一步损伤,口咽部白念珠菌通过被破坏的呼吸道黏膜下行至肺部,产生较多的细胞外酶,损害机体细胞,导致念珠菌感染率高。
-
在肺结核合并念珠菌感染的283例患者中,共检出6种念珠菌,其中白念珠菌、光滑念珠菌和热带念珠菌3种主要的念珠菌检出271例,占病原体分离株的95.76%,与孟笑等[14]报道一致,符合国内大多数医院病原菌感染特征,但感染率相对偏高,其中,白念珠菌226株,占79.86%,光滑念珠菌35株,占12.37%,热带念珠菌10株,占3.53%。肺结核合并念珠菌感染的主要致病菌为白念珠菌,与张海燕等[15]、黄国军等[16]和程玲[17]报道一致,其他两种致病菌为光滑念珠菌、热带念珠菌。上述念珠菌耐药性实验结果显示,白念珠菌对氟康唑、伏立康唑、伊曲康唑的耐药率为70%以上;光滑念珠菌对氟康唑、伊曲康唑、伏立康唑的耐药率可达60%以上;克柔念珠菌对氟康唑固有耐药,对伏立康唑、伊曲康唑耐药率为40%以上;氟康唑、伊曲康唑、伏立康唑为治疗肺部真菌感染的常用药物,抗菌谱广,临床使用广泛,患者反复长期使用,且药物半衰期长,可能是导致这几种药物耐药率高的原因,且存在交叉耐药的情况。两性霉素B、氟胞嘧啶等药物耐药率低,虽然抗真菌效果相对较好,但对肝肾功能影响较大,两性霉素B会导致高热、寒颤、恶心呕吐等不良反应,氟胞嘧啶治疗周期长,使用剂量较大,且需要与其他药物联合使用,不是临床治疗念珠菌感染的一线用药[18-19],但可以作为在唑类或棘白菌素不能使用时的治疗方案。棘白菌素对大多数念珠菌具有高度活性,且棘白菌素在本院使用量较少,考虑为棘白菌素类无耐药菌株产生的可能因素。
综上所述,抗念珠菌药物的选择需根据本地药敏结果和结核患者实际情况进行综合分析,得出更适合患者的有效治疗方案,从根源上使青藏高原地区肺结核合并念珠菌感染的发病率得到遏制。
Distribution characteristics and drug resistance rate of pathogenic bacteria in patients with pulmonary tuberculosis combined with Candida infection on the Tibetan plateau
-
摘要:
目的 研究青藏高原肺结核患者中机会性念珠菌病原学分布特点及耐药情况。 方法 分析2020年3月1日至2020年12月31日青海省第四人民医院3 012例住院肺结核患者,收集痰标本,采用VITEK-32-YBC全自动细菌分析系统进行念珠菌鉴定,并对检出的念珠菌进行药敏试验。 结果 在本次调查的3 012例肺结核患者中,合并念珠菌感染的肺结核患者有283例,占9.40%。其中,念珠菌类型又以白念珠菌为主,占总数的79.86%。 结论 青藏高原地区肺结核合并念珠菌感染的患病率较高。因此,选择抗菌药物要根据患者的情况综合分析,以此来选择最佳、最有效的药物治疗方法。 Abstract:Objective To investigate the pathogenic distribution characteristics and drug resistance of opportunistic Candida in patients with pulmonary tuberculosis on the Qinghai-Tibet Plateau. Methods 3 012 hospitalized cases of pulmonary tuberculosis at Qinghai Province Fourth People’s Hospital from March 1, 2020 to December 31, 2020 were analyzed, sputum samples were collected, Candida identification was carried by VITEK-32-YBC automatic bacterial analysis system, and the detected Candida was tested for drug sensitivity. Results Among the 3 012 cases of pulmonary tuberculosis in this investigation, 283 cases of pulmonary tuberculosis patients with Candida infection, accounting for 9.40%. Among them, Candida albicans was the main type of Candida, accounting for 79.86% of the total. Conclusion The prevalence rate of pulmonary tuberculosis complicated with Candida infection was high in Qinghai-Tibet Plateau. Therefore, the selection of antimicrobial drugs should be based on a comprehensive analysis of the patient's condition, in order to select the best and most effective drugs for treatment. -
Key words:
- pulmonary tuberculosis /
- Candida /
- etiology /
- drug resistance
-
2型糖尿病(T2DM)是一种以持续性高血糖为主要症状,以胰岛素抵抗为病理生理特征的异质性疾病。近年来,尽管一些研究显示糖尿病发病率逐渐放缓,但T2DM的患病率持续上升。目前全球糖尿病患者超过4.25亿,其中90%为T2DM[1],我国糖尿病患者超1.4亿,位居世界首位[2]。胰高糖素样肽-1(GLP-1)是一种主要由肠道L细胞所产生的激素。艾塞那肽是一种GLP-1受体激动剂(GLP‐1RA),它以葡萄糖浓度依赖的方式增强胰岛素分泌同时抑制胰高糖素分泌,并能够延缓胃排空,通过中枢性的食欲抑制减少进食量,从而达到降低血糖作用[3]。艾塞那肽属于短效GLP-1RA,其半衰期只有2.4 h,需每天2次注射给药,在一定程度上影响患者的用药依从性[4]。艾塞那肽微球(商品名为Bydureon®)是一种长效GLP‐1RA,每周一次给药,与短效GLP‐1RA相比,可提高患者的依从性和生活质量。
美国食品药品监督管理局(FDA)于2012年1月2日批准艾塞那肽微球上市,用于改善T2DM患者的血糖控制。2018年1月4日,原中国食品药品监督管理总局(CFDA)批准该药正式在中国上市,国内获批适应证为用于改善T2DM患者的血糖水平,适用于单用二甲双胍、磺脲类以及二甲双胍合用磺脲类血糖仍控制不佳的患者。2020年《中国2型糖尿病防治指南》[5]和2021年美国糖尿病学会(ADA)指南[6]推荐:GLP-1RA 类药物在合并动脉粥样硬化性心血管疾病(ASCVD)及其高风险的患者、慢性肾病的部分患者中可无须考虑患者的HbA1c水平和二甲双胍的使用而直接使用。2022年ADA/EASD共识报告[7]中指出,在ASCVD或其高风险人群中,GLP-1RA类药物优先于钠-葡萄糖协同转运蛋白2抑制剂。
作为国内首个每周给药一次的GLP-1药物,艾塞那肽微球通过缓释微球技术持续提供稳态艾塞那肽血液浓度水平,从而大大降低给药频率,降低胃肠道不良作用,并增加药物的稳定性和提高患者依从性,为广大T2DM患者提供全新的治疗选择。随着艾塞那肽微球的广泛使用,药物不良事件(ADE)报告也逐渐增多。本文通过对FDA不良事件报告系统(FAERS)收集到的数据进行挖掘和筛选,分析艾塞那肽微球可疑的ADE信号,为国内临床合理安全用药提供参考。
1. 资料和方法
1.1 资料来源
本研究全部资料来源于FAERS收集的艾塞那肽微球相关ADE报告。本研究提取数据为艾塞那肽微球上市时间(2012年1月2日)至2023年3月31日。
1.2 数据提取和统计
以“艾塞那肽微球”为目标药物,检索关键词为“exenatide microspheres for injection”、“LY05006”、“AC
2993 LAR”及“bydureon”。采用Excel表格统计患者基本信息,包括性别、年龄、ADE上报国家和上报人员、ADE 严重程度和类型等。采用《监管活动医学词(26.0版本)》中的首选系统器官分类(SOC)和首选术语(PT)对ADE进行描述、分类和统计。1.3 数据挖掘
采用比值失衡测量法的报告比值比法(ROR)和综合标准法(MHRA)对艾塞那肽微球相关ADE 进行数据挖掘[8-9],其具体计算公式及阈值见表1。
表 1 ROR和MHRA法的计算公式及相应阈值方法
名称计算公式 阈值 ROR法 ROR=a/c/(b/d) a≥3,ROR值的95%CI下限>1,则提示生成1个
信号ROR 95%CI=
${\mathrm{e}}^{\left[{\mathrm{ln}}({\mathrm{ROR}})\pm 1.96\sqrt {\frac{1}{a} + \frac{1}{b} + \frac{1}{c} + \frac{1}{d}}\right]} $MHRA法 PRR=a/(a+b)/[c/(c+d)] a≥3,PRR值>2,χ2值>4,则提示生成1个信号 χ2 =(ad−bc)2(a+b+c+d)/[(a+b)(c+d)(a+c)(b+d)] 注:a:目标药物的目标事件报告数;b:目标药物的其他事件报告数;c:其他药物的目标事件报告数;d:其他药物的其他事件报告数;95%CI:95%置信区间;PRR:比例报告比值比。 2. 结果
2.1 艾塞那肽微球相关ADE报告年度分布
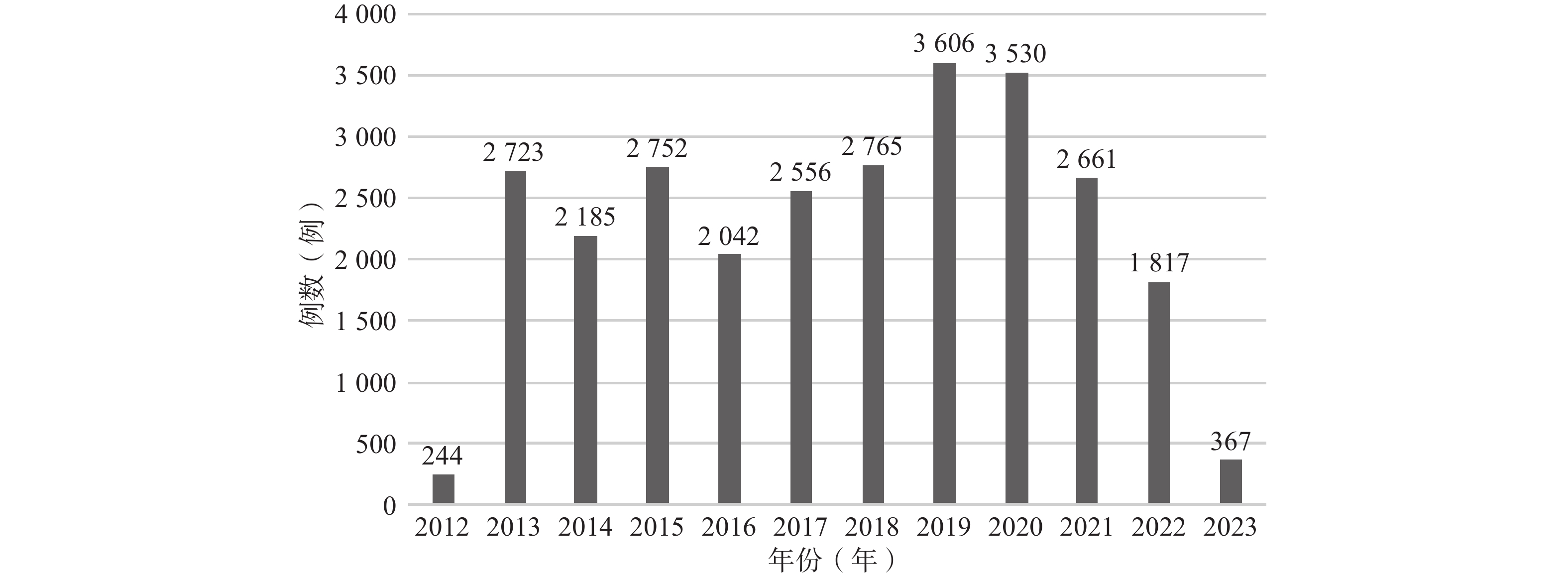
2012年1月2日至2023年3月31日,FDA共收到艾塞那肽微球相关ADE报告27 248 份,具体年度份数的分布如图1所示。
2.2 艾塞那肽微球相关ADE报告相关患者性别和年龄分布
艾塞那肽微球相关ADE报告27 248份共涉及27 248例患者,患者的性别和年龄分布情况见表2。
表 2 艾塞那肽微球相关ADE涉及患者性别及年龄分布参数 分类 例数(例) 占比(%) 性别 男 11 814 43.36 女 14 328 52.58 未知 1 106 4.06 合计 27 248 100.00 年龄 18-64岁 186 0.68 ≥65岁 339 1.24 未知 26 723 98.07 合计 27 248 100.00 2.3 艾塞那肽微球相关ADE报告上报人员和上报国家分布
统计结果显示,艾塞那肽微球相关ADE报告上报人员以消费者为主(18 435例,占67.66%)。上报国家共 51个,报告数以美国最高(26 295例,占96.5%),其次为日本(117例,占0.4%),具体见表3。
表 3 艾塞那肽微球相关ADE报告上报人员和上报国家分布参数 分类 例数(例) 占比(%) 上报人员 消费者 18 435 67.66 医务人员 2 947 10.82 其他 1 237 4.54 未知 4 629 16.99 合计 27 248 100.00 上报国家 美国 26 295 96.50 日本 117 0.43 英国 114 0.42 法国 104 0.38 澳大利亚 74 0.27 其他 514 1.89 未知 30 0.11 合计 27 248 100.00 2.4 艾塞那肽微球相关ADE中的严重不良事件
在上报的27 248份报告中,报告了4 719例次严重ADE,包括住院、死亡、危及生命、残疾等,具体见表4。
表 4 艾塞那肽微球严重不良事件分布严重不良事件类型 例数(例) 占比(%) 住院 1 462 30.98 死亡 246 5.21 危及生命 146 3.10 残疾 112 2.37 其他 12 56.33 未知 95 2.01 合计 4 719 100.00 2.5 艾塞那肽微球相关ADE中累及的系统和器官
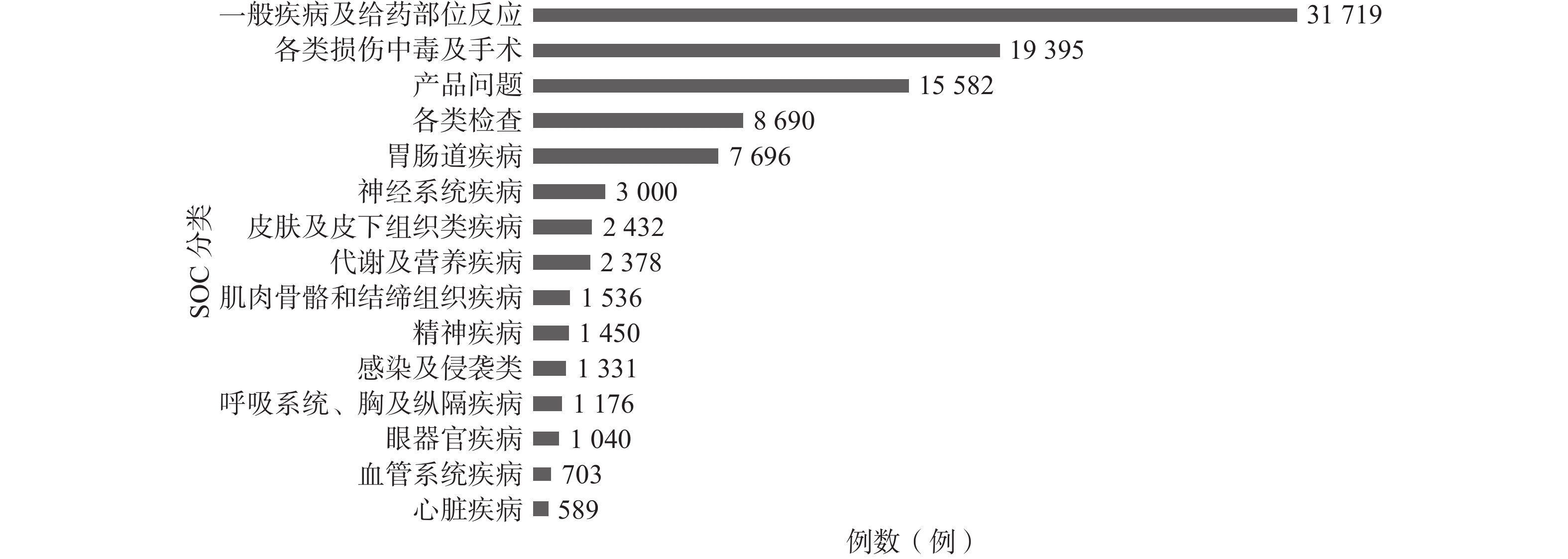
在上报的27 248份报告中,共发生101 469例次ADE。ADE共涉及27个SOC,以给药部位反应为主,具体见图2。
2.6 基于PT术语的信号挖掘
对以艾塞那肽微球为首要怀疑药物的ADE报告进行筛选,PT 报告总数为2 474个,较为常见的 ADE报告数为注射部位不适、血糖升高、体质量降低等,结果见表5。
表 5 艾塞那肽微球相关ADE报告数排序(前50位)序号 PT 报告数/例(个) 序号 PT 报告数/例(个) 1 注射部位出血 5 262 26 注射部位硬结 164 2 注射部位痛 4 586 27 注射部位发热 159 3 注射部位肿块 3 529 28 肿块 156 4 注射部位结节 2 869 29 注射部位不适 146 5 血葡萄糖升高 2 572 30 注射部位疤痕 104 6 体质量降低 2 269 31 皮肤肿块 104 7 注射部位瘙痒 1 590 32 糖化血红蛋白异常 100 8 注射部位瘀青 1 239 33 饥饿感 98 9 注射部位红斑 1 061 34 胃排空障碍 94 10 注射部位肿胀 743 35 体质量波动 94 11 糖化血红蛋白升高 682 36 注射部位刺激 86 12 血葡萄糖降低 553 37 注射部位炎症 79 13 胰腺炎 416 38 挫折承受力降低* 79 14 血葡萄糖异常 391 39 糖化血红蛋白降低 73 15 糖尿病控制不佳 347 40 脂肪酶升高* 68 16 注射部位反应 342 41 食欲障碍 52 17 注射部位损伤 322 42 注射部位血肿 52 18 结节 305 43 注射部位脓肿 50 19 注射部位变色 300 44 注射部位感染 49 20 血葡萄糖波动 221 45 注射部位分泌物 48 21 注射部位皮疹 202 46 超重 43 22 身高降低* 198 47 注射部位结痂 39 23 嗳气 195 48 注射部位蜂窝织炎 37 24 注射部位荨麻疹 193 49 注射部位囊泡 32 25 注射部位凹陷 178 50 血胆固醇异常* 28 注:*表示说明书未列入的ADE。 经ROR法和MHRA法双重筛选,最终获得阳性信号163个。按信号强度( ROR值的 95% CI下限)对前50位PT进行排序,结果见表6。相关性较高的ADE为注射部位不适、获得性混合型高脂血症、糖化血红蛋白异常等。另外,挖掘到未列入药品说明书的ADE共7种。
表 6 艾塞那肽微球相关ADE信号强度排序(前50位)序号 PT 报告数/
例(个)PRR ROR(95% CI) 序号 PT 报告数/
例(个)PRR ROR(95% CI) 1 注射部位结节 2 869 247.06 254.22(242.57-266.43) 26 注射部位脓肿 50 14.02 14.03(10.58-18.60) 2 注射部位凹陷 178 76.69 76.82(65.44-90.19) 27 血葡萄糖波动 221 13.75 13.78(12.05-15.76) 3 获得性混合型高脂血症* 3 71.01 71.02(20.81-242.33) 28 结节 305 13.59 13.63(12.16-15.28) 4 糖化血红蛋白异常 100 66.40 66.47(53.79-82.14) 29 注射部位蜂窝织炎 37 13.49 13.49(9.72-18.72) 5 注射部位囊肿 27 62.44 62.46(41.64-93.69) 30 糖尿病控制不佳 347 13.29 13.33(11.98-14.84) 6 注射部位肿块 3 529 60.93 63.09(60.86-65.40) 31 注射部位肉芽肿 5 12.73 12.73(5.23-31.02) 7 血胰高血糖素增高 4 55.50 55.51(19.51-157.89) 32 胃肿块* 18 12.71 12.71(7.95-20.32) 8 注射部位变形 8 53.65 53.66(25.66-112.21) 33 血葡萄糖异常 391 12.15 12.20(11.03-13.49) 9 注射部位损伤 322 49.86 50.01(44.54-56.16) 34 血管损伤* 23 10.53 10.53(6.96-15.93) 10 注射部位出血 5 262 46.12 48.59(47.19-50.03) 35 注射部位炎症 79 10.17 10.18(8.14-12.72) 11 给药部位结节 3 36.58 36.58(11.22-119.29) 36 注射部位痛 4 586 10.03 10.46(10.15-10.78) 12 注射部位关节痛 5 35.30 35.30(14.15-88.07) 37 注射部位感染 49 9.63 9.63(7.26-12.79) 13 给药部位凹陷 3 33.53 33.53(10.33-108.90) 38 身高降低* 198 9.36 9.38(8.14-10.80) 14 腹壁肿块* 5 32.45 32.45(13.05-80.72) 39 注射部位瘀青 1 239 9.06 9.16(8.65-9.69) 15 身高异常* 7 30.62 30.62(14.20-66.03) 40 注射部位不适 146 8.97 8.98(7.62-10.58) 16 糖化血红蛋白降低 73 29.73 29.75(23.46-37.74) 41 注射部位刺激 86 8.95 8.96(7.23-11.09) 17 注射部位结痂 39 25.44 25.45(18.41-35.17) 42 血葡萄糖升高 2 572 8.78 8.99(8.64-9.35) 18 注射部位疤痕 104 22.78 22.80(18.71-27.79) 43 皮肤肿块 104 8.76 8.77(7.22-10.65) 19 腹部脂肪堆积* 3 21.56 21.56(6.75-68.87) 44 嗳气 195 7.90 7.91(6.86-9.12) 20 糖化血红蛋白升高 682 16.99 17.10(15.83-18.47) 45 血葡萄糖降低 553 7.71 7.75(7.12-8.43) 21 注射部位腐烂 11 16.96 16.96(9.28-31.01) 46 注射部位硬结 164 7.66 7.67(6.57-8.96) 22 注射部位分泌物 48 16.02 16.02(12.01-21.38) 47 胃排空障碍 94 7.53 7.54(6.15-9.25) 23 注射部位瘙痒 1 590 15.25 15.48(14.72-16.28) 48 注射部位肿胀 743 6.51 6.55(6.09-7.05) 24 注射部位变色 300 14.67 14.71(13.10-16.51) 49 肿块 156 6.28 6.29(5.37-7.37) 25 体质量指数异常 4 14.12 14.12(5.21-38.27) 50 注射部位红斑 1 061 5.54 5.58(5.25-5.93) 注:*表示说明书未列入的ADE。 3. 讨论
本研究利用FAERS数据库中艾塞那肽微球的ADE报表数据,应用比值失衡法对艾塞那肽微球上市后发生的ADE进行分析和挖掘,为减少结果偏倚,本研究采用ROR法与MHRA法两种方法进行数据挖掘。艾塞那肽微球相关ADE信号较强且较多地集中在给药部位反应、血糖控制不佳、胃肠道系统反应等方面,与药品说明书中ADE大致相同。
本研究结果显示,艾塞那肽微球较强的ADE为注射部位反应包括结节、凹陷、肿块,关联较强的ADE为胃肠道药物不良反应、血糖控制不佳,提示临床使用艾塞那肽微球时应重点关注注射部位反应、胃肠道反应如嗳气、胃排空障碍以及血糖波动等相关ADE。GLP-1RA一方面通过增加胰岛β细胞胰岛素分泌和减少α细胞胰高血糖素分泌来改善糖代谢[10];另一方面通过抑制食欲和减少食物摄入来减轻体质量[11]。由此造成胃排空障碍、嗳气等一系列ADE,并同时作用于中枢神经系统,造成食欲下降。既往研究结果显示,相比其他半衰期较短的GLP-1RA(如艾塞那肽、利拉鲁肽等),艾塞那肽微球不仅在持续血糖控制和减轻体重各方面具有更好的疗效[12-14],而且胃肠道相关ADE的发生率显著降低[15]。
艾塞那肽微球是长效制剂,每周给药1次。艾塞那肽微球从微球中逐渐释放药物可以帮助患者减少皮下注射次数。由于缓释制剂的便利性,可以改善患者的依从性和提高生活质量,与短效GLP-1 RA相比,可以更好地控制血糖。这可能与艾塞那肽微球制剂中血浆艾塞那肽的浓度在白天更稳定有关,可能有助于患者胰岛β细胞功能的改善[13, 16]。
注射用艾塞那肽微球给药前需要混合药物和填充注射器,对使用方法有一定的要求,如注射给药应在腹部、大腿或上臂区域皮下注射,在同一区域注射时,每周应选择不同的部位,减少注射部位ADE的发生[17]。注射部位反应如结节、凹陷、肿块、出血等 ADE的报告数与信号强度均排在前列。提示在临床使用艾塞那肽微球时,专业医疗人员应当注意加强对患者药物注射的用药教育,保障患者用药的有效性和安全性。
本研究经ROR法和MHRA法双重筛选,最终获得阳性信号163个,其中发现有10个未在说明书中出现的ADE信号。说明书中提示急性胰腺炎包括致死性和非致死性出血或坏死性胰腺炎的发生与使用艾塞那肽有关[18]。本研究发现了胰腺炎阳性信号,提醒医务人员应注意使用该药应密切关注患者是否发生急性胰腺炎的症状和体征,包括持续性严重腹痛并可放射到背部或伴有恶心和呕吐。如果怀疑出现胰腺炎应立即停药。对确诊胰腺炎患者,则不应重新开始注射用艾塞那肽微球治疗。
本研究属于上市后ADE信号研究,即使有大样本量的数据,仍然存在一定局限性。首先FAERS是自发上报系统,因此存在重复报告、错报、漏报等情况[19]。如在本研究中,超过90%的患者年龄信息未知,对于ADE年龄的分布估计有一定的影响。其次尽管同时使用ROR法与MHRA法两种方法,但是仍然不能排除假阳性信号出现,而且FAERS数据库中ADE项的信息填写可能过于主观,如对于同一个ADE,不同的报告者可能采用不同的描述,即使通过术语标准化仍然无法消除这一问题,导致单个PT的ROR、PRR值的计算可能存在误差。最后FAERS数据库中数据来源主要是欧美国家,而亚洲人群的数据,尤其是中国患者的数据少,因此需要考虑研究发现的ADE信号是否符合中国人群现状。本研究虽然用 2 种方法进行综合评价,检出阳性信号并非必然的因果关系,仍需进一步临床研究加以证实。
-
表 1 不同类型肺结核患者念珠菌感染率
肺结核分型 调查例数 感染例数 感染率(%) χ2 P 浸润型 903 38 4.21 44.629 <0.001 纤维空洞型 2 044 242 11.84 血行播散型 65 3 4.62 表 2 肺结核患者痰培养念珠菌构成比
念珠菌 株数 构成比(%) 白念珠菌 226 79.86 光滑念珠菌 35 12.37 热带念珠菌 10 3.53 克柔念珠菌 5 1.77 近平滑念珠菌 2 0.71 其他 5 1.77 合计 283 100.00 表 3 肺结核患者感染念珠菌对抗真菌药物的耐药率(%)
抗真菌
药物白色念珠
菌耐药率光滑念珠
菌耐药率热带念珠
菌耐药率克柔念珠
菌耐药率近平滑念珠
菌耐药率两性霉素B 0.87 0.00 0.00 15.23 0.00 氟胞嘧啶 7.36 0.00 0.00 14.78 0.00 制霉菌素 0.01 0.00 0.00 0.00 0.00 咪康唑 0.50 0.00 0.12 0.26 0.00 伊曲康唑 78.35 63.89 0.00 45.63 0.00 伏立康唑 77.06 65.63 7.63 56.36 0.00 氟康唑 81.90 63.33 0.00 100 0.00 酮康唑 0.50 0.00 0.15 0.00 0.00 卡泊芬净 0.00 0.00 0.00 0.00 0.00 米卡芬净 0.00 0.00 0.00 0.00 0.00 -
[1] 秦毅, 李倩倩, 苏贵金, 等. 青藏高原地区主要疾病流行特征及健康评价方法[J]. 环境化学, 2021, 40(6):1668-1682. doi: 10.7524/j.issn.0254-6108.2020101101 [2] 国家卫生和计划生育委员会. 中国卫生和计划生育统计年鉴-2013[M]. 北京: 中国协和医科大学出版社, 2013. [3] 国家卫生健康委员会. 中国卫生健康统计年鉴-2018[M]. 北京: 中国协和医科大学出版社, 2018. [4] 王朝才, 刘燕, 晁秀珍, 等. 2006−2015年青海省肺结核流行特征分析[J]. 现代预防医学, 2017, 44(3):397-400. [5] WANG H Q, DAI H P, HE J Y, et al. Epidemiological characteristics of pulmonary tuberculosis in patients with pneumoconiosis based on its social determinants and risk factors in China: a cross-sectional study from 27 provinces[J]. Chin Med J, 2022, 135(24):2984-2997. doi: 10.1097/CM9.0000000000002486 [6] ASTEKAR M, BHATIYA P S, SOWMYA G V. Prevalence and characterization of opportunistic candidal infections among patients with pulmonary tuberculosis[J]. J Oral Maxillofac Pathol, 2016, 20(2):183-189. doi: 10.4103/0973-029X.185913 [7] PAPPAS P G, KAUFFMAN C A, ANDES D R, et al. Clinical practice guideline for the management of candidiasis: 2016 update by the infectious diseases society of America[J]. Clin Infect Dis, 2016, 62(4):e1-e50. doi: 10.1093/cid/civ933 [8] 邓永佳, 黄汐. 肺结核患者真菌感染的临床特点及耐药性的疗效观察[J]. 北方药学, 2020, 17(1):160-161. doi: 10.3969/j.issn.1672-8351.2020.01.118 [9] 葛均波, 徐永健. 内科学[M]. 8版. 北京: 人民卫生出版社, 2013. [10] 沈小波. 肺结核合并肺部真菌感染的多因素Logistical回归分析[J]. 临床肺科杂志, 2016, 21(11):2095-2097. doi: 10.3969/j.issn.1009-6663.2016.11.046 [11] 何忠彩, 李国周, 吴洁贞, 等. 肺结核合并真菌感染的临床特点及药物敏感性分析[J]. 国际检验医学杂志, 2016, 37(1):89-91. doi: 10.3969/j.issn.1673-4130.2016.01.040 [12] 武艳霞, 陈媛媛. 肺结核抗痨治疗与真菌培养阳性相关性分析[J]. 临床肺科杂志, 2013, 18(8):1455-1456. doi: 10.3969/j.issn.1009-6663.2013.08.049 [13] 杨生岳. 高原常见呼吸系统疾病防治的研究进展[J]. 高原医学杂志, 2014, 24(4):44-63. [14] XIAO M, SUN Z Y, KANG M, et al. Five-year national surveillance of invasive candidiasis: species distribution and azole susceptibility from the China hospital invasive fungal surveillance net (CHIF-NET)study[J]. J Clin Microbiol, 2018, 56(7):e00577-e00518. [15] 张海燕, 张偲, 范晖. 肺结核并发真菌感染的临床特征及危险因素[J]. 中国当代医药, 2022, 29(7):42-45. doi: 10.3969/j.issn.1674-4721.2022.07.012 [16] 黄国军, 高晓, 唐细良, 等. 肺结核患者并发肺部真菌感染危险因素的meta分析[J]. 实用预防医学, 2021, 28(8):906-910. [17] 程玲. 肺结核合并真菌感染或定植的临床特点及耐药分析[J]. 中国社区医师, 2021, 37(13):23-25. doi: 10.3969/j.issn.1007-614x.2021.13.011 [18] 王皓飞, 王金龙, 胡文瀚, 等. 重症侵袭性真菌感染患者两性霉素B的药代动力学变化及其影响因素分析[J]. 中国真菌学杂志, 2023, 18(2):117-122. [19] 赵婧芳. 肺结核合并真菌感染的临床特点及耐药研究[J]. 世界复合医学, 2021, 7(6):162-164. -





 下载:
下载:
 下载:
下载: 

