-
胰腺癌是一种发病隐匿且进展迅速的消化系统恶性肿瘤。胰腺癌发病与吸烟、肥胖、遗传、糖尿病和饮酒等多种危险因素相关,其首次确诊时通常已是晚期,预后极差[1]。尽管过去10年内全球癌症的生存率不断提高,但胰腺癌的发病率在不断提高的同时,其5年生存率在我国胰腺癌患者中却并未提高,仅为7%左右[2]。晚期胰腺癌的治疗主要以化疗为主,其中,FOLFIRINOX化疗方案与白蛋白结合型紫杉醇联合吉西他滨的治疗方案对胰腺癌患者的生存率有一定的提高[3]。尽管联合化疗方案对胰腺癌的治疗有一定效果,但化疗药物的毒副作用与肿瘤细胞的耐药性限制了其在胰腺癌治疗中的应用。
中医秉承整体调理与辨证论治的治疗理念,在胰腺癌的治疗方面具有独特的优势,如缓解临床症状,提高抗癌药物的临床效果,改善患者的生活质量以及延长患者的生命等[4]。研究表明,在中医治疗胰腺癌的用药规律中,白术-半夏-茯苓是最常用且置信度最高的药组。三药协同可产生健脾益气、燥湿化痰等功效[5]。中药白术是将菊科植物白术的根茎干燥后制得,具有健脾益气、除湿益燥的功效。其活性成分可以促进肿瘤细胞凋亡,抑制胰腺肿瘤细胞生长与转移,调节免疫代谢等[6]。中药半夏为天南星科植物半夏的干燥块茎,具有燥湿化痰、消痞散结的作用效果。半夏的化学成分包括生物碱类、 有机酸类、黄酮类和糖类等,具有抗肿瘤、 抗炎等药理活性[7]。中药茯苓是真菌茯苓的干燥菌核,其多糖与三萜类化合物成分可以通过增强机体免疫力、增加其他化疗药物的抗肿瘤效果以及降低其他化疗药物的毒副作用等机制发挥抗肿瘤效果[8]。尽管临床上白术-半夏-茯苓药组常用于胰腺癌的配伍治疗,但其包含的活性成分复杂,具体分子作用机制尚未系统阐述。
网络药理学可以利用药物疾病相关数据库以及生物系统分析方法来预测药物、疾病、靶点间的联系,从而了解药物成分对机体的潜在调控机制[9]。分子对接技术则利用计算机模拟配受体间的相互结合模式,通过一系列参数筛选出能相互结合的药物活性成分与靶点蛋白,从而提高药物开发与分子机制验证的成功率[10]。本研究利用网络药理学与分子对接技术分析验证白术-半夏-茯苓配伍治疗胰腺癌的潜在分子机制,以期为临床使用该药组提供理论参考依据。
-
通过中药系统药理学数据库和分析平台(Traditional Chinese Medicine Systems Pharamacology Database and Analysis Platform,TCMSP;https://www.tcmsp-e.com/)检索白术-半夏-茯苓药组的活性成分及作用靶点,并设定筛选条件:口服生物利用度(OB)≥30%,类药性(DL)≥0.18。同时通过TCMSP平台下载药组活性成分的化学结构式,保存为mol2格式文件。将格式文件上传至PharmMapper平台(http://www.lilab-ecust.cn/pharmmapper/)进行靶点预测, 预测靶点范围设置为Human Protein Targets Only (v2010,2241),其余参数为默认设置。预测结果按照“Normalized Fit Score≥0.9,z'-score>0”进行筛选。将TCMSP 平台与PharmMapper平台搜集的活性成分作用靶点合并去重后,通过UniProt数据库(https://www.uniprot.org/)对活性成分的靶点名称进行标准化规范。
-
利用GeneCards(https://www.genecards.org/)、OMIM(Online Mendelian Inheritance in Man; https://omim.org/)两个数据库,以“pancreatic cancer”为关键词进行检索, 筛选评分大于>10的GeneCards数据库内与胰腺癌相关的基因靶点数据,并与OMIM数据库的检索结果去重汇总。
-
通过Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)制作白术-半夏-茯苓药组靶点和胰腺癌靶点的韦恩图,并通过韦恩图提取交集靶点。
-
将药物、活性成分、交集靶点相关数据导入Cytoscape 3.9.1软件构建白术-半夏-茯苓治疗胰腺癌的药物-成分-靶点网络。
-
将所获取的药组与疾病的交集靶点导入在线STRING 11.5 平台 (https://cn.string-db.org/),将物种设定为 Homo sapiens,minimum required interaction score >0.9,其余设置为默认值,获取PPI网络数据,并将其导入Cytoscape 3.9.1软件构建蛋白质-蛋白质相互作用(PPI)网络并进行分析,筛选出白术-半夏-茯苓配伍治疗胰腺癌的核心靶点。
-
将药组与胰腺癌交集靶点导入DAVID数据库 (https://david.ncifcrf.gov/),将物种选择为Homo sapiens后进行GO功能富集分析及KEGG通路富集分析,分别筛选出前10个生物过程(BP)、细胞组成(CC)、分子功能(MF)条目,前20条KEGG通路以及胰腺癌相关的靶点通路,并用作图平台(http://www.bioinformatics.com.cn/)对数据进行可视化。
-
将上述KEGG的前20条显著差异的信号通路与相应靶点导入 Cytoscape 3.9.1软件,构建白术-半夏-茯苓治疗胰腺癌的靶点-通路网络。
-
以药物-成分-靶点网络中每种中药度值排名前三的核心成分和胰腺癌相关靶点为研究对象,进行分子对接验证。具体操作如下:① 利用TCMSP数据库,Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/),Chem3D 20.0软件和Open Babel软件得到能量最小化的活性成分pdb格式文件;② 从RCSB PDB数据库(https://www.rcsb.org/)下载网络度值较高的疾病靶点蛋白3D结构,并将其导入PyMOL软件对蛋白进行去水、去配体等操作,导出为 pdb文件;③ 运用Autodock Tools 1.5.7软件将靶点蛋白添加非极性氢后计算Gasteiger电荷,而原始配体添加非极性氢后检测扭转键,分别保存为pdbqt文件。用 Autogrid模块获得对接活性的位点,用Autodock模块进行药组核心成分与胰腺癌关键靶点的分子对接;④ 采用PyMOL软件将结合能最佳的前三结果进行可视化处理。
-
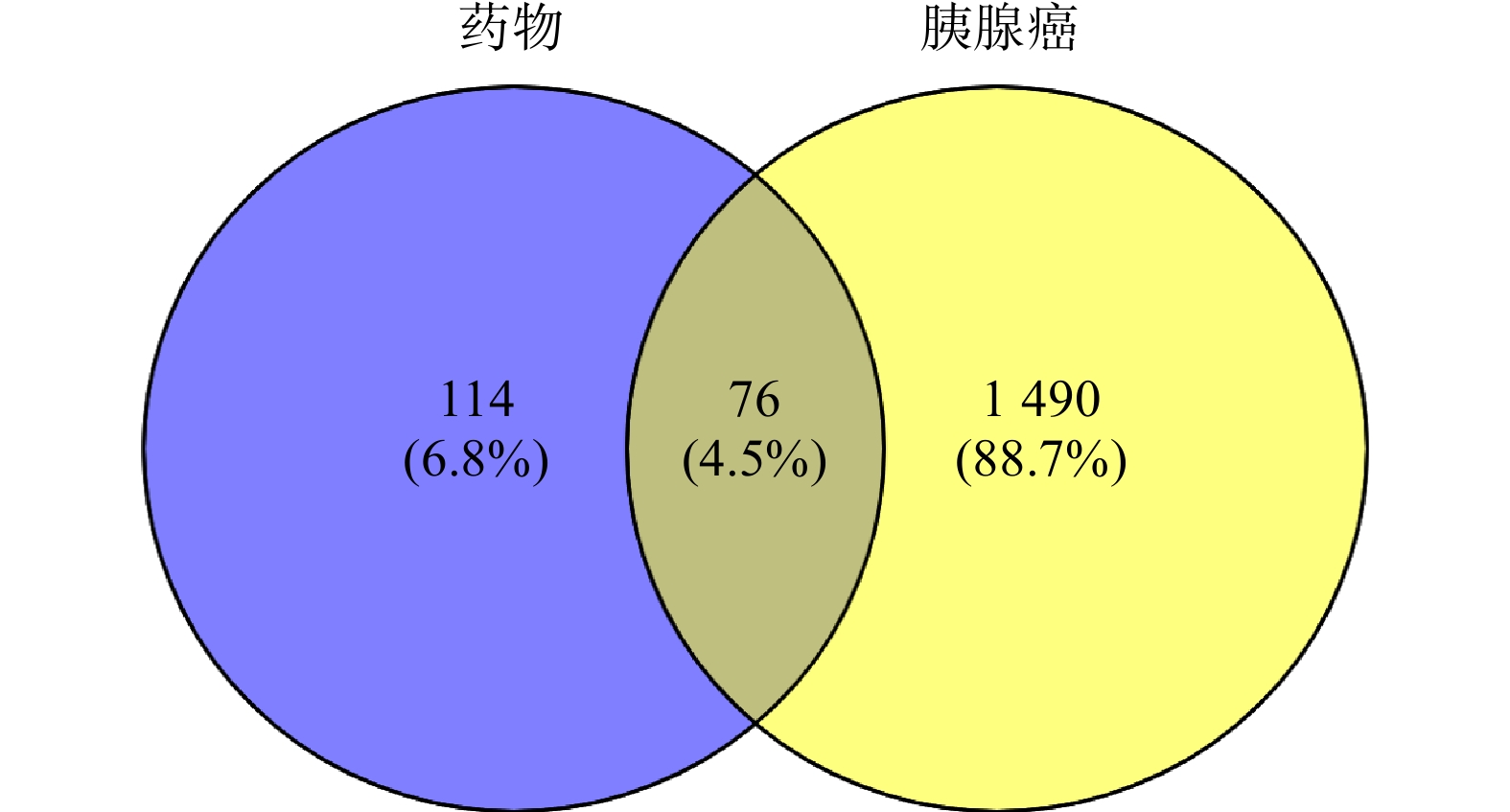
在TCMSP数据库中检索到白术55个化合物,半夏116个化合物,茯苓34个化合物。在OB≥30%,DL≥0.18的筛选条件下,共得到35 个活性成分化合物,其中,白术 7个, 半夏13个,茯苓15 个。通过 PharmMapper平台对 35个化合物的靶点进行预测,将得到的结果与TCMSP搜集的靶点汇总去重后,经 UniProt 数据库标准化后得到190个潜在作用靶点。通过检索OMIM和GeneCards数据库,筛选汇总后共获得1 566个胰腺癌相关靶点。通过绘制韦恩图,得到白术-半夏-茯苓配伍治疗胰腺癌的交集靶点共76个(图1)。
-
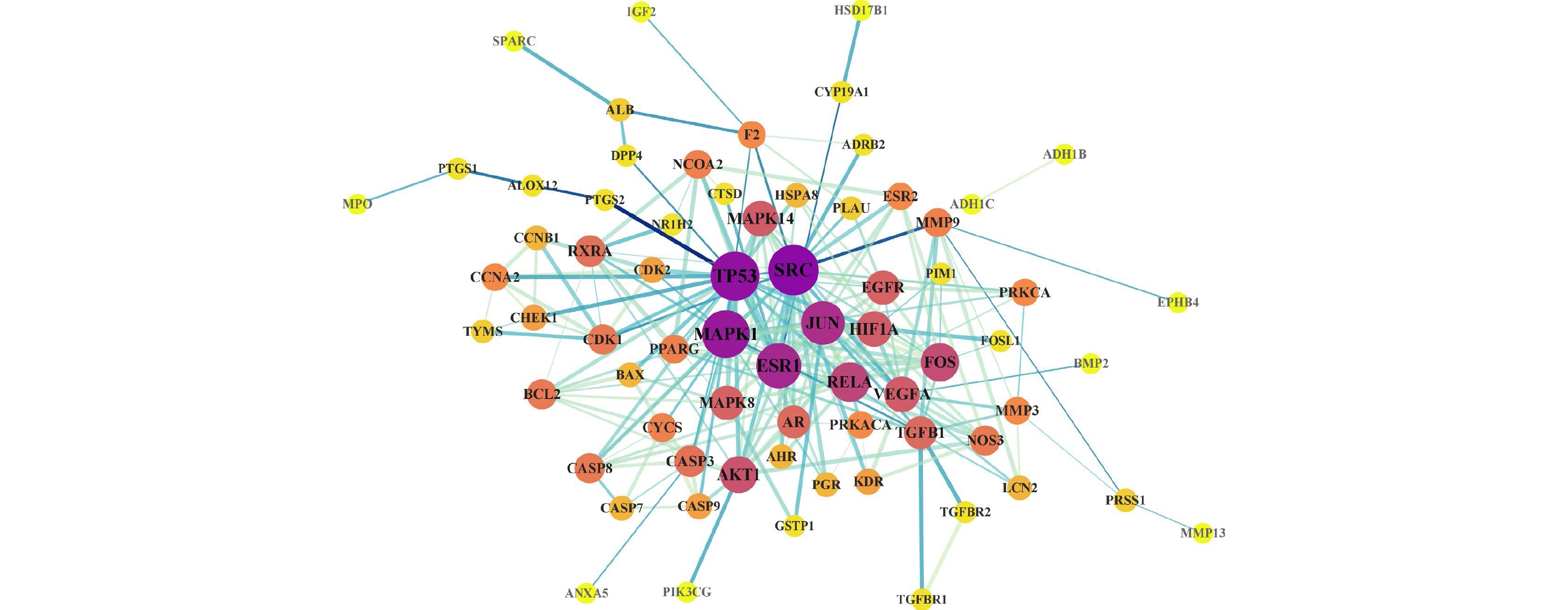
在Cytoscape 3.9.1软件中导入白术-半夏-茯苓配伍治疗胰腺癌的活性成分与交集靶点数据,构建药物-成分-交集靶点的关系网络(图2),包括114个节点(3个中药节点、35个活性成分节点、76个交集靶点节点)和516条边。其中,用拼音首字母BZ、BX、FL分别代表白术、半夏、茯苓;首字母+数字代表每种药物的活性成分。从图2 可以看出,同一活性分子可作用多个靶点,而不同活性分子可作用同一靶点,说明该药组配伍治疗胰腺癌可能是通过多成分、多基因靶点发挥作用的。在网络中,节点越大,节点相连的线条数越多,则节点的度值越大,其在网络中发挥的作用也相对越大。所有活性成分中,白术活性成分度值排名前三的是12-千里光酰基-8-反式白术三醇(12-senecioyl-2E,8E,10E-atractylentriol,度值15),14-乙酰基-12-千里光酰基-8-反式白术三醇(14-acetyl-12-senecioyl-2E,8E,10E-atractylentriol,度值15),3β-乙酰氧基苍术酮(3β-acetoxyatractylone,度值9);半夏活性成分度值排名前三的是黄芩素(baicalein,度值31),12,13-环氧-9-羟基十九碳-7,10-二烯酸(12,13-epoxy-9-hydroxynonadeca-7,10-dienoic acid,度值23),β-谷甾醇(beta-sitosterol,度值22);茯苓活性成分度值排名前三的是茯苓酸A(poricoic acid A,度值22),茯苓酸B(poricoic acid B,度值22),3β-羟基-24-亚甲基-8-羊毛甾烯-21-酸(3beta-Hydroxy-24-methylene-8-lanostene-21-oic acid,度值21)。度值排名前10的靶点分别为CA2(度值32),PIM1(度值27),ALB(度值25),MAPK1(度值21),AR(度值20),GSTP1(度值20),CASP3(度值19),PGR(度值17),BMP2(度值17),CASP7(度值15)。
-
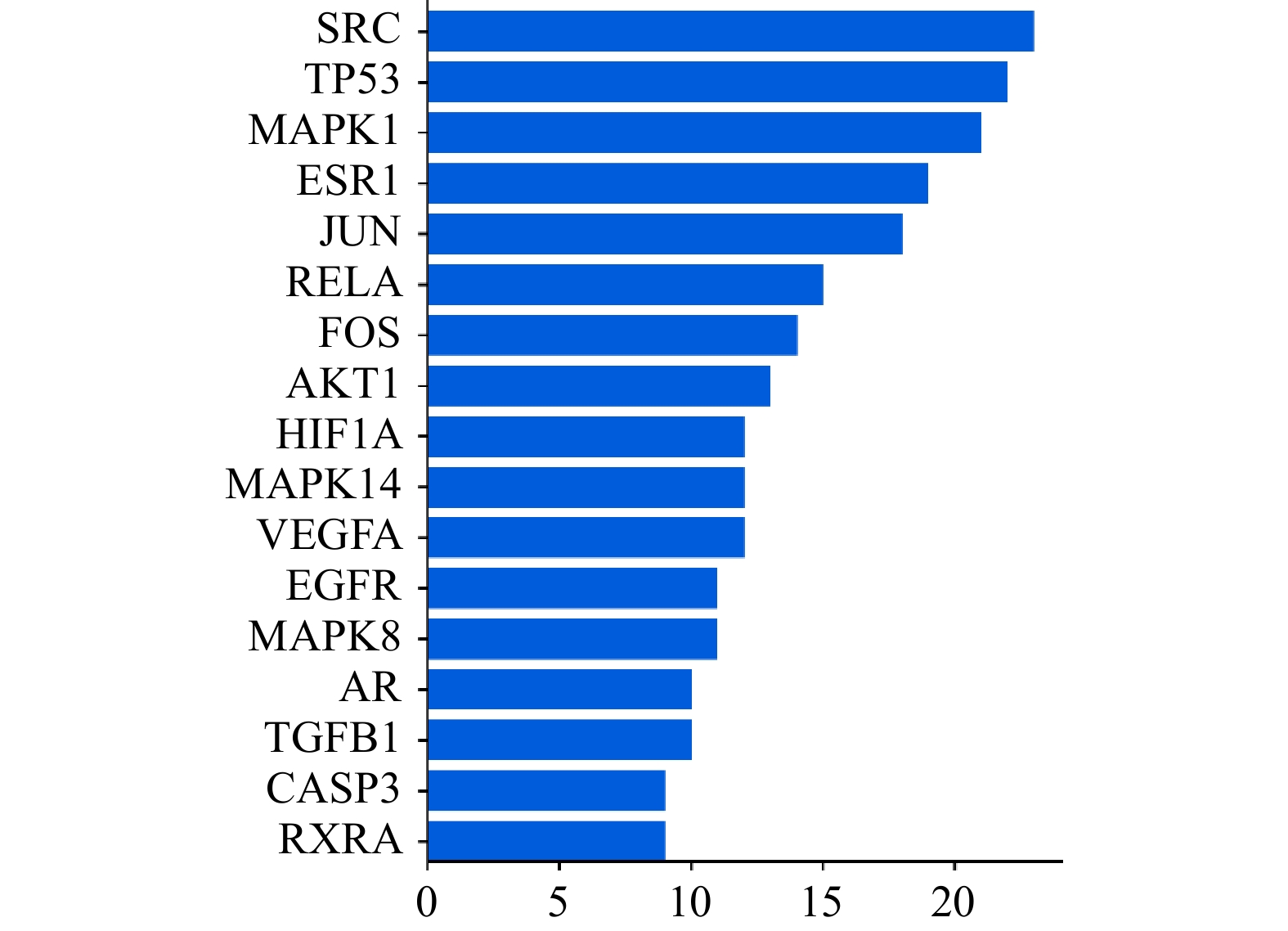
使用STRING 11.5平台对交集靶点进行分析,并将结果数据导入Cytoscape 3.9.1构建PPI网络(图3)。其中,节点颜色越深、直径越大代表它与其他靶点的相关性越大,在蛋白相互作用的网络中处于越中心的位置。对PPI网络进行拓扑分析,筛选得到网络中degree值>2倍中位数值的17个核心靶点蛋白基因(图4),degree值排名前十的靶点蛋白基因分别是SRC、TP53、MAPK1、ESR1、JUN、RELA、FOS、AKT1、HIF1A、MAPK14。在PPI网络中,靶点degree值越大,说明该靶点与其他靶点的相互作用越强。因此,上述10个靶点基因可能是白术-半夏-茯苓配伍治疗胰腺癌的核心靶点。
-
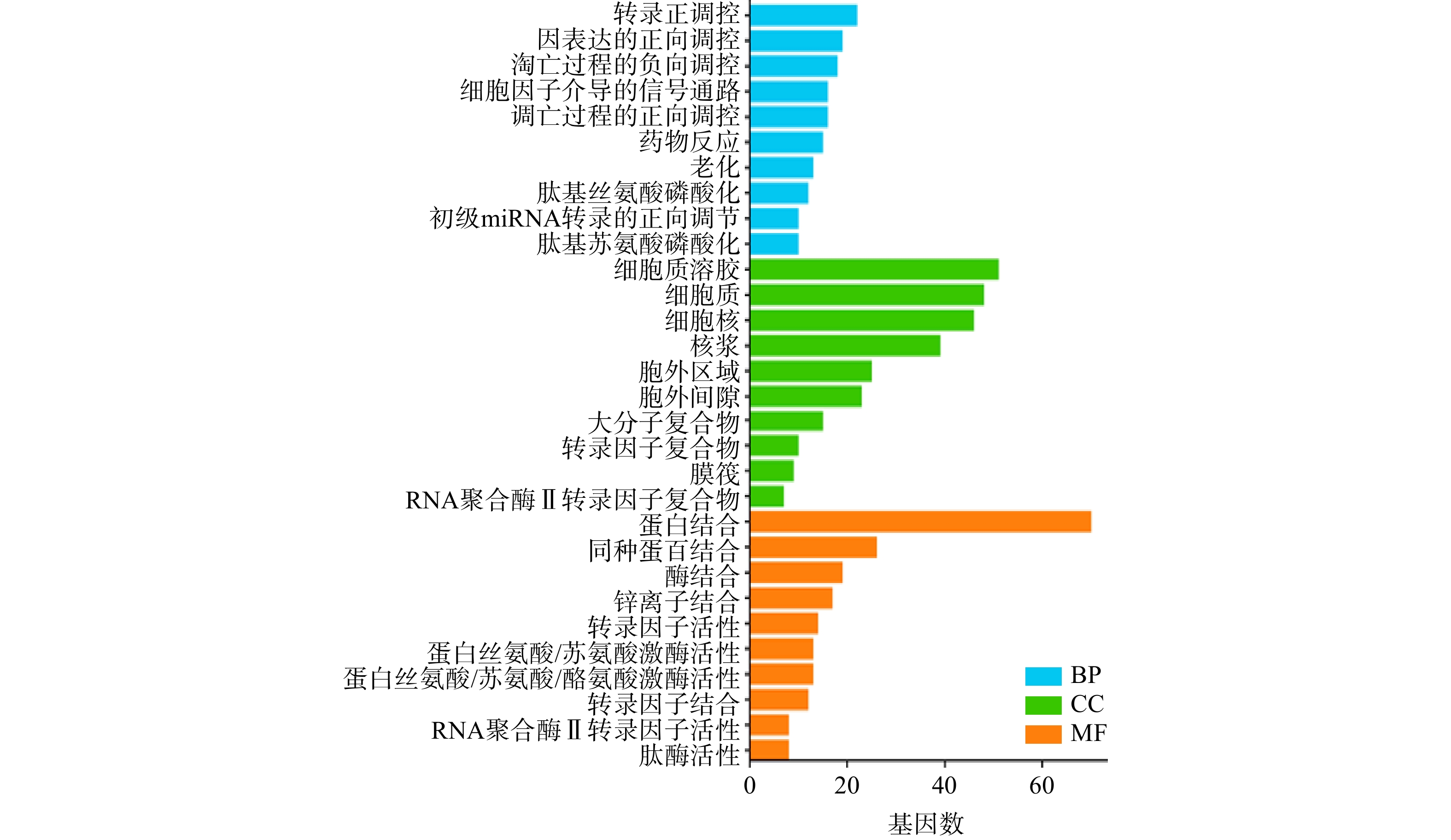
将白术-半夏-茯苓与胰腺癌的交集靶点基因导入DAVID数据库进行GO富集分析,得到P<0.05的结果共计498个。其中,包含生物过程(BP)条目373个,细胞组成(CC)条目36个,分子功能(MF)条目89个。将生物过程、细胞组成和分子功能排名前十的分析结果绘制成柱状图(图5)。
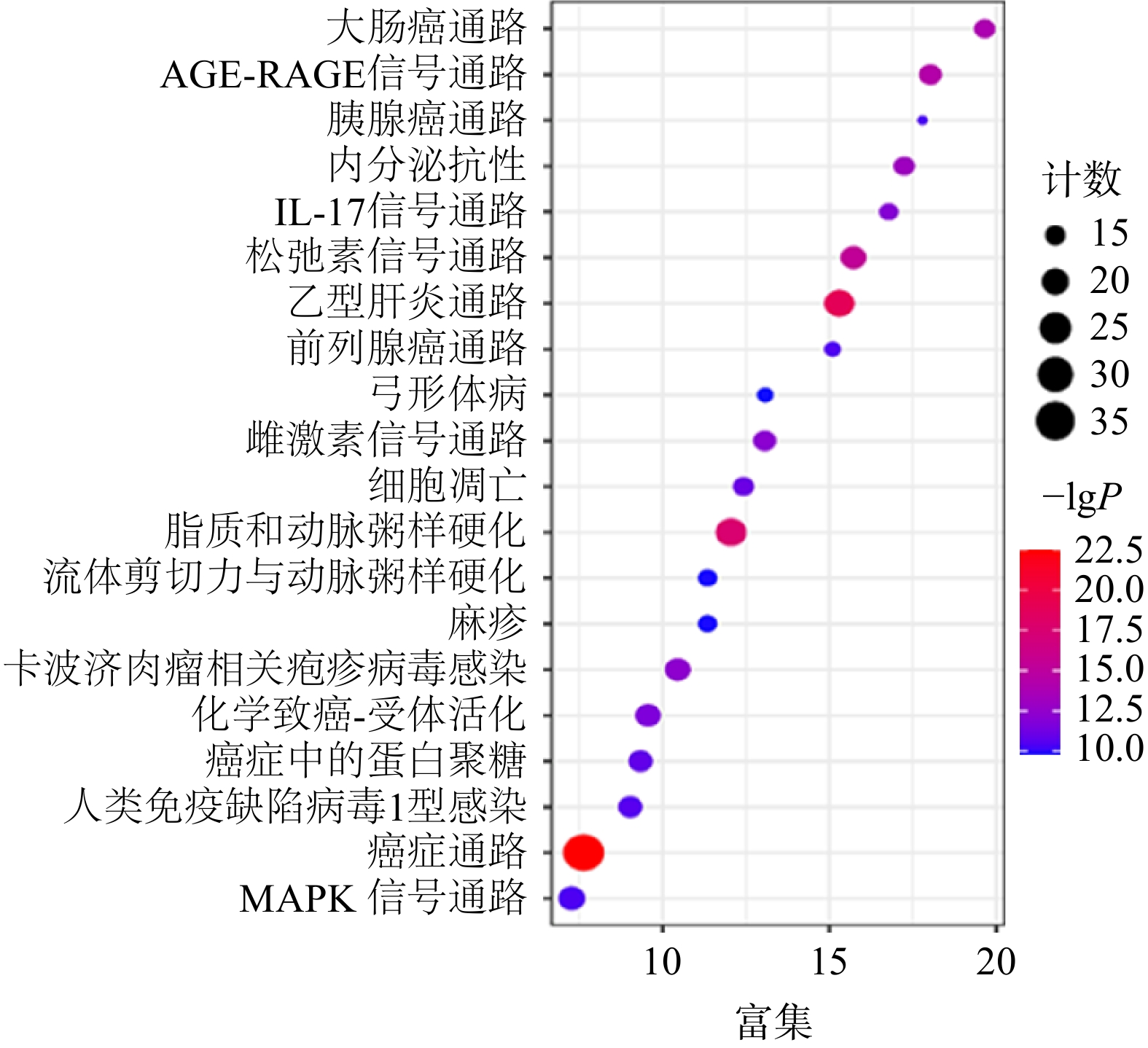
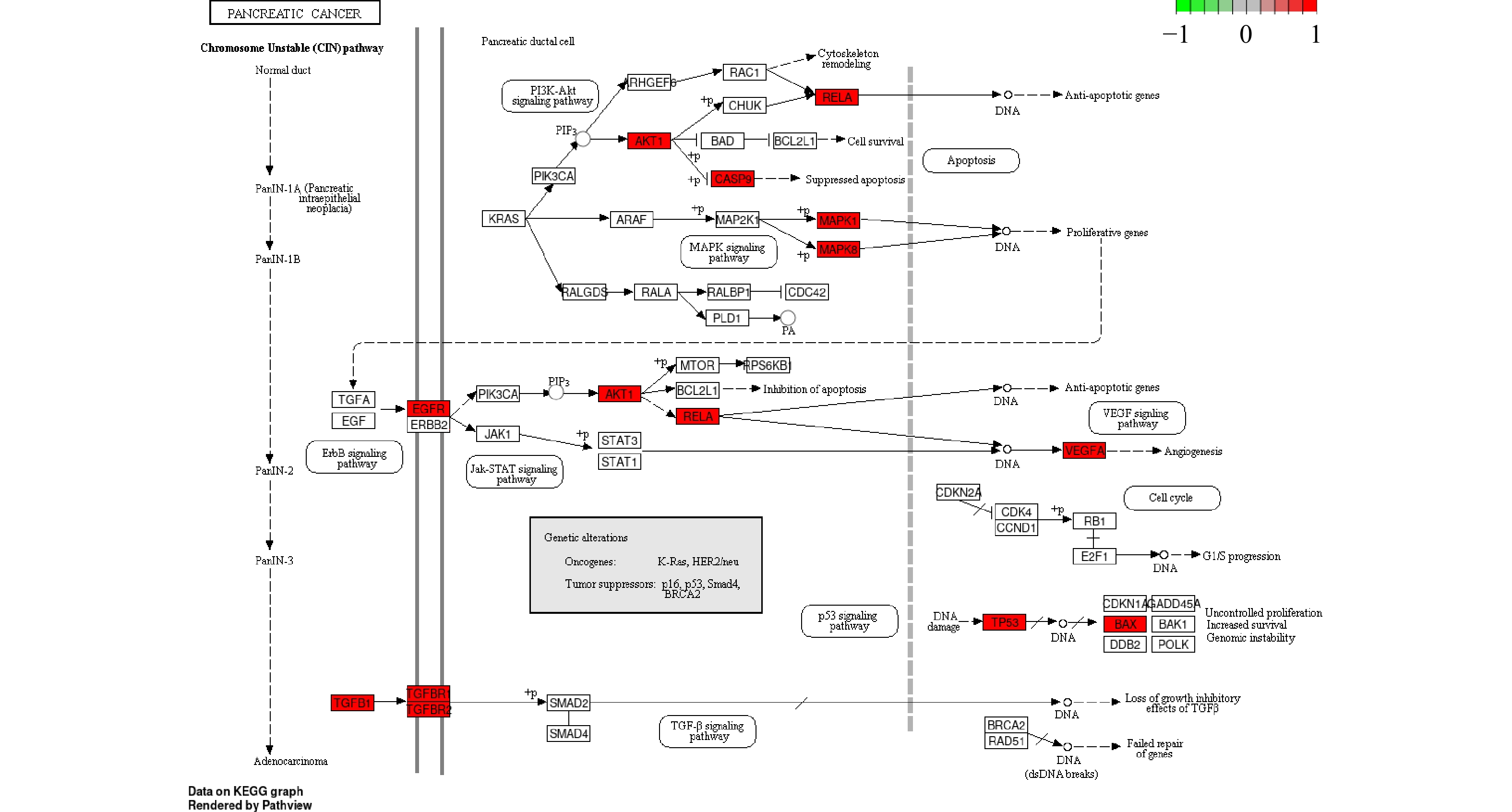
通过KEGG分析筛选出P<0.05的通路共134条,前20条通路见图6。其中,胰腺癌信号通路的潜在靶点有AKT1,MAPK1,MAPK8,RELA,TP53,CASP9,TGFB1,BAX,EGFR,TGFBR1,TGFBR2,VEGFA。通过进一步分析,白术-半夏-茯苓配伍治疗胰腺癌是通过影响KRAS下游的PI3K-Akt信号通路、MAPK信号通路、ErbB信号通路、VEGF信号通路、p53信号通路以及TGF-β信号通路发挥作用的(图7)。
-
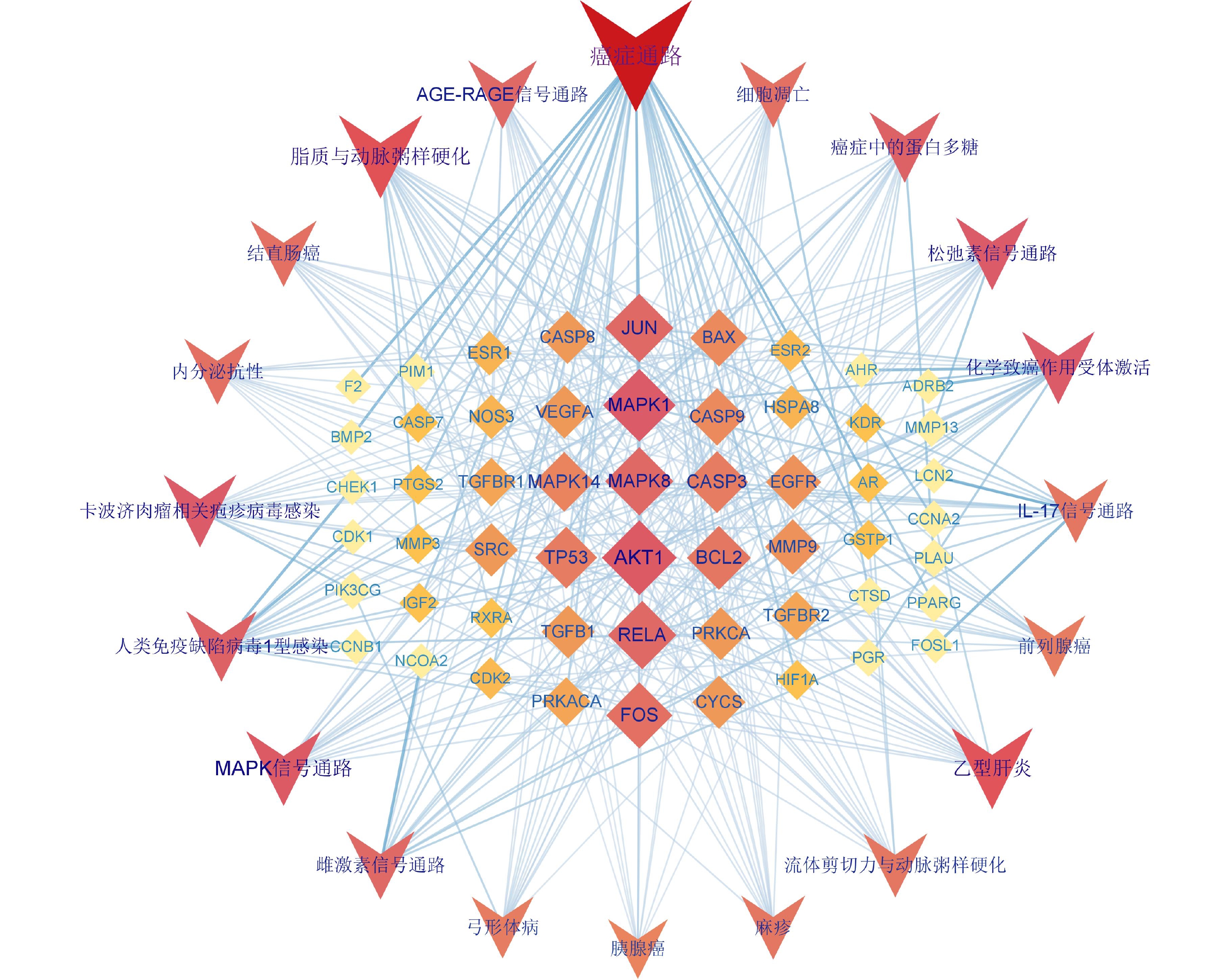
将KEGG富集分析得到的前20条显著差异的信号通路与相应靶点导入 Cytoscape 3.9.1软件构建白术-半夏-茯苓治疗胰腺癌的靶点-通路网络(图8)。该网络中共75个节点,其中 55个菱形节点为药组治疗胰腺癌的潜在作用靶点,20个V形节点代表信号通路。度值排名前10的靶点为AKT1(度值19)、MAPK1(度值18)、MAPK8(度值16)、RELA(度值16)、JUN(度值16)、FOS(度值15)、BCL2(度值14)、TP53(度值13)、CASP3(度值13)、MAPK14(度值12)。
-
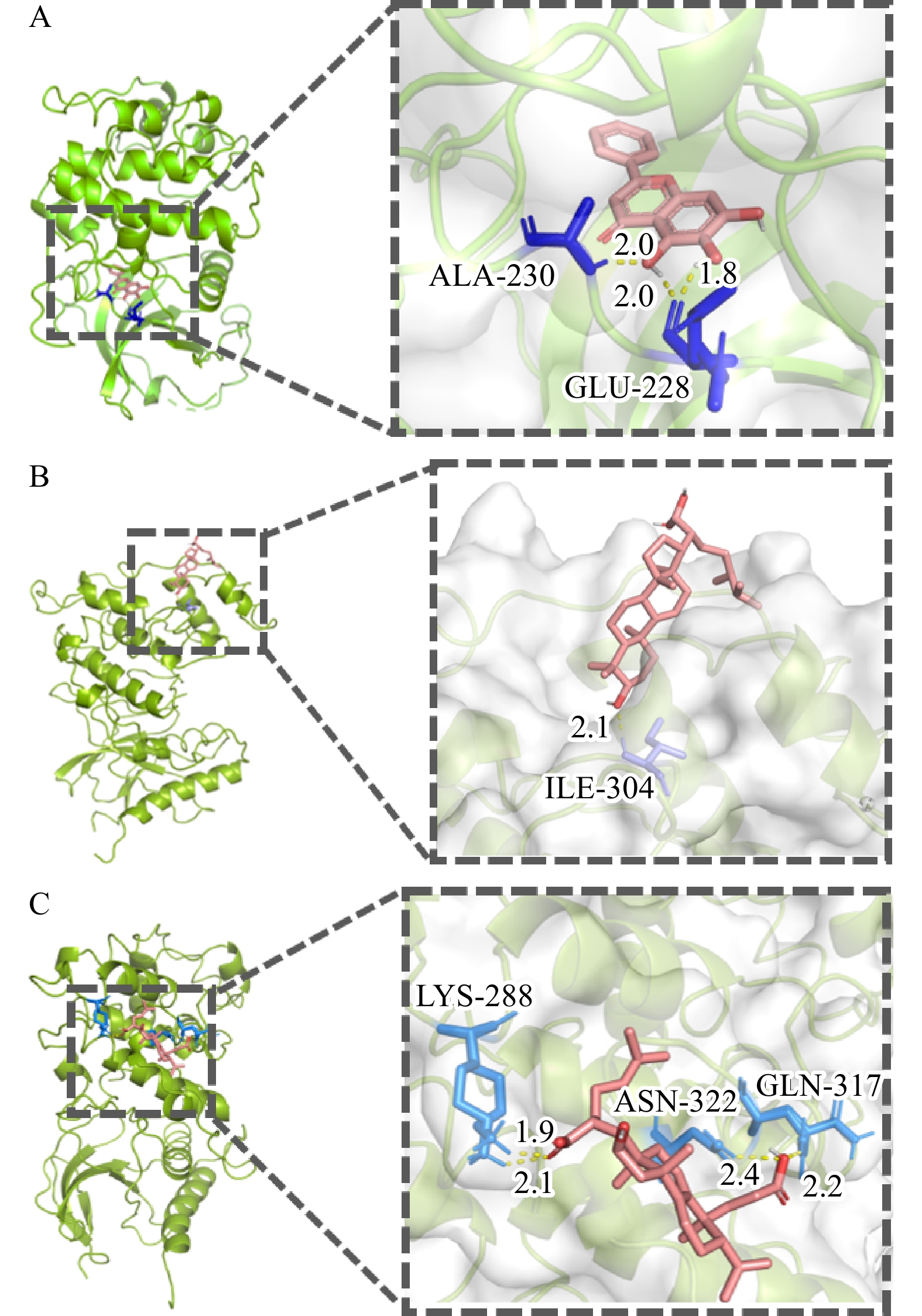
一般而言,配受体间的结合能越小,结合越稳定。结合能≤−20.93 kJ/mol,表明配受体间有较好的结合活性[11]。为了能更好地阐述白术-半夏-茯苓配伍治疗胰腺癌的可能作用机制,选取靶点-通络网络中胰腺癌通路相关的关键靶点AKT1,MAPK1,MAPK8,RELA和TP53,并筛选出与胰腺癌通路关键靶点相关的位于药物-成分-交集靶点网络图中度值排名前三的核心活性成分进行分子对接验证,结果见表1。其中,茯苓酸A与靶点AKT1,3β-羟基-24-亚甲基-8-羊毛甾烯-21-酸与靶点MAPK8,茯苓酸B与靶点MAPK8的结合能≤−20.93 kJ/mol,表明它们与靶点间有较好的结合活性。利用PyMOL软件将稳定结合排名前三的对接结果进行可视化处理(图9)。茯苓酸A与靶点AKT1的氨基酸残基ALA-230/GLU-228形成3个氢键,3β-羟基-24-亚甲基-8-羊毛甾烯-21-酸与靶点MAPK8的氨基酸残基ILE-304形成1个氢键,茯苓酸B与靶点MAPK8的氨基酸残基LYS-288/ASN-322/GLN-317形成4个氢键,这些氢键可能是配体结合到相应靶蛋白位点的主要作用力。
表 1 白术-半夏-茯苓核心成分与胰腺癌关键靶点的结合能
序号 活性分子 靶点 结合能(kJ/mol) 1 黄芩素 AKT1 −26.87 2 3β-羟基-24-亚甲基-8-羊毛甾烯-21-酸 MAPK8 −21.64 3 茯苓酸 B MAPK8 −21.39 4 黄芩素 RELA −19.46 5 黄芩素 TP53 −19.38 6 茯苓酸 A MAPK1 −19.30 7 3β-羟基-24-亚甲基-8-羊毛甾烯-21-酸 MAPK1 −18.71 8 茯苓酸 A MAPK8 −18.59 9 14-乙酰基-12-千里光酰基-8-反式白术三醇 MAPK8 −13.44 10 茯苓酸 B MAPK1 −11.13 11 12-千里光酰基-8-反式白术三醇 MAPK8 −8.58 12 12,13-环氧-9-羟基十九碳-7,10-二烯酸 MAPK1 −8.33 13 12-千里光酰基-8-反式白术三醇 MAPK1 −6.15 14 12,13-环氧-9-羟基十九碳-7,10-二烯酸 MAPK8 −3.10 -
胰腺癌是一种预后极差的消化系统恶性肿瘤。目前临床上治疗胰腺癌倡导综合姑息性手术、放化疗、分子靶向治疗等多学科疗法[12]。中医在治疗晚期胰腺癌的目标并不只是消灭肿瘤,其注重整体调理与辨证论治的治疗方式能显著提高患者的生活质量与5年生存率[13]。多数中医认为,胰腺癌总体属于正虚邪实的病证,其疾病的机制可以归纳成脾虚、肝郁、痰瘀等。中医治疗胰腺癌时注重攻补兼施,常以健脾益气的中药为主,并且用疏肝理气、利水渗湿、燥湿化痰等中药辅助。白术-半夏-茯苓三药协同施用可产生健脾化湿的功效,对相应病证的胰腺癌患者具有良好的效果[14]。
本研究通过网络药理学方法,筛选出白术-半夏-茯苓3种中药的主要活性成分共35个,包括黄芩素、β-谷甾醇、茯苓酸A、茯苓酸B、3β-乙酰氧基苍术酮等。黄芩素又称黄芩苷元,是半夏的主要活性成分之一,具有抗肿瘤、抗氧化、抗菌消炎等生理活性[15]。黄芩素能通过Hedgehog通路有效抑制胰腺癌干细胞的增殖,并通过转录机制降低抗凋亡基因Mcl-1的表达,促进线粒体细胞色素 C的释放以及激活半胱氨酸蛋白酶来诱导细胞的凋亡[16]。此外,黄芩素还可通过抑制巨噬细胞相关的炎症反应来降低肿瘤微环境的炎症, 从而抑制大鼠胰腺腺泡的导管样化生[17]。β-谷甾醇是一种植物甾醇类成分,能诱导活化淋巴细胞来提高机体免疫力并发挥靶细胞杀伤作用,进而抑制乳腺癌、胃癌、大肠癌等肿瘤细胞的生长[18]。它能抑制人胰腺癌的增殖、诱导其凋亡,抑制其迁移与侵袭,并通过 AKT/GSK-3β信号通路抑制上皮间质转化[19]。茯苓酸A是中药茯苓表层的主要三萜类化学成分,可以通过Akt/mTOR 通路温和地抑制多种癌细胞的生长。茯苓酸A通过降低mTOR 和 p70s6K 的磷酸化来调节 mTOR/p70s6k 通路,从而诱导卵巢癌细胞凋亡和自噬,极大地抑制卵巢癌细胞的增殖、迁移和侵袭[20]。茯苓酸 B能诱导巨噬细胞中NO的产生,降低炎性细胞因子,产生比茯苓酸A更高的抗炎活性[21]。白术药用成分挥发油的主要成分是苍术酮。MTT 法检测发现,它能对肝癌细胞、肺癌细胞、乳腺癌细胞及结肠癌细胞均产生不同程度的抑制活性[22]。
本研究中, 通过STRING数据库获取了白术-半夏-茯苓配伍治疗胰腺癌潜在作用靶点蛋白相互关系的数据,构建 PPI 网络后分析数据得到degree值排名前十的核心靶点蛋白,分别是SRC、TP53、MAPK1、ESR1、JUN、RELA、FOS、AKT1、HIF1A、MAPK14。SRC基因编码人原癌基因酪氨酸蛋白激酶Src。Src作为一种非受体细胞质酪氨酸激酶参与多种细胞活动,如细胞分化、增殖、黏附和迁移等。Src活性增加可促进癌细胞的过度增殖、迁移、侵袭和上皮间质转化。SRC基因过表达与激活促进了胰腺癌细胞的转移,而对胰腺癌应用酪氨酸蛋白激酶Src 抑制剂能产生一定的临床治疗效果[23]。TP53 是一种肿瘤抑制基因,编码一种在细胞中具有调节活性的抑癌蛋白。TP53在75%的胰腺癌中发生突变,而这种突变会促进肿瘤细胞的生长和远处转移[24]。MAPK1与MAPK14是MAPK家族的成员,它们编码的蛋白激酶1主要调节各种细胞活动,如细胞增殖、分化、侵袭和转移。胰腺癌中存在 MAPK通路的异常激活,而这与胰腺癌的远处转移密切相关[25]。ESR1编码的人雌激素受体是类固醇核受体超家族的成员,作为转录因子发挥作用,在促进各种癌症的生长过程中起关键作用。它在胰腺癌细胞中表现出增强的转录活性,从而促进胰腺癌细胞的增殖和迁移[26]。JUN基因编码的转录因子Jun是JNK信号通路的下游靶标,其与87%胰腺肿瘤的进展相关[27]。RELA 基因编码的蛋白是经典的核因子-κB通路的信号转导因子,其与胰腺癌的发生发展相关。相比于正常小鼠,RELA 敲除小鼠在胰腺癌前病变过程中出现了更多的 DNA 损伤,而这种损伤会促进胰腺癌的进展[28]。FOS基因编码的蛋白c-Fos是激活蛋白复合物的成员,它是其他癌基因的重要效应物,参与细胞增殖、迁移、细胞凋亡等过程的调节。致癌因子c-Fos的异常表达会促进胰腺癌的进展,并与其预后相关[29]。AKT1 基因编码一种丝氨酸/苏氨酸蛋白激酶。活化的Akt激酶可磷酸化多种蛋白底物,引起胰腺肿瘤的发生与转移。Akt激酶抑制剂与吉西他滨联用可以显著抑制胰腺癌细胞的转移,诱导癌细胞凋亡[30]。HIF1A基因编码的缺氧诱导因子1α是一种机体对低氧应答的核蛋白,参与血管形成,能量代谢,细胞凋亡等生物学过程。胰腺导管腺癌基质中缺乏血管与氧气,导致缺氧诱导因子1α的上调,从而促进癌细胞在低氧环境中存活。缺氧诱导因子1α可通过抑制蛋白磷酸酶1调节因子亚基1B的表达以及p53 蛋白的降解来发挥肿瘤抑制作用。胰腺癌细胞中HIF1A 基因缺失将增加肿瘤细胞的侵袭性和转移活性[31]。
GO与KEGG 富集分析显示,白术、半夏和茯苓主要通过参与基因表达的调控,细胞因子介导的信号通路,蛋白质的磷酸化以及细胞凋亡等生物过程,从多方面影响胰腺癌的进展。通过对作用机制的进一步研究,白术-半夏-茯苓通过影响KRAS下游的PI3K-Akt信号通路、MAPK信号通路、ErbB信号通路、VEGF信号通路以及p53信号通路发挥治疗胰腺癌作用。PI3K-Akt信号通路是KRAS下游的重要信号通路,能调节肿瘤细胞的增殖与凋亡。研究表明,通过下调 PI3K/Akt 信号通路可抑制胰腺癌细胞 [32]。MAPK信号通路在胰腺癌的多种信号传递过程中起关键作用,参与调控基因的表达、细胞的增殖与凋亡。MAPK信号通路主要包括细胞外信号调节蛋白激酶(ERK)、p38丝裂原活化蛋白激酶(p38 MARK)和c-Jun氨基末端激酶(JNK)。其中,ERK主要调节细胞的生长与分化,而p38 MAPK与JNK信号通路在调节机体炎症和细胞凋亡等方面发挥作用[33]。ErbB 信号通路在多种类型的实体瘤中表现出异常的信号转导,包括胰腺癌、乳腺癌、膀胱癌和直肠癌等。ErbB信号通路不仅参与细胞增殖,还能调节肿瘤进展的其他活动,如细胞运动、黏附、血管生成以及免疫抑制等。ErbB 信号通路的EGF 受体过表达或活性失调通常与癌症的恶性程度和预后不良有关[34]。VEGF信号通路是通过血管内皮生长因子(vVEGF)与相应受体结合来激活酪氨酸激酶介导的信号网络来发挥其血管生成功能。胰腺癌组织中,VEGF信号通路异常激活,导致胰腺癌基质血管的异常增生,这与肿瘤的转移和进展有密切联系[35]。p53肿瘤抑制信号通路通过控制有丝分裂,脂肪酸的β氧化、葡萄糖与氨基酸代谢等致癌信号来抑制肿瘤的生长。在胰腺癌中,p53信号通路功能的缺失普遍存在。p53 基因的错义突变或截短突变导致信号通路的异常,以致于机体缺失促进细胞凋亡、触发DNA 损伤反应以及维持细胞极性等反应,促进了胰腺癌的发生与发展[36]。TGF-β信号通路由多种功能性细胞因子,受体以及信号转导分子构成,能调节基因的表达,影响细胞的增殖、黏附、转移以及凋亡等过程。它在癌症发生发展过程中起到双重作用。在癌症形成早期,TGF-β 信号通路通过启动细胞停滞与凋亡程序来抑制肿瘤的生长;在癌症发展中晚期,它对癌细胞的抑制作用会降低,反而成为癌细胞生长的助力[37]。
为了进一步验证白术-半夏-茯苓配伍治疗胰腺癌的作用机制,采用分子对接技术对核心活性成分与关键靶点蛋白进行分子对接。对接结果显示,茯苓酸A与靶点AKT1,3β-羟基-24-亚甲基-8-羊毛甾烯-21-酸与靶点MAPK8,茯苓酸B与靶点MAPK8有较好的结合活性。因此,白术-半夏-茯苓可能主要通过KRAS下游的PI3K-Akt信号通路与MAPK信号通路发挥胰腺癌的治疗作用。
综上所述,本文通过网络药理学方法对白术-半夏-茯苓配伍治疗胰腺癌的作用机制进行分析,发现白术-半夏-茯苓通过多靶点、多通路对胰腺癌进行调控,为阐述白术-半夏-茯苓配伍治疗胰腺癌的作用机制提供了初步的理论依据,但后续仍然需要进一步基础与临床实验来验证白术-半夏-茯苓配伍治疗胰腺癌的作用机制与效果。
Research on the mechanism of Atractylodes-Pinellia-Poria in the treatment of pancreatic cancer based on network pharmacology and molecular docking
-
摘要:
目的 采用网络药理学和分子对接技术预测白术-半夏-茯苓配伍治疗胰腺癌的作用靶点,探讨其治疗胰腺癌的潜在分子作用机制。 方法 通过中药系统药理学数据库和分析平台(TCMSP)、PharmMapper、OMIM、GeneCards、STRING、DAVID等在线数据库与Cytoscape软件构建一系列网络图、 筛选核心靶点并对靶基因进行GO分析和KEGG通路富集分析,最后通过AutoDock软件对关键活性成分与潜在作用靶点进行分子对接验证。 结果 共筛选得到药组活性成分35个,相关靶点190个,胰腺癌靶点1 566个以及白术-半夏-茯苓治疗胰腺癌的交集靶点76个。这些交集靶点主要参与基因表达的正调控,细胞因子介导的信号通路以及细胞凋亡调控等生物学过程,并与癌症通路、乙型肝炎、大肠癌、化学致癌受体激活、胰腺癌以及MAPK 信号通路等相关。分子对接结果显示,白术-半夏-茯苓的主要活性成分与胰腺癌的潜在作用靶点间具有一定的结合活性。 结论 白术-半夏-茯苓主要通过多成分、多靶点、多通路发挥对胰腺癌的治疗作用,为临床应用白术-半夏-茯苓配伍治疗胰腺癌提供一定的理论依据。 Abstract:Objective To predict the target of Atractylodes-Panxia-Poria in the treatment of pancreatic cancer, and to explore its potential molecular mechanism by using network pharmacology and molecular docking. Methods Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform (TCMSP), PharmMapper, OMIM, GeneCards, STRING, DAVID and Cytoscape software were used to construct a series of network diagrams. The core targets and conduct GO analysis and KEGG pathway enrichment analyses of the target genes were selected. Finally, molecular docking verification of key active ingredients and potential targets were conducted by AutoDock software. Results A total of 35 active ingredients, 190 related targets, 1566 targets of pancreatic cancer and 76 intersection targets were screened for the treatment of pancreatic cancer with Atractylodes-Panxia-Poria. These intersection targets were mainly involved in several biological processes, including positive regulation of gene expression, cytokine-mediated signaling pathway and regulation of apoptotic process, etc, which were also related to pathways in cancer, hepatitis B, colorectal cancer, chemical carcinogenesis-receptor activation, pancreatic cancer, and MAPK signaling pathway, etc. Molecular docking results showed that the main active components of Atractylodes-Panxia-Poria had certain affinity with the potential targets of pancreatic cancer. Conclusion Atractylodes-Panxia-Poria mainly exerts a therapeutic effect on pancreatic cancer through multi-component, multi-target and multi-pathway, which provides a certain theoretical basis for the clinical application of Atractylodes -Panxia-Poria in the treatment of pancreatic cancer. -
自1843年11月17日开埠以来,上海以其“开放包容、经济发达、生活精致、文化繁荣”等独特的地域特征,渐渐形成了独特的海派文化特质,即“海纳百川、兼容并蓄、开放创新、追求卓越”,而海派中医则是海派文化的重要组成之一[1]。海派著名老中医善用膏方,逐渐形成了独具特色的“海派膏方”。海派膏方因人、因时、因地制宜,越来越迎合现代人治病、食补或保健的需求,“海派膏方热”迅速蔓延。海派膏方的应用虽得到广泛推广,且效果良好,但其历史渊源未见详细报道,故笔者查阅相关文献,结合实际,浅析海派膏方的历史渊源,梳理其各个阶段的发展情况,并进行总结归纳[2],以期更全面地了解与掌握海派膏方,为人们提供更优质的服务。
1. 海派膏方相关概念
1.1 海派文化
上海,地处吴越中心地带,地理位置优越,处于长江的入海口,是典型的冲积平原,经济发达,物产丰富,交通也比较便捷,各种物质、信息、人员在此汇聚,逐渐形成了特有的“海派文化”。海派文化的独特之处在于,它不像中国其他地区一样只有一种文化,它既有江南地区传统的吴越文化,又包含了自从开埠以后汇入的西方各国文化;它不注重功名和官衔,而看重实际利益和个人的奋斗。正是这种“海纳百川、开放包容”的“海派文化”,给了许多优秀、有才华、勇于拼搏的知识分子包括中医师汇聚上海的动力,为他们提供了发展的舞台[3]。同时,四季分明的气候特点让上海人十分注意遵循时令的变化而采取不同的养生保健措施,与中医的“天人合一”理论相合。俗话说“冬令进补,夏天打虎”,这样的传统在上海更是根深蒂固,除一般食补以外,人们提出了更高的医疗保健需求。
1.2 海派中医
“海派文化”对近现代的中国社会产生了一定的影响,而“海派中医”则是组成海派文化的一个无可替代的部分[1]。“海派中医”是以“海派文化”为滋生土壤,以中西医学兼容并蓄的名医群体为代表,尤其是许多享誉海内外的名医群体,在一种独特的地域环境下形成的医学文化现象[4]。“海派中医”中包含了不同的行医风格、不同的医学门派以及不同的学术见解的各科医家流派,共同组成了“海纳百川、有容乃大”的海派中医流派[5]。
1.3 海派膏方
海派著名老中医一直重视膏方,逐渐形成了“海派膏方”。彼时北方膏方仍以巩固宿疾、治疗为主,并无对时令的要求。至清代后期,南北差异日益显著。在上海这种独特的经济、文化和地理气候影响下,形成了自身独特的“海派膏方”特点,即“补中寓治,治中寓补,补治结合”。海派中医在开具海派膏方时,较少使用攻伐作用强的猛药,例如芒硝、大黄等,而是用药比较温和,阿胶、龟板、熟地、人参等补阳、补阴、补血、补气等性情温和的补虚之品较为常见。海派中医在组方时会辨证分型治疗,使得海派膏方并不局限于补益这一种形式。此外,海派膏方还首次提出了“开路方”的思想,意思就是若患者本来其体内就有湿、痰、瘀等淫邪或者有一定程度上的脾胃消化不良,则在服用海派膏方前,先使用化湿健脾的药物,使得脾胃健运,防止“闭门留寇”。“开路方”同时也是对患者的身体进行一次试探性的调补,以此来观察其用药后的反应,为膏方正式调补提供“开路”基础[6]。最终逐渐形成了先用“开路方”祛邪扶正、健脾开胃,再给予膏方滋肾固精、益寿延年的治法[7]。
2. 海派膏方的起源与发展
据文献报道,“海派中医”始于清末民初[4],所以本文从清代开始浅析海派膏方的发展轨迹。
2.1 清代时期
江南地区是膏方文化的发源地,而上海则为江南地区膏方的中心[8]。上海地区原属江苏,还未开埠时,中医师就已经有了开膏方的习惯。清代早期,沪上名医沈鲁珍(1658—1738年)开具的膏方是典型的素膏,其用法也与现在的膏方无差[9]。在其《沈氏医案》一书中,记载了多个与膏方有关的医案,例如崇明范锡凡案,范氏患痰火之哮喘,除豁痰降气清火之煎剂外,沈氏处以膏方,即以煎方去桑皮、甘草、莱菔子,加梨汁、莱菔汁、地栗汁、竹沥、姜汁,用饴糖四两,烊入收贮,燉热不时挑化[9]。又如孙采邻提出:“煎膏加蜜成规:凡药一两,煎膏三钱。每膏一两,加白蜜二钱,此成规也。”这基本上成为了清代膏方的统一制作标准。这个时期的冬令膏方无论是在遣方布药上,还是在胶类和收膏的方法使用上几乎与现在的膏方没有差别[7]。
在清中后期时,冬令膏方已见端倪,但却是在诸案中星星点点的散落出现,在流传的一些名医的膏方手稿中可见。这一时期的海派名医张氏内科第八代传人张玉书(1822−1867年)善于给患者开膏方,上海历史博物馆收藏了其留存的上百份膏方处方原件,其后人张骧云留存的膏方手稿收藏于上海中医药博物馆[6]。
在清代晚期,膏方走向民间,冬令膏方开始在江浙一带兴盛起来,这个时期的膏方很大一部分都是在冬季服用,其中夹杂的一些传统膏方的应用已较少,而且胶类、糖类等的使用方法也与现代相似[10]。
此时期的“孟河四大家”之一,海派名医丁甘仁(1865−1926年)在其撰写的《丁甘仁医案·膏方》中出现了“膏方”专章[10]。
2.2 民国时期
民国时期(1912−1949年左右),膏方发展已经比较成熟,而且在人民群众中拥有了良好的根基,成为了人们治病养生的首选[10],尤其是冬令膏方,成为一种冬令进补膏方的潮流。这个时期的北京同仁堂、上海雷允上等很多老字号的中药堂店推出了自制的成品膏方,例如葆春膏、八仙民寿膏等,发展前景十分广阔[2]。
民国时期,沪上名医大家秦伯未(1901−1969年)撰写了《膏方大全》和《谦斋膏方案》,这两本书被看作是最早的膏方方面的专著,为膏方的未来发展奠定了理论基础以及临床应用规范[9]。其中,《膏方大全》对膏方的发展的贡献尤为巨大,总结为以下三点:第一,对膏方的名称下了定义。“膏方者,盖煎熬药汁成脂液而所以营养五脏六腑之枯燥虚弱者也,故俗亦称膏滋药”。第二,明确了膏方的性质和用途。“润泽、滋补”是膏方的主要性质,“膏方并非单纯之补剂,乃包含救偏却病之义”。第三,创立了膏方施治的法则。“须视各个之体质而施以平补、温补、清补、涩补;亦须视各个之病根,而施以生津、益气、固精、养血”[11]。即:膏方在选药时要辩不同的体质、不同的病因而不同施治。膏方是以治疗疾病为主,不能把膏方看作是唯一进补之品而盲目进补[12]。这本书已经成为了中医师开膏方的准绳,更是一些年轻的中医师们学习、借鉴膏方的书籍首选[10],甚至现代膏方的药材选配、制作方法等也以该书中的内容为规范[2]。而《谦斋膏方案》则是记载了其本人运用膏方的临证验案[2]。
此外,民国时期还有很多其他海派中医,如李平书、张骧云、夏应堂、余伯陶、张山雷等[13]亦为海派膏方的发展起到了推动作用。
2.3 近现代时期
近现代时期海派膏方进入了迅猛发展阶段。在大量使用海派膏方的同时,冬令膏方的理论体系也初步建立。上海名医既继承了以前的膏方传统,又结合理论和实践做了进一步的探索和研究,使得膏方上了一个新台阶。
1984年,上海中医药大学附属龙华医院首次开设膏方门诊,并且形成了一套规范、全面的炮制流程和标准[2]。随后,江苏、浙江等地模仿上海地区也陆续开设了膏方门诊。一些中药名店也开始推广膏方的应用,例如上海雷允上、杭州胡庆余堂、北京同仁堂等。伴随着膏方门诊数量的增加以及膏方专著的面世,膏方的发展越来越受到医学界的关注和重视,也越来越体现了膏方的临床应用价值[14]。
这个时期对膏方的发展起了重要作用的海派中医有:祝味菊、黄文东、蔡香荪、陈道隆、程门雪、严苍山等名家,并且有膏方医案流传[9]。
2.4 现代时期
进入新世纪,海派膏方的发展也进入了新的阶段。上海掀起了一股“海派膏方热”,老百姓们趋之若鹜,尤其是冬令时节,各个中医医院的膏方门诊都排起了长队。数量上的大幅增长催生出了膏方的工业化大生产,逐渐取代了作坊式的膏方生产[9],这一点从海派膏方的包装上可以看出:所用瓷罐越来越漂亮、精美,而且出现了由包装机器生产的真空袋装膏方,既定量,又密封,服用、携带也方便。伴随着一系列生产管理、经营规范的出台,膏方的发展一直保持在健康向上的轨道上,同时,膏方的生产制作方面也上升了新台阶,例如在卫生条件、质量控制等方面[9]。高效液相色谱法、气相色谱法及薄层色谱法等是在膏方质量控制中运用最多的检测手段,而高效液相色谱法是其中的重要检测方法[15]。
最早采用海派膏方制备传统工艺制作的医疗机构——上海中医药大学附属岳阳中西医结合医院,独立制作加工古法炮制海派膏方,是目前上海地区唯一一家具备自制膏方能力的医院。其在传统中医膏方熬制技艺的基础上,形成了独一无二的“海派中医膏方熬制技艺”——主要包括审方、配方、煎熬前期准备、中药饮片的煎煮、中药药汁的浓缩、收膏、装膏、凉膏、成膏,每个步骤均有特定的规程。最终制备而成的“岳阳膏方”可以达到“其黑如漆,其亮如镜,入口即化”的最优质量。海派中医膏方熬制技艺的主要传承人是郭庆标、鲍忠华、徐玲玲、年华等。其中,徐玲玲作为海派中医膏方熬制技艺的领军人物,在膏方的制备中继承了海派中医膏方熬制技艺学说,并在制膏中广泛应用“海派中医膏方熬制技艺”得到了较好的继承与发展,推动了海派膏方的传播与发扬。
师从张氏第十二代传人张伯讷及七代中医世家刘树农教授的朱抗美,是上海中医药大学附属曙光医院教授,她对海派膏方的贡献可谓是开创性的,从海派膏方的最初发掘、整理,到后续的推广、应用等方面都有她忙碌的身影。
此外,上海目前有15项海派中医流派传承研究基地建设项目,包括丁氏内科、顾氏外科、石氏伤科、陆氏针灸、徐氏儿科、张氏内科、颜氏内科、朱氏妇科、蔡氏妇科、魏氏伤科、丁氏推拿、夏氏外科、董氏儿科、杨氏针灸和恽氏中西医汇通[16]。这些项目将会持续推动海派中医流派的传承,大力促进海派中医流派特色的发扬,同时也为海派膏方的传承与发展做了基础铺垫。
海派膏方文化的影响力越来越大,其衍生的相关文化产物也越来越普及,例如膏方节、开炉仪式等活动[6],而“海派膏方”也越来越被推崇为“膏方之首”。
3. 小结
综上所述,海派膏方从清代到民国再到当代,逐渐走向兴盛[10]。时至今日,服用膏方不仅仅是治病,人们对其提出了更高的医疗保健需求,而海派膏方正好满足了这一需求。2009年,上海全市开出了大约15万料膏方,此后,该数字保持每年10%以上的增长速度,膏方热成为了一种流行趋势。自上世纪80年代中期起,上海中医药大学附属岳阳中西医结合医院恢复开展由中医专家主持的膏方门诊,并设立专用场地,以传统工艺自制加工膏方。每年都有许多专程上门请中医专家把脉、定制服用“岳阳膏方”者,在上海、浙江、江苏、北京和港澳台地区都能看到“岳阳膏方”的“身影”,岳阳医院已成为中医膏方研究和应用的主要基地之一。岳阳医院的“海派中医膏方熬制技艺”已经获得了上海市虹口区非物质文化遗产的批准,同时“岳阳膏方”的研究基地也成为了长三角膏方联盟的副会长单位。目前,全国各地的膏方都有海派膏方的痕迹。在当前广阔的市场和发展前景下,海派膏方的未来发展既有“大显身手”的机遇,也有“披荆斩棘”的挑战,我们要在保持传统中医传承与根本的基础上,推陈出新,使海派膏方的海派中医特色更“传统”,借助现代科技手段的发展更“新颖”,向着更加有利于现代膏方的可持续方向发展,像熠熠生辉的太阳源源不断绽放新光芒。
-
表 1 白术-半夏-茯苓核心成分与胰腺癌关键靶点的结合能
序号 活性分子 靶点 结合能(kJ/mol) 1 黄芩素 AKT1 −26.87 2 3β-羟基-24-亚甲基-8-羊毛甾烯-21-酸 MAPK8 −21.64 3 茯苓酸 B MAPK8 −21.39 4 黄芩素 RELA −19.46 5 黄芩素 TP53 −19.38 6 茯苓酸 A MAPK1 −19.30 7 3β-羟基-24-亚甲基-8-羊毛甾烯-21-酸 MAPK1 −18.71 8 茯苓酸 A MAPK8 −18.59 9 14-乙酰基-12-千里光酰基-8-反式白术三醇 MAPK8 −13.44 10 茯苓酸 B MAPK1 −11.13 11 12-千里光酰基-8-反式白术三醇 MAPK8 −8.58 12 12,13-环氧-9-羟基十九碳-7,10-二烯酸 MAPK1 −8.33 13 12-千里光酰基-8-反式白术三醇 MAPK1 −6.15 14 12,13-环氧-9-羟基十九碳-7,10-二烯酸 MAPK8 −3.10 -
[1] HALBROOK C J, LYSSIOTIS C A, PASCA DI MAGLIANO M, et al. Pancreatic cancer: advances and challenges[J]. Cell, 2023, 186(8):1729-1754. doi: 10.1016/j.cell.2023.02.014 [2] ZHAO C F, GAO F, LI Q W, et al. The distributional characteristic and growing trend of pancreatic cancer in China[J]. Pancreas, 2019, 48(3):309-314. doi: 10.1097/MPA.0000000000001222 [3] ZHANG X F, MAO T B, ZHANG B, et al. Characterization of the genomic landscape in large-scale Chinese patients with pancreatic cancer[J]. EBioMedicine, 2022, 77:103897. doi: 10.1016/j.ebiom.2022.103897 [4] 王馨慧, 刘小英, 付文胜. 胰腺癌的中医药治疗研究进展[J]. 中国中西医结合消化杂志, 2022, 30(4):303-307. [5] 万宇翔, 李丽玲, 张春光,等. 基于数据挖掘的胰腺癌组方规律研究[C]//第五届全国肿瘤阳光论坛暨中医精准控瘤高峰论坛会议论文集. 北京, 2021: 57-65. [6] 左军, 张金龙, 胡晓阳. 白术化学成分及现代药理作用研究进展[J]. 辽宁中医药大学学报, 2021, 23(10):6-9. [7] 王依明, 王秋红. 半夏的化学成分、药理作用及毒性研究进展[J]. 中国药房, 2020, 31(21):2676-2682. [8] 马艳春, 范楚晨, 冯天甜,等. 茯苓的化学成分和药理作用研究进展[J]. 中医药学报, 2021, 49(12):108-111. [9] LI S, ZHANG B. Traditional Chinese medicine network pharmacology: theory, methodology and application[J]. Chin J Nat Med, 2013, 11(2):110-120. [10] Saikia S, Bordoloi M. Molecular docking: challenges, advances and its use in drug discovery perspective[J]. Current drug targets, 2019, 20(5):501-521. doi: 10.2174/1389450119666181022153016 [11] HSIN K Y, GHOSH S, KITANO H. Combining machine learning systems and multiple docking simulation packages to improve docking prediction reliability for network pharmacology[J]. PLoS One, 2013, 8(12):e83922. doi: 10.1371/journal.pone.0083922 [12] WOOD L D, CANTO M I, JAFFEE E M, et al. Pancreatic cancer: pathogenesis, screening, diagnosis, and treatment[J]. Gastroenterology, 2022, 163(2): 386-402. [13] 刘鲁明. 中西医结合治疗胰腺癌的机遇与挑战[J]. 中国中西医结合杂志, 2019, 39(1):18-20. [14] 徐光星, 何若苹. 国医大师何任学术思想浅析: 基于不同主症的胰腺癌辨治经验[J]. 浙江中医药大学学报, 2019, 43(10):1019-1023,1029. [15] 董家潇, 金永生, 曹莺. 黄芩素抗肿瘤作用及其机制研究新进展[J]. 药学实践杂志, 2021, 39(1):9-12,43. [16] TAKAHASHI H, CHEN M C, PHAM H, et al. Baicalein, a component of Scutellaria baicalensis, induces apoptosis by Mcl-1 down-regulation in human pancreatic cancer cells[J]. Biochim Biophys Acta, 2011, 1813(8):1465-1474. doi: 10.1016/j.bbamcr.2011.05.003 [17] PU W L, LUO Y Y, BAI R Y, et al. Baicalein inhibits acinar-to-ductal metaplasia of pancreatic acinal cell AR42J via improving the inflammatory microenvironment[J]. J Cell Physiol, 2018, 233(8):5747-5755. doi: 10.1002/jcp.26293 [18] O’CALLAGHAN Y C, FOLEY D A, O’CONNELL N M, et al. Cytotoxic and apoptotic effects of the oxidized derivatives of stigmasterol in the U937 human monocytic cell line[J]. J Agric Food Chem, 2010, 58(19):10793-10798. doi: 10.1021/jf1023017 [19] 曹张琦. β-谷甾醇协同吉西他滨通过诱导凋亡和抑制上皮间质转化的抗胰腺癌作用研究[D]. 兰州: 兰州大学, 2019. [20] MA R, ZHANG Z H, XU J, et al. Poricoic acid A induces apoptosis and autophagy in ovarian cancer via modulating the mTOR/p70s6k signaling axis[J]. Braz J Med Biol Res, 2021, 54(12):e11183. doi: 10.1590/1414-431x2021e11183 [21] ZHANG L J, YIN M Z, FENG X, et al. Anti-inflammatory activity of four triterpenoids isolated from poriae cutis[J]. Foods, 2021, 10(12):3155. doi: 10.3390/foods10123155 [22] 陆家佳. 白术挥发性成分GC-MS分析及对五种肿瘤细胞抑制活性研究[J]. 海峡药学, 2016, 28(6):28-31. [23] ABULA Y, SU Y T, TUNIYAZI D, et al. Desmoglein 3 contributes to tumorigenicity of pancreatic ductal adenocarcinoma through activating Src–FAK signaling[J]. Animal Cells Syst, 2021, 25(3):195-202. doi: 10.1080/19768354.2021.1943707 [24] ABRAMS S L, DUDA P, AKULA S M, et al. Effects of the mutant TP53 reactivator APR-246 on therapeutic sensitivity of pancreatic cancer cells in the presence and absence of WT-TP53[J]. Cells, 2022, 11(5):794. doi: 10.3390/cells11050794 [25] SAHU N, CHAN E, CHU F, et al. Cotargeting of MEK and PDGFR/STAT3 pathways to treat pancreatic ductal adenocarcinoma[J]. Mol Cancer Ther, 2017, 16(9):1729-1738. doi: 10.1158/1535-7163.MCT-17-0009 [26] TOMER B, KEREN M L, SHANI J, et al. R269C variant of ESR1: high prevalence and differential function in a subset of pancreatic cancers[J]. BMC Cancer, 2020, 20(1):531. doi: 10.1186/s12885-020-07005-x [27] MARIA K, LI R X, MILLS GORDON B, et al. Mechanical stress signaling in pancreatic cancer cells triggers p38 MAPK- and JNK-dependent cytoskeleton remodeling and promotes cell migration via Rac1/Cdc42/Myosin II[J]. Mol Cancer Res, 2022, 20(3):485-497. doi: 10.1158/1541-7786.MCR-21-0266 [28] LESINA M, WÖRMANN S M, MORTON J, et al. RelA regulates CXCL1/CXCR2-dependent oncogene-induced senescence in murine kras-driven pancreatic carcinogenesis[J]. J Clin Investig, 2016, 126(8):2919-2932. doi: 10.1172/JCI86477 [29] LIU S S, ZHANG J F, YIN L Y, et al. The lncRNA RUNX1-IT1 regulates C-FOS transcription by interacting with RUNX1 in the process of pancreatic cancer proliferation, migration and invasion[J]. Cell Death Dis, 2020, 11(6):412. doi: 10.1038/s41419-020-2617-7 [30] MASSIHNIA D, AVAN A, FUNEL N, et al. Phospho-Akt overexpression is prognostic and can be used to tailor the synergistic interaction of Akt inhibitors with gemcitabine in pancreatic cancer[J]. J Hematol Oncol, 2017, 10(1):1-17. doi: 10.1186/s13045-016-0379-6 [31] TIWARI A, TASHIRO K, DIXIT A, et al. Loss of HIF1A from pancreatic cancer cells increases expression of PPP1R1B and degradation of p53 to promote invasion and metastasis[J]. Gastroenterology, 2020, 159(5): 1882-1897. [32] ZHANG J H, LAI F J, CHEN H, et al. Involvement of the phosphoinositide 3-kinase/Akt pathway in apoptosis induced by capsaicin in the human pancreatic cancer cell line PANC-1[J]. Oncol Lett, 2013, 5(1):43-48. doi: 10.3892/ol.2012.991 [33] LI M Y, TANG D D, YANG T, et al. Apoptosis triggering, an important way for natural products from herbal medicines to treat pancreatic cancers[J]. Front Pharmacol, 2022, 12:796300. doi: 10.3389/fphar.2021.796300 [34] KUMAGAI S, KOYAMA S, NISHIKAWA H. Antitumour immunity regulated by aberrant ERBB family signalling[J]. Nat Rev Cancer, 2021, 21(3):181-197. doi: 10.1038/s41568-020-00322-0 [35] CAI D X, CHEN C J, SU Y X, et al. LRG1 in pancreatic cancer cells promotes inflammatory factor synthesis and the angiogenesis of HUVECs by activating VEGFR signaling[J]. J Gastrointest Oncol, 2022, 13(1):400-412. doi: 10.21037/jgo-21-910 [36] VOUTSADAKIS I A. Mutations of p53 associated with pancreatic cancer and therapeutic implications[J]. Ann Hepatobiliary Pancreat Surg, 2021, 25(3):315-327. doi: 10.14701/ahbps.2021.25.3.315 [37] QIU W L, KUO C Y, TIAN Y, et al. Dual roles of the activin signaling pathway in pancreatic cancer[J]. Biomedicines, 2021, 9(7):821. doi: 10.3390/biomedicines9070821 -





 下载:
下载: