-
近年来,侵袭性真菌感染(IFD)的发病率和病死率逐年增高,临床上常见的侵袭性真菌主要有以念珠菌为主的酵母样真菌和以曲霉为主的丝状真菌。而念珠菌引起的IFD的总发病率达0.03%~0.50%,病死率可达35%~80%[1],白念珠菌(Candida albicans)是侵袭性真菌感染中最常见的致病真菌,约占40.1%[2]。尽管目前已研发出有效的抗真菌药物可供临床治疗,但仍存在着耐药性、价格昂贵、毒性大等问题亟需解决[3]。随着抗真菌药物经年累月使用,耐药性问题越发突出。唑类药物是临床常用的抗真菌药物,疗效好、毒性低,但因应用历史较长,临床上对其耐药的真菌越来越多[4]。目前,临床可选择的药物数量有限,解决真菌对药物的耐药性问题便成为一个必须攻克的难关。联合用药是一种有效的克服药物耐药性的方法,两者的协同作用不仅可以克服药物的耐药性,还可以增强原有药物的抗真菌作用[4]。
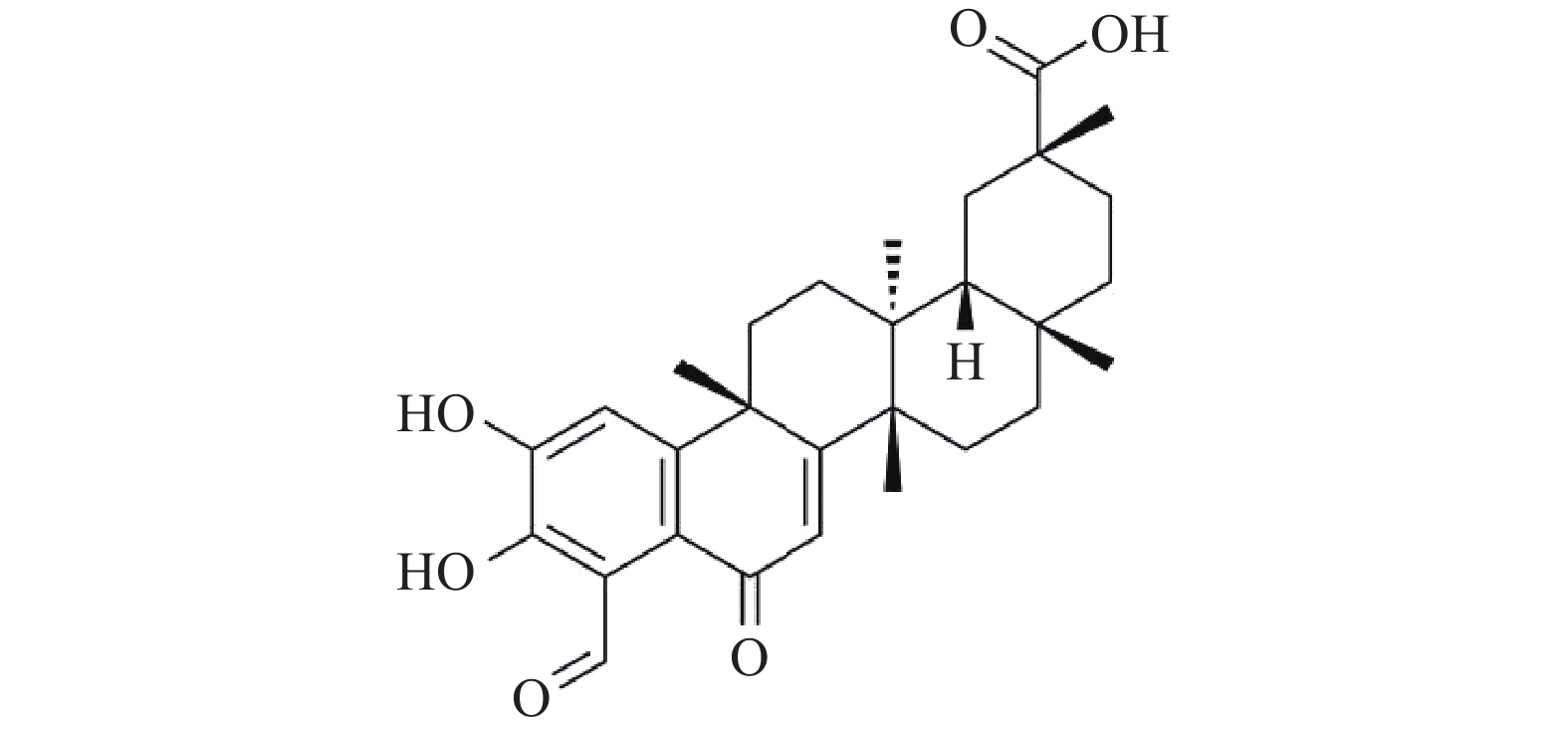
去甲泽拉木醛(DMZ)是从雷公藤根皮中提取的三萜类单体化合物,是雷公藤中含量较高的单体成分,其分子式是C29H36O6(图1)。DMZ具有抗炎、抗癌、免疫调节、抗生育、雌激素代谢调节等药理活性[5],但其在抗真菌方面的研究尚未见报道。本研究发现,DMZ具有良好的广谱抗真菌活性,并且与氟康唑联合使用具有协同抗耐药真菌作用。
-
白念珠菌实验株SC5314来自美国Georgetown大学。白念珠菌(C. albicans)临床株103、7879、9161、10066、9296、10060、10061、7654、901、904、632,耳念珠菌(Candida auris)0029,克柔念珠菌(Candida krusei)62588、4996、10153,热带念珠菌(Candida tropicalis)8915、409,烟曲霉(Aspergillus fumigatus)7544,近平滑念珠菌(Candida parapsilosis)22019、90018,须毛癣菌(Trichophyton mentagrophytes)T5a、T5b由海军军医大学第二附属医院提供。小鼠胚胎成纤维细胞(NIH/3T3)来自中国科学院典型培养物保藏委员会细胞库。
-
DMZ购自陶术生物有限公司;氟康唑(FLC)购自Macklin公司;二甲基亚砜(DMSO)购自国药集团化学试剂有限公司。
-
YPD培养液:酵母浸膏10.0 g,蛋白胨20.0 g。D-葡萄糖20.0 g,加超纯水800 ml溶解,再以超纯水定容至1 000 ml,经高压蒸汽灭菌(121°C,15 min),自然冷却至室温后于4°C保存备用。
PBS缓冲溶液:NaCl 8.0 g,Na2HPO4·12H2O 3.57 g,KCl 0.2 g,KH2PO4 0.24 g,用三蒸水溶解并定容至1 000 ml,高温高压灭菌(121°C,15 min)后室温保存。
RPMI 1640培养基:RPMI 1640(Gibco BRL) 10.0 g,NaHCO3 2.0 g,3-吗啉丙磺酸(MOPS)34.5 g,NaOH 2.7 g,以超纯水定容至1 000 ml,经0.22 μm微孔滤膜抽滤灭菌后于4°C保存备用。
含药SDA培养基:蛋白胨10 g,D-葡萄糖40 g,琼脂20 g,加超纯水800 ml溶解,调整PH为7.0,以超纯水定容至1 000 ml,高压蒸汽灭菌(121 ℃,15 min)。待冷却至50~55 ℃,将适当药物溶液加入液体状态的SDA培养液中,混合均匀,分倒入9 mm细菌培养皿中,自然冷却凝固后于4 ℃保存备用。
DMEM完全培养基:45 ml DMEM高糖培养基中加入5 ml小牛血清,充分混匀后置于4 ℃保存。
-
生物安全柜(BSC-1004II A2,苏州安泰空气技术有限公司);生物显微镜(LW100T,北京测维光电技术有限公司);霉菌培养箱(MJ-150-I,上海一恒科学仪器有限公司);酶标仪(Thermo Multiskan FC,赛默飞世尔上海仪器有限公司)。
-
于−80°C低温保存箱中取出冻存的待测菌株,吸取10 μl菌液加入装有1 ml YPD培养液的15 ml玻璃摇菌管中,置于30°C气浴恒温振荡培养箱中,200 r/min振荡培养。24 h后从YPD菌悬液中吸取10 μl加入到新的1 ml YPD培养液中,继续30°C振荡培养16 h,活化完成,此时的真菌即处于指数生长末期。
取处于指数生长末期的待测菌株置于1.5 ml离心管中,离心(3 000 r/min,1 min),吸弃上清液,用1 ml PBS缓冲溶液洗涤菌株,离心(3 000 r/min,1 min),吸弃上清液,重复洗涤3次。取10 μl真菌原液稀释100倍后,使用血细胞计数板于生物显微镜下计数,计算出真菌原液的菌浓度,然后用RPMI1640培养液稀释配制成实验所需浓度的菌悬液。
-
根据CLSI出版的微量液基稀释法实验手册M27-A3所推荐的标准实验方法来测定[6]。取处于指数生长末期的待测菌株,用RPMI 1640培养基稀释配置成1×103 CFU/ml的菌悬液。取96孔细胞培养板,于第1列加入100 μl RPMI 1640培养基作为空白对照;第2列加入200 μl菌液,3~12列加入100 μl菌液,于第2列每孔分别加入6.4 μl药液,依次2倍倍比稀释至11列,最高药物浓度为64 g/L,12号孔菌液作为生长对照。96孔板置于30°C恒温培养箱中静置培养(白念珠菌24 h,烟曲霉48 h),之后用酶标仪测定630 nm处A值。与生长对照孔比较,抑制80%以上真菌生长对应的最低药物浓度即为MIC80。实验至少重复3次,取较为稳定的结果作为最终的测定结果。
-
取处于指数生长末期的待测菌株,用RPMI 1640培养基稀释配置成1×103 CFU/ml的菌悬液。将配制好的菌悬液涡旋均匀后,转移至6孔细胞培养板中,第1孔加入2.6 ml,第2~6孔每孔加入1.3 ml。取83.2 μl待测化合物溶液加入第1孔中使其终浓度为64 g/L,依次进行倍半稀释,使得第1~6孔中的化合物终浓度分别为64、32、16、8、4、2 g/L。将在6孔细胞培养板中配制好的含药菌悬液按化合物浓度从高到低(64→2 g/L)依次对应转移至96孔细胞培养板的A~F行中,第1列每孔加入200 μl,第2~10列每孔加入100 μl。第11列的A11~F11孔和第G行的G1~G10孔中加入未加药的空白菌悬液100 μl/孔。将配制好的FLC溶液分别加入第1列的A1~G1孔中,每孔加入6.4 μl使其终浓度为64 g/L。各列从左到右依次进行倍半稀释,使得第1~9列的FLC终浓度分别为64→0.25 g/L。96孔细胞培养板第11列的A11~F11孔中为未加任何药物作用的菌悬液,作为阴性对照组。第12列和H行各孔中分别加入100 μl的RPMI 1640培养液,作为空白对照组。将96孔细胞培养板置于30°C恒温培养箱中静置培养,48 h后使用酶标仪测定每孔真菌在630 nm处的光密度值A630。以阴性对照组的A630值为100%,利用公式计算协同指数FICI。FICI的计算公式为:FICI=MIC80 化合物(联用)/MIC80 化合物(单用)+MIC80 FLC(联用)/MIC80 FLC(单用)
-
取己洗涤的待测真菌,用PBS缓冲溶液稀释配制成实验所需浓度(1x106 CFU/ml)的菌悬液,吸取100 μl均匀涂布于含药的SDA培养基中(考察协同作用时培养基中应加入适宜浓度的DMZ)。在培养基中等距放置7枚灭菌纸片,向纸片中滴加药液,使纸片载药量分别为0、2、4、8、16、32 μg(载药量视实验情况而定),置于30°C恒温培养箱中静置培养48 h,观察真菌生长情况并拍照记录[7]。
-
取小鼠胚胎成纤维细胞(NIH/3T3),胰酶消化后,离心收集细胞并用DMEM完全培养基重悬。血细胞计数板计数后调整细胞密度至5x104个/ml。取96孔板划分出实验区、对照区、无细胞区。实验区、对照区每孔加入100 μl细胞液,无细胞区加100 μl DMEM完全培养基,注意尽量使孔内细胞分布均匀。细胞于37°C培养箱中贴壁过夜。第2天,取无菌EP管,用DMEM完全培养基对待测药物进行倍比稀释,随后取出96孔板,吸弃培养基。每孔加100 μl含不同浓度药物的DMEM完全培养基,37°C继续孵育24 h。取出96孔板,吸弃培养基,每孔加110 μl含CCK-8的DMEM完全培养基(CCK-8∶DMEM完全培养基=1∶10),37°C孵育2 h。测量各孔的A450。处理结果时用实验区、对照区A值减去无细胞区的A值,以对照区细胞活力为1.0,计算各组细胞活力。重复3次实验,用GraphPad作图并统计分析。
-
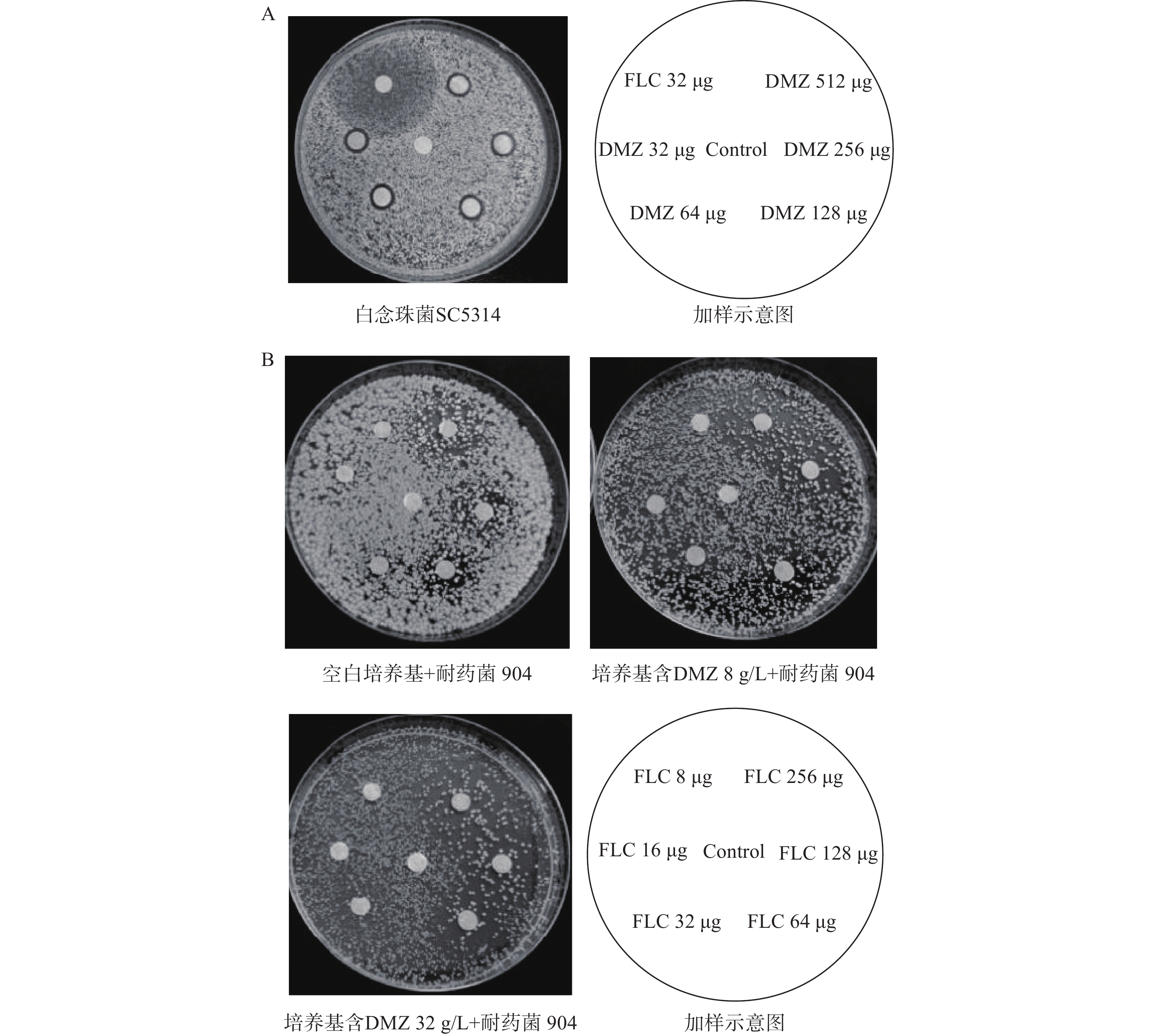
测定DMZ对临床中常见的病原真菌的抗菌活性,共计23株。实验结果显示,DMZ对所试真菌都有一定的抑制效果(表1)。对白念珠菌(含11株临床株)的MIC范围为4~16 g/L,值得注意的是,其中有3株临床菌对FLC显示出较强的耐药性(901、904、632),DMZ对它们的MIC稳定在8 g/L,表现出与敏感菌类似的抗菌活性。对FLC天然耐药的耳念珠菌与克柔念珠菌,DMZ也表现出较好的抗真菌活性,MIC分别为32 g/L、2~8 g/L。对其他的念珠菌如热带念珠菌、近平滑念珠菌也有较强的抗菌活性,MIC为4~16 g/L,对丝状菌如烟曲霉菌、须毛癣菌有较好的抗菌活性,MIC分别为32 g/L和2 g/L。以上结果表明,DMZ对常见的病原真菌均表现出较好的抗菌活性,抗菌谱较广。
表 1 DMZ与FLC单独应用于23株真菌的MIC值
菌种 菌株 MIC80(g/L) FLC DMZ 白念珠菌 FLC敏感菌株 SC5314 0.25 8 7654 0.25 4 103 2 16 9161 0.25 4 10066 2 8 10060 0.25 4 10061 0.25 4 7879 1 8 9296 0.25 8 FLC耐药菌株 901 64 8 904 64 8 632 64 8 耳念珠菌 0029 64 32 热带念珠菌 8915 16 8 409 1 16 烟曲霉 7544 64 32 近平滑念珠菌 22019 2 4 90018 1 8 克柔念珠菌 4996 16 8 62588 16 8 10153 32 2 须毛癣菌 T5b 32 2 T5a 32 2 -
选取3株对FLC耐药的白念珠菌901、904和632,采用棋盘微量液基稀释法考察DMZ与FLC联合使用是否存在协同作用。结果显示,在与2 g/L DMZ联合使用的情况下,FLC对上述3株耐药菌的有效浓度从64 g/L降低至0.25 g/L(表2),是原抗菌浓度的1/256,两药联合使用的FICI为0.129~0.254,表明DMZ与FLC具有较强的协同抗耐药菌作用。
表 2 DMZ与FLC的协同抗氟康唑耐药白念珠菌的作用
菌株 MIC80(g/L) 协同指数 单用FLC 单用DMZ 联用FLC 联用DMZ 901 64 8 0.25 2 0.129 904 64 16 0.25 2 0.254 632 64 8 0.25 2 0.254 应用琼脂平板扩散实验更直观地验证了DMZ与FLC的协同抗真菌作用。结果显示,在单用DMZ的情况下,不同浓度的DMZ均产生了明显的抑菌圈,但抑菌圈直径的大小并没有显示出剂量依赖性;单用FLC能产生较大的抑菌圈,但抑菌作用较弱,抑菌圈内部仍有少量真菌菌落生长(图2A)。进一步用抑菌圈实验验证两药联用对耐药菌的抗真菌效果。结果显示,在含有一定浓度DMZ的琼脂中,真菌长得稀薄,DMZ的浓度越高,真菌长得越稀薄,表现出剂量依赖性。在含有不同浓度FLC的纸片周围都出现了直径较大的抑菌圈(图2B),抑菌圈的大小与FLC的含量呈现出明显的剂量依赖关系。上述实验结果表明,DMZ与FLC联合使用具有协同抗耐药菌的作用。
-
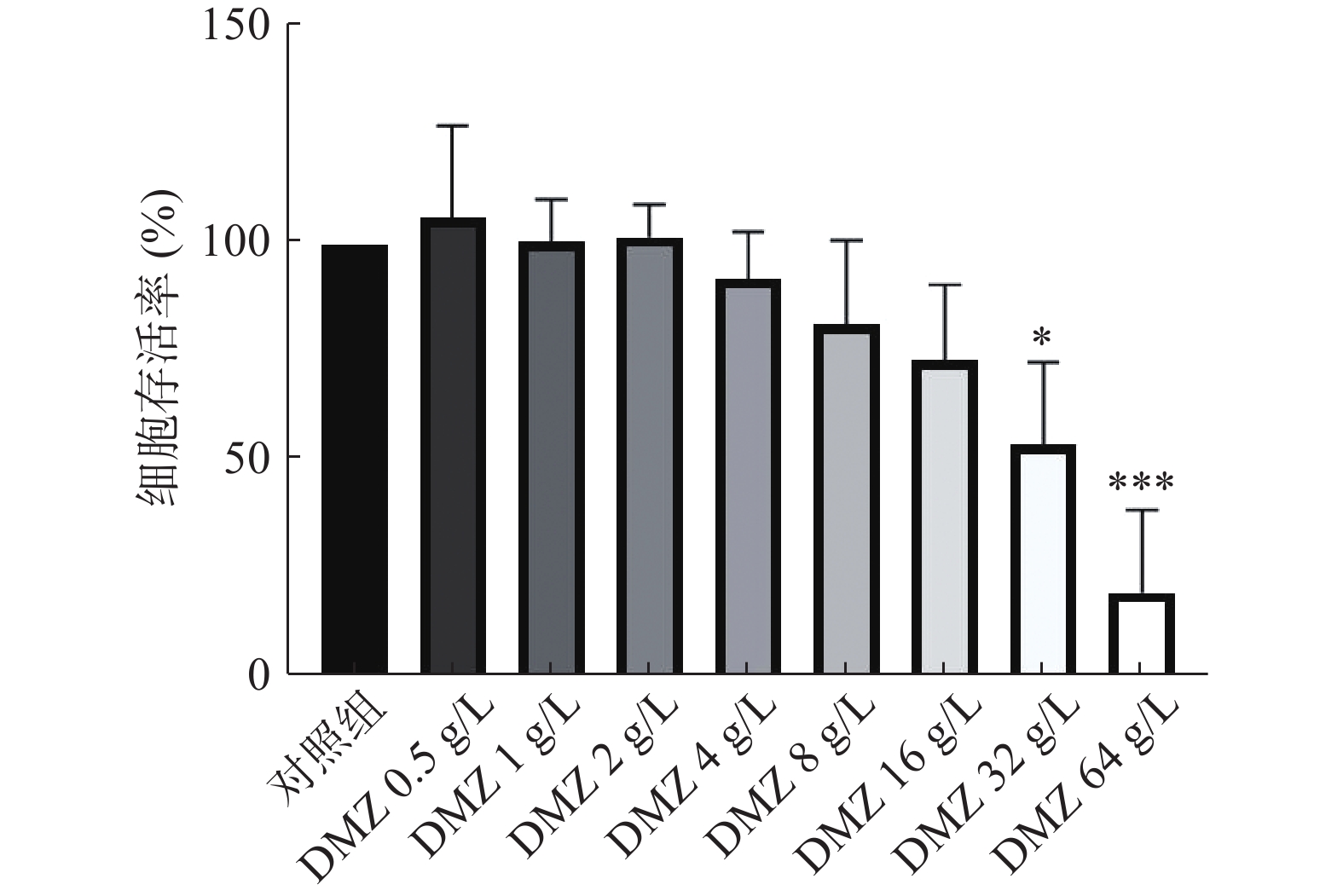
利用CCK-8法考察DMZ对小鼠胚胎成纤维细胞的毒性。CCK-8试剂中含有WST-8,在电子载体的作用下被细胞中的脱氢酶还原为具有高度水溶性的黄色甲瓒产物,生成的甲瓒物的数量与活细胞的数量成正比。因此,可利用这一特性考察DMZ对哺乳动物细胞的毒性。结果显示,当DMZ浓度为32 g/L时,小鼠胚胎成纤维细胞的存活率下降到54%,显示出一定毒性,而低于32 g/L时DMZ的毒性较低,没有表现出显著的细胞毒作用(图3)。实验结果通过单因素方差分析(ANOVA),然后进行事后Dunnett-t检验,标准偏差基于3次独立实验。
-
中药作为我国传统药物,在抗真菌病方面有极佳的待研发前景,从中草药中提取出疗效佳、毒副作用小、不易耐药、价格低廉的新型抗真菌药物已成为目前的研究热点[8]。DMZ是从雷公藤树皮中分离提取的酚性去甲基三萜化合物,是雷公藤中含量较高的单体,是一种结构明确、易分离的天然产物[9]。本研究考察了DMZ的抗真菌作用和协同FLC抗真菌的作用。
IFD每年的发病率为每6万人中约有100例[10]。侵袭性念珠菌感染(IC)在IFD中占主要地位,约有80%的IFD是IC引起的[11]。其中,白念珠菌是导致IC的最主要的念珠菌种类[12],但近年来,其他念珠菌的占比在逐渐升高[13]。DMZ的抗菌谱很广,对常见的念珠菌如白念珠菌、热带念珠菌、近平滑念珠菌、克柔念珠菌等均有较好的抗菌活性,MIC在2~16 g/L,对其他IFD中常见的病原菌如烟曲霉菌也有很好的抗菌活性。耳念珠菌是近年来新兴的一种念珠菌,因其多重耐药性而受到关注,又被称为“超级真菌”,不到10年的时间里已在全球范围内传播,且发病率、病死率高[14]。有研究表明[15],耳念珠菌中有高达90%的分离株对氟康唑产生耐药。DMZ对耳念珠菌也有一定的抗菌活性(MIC值为32 g/L),为研发抗耳念珠菌的药物提供了新的选择。
FLC是一种典型的唑类抗真菌药物,已在临床上使用近30年。鉴于FLC的抗真菌作用强且安全性高,长期以来都是一线抗真菌药物。然而,唑类药物的广泛使用导致了真菌对其有严重的耐药性,从而降低了治疗效果。其耐药机制主要包括:药物靶点的突变、甾醇生物合成途径的变化以及转录因子的功能突变导致麦角甾醇生物合成基因和多药外排泵的组成性上调等[16]。DMZ对氟康唑耐药的念珠菌有类似于敏感菌的抗菌活性,这表明DMZ的抗菌作用机制可能与FLC不同,有潜力用于抗耐药真菌。已有研究报道,DMZ通过激活外源性细胞凋亡在体外抑制癌细胞的细胞生长,并降低了癌细胞中的线粒体膜电位[17],这将为DMZ的抗真菌机制提供研究方向。
药物联合使用是应对耐药菌的一种常用策略。DMZ与FLC具有较强的协同抗菌效果,能有效抑制耐药菌的生长。两药联用可以将FLC的有效浓度降低数百倍,DMZ的疗效也增加数倍。细胞毒性实验结果表明,DMZ在抗真菌作用浓度范围时(特别是与FLC联合使用时),毒性相对较低。两药联合使用时,DMZ起效浓度仅有细胞毒浓度的几十分之一。在增加药物疗效的同时,降低了药物用量,从而减少了毒副作用。另外,DMZ与FLC作为两种不同作用机制的抗真菌药物联合使用,还能起到预防真菌耐药的作用。总之,DMZ作为一种广谱、高效的抗真菌天然产物,具有较强的与FLC协同抗真菌能力,有潜力成为抗真菌候选先导化合物。同时,还有潜力成为一种增效剂,与FLC联合使用应对耐药真菌。
Study on antifungal effect of demethylzelamaldehyde in vitro
-
摘要:
目的 研究去甲泽拉木醛的体外抗真菌作用。 方法 采用微量液基稀释法测定去甲泽拉木醛与氟康唑单独应用于23株真菌的最低抑菌浓度(MIC),以棋盘式微量液基稀释法测定两药联合抗耐药白念珠菌的协同指数(FICI),判断两药联合抗菌效果;并通过纸片扩散实验直观验证两药联合的协同作用。最后通过CCK-8法测定去甲泽拉木醛的细胞毒性。 结果 去甲泽拉木醛单用时呈现广谱的抗真菌作用,MIC范围为4~32 g/L。两药联用时,可将氟康唑的有效浓度从大于64 g/L降至0.25 g/L,FICI值介于0.129~0.254之间,两药表现出协同抗耐药白念珠菌作用。CCK-8结果显示,去甲泽拉木醛在高于MIC值4倍浓度下才展示出细胞毒性。 结论 去甲泽拉木醛表现出较好的抗真菌作用,与氟康唑联合时有很好的协同效果,且毒性较低。 Abstract:Objective To study the antifungal effect of demethylzelamaldehyde in vitro. Methods The minimum inhibitory concentrations (MIC) of demethylzeylasteral and fluconazole against 23 fungal strains were determined by micro liquid dilution method. The synergistic index (FICI) of the two drugs was determined using a checkerboard micro liquid dilution method. The synergistic effect of the combination of the two drugs was visually verified by paper diffusion experiments. Finally, the cytotoxicity of demethylzelamaldehyde was determined by CCK-8 method. Results Demethylzelamaldehyde showed a broad spectrum of antifungal activity when used alone, with MICs ranging from 4 g/L to 32 g/L. When combined with fluconazole, the effective concentration of fluconazole could be reduced from over 64 g/L to 0.25 g/L, with FICI values ranging from 0.129 to 0.254, indicating the synergistic effect of the two drugs. The CCK-8 results showed that demethylzeylasteral exhibited cytotoxicity only at concentrations four times higher than the MIC value. Conclusion Demethylzelamaldehyde exhibited good antifungal effect and synergistic effect with fluconazole, and its toxicity was low. -
Key words:
- Candida albicans /
- demethylzeylasteral /
- fluconazole /
- synergistic effects /
- drug resistance
-
在正常条件下,大部分肝细胞处于静止状态(G0期),通常很少进入有丝分裂期。一旦肝细胞受到手术切除和药物等应激的刺激,它们会迅速对促分裂原产生反应,过渡到有丝分裂期,并开始增殖[1-4]。肝细胞增殖不仅是肝脏自我修复和再生的基础,也是应对慢性肝炎、肝硬化以及药物性肝损伤(DILI)等多种损害的重要机制。研究表明,肝脏出现病理性损伤后产生多种肝细胞因子,例如纤维蛋白原样蛋白(FGL1)、Hepassocin、肝细胞生长因子(HGF)等,在促进肝细胞增殖方面发挥重要作用[5-8]。例如,FGL1通过激活细胞增殖相关的信号通路促进肝细胞的再生,从而加速肝脏的修复[9]。此外,Hepassocin通过自分泌机制促进肝细胞生长[6]。这些研究提供了肝脏疾病治疗的新思路,尤其是调控这些肝细胞因子来加速肝功能的恢复。
Orosomucoid-1(ORM1),也称为α-1-酸性糖蛋白1(AGP1),作为一个已知的肝细胞因子[10],是一种主要由肝脏合成分泌的急性期蛋白,在应激条件下(如组织损伤和炎症)显著升高,具有调控细胞外基质(ECM)、调节糖代谢、维持血管通透性等重要的生物学功能[10-12]。此外,ORM1在结肠腺癌细胞、肝细胞、免疫细胞等多种细胞上,表现出促进增殖的作用[13-15]。但ORM1调控肝细胞增殖的具体作用机制尚不完全明确,有待进一步研究。
为进一步探究ORM1在肝细胞增殖中的具体作用及机制,本研究首先在两种肝细胞系上验证了ORM1促进肝细胞增殖,并通过对ORM1敲除小鼠的肝脏组织测序,挖掘ORM1调控肝细胞增殖的可能机制。本研究旨在揭示ORM1促进肝细胞增殖的潜在功能和机制,为肝脏损伤修复及相关疾病的治疗提供新的分子靶点和理论依据。
1. 材料与方法
1.1 试剂
α1-酸性糖蛋白(美国 Sigma-Aldrich 公司)、CCK8试剂盒(Adamas life)、Lipofectamine 3000试剂(Thermo Fisher Scientific)。
1.2 实验细胞
小鼠肝癌细胞系Hepa1-6,购自中国科学院细胞库。培养液配方:DMEM、10%FBS、1%双抗生素。培养条件:5%CO2、37 ℃恒温孵育箱。人肝癌细胞系HepG2,购自武汉普诺赛生命科技有限公司。培养液配方:MEM(含NEAA)、10%FBS、1%双抗生素。培养条件:5%CO2、37 ℃恒温孵育箱。
1.3 CCK8
细胞接种于96孔板,密度约104/孔,每组复孔为9;ORM1过表达、干扰或人源ORM给药(10、50、100 μg/ml)处理相应时间后,弃去培养基,在细胞贴壁后,使用无血清培养基处理细胞,培养相应时间后,加入CCK8试剂,吸光度测定(Epoch BioTeK酶标检测仪)450 nm处的A值,根据不同组之间的A值计算组间差异。
1.4 细胞瞬时转染
通过LipofectamineTM
3000 将ORM1过表达质粒(序列见NM_008768.2)或siRNA转染进细胞内,以实现过表达或干扰目标基因的目的。当细胞密度达到50%~70%时,进行过表达质粒的瞬时转染实验;当细胞密度达到30%~50%时,进行siRNA的瞬时转染实验。吸取舍弃原培养基后用1×PBS轻柔洗涤细胞1~2次,根据转染条件配制好转染试剂,随后将配置好含有过表达质粒(或siRNA)的DMEM培养基加入至细胞培养基中用于细胞继续培养,最后置于细胞培养箱中孵育24 h(若为转染siRNA,则孵育48 h)即可完成细胞瞬时转染试验。siRNA序列及转染试剂配制方法见表1、表2。表 1 ORM1 siRNA序列siRNA名称 siRNA序列(5'→3') si-ORM1 CCACCAACUUGAUAAACGATT 表 2 96孔培养板转染条件培养皿 Opti-MEM (μl) Lipo3000 (μl) DNA转染 RNA转染 DNA (ng) P3000 (μl) RNA (pmol) 96孔板 2×10 0.3 100 0.2 20 1.5 RNA-seq及差异基因富集分析
使用ORM1基因敲除(KO)小鼠和对应的野生型(WT)小鼠(均为C57BL/6背景,n=6)。在小鼠24周龄时采集肝脏组织,液氮速冻并存储于−80°C。RNA-seq委托上海欧易生物公司进行,差异基因分析通过DESeq完成,筛选标准为FoldChange>1.5或<0.66,且P<0.05。
差异基因富集分析通过DAVID进行,进行Kyoto Encyclopedia of Genes and Genomes (KEGG)富集分析。KEGG分析用于揭示差异基因在代谢通路中的富集情况。富集分析筛选标准为P<0.05。
1.6 数据统计与分析
实验数据采用GraphPad Prism 9.0软件进行统计与分析。单因素两组之间相互比较,采用双尾非配对t检验(Student’t)检验分析;单因素多组之间相互比较,采用单向方差分析(One-way ANOVA)检验,组间均值两两比较采用Dunnett's multiple comparisons test。实验结果均采用“均数±标准误(Mean±SE)”表示。以P<0.05认为差异具有统计学意义。
2. 结果
2.1 ORM1在小鼠肝切除术后表达增加
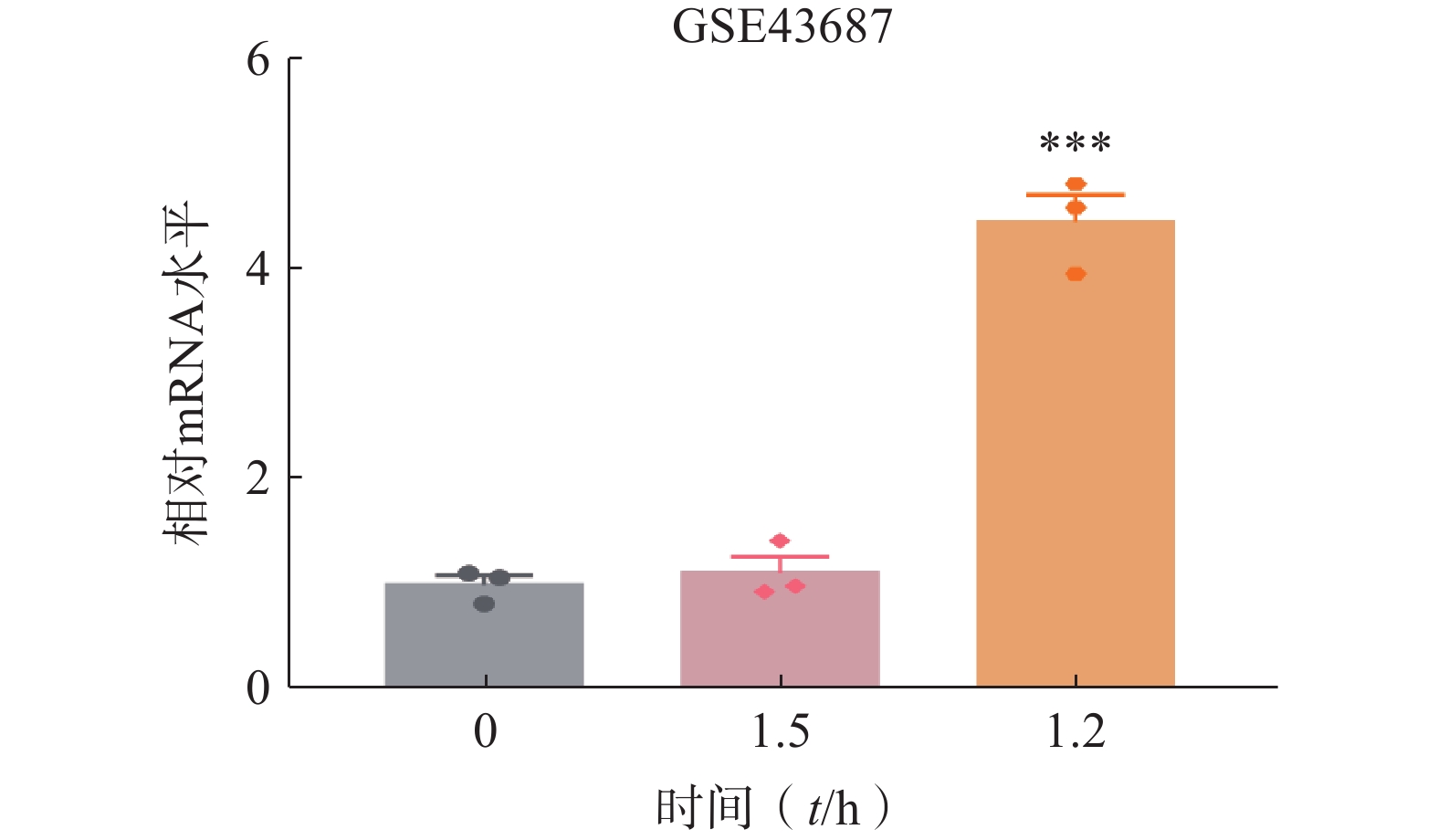
肝脏组织在肝切除术后会进入肝细胞快速增殖状态[16]。通过检索GEO数据库,选取C57BL/6小鼠在2/3肝脏部分切除术(PH)后数据(GSE43687)进行分析。结果显示,肝脏组织中ORM1的表达在PH后1.5 h时无显著变化,在PH后12 h显著上升(图1)。这一结果提示ORM1可能参与肝脏再生过程。
2.2 ORM1促进小鼠和人肝细胞增殖
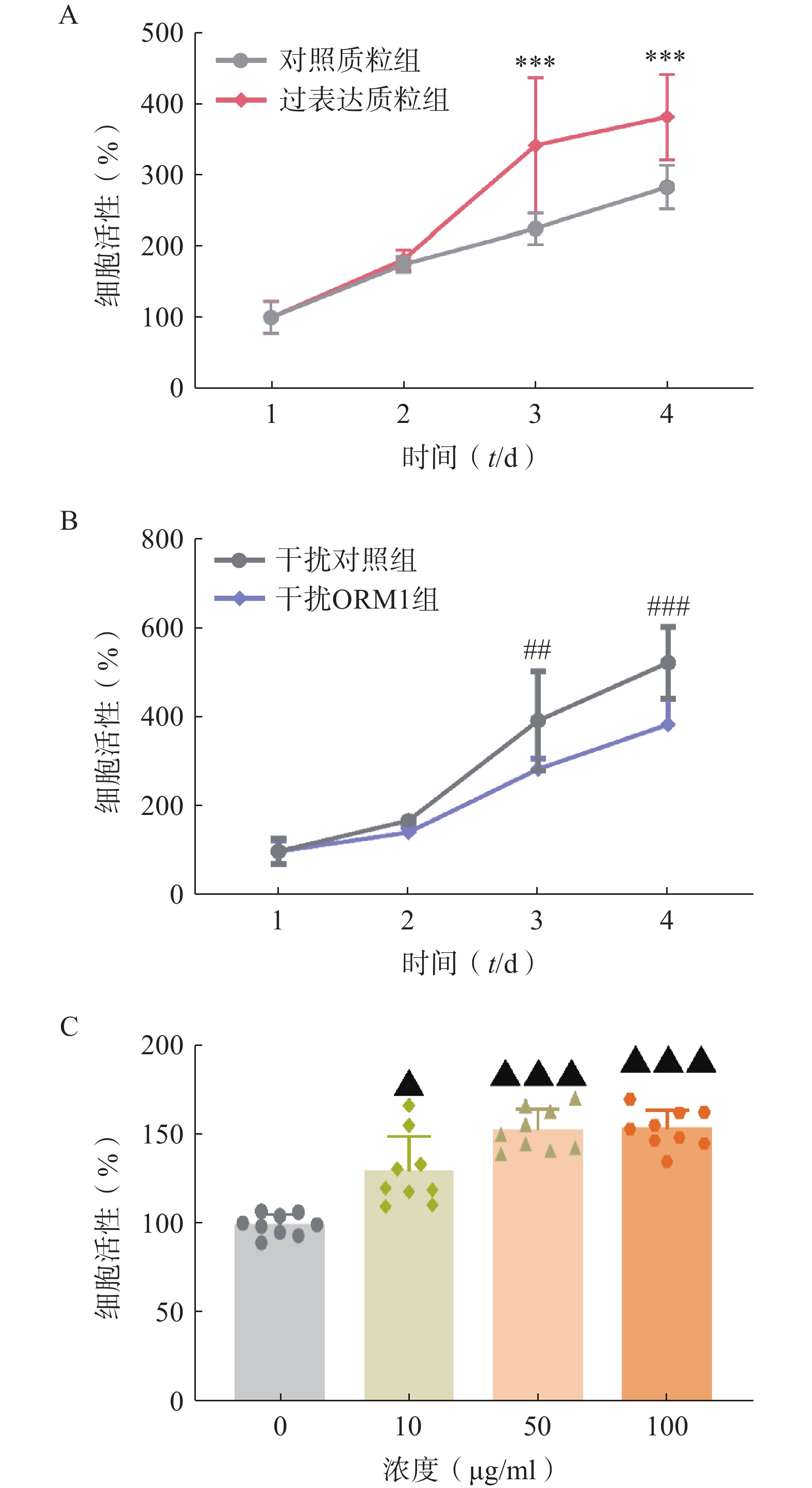
为验证ORM1对肝细胞增殖的影响,我们在小鼠和人的肝细胞系上进行了ORM1过表达、干扰或ORM外源性给药实验。在小鼠Hepa1-6肝癌细胞系过表达ORM1(pCMV-ORM1),与对照质粒组(pCMV)组相比,转染后第3、4天ORM1过表达质粒组的细胞增殖显著增加(图2A)。而干扰ORM1后细胞增殖能力呈现相反的结果(图2B)。人HepG2肝细胞上给予不同浓度外源性ORM,48 h后检测细胞增殖情况,可见随着ORM1浓度的增加,细胞增殖呈现显著上升(图2C)。上述结果表明ORM1对肝细胞增殖具有显著的促进作用。
2.3 ORM1基因敲除对肝脏细胞生物学功能及信号通路的影响
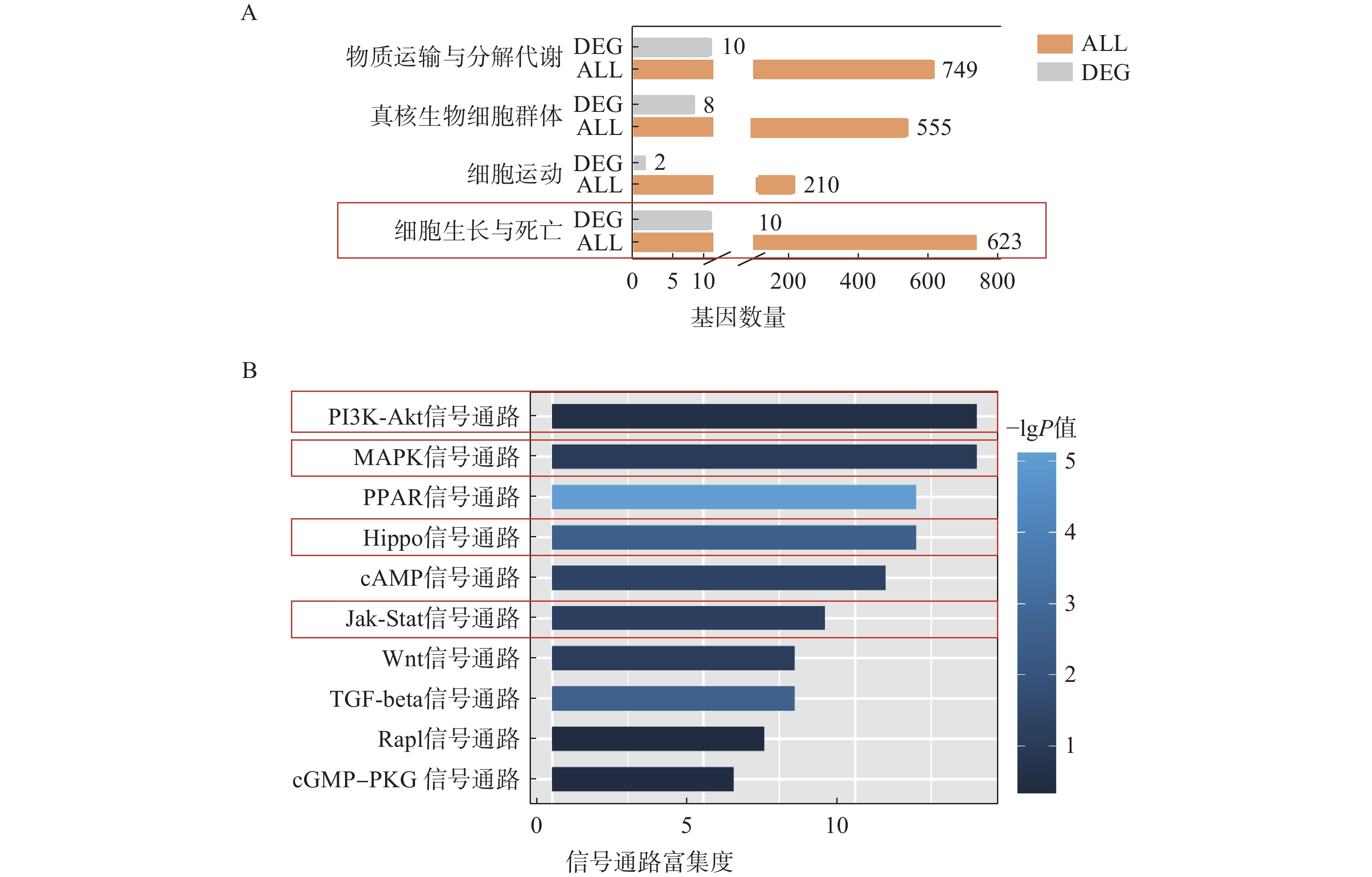
为了进一步探究ORM1基因敲除后对肝脏组织的影响,我们对ORM1基因敲除(KO)小鼠和野生型(WT)小鼠的肝脏组织进行了测序。KEGG富集分析表明,在ORM1基因敲除小鼠与野生型小鼠的比较中,差异表达基因被富集在“细胞生长与死亡”和“细胞运输与自噬”等通路中(图3A),提示ORM1缺失会引起细胞生长和死亡相关的通路相关改变。
进一步信号通路的富集分析显示,PI3K-Akt、MAPK、PPAR、Hippo、Jak-Stat等通路在差异基因表达分析中有显著富集(图3B),其中,PI3K-Akt、MAPK、Hippo、Jak-Stat通路据报道与细胞增殖高度相关[17-19]。这些结果提示,ORM1基因敲除可能影响细胞增殖关键通路,通过调控细胞生长、死亡相关的基因影响肝细胞增殖。
2.4 ORM1可能通过调控多条信号通路促进肝细胞增殖
为进一步明确ORM1在这些经典通路中的调控机制,我们重点分析了其中与细胞增殖相关的差异基因表达变化。在PI3K-Akt信号通路中,具有促增殖作用的Itgb8和Ntf3显著下调(图4A)。在MAPK信号通路中,同样具有促增殖作用的Map3k6在KO组中显著下调,而抑制细胞增殖作用的Gadd45a则显著上调,Hspa1b和Hspa2下调(图4B)。与之类似,Jak-Stat信号通路中的Il6ra和Lepr具有促增殖作用,其表达在KO组中也显著下调,而有抑制细胞增殖作用的Cish在KO组中的表达显著上调(图4C)。在Hippo信号通路中,具有促增殖作用的Tef7、Tead1、Ctgf在KO组中的表达显著下调(图4D)。这些结果表明,ORM1可能调控PI3K-Akt、MAPK、Jak-Stat和Hippo信号通路中的影响细胞增殖的多种关键信号分子影响肝细胞的增殖。
3. 讨论
本研究中,我们揭示了ORM1在肝细胞增殖中的潜在调控机制。首先,利用GEO数据库(GSE43687)分析,发现ORM1在小鼠2/3肝切除术后12h表达升高,提示ORM1可能参与肝脏再生。而在体外肝细胞系中,过表达ORM1或外源性给药ORM,可以促进肝细胞增殖;相反,干扰ORM1抑制的肝细胞的增殖,进一步验证了ORM1对肝细胞增殖的促进作用。此外,我们对ORM1基因敲除小鼠组学分析,发现PI3K-Akt、MAPK、Hippo、Jak-Stat等细胞增殖相关通路的多个信号分子在ORM1缺失时表现出显著变化,提示这些关键通路可能参与了ORM1对肝细胞增殖的调控。
在PI3K-AKT信号通路中,Ntf3(neurotrophin-3)主要通过与受体TrkC结合,促进细胞的存活、增殖和分化[20]。ORM1缺失后Ntf3的下调可能导致细胞存活和再生能力减弱。而Itgb8(整合素β8)和Lamc2(laminin subunit gamma-2)作用类似,均是通过与细胞外基质(ECM)蛋白(如纤连蛋白、胶原蛋白等)结合,介导细胞与其周围环境的相互作用,从而影响细胞的增殖和分化[21-22]。ORM1缺失后,Itgb8和Lamc2下调提示ECM重塑减弱,从而无法为新生肝细胞的重新附着与生长提供必要的微环境支持。
在MAPK信号通路中,Gadd45a(growth arrest and DNA damage-inducible alpha)是一种生长停滞和DNA损伤诱导因子,通过抑制细胞周期相关激酶(如CDK1和CDK2),阻止细胞从G1期或G2/M期进入下个阶段[23]。ORM1缺失后Gadd45a上调提示可能出现细胞周期停滞,从而抑制了肝细胞的增殖。Map3k6(mitogen-activated protein kinase 6)作为一种激酶,通过磷酸化MAPK激酶调控下游的信号分子和后续的细胞生物学反应,如细胞增殖、分化、存活、迁移和应激反应[24]。ORM1缺失后Map3k6下调可能导致MAPK通路激活减少。Hspa1b和Hspa2是热休克蛋白,在抑制凋亡通路主要通过抑制线粒体凋亡途径,caspase的活化以及调控JNK信号通路发挥作用;同时,Hspa1b和Hspa2通过清除活性氧(ROS)和稳定线粒体功能,发挥抗氧化应激损伤的作用,进而增加细胞存活。Hspa1b和Hspa2的下调提示ORM1缺失可能削弱细胞的抗氧化应激能力,从而影响肝细胞存活[26]。
此外,Jak-Stat3信号通路激活通过诱导与细胞增殖和抗凋亡相关的基因表达,如Cyclin D1和Bcl-2,从而促进细胞增殖、存活和组织修复[27]。而Cish(cytokine-inducible SH2-containing protein)是该通路一个重要的负反馈调节因子,通过抑制Jak-Stat信号的活化,调控细胞因子信号传导的强度和持续时间,发挥抑制细胞增殖和促进细胞凋亡的作用[28]。与之相反,Il6ra是IL-6受体的亚基,IL-6结合IL-6受体后激活Jak-Stat3信号通路,诱导与细胞存活、增殖和组织修复相关基因的表达[29]。此外,Lepr(leptin receptor)是瘦素(leptin)的主要受体,该受体激活后亦可激活下游Jak-Stat3信号通路[27]。特别是在肝脏中,Lepr信号能够促进肝细胞的再生和修复能力[30]。而ORM1敲除时,Cish上调,Il6ra、Lepr下调均表明JAK-STAT通路激活减少,从而导致细胞增殖减弱。
最后,在Hippo信号通路中,Tcf7在Hippo信号通路中扮演着重要的角色,其与细胞增殖的关系主要通过YAP/TAZ的激活来实现,并参与促进细胞增殖[31],Ctgf是一种与细胞外基质(ECM)相关的结合肝素的蛋白,能够直接与整合素结合。它由成纤维细胞合成,并能促进细胞的增殖和趋化[32],ORM1敲除导致Hippo通路中Tcf7和Ctgf表达下调,可能通过解除其对肝细胞增殖的抑制作用而促进细胞增殖。ORM1缺失还导致了该通路Tead1基因的下调,而Tead1作为YAP(yes-associated protein)和TAZ的下游效应器,与YAP/TAZ结合后在细胞核中调控靶基因Birc5、Cyr61、CTGF和Myc等的表达,进而促进细胞增殖、抑制细胞凋亡,并推动组织生长和再生[33]。
本研究阐释了ORM1可能通过调控PI3K-Akt、MAPK、Hippo、Jak-Stat等信号通路发挥促进肝细胞增殖的作用。提示ORM1可能通过影响肝细胞存活、ECM重塑等一系列复杂机制调节肝细胞增殖过程。未来研究应进一步探讨ORM1在这些信号通路中的具体调控机制,特别是在不同病理条件下如何影响肝细胞的增殖、凋亡以及组织修复,为肝脏疾病的治疗提供新的潜在靶点。
-
表 1 DMZ与FLC单独应用于23株真菌的MIC值
菌种 菌株 MIC80(g/L) FLC DMZ 白念珠菌 FLC敏感菌株 SC5314 0.25 8 7654 0.25 4 103 2 16 9161 0.25 4 10066 2 8 10060 0.25 4 10061 0.25 4 7879 1 8 9296 0.25 8 FLC耐药菌株 901 64 8 904 64 8 632 64 8 耳念珠菌 0029 64 32 热带念珠菌 8915 16 8 409 1 16 烟曲霉 7544 64 32 近平滑念珠菌 22019 2 4 90018 1 8 克柔念珠菌 4996 16 8 62588 16 8 10153 32 2 须毛癣菌 T5b 32 2 T5a 32 2 表 2 DMZ与FLC的协同抗氟康唑耐药白念珠菌的作用
菌株 MIC80(g/L) 协同指数 单用FLC 单用DMZ 联用FLC 联用DMZ 901 64 8 0.25 2 0.129 904 64 16 0.25 2 0.254 632 64 8 0.25 2 0.254 -
[1] CHEN M, XU Y, HONG N, et al. Epidemiology of fungal infections in China[J]. Front Med, 2018, 12(1):58-75. doi: 10.1007/s11684-017-0601-0 [2] MCCARTY T P, WHITE C M, PAPPAS P G. Candidemia and invasive candidiasis[J]. Infect Dis Clin N Am, 2021, 35(2):389-413. doi: 10.1016/j.idc.2021.03.007 [3] PEREIRA R, SANTOS FONTENELLE R O, BRITO E H S, et al. Biofilm of Candida albicans: formation, regulation and resistance[J]. J Appl Microbiol, 2021, 131(1):11-22. doi: 10.1111/jam.14949 [4] 杨偲睿, 任彪, 彭显, 等. 药物联用逆转白色念珠菌唑类耐药机制的研究进展[J]. 国际口腔医学杂志, 2022, 49(5):511-520. doi: 10.7518/gjkq.2022050 [5] BAI J P, SHI Y L, FANG X, et al. Effects of demethylzeylasteral and celastrol on spermatogenic cell Ca2+ channels and progesterone-induced sperm acrosome reaction[J]. Eur J Pharmacol, 2003, 464(1):9-15. doi: 10.1016/S0014-2999(03)01351-7 [6] PFALLER M A, BOYKEN L B, HOLLIS R J, et al. Validation of 24-hour fluconazole MIC readings versus the CLSI 48-hour broth microdilution reference method: results from a global Candida antifungal surveillance program[J]. J Clin Microbiol, 2008, 46(11):3585-3590. doi: 10.1128/JCM.01391-08 [7] AHSAN H, REAGAN-SHAW S, BREUR J, et al. Sanguinarine induces apoptosis of human pancreatic carcinoma AsPC-1 and BxPC-3 cells via modulations in Bcl-2 family proteins[J]. Cancer Lett, 2007, 249(2):198-208. doi: 10.1016/j.canlet.2006.08.018 [8] 夏雅静. 我国中草药抗真菌的回顾性分析和研究方向的探讨[D]. 昆明: 昆明医科大学, 2019. [9] 路璐. 创新药物去甲泽拉木醛质量控制和稳定性研究[D]. 上海: 复旦大学, 2012. [10] VON LILIENFELD-TOAL M, WAGENER J, EINSELE H, et al. Invasive fungal infection[J]. Deutsches Ä rzteblatt Int, 2019, 116(16):271-278. [11] BASSETTI M, GARNACHO-MONTERO J, CALANDRA T, et al. Intensive care medicine research agenda on invasive fungal infection in critically ill patients[J]. Intensive Care Med, 2017, 43(9):1225-1238. doi: 10.1007/s00134-017-4731-2 [12] ARMSTRONG-JAMES D, BROWN G D, NETEA M G, et al. Immunotherapeutic approaches to treatment of fungal diseases[J]. Lancet Infect Dis, 2017, 17(12):e393-e402. doi: 10.1016/S1473-3099(17)30442-5 [13] BORMAN A M, SZEKELY A, JOHNSON E M. Comparative pathogenicity of United Kingdom isolates of the emerging pathogen Candida auris and other key pathogenic Candida species[J]. mSphere, 2016, 1(4): e00189-16. [14] BING J, HU T R, ZHENG Q S, et al. Experimental evolution identifies adaptive aneuploidy as a mechanism of fluconazole resistance in Candida auris[J]. Antimicrob Agents Chemother, 2020, 65(1):e01466-e01420. [15] SHAHI G, KUMAR M, SKWARECKI A S, et al. Fluconazole resistant Candida auris clinical isolates have increased levels of cell wall chitin and increased susceptibility to a glucosamine-6-phosphate synthase inhibitor[J]. Cell Surf, 2022, 8:100076. doi: 10.1016/j.tcsw.2022.100076 [16] MORSCHHÄUSER J. The development of fluconazole resistance in Candida albicans - an example of microevolution of a fungal pathogen[J]. J Microbiol, 2016, 54(3):192-201. doi: 10.1007/s12275-016-5628-4 [17] YANG Y, ZHAO M, HU T, et al. Identification of an antitumor effect of demethylzeylasteral on human gastric cancer cells[J]. Oncol Lett, 2021, 21(1):49. -





 下载:
下载:

 下载:
下载: