-
据相关流行病学调查[1]显示,全球约有3亿人患有支气管哮喘,其中,中国占1/10,且病情控制现状并不理想。孟鲁司特钠作为指南推荐的可单独应用的长期控制性药物,虽可抑制支气管痉挛现象,但长期使用药物毒副作用增加,加之患者依从性较低,影响了整体疗效[2-3]。与现代医学相比,中医强调从整体着眼,根据患者个体情况辨证论治,以极大的发挥中医中药独特优势,现在支气管哮喘的治疗中取得良好成效[4-5]。支气管哮喘在中医中归属“哮病”、“喘证”范畴,多由饮食不当,邪气外侵,引动伏痰,痰壅气道,郁而化热,肺气上逆,肺失宣降所致。因而治疗应以化痰平喘,宣肺降气,疏风清热为主。同时,中医整体观念认为肺主气,鼻为肺之窍,喉为肺之门,故而肺部病变多伴有鼻、咽喉证候。因此在治疗时应重视整体肺系,强调辨主病,抓主症,标本兼治,寒热兼顾。平喘方将张仲景麻杏石甘汤作为主方,辅以王琦教授脱敏调体方,起到了体、病、证并调的作用,具有宣肺平喘,清热化痰的功效。祖雅琪等[6]研究显示,中西医联合治疗可明显提高支气管哮喘患者临床疗效。本研究拟将平喘方联合孟鲁司特钠应用于支气管哮喘患者的治疗中,从疗效、中医证候积分、炎症因子及不良反应等方面探讨临床影响。
-
选取2022年5月至2023年12月宝鸡市妇幼保健院(本院)收治的102例支气管哮喘患者。纳入标准:①西医:满足支气管哮喘诊断标准[7]。②中医[8]:热哮证,主症:喉中痰鸣,气粗息涌,咳呛阵作;次症:胸髙胁胀,口渴喜饮,面赤,汗出,烦闷不安,口苦;舌脉象:舌质红、苔黄腻,脉滑数或弦滑。同时有以上2项主症和1项次症、舌脉即可确诊。排除标准:对此次研究药物过敏者;存在重度和危重哮喘者;存在因其他原因引起的胸闷、咳嗽者;存在恶性肿瘤者;存在肝、肾、心、脑等脏器功能障碍者;入组前接受过相关治疗者。
将试验患者按照简单随机法分为对照1组(孟鲁司特钠治疗,n=34)、对照2组(平喘方治疗,n=34)及观察组(平喘方联合孟鲁司特钠治疗,n=51)。对照1组:男∶女=14∶20,年龄2~5岁(3.09±0.71),病程3~11个月(7.35±1.21),轻度18例,中度16例;对照2组:男∶女=16∶18,年龄2~5岁(3.17±0.82),病程3~11个月(7.26±1.09),轻度19例,中度15例;观察组:男∶女=11∶23,年龄2~5岁(3.28±0.75),病程3~11个月(7.42±1.13), 轻度20例, 中度14例。3组基线资料经对比,无明显差异(P>0.05)。此次研究经医院伦理委员会审批通过, 且患者监护人对此次研究知情同意。
-
对照1组予以孟鲁司特钠(国药准字H20183239, 杭州民生滨江制药有限公司) 治疗。 4 mg/次,1次/d,睡前服用,持续治疗21 d。
对照2组予以平喘方治疗。平喘方药方组成:生石膏30 g、乌梅20 g、炙麻黄10 g、杏仁10 g、蝉蜕10 g、防风10 g、赤芝10 g,生甘草6 g。由我院药剂科以水煎制,200 mg/d,分早晚2次服用。7 d为一个疗程,持续治疗21 d。
观察组予以孟鲁司特钠联合平喘方治疗。孟鲁司特钠用法用量同对照1组;平喘方用法用量同对照2组。
-
于疗程治疗结束后评估临床疗效,分为临床控制、显效、有效和无效。临床控制:患者气急、胸闷和咳嗽等症状及体征基本消失,偶有哮喘发作但无需用药即可恢复,中医证候积分减少>95%;显效:患者气急、胸闷和咳嗽等症状和体征明显改善,中医证候积分减少70%~95%;有效:患者气急、胸闷和咳嗽等症状和体征均有好转,中医证候积分减少30%~69%;无效:证候积分减少29%以下,气急、胸闷和咳嗽等症状和体征均无改善。总有效率=临床控制率+显效率+有效率。
-
于治疗前后根据《中医病证诊断疗效标准》评估患者主症(喉中痰鸣,气粗息涌,咳呛阵作)中医证候积分,根据症状程度分别记为0分(无)、2分(轻度)、4分(中度)、6分(重度),分数降低,提示症状好转。
-
采集患者治疗前后空腹静脉血3 ml,经离心处理后取上层清液,放置于−40℃环境中保存待检。采用酶联法(浙江羽翔生物科技有限公司)检测白细胞介素(IL)-12、IL-17、干扰素(IFN)-γ、免疫球蛋白(Ig)E、转化生长因子(TGF)-β1水平。
-
于治疗前后评估患者呼吸和哮喘控制测试(TRACK)评分[11],该测试包括5项内容,采用0、5、10、15、20分,总分0~100分,分数越高哮喘控制越好。
-
记录不良反应,如腹泻、头痛、皮疹、恶心呕吐等发生情况。
-
将SPSS 22.0作为数据处理软件,计量资料经检验均满足正态分布,以(
$ \bar{x} $ ±s)表示,计数资料用[例(n),百分比(%)]表示,分别行t检验、单因素方差分析和χ2检验,以P<0.05为有统计学意义。 -
与对照1组和对照2组相比,观察组总有效率更高(P<0.05),但对照1组与对照2组总有效率比较,差异无统计学意义(P>0.05),见表1。
表 1 3组临床疗效对比[n(%)]
组别 例数 临床控制 显效 有效 无效 总有效率 观察组 34 5(14.71) 19(55.88) 8(23.53) 2(5.88) 94.12 对照1组 34 1(2.94) 11(32.35) 13(38.24) 9(26.47) 73.53 对照2组 34 3(8.82) 12(35.29) 11(32.35) 8(23.53) 76.47 x2/P(观察组vs 对照1组) 5.314/0.021 x2/P(观察组vs 对照2组) 4.221/0.040 x2/P(对照1组vs 对照2组) 0.078/0.779 -
与对照1组和对照2组相比,治疗后观察组(喉中痰鸣、气粗息涌、咳呛阵作)中医证候积分均更低(P<0.05),但对照1组与对照2组中医证候积分比较,差异均无统计学意义(P>0.05),见表2。
表 2 3组中医证候积分对比(
$ \bar{x} $ ±s,n=34)组别 喉中痰鸣 气粗息涌 咳呛阵作 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 观察组 4.43±0.38 1.37±0.31*#▲ 4.38±0.44 1.12±0.22*#▲ 4.35±0.50 1.09±0.31*#▲ 对照1组 4.49±0.36 1.96±0.42* 4.41±0.47 1.37±0.29* 4.33±0.48 1.48±0.26* 对照2组 4.46±0.37 1.82±0.35* 4.36±0.45 1.31±0.30* 4.39±0.46 1.41±0.29* F 0.223 24.540 0.105 7.809 0.138 17.796 P 0.800 <0.001 0.901 0.001 0.872 <0.001 *P<0.05,与同组治疗前比较;#P<0.05,与对照1组比较;▲P<0.05,与对照2组比较。 -
治疗后观察组IL-4、IL-17、TGF-β1及IgE水平均低于对照1组与对照2组,IFN-γ水平高于对照1组与对照2组(P<0.05),但对照1组与对照2组上述指标比较,差异均无统计学意义(P>0.05),见表3。
表 3 3组炎症因子对比(
$ \bar{x} $ ±s,n=34)指标 时间 观察组 对照1组 对照2组 F P IFN-γ(pg/ml) 治疗前 79.37±5.42 79.85±5.27 79.52±5.34 0.072 0.931 治疗后 136.43±9.19*#▲ 120.72±8.74* 122.48±8.63* 32.112 <0.001 IL-4(ng/L) 治疗前 48.96±4.51 49.13±4.36 49.05±4.27 0.013 0.987 治疗后 24.60±2.42*#▲ 30.55±2.50* 29.63±2.71* 53.094 <0.001 IL-17(pg/ml) 治疗前 13.58±2.60 13.78±2.39 13.91±2.45 0.153 0.859 治疗后 5.96±1.23*#▲ 10.39±1.46* 10.47±1.32* 126.142 <0.001 TGF-β1(ng/ml) 治疗前 25.73±3.18 25.85±3.21 25.90±3.42 0.024 0.976 治疗后 11.81±1.32*#▲ 16.33±2.14* 15.45±1.98* 57.186 <0.001 IgE(IU/ml) 治疗前 218.39±18.72 218.82±19.03 218.62±18.75 0.004 0.996 治疗后 132.56±9.14*#▲ 167.70±12.52* 163.84±11.13* 104.015 <0.001 *P<0.05,与同组治疗前比较;#P<0.05,与对照1组比较;▲P<0.05,与对照2组比较。 -
治疗前,观察组、对照1组、对照2组TRACK评分分别为(52.48±2.37)、(52.57±2.41)、(52.69±2.32)分,差异无统计学意义(F=0.067、P=0.935);治疗后,观察组TRACK评分为(74.39±3.54)分,高于对照1组的(67.25±2.16)分和对照2组的(66.73±2.40)分(F=81.401、P<0.001)。
-
3组均无严重不良反应发生,仅观察组出现3例恶心呕吐、2例头晕和3例皮疹,对照1组发生3例腹泻和2例恶心呕吐,对照2组发生3例恶心呕吐和1例皮疹,经对比差异无统计学意义(x2=1.835,P=0.399)。
-
中医认为支气管哮喘的主要病位为肺,并涉及到脾、肾,当其受损后,肺失宣降,脾不健运,肾不制水,导致津液聚集成痰,伏藏于肺,成为发病的“夙根”,再加之外感风邪、内伤饮食,或先天禀赋不足,导致积痰蒸热,热痰蕴肺,壅阻气道,肺失宣降,肺管狭窄,通畅不利,痰和气交结于此,相互搏结,出现痰鸣、喘促等病症,发为哮喘[12-13]。元·朱丹溪也曾在《丹溪心法》中提出:“哮喘专主于痰”,故痰阻气闭为发作时的主要病理环节,并以邪实为主,伏痰或因素体阳盛导致痰从热化,热痰伏肺,肺气上逆,遇感而生,属痰热则发为热哮证。因小儿肺脏娇嫩,肺常不足,气宣发功能尚不健全,腠理开合、固表抗邪的功能较弱,御邪能力较弱,藩篱不固,抗病能力不强,故更易受风邪侵袭而发病。因而临床对于本病的治疗应以清肺平喘、化痰宣肺为主。
平喘方主要由生石膏、炙麻黄、乌梅、杏仁、蝉蜕、防风、赤芝及生甘草组成,其中乌梅一能入肺则收,针对肺气失于宣降可收敛浮热,纳气归元,助纳气定喘,二则生津润肺,可防辛散之药损耗津气。防风乃风药中之润剂,更是祛风之要药,微温而不燥,药性缓和,用于热哮证哮喘可发挥祛风止痉的功效。乌梅与防风配伍使用,散收兼顾,相辅相成,在祛除外邪的同时而不耗伤气津,起到敛肺祛邪,化痰而不耗其气的功效。蝉蜕散风除热,利咽;赤芝止咳平喘,二者配伍相用,扶正祛邪,标本兼治,以调禀质。炙麻黄质轻味薄之品,入肺经,具宣肺平喘之功,可疏通营卫,开宣肺气,透达表邪。生石膏清泄肺胃之热以生津,与麻黄相配,既能宣肺,又能泻热。杏仁祛痰止咳,平喘,润肠,可宣肺降气行滞而消痰饮,通胸阳以开肺闭,既助石膏沉降下行,又助麻黄泻肺热,甘草防石膏之大寒伤胃,调和麻黄与石膏的寒热。纵观全方,配伍严谨,清宣降、调体质,紧扣病因病机,共奏清肺平喘、宣泄郁热、祛风化痰的功效。本研究中根据样本量公式N=[2pq(Za+Zβ)2]/(p1-p2)2,计算出总例数为102例,按简单随机法分组,各组均为34例。与对照1组和对照2组相比,观察组总有效率更高,中医证候(喉中痰鸣、气粗息涌、咳呛阵作)积分均更低,表明平喘方联合孟鲁司特钠治疗利于提高支气管哮喘患者临床疗效,改善临床症状。可能为平喘方从哮喘发病的根本出发,宣降肺气定其喘,祛热化痰撼其根,以调其脏腑功能达到治本目的,继而起到提高整体疗效的作用。
支气管哮喘发病机制复杂,随着现代医学的不断深入研究认为免疫炎症与支气管哮喘发病密切相关,其中Th1/Th2、Th17/Treg细胞失衡为重要发病机制[14-15]。Th17细胞属于促炎性Th细胞,在促炎和自身免疫性疾病中发挥重要作用,主要分泌IL-17等炎性因子,Treg细胞是抑制性T细胞的一种功能亚群,能分泌TGF-β1等因子,有效抑制免疫强度,降低炎症损伤;INF-γ为Th1细胞的标志性因子,其含量可间接反映Th1功能活性,介导细胞免疫应答;IL-4由Th2细胞分泌,可对体液免疫产生介导作用,诱导IgE大量产生,从而加重气道炎症[16-17]。本研究中治疗后观察组IL-4、IL-17、TGF-β1及IgE水平均低于对照1组和对照2组,IFN-γ水平高于对照1组和对照2组,但对照1组与对照2组上述指标比较,差异均无统计学意义,提示平喘方联合孟鲁司特钠治疗更利于改善支气管哮喘患者Th1/Th2、Th17/Treg细胞失衡现象,缓解炎症反应造成的免疫损伤。考虑为现代药理学研究表明麻黄具有抗炎、抗过敏、平喘的作用;生石膏具有增强免疫功能的作用;杏仁止咳平喘、抗炎、调节免疫;甘草中多种成分如甘草酸、多糖等均能起到抗炎、增强免疫力的功效。诸药合用,进一步调节免疫应答,减轻炎症反应。本研究中治疗后观察组TRACK评分较对照1组和对照2组均更高,但对照1组与对照2组比较无差异,这一结果再次证实了平喘方联合孟鲁司特钠治疗的有效性,对于缓解病情,控制哮喘发生有积极意义。本研究中3组不良反应比较差异无统计学意义,提示平喘方联合孟鲁司特钠治疗具较高的安全性,并不会增加患者不良反应的发生率。
综上所述,平喘方联合孟鲁司特钠治疗利于提高支气管哮喘患者临床疗效,并可缓解病情,调节炎症因子水平。本研究不足之处在于纳入样本量偏少,结果可能存在偏倚性,今后应扩大样本量对更多的可能机制进一步探讨研究。
Clinical curative effect of Pingchuan prescription combined with montelukast sodium on patients with bronchial asthma
-
摘要:
目的 探讨平喘方联合孟鲁司特钠治疗儿童支气管哮喘的临床疗效。 方法 选取2022年5月至2023年12月宝鸡市妇幼保健院收治的102例支气管哮喘患者,据简单随机法分为对照1组(孟鲁司特钠治疗,n=34)、对照2组(平喘方治疗,n=34)及观察组(平喘方联合孟鲁司特钠治疗,n=51),均持续治疗21 d。评估3组临床疗效。于治疗前后对比3组中医证候积分、炎症因子[白细胞介素(IL)-4、IL-17、干扰素(IFN)-γ、转化生长因子-β1(TGF-β1)、免疫球蛋白(Ig)E]及儿童呼吸和哮喘控制测试(TRACK)评分;记录不良反应。 结果 与对照1组和对照2组相比,观察组总有效率更高(P<0.05)。治疗后观察组(喉中痰鸣、气粗息涌、咳呛阵作)中医证候积分与对照1组和对照2组相比均更低(P<0.05)。治疗后,观察组IL-4、IL-17、TGF-β1及IgE水平均低于对照1组和对照2组,IFN-γ水平及TRACK评分均高于对照1组和对照2组(P<0.05)。3组不良反应对比无差异(P>0.05)。 结论 平喘方联合孟鲁司特钠用于治疗支气管哮喘患者可提高临床疗效,利于减轻炎症反应,缓解病情,且具安全性。 Abstract:Objective To explore the clinical curative effect of Pingchuan prescription combined with montelukast sodium on patients with bronchial asthma. Methods A total of 102 patients with bronchial asthma admitted to the hospital were enrolled between May 2022 and December 2023. According to simple randomization method, they were divided into control 1 group (montelukast sodium, n=34), control 2 group (Pingchuan prescription, n=34) and observation group (Pingchuan prescription combined with montelukast sodium, n=51). All patients were treated for 21 d. The clinical curative effect in the three groups was evaluated. The scores of TCM syndromes, inflammatory factors [interleukin(IL)-4, IL-17, interferon(IFN)-γ, transforming growth factor-β1(TGF-β1), immunoglobulin(Ig)E] and scores of the test for respiratory and asthma control in kids (TRACK) in the three groups were compared before and after treatment. The adverse reactions were recorded. Results Compared with control 1 group and control 2 group, total response rate was higher in observation group (P<0.05). After treatment, scores of TCM syndromes (wheezing due to phlegm in throat, tachypnea, choking)in observation group were lower than those in control 1 group and control 2 group (P<0.05). After treatment, levels of IL-4, IL-17, TGF-β1 and IgE in observation group were lower than those in control 1 group and control 2 group, while IFN-γ level and TRACK score were higher than those in control 1 group and control 2 group (P<0.05). There was no difference in adverse reactions among the three groups (P>0.05). Conclusion Pingchuan prescription combined with montelukast sodium could improve clinical curative effect in patients with bronchial asthma, which was beneficial to alleviate inflammatory response and disease severity, with certain safety. -
Key words:
- Pingchuan prescription /
- montelukast sodium /
- bronchial asthma /
- inflammatory factor
-
辅酶Q10(CoQ10)是生物体内广泛存在的脂溶性醌类化合物,作为细胞中的辅酶,其具有重要且广泛的药理作用[1],目前主要用于预防心血管疾病和增强免疫力等方面[2-4]。CoQ10分子量高、水溶性低,口服生物利用度低,注射剂稳定性差,对光十分敏感[5],越来越多的研究表明静脉注射乳剂是其理想载体[6]。
高油量可溶解更大量药物,对极难溶性药物的优势更为明显。但是目前对于含药静脉注射乳剂的研究中,油的质量体积比通常为10%[7],更高油量的研究相对较少。基于营养型脂肪乳剂的长期临床应用实践,高油量静脉注射乳剂的安全性已得到证实,具有广阔的发展空间和巨大的市场价值。同时乳剂不能经受冷冻也长期困扰着研究者们,卵磷脂与含亲水链段的乳化剂组合及恰当的油黏度是解决此问题的关键。本研究在乳剂经典处方中添加单唾液酸四己糖神经节苷脂(GM1),GM1含有一个较大的亲水头基,具有两亲性,利用其特殊的结构优势来解决乳剂不耐受冻融的难题。本研究旨在制备高油量、高载药量且耐冻融循环的CoQ10乳剂,建立其HPLC含量分析方法,并进行物理化学性质表征和稳定性评价,以弥补CoQ10现有制剂的不足,为高油量含药静脉注射乳剂的研究开发提供参考依据。
1. 仪器与试剂
BS124s电子分析天平(德国Sartorius公司);DF-101S 集热式恒温加热磁力搅拌器(巩义市英峪予华仪器厂);高速分散机(德国IKA T18 ULTRA TURRAX);M-110L型微射流仪(美国Microfluidics公司);垂直旋转自动高压灭菌器(沈阳天美达科学仪器有限公司);Nicomp-380 激光粒度测定仪(美国Particle Sizing Systems公司);PHS-2C型数字显示酸度计(上海伟业仪器厂);CS120GXL型超速离心机(日本Hitachi公司);UV228紫外-可见光检测器、P230高压恒流泵(大连依利特分析仪器有限公司);高精度全自动交流稳压器(浙江中川电气科技有限公司);AT-130柱温箱(天津市金洲科学仪器有限公司);人工气候箱(德国MMM公司)。
CoQ10(广东润和生物科技有限公司,批号:2017052405,纯度
$\geqslant $ 98%),中链油(MCT,辽宁铁岭北亚药用油有限公司,注射级),大豆油(LCT,辽宁铁岭北亚药用油有限公司,注射级),蛋黄卵磷脂(E80,德国Lipoid公司,注射级),GM1(重庆寰瑞生物制药有限公司,注射级),维生素E(VE,BASF维生素有限公司),甘油(湖南尔康制药有限公司,注射级),聚乙二醇12-羟基硬脂酸酯(HS15,德国BASF公司,注射级),葡萄糖注射液(昆明南疆制药有限公司),氯化钠注射液(吉林省都邦药业股份有限公司),灭菌注射用水(石家庄四药有限公司),其他试剂均为色谱纯。2. 方法与结果
2.1 CoQ10乳剂的制备
油种类对乳剂的稳定性至关重要,LCT和MCT单独应用时均存在各自的缺陷,且乳剂不能经受冷冻,因此将二者联合应用,质量比为1∶1[8]。结合静脉注射乳剂经典处方组成,CoQ10乳剂按如下方法制备[9]。称取质量体积比为30% LCT/MCT (质量比1∶1)、2% E80、0.05% VE和2% CoQ10于60 ℃水浴中加热熔融、分散均匀。2.25%甘油和0.2% GM1溶解于适量重蒸水中,60 ℃加热搅拌至完全溶解。待两相温度平衡后,高剪切搅拌下(8000 r/min)将水相加入油相中,完全加入后继续分散5 min,即得初乳。待初乳冷却至室温后,加重蒸水定容至处方量。将初乳转移至微射流仪中,经6 000 psi均质3个循环,14 000 psi均质6个循环减小粒径。依次过0.80和0.45 μm微孔滤膜。将所得乳剂分装,充氮气,121 ℃灭菌8 min。
2.2 CoQ10乳剂HPLC方法的建立
2.2.1 色谱条件[10]
色谱柱:Betasil C18(200 mm×4.6 mm,5 μm,大连依利特);流动相:甲醇-无水乙醇(体积比20∶80);柱温:35 ℃;流速:1.0 ml/min;检测波长:275 nm;进样量:20 μl。
2.2.2 溶液的配制
精密称定CoQ10 25.0 mg,置于25 ml量瓶中,用无水乙醇溶解并稀释至刻度,摇匀,即得浓度为1000.0 μg/ml的CoQ10对照品储备液。精密移取CoQ10乳剂0.1 ml,置于10 ml量瓶中,加入无水乙醇破坏乳剂并稀释至刻度,摇匀,过0.45 μm微孔滤膜,即得CoQ10乳剂样品溶液。
2.2.3 专属性试验
取CoQ10乙醇溶液20 μl进样,记录色谱图。将空白乳和CoQ10乳剂分别加适量无水乙醇破乳,经0.45 μm微孔滤膜滤过,取各续滤液20 μl进样,记录色谱图。在此色谱条件下辅料和溶剂对药物测定无干扰,见图1。
2.2.4 线性关系考察
精密量取CoQ10对照品储备液适量,用无水乙醇稀释成浓度为10.0、25.0、50.0、100.0、150.0、200.0、250.0 μg/ml的系列标准溶液,过0.45 μm微孔滤膜,各取20 μl进样分析,记录峰面积A。以A对浓度C(μg/ml)进行线性回归,得线性方程为A=15738 C- 12584,r=0.999 8。结果表明CoQ10在10.0 ~ 250.0 μg/ml范围内线性关系良好。
2.2.5 精密度试验
分别取低、中、高浓度(25.0、100.0、200.0 μg/ml)的CoQ10对照品溶液,于2、4、6、8、10 h各测定一次,以峰面积求算日内精密度;于1、2、3、4、5天各测定一次,以峰面积求算日间精密度。结果表明RSD均小于2%,方法精密度良好。
2.2.6 稳定性试验
取“2.2.2”项下CoQ10乳剂样品溶液室温下避光放置,于0、2、4、6、8、10、24 h分别取20 μl进样分析,记录峰面积。计算得各时间点峰面积为0 h测定值的100.45%、101.23%、99.27%、100.26%、99.34%及100.06%,表明样品溶液在24 h内稳定。
2.2.7 重复性试验
按“2.2.2”项下方法平行制备6份CoQ10乳剂样品溶液。另精密称定CoQ10适量,加乙醇溶解并稀释成浓度为200.0 μg/ml的溶液,摇匀,过0.45 μm微孔滤膜,即得对照品溶液。精密量取样品和对照品溶液20 μl进样,记录峰面积。外标法计算得样品中药物浓度分别为201.3、199.6、198.2、200.7、199.2、198.4 μg/ml,RSD为0.62%,表明该方法重复性良好。
2.2.8 回收率试验
精密移取CoQ10对照品储备液0.25、1.0和2.0 ml各3份于10 ml量瓶中,分别加入0.1 ml空白乳,再加乙醇破坏乳剂并稀释至刻度,摇匀,过0.45 μm微孔滤膜。将上述各溶液进样分析,记录峰面积,按“2.2.4”项下标准曲线方程求得药物浓度,计算回收率。结果表明25、100和200 μg/ml CoQ10样品溶液的平均回收率分别为100.04%、99.63%和100.49%,RSD分别为0.29%、0.80%和0.52%。
2.3 CoQ10乳剂的质量评价
2.3.1 外观
按照“2.1”项下的处方工艺制备CoQ10乳剂,观察其外观。CoQ10乳剂外观为淡黄色均匀乳状液体,无油滴、不溶性成分或块状团聚物,见图2。
2.3.2 物理化学性质
取CoQ10乳剂适量,用蒸馏水稀释至适宜浓度,采用激光散射粒径测定仪测定3批CoQ10乳剂的粒径、粒径分布和Zeta电位。测定波长为632.8 nm,测定角为90°,测定温度为25 ℃。结果显示3批样品的平均粒径为(239.5±0.8)nm,未见大于5 μm的粒子,符合静脉注射液的要求;粒径为(0.300±0.011)nm;Zeta电位为(−32.28±2.04)mV。同时测定了CoQ10乳剂的pH值为(5.86±0.02),符合注射剂质量要求。
2.3.3 含量测定
精密量取CoQ10 乳剂0.1 ml(含CoQ10约2 mg)于10 ml量瓶中,加乙醇溶解并稀释至刻度,摇匀,过0.45 μm微孔滤膜,取20 μl进样,记录色谱图。另取相同浓度的药物溶液,同法测定。外标法计算乳剂中CoQ10的含量,最终测得3批供试品的标示量百分比分别为99.18 %、101.50 %和101.08%,RSD为1.24%。
2.3.4 包封率测定
采用超速离心法测定CoQ10乳剂的包封率。乳剂经过超速离心后,油相、乳化层和水相彻底分开,将油相与乳化层中的药物量合并考虑,通过测定水相中的药物量来计算包封率。精密移取CoQ10乳剂0.1 ml至10 ml量瓶中,加入乙醇稀释至刻度,混匀,过0.45 μm微孔滤膜,取续滤液进行HPLC检测,外标法计算药物总量。移取CoQ10乳剂4 ml至超速离心管中,温度为4 ℃,以50 000 r/min离心2 h。精密移取下层液体1.0 ml至10 ml量瓶中,乙醇稀释至刻度,混匀,过0.45 μm微孔滤膜,取续滤液进行HPLC检测,外标法计算水相中药物含量。按上述方法测得3批CoQ10乳剂的平均包封率为(98.5%±1.1)%,表明药物绝大部分存在于制剂的油相和油水界面层中。
2.4 灭菌和冻融稳定性
将CoQ10乳剂分装于西林瓶,充氮气密封,121 ℃灭菌8 min。参考《化学药物稳定性研究技术指导原则》中涉及乳剂冻融试验的方法,将灭菌后样品在−20 ℃冷冻48 h,40 ℃放置48 h为一个循环,共循环3次,每完成一个循环测定粒径。结果显示3批CoQ10乳剂均具有良好的灭菌稳定性和冻融稳定性,见表1。
表 1 CoQ10乳剂的灭菌和冻融试验结果批次 粒径(l/nm) 灭菌前 灭菌后 冻融1次 冻融2次 冻融3次 1 241.4 239.6 255.7 263.0 271.2 2 238.5 240.0 252.6 265.9 272.3 3 240.2 238.7 259.0 263.5 269.1 2.5 稀释稳定性
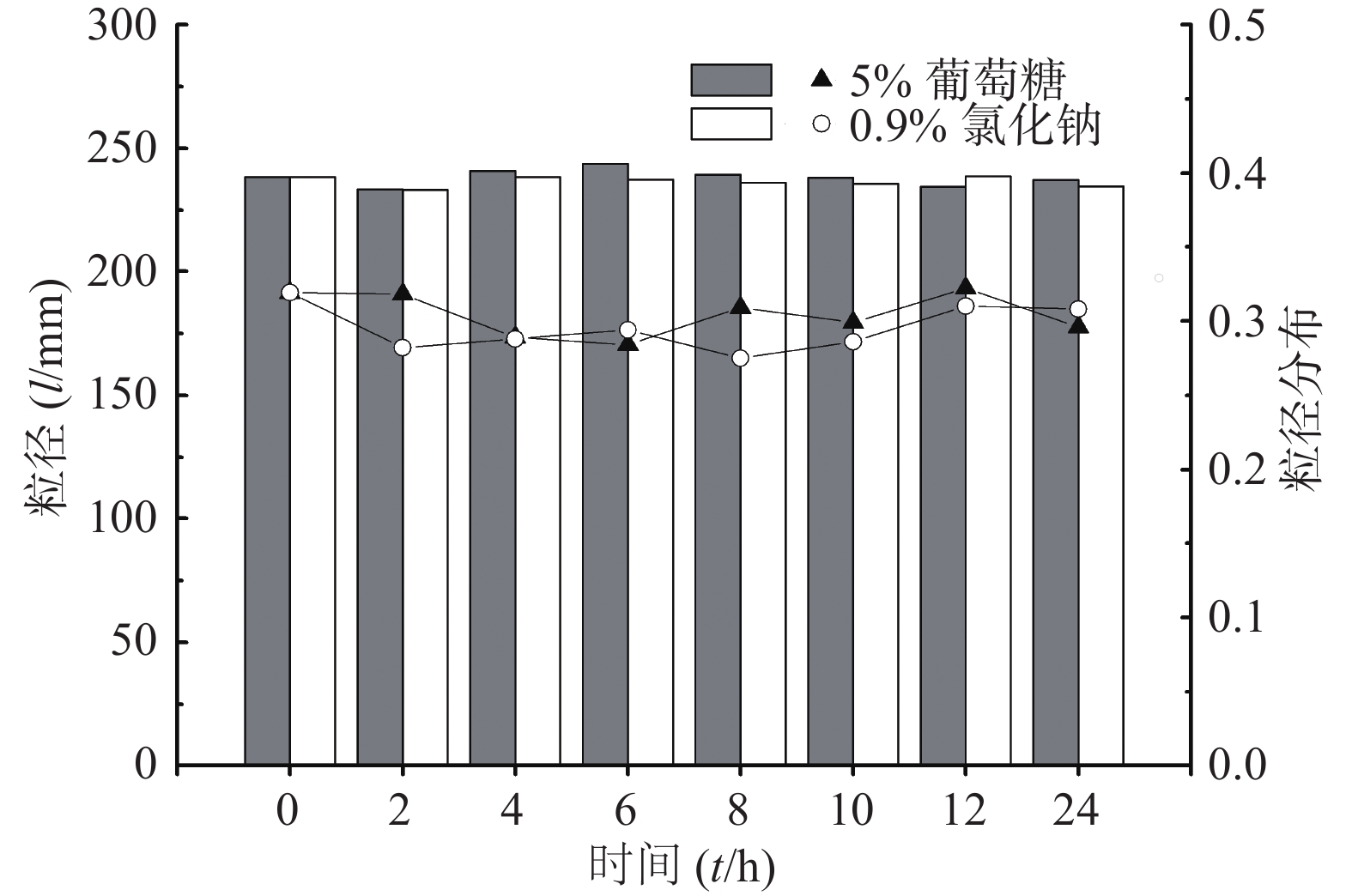
以平均粒径和粒径分布为指标,考察CoQ10乳剂在5%葡萄糖注射液和0.9%氯化钠注射液中的稀释稳定性。将制剂用上述稀释介质进行50倍稀释,于0、2、4、6、8、10、12、24 h取样,测定粒径和粒径分布。结果见图3,制剂经5%葡萄糖注射液和0.9%氯化钠注射液稀释后放置24 h,粒径和粒径分布均比较稳定,稀释稳定性良好。
2.6 光降解试验
CoQ10结构中含有大量不饱和双键,是典型的光敏性药物。以药物含量为主要指标,考察不同因素对CoQ10乳剂光解速率的影响。将样品分装于透明西林瓶,置于人工气候箱中,于(25±2) ℃、(4500±500)lux条件下进行强制光解试验,调整样品与光源的距离约10 cm,使受光均匀,分别于0、24、48、72、96、120 h取样,HPLC法测定药物含量。绘制光降解曲线,并进行反应级数拟合,求出光解半衰期(t1/2)。
2.6.1 载体对光照稳定性的影响
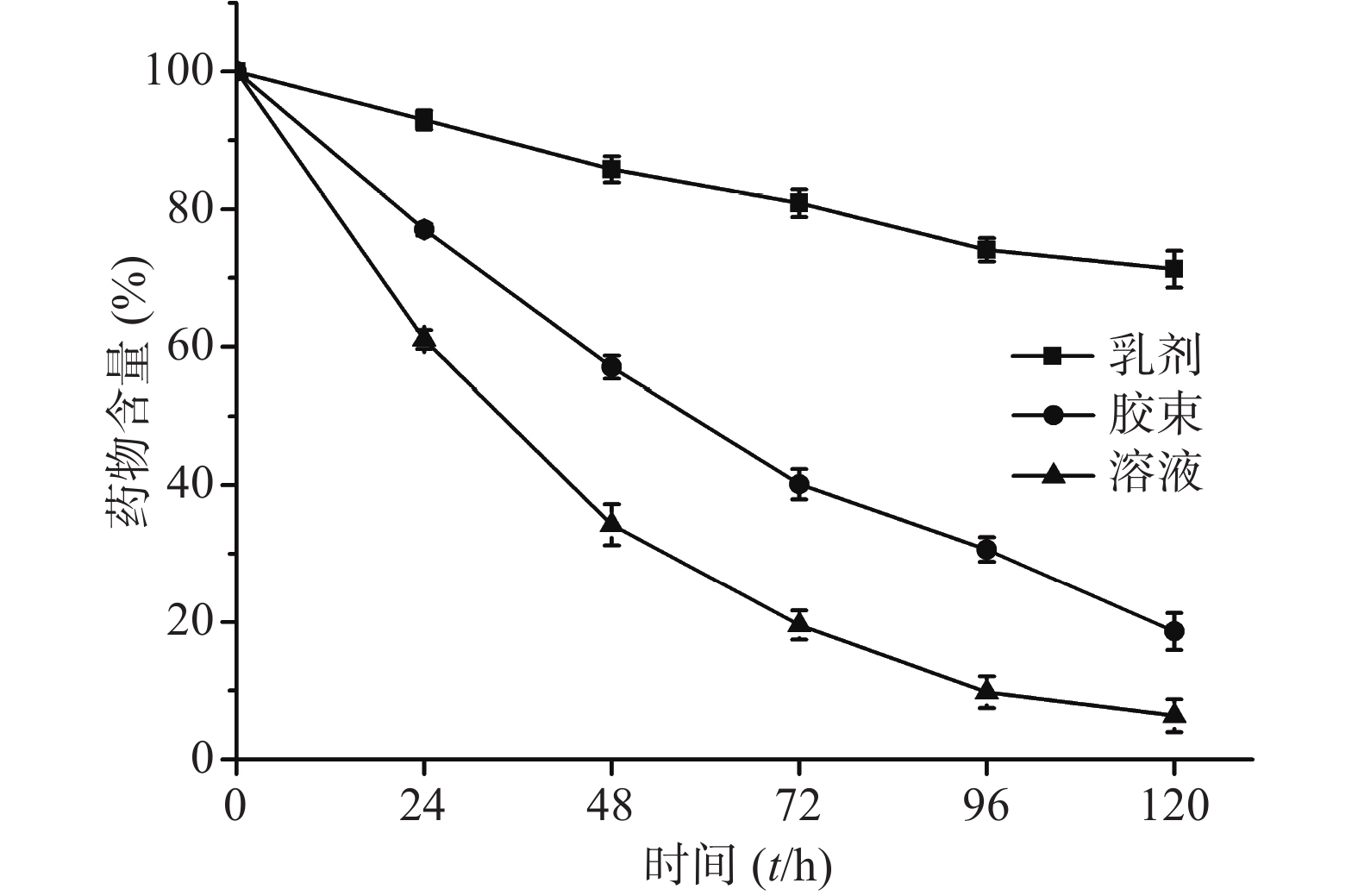
将适量CoQ10用无水乙醇溶解并稀释,即得CoQ10溶液。称取0.25% CoQ10和3% HS15于55 ℃水浴中加热熔融,分散均匀。搅拌状态下加入预热至相同温度的注射用水,搅拌10 min,即得CoQ10胶束。制备相同药物浓度(1 mg/ml)的CoQ10溶液、胶束和乳剂进行光解试验。光解曲线见图4,反应级数均为一级。对CoQ10的光保护作用由强到弱依次为乳剂、胶束和溶液,t1/2分别为239.0、50.6和29.4 h。
2.6.2 稀释倍数对光照稳定性的影响
将CoQ10乳剂(20 mg/ml)分别稀释0、2、4、10、20倍进行光解试验。光解曲线见图5,反应级数均为一级,稀释倍数由低到高,t1/2分别为533.1、495.0、288.8、115.5和62.4 h。
2.6.3 载药量对光照稳定性的影响
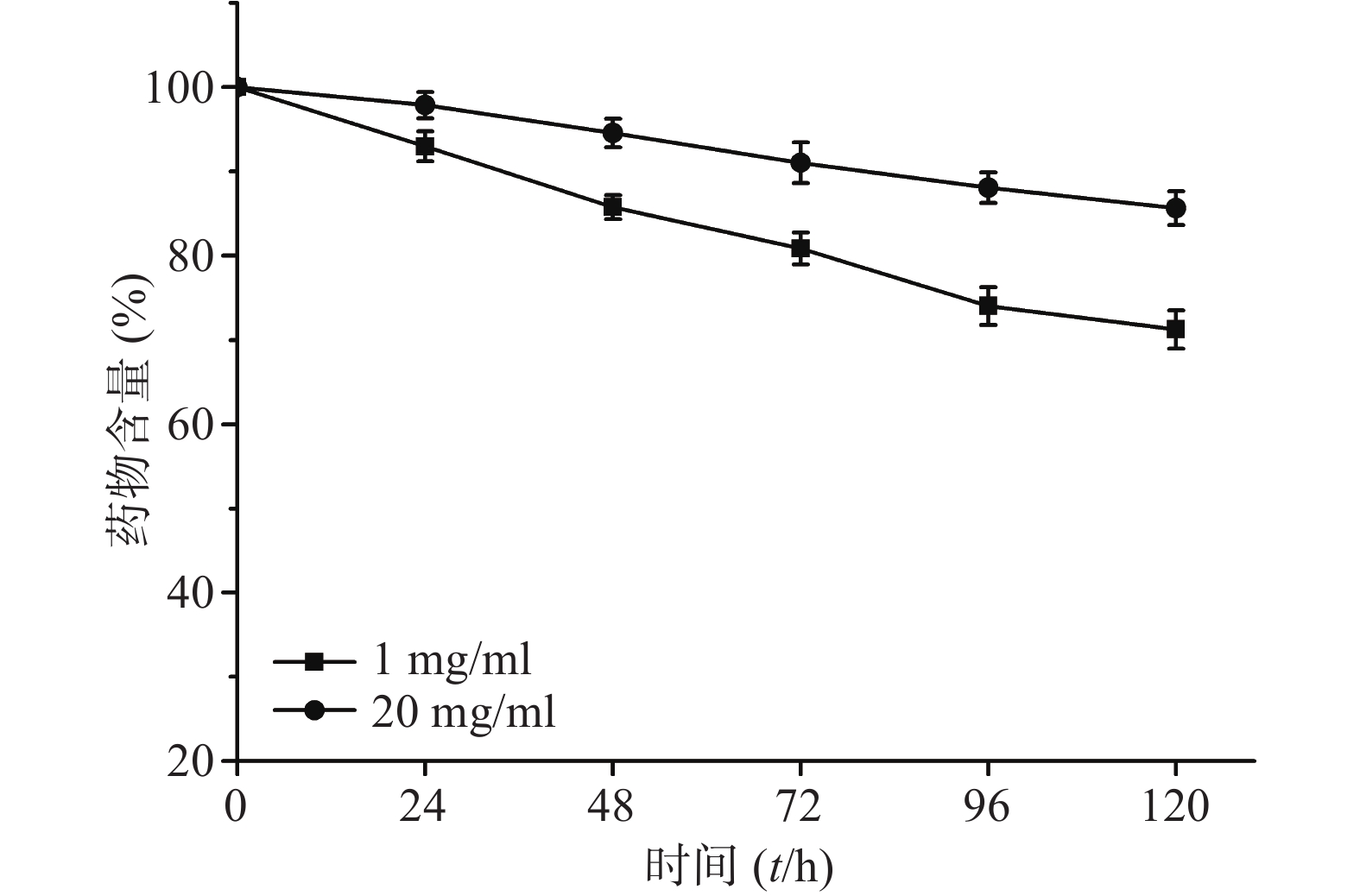
分别制备0.1%(1 mg/ml)和2.0%(20 mg/ml)载药量的CoQ10乳剂,进行光解试验。光解曲线见图6,反应级数均为一级,0.1%和2.0%载药量乳剂的t1/2分别为233.5和533.1 h。结果表明,光解速率与载药量呈反比,载药量越大,光解速率越小。
2.7 影响因素试验
CoQ10乳剂需在冰箱(2~8 ℃)内储存,因此以下稳定性实验参照《中国药典》2020版中对温度特别敏感药物制剂的实验条件进行。
2.7.1 光照稳定性
将CoQ10乳剂分装于棕色西林瓶中,充氮气、密封,在(25±2) ℃、(4 500±500) lux条件下,于第0、5、10天取样,以制剂外观、含量、粒径、pH为评价指标,考察CoQ10乳剂的光照稳定性。结果(见表2)表明3批制剂的含量和pH略有下降,提示该乳剂需避光制备与储存。
表 2 CoQ10乳剂的光照稳定性试验结果天数(t/d) 外观 含量(%) 粒径(l/nm) pH 0 良好 100.4 243.2 5.82 5 良好 97.7 239.8 5.79 10 良好 93.6 241.4 5.70 2.7.2 40 ℃高温稳定性
将CoQ10乳剂分装于西林瓶中,充氮气、密封,在(40±2) ℃条件下避光放置,于第0、5、10天取样,以制剂外观、含量、粒径、pH为评价指标,考察CoQ10乳剂在高温条件下的稳定性。结果(见表3)显示3批制剂的含量和pH随时间延长呈下降趋势。
表 3 CoQ10乳剂在40 ℃的稳定性试验结果天数(t/d) 外观 含量(%) 粒径(l/nm) pH 0 良好 100.4 243.2 5.82 5 良好 100.2 245.2 5.57 10 良好 99.5 245.0 5.21 2.8 25 ℃加速试验
取3批CoQ10乳剂分装于西林瓶中,充氮气、密封,在(25±2) ℃、相对湿度60%的条件下避光放置6个月,分别于第0、1、2、3、6个月取样,观察制剂外观,测定含量、粒径和pH值。结果表明,CoQ10乳剂在(25±2) ℃条件下避光放置6个月,各指标均在合格范围内,稳定性良好。
2.9 长期稳定性试验
取3批CoQ10乳剂分装于西林瓶中,充氮气、密封,在(5±3) ℃条件下避光放置12个月,分别于第0、3、6、9、12个月取样,观察制剂外观,测定含量、粒径和pH值。结果表明,CoQ10乳剂在(5±3) ℃条件下避光放置12个月,各指标均在合格范围内,稳定性良好。
3. 讨论
3.1 冻融稳定性
乳剂冷冻期间冰晶的形成会破坏乳化膜,从而引发小油滴聚集成大油滴,甚至导致浮油、破乳。解决乳剂冻融问题的主要手段为油相和乳化剂的合理选择。其一是油相要有恰当的黏度,将LCT与MCT联合应用既能克服单独使用存在的问题,又可取长补短,有利于乳剂冻融稳定性的提高。其二,牢固的乳化膜可增强乳剂的冻融稳定性,有研究[11]发现卵磷脂与含亲水链段的乳化剂组合对提高冻融稳定性有至关重要的作用。本实验CoQ10乳剂处方组成中的GM1是一种内源性糖脂,具有生物可降解、无免疫原性等特点[12],近年来已有研究将GM1应用于乳剂、脂质体和胶束的制备[12-14]。GM1是两亲性物质,可与卵磷脂形成复合乳化膜,增加膜的韧性。其结构中的较大亲水头基形成的空间立体位阻,及结构中唾液酸的荷负电对提高乳剂的冻融稳定性也至关重要。此外,在水相中加入含羟基的醇类或糖类(冻融保护剂),可以增加水相黏度,减慢冰晶的生长速度和程度,增强乳剂的冻融稳定性。
3.2 光照稳定性
CoQ10的光解具有浓度依赖性,起始浓度高时光解速率相对较慢,但当制剂稀释倍数增加时,其透光性大大增加,光解反应加剧。对于微粒给药系统,粒径是一个重要参数,同时其光解具有一定的粒径依赖性。本研究所制备的乳剂属于高油量低磷脂含量,与普通乳剂相比粒径较大,因此光稳定性要更好。推测原因为光不容易穿透大粒径制剂的内部,降低了药物的曝光率;此外,粒径大时粒子的曲率较低,比表面积小,因此曝光机会少,越不易光解[10]。本实验证明了将CoQ10包封入乳剂中可减少其曝光机会,对药物能起到一定的保护作用。但CoQ10乳剂仍需低温氮气环境下保存,使用过程中避光处理,以减少光解的概率。
-
表 1 3组临床疗效对比[n(%)]
组别 例数 临床控制 显效 有效 无效 总有效率 观察组 34 5(14.71) 19(55.88) 8(23.53) 2(5.88) 94.12 对照1组 34 1(2.94) 11(32.35) 13(38.24) 9(26.47) 73.53 对照2组 34 3(8.82) 12(35.29) 11(32.35) 8(23.53) 76.47 x2/P(观察组vs 对照1组) 5.314/0.021 x2/P(观察组vs 对照2组) 4.221/0.040 x2/P(对照1组vs 对照2组) 0.078/0.779 表 2 3组中医证候积分对比(
$ \bar{x} $ ±s,n=34)组别 喉中痰鸣 气粗息涌 咳呛阵作 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 观察组 4.43±0.38 1.37±0.31*#▲ 4.38±0.44 1.12±0.22*#▲ 4.35±0.50 1.09±0.31*#▲ 对照1组 4.49±0.36 1.96±0.42* 4.41±0.47 1.37±0.29* 4.33±0.48 1.48±0.26* 对照2组 4.46±0.37 1.82±0.35* 4.36±0.45 1.31±0.30* 4.39±0.46 1.41±0.29* F 0.223 24.540 0.105 7.809 0.138 17.796 P 0.800 <0.001 0.901 0.001 0.872 <0.001 *P<0.05,与同组治疗前比较;#P<0.05,与对照1组比较;▲P<0.05,与对照2组比较。 表 3 3组炎症因子对比(
$ \bar{x} $ ±s,n=34)指标 时间 观察组 对照1组 对照2组 F P IFN-γ(pg/ml) 治疗前 79.37±5.42 79.85±5.27 79.52±5.34 0.072 0.931 治疗后 136.43±9.19*#▲ 120.72±8.74* 122.48±8.63* 32.112 <0.001 IL-4(ng/L) 治疗前 48.96±4.51 49.13±4.36 49.05±4.27 0.013 0.987 治疗后 24.60±2.42*#▲ 30.55±2.50* 29.63±2.71* 53.094 <0.001 IL-17(pg/ml) 治疗前 13.58±2.60 13.78±2.39 13.91±2.45 0.153 0.859 治疗后 5.96±1.23*#▲ 10.39±1.46* 10.47±1.32* 126.142 <0.001 TGF-β1(ng/ml) 治疗前 25.73±3.18 25.85±3.21 25.90±3.42 0.024 0.976 治疗后 11.81±1.32*#▲ 16.33±2.14* 15.45±1.98* 57.186 <0.001 IgE(IU/ml) 治疗前 218.39±18.72 218.82±19.03 218.62±18.75 0.004 0.996 治疗后 132.56±9.14*#▲ 167.70±12.52* 163.84±11.13* 104.015 <0.001 *P<0.05,与同组治疗前比较;#P<0.05,与对照1组比较;▲P<0.05,与对照2组比较。 -
[1] PIKE K C, LEVY M L, MOREIRAS J, et al. Managing problematic severe asthma: beyond the guidelines[J]. Arch Dis Child, 2018, 103(4):392-397. doi: 10.1136/archdischild-2016-311368 [2] DEMET AKBAŞ E, RAZI C H, ANDıRAN N. Effects of using montelukast during acute wheezing attack in hospitalized preschool children on the discharge rate and the clinical asthma score[J]. Pediatr Pulmonol, 2021, 56(7):1931-1937. doi: 10.1002/ppul.25394 [3] 邱世光, 王高岸, 李雅琴, 等. 射麻止喘方联合孟鲁司特钠治疗支气管哮喘疗效研究[J]. 陕西中医, 2021, 42(2):172-176. doi: 10.3969/j.issn.1000-7369.2021.02.009 [4] 杨勤军, 童佳兵, 杨程, 等. 麻芍平喘汤治疗支气管哮喘冷哮证临床疗效观察及对血清炎症因子的影响[J]. 中药新药与临床药理, 2021, 32(4):573-578. [5] 东雪洁, 贾广媛, 张葆青, 等. 清咳平喘颗粒联合布地奈德和硫酸特布他林治疗小儿支气管哮喘急性发作期(热哮证)的疗效观察[J]. 现代药物与临床, 2023, 38(5):1142-1146. [6] 祖雅琪, 张洪春. 祛痰化浊方联合辨证贴敷对支气管哮喘急性发作期患者气道重塑指标的影响[J]. 环球中医药, 2020, 13(4):730-733. doi: 10.3969/j.issn.1674-1749.2020.04.043 [7] 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童支气管哮喘诊断与防治指南(2016年版)[J]. 中华儿科杂志, 2016, 54(3):167-181. doi: 10.3760/cma.j.issn.0578-1310.2016.03.003 [8] 中华中医药学会肺系病分会. 支气管哮喘中医诊疗专家共识(2012)[J]. 中医杂志, 2013, 54(7):627-629. [9] 中华人民共和国卫生部. 中药新药临床研究指导原则[M]. 北京: 中国医药科技出版社, 2002: 88-90. [10] 国家中医药管理局. 中医病证诊断疗效标准[M]. 南京: 南京大学出版社, 1994: 39. [11] 洪建国. 儿童呼吸和哮喘控制测试(TRACK)改良中文版及其临床价值[J]. 中国实用儿科杂志, 2018, 33(3):192-195. [12] 李红华. “清肺平喘、祛风解痉” 法联合西药治疗支气管哮喘急性发作(热哮证)临床疗效及对血清趋化因子影响[J]. 辽宁中医药大学学报, 2021, 23(8):130-134. [13] 许丽菲, 高鸿博, 张艳文, 等. 小儿支气管哮喘发病的中医理论探讨[J]. 四川中医, 2023, 41(4):26-29. [14] 努尔阿米娜·铁力瓦尔迪, 热依拉·牙合甫, 韩利梅, 等. 支气管哮喘气道炎症表型与Th1/Th2和IgE的相关研究[J]. 国际检验医学杂志, 2020, 41(1):33-36. doi: 10.3969/j.issn.1673-4130.2020.01.009 [15] 姜小云, 张丽珊. Th17/Treg平衡在儿童哮喘发病机制中的作用[J]. 中国卫生检验杂志, 2019, 29(12):1472-1474. [16] 班紫妍, 刘长富, 刘梦娜, 等. 肺部感染对支气管哮喘患儿肺功能和Th17、Treg T细胞亚群的影响及作用机制[J]. 中国感染与化疗杂志, 2022, 22(2):140-145. [17] 刘美秀, 严正平, 沈王丰, 等. 祛风平喘汤辨证治疗支气管哮喘的临床观察[J]. 中国中医急症, 2022, 31(7):1212-1215. doi: 10.3969/j.issn.1004-745X.2022.07.022 -





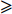
 下载:
下载:


 下载:
下载: 




