-
心肌梗死是一种严重的心血管疾病,由于冠状动脉血供急剧减少或中断,使心肌持续性缺血缺氧以致坏死,损害心功能且可能导致心律失常、休克以及心力衰竭等严重后果,已成为威胁人类生命健康的重大疾病之一[1-2]。近几十年来,随着医疗技术的进步,再灌注心肌治疗可显著改善心梗患者的生存率,但由于心梗发生发展及转归过程极其复杂,使其在临床治疗中仍然面临许多挑战[3],因此构建合适的动物模型对探究人心肌梗死的发病机制和病理过程、评价药物疗效以及探索新的治疗方法至关重要。通过结扎冠状动脉模拟心肌缺血过程来建立心肌梗死的动物模型是目前广泛应用的较为成熟的方法[4-5]。以往更倾向于选择较大动物构建模型,随着基因工程技术的发展,基因工程小鼠成为炙手可热的研究工具,因此建立简便有效的小鼠心梗模型对心肌梗死疾病的深入研究有重要意义。但目前国内关于小鼠心梗模型构建方法的报道较少,缺乏一种比较便捷的模型制作方法和无创评价手段。本文基于Gao等[6]报道的心梗模型构建方法结合实际操作总结了一些经验。
-
SPF级C57BL/6J 10~12周龄雄性小鼠,共29只,体重为(29.65±5.35)g,购于海西普尔-必凯实验动物有限公司。实验动物均饲养在具有IVC系统的动物房[人工照明12 h;温度(23±2)℃;相对湿度40%~60%;噪音≤60 dB],自由饮食进水,在正式实验之前需适应饲养环境至少1周。动物实验方案与操作均遵守动物福利及“3R”原则。
-
异氟烷(河北一品制药);4%水合氯醛、2%TTC染液(批号:E110BA0007、AC29BA0025,BBI Life Science);0.9%NaCl溶液;4%多聚甲醛组织固定液(批号:154608,博光生物)。气体麻醉机(上海曼普生物科技有限公司);恒温垫;彩色扫描仪(BenQ,K802);MPA血压与心率分析系统(上海奥尔科特生物科技有限公司);显微外科手术器械。缝线(3-0,用于肌肉、皮肤缝合)、缝针;带线缝针(7-0,用于结扎冠状动脉)。
-
所有手术器械使用前均高温蒸汽灭菌30 min。实验小鼠术前禁食12 h。按照麻醉机说明书连接好管路。将小鼠放进麻醉机的诱导箱,开启氧气调节气流量(0.25 MPa,1 L/min),调整麻醉药(异氟烷)浓度为5%,约1 min完成小鼠诱导麻醉,之后调整麻醉药浓度至2%,连接小鼠面罩并持续吸入。
-
小鼠仰卧位固定,左胸前手术区域剔除鼠毛并消毒。距胸骨左缘约1~2 mm皮肤处做长约1 cm纵向切口,切口处行垂直外翻褥式缝合预留缝线。逐层钝性分离胸壁肌肉,从第3或第4肋间隙快速进入胸腔,用止血钳撑开肋间隙,配合心脏跳动左手轻轻挤压使心脏从孔隙中弹出。在左心耳下缘1~2 mm、肺动脉圆锥旁0.5 mm处以7-0带线缝合针穿过冠状动脉前降支将其结扎,松紧适宜,控制进针深度(以隐约可见细针为宜)和行针宽度(2 mm左右)。由于不借助通气装置,要求开胸时间不要超过30 s,结扎操作尽量控制在10 s左右完成。结扎完成后轻柔地将心脏送回胸腔,挤压胸腔排出空气同时收紧结扎切口处预留缝线,完成手术。术中逐步调整麻药浓度至零,取下面罩后将小鼠置于恒温垫上约3~5 min即可复苏。
-
小鼠异氟烷吸入麻醉后,仰卧固定,按照仪器说明连接MPA系统心脏导联线,并将针电极分别固定在右上肢、左上肢,右下肢接地,避免周围磁场干扰。待基线平稳后,记录4~5个心动周期。实验中我们主要使用II导联观察心脏前下壁心梗发生的情况,与冠状动脉左前降支所供给的心肌区域相吻合。心电图导联的选择可以根据实验需求进行调整。
-
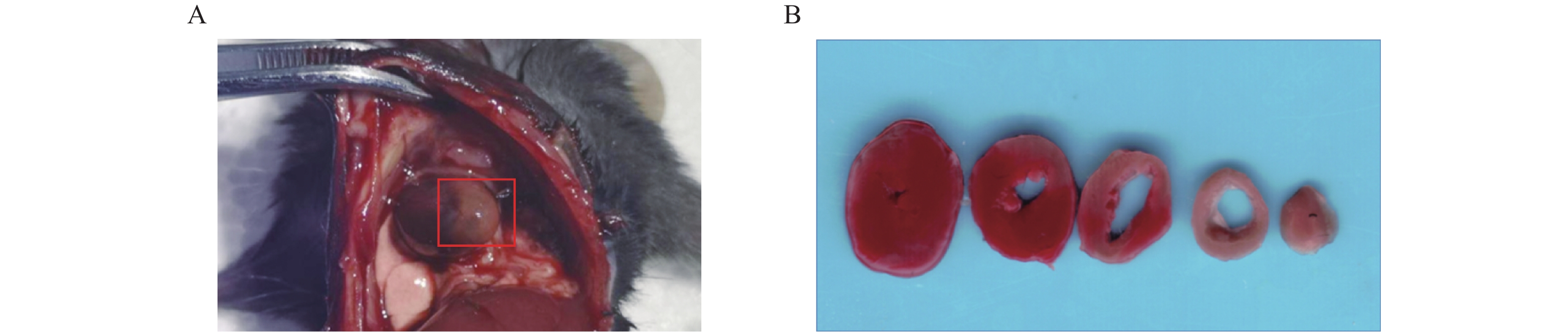
术后24 h对模型小鼠施行安乐死(4%水合氯醛,300 mg/kg),打开胸腔,肉眼观察心梗部位,并拍照记录。留取心脏标本置于生理盐水中,冲洗除去多余的血液,用滤纸吸干液体后修剪,仅保留全心室称重,记为M1(mg)。全心室心脏标本置于–20 ℃冷冻约30 min后,将心脏切成厚度为1 mm左右的薄片若干,经常规TTC染色后[7],进行扫描拍照。剪下白色梗死区域用滤纸吸干后称重,记为M2(mg),梗死区大小计算以百分比表示,即梗死大小(%)=(M2/M1)×100%。
-
数据均采用平均值±标准差(
$ {\rm{\bar X}} $ ±s)表示。 -
小鼠心梗模型总体成功率为79.3%(23/29)。其中,冠脉结扎术中死亡率为6.8%(2/29),1只由于穿刺过深导致心脏破裂出血,1只由于胸腔暴露时间过长导致气胸。术后早期(<4 h)死亡率为10.3%(3/29);2只解剖后发现胸腔内有大量积血,1只疑为发生不可逆转的致死型心律失常。此外,1只造模失败未发生心梗,术后24 h TTC染色未见明显梗死区,且术后即刻和术后4 h心电图均无ST段改变(表1)。
表 1 小鼠心梗模型失败原因分析及解决方法
失败时段 比例(%) 原因分析 只数 解决方法 术中死亡 6.8 术中心脏破裂致死 1 控制穿刺深度和宽度 术中气胸致死 1 穿刺结扎迅速,快速闭合胸腔 术后死亡 10.3 术后胸腔出血致死 2 保证视野开阔,用纱布保护胸壁及肺,避免刺破大血管和肺脏 术后致死型心律失常致死 1 结扎动作迅速轻柔,减少对心脏的刺激 其他 3.4 术后未发生心梗 1 (造模失败) -
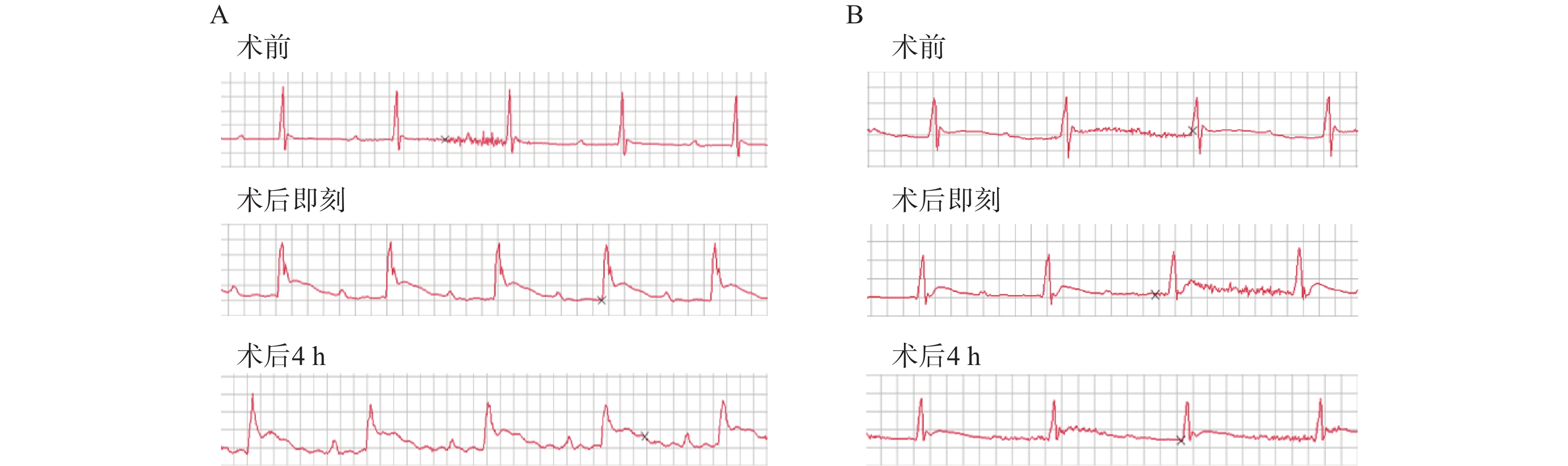
造模小鼠均施行术后即刻和术后4 h两次心电图检查,发现经24 h TTC染色后证实有心肌梗死发生的23只造模成功的小鼠中,两次心电图中均呈现出明显的ST段抬高以及变异T波(图1A),而造模失败的小鼠心电图则没有明显异常(图1B)。
-
术后24 h打开小鼠胸腔,肉眼可见左心室前下壁靠近心尖处呈灰白色(图2A)。取心脏标本经常规TTC染色后,可观察到梗死区域呈白色,而非梗死区域呈红色(图2B)。根据前文提到心梗区大小的计算方法,本实验中,心梗模型梗死区大小最大可达40%,几乎累及整个左心室;最小为17%,主要集中在心尖部位;梗死区平均大小为(28±6)%(见表2)。
表 2 23只小鼠心肌梗死区大小情况
项目 体重/g 全心室重量(M1)/mg 梗死心肌重量(M2)/mg 梗死大小(M2/M1)/(%) 总计($ {\rm{\bar X}} $±s) 29.65±5.35 76±13 21.91±7.06 28±6 -
建立疾病的实验动物模型常常是研究工作至关重要的一步,需要考虑多方面的因素,使疾病本身特征和研究目的与所建立的动物模型达到尽可能地一致。首先,实验动物的选择要考虑各实验室以及实验者自身的条件。就心梗模型而言,大动物(猪、犬、兔等)因其心脏在形态大小、解剖结构以及生理条件上与人类更为相似,构建模型成功率相对较高,通常用于病理生理过程以及药物治疗疗效等研究。小动物生命力弱、手术耐受性差,导致模型建立具有一定难度,但由于其能够建立相关基因工程动物形成较为一致的品系,对于深入研究心肌梗死病理及治疗相关机制有重要意义。目前心梗治疗研究不断深入,基于心肌细胞不可再生的特性,移植治疗、干细胞治疗、基因治疗等多种治疗手段及相关机制研究成为心梗治疗方案的新方向[8-10],建立一种稳定性强、成功率高的小鼠心梗模型是非常必要的。因此,笔者结合小鼠自身特点,在以往大动物模型的基础上,比较成功地建立了小鼠的心梗模型。
目前建立心肌梗死动物模型的方法有多种,包括:冠脉结扎法、药物法、球囊堵闭法、栓塞法以及血栓形成法等。其中药物法主要使用垂体后叶素等诱发血管痉挛促使心肌缺血梗死,但此法很难明确发生梗塞的动脉且效果具有不确定性;后三种方法可直接形成冠脉闭塞,但需要借助心导管技术和冠脉造影等影像学技术,且小鼠细小的冠状动脉给操作增加了难度[11]。而冠状动脉结扎法[12]操作简单、血管阻塞明确,比较符合心梗发生的病理过程,能较好的实现临床转化,因此本实验主要采用此法建立小鼠心梗模型。实验过程中,采用5%异氟烷诱导后联合2%异氟烷面罩持续吸入麻醉的方法,不同于传统的腹腔麻醉联合气管插管通气的方法[13],避免了气管插管和机械通气可能产生的组织损伤,同时也提高了麻醉的安全性和手术效率。但是,此法要求实验者在短时间内完成冠脉结扎术,尽快完成冠脉结扎并闭合胸壁,降低长时间暴露胸腔可能导致心律失常、气胸等致死风险。术中需要密切关注小鼠状况以便及时调整麻药浓度,从而促进小鼠的术后复苏。除了安全有效的麻醉方法之外,冠脉结扎位置的选择至关重要,由于小鼠血管细小,侧枝循环丰富且走行不易观察,因此要求实验者操作精确,既要保证能够引起足够面积的心肌梗死,又要避免梗死面积过大而导致死亡,尽量在同一高度结扎形成较为一致的模型;此外,小鼠心室壁较薄,操作者需要严格控制穿刺深度,避免穿刺过深直接刺破室壁造成大出血。
心梗模型的评价方法可根据实验动物的生存状态分为活体检测和尸检。前者主要包括冠状动脉造影荧光微粒注射、MRI、PET和超声心动图等[14-15],这些方法可以获得冠脉血供状况从而间接评估心肌梗死,但设备要求高、价格昂贵,检测操作复杂;后者则主要是染料染色法包括TTC、依文思蓝、Masson三色法等,可以获得心肌梗死的直接结果。心电图通常是临床心肌梗死病人首选的实验室检查。然而,在动物心梗模型的评价中,人们往往忽视这一最为简便快捷方法的应用。在本实验的模型构建中,笔者采用术后即刻和术后4 h心电图检查两个指标来评估小鼠心梗情况。首先,在术后立刻对模型鼠施行心电图检查有助于帮助我们判断冠脉结扎的初期效果,以及发现潜在的心律异常改变。其次,考虑到心肌梗死特异性标志物之一——肌钙蛋白(cTn),一般在心肌坏死后3~4 h开始升高[16],我们又选择术后4 h的心电图检查,再次对模型小鼠心梗发生情况进行判断,同时,排除由于手术对心脏刺激可能造成的假阳性结果,并利用术后24 h TTC病理染色来验证心电图评估心梗发生的准确情况。最终,发现心电图评价心梗发生的准确性较高,且具有操作简便、结果获取迅速、不受场地时间限制、经济成本低等特点,故而在模型制备结果的评价中较其他活体检测方法有明显优势。
本研究成功构建了小鼠心肌梗死模型并利用TTC染色法明确区域。同时观察到,心梗模型小鼠早期心电图呈现出明显ST段抬高可以作为心梗发生的可靠依据,即心电图可以作为小鼠心梗模型早期快速无创评价的可靠方法。因此,本实验建立的关于小鼠心肌梗死模型的高效制作方法和无创评价手段为确切研究心梗病理生理及治疗机制提供了良好选择。
Establishment of mouse myocardial infarction model and early electrocardio- gram assessment
-
摘要:
目的 构建并优化小鼠心肌梗死模型,联合使用冠脉结扎术后即刻和术后4 h的两次肢体导联心电图对心梗发生情况进行早期评价。 方法 C57BL/6J雄性小鼠29只,异氟烷吸入麻醉后,经左侧第3/4肋间进入胸腔,结扎冠状动脉左前降支建立模型,施行术后即刻和术后4 h肢体导联心电图评价心梗发生情况。术后24 h打开胸腔观察梗死情况,留取心脏标本进行TTC染色确定梗死区域并计算梗死面积。 结果 小鼠行冠状动脉结扎术,术中死亡率为6.8%(2/29),术后早期(<4 h)死亡率为10.3%(3/29),24 h存活率为82.8%(24/29);术后24 h TTC染色明确梗死发生,则心梗模型建立,造模成功率为79.3%(23/29),平均梗死区域大小(梗死心肌重量/全心室重量)为(28±6)%;成功建立模型的小鼠在术后4 h心电图可见明显ST-T改变,提示心梗已发生。 结论 成功建立小鼠心肌梗死模型,且联合使用术后即刻和术后4 h两次心电图可以作为小鼠心肌梗死模型快速无创的评价方法。 Abstract:Objective To establish and optimize a mouse myocardial infarction (MI) model, and to use twice limb lead ECGs immediately after coronary ligation and 4 h after surgery to evaluate the occurrence of myocardial infarction. Methods Twenty-nine male C57BL/6J mice were anesthetized with isoflurane. then a myocardial infarction model was established by ligating the left anterior descending (LAD) coronary artery through the third/fourth intercostal space of left anterior chest. Immediate and 4 h postoperative limb lead ECGs were performed. Twenty-four hours after surgery, the chest was opened and the occurrence of myocardial infarction was evaluated. The heart samples were taken for TTC staining to determine the infarct area and calculate the infarct area. Results During the mice underwent coronary artery ligation the intraoperative mortality was 6.8% (2/29), and the early postoperative (<4 h) mortality was 10.3% (3/29). The 24 h survival rate was 82.8% (24/29). 24 hours after TTC staining confirmed the occurrence of infarction, the myocardial infarction model was established. The success rate of the model was 79.3% (23/29), and the average infarct size (infarcted myocardial weight / whole ventricular weight) was (28 ± 6)%; The mice successfully established by the model showed obvious ST-T changes in the ECG at 4 hours after surgery, suggesting that a myocardial infarction has occurred. Conclusions The mouse myocardial infarction model was successfully established. The combined use of ECG immediately after surgery and 4 h after surgery could be used as a rapid and non-invasive evaluation method for mouse myocardial infarction. -
Key words:
- myocardial infarction /
- mouse /
- animal model /
- ECG assessment /
- TTC staining
-
静脉用药调配中心(pharmacy intravenous ad-mixture services, PIVAS)是专为临床提供静脉用药调配服务的药品调剂部门。随着PIVAS业务的发展,人员配置、时间分配等诸多管理话题备受关注[1-4]。通常资源配置、时间管理及工作方式等管理决策的落地均需结合工作量情况,这是因为工作量不仅可用于绩效考核,也可用于衡量需求与供给是否匹配,是调整工作强度和实现最佳调配实践过程的关键组成部分,并且对静脉药物调配服务的提供有着深远的影响(诸如人员倦怠、供应短缺导致治疗延误、调配差错等不期望的结局)[5]。因而,客观选择能够代表工作量的关键指标进行准确量化及特征分析,对PIVAS工作模式的制定和优化具有重要意义。
据上海市药学会医院药学专委会PIVAS学组2022年统计数据显示,以长期医嘱(执行两次以上的定期医嘱)为调配工作类型的上海医疗机构高达97.4%,其中31.6%的机构仅接收执行此项工作[6]。因此,客观上存在管理决策匹配至长期医嘱工作的需求,以达到解决临床用药需求、保证准点交付及提高服务质量的目的。然而,现阶段PIVAS管理决策的匹配多依赖于实操经验,缺乏可靠的理论依据,主要原因是长期医嘱工作量特征没有得到细致量化的分析并在文献中进行报道。
按日期汇总的PIVAS长期医嘱工作量是典型的时间序列,而时间序列分析法目前较为成熟,已在金融、气象、医学等领域得到广泛应用[7]。该技术不仅可通过分解法识别变量存在的周期性、循环性、趋势性等变化特征,还可根据历史数据特征进行回归分析或机器学习等模型的构建及预测[8]。因此,本研究借助时间序列分析法对PIVAS长期医嘱工作量数据进行特征分析及预测,以期为PIVAS工作模式的制定提供参考。
1. 资料与方法
1.1 数据来源
数据来自复旦大学附属中山医院东院区PIVAS,选取2020年7月至2021年6月的长期医嘱日工作量整年周期数据,进行时间序列分析及预测模型构建,选取2021年7月的数据用于模型预测准确度的验证。
1.2 数据波动性分析
利用SPSS 25.0软件对获得的工作量数据绘制时间序列图。通过局部加权回归拟合函数(loess function)对序列进行季节和趋势分解[9],初步描述分析数据的长期趋势、季节波动、循环波动、不规则波动等重要特征。
1.3 预测模型构建及评价方法
基于数据的趋势性、季节性或平稳性假设,通过制定一个数学模型来捕捉现有的动态关系,理解数据生成过程,并可能在提出的假设限制内进行预测。传统的建模方法包括指数平滑、移动平均、多元线性回归和自回归综合移动平均等,可利用 SPSS 25.0软件直接进行统计分析以识别适合的建模方法。
1.3.1 数据预处理
预测模型的构建方法大多需要序列平稳假设的前提,即序列的均值和方差等基本统计量随时间保持不变。采用Eviews 11对时间序列数据进行单位根检验(ADF检验),以观察平稳性,若检验为非平稳序列则需进行差分运算,转化为平稳时间序列。
1.3.2 模型构建方法
应用SPSS 25.0软件中的“时间序列建模器”进行建模。根据序列的波动特征、自相关系数(ACF)及偏自相关系数(PACF)识别模型,通过试误法进行模型参数估计。以Ljung-Box统计量检验残差是否符合常态分配的基本假设,P>0.05说明模型构建成功;当拟合度(平稳R2和R2)>0.05、残差的ACF和PACF图无规律及拟合值与实际值的平均绝对误差(MAPE)<10%时,说明模型拟合效果好。
1.3.3 模型预测效果评价
利用所构建的时间序列模型进行样本外预测,并与实际值比较,通过相对误差百分比验证模型的预测能力。相对误差百分比(δ)= (预测值−实际值)/实际值×100%,δ<10%时说明模型预测有效。
2. 结果
2.1 波动特征
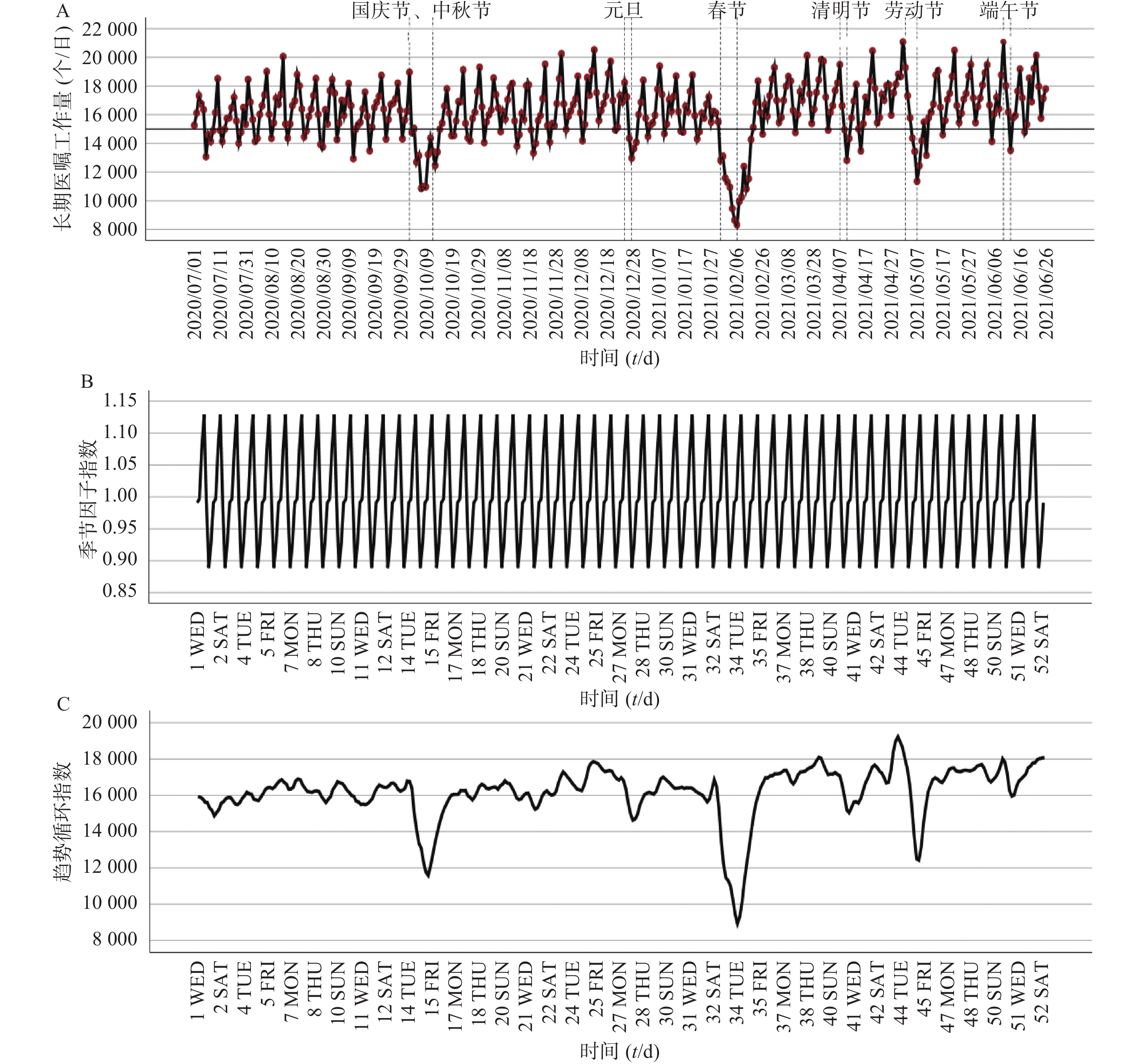
利用复旦大学附属中山医院东院区2020年7月至2021年6月PIVAS长期医嘱工作量数据,绘制原始序列图并进行时间序列分解。图1A为原始序列,由365个数据集成,工作量日均值为16188.55个,且整年数据基本维持在16000振幅波动,但极值(8326~21302)间相差约为2.5倍,说明PIVAS长期医嘱工作量的波动存在规律性及异常性等特征。时间序列分解结果表明:序列具有周期性、缓慢上升趋势及不规则变动等特征。图1B为季节因子序列,说明长期医嘱工作量数据遵循以7 d为周期的变动规律,单周期波动总体存在周一(谷值)至周六(峰值),先上升而后下降的模式;图1C为循环趋势序列,提示不规则变动均发生在国家法定节假日期间,且假期越长序列的不规则性越明显;工作量总体呈现缓慢上升趋势且在节假日前迎来高峰。
2.2 PIVAS长期医嘱工作量时间序列预测模型构建
2.2.1 时间序列平稳性检验
对PIVAS长期医嘱日工作量时间序列进行单位根ADF检验,检验结果表明:ADF统计值为−5.922 144,小于1%(−3.448 518)、5%(−2.869 442)、10%(−2.571 047)显著性水平的临界值(P<0.000 01),说明工作量时间序列不存在单位根,为平稳序列,符合时间序列模型构建要求。
2.2.2 模型评价
根据原始序列图的波动特征,将趋势及季节因素均纳入考虑的简单季节性模型、温特斯加法模型或温特斯乘法模型建模,最终选取温特斯乘法模型。该模型Ljung-Box统计量的显著性值大于0.05(P=0.060),表明模型正确,说明所观测的序列中不存在模型无法解释的结构(图2)。拟合参数平稳R2=0.549、R2=0.777、残差的ACF和PACF图无规律性(图2A);工作量拟合图拟合值波动趋势与实际值基本吻合(图2B),且 MAPE=4.45%(<10%),说明模型拟合效果好。
2.2.3 模型预测效果评价
工作量预测结果的波动特征呈现明显的周期性特征(图2B)。表1显示,2021年7月长期医嘱工作量的短期预测误差处于10%之内,且平均相对偏差为3.81%,说明模型有效。
表 1 2021年7月静脉用药调配中心实际工作量与预测工作量的比较日期 实际工作量(袋) 预测工作量(袋) 相对误差(%) 2021-07-01 17467 18161 3.97 2021-07-02 19722 19495 −1.15 2021-07-03 18732 20386 8.83 2021-07-04 17317 17890 3.31 2021-07-05 15412 15962 3.57 2021-07-06 16238 16726 3.01 2021-07-07 18796 17942 −4.54 2021-07-08 16766 18197 8.54 2021-07-09 20154 19534 −3.08 2021-07-10 18697 20427 9.25 2021-07-11 17521 17926 2.31 2021-07-12 15295 15994 4.57 2021-07-13 16088 16759 4.17 2021-07-14 17495 17978 2.76 2021-07-15 17968 18233 1.47 2021-07-16 20266 19573 −3.42 2021-07-17 19986 20468 2.41 2021-07-18 17335 17962 3.62 2021-07-19 14618 16026 9.63 2021-07-20 16982 16793 −1.11 2021-07-21 16879 18014 6.72 2021-07-22 18567 18270 −1.60 2021-07-23 20632 19612 −4.94 2021-07-24 20689 20508 −0.87 2021-07-25 16998 17997 5.88 2021-07-26 16086 16058 −0.17 2021-07-27 16675 16826 0.91 2021-07-28 17929 18049 0.67 2021-07-29 17634 18306 3.81 2021-07-30 20090 19651 −2.19 2021-07-31 21755 20549 −5.54 3. 讨论
前期通过文献查阅梳理出可以代表工作量的常见指标[10-12],主要包括“日调配时间”、“日输液袋量”、“日用药支数”及“日注射剂总量”。通过相关性分析(表2)发现,指标间均存在显著正相关,说明指标间可能存在某种联系,一定程度均可以代表工作量。尽管按输液量(袋数)计算的日调配量是现今PIVAS工作量评价共识[12],但该指标更适用于周转过程的统计,并不能较好体现输液制备过程的工作难易程度。此外,“日调配时间”指标统计过程的规范化程度,以及“日用药支数”指标忽略大容量注射剂(输液)统计导致的大容量注射剂工作量缺失,均可能引发工作量特征量化的准确性争议。因此,基于指标参数获取的准确性、PIVAS长期医嘱工作结构、过程及结果的综合考虑,本研究最终选择“日注射剂总量”(即每日注射剂总量,包含大容量注射剂)作为长期医嘱工作量指标。该指标参数不仅可直接从医院信息系统(HIS系统)获得,而且一定程度体现了工作强度及药品使用情况,有助于建立管理和PIVAS医嘱工作量之间的统计关联。
表 2 主要指标的相关系数矩阵(n=365)变量 均值 标准差 日调配
时间
(min)日输液量
(袋)日用药量
(支)日调配时间
(min)3045.96 399.749 日输液量
(袋)3087.49 312.444 0.908** 日用药量
(支)13101.06 1775.484 0.839** 0.879** 日注射剂
总量(个)16188.55 2055.580 0.863** 0.911** 0.997** 注:**P<0.01。 研究发现长期医嘱工作量波动具有明显的周期性、受节假日因素影响的不规则变动以及不明显的缓慢增长趋势等特征。有意思的是,多项研究证实门急诊日诊量波动具有同样的波动特征[13-14],说明医院工作模式可能是影响医疗机构内日工作量波动的关键因素。需要注意的是,PIVAS药学服务在医疗机构中属于下游服务节点,存在滞后性,从而导致工作量波动特征存在周一谷值和周六峰值等现象。此外,波动性还可能受临床患者住院时间的主观因素影响,包括入院期、出院期、床位周转率、化疗周期以及患者手术择期选择等因素[15]。后续有必要采用相关性分析等手段进一步验证假设,从而建立与临床数据间的联系,以便更好地为临床服务。随后课题组将波动特征规律运用到PIVAS运营管理中,制订了一些措施,取得较好成效。如:(1)周六及节假日初期充足准备,中后期直至工作日来临适当减少,一旦进入工作日周期又逐步增加的资源配备;(2)通过周排班模式合理搭配、均衡人力配置原则来统筹协调人力资源;(3)每周周一盘点,周二物资采购,周五补充,来保障物资供应以应对周内工作量攀升压力。
简单季节模型、温特斯乘法模型均能提供准确预测,基于贝叶斯信息准则最小原则选择温特斯乘法模型。温斯特乘法模型具有实践轻松简单、高预测精度的优点,然而仍存在一定的局限性,体现在其主要通过提取时间序列中季节变动及长期趋势因素建模,对于元旦、春节等节假日信息提取不足,从而可能降低预测值的精确度。导致这一结果的根本原因是节假日的时间跨度不明确,后期将收集更多长期医嘱工作量数据以便丰富数据,考虑构建长期记忆模型以便将元旦等节假日因素纳入模型中,从而使预测更精准。
综上所述,本研究所采用的时间序列分析法为科学分析与预测PIVAS长期医嘱工作量变化提供了思路,该方法实现简单,可行性强,准确度高,对药房管理有一定指导和实践意义。然而,真实世界中的数据存在固有的复杂性,不存在适用于任何环境的通用模型,如受天气或流感爆发等因素影响时,可进行及时的短期分析以实现更精确的近期预测。
-
表 1 小鼠心梗模型失败原因分析及解决方法
失败时段 比例(%) 原因分析 只数 解决方法 术中死亡 6.8 术中心脏破裂致死 1 控制穿刺深度和宽度 术中气胸致死 1 穿刺结扎迅速,快速闭合胸腔 术后死亡 10.3 术后胸腔出血致死 2 保证视野开阔,用纱布保护胸壁及肺,避免刺破大血管和肺脏 术后致死型心律失常致死 1 结扎动作迅速轻柔,减少对心脏的刺激 其他 3.4 术后未发生心梗 1 (造模失败) 表 2 23只小鼠心肌梗死区大小情况
项目 体重/g 全心室重量(M1)/mg 梗死心肌重量(M2)/mg 梗死大小(M2/M1)/(%) 总计( $ {\rm{\bar X}} $ ±s)29.65±5.35 76±13 21.91±7.06 28±6 -
[1] THYGESEN K, ALPERT J S, JAFFE A S, et al. Third universal definition of myocardial infarction[J]. Glob Heart,2012,7(4):275-295. doi: 10.1016/j.gheart.2012.08.001 [2] EMELIA J. BENJAMIN, MICHAEL J. BLAHA, STEPHANIE E. CHIUVE. Heart disease and stroke statistics—2017 Update: A Report From the American Heart Association[J]. Circulation,2017,135(10):e146-e603. [3] HEUSCH G, GERSH B J. The pathophysiology of acute myocardial infarction and strategies of protection beyond reperfusion: a continual challenge[J]. Eur Heart J,2016:ehw224. doi: 10.1093/eurheartj/ehw224 [4] KUMAR M, KASALA E R, BODDULURU L N, et al. Animal models of myocardial infarction: Mainstay in clinical translation[J]. Regul Toxicol Pharmacol,2016,76:221-230. doi: 10.1016/j.yrtph.2016.03.005 [5] TANG Y P, LIU Y, FAN Y J, et al. To develop a novel animal model of myocardial infarction: a research imperative[J]. Anim Models Exp Med,2018,1(1):36-39. doi: 10.1002/ame2.12010 [6] GAO E H, LEI Y H, SHANG X Y, et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse[J]. Circ Res,2010,107(12):1445-1453. doi: 10.1161/CIRCRESAHA.110.223925 [7] GUO Y R, WU W J, QIU Y M, et al. Demonstration of an early and a late phase of ischemic preconditioning in mice[J]. Am J Physiol-Heart Circ Physiol,1998,275(4):H1375-H1387. doi: 10.1152/ajpheart.1998.275.4.H1375 [8] GAO F, KATAOKA M, LIU N, et al. Therapeutic role of miR-19a/19b in cardiac regeneration and protection from myocardial infarction[J]. Nat Commun,2019,10:1802. doi: 10.1038/s41467-019-09530-1 [9] ROJAS S V, KENSAH G, ROTAERMEL A, et al. Transplantation of purified iPSC-derived cardiomyocytes in myocardial infarction[J]. PLoS One,2017,12(5):e0173222. doi: 10.1371/journal.pone.0173222 [10] CAHILL T J, CHOUDHURY R P, RILEY P R. Heart regeneration and repair after myocardial infarction: translational opportunities for novel therapeutics[J]. Nat Rev Drug Discov,2017,16(10):699-717. doi: 10.1038/nrd.2017.106 [11] TAO B, GAO H K, ZHENG M W, et al. Preclinical modeling and multimodality imaging of chronic myocardial infarction in minipigs induced by novel interventional embolization technique[J]. EJNMMI Res,2016,6(1):59. doi: 10.1186/s13550-016-0214-7 [12] KOLK M V V, MEYBERG D, DEUSE T, et al. LAD-ligation: a murine model of myocardial infarction[J]. J Vis Exp,2009,14(32):1438. [13] MICHAEL L H, ENTMAN M L, HARTLEY C J, et al. Myocardial ischemia and reperfusion: a murine model[J]. Am J Physiol-Heart Circ Physiol,1995,269(6):H2147-H2154. doi: 10.1152/ajpheart.1995.269.6.H2147 [14] KATHERINE C. WU, JOãO A.C. LIMA. Noninvasive imaging of myocardial viability: current techniques and future developments[J]. Circ Res,2003,93(12):1146-58. doi: 10.1161/01.RES.0000103863.40055.E8 [15] GRAY G A, WHITE C I, THOMSON A, et al. Imaging the healing murine myocardial infarctin vivo: ultrasound, magnetic resonance imaging and fluorescence molecular tomography[J]. Exp Physiol,2013,98(3):606-613. doi: 10.1113/expphysiol.2012.064741 [16] CUMMINS B, AUCKLAND M L, CUMMINS P. Cardiac-specific troponin-l radioimmunoassay in the diagnosis of acute myocardial infarction[J]. Am Heart J,1987,113(6):1333-1344. doi: 10.1016/0002-8703(87)90645-4 -





 下载:
下载:

 下载:
下载: