-
1960年,Jenning首次提出了心肌再灌注损伤的概念[1]。心肌缺血/再灌注损伤的主要原因包括氧自由基增多、细胞内钙超载及微血管损伤等[2-3],缺血组织细胞恢复灌注后发生的再灌注损伤(MIRI)在恢复血流的过程中常会引起心肌细胞的氧化应激损伤[4-5],往往造成患者预后不佳 [6]。
升陷汤出自张锡纯《医学衷中参西录》,该方由黄芪、柴胡、升麻、桔梗、知母组成,主治大气下陷之证,临床广泛用来防治心肌缺血性疾病[7]、治疗老年慢性充血性心力衰竭[8]、治疗不稳定型心绞痛[9]、治疗青少年病毒性心肌炎[10-11]。课题组前期考察了升陷汤及各单味药对阿霉素致心肌细胞的保护作用[12],尚未见升陷汤对心肌细胞缺氧/复氧损伤模型保护作用的报道。本实验基于经典的心肌细胞缺氧/复氧损伤模型[13],从细胞凋亡的角度初步探讨升陷汤及单味药对心肌缺氧/复氧的作用机制。
-
纯净水(美国Millipore公司)、Fura-3/AM(碧云天生物技术有限公司)、生理盐水(海军军医大学附属长征医院);0.25%胰蛋白酶溶液(Gibco公司);DMEM低糖培养基、培养液(美国Hyclone公司);MTT工作液(美国sigma公司);二甲基亚砜(德国GmbH公司);PBS缓冲液(南京滴纯生物科技有限公司);胎牛血清(美国Gibco公司);DCFH-DA(碧云天生物有限公司);Annexin V-FITC/PI 凋亡检测试剂盒(美国BD公司);16%甲醛(无甲醇,赛默飞世尔科技有限公司);其他试剂为分析纯。
倒置荧光显微镜(重庆奥特光学仪器);流式细胞仪(美国BD公司);全自动酶标仪(美国Multiskan MK3公司);CO2细胞培养箱(德国Heraeus公司);低温高速离心机(德国Heraeus公司);台式高速离心机(德国Eppendorf公司);荧光显微镜(日本OLYMPUS公司);二氧化碳培养箱(美国Forma公司);79-1型磁力搅拌器(江苏周庄科研仪器厂);YJ-II型超声波细胞粉碎机(上海新芝生物技术研究所);海尔低温冰箱。
-
升陷汤中五味药材饮片由长征医院药材科提供。将5 L水浸泡升陷汤全方提取物或各单味药材24 h后,再煎煮,重复3次,将浓缩水煎煮液合并至650 ml,干燥得提取物浸膏。其中,升陷汤组方饮片(简称药物SXT)包括黄芪600 g,知母300 g,柴胡150 g,桔梗150 g和升麻100 g。SXT、黄芪、知母、柴胡、桔梗和升麻水提液蒸干后的浸膏重量分别为431.2、187.5、89.5、45.2、43.5、28.1 g。将所有提取物分别研细,于−20°C冰箱中保存备用。
-
H9C2细胞培养在含10% FBS的高糖DMEM培养液、37 ℃、5% CO2、95% O2饱和湿度的恒温细胞培养箱,待细胞汇合度达到80%~90%进行传代培养。传代时,弃去培养液,用PBS缓冲液洗2~3次后用含0.25%胰蛋白酶消化液消化细胞,待细胞变圆时立刻停止消化,以1000 r/min离心5 min。弃上清液,用含10% FBS 的DMEM培养基重悬后,并按1∶3分瓶,隔天更换培养液。取对数生长期细胞进行试验。
-
将心肌细胞随机分为以下8组:对照组:心肌细胞正常培养基培养;模型组:心肌细胞用低糖无血清培养基预孵育1 h后,在含95% N2和5%CO2的培养箱中缺氧6 h,再在5% CO2和95%空气饱和的培养箱复氧1 h造成心肌缺血损伤模型组;药物干预组:心肌细胞用低糖无血清培养基稀释的药物预孵育1 h后,经缺氧6 h-复氧1 h处理后即为药物干预组。其中,干预药物包括SXT、黄芪、知母、柴胡、桔梗和升麻水提液(共6组)。
-
培养完成后,将对照组和模型组组以及药物干预组中取对数期生长的细胞接种于96孔板,调整细胞的浓度使每孔有5×105个细胞,然后向每孔中加入20 μl MTT(5 mg/ml)工作液,孵育一段时间,后向每孔中加入150 μl DMSO,室温条件先低速震荡让二者充分融合,然后参照MTT比色法试剂盒说明,在490 nm测定各孔下的吸光值,分别记录结果。模型组、各药物干预组与对照组的比值为细胞活力相对值。
-
培养完成后,分别收集所有组中悬浮细胞,在各组细胞中加入150 μl DCFH-DA溶液,在37 ℃细胞培养箱内避光孵育30 min。每隔5 min震荡1次,使探针和细胞充分接触。用无血清细胞培养液将细胞洗几遍,最后用PBS重悬。采用多功能酶标仪检测细胞内ROS活性(激发波长488 nm,检测波长525 nm)。
-
培养结束后,用0.25%胰酶消化离心,分别将所有组中细胞用缓冲液PBS冲洗,再与10 μmol/L钙离子荧光探针Fura-3/AM(10)共同孵育60 min,然后用缓冲液冲洗2次,最后用PBS重悬。将制成的标本置于倒置荧光显微镜下,用340 nm紫外光激发获得荧光图像,经过计算机图像处理后根据标准曲线算出细胞内钙浓度。
-
培养完成的细胞用不含 EDTA 的胰酶消化,离心收集悬浮细胞,2 000 r/min离心5 min,弃培养基;用预冷的PBS洗涤细胞;加入100 μl结合缓冲液悬浮细胞,浓度约为 1 × 106/ml;然后在细胞悬浮液中加入5 μl Annexin V-FITC,轻轻混匀后于 4 ℃ 避光条件下孵育 15 min;再加入 5 μl PI 后轻轻混匀于 4 ℃ 避光条件下孵育5 min;添加PBS至500 μl并轻轻震摇均匀,于60 min内用流式细胞仪检测细胞凋亡率。
-
使用GraphPad Prism v5.0统计软件进行统计学分析,实验数据以(
$\bar x \pm s$ )表示,组内两两比较采用t-test,当P < 0.05时判定差异具有统计学意义。 -
本实验根据临床给药剂量及预实验结果,在药物试验浓度分别为2.5、5.0、10.0、20.0、40.0、80.0、160.0和320.0 μg/ml的药物浸膏时,研究全方及各单味药对心肌细胞缺氧/复氧后细胞活力的影响。MTT结果显示:升陷汤、黄芪、知母、桔梗、升麻在20 μg/ml时,细胞活力最佳,因此确定上述提取物浓度组均为20 μg/ml;由于20 μg/ml柴胡提取物对心肌细胞有一定损伤,经试验最终确定药物浓度为0.3 μg/ml时对缺氧/复氧后细胞活力无明显影响(表1)。
表 1 升陷汤各单味药对缺氧/复氧造成的心肌细胞活力的影响
组别 终浓度(μg/ml) MTT增殖率(%) 全方 20 18.745 黄芪 20 14.300 知母 20 11.199 桔梗 20 9.244 升麻 20 10.977 柴胡 0.3 26.512 -
实验结果表明:心肌细胞在缺氧/复氧条件下,细胞内活性氧含量明显增加,升高至对照组的2.49倍(P<0.01,图1),表明缺氧/复氧引起细胞内自由基损伤;给药后,除柴胡外,升陷汤全方及各单味药均能明显降低心肌缺氧/复氧致心肌损伤模型的细胞内ROS的荧光强度,升陷汤全方、黄芪、知母、桔梗和升麻处理组分别为对照组的1.46、1.40、1.79、1.52和1.83倍(P<0.01,图1)。其中,升陷汤与黄芪作用最强,两者无明显统计学差异。
-
实验结果表明:心肌细胞在常氧下(对照组),Ca2+荧光强度较低,缺氧/复氧后,Ca2+荧光强度增加(P<0.01,图2),表明心肌细胞低氧/复氧时存在Ca2+超载。升陷汤全方和黄芪、知母药物干预后,各组细胞内荧光强度与模型组相比,分别降低了15.20%、23.98%和15.79%(P<0.05,图2),表明其对低氧/复氧时心肌细胞内Ca2+ 超载有抑制作用。桔梗、升麻药物处理后,上述值虽然有降低,但差异不明显。
-
采用Annexin V-FITC/Pl双染流式细胞术检测药物对缺氧/复氧损伤后心肌细胞凋亡情况。从检测结果发现,心肌细胞在常氧下(对照组),细胞凋亡较低;缺氧/复氧后,细胞凋亡增加;给药组中升陷汤全方、黄芪、桔梗可以降低细胞的凋亡率(P<0.05,图3)。
-
心肌细胞缺氧/复氧损伤是模拟MIRI的病理生理过程的经典模型,心肌细胞短时间内缺血再灌注造成的组织细胞功能代谢发生障碍及结构功能破坏加重,甚至发生不可逆性损伤的现象[14]。Ca2+超载一直被认为是心肌缺血再灌注的主要机制。缺血缺氧时,心肌细胞内Ca2+超载,线粒体膜的通透性转换孔开放;再灌注恢复使得心肌细胞重新摄取O2,产生大量的线粒体内活性氧,进一步增加线粒体胞质内的Ca2+浓度,线粒体的氧化磷酸化进而受阻促使心肌细胞死亡[15-16]。另外,线粒体内活性氧触发氧化应激反应并加重心肌细胞的凋亡和坏死[17-19]。由此可见,细胞内ROS活性和Ca2+浓度是MIRI重要的检测指标[20-21]。
本课题组前期采用大鼠冠状动脉结扎急性心肌缺血致慢性心力衰竭模型,心肌组织病理学切片证实了升陷汤全方对心肌细胞损伤和炎症发展起到有效的控制作用,通过药理指标测定结合代谢组学研究证实了升陷汤对心衰具有显著的治疗作用。升陷汤通过改善心肌细胞损伤,减少炎症反应,增强左室射血功能,调节机体磷脂代谢和脂肪酸生物合成来发挥其保护心肌作用,从而治疗慢性心力衰竭[22-23]。本课题组通过体外细胞实验从缺氧/复氧致心肌细胞损伤角度,基于心肌细胞活力角度考察并证实了升陷汤的保护作用,可通过抑制细胞凋亡、降低细胞内ROS以及Ca2+的浓度实现。同时,发现各单味药也具有一定的保护作用,但弱于全方的保护功效,进一步证实了全方治疗“大气下陷”的合理性。升陷汤全方是以黄芪补气升陷为主药,知母凉润制主药之温燥,柴胡、升麻助黄芪升陷之力,桔梗载药力上达胸中,共奏升补大气之效[24]。药材柴胡提取液在本实验中尚未发现具有保护缺氧/复氧损伤心肌细胞的作用,在一定程度上证实了其他药味配伍的合理有效性。
Protective effect of Shengxian decoction and the decoction of single herb component against myocardial injury induced by hypoxia/reoxygenation
-
摘要:
目的 通过观察升陷汤及单味药材水提物对离体培养的大鼠心肌细胞缺氧/复氧损伤的影响,并对其作用机制进行初步探讨。 方法 培养H9C2大鼠心肌细胞,共分成8组:空白对照组,缺氧/复氧组(模型组),缺氧复氧损伤后药物干预组(升陷汤全方及5个单味药材水提物组)。分别对心肌细胞凋亡率、心肌细胞的活力、细胞内活性氧(ROS)活性、细胞内钙离子浓度(Ca2+)等指标进行检测。 结果 升陷汤全方及黄芪、知母等药材干预能明显降低细胞凋亡率、细胞内ROS活性和Ca2+浓度(P<0.05),其中,全方的作用最强。与缺氧/复氧组细胞内ROS活性和Ca2+浓度增加至空白对照组的2.49倍及1.71倍相比,全方能使细胞内ROS活性和Ca2+浓度增加率降至缺氧/复氧组的41.37%和15.20%。 结论 升陷汤及单味药材对缺氧/复氧致心肌损伤具有保护作用,该作用的机制可能通过抑制细胞凋亡、降低细胞内ROS以及Ca2+的浓度所致。 Abstract:Objective To study the protective effect of Shengxian decoction and the single herb decoction against myocardial injury induced by hypoxia/reoxygenation. Methods The H9c2 cells were cultured to establish hypoxia/reoxygenation model. Rats were divided into 8 groups: normal control group, hypoxia/reoxygenation group (model group) and treated groups (Shengxian decoction and the single herb decoction). The apoptotic rate of cardiomyocytes, the activity of reactive oxygen species (ROS) and intracellular calcium concentration (Ca2+) were measured. Results Compared with hypoxia/reoxygenation group, the apoptosis rate, ROS activity and intracellular Ca2+ concentration were significantly lower in all treated groups (P<0.05). The ROS activity and intracellular Ca2+ concentration was decreased by 41.37% and 15.20% in Shengxian decoction group compared to the model group. Conclusion Shengxian decoction and the single herb decoction had protective effect on myocardial injury induced by hypoxia/reoxygenation. -
Key words:
- Shengxian decoction /
- hypoxia/reoxygenation injury /
- cardiomyocyte /
- protection effect
-
非酒精性脂肪性肝病(NAFLD)是临床常见的肝脏疾病之一,其中,非酒精性脂肪性肝炎(NASH)是非酒精性脂肪肝(NAFL)向非酒精性脂肪性肝硬化转化过程中一个非常重要的环节[1]。非酒精性脂肪性肝炎发展到晚期将导致肝硬化的发生,最终进展为肝细胞癌(HCC),从而影响整体肝功能。因此,NASH的防治具有重要意义。七味脂肝方由垂盆草、豨莶草、牡蛎等七味药组成,处方源于岐黄学者、中医临床肝病专家季光教授临床经验的总结,长期临床应用显示对NASH具有很好的效果。本研究参考常用的NASH动物模型[2-4],选用蛋氨酸和胆碱缺乏(MCD)饮食诱导以及胆碱缺乏的高脂高胆固醇饮食(CDAHFHC)诱导的2个经典NASH的动物模型,研究七味脂肝方对NASH的药效作用,为临床用药提供科学的理论依据。
1. 材料与仪器
1.1 药物与试剂
七味脂肝方供试品(江苏康缘药业股份有限公司提供,批号:Z201001),根据项目组前期制定的提取工艺,将七味脂肝方制备成每1 g含6.19 g生药的浸膏粉;维生素E(VE)软胶囊(上海信谊延安药业有限公司,国药准字H31020237,批号:03210202);罗格列酮片(成都恒瑞制药有限公司,国药准字H20030569,批号:210601);丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、甘油三酯(TG)、胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)测定试剂盒(上海惠中生物科技有限公司,批号:01ALT210107、01AST210329、01ALP210222、02TG210330、01CHOL210226、01HDL210525、01LDL210302);乳酸脱氢酶(LDH)测定试剂盒(上海执诚生物科技有限公司,批号:ZCJULT019);游离脂肪酸(FFA)、总胆红素(TBIL)测定试剂盒(美康生物科技股份有限公司,批号:210609101、190731101);苏木素、伊红染色液(珠海贝索生物技术有限公司,批号:719041、719033);F4/80抗体,(Abcam,批号:1004577-2)。
1.2 仪器
全自动生化分析仪(日本东芝,型号:TBA-40R);全自动样品快速研磨仪(上海净信,型号:Tissuelyser-24);轮转式石蜡切片机、冷冻切片机、组织包埋机(徕卡显微系统(上海)贸易有限公司,型号:RM2235、CM1950、Histocore Amber);正置显微镜(日本OLYMPUS,型号:CX31RTSF)。
1.3 实验动物
Sprague-Dawley大鼠(SD大鼠),雄性,6周龄,体重200~250 g,48只,购自上海市计划生育科学研究所实验动物经营部,生产许可证号:SCXK(沪)2018-0006。C57BL/J小鼠,雌雄各半,6周龄,体重(24±2)g,96只,购置于上海吉辉实验动物饲养有限公司,生产许可证号:SCXK(沪)2017-0012。通过上海中医药大学实验动物中心实验动物伦理(伦理号:PZSHUTCM210625020)审查,实验动物使用许可证号:SYXK(沪)2018-0006,SPF级环境饲养。
2. 方法
2.1 造模与分组
2.1.1 MCD诱导的大鼠NASH模型
48只雄性SD大鼠,饲养于上海中医药大学实验动物中心,正常饮食,自由食水,观察7 d。第8天,根据动物体重按随机数字法随机分为对照组和模型组,除对照组外,其余动物饲料梯度替换为MCD饲料(正常饲料喂养;25%MCD饲料喂养2 d;50%MCD饲料喂养2 d;75%MCD饲料喂养2 d;100%MCD饲料喂养2周),自由食水。造模2周后,对模型组动物根据体重随机分组,分为模型组、七味脂肝方低剂量组(2.8 g/kg生药)、七味脂肝方中剂量组(5.6 g/kg生药)、七味脂肝方高剂量组(11.2 g/kg生药)、阳性对照VE组(40 mg/kg),每组8只。各给药组每天灌胃1次,连续28 d,对照组及模型组灌胃等量的生理盐水。
2.1.2 CDAHFHC诱导的小鼠NASH模型
96只C57BL/J小鼠,雌雄各半,饲养于上海中医药大学实验动物中心,正常饮食,自由食水,观察7 d。第8天,根据动物体重按随机数字法随机分为对照组和模型组,除对照组外,其余动物饲料梯度替换为CDAHFHD饲料(正常饲料喂养;25%CDAHFHC饲料喂养2 d;50%CDAHFHC饲料喂养2 d;75%CDAHFHC饲料喂养2 d;100%CDAHFHC饲料喂养2周),自由食水。造模2周后,对模型组动物根据体重随机分组,分为模型组、七味脂肝方低剂量组(4 g /kg生药)、七味脂肝方中剂量组(8 g/kg生药)、七味脂肝方高剂量组(16 g/kg生药)、阳性对照罗格列酮组(RSG,1.14 mg/kg),每组16只。各给药组每天灌胃1次,连续28 d,对照组及模型组灌胃等量的生理盐水。
2.2 检测方法
2.2.1 血清肝功能和血脂生化指标检测
使用全自动生化分析仪测定ALT、AST、ALP、LDH、TG、TC、HDL-C、LDL-C、TBIL、FFA在血清中的水平。
2.2.2 肝组织脂质水平检测
取新鲜肝脏组织样本,加入1∶9(质量体积比)的匀浆介质(乙醇∶丙酮=1∶1),冰浴条件下匀浆,置于冰箱4 ℃过夜,4 000 r/min离心15 min,收集上清液样本,使用全自动生化分析仪测定TG、TC、HDL-C、LDL-C在肝脏组织中的水平。
2.2.3 肝脏组织病理学评价
肝脏左叶样本固定后,经组织脱水,石蜡包埋,将其切成4 μm的石蜡切片。
(1)HE染色
取肝脏石蜡切片样本,经HE染色,用正置显微镜拍照并评价肝脏病理变化。NASH病理诊断标准采用NAFLD活动度积分(NAS)进行评估(具体评判标准见表1)。
表 1 NAFLD活动度积分(NAS)组织学评分判断标准评分 肝细胞脂肪变(%) 小叶内炎症 肝细胞气球样变 0 <5 无病灶 无 1 5~33 <2 少量气球样细胞 2 34~66 2~4 较多/显著气球样变 3 >66 >4 注:NAS≥5分可明确NASH的诊断;NAS<3分则可排除NASH;两者之间者为NASH可能。 (2)Masson染色
取肝脏石蜡切片样本,经Masson三色染色,通过正置显微镜观察并拍照记录,评价肝组织纤维化程度。Masson染色纤维化诊断评分参照以下评分标准(表2)。
表 2 肝纤维化分期评分判断标准评分 纤维化程度 0 无 1 窦周或汇管区纤维化 2 窦周和汇管区周围纤维化 3 桥接纤维化 4 肝硬化 (3)免疫组织化学染色
取肝脏石蜡切片样本,经F4/80抗体免疫组织化学染色,通过正置显微镜观察并拍照记录,评价肝组织中Kupffer细胞的活化程度。
2.3 统计方法
所有计量资料采用平均值±标准偏差(
$ \bar{x}\pm s $ )表示。计量资料采用单因素方差分析(one-sample Kolmogorov-Smirnov test)进行数据分布判断,正态分布时采用参数检验的单因素方差分析(ANOVA),偏态分布时采用非参数检验(Mann-Whitney test)。所有数据均使用GraphPad Prism 8软件进行统计并进行图表制作。3. 结果
3.1 对肝脏形态、肝重及肝脏指数的影响
3.1.1 MCD诱导的大鼠NASH模型实验结果
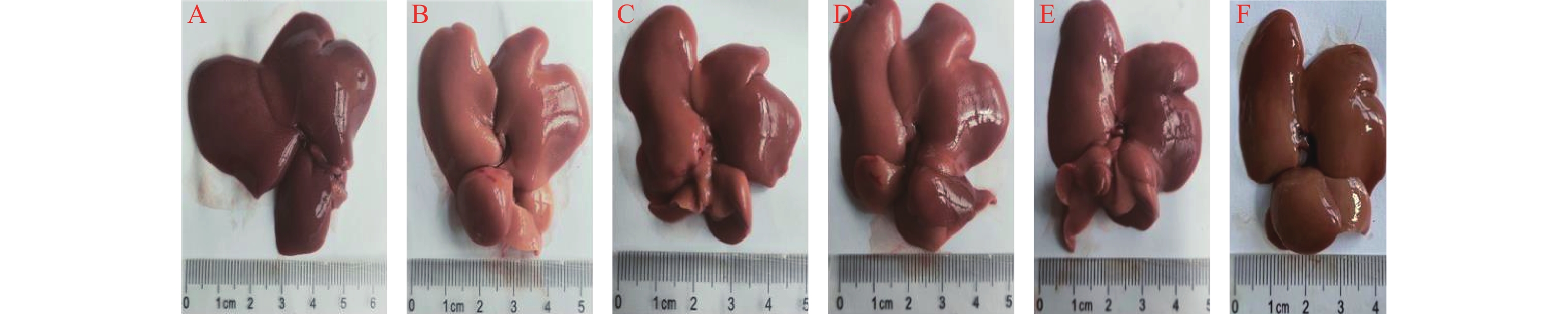
对照组肝脏表面光滑,色深红,质地软,有弹性,肝叶边缘锐利。与对照组相比,模型组肝脏体积增大,颜色变浅;与模型组相比,七味脂肝方各剂量组和阳性对照VE组可以观察到肝脏颜色稍红,各组均可一定程度改善肝脏形态,结果见图1和表3。
表 3 大鼠体重、肝脏重量及肝脏指数($ \bar{{x}}\pm {s} $ )组别 动物数(n) 体重(m/g) 肝重(m/g) 肝指数(%) 对照组 8 397.28±31.15 10.46±1.15 2.63±0.14 模型组 8 202.19±15.56## 6.91±1.10## 3.41±0.42## 七味脂肝方低剂量组 8 202.75±14.72 7.31±1.08 3.59±0.34 七味脂肝方中剂量组 8 202.98±17.39 7.90±1.54 3.88±0.57 七味脂肝方高剂量组 8 201.83±16.04 7.82±0.90 3.88±0.43* 阳性对照VE组 8 201.83±11.16 7.22±0.57 3.59±0.34 *P<0.05,与模型组比较; ##P<0.01,与对照组比较。 3.1.2 CDAHFHC诱导的小鼠NASH模型实验结果
对照组肝脏表面光滑,色深红,质地软,有弹性,肝叶边缘锐利;与对照组相比,模型组肝脏体积增大,颜色变浅;与模型组相比,七味脂肝方各剂量组和阳性对照RSG组可以观察到肝脏颜色稍红,各组均可一定程度改善肝脏形态,结果见图2。
与对照组相比,模型组肝脏重量、肝脏指数显著升高(P<0.01);与模型组相比,七味脂肝方的各剂量组和阳性对照RSG组均能显著降低肝脏重量(P<0.05或P<0.01),七味脂肝方的中、高剂量组和阳性对照RSG组能显著降低肝脏指数(P<0.01),结果见表4。
表 4 小鼠体重、肝脏重量及肝脏指数($ \bar{x}\pm {s} $ )组别 动物数(n) 体重(m/g) 肝重(m/g) 肝指数(%) 对照组 16 22.12±2.00 0.91±0.16 4.11±0.47 模型组 16 18.91±1.36## 1.69±0.15## 8.96±0.62## 七味脂肝方低剂量组 16 18.59±1.01 1.56±0.20* 8.41±1.06 七味脂肝方中剂量组 16 18.48±1.08 1.51±0.18** 8.17±0.72** 七味脂肝方高剂量组 16 18.32±1.03 1.54±0.13** 8.38±0.53** 阳性对照RSG组 16 19.14±1.34 1.56±0.18* 8.16±0.68** *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与对照组比较。 3.2 对血清肝功能、血脂水平的影响
3.2.1 MCD诱导的大鼠NASH模型实验结果
与对照组相比,模型组血清ALT水平显著升高(P<0.01);与模型组相比,七味脂肝方中剂量组血清ALT水平显著降低(P<0.05),七味脂肝方中、高剂量组可改善血清ALP、LDH、HDL水平,结果见表5、表6。
表 5 大鼠血清肝功能数据($ \bar{x}\pm {s}$ )组别 动物数(n) ALT(U/L) AST(U/L) ALP(U/L) LDH(U/L) 对照组 8 45.50±3.38 165.38±24.80 88.50±15.73 1547.50 ±243.04模型组 8 107.25±32.84## 187.50±24.36 93.75±32.65 1250.00 ±235.02#七味脂肝方低剂量组 8 107.00±37.80 195.88±25.90 87.25±24.54 1263.00 ±451.90七味脂肝方中剂量组 8 69.38±16.33* 171.25±19.91 63.13±18.76* 886.88±304.48* 七味脂肝方高剂量组 8 114.13±51.86 177.88±44.05 89.75±34.65 855.88±375.75* 阳性对照VE组 8 111.00±15.76 165.75±16.61 128.50±58.52 1219.63 ±368.75*P<0.05,与模型组比较;#P<0.05,##P<0.01,与对照组比较。 表 6 大鼠血脂4项数据($ \bar{x}\pm {s} $ )组别 动物数(n) TG(mmol/L) TC(mmol/L) HDL(mmol/L) LDL(mmol/L) 对照组 8 0.32±0.10 1.12±0.22 0.28±0.03 0.15±0.02 模型组 8 0.23±0.05# 0.83±0.18# 0.32±0.06 0.14±0.04 七味脂肝方低剂量组 8 0.29±0.07 0.93±0.12 0.38±0.07 0.15±0.03 七味脂肝方中剂量组 8 0.32±0.19 1.25±0.51* 0.49±0.19* 0.21±0.08 七味脂肝方高剂量组 8 0.23±0.06 1.20±0.26** 0.48±0.10** 0.21±0.08 阳性对照VE组 8 0.23±0.05 0.84±0.23 0.33±0.12 0.15±0.04 *P<0.05,**P<0.01,与模型组比较;#P<0.05,与对照组比较。 3.2.2 CDAHFHC诱导的小鼠NASH模型结果
与对照组相比,模型组血清ALT、AST、ALP、LDH、TG、TC、LDL水平显著升高(P<0.01),HDL水平显著降低(P<0.01);与模型组相比,七味脂肝方低剂量组血清ALP、TG水平显著降低(P<0.05或P<0.01),七味脂肝方中剂量组血清LDH、TG水平显著降低(P<0.05),七味脂肝方高剂量组血清ALT、AST、ALP、LDH、TG水平显著降低(P<0.05或P<0.01),阳性对照RSG组血清ALT水平显著降低(P<0.05),结果见表7和表8。
表 7 小鼠血清肝功能数据($\bar{x}\pm {s}$ )组别 动物数(n) ALT(U/L) AST(U/L) ALP(U/L) LDH(U/L) 对照组 16 35.13±6.08 146.06±43.63 88.31±9.41 653.94±145.10 模型组 16 606.06±111.12## 486.31±69.39## 216.19±28.30## 1390.25 ±128.14##七味脂肝方低剂量组 16 561.44±98.43 440.69±67.29 179.06±46.80* 1347.19 ±150.78七味脂肝方中剂量组 16 553.00±116.35 442.94±72.95 198.06±32.64 1261.69 ±122.55*七味脂肝方高剂量组 16 486.63±88.90** 406.25±75.39** 189.94±34.09* 1161.00 ±134.22**阳性对照RSG组 16 513.56±91.17* 441.81±70.00 273.94±43.98** 1328.75 ±160.91*P<0.05,**P<0.01,与模型组比较;##P<0.01,与对照组比较。 表 8 小鼠血脂4项数据($\bar{x}\pm {s}$ )组别 动物数(n) TG(mmol/L) TC(mmol/L) HDL(mmol/L) LDL(mmol/L) 对照组 16 0.82±0.39 2.70±0.42 1.64±0.35 0.18±0.03 模型组 16 1.27±0.26## 3.45±0.55## 0.93±0.29## 0.57±0.17## 七味脂肝方低剂量组 16 1.01±0.25** 3.29±0.61 0.91±0.19 0.55±0.18 七味脂肝方中剂量组 16 1.01±0.31* 3.46±0.52 0.99±0.26 0.59±0.13 七味脂肝方高剂量组 16 1.01±0.29* 3.37±0.34 0.99±0.13 0.57±0.10 阳性对照RSG组 16 1.10±0.28 3.33±0.79 0.94±0.32 0.56±0.15 *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与对照组比较。 与对照组相比,模型组血清TBIL、FFA水平显著升高(P<0.01);与模型组相比,七味脂肝方高剂量组和阳性对照RSG组血清TBIL水平显著降低(P<0.05)。结果见表9。
表 9 小鼠血清TBIL、FFA数据($\bar{x}\pm {s}$ )组别 动物数(n) TBIL(μmol/L) FFA(mmol/L) 对照组 16 3.59±0.55 1.41±0.31 模型组 16 7.77±1.52## 2.16±0.46## 七味脂肝方低剂量组 16 6.95±1.78 2.01±0.43 七味脂肝方中剂量组 16 7.79±3.97 1.98±0.49 七味脂肝方高剂量组 16 6.37±1.72* 2.16±0.49 阳性对照RSG组 16 9.09±1.69* 2.20±0.55 *P<0.05,与模型组比较; ##P<0.01,与对照组比较。 3.3 对肝脏脂质水平的影响
3.3.1 MCD诱导的大鼠NASH模型实验结果
与对照组相比,模型组肝脏TG水平显著升高(P<0.01),HDL水平显著降低(P<0.01);与模型组相比,阳性对照VE组肝脏HDL水平显著升高(P<0.01),结果见表10。
表 10 大鼠肝脏脂质水平($\bar{x}\pm {s}$ )组别 动物数(n) TG(mmol/g) TC(mmol/g) HDL(mmol/g) LDL(mmol/g) 对照组 8 3.93±0.56 1.49±0.16 0.11±0.03 0.67±0.08 模型组 8 5.97±0.53## 1.14±0.13## 0.03±0.02## 0.25±0.13## 七味脂肝方低剂量组 8 5.73±0.82 1.03±0.12 0.02±0.02 0.27±0.10 七味脂肝方中剂量组 8 5.57±0.93 1.14±0.12 0.03±0.03 0.31±0.07 七味脂肝方高剂量组 8 5.93±0.81 1.10±0.14 0.02±0.01 0.27±0.08 阳性对照VE组 8 7.25±1.40* 1.21±0.15 0.08±0.02** 0.34±0.09 *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与对照组比较。 3.3.2 CDAHFHC诱导的小鼠NASH模型实验结果
与对照组相比,模型组肝脏TG、TC水平显著升高(P<0.01);与模型组相比,七味脂肝方高剂量组肝脏TG水平显著降低(P<0.01),结果见表11。
表 11 小鼠肝脏脂质水平($\bar{x}\pm {s}$ )组别 动物数(n) TG(mmol/g) TC(mmol/g) HDL(mmol/g) LDL(mmol/g) 对照组 16 3.54±1.98 1.04±0.15 0.20±0.07 0.35±0.11 模型组 16 8.78±0.89## 2.29±0.21## 0.47±0.13## 0.42±0.21 七味脂肝方低剂量组 16 8.54±1.04 2.20±0.20 0.47±0.08 0.36±0.16 七味脂肝方中剂量组 16 8.69±1.54 2.28±0.31 0.49±0.09 0.43±0.17 七味脂肝方高剂量组 16 7.85±0.79** 2.12±0.39 0.45±0.14 0.39±0.24 阳性对照RSG组 16 8.44±0.97 2.12±0.26 0.47±0.09 0.36±0.16 **P<0.01,与模型组比较; ##P<0.01,与对照组比较。 3.4 对肝脏病理NAS评分的影响
3.4.1 MCD诱导的大鼠NASH模型HE染色实验结果
对照组大鼠肝小叶结构完整,肝细胞排列整齐,肝板以中央静脉为中心呈放射状排列,未见明显病理性改变。
模型组镜下可见广泛的肝细胞空泡变性,中央静脉及汇管区周围可见肝细胞坏死,小叶间炎症细胞浸润,肝小叶结构被破坏。与对照组相比,模型组脂肪变性、小叶内炎症及NAS评分显著升高(P<0.01)。
与模型组相比,七味脂肝方的各给药组和阳性对照VE组可明显减轻小叶内炎症程度。与模型组相比,七味脂肝方低、中、高剂量组和阳性对照VE组小叶内炎症评分显著降低(P<0.05或P<0.01),七味脂肝方的中剂量组和阳性对照VE组NAS评分显著降低,结果见表12。
表 12 大鼠肝脏NAS评分($\bar{x}\pm {s}$ )组别 动物数(n) 脂肪变性 小叶内炎症 气球样变 NAS 对照组 8 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 模型组 8 2.88±0.35## 1.63±0.52## 0.00±0.00 4.50±0.76## 七味脂肝方低剂量组 8 3.00±0.00 1.00±0.00* 0.38±0.52 4.38±0.52 七味脂肝方中剂量组 8 3.00±0.00 0.88±0.35* 0.00±0.00 3.88±0.35* 七味脂肝方高剂量组 7 3.00±0.00 0.86±0.38* 0.00±0.00 3.86±0.38 阳性对照VE组 8 3.00±0.00 0.63±0.52** 0.00±0.00 3.63±0.52* *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与对照组比较。 3.4.2 CDAHFHC诱导的小鼠NASH模型HE染色实验结果
对照组肝小叶结构完整,肝细胞排列整齐,肝板以中央静脉为中心呈放射状排列,未见明显病理性改变。
模型组镜下可见广泛的肝细胞空泡变性,中央静脉及汇管区周围可见肝细胞点状或灶状坏死,小叶间炎性细胞浸润,肝小叶结构被破坏,较多个肝细胞呈气球样变。与对照组相比,模型组脂肪变性、小叶内炎症、气球样变及NAS评分显著升高。
与模型组相比,七味脂肝方中、高剂量组可有效减轻炎性灶数量和肝细胞气球样变,显著降低小叶内炎症程度评分、气球样变评分及NAS评分(P<0.01),阳性对照RSG组可减轻小叶内炎症程度,显著降低小叶内炎症程度评分及NAS评分(P<0.01),结果见表13。
表 13 小鼠肝脏NAS评分($\bar{x}\pm {s}$ )组别 动物数(n) 脂肪变性 小叶内炎症 气球样变 NAS 对照组 16 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 模型组 16 3.00±0.00## 2.81±0.40## 1.88±0.34## 7.69±0.48## 七味脂肝方低剂量组 16 3.00±0.00 2.56±0.51 1.69±0.48 7.25±0.86 七味脂肝方中剂量组 16 3.00±0.00 2.13±0.34** 1.38±0.50** 6.50±0.73** 七味脂肝方高剂量组 16 3.00±0.00 1.88±0.34** 1.31±0.48** 6.19±0.66** 阳性对照VE组 16 3.00±0.00 2.19±0.40** 1.56±0.51 6.75±0.68** **P<0.01,与模型组比较; ##P<0.01,与对照组比较。 3.5 对肝脏Masson染色及纤维化评分的影响
CDAHFHC诱导的小鼠NASH模型Masson染色结果显示,对照组肝小叶结构完整,肝细胞排列整齐,汇管区结构清晰,被染成蓝色的纤维结缔组织分布在肝小叶间血管和胆管周围,汇管区周围的纤维结缔组织呈围管状包绕血管及胆管分支。
模型组可见肝细胞点状或灶状坏死,炎症细胞浸润,镜下多个视野可见小叶内和汇管区周围被染成蓝色的胶原纤维增生。与对照组相比,模型组纤维化评分显著升高(P<0.01)。
与模型组相比,七味脂肝方的中、高剂量组可观察到肝小叶内和汇管区周围胶原纤维增生情况明显减轻,并呈现一定程度的剂量梯度效应;阳性对照RSG组在肝小叶和汇管区周围的胶原纤维增生情况也可得到一定程度的改善。与模型组相比,七味脂肝方的高剂量组纤维化评分显著降低(P<0.05),结果见表14。
表 14 小鼠肝脏纤维化分期评分($\bar{x}\pm {s}$ )组别 动物数(n) 纤维化分期评分 对照组 16 0.00±0.00 模型组 16 1.56±0.51## 七味脂肝方低剂量组 16 1.75±0.45 七味脂肝方中剂量组 16 1.44±0.51 七味脂肝方高剂量组 16 1.19±0.40* 阳性对照RSG组 16 1.25±0.45 *P<0.05,与模型组比较; ##P<0.01,与对照组比较。 3.6 对肝脏Kupffer细胞的影响
MCD诱导的大鼠和CDAHFHC诱导的小鼠NASH模型F4/80免疫组织化学染色结果显示,对照组大鼠肝脏Kupffer细胞处于静息状态,为不规则或树枝状分布。
模型组可观察到在肝小叶炎性灶及汇管区周围大量的被激活的Kupffer细胞,呈现花冠状分布,被F4/80标记的阳性细胞数明显增加。
与模型组相比,七味脂肝方的中、高剂量组显示被F4/80标记的阳性细胞数密度降低,Kupffer细胞活化程度明显减弱,花冠状分布程度明显减轻,呈一定程度的浓度依赖;阳性对照VE组和RSG组同样可减轻Kupffer细胞活化程度,与文献报道一致,结果见图3、图4。
4. 讨论
NASH是在非酒精性肝脂肪变基础上形成的,出现血清生化酶学超过正常值上限,肝穿刺病理组织学显示肝细胞脂肪变>5%,伴有炎症及肝细胞损伤(如气球样变),并除外导致肝脂肪变的其他原因,如大量饮酒、长期应用促脂肪形成药物或单基因遗传紊乱等的疾病[1]。近年来,关于NASH发病机制的研究已取得很大进展,但目前治疗选择非常有限[5-6],FDA、SFDA尚未批准针对该疾病的有效药物。权威指南中推荐使用的药物有维生素E、吡格列酮等,但这些药物的有效性和安全性存在争议[7-8]。目前,防治NASH的主要方法以生活方式干预为主,其他方法包括降糖、降脂和保肝的间接对症治疗,降低导致NASH的高危因素的相关疾病,使患者间接获益。
中医药因具有多因子、多靶点和多环节的协同药理效应,在治疗该类疾病具有独特的优势,在治NASH方面取得了一定进展[9-11]。非酒精性脂肪性肝炎并无确切中医学病名[12],根据其临床表现可归属于“肝癖”、“胁痛”、“黄疸”等范畴。病位主要涉及肝脾,病久及肾。由于过食肥甘厚味,运化失职,使谷精不能尽化气血而凝为膏脂,导致肝失疏泄、脾失健运,痰浊淤积于肝;脾胃为气机升降之枢,湿浊困脾,脾气不升,一身气机运化失常,加剧肝气郁结和肝络失养。
七味脂肝方中酒豨莶草、垂盆草清热解毒、利湿退黄,二药合为君药;煅牡蛎软坚散结,《珍珠囊》谓其可“软痞积”,《本草纲目》谓“化痰软坚,清热除湿”,山楂消食积,散淤血,《本草纲目》认为其可“化饮食,消肉积,癥瘕,痰饮痞满吞酸,滞血痛胀”,海藻消痰软坚散结,利水消肿,三药共为臣药;虎杖协同加强解毒、化瘀、退黄之功效,为佐药;醋五味子收敛固涩、益气生津、补肾宁心,可补五脏气,为使药。全方七味药物相辅相成,达到湿、痰、瘀、毒兼顾,利湿解毒,消痰散结,用于NASH湿热痰瘀互结证。现代药理学表明,方中垂盆草中的槲皮素[13]、虎杖中的虎杖苷等成分均对NASH有一定治疗作用[14-15]。
NASH是一种更严重的NAFLD病理类型,NASH的特征是存在肝细胞损伤、肝脂肪变性、炎症和纤维化,进而发生肝硬化并增加肝细胞癌的风险[16]。在NASH发展过程中,肝脏内脂肪合成量不断上升,代谢功能逐渐下降,肝脏对脂质的摄取和代谢能力随之减弱,导致脂质代谢过程中TC、TG和LDL-c含量升高,同时受损的肝细胞还会释放AST、ALT活力到血液中,导致AST、ALT活力升高,这些指标的异常变化可作为NASH的标志[17]。肝内过量的脂质沉积可导致炎症反应,促使单纯性脂肪肝向NASH的病理进展[18]。肝纤维化是肝细胞外基质的弥漫性过度沉积与异常分布,是肝脏对慢性损伤的病理性修复反应。目前,肝组织病理学检查仍是肝纤维化诊断的“金标准”。目前的科学研究普遍认为,Kupffer细胞对NAFLD的发生和发展至关重要,如果它们被适度激活,可以发挥防御作用,但如果它们被过度激活,将释放大量的促炎细胞因子,这对肝组织和其他细胞会造成一定程度的损伤。已有文献表明,活化的肝脏巨噬细胞可以促进NASH的进展[19]。
本研究在MCD诱导的大鼠和CDAHFD诱导的小鼠两个经典NASH模型的实验结果显示,经过2周的诱导后,模型组的肝脏质量以及ALT、AST、ALP、LDH、TG、TC、LDL、TBIL及FFA水平显著高于对照组,HE、Masson及免疫组化染色显示,肝脏组织炎症和肝细胞脂肪变性严重,NAS评分显著增加,肝小叶内和汇管区周围胶原纤维增生及Kupffer细胞活化程度加重,说明建立NASH模型成功。经4周的给药后,七味脂肝方能显著降低上述指标,此外,HE、Masson及免疫组化染色显示,七味脂肝方能显著减轻肝脏组织炎症程度,降低肝脏组织病理NAS评分,减轻肝纤维化及Kupffer细胞活化程度。说明七味脂肝方能有效降低血脂、调节肝脏脂质代谢紊乱,改善NASH小鼠肝脏炎症损伤向肝纤维化发展的趋势,改善肝脏组织病理损伤,从而有效减缓并改善NASH的进展程度。
NASH的发病机制尚未完全阐明,目前公认的是“多重打击”理论,其认为胰岛素抵抗、脂肪毒性、炎症、氧化应激等多种致病因素共同导致了NASH的发生发展,而炎症在NASH的恶化过程中扮演着至关重要的角色[18]。肝脏具有密集的吞噬细胞网络,在非炎症条件下维持耐受性,并快速感知肝细胞损伤和氧化应激信号,导致促炎级联反应的激活。在损伤后,白细胞迅速渗入肝实质,通过产生可溶性介质激活其他免疫细胞和非实质细胞群,从而促进炎症和纤维化的发生。炎症介质可以激活肝星状细胞(HSCs),HSCs是肝纤维化形成过程中的主要效应细胞,导致细胞外基质过度沉积,形成创伤愈合或瘢痕反应,进一步促进纤维化发展。活化的HSCs产生促炎介质,进而使肝脏炎症持续存在,导致炎症的慢性循环和瘢痕组织的形成,最终导致器官衰竭[20]。因此,抑制炎症对于NASH的预防和治疗具有重要意义,深入理解NASH相关的炎症信号通路(NF-κB和MAPK等),并找到能够有效靶向特定炎症的靶点,将为治疗NASH提供更多的思路和新的策略。已有多次报道NF-κB信号通路参与NASH中炎症反应,损伤相关分子模式(DAMPs)激活Kupffer细胞,诱导细胞内的NF-κB信号激活[21]。本研究病理染色结果证明,七味脂肝方可减少炎性浸润,减轻肝纤维化程度,改善NASH动物肝脏的病理表现,后续将继续探究七味脂肝方药效物质基础作用的炎症通路,进一步阐明其治疗NASH的机制。
本研究结果初步提示,七味脂肝方可能是通过改善NASH肝脏炎症损伤,继而阻碍其向肝纤维化发展的趋势来发挥药效,为其后续机制探究提供研究方向。针对目前的NASH临床需求,七味脂肝方具有较好的临床价值。
-
表 1 升陷汤各单味药对缺氧/复氧造成的心肌细胞活力的影响
组别 终浓度(μg/ml) MTT增殖率(%) 全方 20 18.745 黄芪 20 14.300 知母 20 11.199 桔梗 20 9.244 升麻 20 10.977 柴胡 0.3 26.512 -
[1] SEWELL W H, KOTH D R, HUGGINS C E. Ventricular fibrillation in dogs after sudden return of flow to the coronary artery[J]. Surgery,1955,38(6):1050-1053. [2] RANA A, GOYAL N, AHLAWAT A, et al. Mechanisms involved in attenuated cardio-protective role of ischemic preconditioning in metabolic disorders[J]. Perfusion,2015,30(2):94-105. doi: 10.1177/0267659114536760 [3] 陈福晖, 刘达兴, 容松. 心肌缺血再灌注损伤发生机制的研究进展[J]. 安徽医药, 2017, 21(12):2145-2148. doi: 10.3969/j.issn.1009-6469.2017.12.003 [4] CHANG G L, ZHANG D Y, YU H, et al. Cardioprotective effects of exenatide against oxidative stress-induced injury[J]. Int J Mol Med,2013,32(5):1011-1020. doi: 10.3892/ijmm.2013.1475 [5] 宋旭辉. Decorin在脑缺血防治中的功能及机制研究[D]. 上海: 第二军医大学, 2010. [6] 吴立玲, 张幼怡. 心血管病理生理学[M]. 北京: 北京大学医学出版社, 2009: 8. [7] 康红钰, 张福华, 刘喜民, 等. 升陷汤对大鼠急性心肌缺血作用机制的探讨[J]. 中国医院药学杂志, 2007, 27(5):617-619. doi: 10.3321/j.issn:1001-5213.2007.05.018 [8] 张万义, 邱云卿, 张万芬. 升补宗气法治疗老年慢性充血性心力衰竭疗效观察[J]. 中国中西医结合杂志, 2004, 24(1):43. doi: 10.3321/j.issn:1003-5370.2004.01.035 [9] 裴天仙, 徐长庆, 李滨, 等. 槲皮素对阿霉素致小鼠心肌损伤的保护作用及其机制[J]. 药学学报, 2007, 42(10):1029-1033. doi: 10.3321/j.issn:0513-4870.2007.10.004 [10] 曹洪欣, 朱海燕. 大气下陷证与病毒性心肌炎相关性机理的理论探讨[J]. 陕西中医, 2002, 23(2):141. doi: 10.3969/j.issn.1000-7369.2002.02.035 [11] 曹洪欣, 朱海燕. 益气升陷法治疗病毒性心肌炎的辨治要点[J]. 中医药学报, 2002, 30(5):18-19. doi: 10.3969/j.issn.1002-2392.2002.05.010 [12] 满缓, 张凤, 黄豆豆, 等. 升陷汤及各单味药对阿霉素致心肌细胞损伤的保护作用[J]. 药学实践杂志, 2019, 37(4):304-308. doi: 10.3969/j.issn.1006-0111.2019.04.004 [13] THANDROYEN F T, BELLOTTO D, KATAYAMA A, et al. Subcellular electrolyte alterations during progressive hypoxia and following reoxygenation in isolated neonatal rat ventricular myocytes[J]. Circ Res,1992,71(1):106-119. doi: 10.1161/01.RES.71.1.106 [14] MIMURO S, KATOH T, SUZUKI A, et al. Deterioration of myocardial injury due to dexmedetomidine administration after myocardial ischaemia[J]. Resuscitation,2010,81(12):1714-1717. doi: 10.1016/j.resuscitation.2010.07.021 [15] MIYAMAE M, CAMACHO S A, WEINER M W, et al. Attenuation of postischemic reperfusion injury is related to prevention of [Ca2+]m overload in rat hearts[J]. Am J Physiol,1996,271(5 Pt 2):H2145-H2153. [16] HAUSENLOY D J, YELLON D M. Myocardial ischemia-reperfusion injury: a neglected therapeutic target[J]. J Clin Invest,2013,123(1):92-100. doi: 10.1172/JCI62874 [17] JIANG J T, YUAN X, WANG T, et al. Antioxidative and cardioprotective effects of total flavonoids extracted from Dracocephalum moldavica L. against acute ischemia/reperfusion-induced myocardial injury in isolated rat heart[J]. Cardiovasc Toxicol,2014,14(1):74-82. doi: 10.1007/s12012-013-9221-3 [18] ZHOU M J, REN H H, HAN J C, et al. Protective effects of kaempferol against myocardial ischemia/reperfusion injury in isolated rat heart via antioxidant activity and inhibition of glycogen synthase kinase-3β[J]. Oxid Med Cell Longev,2015,2015:481405. [19] MOENS A L, CLAEYS M J, TIMMERMANS J P, et al. Myocardial ischemia/reperfusion-injury, a clinical view on a complex pathophysiological process[J]. Int J Cardiol,2005,100(2):179-190. doi: 10.1016/j.ijcard.2004.04.013 [20] MOZAFFARI M S, LIU J Y, ABEBE W, et al. Mechanisms of load dependency of myocardial ischemia reperfusion injury[J]. Am J Cardiovasc Dis,2013,3(4):180-196. [21] NEUHOF C, NEUHOF H. Calpain system and its involvement in myocardial ischemia and reperfusion injury[J]. World J Cardiol,2014,6(7):638-652. doi: 10.4330/wjc.v6.i7.638 [22] ZHANG F, ZHAN Q, DONG X, et al. Shengxian decoction in chronic heart failure treatment and synergistic property of Platycodonis Radix: a metabolomic approach and its application[J]. Mol Biosyst,2014,10(8):2055-2063. doi: 10.1039/C4MB00055B [23] ZHANG F, ZHAN Q, GAO S H, et al. Chemical profile- and pharmacokinetics-based investigation of the synergistic property of platycodonis Radix in traditional Chinese medicine For Mula Shengxian decoction[J]. J Ethnopharmacol,2014,152(3):497-507. doi: 10.1016/j.jep.2014.01.033 [24] 杨承芝, 朱爱华. 浅析张锡纯大气下陷证与升陷汤[J]. 中国中医药现代远程教育, 2014, 12(14):116-117. doi: 10.3969/j.issn.1672-2779.2014.14.072 -





 下载:
下载:
















 下载:
下载:





