-
METRNL(Meteorin-like)是一个新发现的分泌蛋白,为神经营养调节因子Meteorin的同源蛋白。2014年,本实验室首次报道METRNL是一个新的脂肪因子,由于其在皮下白色脂肪组织中表达很丰富,故也称为Subfatin[1]。10年来,我们对METRNL的功能进行了多方面的探索,并不断扩展METRNL的研究工具与平台。我们的研究已发现,该蛋白参与调节机体多种病理生理过程,比如:脂肪细胞METRNL可促进白色脂肪分化、脂质代谢并抑制脂肪炎症,从而抵抗高脂饮食诱导的胰岛素抵抗[2];肠上皮细胞METRNL参与调节肠道抗菌肽的平衡[3],且肠道METRNL缺乏会加重溃疡性结肠炎[4];此外,METRNL促进小鼠皮肤创伤愈合[5],并能对抗D-半乳糖诱导的衰老小鼠的认知功能障碍[6]。最近,我们新报道了血液METRNL的主要分泌来源是血管内皮细胞,并发现内皮细胞METRNL对维持血管内皮正常功能和对抗动脉粥样硬化具有重要作用[7]。在这些研究中,我们构建METRNL基因的全身性和各种组织特异性的敲除小鼠,以及多种双基因敲除小鼠,并在体外细胞实验中充分利用METRNL重组蛋白探索相关治疗学意义。除了本实验室,全球其他多个实验室也展开了对METRNL的功能探索,并发现METRNL在能量代谢[8-9]、炎症[10-11]、心脏疾病[12-13]等多种病理生理过程中发挥积极作用。
尽管目前有很多关于METRNL的研究结果提示,该蛋白具有非常好的临床治疗潜力,但有关整体METRNL治疗学探索不多,尤其是长期治疗研究几乎没有。主要原因之一是市场METRNL重组蛋白价格昂贵,而且我们前期研究结果发现:对C57BL/6J 小鼠单次静脉注射1.75 µg METRNL重组蛋白后,血清METRNL在15 min后急剧升高(226 ng/ml),接着在4 h内迅速下降约90%。虽然在注射后24 h仍明显高于基础水平,但此时血中METRNL浓度已下降约97%[2]。因此,以重组蛋白给药方式在动物整体水平研究METRNL的治疗学作用,尤其是长期治疗学作用将产生巨大经济成本。另一方面,对于一些已经体现METRNL治疗潜力的疾病(如动脉粥样硬化),疾病发展缓慢,短期给予METRNL重组蛋白很难起到治疗作用。
因此,本研究旨在构建一株长期稳定高表达METRNL的小鼠作为METRNL的治疗学研究工具,并对该小鼠高表达METRNL的情况进行验证。
-
鼠尾DNA提取试剂盒(CW2094S)购自北京康伟试剂生物科技有限公司;5 × PrimeScript RT Master Mix(Takara 公司);小鼠Tubulin抗体( AT819,碧云天公司);通用型RNA提取试剂盒Ⅱ(AG21022,艾瑞克生物科技);Human Meteorin-like/METRNL DuoSet ELISA试剂盒(DY7867-05,R&D system公司);山羊抗兔 IgG(ab175471)、山羊抗小鼠 IgG(ab216772)、抗METRNL抗体(ab235775)购自Abcam公司。
LightCycler96实时荧光定量PCR仪(Roche公司);TP600PCR仪(Takara公司);5200S化学发光分析系统(Tanon公司)。
-
人METRNL基因条件性过表达(R26-LSL-METRNL+/-)小鼠为实验室前期构建所得。SPF级8周龄 C57BL/6J 小鼠和Dppa-Cre小鼠购自上海南方模式生物技术有限公司。
所有实验小鼠均饲养在独立通气笼盒(IVC)系统中,温度(24±2)℃,相对湿度为40%~60%,饲养期间笼盒内保持清洁,小鼠在笼内自由活动、进食及饮水,动物房内照明系统为自动控制(12 h照明、12 h黑暗)。动物实验标准均依照国家《实验动物护理使用卫生指南》,并经过海军军医大学医学研究伦理委员会批准指导。
-
将剪刀消毒后剪取小鼠尾尖约3 mm,剪碎,按照DNA提取试剂盒的说明书方法提取DNA之后,对目的基因进行PCR扩增,各引物序列见表1。
表 1 PCR扩增实验中的引物序列
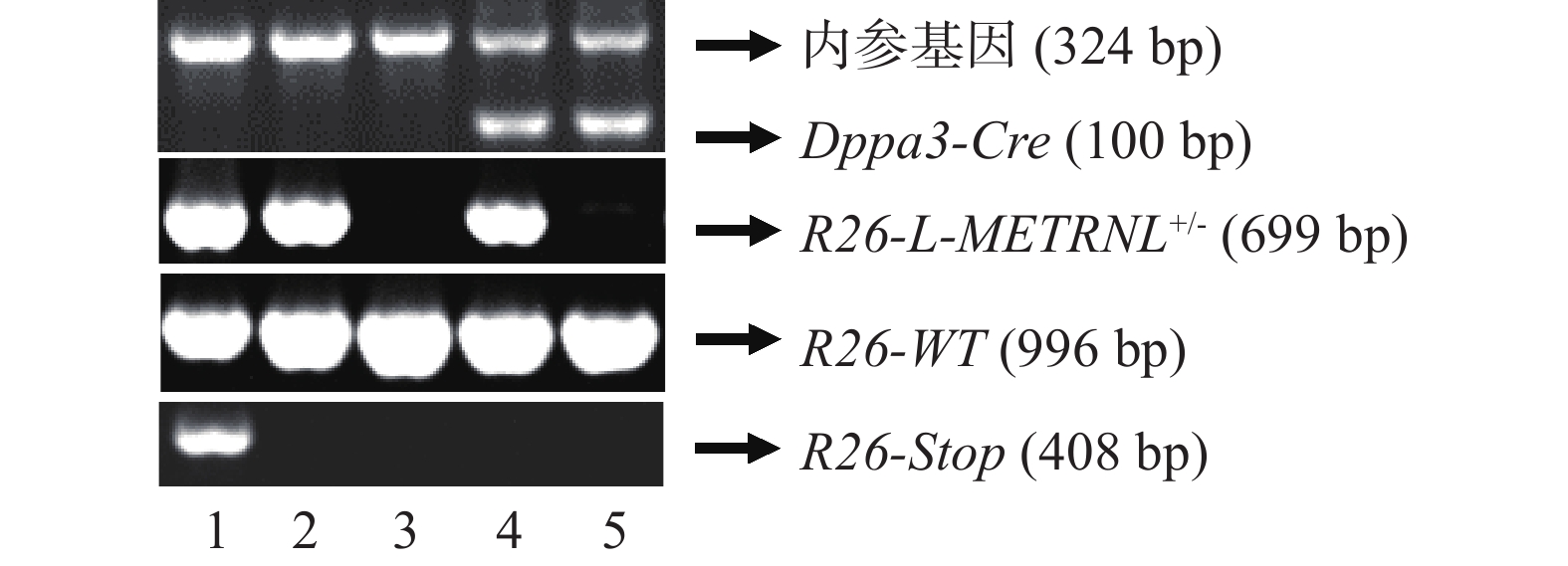
基因名称 上游引物(5’→3’) 下游引物(5’→3’) R26-WT TCAGATTCTTTTATAGGGGACACA TAAAGGCCACTCAATGCTCACTAA R26-L-METRNL AAAGTCCCGGAAAGGAGCTG GAGGCTCCATCCAGCAAGTT R26-Stop GGGCAACGTGCTGGTTATTG ACTTGCCCCTTGCTCCATAC 内参基因 TGGGTTGGGTGTCTGTTTCATTGT GATCCACCTGTCTCTGCCTTCC Dppa-Cre TGGGTTGGGTGTCTGTTTCATTGT GACCTTGCATTCCTTTGGCGAGAG 将PCR产物进行1.2% 琼脂糖凝胶电泳,上样量为每孔6 μl,电泳条件为100 V,30 min,结束后进行拍照、分析。
-
将小鼠称重后,腹腔注射1%戊巴比妥钠溶液(100 mg/kg),待小鼠处于深度麻醉后,打开其胸腔,自上下腔静脉汇合处缓慢抽取血液,并转移至1.5 ml EP管静置于室温。迅速剪取小鼠心、肝、脾、肺、肾、脑、白色脂肪和肌肉组织,放入组织冻存管扔进液氮速冻,待取材结束后及时转入−80 ℃超低温冰箱储存。血液于室温静置2 h后离心:4 ℃,3000×g,15 min,分离血清,储存至−80 ℃超低温冰箱。
-
使用RNA提取试剂盒提取组织RNA,将得到的RNA进行浓度测定与吸光度测定后进行逆转录,得到cDNA用于实时荧光定量PCR实验,各引物序列见表2。
表 2 实时荧光定量PCR实验中的引物序列
基因名称 上游引物(5′→3′) 下游引物(5′→3′) 人 METRNL ACCAGCGACTTCGTAATTCAC CAGCTCCACGTCATGGGTG 小鼠 Gapdh GTATGACTCCACTCACGGCAAA GGTCTCGCTCCTGGAAGATG -
取适量组织至2 ml高速离心管,加入蛋白裂解液后,使用高通量匀浆仪匀浆240 s。取出高速离心管,离心:12000 × g,20 min。将上清液转移至另一干净1.5 ml EP管中,进行蛋白浓度测定,剩余样品加入5 × 蛋白上样缓冲液,97 ℃变性10 min得到蛋白样品。
使用10% SDS-PAGE凝胶进行电泳,电泳条件为:150 V,60 min。使用PVDF膜进行转膜,转膜条件为100 V,60 min。
转膜结束后,使用快速封闭液封闭15 min,之后使用1×TBST缓冲液洗膜,5 min × 3次。加入一抗(1∶1000稀释)4 ℃孵育过夜。次日去除一抗孵育液,使用1 × TBST缓冲液洗膜,5 min × 3次。加入二抗孵育液(1∶2 000稀释)常温孵育1 h,用1 × TBST缓冲液洗去二抗,5 min × 4次,结束后即可进行扫膜。
-
使用酶联免疫吸附实验试剂盒(DY7867-05)测定小鼠血清中的METRNL水平,具体操作按照试剂盒说明书进行。
-
实验数据使用GraphPad Prism 8.0进行统计分析。两组间的比较使用双尾t检验,P<0.05视为差异有统计学意义。
-
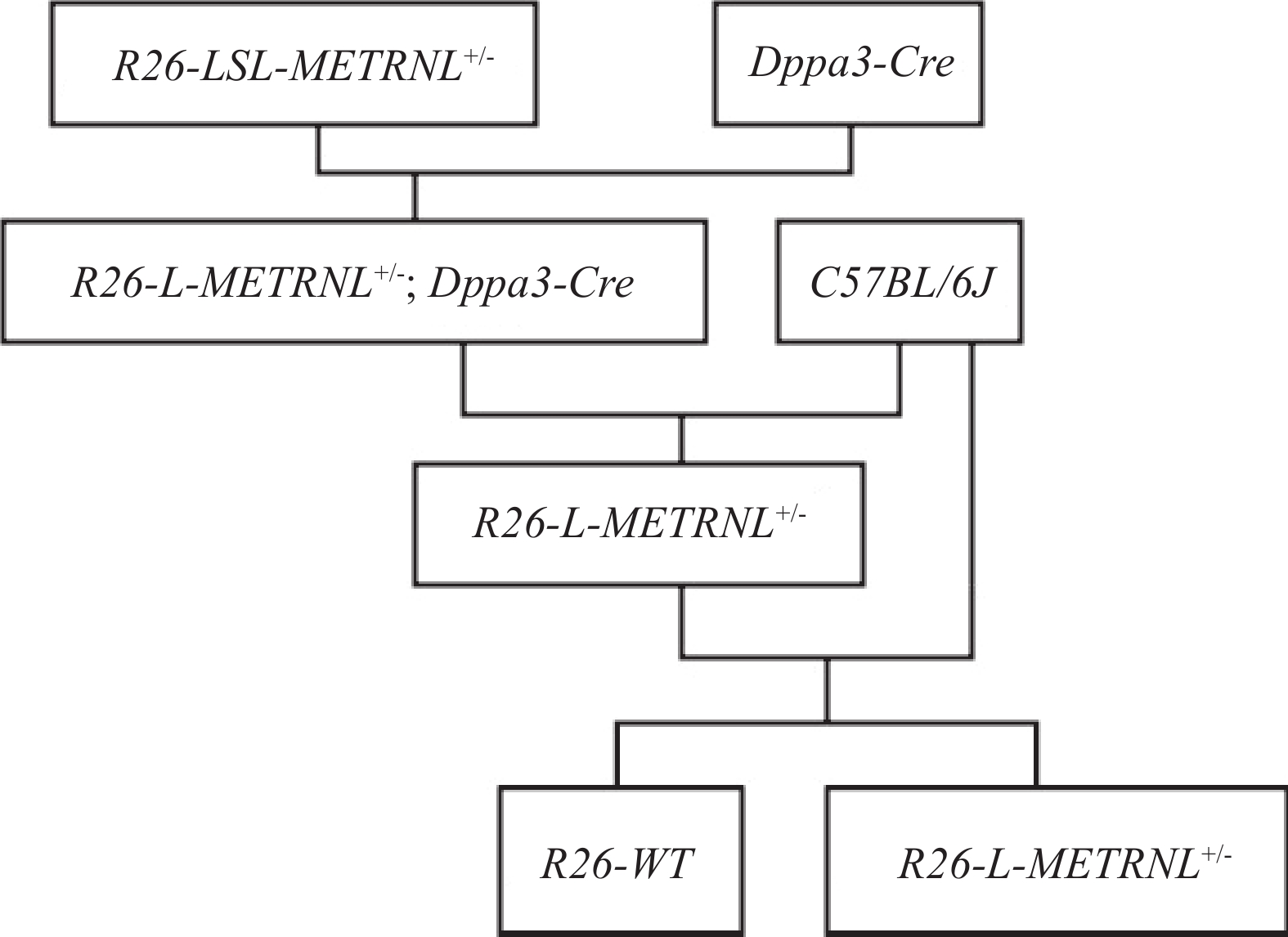
本研究基于前期构建好的人METRNL基因条件性过表达小鼠(简称为R26-LSL-METRNL+/-小鼠)和Cre-LoxP技术,最终获得全身过表达人METRNL基因小鼠(简称为R26-L-METRNL+/-小鼠),具体构建策略如图1所示。
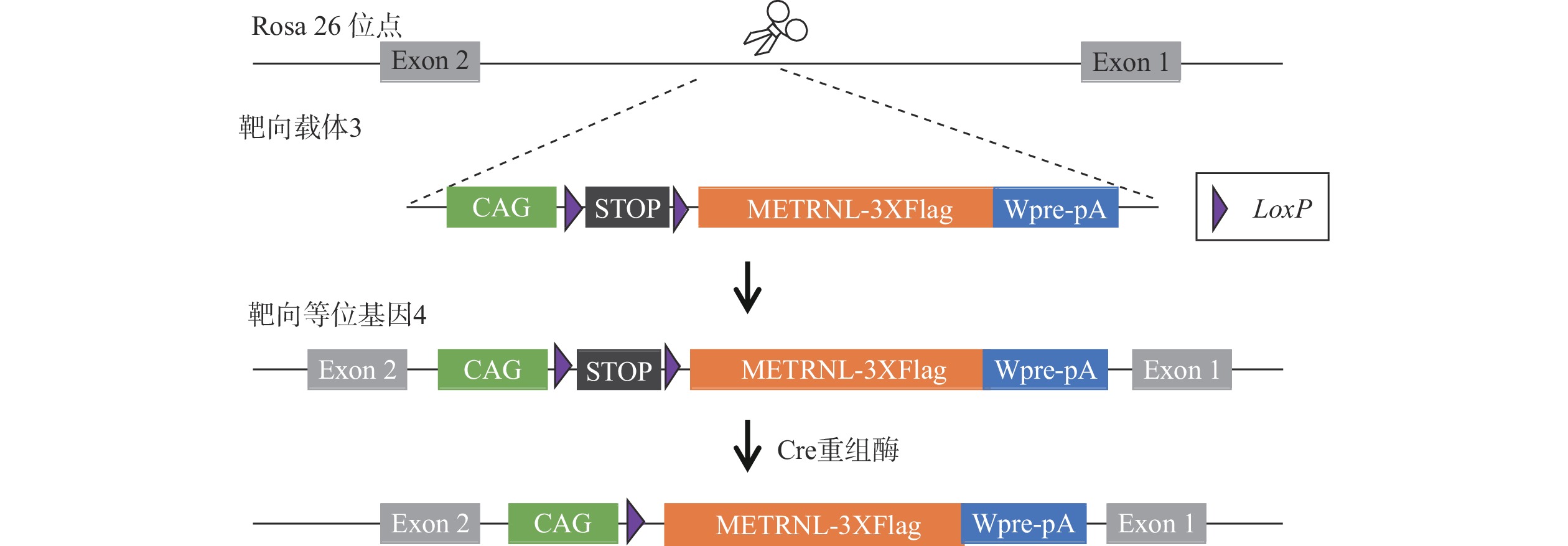
R26-LSL-METRNL+/-小鼠是前期通过CRISPR/Cas9基因编辑技术构建而成,即在其中一个Rosa26基因位点定点插入了CAG-LoxP-Stop-LoxP-METRNL-3XFlag-Wpre-pA表达框,且该表达框的终止密码子Stop两侧插有同向LoxP位点,可基于Cre-loxP系统在Cre酶的作用下,将LoxP位点之间的序列切除,只留下一个LoxP位点,最终达到人METRNL基因过表达的目的。在该小鼠的名称“R26-LSL-METRNL+/-”中,“+”表示有外源基因表达框的插入,“-”表示无外源基因表达框插入。
Dppa3-Cre小鼠是由Dppa3基因启动子介导Cre重组酶在全身表达的工具鼠,将R26-LSL-METRNL+/-小鼠和Dppa3-Cre小鼠杂交,可获得R26-L-METRNL+/-小鼠,具体繁殖方法如图2所示。其中,野生对照小鼠简写为R26-WT,表示在Rosa26位点没有外源人METRNL基因表达框的插入。
在繁殖过程中进行基因型鉴定时,需确认外源人METRNL基因表达框、终止密码子Stop和Dppa-Cre基因的存在情况。采用相应基因上下游引物分别进行鼠尾基因型鉴定,外源性表达框阳性条带为699 bp,对应野生型序列条带为996 bp,终止密码子Stop阳性条带为408 bp,Cre基因阳性条带为100 bp。如图3所示,泳道1为R26-LSL-METRNL+/-小鼠,泳道2为R26-L-METRNL+/-小鼠,泳道3为R26-WT小鼠,泳道4为R26-L-METRNL+/-Cre小鼠,泳道5为R26-WT;Cre小鼠。
-
为验证R26-L-METRNL+/-小鼠是否存在人METRNL基因过表达,本研究首先利用实时荧光定量PCR技术检测了该小鼠各组织中人METRNL mRNA的表达情况。如图4所示,以 R26-WT 小鼠白色脂肪的人 METRNL mRNA表达量为1,肝、脾、肺、肾、白色脂肪和脑组织的相对表达量分别为94 008.6、618.1、88 537.3、68 897.9、32 386.3和24 816.5。该结果说明,R26-L-METRNL+/-小鼠在组织mRNA水平上实现了人METRNL基因过表达。
-
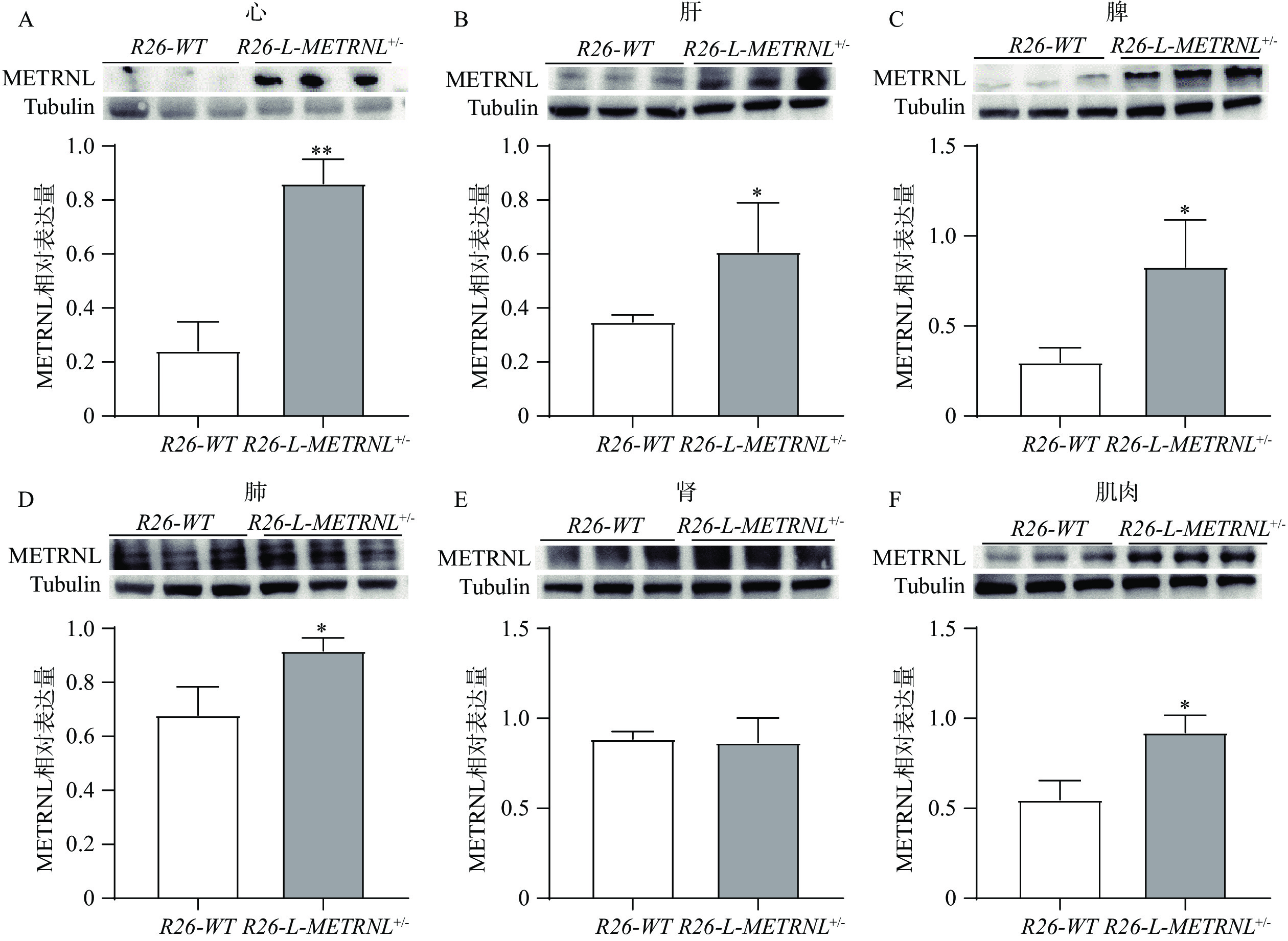
接着,本研究提取各组织的蛋白,使用蛋白免疫印迹实验方法验证R26-L-METRNL+/-小鼠各组织中人METRNL蛋白表达情况。在该实验中,所用METRNL抗体可同时抗人和小鼠的METRNL蛋白。如图5所示,METRNL蛋白在R26-L-METRNL+/-小鼠的心、肝、脾、肺和肌肉组织中的含量明显高于R26-WT小鼠,而在肾组织中METRNL抗体的结合效果不佳,且并未发现两组小鼠肾METRNL蛋白存在明显差异。该结果提示,R26-L-METRNL+/-小鼠在组织蛋白水平上实现了人METRNL基因过表达。
-
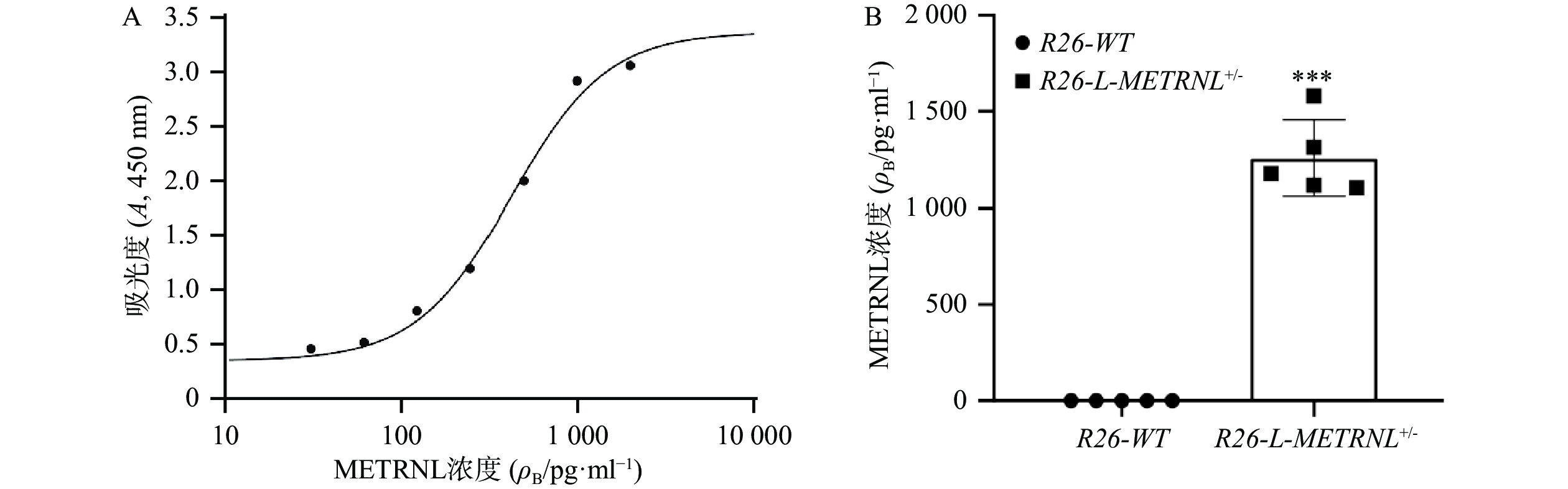
由于METRNL为分泌性蛋白,本研究最后使用ELISA方法测定R26-L-METRNL+/-小鼠及其对照小鼠血清中人METRNL蛋白水平。如图6所示,可成功检测到R26-L-METRNL+/-小鼠血液中的人METRNL,浓度在1 100.3~1 579.3 pg/ml,而在R26-WT小鼠血液中检测不到人METRNL。该结果说明,R26-L-METRNL+/-小鼠的血液中存在大量人METRNL蛋白,提示R26-L-METRNL+/-小鼠实现了人METRNL基因过表达。
-
本研究利用Dppa-Cre小鼠和实验室前期构建的R26-LSL-METRNL+/-小鼠进行杂交繁殖,最终获得R26-L-METRNL+/-小鼠。该小鼠与R26-LSL-METRNL+/-小鼠都在Rosa26基因位点含有外源性基因表达框,不同的是在R26-L-METRNL+/-小鼠外源表达框中的终止密码子Stop被Cre酶成功切除,因此R26-L-METRNL+/-小鼠可实现全身细胞过表达人METRNL。
本研究从mRNA水平、组织蛋白水平和血清蛋白水平考察了R26-L-METRNL+/-小鼠过表达METRNL的情况。由于该小鼠插入的外源METRNL基因是人METRNL基因,因此在进行实时荧光定量PCR实验时,使用的是人METRNL引物和小鼠Gapdh引物。类似地,在ELISA实验中,使用的是检测人METRNL的试剂盒。由于没有特异性抗人的METRNL抗体,因此在蛋白免疫印迹实验中使用的是可同时抗人和小鼠的METRNL抗体,而内参使用的是抗鼠的Tubulin抗体。本研究结果显示,R26-L-METRNL+/-小鼠的各组织存在人METRNL mRNA高表达,虽然各组织的表达量有所波动,但都比R26-L-WT小鼠的表达量高几千倍甚至是数十万倍。蛋白免疫印迹实验结果显示,在R26-L-METRNL+/-小鼠的心、肝、脾、肺、肌肉组织存在明显升高的METRNL蛋白水平,但该实验中检测的METRNL蛋白量升高倍数不多,可能与使用的METRNL抗体可以同时抗人和小鼠的METRNL有关。另外,我们也注意到两组小鼠肾组织的METRNL蛋白水平并没有明显差异,并且两组条带都非常微弱,为确证实验结果,我们进行了重复实验,得出相同结果。经过分析可能是因为该METRNL抗体对肾组织蛋白的亲和力不是很高,导致检测出的蛋白绝对量都太低而使两组之间很难出现差异。在血清水平,本研究结果提示R26-L-METRNL+/-小鼠的血液中存在大量人METRNL蛋白,而R26-L-WT小鼠血中检测不到该蛋白,说明R26-L-METRNL+/-小鼠成功过表达人METRNL,并可以成功分泌至血液中。同时,该实验提示,本研究所使用的人METRNL ELISA试剂盒特异性比较好,可以清晰区别人和鼠来源的METRNL蛋白。
在小鼠培育过程当中,尚未发现R26-L-METRNL+/-小鼠和同窝对照WT小鼠在体重、形态等方面有何差异。根据图2中R26-L-METRNL+/-小鼠的培育方式,采用R26-L-METRNL+/-小鼠与C57BL/6J 小鼠杂交进行扩大繁殖和保种,基于孟德尔遗传定律,后代鼠中R26-L-METRNL+/-小鼠理论得率为50%,但实际中,我们发现该小鼠的得率仅为15%左右,远低于理论值。这一现象非常有趣,因为此前本实验室构建过多种基因工程动物模型,均没有发现类似偏离孟德尔遗传定律的现象,而这一现象是否与METRNL蛋白的全身性过表达有关,值得我们进一步研究。
Construction and validation of a mouse model with systemic overexpression of human METRNL gene
-
摘要:
目的 构建全身过表达人METRNL基因的小鼠模型(R26-L-METRNL+/-小鼠)。 方法 基于Cre-loxP系统利用Dppa3-Cre小鼠和实验室前期构建的人METRNL基因条件性过表达(R26-LSL-METRNL+/-)小鼠进行交配繁殖,得到目标R26-L-METRNL+/-小鼠。将该目标小鼠进行基因型鉴定,收集其血液及心、肝、脾、肺、肾、脑、白色脂肪和肌肉组织,利用实时荧光定量PCR技术、蛋白免疫印迹实验和血清酶联免疫吸附实验,考察人METRNL基因在小鼠的表达情况。 结果 R26-L-METRNL+/- 小鼠的人METRNL在组织mRNA水平、组织蛋白水平和血液蛋白浓度方面都有显著表达,远高于野生对照组小鼠。 结论 R26-L-METRNL+/-小鼠模型构建成功。 Abstract:Objective To generate mice with whole-body overexpression of human METRNL gene. Methods Based on Cre-loxP system, Dppa3-Cre mice were mated with Rosa26-LSL-METRNL knock-in mice(R26-LSL-METRNL+/-)to generate R26-L-METRNL+/- mice. The genotypes of the offsprings were identified, and tissues of the blood, heart, liver, spleen, lung, kidney, brain, white adipose and muscle were collected. The expression of human METRNL gene in mice was investigated by quantitative real-time PCR, western blot and enzyme linked immunosorbent assay. Results Compared with wild type control mice, human METRNL in R26-L-METRNL+/- mice significantly expressed at both mRNA and protein levels in tissues, with abundant METRNL protein in blood. Conclusion The mouse model overexpressing human METRNL gene(R26-L-METRNL+/- mouse)was successfully constructed. -
Key words:
- METRNL /
- systemic overexpression /
- mouse
-
作者通过网络药理学和体外实验,对青蒿治疗肾阴虚型糖皮质激素性骨质疏松(GIOP)的潜在作用靶点及相关信号通路进行预测和初步验证。研究结果表明, 青蒿治疗肾阴虚型GIOP具有多靶点-多通路的特点,可以通过多条途径促进成骨细胞的增殖、分化,其中PI3K/AKT信号通路是一条重要的通路,青蒿治疗肾阴虚型骨质疏松可能与其能够促进PI3K/AKT信号通路,促进AKT的磷酸化有关。
前言
骨质疏松症(osteoporosis, OP)是一种以骨密度(bone mineral density, BMD) 降低、骨量丢失、骨微结构破坏为主要特点的全身代谢性骨病,以骨脆性增加、易发生骨折为主要特征[1]。随着老龄化的加剧,OP的发生率越来越高,在我国50岁以上的人群中,OP的发生率为19.2%,其中女性为32.1%,男性为6.0%[2]。OP可分为原发性OP和继发性OP,在继发性OP中,糖皮质激素性OP(glucocorticoid-induced osteoporosis, GIOP)的发生率排在第一位[3],目前骨质疏松症(OP)是一种以骨密度(BMD) 降低、骨量丢失、骨微结构破坏为主要特点的全身代谢性骨病,以骨脆性增加、易发生骨折为主要特征[1]。随着老龄化的加剧,OP的发生率越来越高,在我国50岁以上的人群中,OP的发生率为19.2%,其中女性为32.1%,男性为6.0%[2]。OP可分为原发性OP和继发性OP,在继发性OP中,GIOP的发生率排在第一位[3],GIOP治疗上西医使用的药物有钙制剂、活性维生素 D、双磷酸盐类以及雌激素等,这些药物不仅忽略了糖皮质激素这个罪魁祸首,还有可能产生一系列的副作用[4],寻找安全有效且有针对性的药物显得尤为重要。
中医认为糖皮质激素是“纯阳”之品[5],使用过量易伤阴津;肾主骨,肾虚是导致骨质疏松的关键病机,因此,肾阴虚证是GIOP的一个主要证型,临床研究也证明,肾阴虚证是GIOP患者的一个易患证型[6]。青蒿为菊科蒿属植物黄花蒿植物Artemisia annua L.的干燥地上部分,分布遍及全国,味苦、辛,性寒,归肝、胆经,具有清虚热、除骨蒸的作用[7],对于过量使用糖皮质激素造成的阴虚火旺、烦躁不安,有一定的疗效,临床上也常用青蒿加减处方治疗糖皮质激素使用过度,造成阴虚火旺、虚火上炎的病症[8-9],同时,体内实验发现,青蒿在多种骨丢失模型动物上,可以促进骨组织的再生,提高骨密度[10],青蒿在治疗骨质疏松方面具有广阔的应用前景。然而,目前关于青蒿治疗OP,特别是在GIOP方面的研究尚有限,为此,本研究应用网络药理学和体外实验,结合中医基础理论知识,研究青蒿治疗肾阴虚型GIOP的关键靶点和信号通路,以期明确中药青蒿抗肾阴虚型GIOP的作用及机制,为骨质疏松的临床治疗提供新思路和方法。
1. 材料与方法
1.1 GIOP相关靶点筛选
在GeneCards数据库(https://www.Genecards.org)、OMIM数据库(https://omim.org)和Drugbank数据库(https://go.drugbank.com)中,以“glucocorticoid induced osteoporosis”作为关键词进行检索,获得GIOP的靶点基因,去除两个数据库的重复结果,获得GIOP疾病靶点基因。
1.2 肾阴虚相关靶点筛选
根据全国中西医结合虚证与老年病研究专业委员会[11]1986年对虚证辩证标准的修订,阴虚证诊断标准:主证:①五心烦热(palms and soles);②咽燥口干(dry throat and thirst );③舌红或少苔、无苔(red tongue or less fur or without fur);④脉细数(thin and rapid pulse)。次证:①午后升火(tidal fever);②便结而尿短赤(constipation and scanty dark urine);③盗汗(night sweating)。诊断条件:具备主证3项,次证1项。在GeneCards数据库中,对各症状关键词进行检索,筛选出4个主证检索结果中至少出现3次的靶点,与次证检索结果交叉分析后得到阴虚靶点。肾虚证诊断标准为:①腰脊酸痛(soreness and weakness of waist);②胫酸膝软或足跟痛(soreness and weakness of knees or heel pain);③耳鸣或耳聋(tinnitus or deaf);④发脱或齿摇(alopecia or toothmobilit)y;⑤尿后有余沥或失禁(urinary incontinence or poor urination);⑥性功能减退、不育、不孕(sexual dysfunction and infertility or sterility)。诊断条件:具备3项。在GeneCards数据库中,对各症状关键词进行检索,筛选出至少出现3次的靶点为肾虚靶点。将阴虚靶点与肾虚靶点交叉分析后获得肾阴虚靶点。将GIOP疾病靶点与肾阴虚靶点交叉分析后获得肾阴虚型GIOP靶点。
1.3 青蒿化学成分筛选
在中药系统药理学数据库与分析平台(TCMSP:http://tcmspw.com/tcmsp.php)上,以Herb:青蒿、OB≥30%、DL≥0.18为条件进行检索,确定青蒿的活性成分。
1.4 预测靶点并添加基因名
利用TCMSP的靶点预测模型,进一步预测青蒿活性成分的相关靶点,通过UniProt数据库(http://www.Uniprot.org/)对预测靶点添加基因名。最后利用微生信在线软件(http://www.bioinformatics.com.cn/)将肾阴虚型GIOP靶点基因与青蒿靶点基因进行交集分析,并绘制出韦恩图。
1.5 构建基因蛋白互作(PPI)网络及拓扑分析
将“青蒿-肾阴虚型GIOP”共同靶点基因数据导入String在线软件(https://string-db.org /),选择种属为“Homo sapiens”,设置最小互作得分为0.4,构建出PPI网络,将数据导入Cytoscape软件中进行可视化分析,并利用CytoNCA插件进行拓扑分析,以度中心度(DC)和介度中心度(BC)均大于上四分位数的靶点作为核心靶点,进一步分析。
1.6 GO和KEGG功能富集分析
为进一步阐述青蒿对肾阴虚型GIOP的作用机制,将“青蒿-肾阴虚型GIOP”共同靶点基因数据导入metascape数据库(https://metascape.org/gp/index.html)进行GO功能富集分析和KEGG功能富集分析,并通过微生信在线软件绘制相关柱状图和气泡图。
1.7 实验材料与仪器
青蒿购于河北安国市场,经海军军医大学药学系生药学教研室辛海量副教授鉴定,密封存放于干燥阴凉处。称取青蒿粉末1g,加入60%乙醇50 ml,室温冷浸7 d,过滤得滤液,55 ℃旋蒸浓缩后,55 ℃烘干备用[12-13]。
其他试剂及生产厂家:地塞米松(大连美仑);胎牛血清(Gibco,美国);DMEM培养基等细胞培养试剂(天津灏洋);碱性磷酸酶(ALP)试剂盒(南京建成);BCA蛋白检测试剂盒、MTT(上海碧云天生物技术有限公司);PI3K、AKT、p-AKT、GADPH抗体(CST公司)。
1.8 原代成骨细胞的分离
以二次消化法从新生大鼠颅骨盖中分离获得原代成骨细胞[14]。
1.9 细胞培养和传代
以含10%胎牛血清和1%青/链霉素的DMEM培养基培养成骨细胞,置于37 ℃、5%CO2培养箱中培养,待细胞铺满80%~90%时,用0.25%胰蛋白酶消化传代培养。
1.10 成骨细胞增殖及ALP检测
取3-8代的成骨细胞计算其数目,配制成细胞浓度为1×104 个/ml细胞悬液接种于96孔板。24 h后分别更换为含药培养液(DEX: 10 μmol/L;AE: 100、50、 25 μg/ml)。给药48 h后采用MTT法检测成骨细胞的增殖情况。
取3-8代的成骨细胞计算其数目,配制成细胞浓度为5×104 个/ml细胞悬液接种于24孔板。24 h后分别更换为含药培养液(给药浓度同上)。培养过程中每3 d更换1次含药培养液。第8d裂解细胞,收集细胞裂解液,于4 ℃、13800×g 离心5 min。用对硝基苯磷酸二钠法测定细胞ALP活性。
1.11 Western blot法检测PI3K、AKT、p-AKT蛋白的表达
将3-8代的成骨细胞裂解,提取细胞总蛋白,根据BCA试剂盒进行蛋白定量。采用Western-blot技术对PI3K、AKT和p-AKT水平进行检测。
1.12 统计学分析
实验结果以“均值±标准差”(
$ \bar x$ ±s)表示。采用SPSS 22.0软件进行数据分析,选用单因素方差分析(One-Way ANOVA)进行组间变量的比较分析。2. 结果
2.1 肾阴虚型GIOP相关靶点筛选
通过Genecards数据库共检索到GIOP相关靶点基因1741个,通过OMIM数据库共检索到GIOP相关靶点基因311个,通过Drugbank数据库共检索到GIOP相关靶点基因30个,将3个数据库检索结果合并后去除重复基因后,最终获得2039个。通过Genecards数据库检索获得阴虚靶点基因876个,肾虚靶点基因4603个,交叉分析后获得肾阴虚靶点基因836个。将肾阴虚靶点基因和GIOP靶点基因交叉分析后获得522个肾阴虚型GIOP靶点基因(图1)。
2.2 青蒿活性成分筛选
通过TCMSP平台共检索到青蒿中OB≥30%,DL≥0.18的活性成分22个,见表1。
表 1 青蒿主要活性成分分子名称 生物利用度(%) 药物相似度(DL) 新西兰牡荆苷_qt 59.85 0.21 醋酸酯 58.02 0.52 脱氧青蒿素 54.47 0.26 青蒿烯 54.36 0.31 万寿菊素 53.11 0.34 牡荆黄素_qt 52.18 0.21 泽兰黄醇素 50.8 0.41 双氢青蒿素 50.75 0.3 青蒿素 49.88 0.31 异鼠李素 49.6 0.31 青蒿亭 49.55 0.48 茵陈黄酮 48.96 0.41 槲皮素 46. 43 0.28 维采宁-2_qt 45.84 0.21 豆甾醇 43.83 0.76 线蓟素 43. 46 0.34 六氟磷酸钠 42.6 0.37 山奈酚 41.88 0.24 谷甾醇 36.91 0.75 木犀草素 36.16 0.25 怪柳黄素 32.86 0.31 玄参黄酮 30.35 0.3 2.3 靶点预测和基因名添加
通过TCMSP和UniProt数据库获得214个青蒿活性成分靶点基因。将其与肾阴虚型GIOP疾病靶点基因交叉分析(图1),“青蒿-肾阴虚型GIOP”交集靶点基因共有98个。
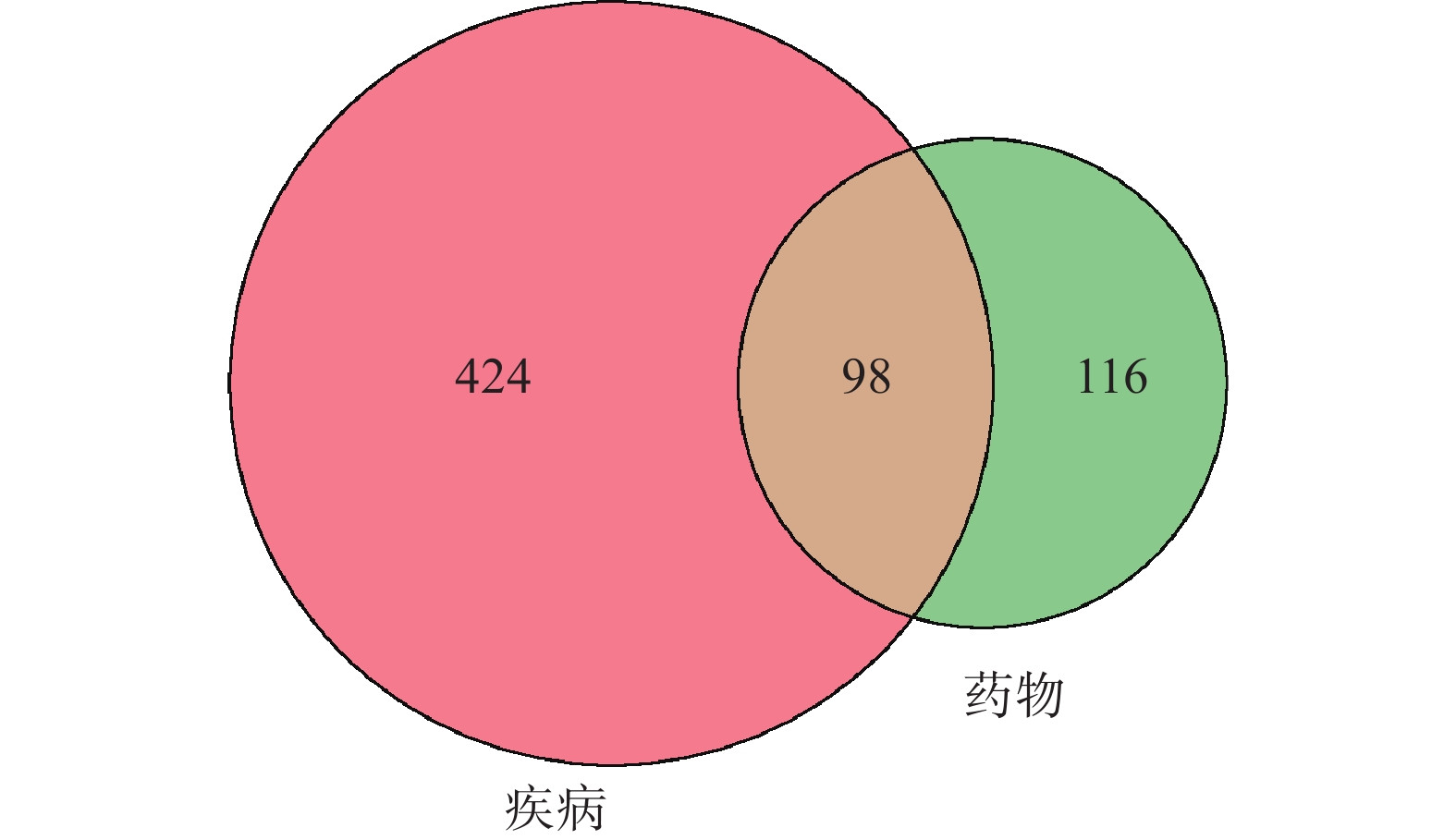
2.4 靶点基因蛋白互作(PPI)网络及拓扑分析
运用String在线软件构建出“青蒿-肾阴虚型GIOP”共同靶点PPI网络(图2),共有98个节点,1935条相互关系,见图2。利用CytoNCA插件计算网络节点的DC,BC上四分位数为59、101.49248,故以DC≥59、BC≥101.49248为筛选条件,筛选青蒿治疗肾阴虚型GIOP的核心靶点,共得到17个核心靶点,如表2。
表 2 “青蒿-肾阴虚型GIOP”核心靶点信息靶点信息 简称 度中心度
(DC)介度中心度
(BC)RAC-α丝氨酸/苏氨酸
蛋白激酶AKT1 84 495.8247 肿瘤坏死因子 TNF 83 336.63745 白细胞介素-6 IL6 81 281.4354 细胞肿瘤抗原p53 TP53 79 273.47903 血管内皮生长因子A VEGFA 78 200.2001 白细胞介素-1β IL1B 76 199.86818 基质金属蛋白酶-9 MMP9 73 146.52397 转录因子AP-1 JUN 71 167.16982 前列腺素G/H合成酶-2 PTGS2 71 140.30101 半胱氨酸蛋白酶-3 CASP3 71 120.33017 表皮生长因子受体 EGFR 68 294.5016 表皮生长因子 EGF 67 107.6285 白细胞介素-8 CXCL8 67 127.67476 雌激素受体 ESR1 65 251.7144 C-C基序趋化因子配体 CCL2 65 101.49248 过氧化物酶体增殖物
激活受体γPPARG 63 118.61439 血红素氧合酶-1 HMOX1 59 156.89531 2.5 GO和KEGG功能富集分析
GO富集分析获得5612个细胞生物学过程,其中BP分析获得4649个条目,MF分析获得585个条目,CC分析获得378个条目,根据富集的基因数进行降序排列,分别选取前10个条目建立BP、MF、CC三合一柱状图(图3)。生物学过程(BP)主要涉及激素应答、性腺发育、细胞死亡的正向调节等,细胞成分(CC)包括细胞外基质、转录调节复合物、膜筏等,分子功能(MF)包括信号受体调节活性、蛋白结构域特异性结合、激酶结合等。
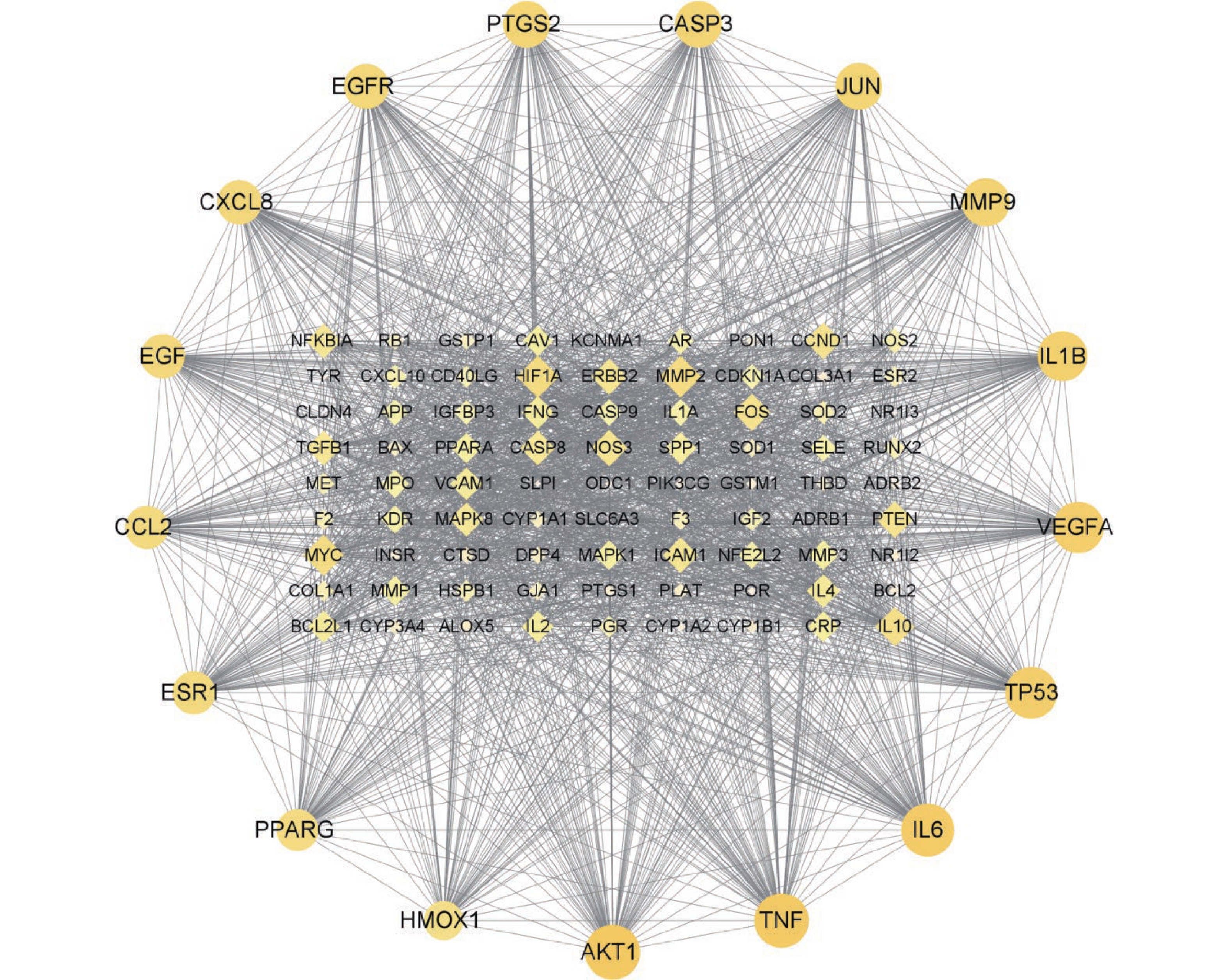
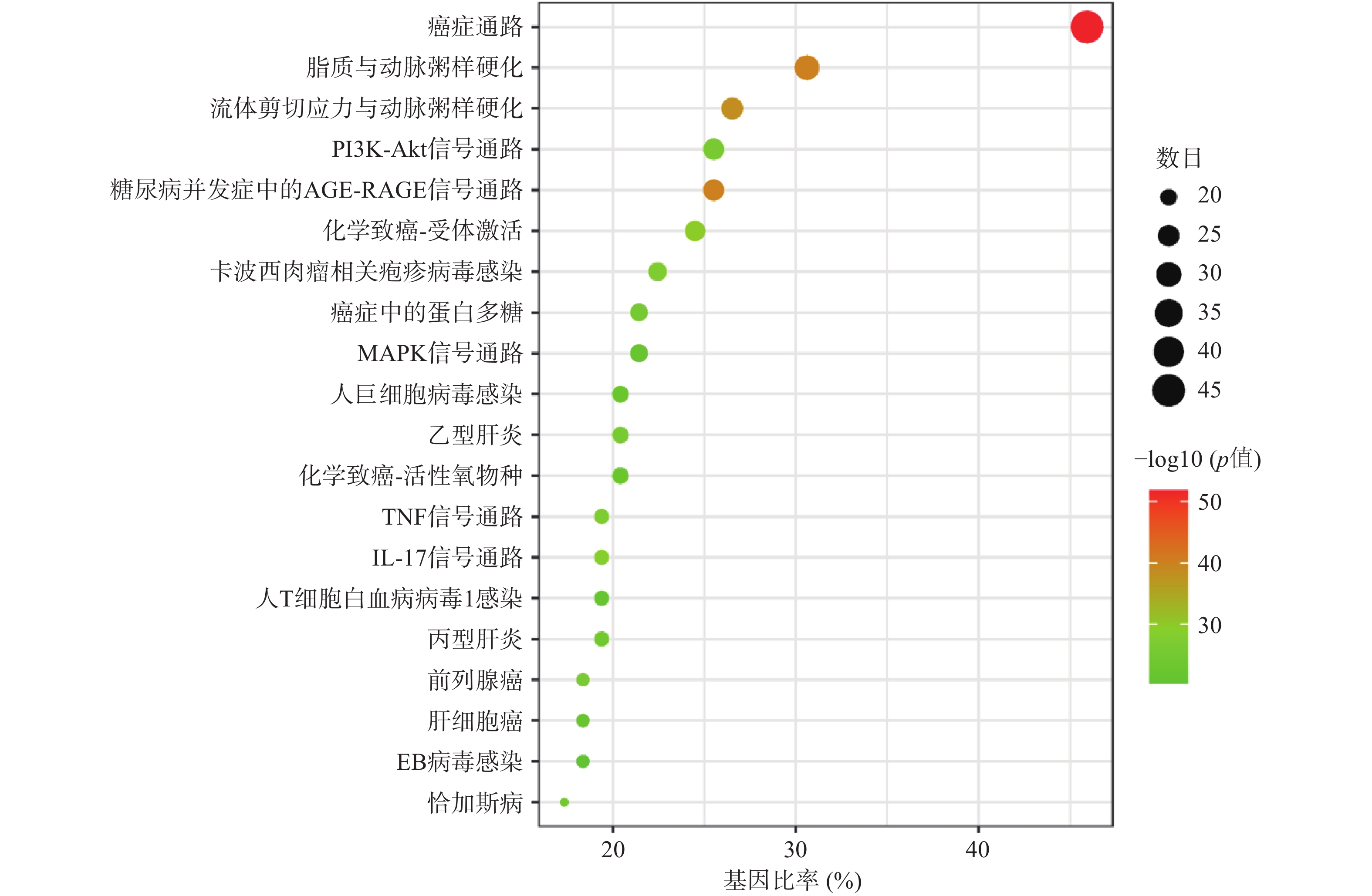
KEGG富集分析获得225个信号过程,根据富集的基因数进行降序排列,选取前20个条目建立气泡图(图4),KEGG富集分析主要涉及的信号通路有PI3K/AKT信号通路,IL-17信号通路,AGE/RAGE信号通路,MAPK信号通路等,说明青蒿治疗肾阴虚型GIOP可能是从多条信号通路联合发挥作用的,其中PI3K/AKT信号通路上富集的共同靶点最多。
2.6 细胞实验
2.6.1 青蒿显著提高DEX损伤的成骨细胞的增殖及分化
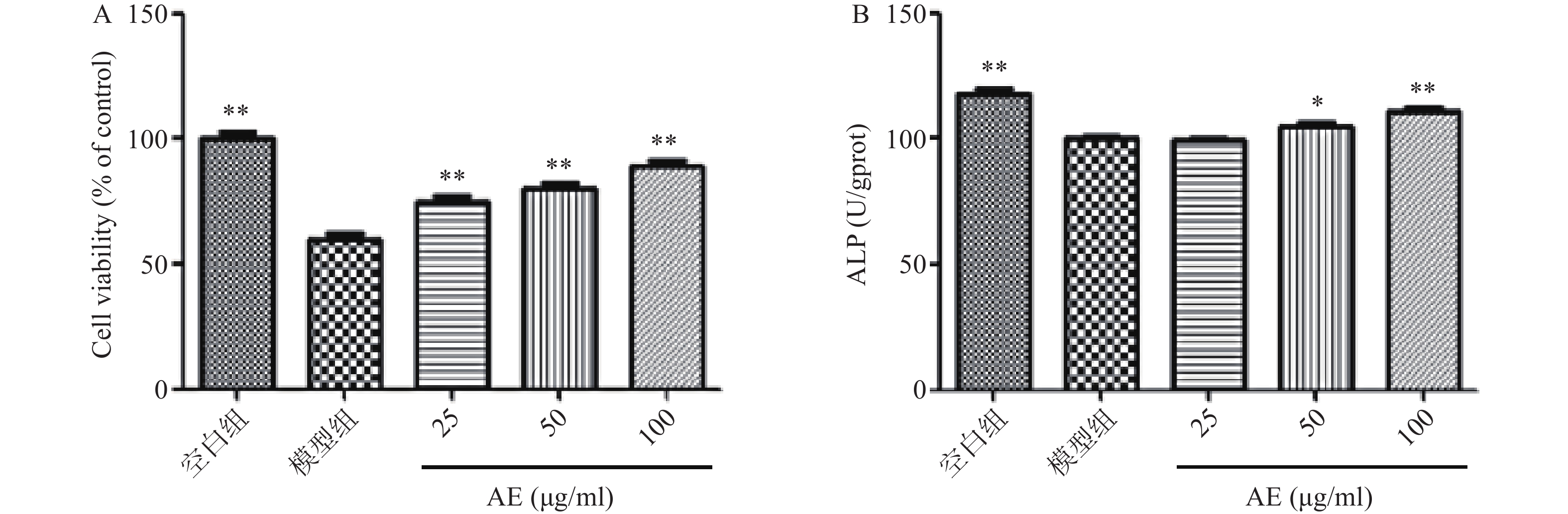
DEX损伤成骨细胞后,其增殖能力及ALP活性显著降低。药物治疗后,青蒿提取物可显著促进DEX损伤的成骨细胞的增殖,提高ALP活性,促进DEX损伤的成骨细胞的增殖(图5)。
2.6.2 青蒿对DEX损伤的成骨细胞PI3K/AKT通路蛋白的影响
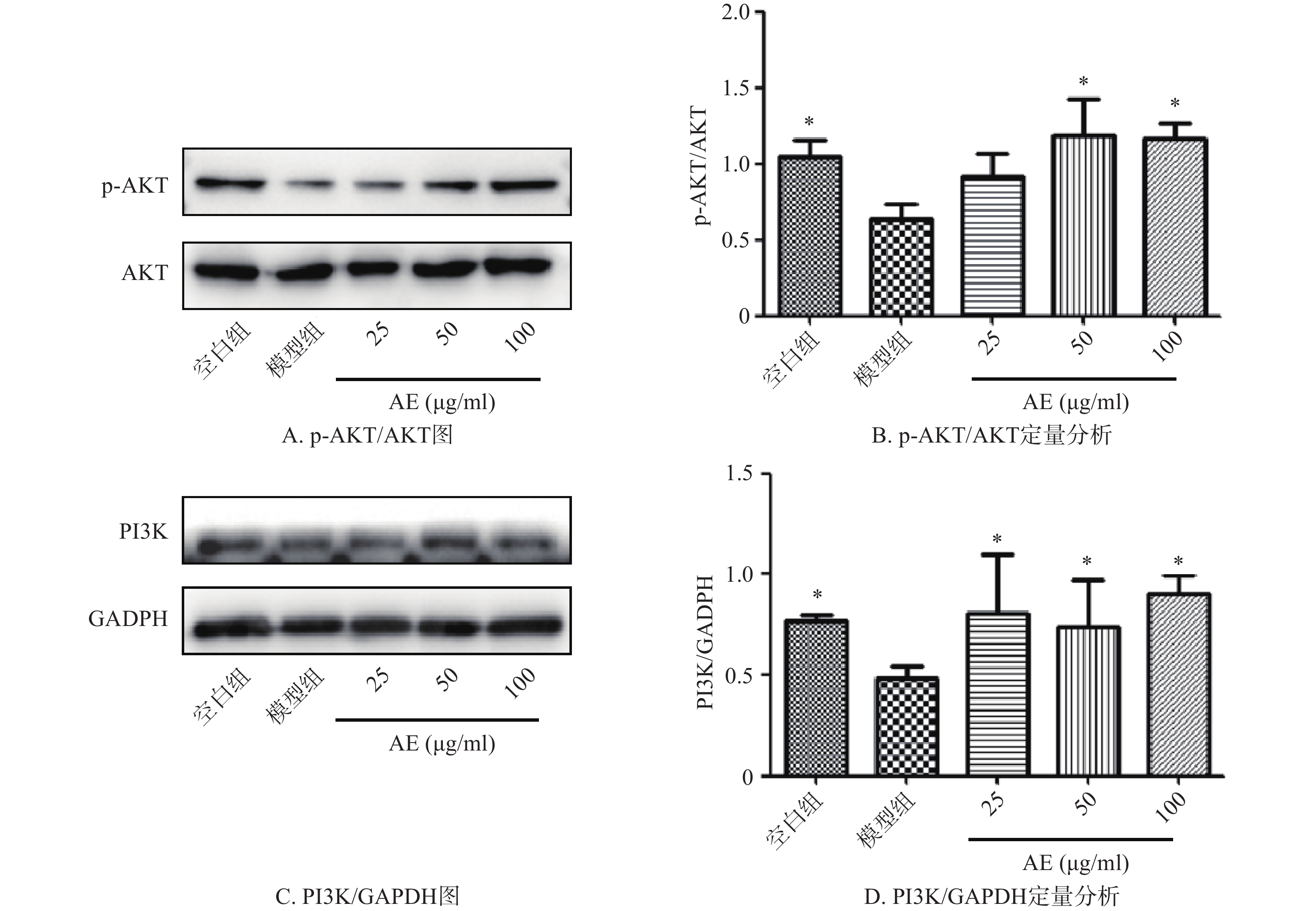
药物处理DEX损伤的成骨细胞48 h后,Western blot结果显示,与空白组比较,模型组p-AKT/AKT比值、PI3K蛋白表达水平明显下降,给予青蒿提取物治疗后,p-AKT/AKT比值、PI3K蛋白表达水平明显提高(图6)。
3. 讨论
研究发现,PI3K/AKT通路与氧化应激有密切的联系,一方面,过量的活性氧(ROS)可抑制AKT的磷酸化[15],另一方面,磷酸化的AKT也可以通过Nrf2/HO-1通路抑制氧化应激[16]。在OP的治疗药物探索过程中,抗氧化是一条重要的线索,如啤酒花中的黄腐酚,杜仲中的绿原酸,黄连中的小檗碱,其抗骨质疏松的机制均与抗氧化有关[17-19],现代药理研究已经证明青蒿具有抗氧化,抗炎,调节免疫等作用[20-21],但青蒿中化学成分众多,虽然目前多以倍半萜类成分青蒿素含量作为其质量评价标准[22]。然而,除了倍半萜类成分外,青蒿中还存在黄酮类成分、有机酸类成分等等[23],青蒿的抗肾阴虚型GIOP的机制可能与抗氧化有关。研究发现,倍半萜类成分、黄酮类成分、有机酸类成分均存在一定的抗氧化效果[24-27],青蒿的抗肾阴虚型GIOP的机制可能与抗氧化有关。因此,研究青蒿是否在抗OP方面存在作用,青蒿中哪种单体成分在其抗OP的过程中起主要作用值得进一步探究。
本研究以网络药理学为基础,初步筛选出了青蒿抗肾阴虚型GIOP的98个共同靶点,通过拓扑分析,筛选出了17个核心靶点。GO分析和KEGG富集分析发现这些共同靶点参与了多个生物学过程,且参与PI3K/AKT,IL-17,AGE/AGE,MAPK等多个信号通路,其中PI3K/AKT信号通路上富集的共同靶点最多。研究表明,PI3K/AKT信号通路可通过影响成骨细胞的增殖和分化,抑制OP的发生[28]。本研究体外实验亦证实青蒿可以促进DEX损伤的成骨细胞的增殖和分化,激活PI3K/AKT信号通路,促进AKT的磷酸化,验证了网络药理学的预测结果,为后续青蒿抗GIOP研究提供了科学依据。
-
表 1 PCR扩增实验中的引物序列
基因名称 上游引物(5’→3’) 下游引物(5’→3’) R26-WT TCAGATTCTTTTATAGGGGACACA TAAAGGCCACTCAATGCTCACTAA R26-L-METRNL AAAGTCCCGGAAAGGAGCTG GAGGCTCCATCCAGCAAGTT R26-Stop GGGCAACGTGCTGGTTATTG ACTTGCCCCTTGCTCCATAC 内参基因 TGGGTTGGGTGTCTGTTTCATTGT GATCCACCTGTCTCTGCCTTCC Dppa-Cre TGGGTTGGGTGTCTGTTTCATTGT GACCTTGCATTCCTTTGGCGAGAG 表 2 实时荧光定量PCR实验中的引物序列
基因名称 上游引物(5′→3′) 下游引物(5′→3′) 人 METRNL ACCAGCGACTTCGTAATTCAC CAGCTCCACGTCATGGGTG 小鼠 Gapdh GTATGACTCCACTCACGGCAAA GGTCTCGCTCCTGGAAGATG -
[1] LI Z Y, ZHENG S L, WANG P, et al. Subfatin is a novel adipokine and unlike Meteorin in adipose and brain expression[J]. CNS Neurosci Ther, 2014, 20(4):344-354. doi: 10.1111/cns.12219 [2] LI Z Y, SONG J, ZHENG S L, et al. Adipocyte metrnl antagonizes insulin resistance through PPARγ signaling[J]. Diabetes, 2015, 64(12):4011-4022. doi: 10.2337/db15-0274 [3] LI Z Y, FAN M B, ZHANG S L, et al. Intestinal Metrnl released into the gut lumen acts as a local regulator for gut antimicrobial peptides[J]. Acta Pharmacol Sin, 2016, 37(11):1458-1466. doi: 10.1038/aps.2016.70 [4] ZHANG S L, LI Z Y, WANG D S, et al. Aggravated ulcerative colitis caused by intestinal Metrnl deficiency is associated with reduced autophagy in epithelial cells[J]. Acta Pharmacol Sin, 2020, 41(6):763-770. doi: 10.1038/s41401-019-0343-4 [5] XU T Y, QING S L, ZHAO J X, et al. Metrnl deficiency retards skin wound healing in mice by inhibiting AKT/eNOS signaling and angiogenesis[J]. Acta Pharmacol Sin, 2023, 44(9):1790-1800. doi: 10.1038/s41401-023-01090-x [6] HONG C, WANG Z, ZHENG S L, et al. Metrnl regulates cognitive dysfunction and hippocampal BDNF levels in D-galactose-induced aging mice[J]. Acta Pharmacol Sin, 2023, 44(4):741-751. doi: 10.1038/s41401-022-01009-y [7] ZHENG S L, LI Z Y, SONG J, et al. Endothelial METRNL determines circulating METRNL level and maintains endothelial function against atherosclerosis[J]. Acta Pharm Sin B, 2023, 13(4):1568-1587. doi: 10.1016/j.apsb.2022.12.008 [8] AMANO Y, NONAKA Y, TAKEDA R, et al. Effects of electrical stimulation-induced resistance exercise training on white and brown adipose tissues and plasma meteorin-like concentration in rats[J]. Physiol Rep, 2020, 8(16):e14540. [9] RAO R R, LONG J Z, WHITE J P, et al. Meteorin-like is a hormone that regulates immune-adipose interactions to increase beige fat thermogenesis[J]. Cell, 2014, 157(6):1279-1291. doi: 10.1016/j.cell.2014.03.065 [10] USHACH I, ARREVILLAGA-BONI G, HELLER G N, et al. Meteorin-like/meteorin-β is a novel immunoregulatory cytokine associated with inflammation[J]. J Immunol, 2018, 201(12):3669-3676. doi: 10.4049/jimmunol.1800435 [11] JUNG T W, LEE S H, KIM H C, et al. METRNL attenuates lipid-induced inflammation and insulin resistance via AMPK or PPARδ-dependent pathways in skeletal muscle of mice[J]. Exp Mol Med, 2018, 50(9):1-11. [12] REBOLL M R, KLEDE S, TAFT M H, et al. Meteorin-like promotes heart repair through endothelial KIT receptor tyrosine kinase[J]. Science, 2022, 376(6599):1343-1347. doi: 10.1126/science.abn3027 [13] LU Q B, DING Y, LIU Y, et al. Metrnl ameliorates diabetic cardiomyopathy via inactivation of cGAS/STING signaling dependent on LKB1/AMPK/ULK1-mediated autophagy[J]. J Adv Res, 2023, 51:161-179. doi: 10.1016/j.jare.2022.10.014 -





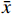
 下载:
下载:



 下载:
下载: