-
随着唑类抗真菌药物的长期广泛使用,真菌耐药的问题更加凸显[1]。目前,临床上从患者体内分离出的真菌以念珠菌为主,而其中白念珠菌占比40%以上[2]。然而,抗真菌药物极为有限,迫切需要研发新的抗真菌药物。
近年来,靶向于真菌线粒体的药物是抗真菌药物研究的重要方向,如正在开展临床研究的F901318、聚酮类化合物Ilicicolin-H等 [3-4]。课题组前期在靶向线粒体的药物研究中发现,亲脂性吡啶鎓盐可以破坏白念珠菌的线粒体功能,发挥抗真菌作用,其中带正电荷的吡啶鎓结构是其抗真菌活性的关键[5-6]。为了进一步筛选通过阳离子靶向线粒体的新骨架类型的化合物,我们从国外ChemDiv化合物库,筛选了具有吡啶鎓结构的化合物,考察其抗真菌活性。其中N1~N9是已知化合物,但此前并未有该类化合物应用于抗真菌领域的相关报道。本文通过研究其体外抗真菌效果,探讨其作为抗真菌先导化合物。
-
洁净工作台[HPeafe-1200LC(A2)上海力申科学仪器有限公司];振荡培养箱(HZ-2111K-B江苏太仓市实验设备厂);微量加样器(Biohit);小型冷冻离心机(HitachiCT15RE);蒸汽灭菌锅(KG-SX500 KAGOSHIMA SELSAKUSYO,Japan);多功能酶标仪(TECAN Infinite M200);倒置相差显微镜(Amersham Pharmacia AMG EVOS×1);紫外分光光度计(Amersham Biosciences Μltrospec10)。
-
白念珠菌标准菌株SC5314由美国Georgetown大学William A Fonzi教授赠送,临床分离的10株氟康唑耐药的白念珠菌(103、538、876、311、911、849、100、32、1010)、隐球菌2株、光滑念珠菌1株、热带念珠菌1株、近平滑念珠菌1株、克柔念珠菌1株,来自海军军医大学附属长征医院、长海医院皮肤科并经生化和形态学鉴定,N1-N9化合物购自ChemDiv,Inc,二甲基亚砜(DMSO)购自博光生物试剂有限公司,酵母提取物、甘露醇、营养肉汤购自BD公司,蛋白胨、葡萄糖、琼脂购自上海生工生物技术有限公司,RPMI1640购自Gibco公司,氟康唑购自阿拉丁试剂有限公司。
-
将保存在SDA固体培养皿的白念珠菌单克隆菌株转接到1 ml YEPD培养基,30 ℃、200 r/min,培养过夜,使真菌菌株处于指数生长平台期。①洗菌:将活化好的菌株转移到1.5 ml离心管中,用无菌PBS缓冲液洗3次,再用1 ml PBS重悬。②调节浓度:用RPMI 1640稀释菌液至终浓度为(1~5)×103 CFU/ml。③制备药敏实验板:取96孔板,第1列加入100 μl RPMI 1640液体培养基做空白对照;第12列加入100 μl上述菌液做阳性对照;第2~11列采用倍比稀释的方法制成不同梯度的加药处理菌液,于30 ℃恒温培养过夜,用酶标仪在λ=630 nm测吸光度(A630)值,使A值下降80%以上的对应的药物浓度为MIC80值[7]。
-
在N系列化合物中筛选活性较强的化合物N2进行进一步的抗真菌谱测定。菌株活化、菌液浓度调节、药敏反应板制备、测定A值(600 nm)值同上,更换实验室常用的菌株,测定化合物N2对多种真菌的作用,重复上述实验步骤进行实验。
-
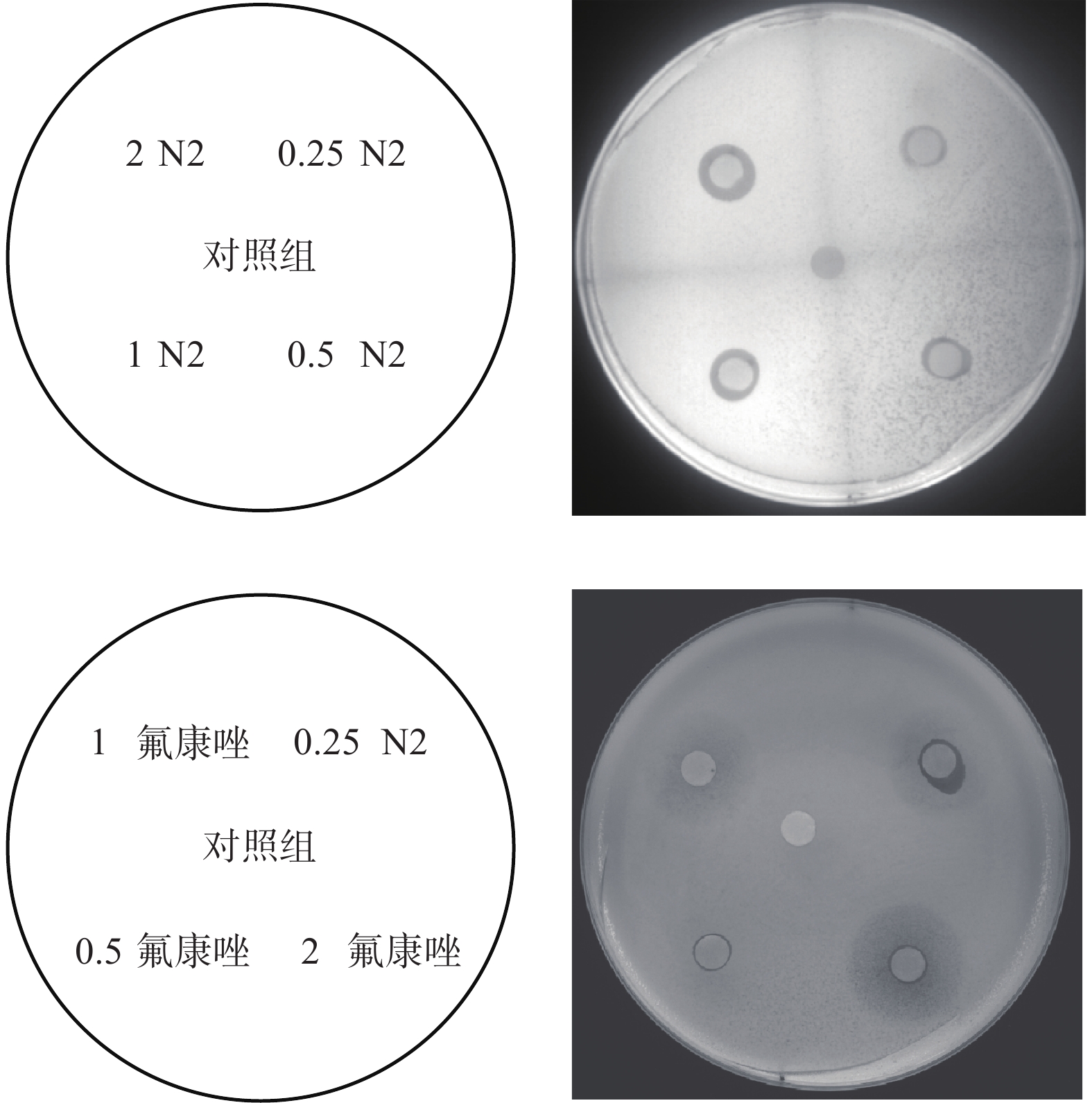
稀释菌液至1×106 CFU/ml,均匀涂布于2个SDA固体培养基上并在2块培养基上分别放置5片小圆纸片。取一块培养基,在5片纸片上分别滴加0、0.25、0.5、1、2 μg N2化合物,另一块按相同方式滴加等量氟康唑。于恒温箱中30 ℃培养24 h后观察并记录2块培养皿上的抑菌圈大小及形态。
-
生长曲线测定:菌株活化、洗菌步骤同前所述,用YPD培养基稀释菌液至1×106 CFU /ml(A630=0.01)。取3支摇菌管加入相同起始菌液量,并对各管进行加药处理,使3支摇菌管中N2浓度分别为0、2、4 μg/ml。30 ℃、200 r/min振荡培养。分别在0、3、6、9、12、24 h测定各管菌液的A值(630 nm)。以A值(630 nm)值对时间做时间-生长曲线[8]。
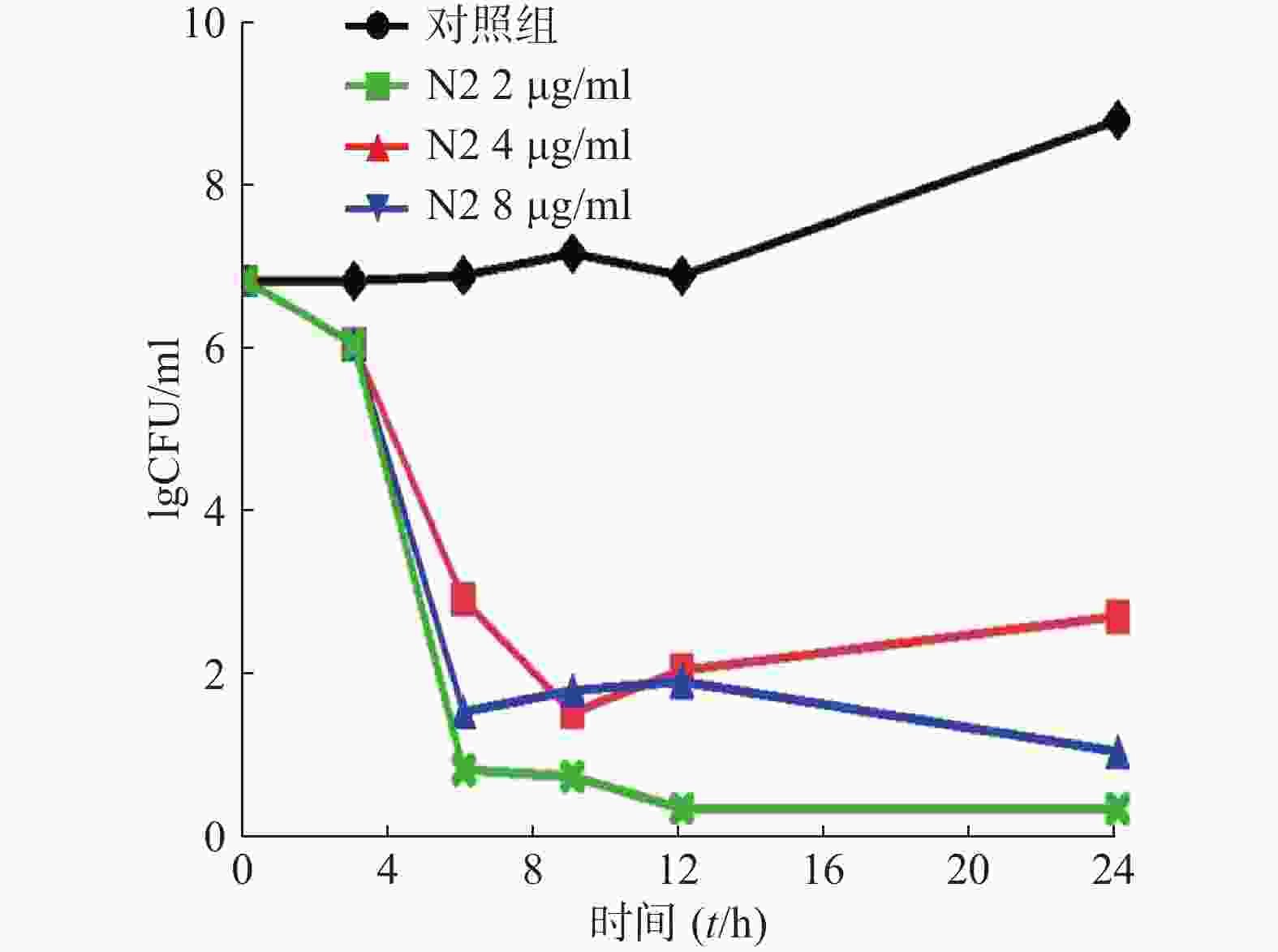
杀菌曲线测定:菌株活化、洗菌步骤同前所述,用RPMI 1640培养基稀释菌液至1×103 CFU /ml。取4支摇菌管,各加入1 ml菌液和一定浓度的N2化合物,使4支摇菌管的药物浓度分别为0、2、4、8 μg/ml。30 ℃、200 r/min振荡培养。分别在0、3、6、9、12、24 h取100 μl菌液,用无菌PBS以10倍浓度梯度稀释,各取100 μl涂于SDA固体培养基表面,30 ℃静置培养24 h~48 h后统计培养基内的菌落克隆数。以lgCFU/ml对时间做时间-杀菌曲线[9]。
-
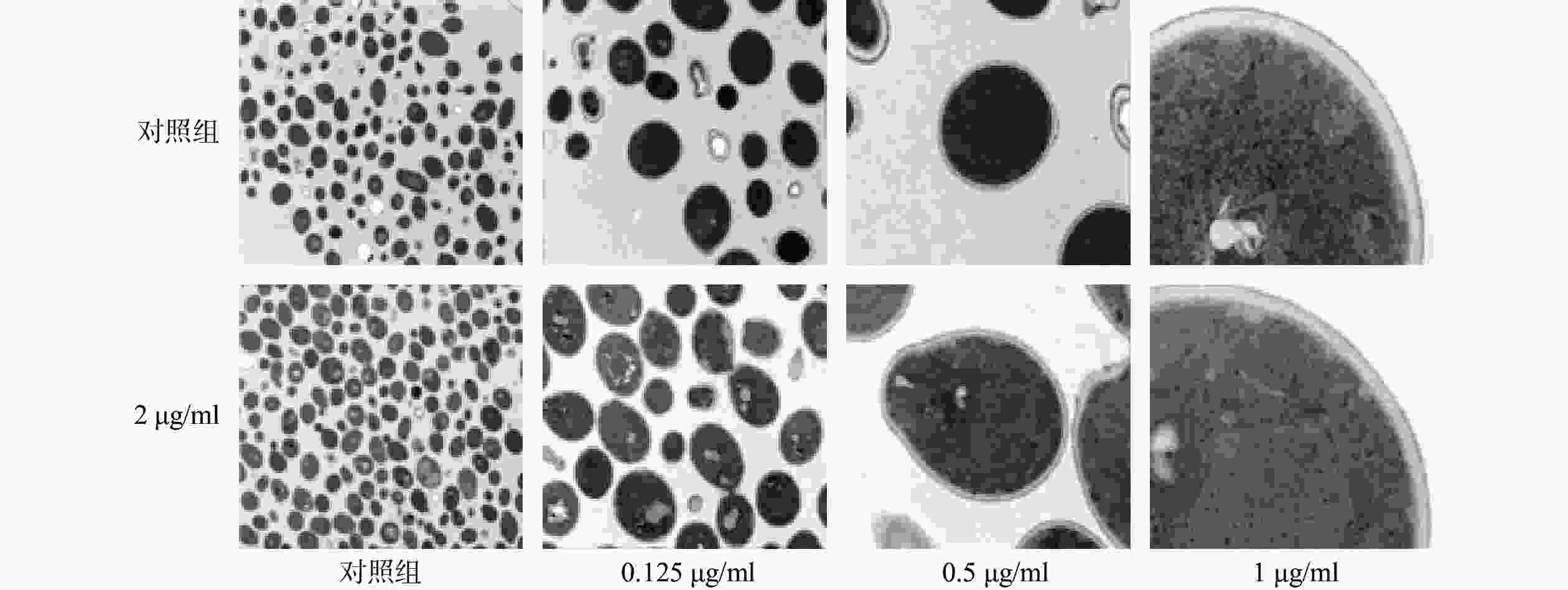
N2化合物对于白念珠菌菌丝形成诱导影响:过夜活化的白念珠菌SC5314分别用Spider培养液和RPMI 1640培养液稀释至菌浓度为5×105 CFU/ml,分别加药使N2终浓度为0.5、0.25、0.125 μg/ml。空白对照加入同体积的DMSO,充分混匀,转移至12孔板中,37 ℃,静置培养3 h,倒置显微镜观察菌丝形态。
XTT法测定N2化合物抗生物被膜形成实验:活化白念珠菌SC5314,离心后去除培养基,用无菌PBS洗菌3次,然后用RPMI 1640液体培养基稀释菌液至1×106 CFU/ml。取TC处理的96孔板制备反应板,37 ℃恒温培养培养30 min,使细胞沉降黏附在孔板底面。然后吸弃上清,用PBS缓冲液洗涤3次。在处理完成的96孔板第一列加入RPMI 1640培养基,第12列加入菌液,第2~11列每2列为一组,分别加入一定量的N2化合物使其浓度为32、16、8、4、2 μg/ml。将96孔板置于恒温培养箱中37 ℃静置培养24 h,随后吸弃上清液并用PBS洗涤3次。之后每孔加入200 μl XTT/Menadione溶液,37 ℃避光孵育3 h。每孔吸取100 μl 上层液体并转移到另一块96孔板对应的位置,用酶标仪测定各孔A值(490 nm)[10-11]。
-
为进一步明确N2化合物对白念珠菌细胞壁和细胞膜的影响,研究设置了2组白念珠菌。一组用2 μg/ml的N2化合物处理,另一组不进行加药处理,作为对照。处理16 h后用2%的戊二醛固定,随后采用透射电镜详细观察2组白念珠菌的形态结构。
-
在RPMI 1640培养液中,采用临床分离的氟康唑耐药白念珠菌103和538(氟康唑单用时,MIC80>32 μg/ml),考察N系列化合物的抗真菌活性。通过对N系列化合物9种衍生物的体外抗真菌活性研究发现,N系列化合物中N2、N6和N8单用对白念珠菌均有一定的抗真菌活性,而N2化合物的MIC最低,为0.5 μg/ml和1 μg/ml,抗真菌作用显著,这些结果表明吡啶鎓类化合物具有体外抗真菌活性,后续可以通过结构改造进一步获得活性更高的类似物开展深入研究。结果见表1。
表 1 N系列化合物对氟康唑耐药白念珠菌103和538的MIC80值
化合物 结构式 白念珠菌103 MIC80 (μg/ml) 白念珠菌538 MIC80 (μg/ml) N1 
>16 >16 N2 
0.5 1 N3 
>16 16 N4 
>16 >16 N5 
>16 >16 N6 
8 8 N7 
>16 >16 N8 
16 8 N9 
>16 >16 -
通过对N1-N9化合物的初步筛选,发现N2的抗真菌活性最强。因此,我们选定N2进行了抗真菌谱的考察。为探究临床常见致病真菌对N2化合物的敏感性,选用国际标准菌C. albicans SC 5314以及9种氟康唑耐药的白念珠菌(C. albicans 876、C. albicans 311、C. albicans 538、C. albicans 103、C. albicans 911、C. albicans 849、C. albicans 100、C. albicans 32、C. albicans 1010)、隐球菌(Cryptococcus H99、Cryptococcus 32609)、光滑念珠菌C. glabrata 537、热带念珠菌C. tropicalist 293、近平滑念珠菌C. parapsilosis 22019、克柔念珠菌C. krusei 463,用微量液基稀释法测定了这些菌株对应的MIC80值。通过不同菌株对应的MIC80值可以发现,N2化合物对这些临床上常见的致病真菌均起到了明显的抑制作用,结果见表2,这些结果表明吡啶鎓类化合物N2具有广谱的抗真菌活性,对于临床常见的具有致病性的酵母菌均有较强的体外抗真菌活性。
表 2 N2化合物处理后菌株对应MIC80值
菌株名称 N2 MIC80(μg/ml) C. albicans SC5314 0.5 C. albicans 876 1.0 C. albicans 311 0.5 C. albicans 538 1.0 C. albicans 103 0.5 C. albicans 911 0.5 C. albicans 849 1.0 C. albicans 100 1.0 C. albicans 32 0.5 C. albicans 1010 1.0 Cryptococcus H99 1.0 Cryptococcus 30609 2.0 C. glabrata 537 0.5 C. tropicalis 293 0.5 C. parapsilosis 22019 0.5 C. krusei 463 2.0 -
通过纸片扩散法,我们以氟康唑为对照探究了N2化合物的抑菌效果。结果显示,相同剂量下,N2化合物和氟康唑均可在培养皿上形成圆形抑菌圈,直径随药量增加而增大。N2化合物处理组抑菌圈内无散在菌落,边界清晰,在培养皿上形成的抑菌圈直径明显大于氟康唑处理组。据此,我们可以认为N2化合物体外抑菌效果优于氟康唑。N2化合物处理组内部无克隆生长提示N2化合物可能具有一定的杀菌能力而不仅仅是抑制作用,结果如图1。
-
为了进一步考察N2对白念珠菌的抑制作用,测定了N2抑制白念珠菌的时间-生长曲线。A值(600 nm)反映了白念珠菌的生长情况,通过不同时间点的测定发现,浓度为2 μg/ml时,N2对白念珠菌的生长增殖有明显的抑制作用(P<0.05),白念珠菌在12 h内,A值(600 nm)的值几乎没有升高,而在24 h时,A值(600 nm)的值仍显著低于未加药组。当N2的浓度增加至4 μg/ml时,白念珠菌在24 h内几乎不能增殖,A值(600 nm)与起始的测定值相当,结果如图2。上述结果表明,化合物N2具有明显的抑制真菌增殖的作用。
为明确化合物N2是否有杀菌功效,我们使用N2化合物处理白念珠菌后,进行涂板培养。测定了0、3、6、9、12、24 h培养基内存活的菌落数。通过测定N2化合物浓度为0、2、4、8 μg/ml时对应的时间-杀菌曲线,发现N2浓度为8 μg/ml时,可以显著降低培养基中白念珠菌的数量,显示出明显的杀菌活性。当N2浓度为2 μg/ml时,白念珠菌3 h时数量减少,而后续数量会增加,提示2 μg/ml 的N2基本不能杀灭培养基中的白念珠菌,结果如图3。上述结果表明,白念珠菌在低浓度时发挥抑菌活性,而当浓度升高时,展现出杀菌活性。
-
酵母态向菌丝态的转换是白念珠菌在体内发生侵袭的重要过程。为了考察N2对白念珠菌菌丝形成的抑制作用,我们采用了不同的菌丝诱导模型考察化合物N2对白念珠菌菌丝形成的作用。结果显示,37 ℃条件下,无论在菌丝诱导培养基YPD+FBS%或RPMI 1640培养基中,当N2的浓度高于1 μg/ml时,白念珠菌基本维持在酵母态,菌丝形成被完全抑制,结果如图4。同时,化合物N2的菌丝抑制的浓度与表2中检测的MIC80值相当,这一结果表明,化合物N2在1 μg/ml以上的浓度时,可以同时抑制菌丝形成和白念珠菌增殖。
-
采用XTT法考察了化合物N2对白念珠菌被膜形成的抑制作用。结果显示,在RPMI 1640培养基中,4 μg/ml和8 μg/ml的N2可以抑制约50%的被膜形成,而当浓度继续升高至16 μg/ml或32 μg/ml时,N2对被膜的抑制率到达70%左右,结果如图5。上述结果表明化合物N2可以显著抑制白念珠菌的被膜形成,后续的结构改造和深入研究可以为抗被膜形成药物的研发提供新的方向。
-
通过对比N2化合物处理组和对照组白念珠菌的电镜照片,结果如图6,我们发现:N2处理后,白念珠菌的表面绒毛状明显增厚,细胞壁分布不均,细胞膜内层变薄,由此推断可能是几丁质和β-1,3-葡聚糖变少。因此,N2化合物可能主要通过损伤白念珠菌细胞膜和细胞壁发挥杀真菌作用。
-
近年来,随着免疫抑制剂的广泛使用、手术介入和免疫缺陷患者的增多,系统性真菌感染的发病率逐年攀升。但抗真菌药物的研发进展缓慢,现有的几类抗真菌药物在长期使用后也逐渐出现了耐药性。为解决临床真菌感染的问题,研发新的抗真菌药物意义重大。本课题组长期致力于抗真菌化合物的筛选和机制研究,前期在基于破坏真菌线粒体功能的研究中发现,亲脂性吡啶鎓盐具有较好的线粒体靶向性和抗真菌活性,因此课题组拓展了化合物的结构类型,本研究中考察了亲脂性吡啶鎓盐的作用。通过体外MIC测定和抗菌谱筛选发现了3个具有抗真菌活性的化合物N2、N6和N8,其中N2结构中含有2个叔丁基的苯环结构,N6含有一个长饱和碳链,均增加了吡啶鎓盐的亲脂性,这些亲脂性基团可能有利于增强吡啶鎓盐的抗真菌活性。后续可以根据上述结构,开展进一步的结构改造。研究前期通过体外筛选结果表明,N2化合物具有体外抗真菌活性较高和抗真菌谱广泛的特点,对包括部分氟康唑耐药菌在内的临床常见致病念珠菌和隐球菌均有一定的抑制作用。尤其是对临床上造成感染问题最为严重的白念珠菌,N2化合物展现出较强的抗菌效果,能够高效地抑制和杀伤白念珠菌。而杀真菌药物是近年来研究的重要方向,通过杀菌活性将体内的念珠菌彻底清除,可以减少念珠菌感染的复发问题,缩短真菌感染的治疗周期。
本研究有望为抗真菌药物研发提供新的思路,但目前涉及的机制研究尚不深入,后续将基于吡啶鎓盐的线粒体靶向性,考察其对线粒体的形态、膜电位、线粒体DNA和线粒体能量代谢的影响,进一步明确该类化合物的作用机制,为后续的结构改造和靶点研究提供理论支撑。
Investigation on the antifungal activity of pyranium derivatives N2
-
摘要:
目的 研究N2系列化合物的抗真菌作用。 方法 利用微量液基稀释法考察化合物N2系列化合物的体外抗真菌活性;在菌丝和被膜诱导条件下考察N2化合物对白念珠菌菌丝和被膜形成的抑制效果。 结果 N2化合物对临床常见条件致病真菌白念珠菌有明显抗真菌活性; N2化合物可以明显抑制白念珠菌菌丝生长和被膜的形成;N2化合物可以通过损伤白念珠菌细胞膜和细胞壁发挥杀菌作用。 结论 N2化合物具有较为广泛的抗真菌谱,能起到明显的体外抗真菌效果,对真菌菌丝和生物被膜的形成均有明显的抑制作用,可以认为N2化合物具有抗真菌潜力,可作为先导化合物,指导进一步改造。筛选获得了具有抗真菌活性的N2化合物,为抗真菌药物研发和解决真菌耐药问题提供新思路。 Abstract:Objective To study the antifungal activity of N2 derivatives. Methods The anti-fungal activity of N2 compounds was investigated by micro-liquid dilution. Then the activity of N2 compounds on hyphal and biofilm formation was investigated. Results N2 compounds had significant antifungal activity against Candida albicans. It also expressed actively inhibitory effect on hyphal and biofilm formation. The mechanism of its fungicidal function was to damage the structure of candida albicans’ cell membrane and cell wall. Conclusion The results showed that N2 had obvious antifungal activity against Candida albicans., which provided a new idea for the development of antifungal drugs and the solution of antifungal drugs resistance. -
Key words:
- N2 compound /
- antifungal activity /
- Candida albicans /
- hyphae formation
-
表 1 N系列化合物对氟康唑耐药白念珠菌103和538的MIC80值
化合物 结构式 白念珠菌103 MIC80 (μg/ml) 白念珠菌538 MIC80 (μg/ml) N1 >16 >16 N2 0.5 1 N3 >16 16 N4 >16 >16 N5 >16 >16 N6 8 8 N7 >16 >16 N8 16 8 N9 >16 >16 表 2 N2化合物处理后菌株对应MIC80值
菌株名称 N2 MIC80(μg/ml) C. albicans SC5314 0.5 C. albicans 876 1.0 C. albicans 311 0.5 C. albicans 538 1.0 C. albicans 103 0.5 C. albicans 911 0.5 C. albicans 849 1.0 C. albicans 100 1.0 C. albicans 32 0.5 C. albicans 1010 1.0 Cryptococcus H99 1.0 Cryptococcus 30609 2.0 C. glabrata 537 0.5 C. tropicalis 293 0.5 C. parapsilosis 22019 0.5 C. krusei 463 2.0 -
[1] BERMAN J, KRYSAN D J. Drug resistance and tolerance in fungi[J]. Nat Rev Microbiol, 2020, 18(6):319-331. doi: 10.1038/s41579-019-0322-2 [2] LEE Y J, PUUMALA E, ROBBINS N, et al. Antifungal drug resistance: molecular mechanisms in Candida albicans and beyond[J]. Chem Rev, 2021, 121(6):3390-3411. doi: 10.1021/acs.chemrev.0c00199 [3] OLIVER J D, SIBLEY G E M, BECKMANN N, et al. F901318 represents a novel class of antifungal drug that inhibits dihydroorotate dehydrogenase[J]. Proc Natl Acad Sci USA, 2016, 113(45):12809-12814. doi: 10.1073/pnas.1608304113 [4] MOTA FERNANDES C, DASILVA D, HARANAHALLI K, et al. The future of antifungal drug therapy: novel compounds and targets[J]. Antimicrob Agents Chemother, 2021, 65(2):e01719-e01720. [5] WONG S S W, KAO R Y T, YUEN K Y, et al. In vitro and in vivo activity of a novel antifungal small molecule against Candida infections[J]. PLoS One, 2014, 9(1):e85836. doi: 10.1371/journal.pone.0085836 [6] ZHANG Y E, LI Q H, CHAO W, et al. Design, synthesis and antifungal evaluation of novel pyrylium salt in vitro and in vivo[J]. Molecules, 2022, 27(14):4450. doi: 10.3390/molecules27144450 [7] CHEN X Q, WU J Y, SUN L, et al. Antifungal effects and potential mechanisms of benserazide hydrochloride alone and in combination with fluconazole against Candida albicans[J]. Drug Des Dev Ther, 2021, 15:4701-4711. doi: 10.2147/DDDT.S336667 [8] FENG W L, YANG J, MA Y, et al. Cotreatment with aspirin and azole drugs increases sensitivity of Candida albicans in vitro[J]. Infect Drug Resist, 2021, 14:2027-2038. doi: 10.2147/IDR.S314538 [9] VAN OS W, ZEITLINGER M. Predicting antimicrobial activity at the target site: pharmacokinetic/pharmacodynamic indices versus time–kill approaches[J]. Antibiotics, 2021, 10(12):1485. doi: 10.3390/antibiotics10121485 [10] GIRARDOT M, MILLOT M, HAMION G, et al. Lichen polyphenolic compounds for the eradication of Candida albicans biofilms[J]. Front Cell Infect Microbiol, 2021, 11:698883. doi: 10.3389/fcimb.2021.698883 [11] FERNÁNDEZ-CALDERÓN M, HERNÁNDEZ-GONZÁLEZ L, GÓMEZ-NAVIA C, et al. Antifungal and anti-biofilm activity of a new Spanish extract of propolis against Candida glabrata[J]. BMC Complement Med Ther, 2021, 21(1):147. doi: 10.1186/s12906-021-03323-0 -





 下载:
下载: