-
类风湿关节炎(RA)以对称性多关节滑膜炎为主要临床表现,具有异质性、系统性,呈慢性、进行性、侵袭性,如无恰当治疗,则病情逐渐加重而形成永久性骨质破坏并最终出现残疾,甚至累及脏器和神经系统而危及生命。通过早诊断、早治疗,阻止关节炎症病变发展成不可逆的骨破坏至关重要。目前常用的治疗RA药物如非甾体抗炎药、糖皮质激素、改善病情的抗风湿药、免疫抑制剂及生物制剂等,可在较短的时间改善患者的临床症状,但长期使用存在不良反应增多、费用较高、单一靶向作用疗效受限等问题,因此寻找有效、低毒、价廉及适合长期服用的RA药物,成为研究热点。
RA属于中医学“历节风”、“顽痹”、“骨痹”、“鹤膝风”等范畴。《素问•痹论》云:“风寒湿三气杂至,合而为痹”,治疗以祛风散寒除湿,通络止痛为主。青风藤为防己科植物青藤Sinomenium acutum(Thunb.)Rehd. et Wils.和毛青藤Sinomenium acutum(Thunb.)Rehd. et Wils. var. cinereum Rehd. et Wils.的干燥藤茎(《中国药典》2020年版),其性味苦、辛、平,归肝、脾经,能有效祛风除湿,通络止痛。《本草汇言》载“青风藤,散风寒湿痹之药,能舒筋活血,正骨利髓。”《本草纲目》认为有“治风湿流注,历节鹤膝”之功。现代研究显示以青风藤为主要药物的汤剂,可有效延缓疾病发展,改善患者临床症状[1-2];青风藤的有效成分青藤碱也具有较好的抗炎镇痛和抑制自身抗体产生的作用,在治疗RA方面,具有较好的临床疗效和较低的副作用[3]。本文旨在通过对青风藤进行网络药理学分析,以期探索其物质基础及可能的作用机制,为进一步研究青风藤治疗RA提供理论依据。
-
中药系统药理学数据库和分析平台(TCMSP)是国内相对完善的中药成分靶点数据库,收录了中药502味,相关靶点3 339个,同时对每个成分的药动学参数进行了详细的描述。通过TCMSP获取青风藤的化学成分。再根据化合物口服生物利用度(OB)与类药性指数(DL)筛选活性成分,其中OB阈值设为OB≥30%,DL阈值设为DL≥0.18[4-5]。下载活性成分的结构,将活性成分的结构保存为mol2格式。
-
DRAR-CPI(https://cpi.bio-x.cn/drar/)是基于DOCK分子对接程序开发的反向分子对接服务器,可对接药物分子和蛋白的三维结构和特征,并通过蛋白-配体相互作用能的亲和性以函数打分并排序。对接分数(Z-score)代表药物分子与蛋白的相互作用强度。服务器研发者认为,Z-score <−1的蛋白质是良好的潜在靶点。通过DRAR-CPI服务器筛选出青风藤有效成分的蛋白靶点后,利用UniProt数据库对靶点处理,得到标准名称,获取基因靶点。
-
通过对Geencards数据库、OMIM数据库进行检索,得到RA的相关靶点。
-
为明确青风藤与RA潜在靶点间的相互作用,利用Venn在线软件将药物与疾病靶点取交集,通过Venn图的形式展现药物靶点与疾病靶点间存在的交集靶点,运用Cytoscape软件进行可视化分析。
-
将筛选得到的药物-疾病共同靶点上传至String在线平台数据库,构建蛋白质相互作用网络模型,获得PPI网络。
-
利用clusterProfiler程序包(3.6版)对药物-疾病共同靶点进行GO分析和KEGG通路分析,设定阈值P<0.05,并按照涉及的靶点数目多少进行排序,筛选GO富集分析中分子功能、细胞组成和生物过程的前10个条目以及KEGG富集的前10个信号通路,进一步筛选与RA相关的信号通路,探讨青风藤抗RA的生物学过程及信号通路。
-
从TCMSP共获得青风藤16个化学成分,以OB>30%,DL>0.18为筛选条件,共筛选出有效活性成分6个(表1)。
表 1 青风藤有效成分
成分代码 化合物名称 OB (%) DL MOL000358 β-谷固醇(beta-sitosterol) 36.91 0.75 MOL000621 拉兹马宁碱(16-epi-Isositsirikine) 49.52 0.59 MOL000627 千金藤啶碱(stepholidine) 33.11 0.54 MOL000625 青藤碱(sinomenine) 46.09 0.53 MOL000623 乌心石环氧内酯(michelenolide) 47.54 0.25 MOL000622 甘露聚糖(magnograndiolide) 63.71 0.19 -
登陆DRAR-CPI服务器并上传青风藤有效活性成分结构的mol2格式文件,筛选Z-score <−1的蛋白靶点的PDB ID导入Uniprot数据库,获取6个有效活性成分的潜在基因靶点合计383个。其中,存在多个有效成分对应同一基因靶点的情况,经去重处理后,共获得青风藤潜在基因靶点176个。
-
通过Geencards数据库得到RA相关靶点4329个,通过筛选设置relevance score≥15,最终获得305个相关靶点,OMIM数据库得到与RA相关靶点13个,筛重后获得疾病相关靶点305个。
-
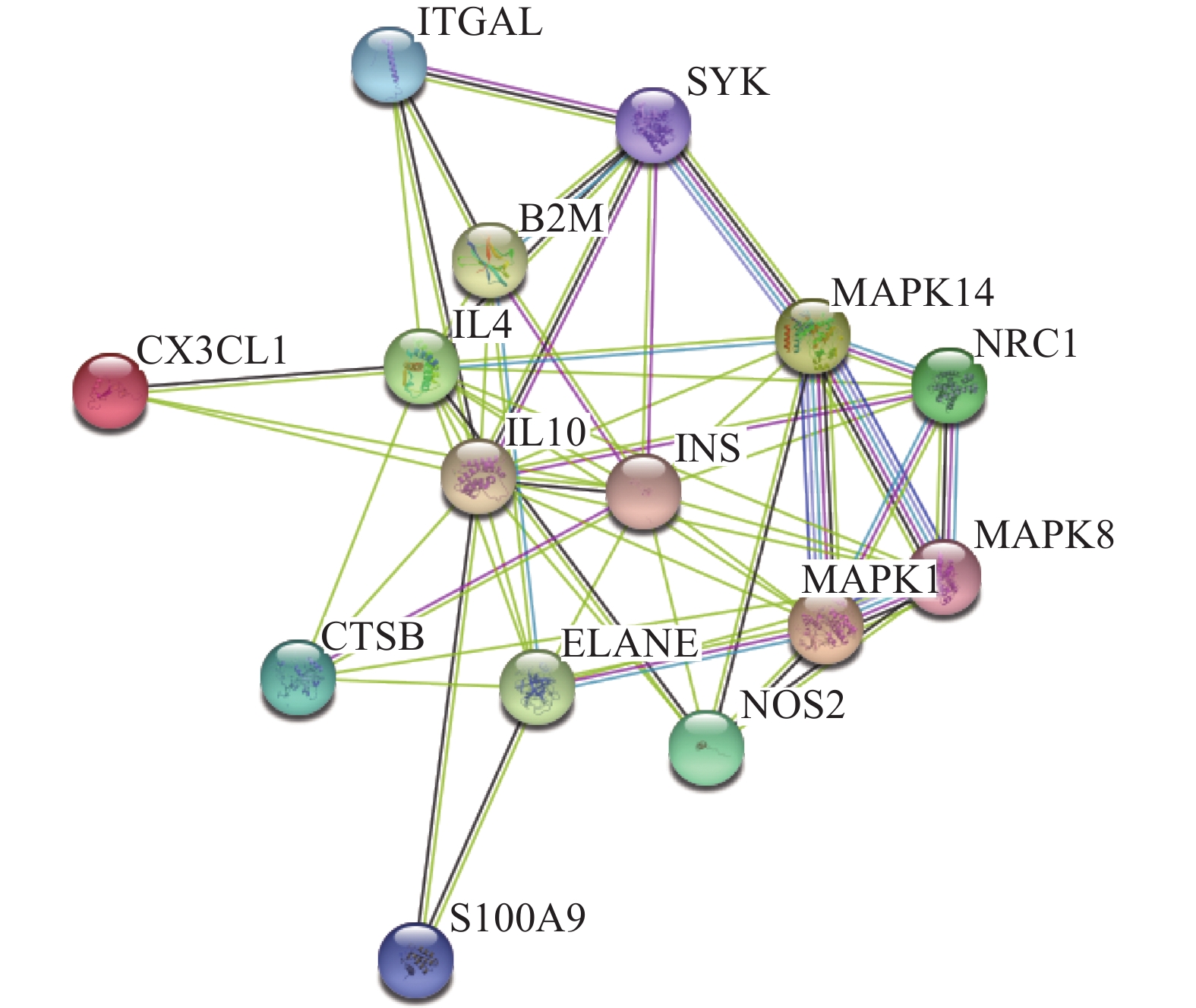
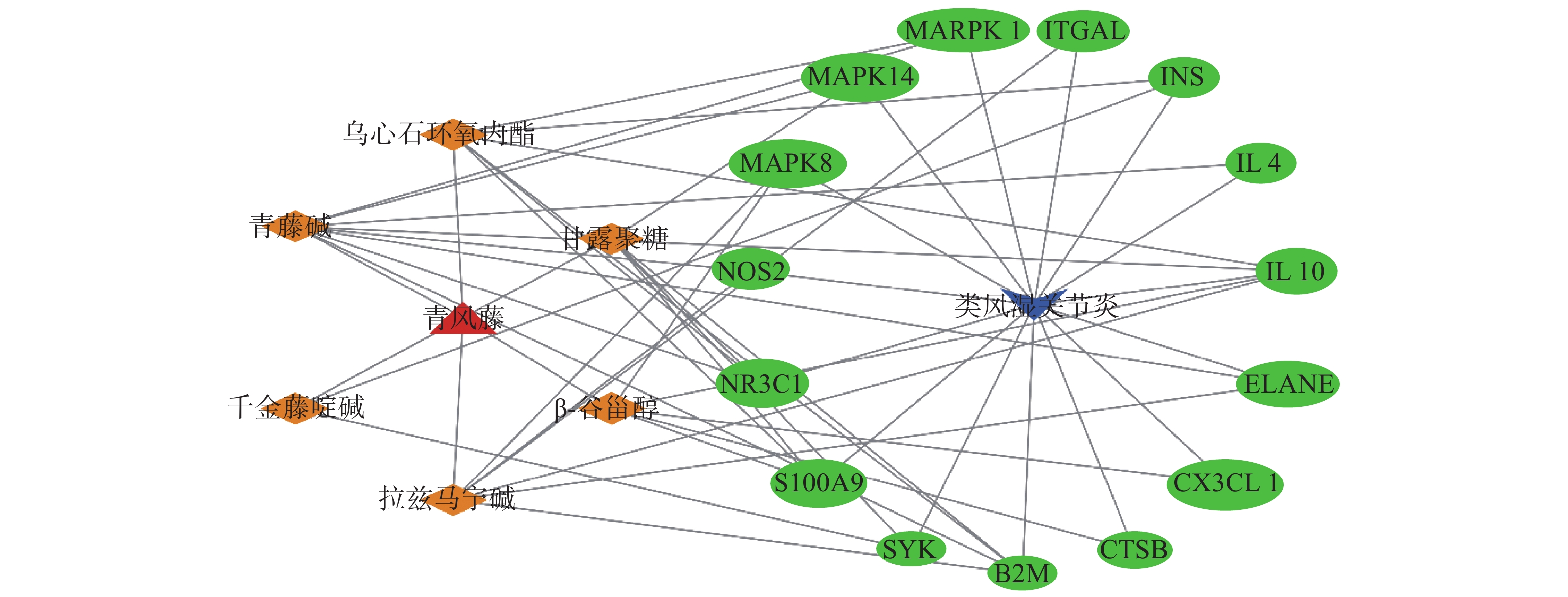
利用Venn 2.1软件将“青风藤”活性成分对应的176个靶点与RA对应的305个靶点进行交集,获得15个共有靶点(图1)。将15个共有靶点导入Cytoscape 3.7.2软件,构建“青风藤-化合物-靶点-RA”的网络图并进行可视化分析(图1)。该网络包含了23个节点,100条边,其中,三角形代表药物;燕尾形代表疾病;菱形代表活性成分;椭圆形代表靶点;连接化合物与靶点的边表示它们之间有作用关系。依据网络拓扑学性质可知,靶点度值(degree)是拓扑结构中的重要参数,其表示网络中和节点相连的路线的条数,度值高的节点很可能在整个网络中起到桥梁作用,有较多节点的化合物或药物靶点在整个网络中可能起到关键的作用。本研究筛选度值较大的节点进行分析,排名前3位的化合物分别为青藤碱(sinomenine)、拉兹马宁碱(16-epi-isositsirikine)及乌心石环氧内酯(michelenolide),其分别能与8、6及6个靶点蛋白发生作用。从靶点的角度看,排名前4位的是IL-10、B2M、NR3C1及S100A9,分别能与4、4、3及3个化合物发生相互作用,体现了中药多靶点的特性。
-
将Venn图获得的15个药物-疾病共同靶点上传至String在线数据库平台得到PPI网络(图2),同时得到网络中相关节点的度值。在此网络中包含节点15个,边55条,度值均值7.33。根据“度值>均值”筛选出关键靶点7个,包括:IL-10、IL-4、INS、MAPK8、ELANE、MAPK1、MAPK14。度值最高的是IL-10,为14;其次为IL-4,度值为13;INS度值为12。度值大的靶点提示在网络调控中起着关键作用,度值大的靶点很可能是青风藤治疗RA的关键靶点。
-
GO是Gene Ontology的简称,主要包括生物过程(BP)、细胞组成(CC)及分子功能(MF)3个部分。本研究GO功能富集分析显示500个生物过程(BP)、18个细胞组成(CC)、28个分子功能(MF),分别对BP、CC及MF前10个条目进行可视化分析,得到图3,其中纵坐标表示富集条目,横坐标表示富集个数。图4显示共同作用靶点在BP中,主要富集条目为对细菌起源分子的反应、细胞对生物刺激的反应,调节DNA结合转录因子活性、积极调节细胞因子的产生、调节炎症反应,以及对中性粒细胞活化的调节、对脂多糖的反应等;共同作用靶点在CC中主要富集条目为分泌颗粒内腔、细胞质囊泡腔、内体腔、液泡腔等;共同作用靶点在MF中主要富集条目为MAP激酶活性、Toll样受体结合、细胞因子受体结合、蛋白质丝氨酸/苏氨酸激酶活性、磷酸酶结合、细胞因子活性等。
-
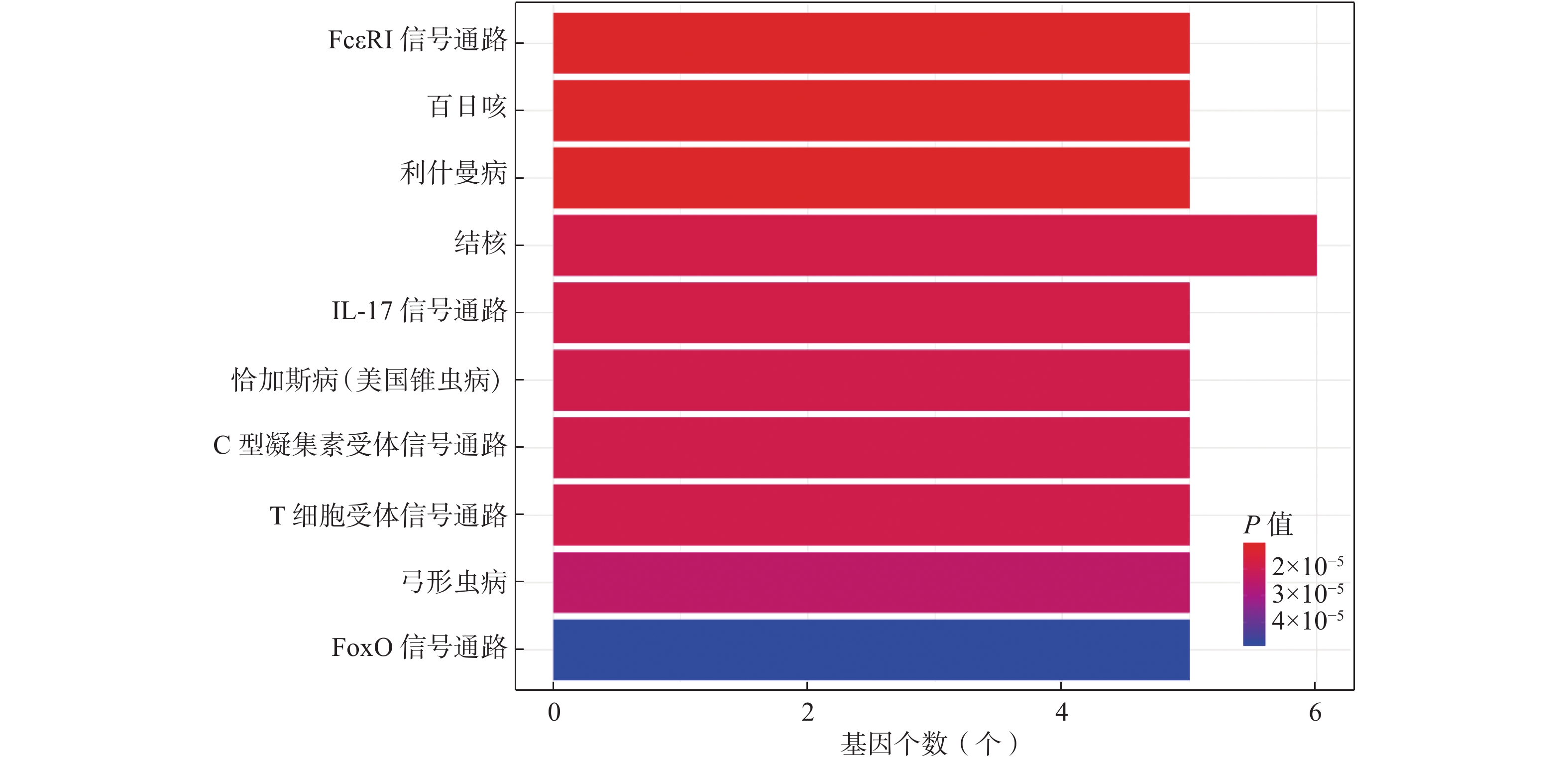
KEGG通路富集分析显示77条通路,对前10条通路进行可视化分析,得到图4,其中纵坐标表示富集通路的名称,横坐标表示富集基因个数。前10条通路显示,靶点主要富集于FcεRI信号通路、百日咳、利什曼病、结核、IL-17信号通路、恰加斯病(美国锥虫病)、C型凝集素受体信号通路、T细胞受体信号通路、弓形虫病、FoxO信号通路等,多为感染、炎症和免疫相关通路。其中涉及到的靶点基因,出现频次较高的是MAPK1、MAPK14、MAPK8、IL-10及IL-4。
-
痹病,是人体正气不足或脏腑功能失调,风寒湿热等邪为患,痰浊瘀血滞留,引起经脉气血不通,出现肢体关节疼痛肿胀及活动不利等为特征的疾病。中药青风藤功能祛风除湿,通络止痛,在痹病治疗中应用较多,疗效可靠。由于中药是一个多成分多靶标并且可以调节机体内多个生物学途径的复杂混合物系统,中药中的化学成分可以作用于机体内多个靶标从而发挥协同作用来治疗疾病,给中药作用机制的研究带来了一定的挑战。近年来,网络药理学发展十分迅速,已成为在药理学研究中一个很有价值的工具,现今也逐渐应用到中医药研究领域,对单位中药及中药复方中活性药物成分的预测和分析、阐述复方的分子作用机制有重要意义[6-9]。
本研究通过TCMSP筛选青风藤有效活性成分6个,分别是β-谷固醇、拉兹马宁碱、千金藤啶碱、青藤碱、乌心石环氧内酯、甘露聚糖。通过DRAR-CPI服务器筛选出青风藤靶点176个。使用GeenCards及OMIM数据库得到与RA相关靶点305个。药物靶点与疾病靶点进行Venn图绘制,获得共同相关的15个靶点。将这15个共同靶点上传至String在线数据库平台得到PPI网络,根据“度值>均值”筛选出关键靶点7个,包括:IL-10、IL-4、INS、MAPK8、ELANE、MAPK1、MAPK14。GO功能富集分析显示500个BP、18个CC、28个MF。KEGG通路富集分析显示77条通路,排名前10的信号通路集中在感染、炎症和免疫等相关通路。
已有的研究提示,β-谷甾醇是植物甾醇的重要组成成分,具有抗炎、调节人体甾体激素、抗氧化及抗肿瘤等作用[10]。Kripa等研究发现,含有β-谷甾醇的白术醇提物可明显降低佐剂型关节炎大鼠血清和组织中的TNF-α、C-反应蛋白和IL-2的含量,证明含有β-谷甾醇的白术具有显著的抗炎作用[11]。拉兹马宁碱可调节COX-2表达[12]。千金藤啶碱不仅具有镇痛及对多巴胺D1激动、D2拮抗、D3拮抗等多重作用,对心脏也具有较强的生物活性[13]。青藤碱具有免疫抑制、抗炎、镇痛、抗心律失常、降血压等多种药理作用,已经被证明在治疗多种疾病中有药理学活性[12]。
本研究中药物与疾病共同的15个靶点,主要参与对细菌起源分子的反应、细胞对生物刺激的反应、调节DNA结合转录因子活性、调节细胞因子的产生、调节炎症反应、对中性粒细胞活化的调节、对脂多糖的反应等生物学过程。主要参与FcεRI信号通路、百日咳、利什曼病、结核、IL-17信号通路、恰加斯病(美国锥虫病)、C型凝集素受体信号通路、T细胞受体信号通路、弓形虫病、FoxO信号通路等感染、炎症和免疫相关通路。这些通路中涉及次数较多的靶基因依次为MAPK1、MAPK14、MAPK8、IL-10及IL-4。总之,提示青风藤具有多成分、多靶点、多通路、多途径的作用特点,通过不同靶点和通路发挥药效以治疗RA。
RA特征性的病理改变包括关节滑膜组织炎性细胞浸润、血管翳形成及对关节骨和软骨以及周围组织造成破坏与侵蚀,在免疫介导的RA的炎症、增生和骨破坏三大病理过程中,MAPK都起着重要的调节作用。IL-10、IL-4作为抑炎和抗炎因子,参与了RA的炎症过程,高水平的细胞因子不断刺激T细胞、破骨细胞、滑膜细胞,导致细胞内的蛋白激酶异常激活和过度的信号传导,从而调控相关基因的过量表达。研究表明,对胶原诱导的关节炎大鼠给予MAPK信号转导通路抑制剂后,在抑制滑膜炎症、骨质破坏和关节软骨的破坏方面,与未给信号通路抑制剂组相比有显著性差异[14]。以MAPK信号通路作为治疗靶点,然后针对其信号传递中的各个阶段抑制其活化,已经成为治疗RA的一个热点。研究显示,用青藤碱与针刺联合治疗大鼠胶原性关节炎,关节炎评分降低,症状好转。同时,核因子κB和磷酸化的p38丝裂原活化蛋白激酶(MAPK)蛋白表达被抑制,提示可能通过核因子κB和MAPK信号通路发挥作用[15]。
本研究通过中药活性成分的筛选、靶点预测、网络构建与分析,从“药物-化合物-靶点-疾病”的关联性对青风藤治疗RA的相关作用机制进行分析,找出了关键靶点和通路,MAPK信号通路也可作为后续研究的参考。为中药青风藤治疗RA的临床和实验研究提供了部分依据和理论支持。同时,本研究尚存在一些局限性,如数据库中数据可能不完全,获取小分子化合物及作用靶标数量有限,不能完全揭示中药药理作用;依托网络构建的数据来源中存在对某些研究热点倾向性,可能对本研究结果产生影响,但仍需进一步做验证实验,以准确揭示中药抗RA有效成分及作用机制。
Mechanism of Sinomenii caulis in the treatment of rheumatoid arthritis based on network pharmacology
-
摘要:
目的 应用网络药理学研究方法,探讨青风藤治疗类风湿关节炎(RA)的可能作用机制。 方法 使用中药系统药理学数据库与分析平台(TCMSP)筛选青风藤的化学成分,并依据TCMSP数据库的口服生物利用度(OB)和类药性指数(DL)筛选出主要有效活性成分。借助DRAR-CPI分子对接服务器得到有效活性成分的潜在作用靶点。通过Genecards、OMIM数据库筛选出RA的靶点,利用Venn软件获取药物与疾病的共同靶点,运用Cytoscape软件构建“化合物-靶点-疾病”网络图。使用String数据库绘制靶蛋白相互作用(PPI)网络,利用clusterProfiler程序包对有效作用靶点进行GO功能、KEGG通路富集分析。 结果 该研究共筛选出青风藤有效活性成分6个,作用靶点176个;RA靶点305个;青风藤治疗RA的靶点15个。GO功能富集分析显示500个生物过程(BP)、18个细胞组成(CC)、28个分子功能(MF)。KEGG通路富集分析显示77条通路。 结论 该研究初步揭示了青风藤中以青藤碱为主的6种有效活性成分发挥了抗RA的作用,治疗的关键靶点与IL-10、IL-4、INS、MAPK8、ELANE、MAPK1、MAPK14有关,涉及的生物学过程及信号通路主要与感染、炎症及免疫相关,为进一步的分子生物学实验研究奠定了基础。 Abstract:Objective To explore the molecular targets and associated potential pathways of Sinomenii caulis in the treatment of rheumatoid arthritis (RA) based on network pharmacology. Methods The constituents of Sinomenii caulis were searched by Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform (TCMSP). The potential active ingredients were screened based on oral bioavailability (OB) and drug like index (DL) in TCMSP database. The potential targets of active ingrediens were explored based on DRAR-CPI docking server. RA related gene targets were retrieved through GeneCards and OMIM database. Venn online software was used to obtain the common target of drugs and diseases. The "herbs-compound-target-disease" network diagram was constructed by using Cytoscape software. String database was used to draw the protein interaction (PPI) network. Gene Ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) pathway analysis of the intersection network were conducted by Bioconductor Database. Results 6 active ingredients and 176 targets were identified. 305 target genes directly related to RA were obtained from the GeneCards and OMIM databases. 15 genes were obtained from the intersection of component-target and disease-target. The GO function analysis found 500 items on biological process (BP), 18 items on cellular component (CC), and 28 items on molecular function (MF). KEGG pathway enrichment analysis revealed 77 pathways. Conclusion This study identified six active ingredients from Sinomenii caulis and revealed the key targets of the anti-RA treatment with Sinomenii caulis being IL10、IL4、INS、MAPK8、ELANE、MAPK1 and MAPK14. The important biological processes and signaling pathways including infection, inflammation and immunity were explored. It has laid the foundation for further molecular biology experiments. -
Key words:
- Sinomenii caulis /
- rheumatoid arthritis /
- network pharmacology /
- signaling pathways
-
疲劳的定义为机体生理过程不能维持其机能在一特定水平上,或不能维持预定的运动强度[1]。由于疲劳的分子机制并不清楚,目前并无真正官方认可的抗疲劳药物。一些天然产物,如人参、红景天、大蒜等,以及营养补充剂,如维生素、矿物质和肌酸等,报道有抵抗肌肉疲劳、提高运动成绩的效应,但是效果缓慢而不显著[2];苯丙胺、莫达非尼、咖啡因等药物虽能快速改善疲劳,但实质为中枢兴奋药,存在成瘾、耐受、改变生物节律等问题[3]。因此,抗疲劳药物的进一步研发,对改善生活质量、提升运动成绩、提高军事作业能力有重要意义。
组织糖原含量与疲劳的发生密切相关[4]。本课题组通过大规模化合物合成和筛选,获得了一个全新小分子化合物HMS-01,可以通过促进肝脏和肌肉组织糖原的储存,改善疲劳后组织损伤,显著增加肌肉耐力,发挥抗疲劳的作用。为了进一步了解HMS-01的药动学特点以及在组织中的分布,本课题组采用液相色谱-串联质谱(LC-MS/MS)技术[5-6],研究建立灵敏、特异的测定血浆等生物样品中HMS-01浓度的分析方法,并开展HMS-01在大鼠体内的药动学研究,为后续药物研发提供理论依据。
1. 仪器与试药
1.1 仪器
Agilent 1290 InfinityⅡ液相色谱仪(Agilent Technologies,美国)、4000 Q-Trap型串联质谱仪(AB Sciex,美国);低温高速离心机(Thermo,德国);XW 80A型涡旋混合器(医大仪器,上海);Mettler AE240十万分之一电子天平(梅特勒-托利多,瑞士);Millipore-Q超纯去离子水净化仪(Millipore,美国)。
1.2 试药
HMS-01(西安秦申嘉合药物研究有限公司,批号HMS-1-1010-3);罗红霉素(Sigma,CAS:2058-46-0);乙腈(色谱纯,Fisher Chemical);甲酸(色谱纯,Fisher Chemical);其他试剂为市售分析纯。
2. 方法与结果
2.1 色谱条件
色谱柱为Gemini C18(50 mm×2.0 mm, 5 μm),流动相:含5 mmol甲酸铵及1 mmol甲酸的水溶液(A)-含1 mmol甲酸的乙腈(B),梯度洗脱,洗脱程序如下:0~2 min,90% A;2~6 min,5% A;6~8 min,90% A。流速:0.35 ml/min,柱温:25 ℃,进样量5μl,运行时间8 min。
2.2 质谱条件
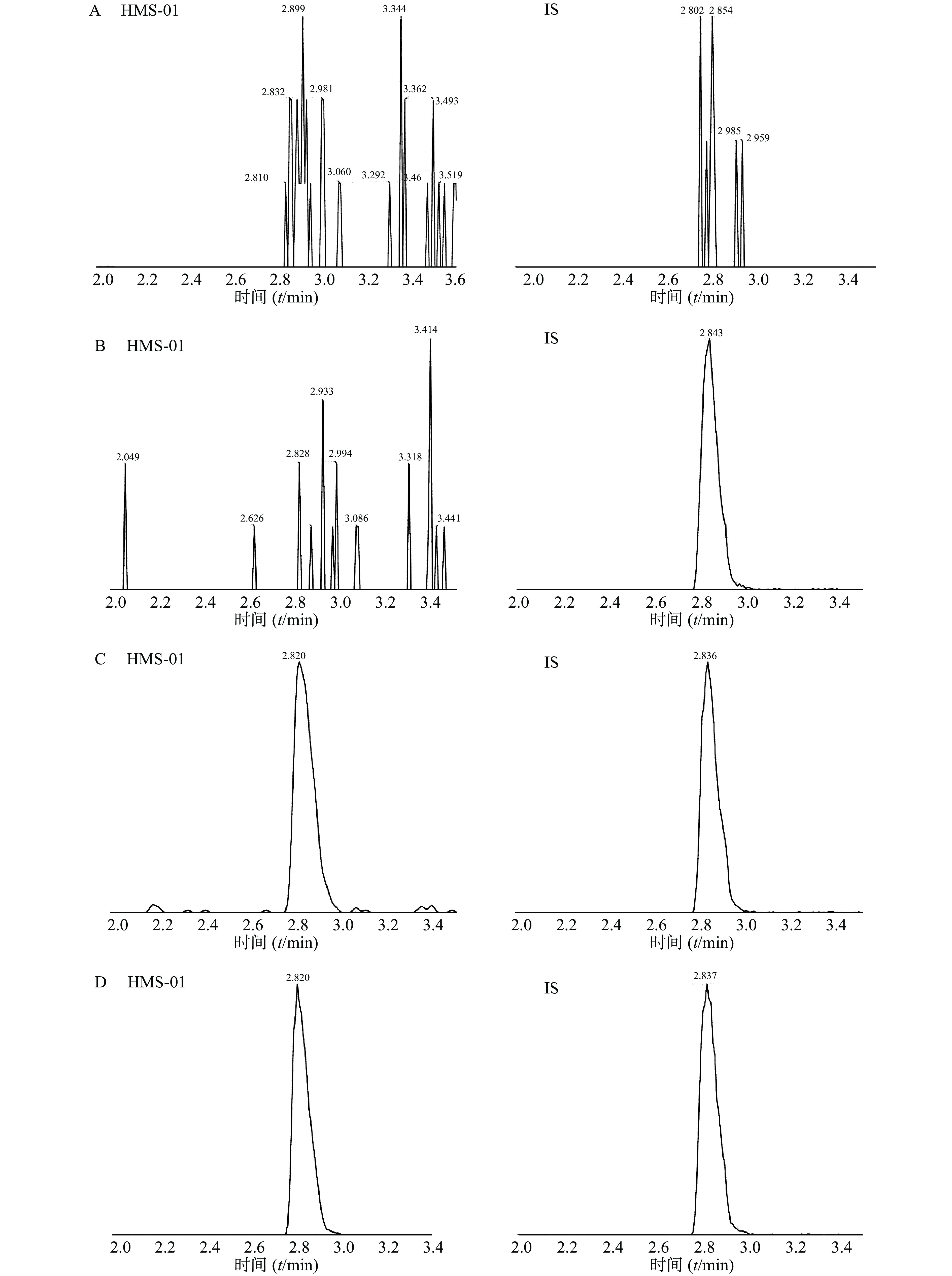
采用ESI正离子模式,多反应离子监测模式(MRM)进行二级扫描;动态反应监测的离子对参数:HMS-01 772.5→614.5;罗红霉素(IS)837.5→158.1。离子源参数设置:干燥气温度350 ℃;干燥气流速10 L/min;雾化器压力40 psi;鞘气温度400 ℃;鞘气流速11 L/min;毛细管电压4 000 V;喷嘴电压500 V。HMS-01保留时间为2.834 min,罗红霉素保留时间为2.839 min,色谱图如图1所示。
2.3 标准曲线溶液的配制和质控样品的制备
精密称取HMS-01对照品772.5 mg,置于10 ml容量瓶中,加甲醇溶解并稀释至刻度,摇匀,得质量浓度为77.25 mg/ml对照品储备液。再采用逐级稀释法配置质量浓度为772.5、386.25、193.125、96.563、48.281、24.141、12.070、6.035、3.018、1.509、0.754 ng/ml的系列含对照品血浆溶液;随行质控样品中HMS-01的低、中、高质量浓度分别为3.09、30.9、618 ng/ml。以上溶液置于4 ℃冰箱备用。
2.4 血浆样品前处理方法
取50 μl血浆样品于离心管中,加入200 μl(含41.875 ng/ml的IS内标)乙腈溶液,涡旋60 s,4 ℃条件下3 000×g离心10 min,取上清液进样。
2.5 线性关系考察
按“2.3”项和“2.4”项中的方法制备标准曲线,平行操作5份,按上述LC-MS/MS条件,连续进样分析,以对照品浓度(X)为横坐标,HMS-01的峰面积与内标的峰面积比值(Y)为纵坐标,进行线性回归,得线性方程:
Y=0.009 3 X+0.005 08, r = 0.999 3,
线性范围为0.976~1 000 ng/ml,以信噪比为3或5时测得HMS-01的最低定量限均为976 pg/ml。
2.6 精密度试验
按“2.3”项和“2.4”项中的方法制备低、中、高3种浓度的质控样品,平行操作5份,连续3 d,计算实测浓度。如表1所示,精密度用相对标准偏差(RSD)表示,结果日内精密度RSD≤12%,日间精密度RSD≤9%;准确度以相对回收率表示,实测浓度与理论加入浓度的比值即为相对回收率。结果表明日内、日间结果准确度范围在87%~106%。
表 1 HMS-01在大鼠血浆中的精密度和准确度(n=5)浓度(ng/ml) 日内 日间 实测浓度(ng/ml) 精密度(%) 准确度(%) 实测浓度(ng/ml) 精密度(%) 准确度(%) 3.09 2.71±0.27 7.7 87.9 2.71±0.27 7.5 87.9 30.9 31.4±4.8 11.8 102 32.6±3.6 8.4 106 618 618±46 5.8 100 618±46 5.4 98.4 2.7 基质效应和提取回收率
按“2.3”项和“2.4”项中的方法制备低、高2种浓度含药血浆,平行操作6份;取空白血浆按“2.4”项下处理,甲醇代替内标溶液,取处理好的空白血浆样品加入相应浓度对照品溶液,使之浓度与待测物的峰面积理论浓度一致,分别制备6份;将待测化合物标准溶液用甲醇稀释,使之与待测物的峰面积理论浓度一致,进样6次。基质效应等于(含基质样品的峰面积)/(80%乙腈溶液的峰面积),提取回收率等于(待测物的峰面积)/(含基质样品的峰面积),考察内标的基质效应和提取回收率操作步骤同上。低、高两种浓度待测物及内标提取回收率均在60%~75%之间,基质效应均在5.6%~6.1%之间,具体结果见表2。
表 2 待测物基质效应和提取回收率(n=6)待测物 浓度(ng/ml) 提取回收率(%) 基质效应(%) HMS-01 3.09 68±3 6.1 618 63±4 5.7 内标 3.35 73±2 6.1 670 73±2 5.6 2.8 稳定性试验
按“2.3”项和“2.4”项中的方法制备低、高2种浓度含药血浆,分别考察样品前处理后室温放置24 h,3次冻融循环以及-70 ℃保存30 d的稳定性,测定样品浓度,计算平均值,并计算RSD(%)及相对偏差RE(%),计算公式:RE%=(实测值−真实值)/真实值×100%。结果见表3。测定结果的RE范围为2%~17%,RSD均小于7%,表明样本稳定性良好。
表 3 样品稳定性(n =3)条件 浓度(ng/ml) RSD(%) RE(%) 室温24 h 3.09 3.7 16.5 618 1.0 2.6 3次冻融循环 3.09 6.7 4.5 618 0.6 5.9 –70 ℃保存30 d 3.06 6.8 8.7 6.18 0.6 10.1 2.9 HMS-01药动学研究
SD大鼠12只,分成2组,每组6只,雌雄各半。给药前禁食12 h,自由饮水。按30 mg/kg的剂量单次灌胃、1 mg /kg的剂量单次静注给药。灌胃给药的,于给药前和给药后5、10、20、30 min和1、1.5、2、4、6、8、10、12、24 h分别眼眶采血约100 µl;静注给药的,于给药前和给药后3、8、15、30 min和1、2、3、4、6、8、10、12、24 h分别眼眶采血约100 µl。血液用1%肝素抗凝,8 000×g离心5 min,分离血浆。–70 ℃保存待测。采血过程冰浴避光,以防止光对药物稳定性产生影响。
大鼠单次静注给予1 mg/kg HMS-01后的药动学参数(非房室模型)总结于表4。大鼠静脉注射1 mg/kg HMS-01后,雄、雌大鼠药动学参数血浆浓度-时间曲线下面积(AUC)、平均清除率(CL)显示有极显著性差异(P<0.01),药动学参数血浆消除半衰期(t1/2)、表观分布容积(V)均呈显著性差异(P<0.05)。雄性大鼠AUC0-t为221 ng·h/ml,CL为4.53 L/h·kg,为大鼠肝脏血流量(约3.3 L/h·kg)的137%,体内清除快, t1/2约为0.786 h,V为5.13 L/kg;雌性大鼠AUC0-t为409 ng·h/ml,CL为2.41 L/h·kg,为大鼠肝脏血流量的73%,体内清除较快, t1/2约为1.27 h,V为3.82 L/kg。
表 4 大鼠静注1 mg/kg HMS-01后血浆药动学参数($ \bar { x}\pm { s}$ ,n=6)性别 AUC0-t (ng·h/ml) AUC0-∞ (ng·h/ml) MRT0-∞ (t/h) t1/2z (t/h) CLz (L/h·kg) Vz (L/kg) cmax (ng/ml) 雄性 221±12.6 221±12.4 0.776±0.022 0.786±0.039 4.53±0.252 5.13±0.388 491±112 雌性 409±23.3** 416±21.0** 1.270±0.115 1.090±0.141* 2.41±0.120** 3.82±0.666* 571±55.1 合计 315±105 319±108 1.030±0.282 0.940±0.193 3.47±1.17 4.47±0.871 531±90.3 大鼠单次灌胃给予30 mg/kg HMS-01后的药动学参数(非房室模型)总结见表5。灌胃给予30 mg/kg HMS-01后,雄、雌大鼠药动学参数AUC显示有极显著性差异(P<0.01),药动学参数CL、F显示有显著性差异(P<0.05)。在大鼠体内血浆浓度达峰时间tmax为1.17 h,达峰浓度cmax为1 243 ng/ml,消除半衰期t1/2为2.00 h。雄、雌大鼠AUC0-t分别为2 271和8 529 ng·h/ml,生物利用度分别为34.3%和69.5%。
表 5 大鼠灌胃30 mg/kg HMS-01后血浆药代动力学参数($\bar { x}\pm { s}$ ,n=6)性别 AUC0-t (ng·h/ml) AUC0-∞ (ng·h/ml) MRT0-∞ (t/h) t1/2z (t/h) tmax (t/h) CLz/F (L/h·kg) Vz/F (L/kg) cmax (ng/ml) F(%) 雄性 2 271±666 2 279±667 2.58±0.156 1.43±0.130 1.17±0.289 14.00±4.31 28.5±7.04 729±263 34.3±10.1 雌性 8 529±1 920** 9 071±1 529** 4.79±1.39 2.58±1.060 1.17±0.289 3.38±0.629* 13.1±7.78 1757±584 69.5±15.6* 合计 5 400±3 661 5 675±3 867 3.68±1.50 2.00±0.924 1.17±0.258 8.69±6.44 20.8±10.7 1 243±694 51.9±22.6 3. 讨论
HMS-01在大鼠体内的药动学过程存在显著的性别差异。口服吸收的比较,雌性大鼠的生物利用度远高于雄性,体内的清除速率方面,雌性比雄性慢,与此同时,HMS-01在雌性体内的半衰期也更长。存在性别差异的原因有待进一步深入研究。本实验采用的分析方法的特异性、灵敏性、准确性、精密度及稳定性均满足定量分析的要求。鉴于HMS-01在大鼠血浆中不稳定的情况,在做动物实验时,课题组将采取以下措施:全血采集后立刻在4 ℃下离心2 min获取血浆,随即立刻取50 µl血浆样品加入至200 µl含内标的乙腈中,从而阻断血浆中的水解酶对化合物进行水解。
-
表 1 青风藤有效成分
成分代码 化合物名称 OB (%) DL MOL000358 β-谷固醇(beta-sitosterol) 36.91 0.75 MOL000621 拉兹马宁碱(16-epi-Isositsirikine) 49.52 0.59 MOL000627 千金藤啶碱(stepholidine) 33.11 0.54 MOL000625 青藤碱(sinomenine) 46.09 0.53 MOL000623 乌心石环氧内酯(michelenolide) 47.54 0.25 MOL000622 甘露聚糖(magnograndiolide) 63.71 0.19 -
[1] 王国芬. 青风藤汤对类风湿关节炎患者Tfh、IL-21及抗CCP抗体的影响[J]. 现代实用医学, 2019(8):1005-1007. doi: 10.3969/j.issn.1671-0800.2019.08.006 [2] 许超, 张方, 吴倩, 等. 青风藤汤联合甲氨蝶呤对类风湿关节炎患者滤泡辅助性T细胞及白介素-21的影响[J]. 中国中西医结合杂志, 2017(7):781-784. doi: 10.7661/j.cjim.20170515.092 [3] 张永立, 欧阳桂林, 肖涟波. 青藤碱治疗类风湿关节炎作用机制研究进展[J]. 中西医结合学报, 2009, 7(8):775-779. [4] TAO W Y, XU X, WANG X, et al. Network pharmacology-based prediction of the active ingredients and potential targets of Chinese herbal Radix Curcumae formula for application to cardiovascular disease[J]. J Ethnopharmacol,2013,145(1):1-10. doi: 10.1016/j.jep.2012.09.051 [5] XU X, ZHANG W X, HUANG C, et al. A novel chemometric method for the prediction of human oral bioavailability[J]. Int J Mol Sci,2012,13(6):6964-6982. doi: 10.3390/ijms13066964 [6] 胡亚洁, 赵晓锦, 宋咏梅, 等. 基于网络药理学的中药复方研究探讨[J]. 时珍国医国药, 2018, 29(6):1400-1402. [7] 张雨, 李恒, 李克宁, 等. 复方中药网络药理学的研究进展[J]. 中成药, 2018, 40(7):1584-1588. doi: 10.3969/j.issn.1001-1528.2018.07.029 [8] LING C Q. Traditional Chinese medicine is a resource for drug discovery against 2019 novel coronavirus (SARS-CoV-2)[J]. J Integr Med,2020,18(2):87-88. doi: 10.1016/j.joim.2020.02.004 [9] ZHANG D H, WU K L, ZHANG X, et al. In silico screening of Chinese herbal medicines with the potential to directly inhibit 2019 novel coronavirus[J]. J Integr Med,2020,18(2):152-158. doi: 10.1016/j.joim.2020.02.005 [10] 任建敏. 食物中植物甾醇生理活性及药理作用研究进展[J]. 食品工业科技, 2015, 36(22):389-393. [11] KRIPA K G, CHAMUNDEESWARI D, THANKA J, et al. Modulation of inflammatory markers by the ethanolic extract of Leucas aspera in adjuvant arthritis[J]. J Ethnopharmacol,2011,134(3):1024-1027. doi: 10.1016/j.jep.2011.01.010 [12] 蔡强, 向莹, 岳涛. 基于网路药理学方法预测青风藤药理机制[J]. 现代中医药, 2019, 39(2):108-112. [13] 周淑媛, 施铮, 刘峥, 等. 左旋千金藤啶碱增加离体大鼠心肌收缩力的作用[J]. 中药药理与临床, 2009, 25(2):23-26. [14] NISHIKAWA M, MYOUI A, TOMITA T, et al. Prevention of the onset and progression of collagen-induced arthritis in rats by the potent p38 mitogen-activated protein kinase inhibitor FR167653[J]. Arthritis Rheum,2003,48(9):2670-2681. doi: 10.1002/art.11227 [15] XU M M, LIU S F, WAN R J, et al. Combined treatment with sinomenine and acupuncture on collagen-induced arthritis through the NF-κB and MAPK signaling pathway[J]. Oncol Lett,2018,15(6):8770-8776. -





 下载:
下载:
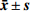
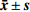
 下载:
下载: