-
骨质疏松症(osteoporosis, OP)是以骨微细结构破坏和骨量减少为特征的全身性骨代谢疾病,可导致骨脆性和骨折风险增加,多见于老年人。衰老是致骨质疏松的一个重要因素,随着机体的衰老,骨骼中过多的活性氧(reactive oxygen species, ROS)抑制成骨细胞的增殖、分化和成熟,抑制成骨细胞分泌骨基质及骨基质的矿化,同时促进破骨细胞骨吸收,导致骨质疏松的发生。2018年国家卫生健康委员会发布OP流行病学调查结果显示,我国65岁以上人群OP患病率达32.0%,其中,男性为10.7%,女性为51.6%[1]。四烯甲萘醌(menatetrenone, MK4)在临床上常单独或协同用于防治老年性骨质疏松症,疗效显著[2-3],是我国现版《原发性骨质疏松症诊疗指南》和《骨质疏松症中西医结合诊疗指南》的推荐药物[1-2]。药理研究发现,MK4能促进成骨增殖、分化和碱性磷酸酶(alkaline phosphatase, ALP)活性[3-4]。MK4能通过调节氧化应激相关基因和蛋白,在成骨细胞骨形成中发挥保护作用[5],且能阻止成骨细胞凋亡[6]。过氧化氢(H2O2)是ROS在体内存在的主要形式,会穿透成骨细胞造成细胞损伤,本研究拟探讨MK4对H2O2刺激成骨细胞氧化损伤的保护作用和调控机制,阐明MK4抗老年性骨质疏松的作用机制。
-
成骨细胞系MC3T3-El(中国科学院上海生命科学研究细胞资源中心);特级胎牛血清(FBS)、DMEM高糖培养基、胰蛋白酶、双抗(青霉素和链霉素混合液)和PBS缓冲液(pH=7.2)均购自美国GIBCO公司;噻唑蓝(MTT)、MK4(Sigma公司)。过氧化氢(H2O2,比利时Acros Organics公司);丙二醛(MDA)试剂盒、谷胱甘肽(GSH)试剂盒、超氧化物歧化酶(SOD)试剂盒、JC-1线粒体膜电势(MMP)试剂盒和活性氧(ROS)试剂盒均购自上海碧云天生物技术有限公司;BCA蛋白检测试剂盒、Annexin V-FITC/PI凋亡检测试剂盒、核酸提取试剂盒、反转录试剂盒和扩增试剂盒(均为Thermo Fisher公司产品);叉头框蛋白(FoxO1和FoxO3)、β细胞淋巴瘤/白血病基因2(Bcl2)和凋亡基因(Bax)等引物购自生工生物工程(上海)股份有限公司。
-
复苏MC3T3-El小鼠成骨细胞系,置于5 ml含10% FBS的DMEM培养基中,放入37 ℃、5% CO2培养箱。以2×104/ml浓度的成骨细胞接种于96孔培养板中培养24 h后,分别采用0、10、20、50和100 μmol/L(n =10)的H2O2处理,培养4、12、24 h后,采用碧云天MTT试剂盒测定细胞活力。
以2×104/ml浓度的成骨细胞接种于96孔培养板中培养24 h后,并按空白、氧化应激模型、药物剂量分组:①对照组,②选择合适浓度H2O2组,③H2O2 +10 μmol/L MK4组,④H2O2 +1 μmol/L MK4组,⑤H2O2 + 0.1 μmol/L MK4组。加入药物培养24 h,采用MTT法检测细胞增殖活性。
-
以2×104/ml浓度的成骨细胞接种于96孔培养板中培养24 h,按照方法“2.1”项下设置各实验组,连续培养6 d,每3 d换液1次,采用硝基苯酚磷酸二钠法检测ALP活性。给药6 d后,弃培养液,PBS洗3次,依次加入100 μl二乙醇胺(50 mmol/L),50 μl的对硝基苯酚磷酸二钠(2.5 mmol/L),在37 ℃孵育30 min,再加入50 μl的0.3 mol/L氢氧化钠溶液终止反应,置405nm处,测吸光度值(A)。以不同浓度的对硝基苯酚溶液绘制标准曲线,ALP活性由每孔释放的对硝基苯酚的μmol数表示。
-
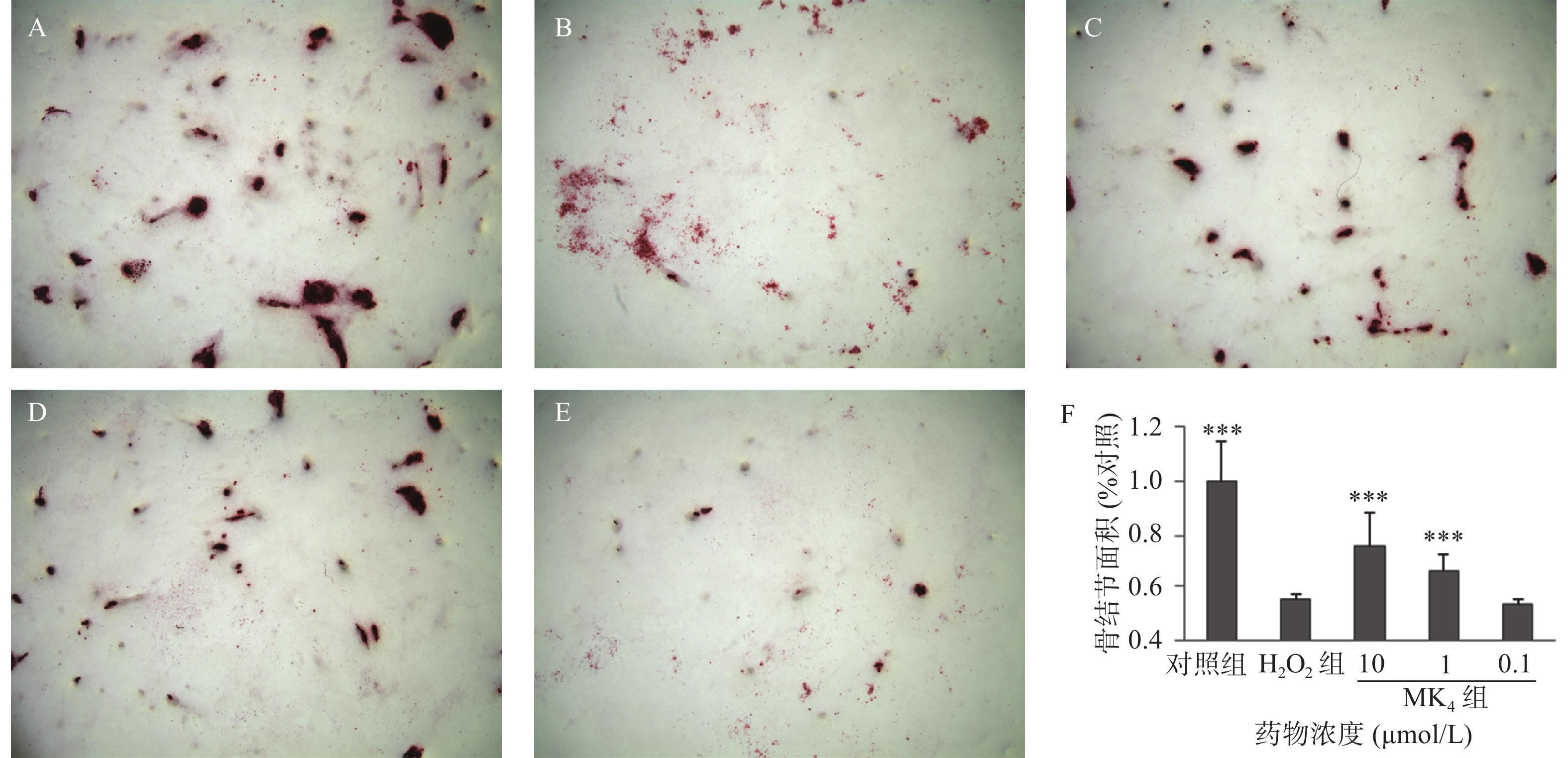
以5×104/ml浓度的成骨细胞将MC3T3-El细胞接种于12孔板内,放入37 ℃,5% CO2培养箱,12 h后换骨结节诱导培养基(0.1%牛血清白蛋白、10 nmol/L地塞米松、10 mmol/L β-甘油磷酸钠、50 μg/ml抗坏血酸以及10%胎牛血清的DMEM培养基)培养24 h,按照方法“2.1”项下设置各实验组,每3 d换液1次,连续培养14 d,采用0.1%茜素红-Tris-Hcl染液(pH 8.3)染色,37 ℃下染色30 min,采用倒置相差显微镜(Leica DMI 3000)观察,并随机拍照10张,用image-Pro Plus (IPP 6.0)分析骨结节面积。
-
以2×105/ml细胞浓度铺6孔板,培养24 h后,按照方法“2.1”项下设置各实验组,干预24 h后,用荧光酶标仪法分别测定JC-1单体和复合物的荧光,DCFH-DA探针法测活性氧水平,ELISA法测定GSH、SOD和MDA水平。
-
以1×106/ml细胞浓度铺6孔板,培养12 h后,按照方法“2.1”项下设置各实验组,干预24 h后,依据Annexin V-FITC/PI凋亡检测试剂盒说明书,采用流式细胞仪法检测。
-
以1×106/ml细胞浓度铺6孔板,培养12 h后,按照方法“2.1”项下设置各实验组,干预24 h后,依据试剂盒说明书进行提取总RNA和反转录后,分别对GAPDH、SOD2、FoxO1、FoxO3、Bcl-2和bax进行RT-PCR扩增,引物序列见表1,PCR反应条件:采用预变性95 ℃、10 min,变性95 ℃、45 s,退火60 ℃、45 s,延伸72 ℃、50 s,循环40次,总反应体系为10 μl。
表 1 小鼠引物序列
基因 上游引物 下游引物 SOD2 TCCCAGACCTGCCTTACGA TCGGTGGCGTTGAGATTG FoxO1 GTACGCCGACCTCATCACCAAG GCACGCTCTTCACCATCCACTC FoxO3 TGCTAAGCAGGCCTCATCTCAA AAGCTGTAAACGGATCACTGTC Bcl-2 AGGAGCAGGTGCCTACAAGA GCATTTTCCCACCACTGTCG bax CATCCAGGATCGAGCAGA GCCTTGAGCACCAGTTTG GAPDH TGAACGGGAAGCTAAGG TCCACCACCCTGTTGCTGGA -
每组实验重复3次。采用SPSS软件经ANOVA方差分析检验,差异有统计学意义(α=0.05),再采用Student's t test检验进行两组比较,以P<0.05为差异有统计学意义。
-
MC3T3-E1经0~100 μmol/L H2O2分别处理4、12、24 h,结果发现0~100 μmol/L H2O2处理4 h对细胞活力均无显著性影响(P>0.05),处理12 h后,在50和100 μmol/L H2O2下的细胞活力显著降低,分别降低19.4%和33.4%。H2O2干预24 h后,在20、50、100 μmol/L均具有显著性差异,分别降低13.2%,47.4%和57.9%(表2)。故后续实验选择20 μmol/L处理24 h。
表 2 H2O2处理的时间与浓度对成骨细胞活力的影响
处理时间(t/h) 对照组 H2O2浓度(μmol/L) 10 20 50 100 4 0.22±0.04 0.23±0.03 0.22±0.04 0.21±0.05 0.20±0.04 12 0.31±0.05 0.33±0.04 0.30±0.04 0.27±0.02* 0.22±0.03* 24 0.38±0.03 0.39±0.03 0.34±0.02* 0.20±0.03** 0.16±0.04** *P<0.05,**P<0.01,与对照组比较。 -
MC3T3-E1经20 μmol/L H2O2处理24 h后,结果显示,显著抑制了成骨细胞的细胞活力(P<0.05),ALP活性(P<0.05)和骨结节形成面积(P<0.05),与空白组比较,分别降低13%、16%和85%,见表3和图1。与模型组比较,MK4在1~10 μmol/L可促进H2O2损伤成骨细胞增殖(P<0.05)。同样,MK4在1~10 μmol/L能显著改善ALP活性(P<0.05)和提高骨结节形成面积(P<0.05),分别增加50.7%和44.5% (表3和图1)。
表 3 MK4对H2O2损伤成骨细胞的影响
组别 MTT(%对照) ALP(%对照) MPP(%对照) 活性氧(%对照) MDA(μmol/g) 细胞凋亡率(%) 对照组 1.00±0.01* 1.00±0.02* 1.00±0.02* 1.00±0.01* 27.2±4.3** 2.3±0.3* H2O2组 0.87±0.02 0.84±0.03 0.78±0.05 1.13±0.02 51.0±3.7 7.3±0.3 H2O2+MK4(10 μmol/L)组 1.03±0.04* 0.99±0.03* 1.05±0.07* 1.02±0.02* 27.3±3.1** 1.8±0.2* H2O2+MK4(1 μmol/L)组 0.96±0.03 0.87±0.04 0.88±0.21 1.06±0.05 44.8±2.0 2.9±0.3* H2O2+MK4(0.1 μmol/L)组 0.85±0.03 0.80±0.03 0.82±0.09 1.09±0.05 51.6±0.3 5.7±0.4 *P<0.05,**P<0.01,与H2O2组比较。 -
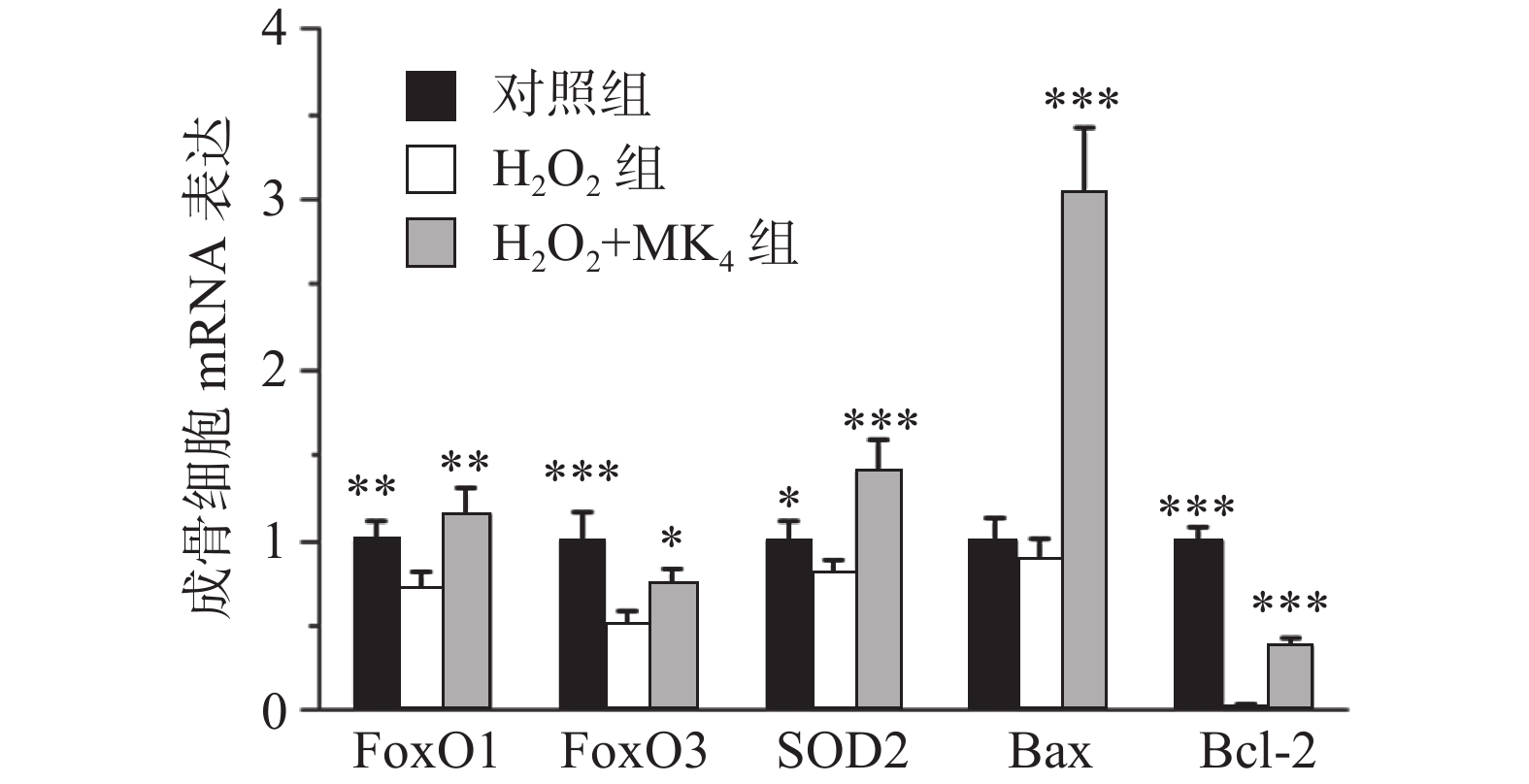
MC3T3-E1成骨细胞经20 μmol/L H2O2处理24 h后,结果发现显著降低成骨细胞膜电势和增高活性氧含量(P<0.05)。与模型组比较,MK4在10 μmol/L可促进H2O2损伤成骨细胞膜电势升高和降低活性氧含量(P<0.05)。与空白组比较,20 μmol/L H2O2能显著降低FoxO1, FoxO3和SOD2的mRNA表达(P<0.05)。与H2O2组比较,给予10 μmol/L MK4后,FoxO1, FoxO3和SOD2的mRNA表达均显著增高(P<0.01)。
-
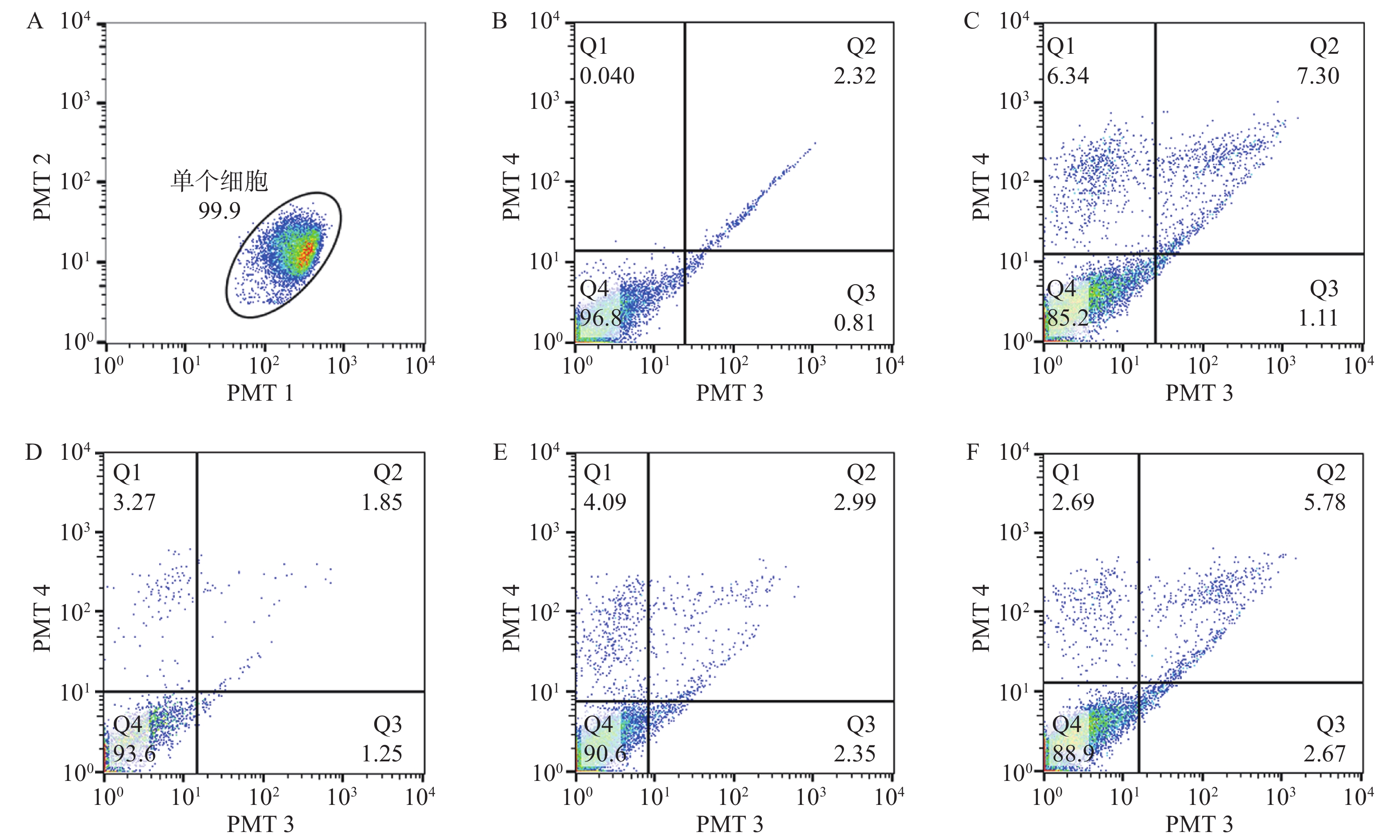
在通道1和通道2观察单个细胞分布区域,选定99.9%的细胞区域用于后续分析,在通道3和通道4观察凋亡细胞分布,Q4为正常细胞,Q1为坏死细胞;Q2为晚期凋亡细胞,Q3为早期凋亡细胞。与对照组比较,20 μmol/L H2O2处理24 h后,细胞的凋亡率显著增高(P<0.05)。经0.1~10 μmol/L浓度MK4干预24 h后发现,1~10 μmol/L浓度MK4能显著降低细胞凋亡率(P<0.05),与对照组相近,见表3和图2。与空白组比较,20 μmol/LH2O2能显著降低Bcl-2的mRNA表达(P<0.001),bax表达无显著差异,给予10 μmol/L MK4后,Bcl-2和bax的mRNA表达均显著增高(P<0.01),见图3。H2O2组的bax/Bcl-2比值为对照组的22.5倍,而MK4处理后降低至对照组的7.6倍。
-
骨代谢中,机体通过调节FoxOs转录因子的活性,产生抗氧化物酶,对抗氧化应激对骨骼的损伤,包括FoxO1、FoxO3、FoxO4和FoxO6等,其中,FoxO1和FoxO3是调节成骨细胞氧化还原平衡和成骨功能的主要分子[7]。活性氧可激活FoxO1的转录,调节线粒体抗氧化酶Mn-SOD的活性[8]。随着活性氧的升高,FoxO3下调,成骨细胞分化受损,抑制骨形成作用[9]。本研究发现,MK4对H2O2引起的氧化应激具有显著的改善作用,降低活性氧和脂质氧化产物MDA水平,上调转录因子FoxO1、FoxO3和抗氧化酶SOD的mRNA表达。
Bcl-2蛋白可减少氧化应激水平,而bax基因可与Bcl-2形成异源二聚体,抑制Bcl-2的作用,进而诱导细胞凋亡。MK4可上调Bcl-2/bax比值,抑制了成骨细胞凋亡[10]。本研究发现,H2O2能显著提高成骨细胞凋亡率,同时增加bax的表达,降低Bcl-2蛋白表达。MK4处理组对成骨细胞凋亡的拮抗作用明显,随着剂量浓度增加而增加。MK4在在氧化应激状态下,可显著上调Bcl-2,下调bax的基因表达,bax/Bcl-2比值显著降低,抑制了成骨细胞凋亡。
FoxOs激活促进Bcl-2相关凋亡调节蛋白(Bim)转录,Bim是线粒体凋亡通路的核心调控者,引起成骨细胞线粒体膜电位降低[10]。线粒体跨膜电位降低说明线粒体膜通透性转运孔(MPTP)过度开放。若MPTP过度开放,易引起呼吸链解偶联,线粒体基质渗透压增高,使得促凋亡活性物质从线粒体释放入细胞基质,导致细胞凋亡。MK4显著改善了H2O2刺激的成骨细胞线粒体膜电势降低,表明MK4对H2O2刺激成骨细胞的氧化损伤具有保护作用。
综上所述,MK4能显著抑制H2O2刺激的成骨细胞氧化损伤,机制与FoxO转录因子相关。同时,MK4对H2O2引起的成骨细胞凋亡具有拮抗作用,其机制为上调Bcl-2和下调bax的基因表达。
Study on the protective effect of menatetrenone against the oxidative stress of osteoblasts
-
摘要:
目的 考察四烯甲萘醌(MK4)对成骨细胞氧化损伤的保护作用,阐明MK4防治骨质疏松作用机制。 方法 采用过氧化氢(H2O2)刺激小鼠成骨细胞系(MC3T3-E1)氧化应激模型,考察细胞活力、ALP活性和骨结节面积,DCFH-DA法检测活性氧(ROS)水平,JC-1检测线粒体膜电势,Annexin V-FITC/PI法检测细胞凋亡率,RT-PCR法考察氧化应激相关基因FoxO1、FoxO3、SOD、Bcl-2和bax等的mRNA表达。 结果 10 μmol/L四烯甲萘醌能显著提高H2O2刺激的成骨细胞增殖、ALP活性、骨结节形成面积和增强细胞膜电势,显著降低H2O2刺激的成骨细胞内丙二醛和活性氧水平,同时显著降低成骨细胞凋亡率和细胞凋亡因子bax/Bcl-2的mRNA表达水平,显著提高抗氧化酶SOD和转录因子FoxO1、FoxO3的mRNA表达。 结论 四烯甲萘醌可通过调控FoxO通路保护成骨细胞氧化损伤和通过下调bax/Bcl-2比例,降低成骨细胞凋亡。 Abstract:Objective To investigate the protective effect of menatetrenone (MK4) on the osteoblasts in oxidative stress, and to clarify the anti-osteoporosis mechanism of MK4. Methods Mouse osteoblasts (MC3T3-E1) induced by hydrogen peroxide (H2O2) was used. Cell viability, ALP activity and the area of bone nodule were observed. The level of ROS was detected by DCFH-DA, mitochondrial membrane potential by JC-1, apoptosis rate by annexin V-FITC/PI, and the expression of FoxO1, FoxO3, SOD, bcl-2 and bax by RT-PCR. Results Menatetrenone at 10 μmol/L significantly increased the proliferation of osteoblasts stimulated by H2O2, ALP activity, bone nodule formation area, cell membrane potential, the antioxidant SOD and transcription factors FoxO1 and FoxO3 mRNA expression. In the meantime, the elevated malondialdehyde and reactive oxygen species level in cells induced by H2O2, the apoptosis rate and the mRNA expression level of bax/Bcl-2 were significantly reduced. Conclusion menatetrenone can protect osteoblasts from oxidative damage by regulating FoxO pathway and reduce osteoblasts apoptosis by up regulating the proportion of Bcl-2/bax. -
Key words:
- menatetrenone /
- osteoporosis /
- osteoblasts /
- oxidative stress /
- FoxO pathway
-
表 1 小鼠引物序列
基因 上游引物 下游引物 SOD2 TCCCAGACCTGCCTTACGA TCGGTGGCGTTGAGATTG FoxO1 GTACGCCGACCTCATCACCAAG GCACGCTCTTCACCATCCACTC FoxO3 TGCTAAGCAGGCCTCATCTCAA AAGCTGTAAACGGATCACTGTC Bcl-2 AGGAGCAGGTGCCTACAAGA GCATTTTCCCACCACTGTCG bax CATCCAGGATCGAGCAGA GCCTTGAGCACCAGTTTG GAPDH TGAACGGGAAGCTAAGG TCCACCACCCTGTTGCTGGA 表 2 H2O2处理的时间与浓度对成骨细胞活力的影响
处理时间(t/h) 对照组 H2O2浓度(μmol/L) 10 20 50 100 4 0.22±0.04 0.23±0.03 0.22±0.04 0.21±0.05 0.20±0.04 12 0.31±0.05 0.33±0.04 0.30±0.04 0.27±0.02* 0.22±0.03* 24 0.38±0.03 0.39±0.03 0.34±0.02* 0.20±0.03** 0.16±0.04** *P<0.05,**P<0.01,与对照组比较。 表 3 MK4对H2O2损伤成骨细胞的影响
组别 MTT(%对照) ALP(%对照) MPP(%对照) 活性氧(%对照) MDA(μmol/g) 细胞凋亡率(%) 对照组 1.00±0.01* 1.00±0.02* 1.00±0.02* 1.00±0.01* 27.2±4.3** 2.3±0.3* H2O2组 0.87±0.02 0.84±0.03 0.78±0.05 1.13±0.02 51.0±3.7 7.3±0.3 H2O2+MK4(10 μmol/L)组 1.03±0.04* 0.99±0.03* 1.05±0.07* 1.02±0.02* 27.3±3.1** 1.8±0.2* H2O2+MK4(1 μmol/L)组 0.96±0.03 0.87±0.04 0.88±0.21 1.06±0.05 44.8±2.0 2.9±0.3* H2O2+MK4(0.1 μmol/L)组 0.85±0.03 0.80±0.03 0.82±0.09 1.09±0.05 51.6±0.3 5.7±0.4 *P<0.05,**P<0.01,与H2O2组比较。 -
[1] 中国中西医结合学会骨伤科专业委员会. 骨质疏松症中西医结合诊疗指南[J]. 中华医学杂志, 2019, 99(45):3524-3533. doi: 10.3760/cma.j.issn.0376-2491.2019.45.002 [2] 中华医学会骨质疏松和骨矿盐疾病分会. 原发性骨质疏松症诊疗指南(2011)[J]. 中国全科医学, 2011, 4(1):2-17. [3] AKBARI S, RASOULI-GHAHROUDI A A. Vitamin K and bone metabolism: a review of the latest evidence in preclinical studies[J]. Biomed Res Int,2018,2018:4629383. [4] WU W J, GAO H Y, JIN J S, et al. A comparatively study of menaquinone-7 isolated from Cheonggukjang with vitamin K1 and menaquinone-4 on osteoblastic cells differentiation and mineralization[J]. Food Chem Toxicol,2019,131:110540. doi: 10.1016/j.fct.2019.05.048 [5] MUSZYŃSKA M, AMBROŻEWICZ E, GĘGOTEK A, et al. Protective effects of vitamin K compounds on the proteomic profile of osteoblasts under oxidative stress conditions[J]. Molecules,2020,25(8):E1990. doi: 10.3390/molecules25081990 [6] URAYAMA S, KAWAKAMI A, NAKASHIMA T, et al. Effect of vitamin K2 on osteoblast apoptosis: vitamin K2 inhibits apoptotic cell death of human osteoblasts induced by Fas, proteasome inhibitor, etoposide, and staurosporine[J]. J Lab Clin Med,2000,136(3):181-193. doi: 10.1067/mlc.2000.108754 [7] SALIH D A, BRUNET A. FoxO transcription factors in the maintenance of cellular homeostasis during aging[J]. Curr Opin Cell Biol,2008,20(2):126-136. doi: 10.1016/j.ceb.2008.02.005 [8] SIQUEIRA M F, FLOWERS S, BHATTACHARYA R, et al. FOXO1 modulates osteoblast differentiation[J]. Bone,2011,48(5):1043-1051. doi: 10.1016/j.bone.2011.01.019 [9] GÓMEZ-PUERTO M C, VERHAGEN L P, BRAAT A K, et al. Activation of autophagy by FoxO3 regulates redox homeostasis during osteogenic differentiation[J]. Autophagy,2016,12(10):1804-1816. doi: 10.1080/15548627.2016.1203484 [10] 李成, 梁庆威, 周志成, 等. Bim在激素诱导成骨细胞凋亡中的表达及意义[J]. 中国医科大学学报, 2015, 44(10):921-925, 929. doi: 10.12007/j.issn.0258-4646.2015.10.014 -





 下载:
下载: