-
《药品生产质量管理规范》(2010年版)第250条描述偏差为“任何偏离生产工艺、物料平衡限度、质量标准、检验方法、操作规程等的情况”[1]。人用药品注册协调会(ICH)明确偏差是指偏离已批准的程序(指导文件)或标准的任何情况[2-3]。在医疗机构制剂的偏差管理中,也已逐渐建立在科学的基础上,以可持续发展的视角,运用各种技术手段,查找偏差根本原因,并采取适当的纠正与预防措施(CAPA),确保制剂质量稳定[4]。近年来,第909医院持续加大制剂质量管理力度,取得了较好的成效,所配制的约70个品规在卫勤战备、为部队服务及临床用药保障等方面发挥着重要作用[5-8]。笔者对本院2017−2019年制剂偏差发生情况进行分析,旨在为质量持续改进明确方向,保证制剂质量合格,保障临床用药安全。
-
回顾分析本院2017−2019年59例次自制制剂偏差情况,运用“头脑风暴”及“鱼骨图”“帕雷托图”等管理工具,使用Minitab软件,从人(人员)、机(机器)、料(物料)、法(方法)、环(环境)5个方面分析偏差根本原因,制订纠正和预防措施,并评估纠正和预防措施的实施效果。
-
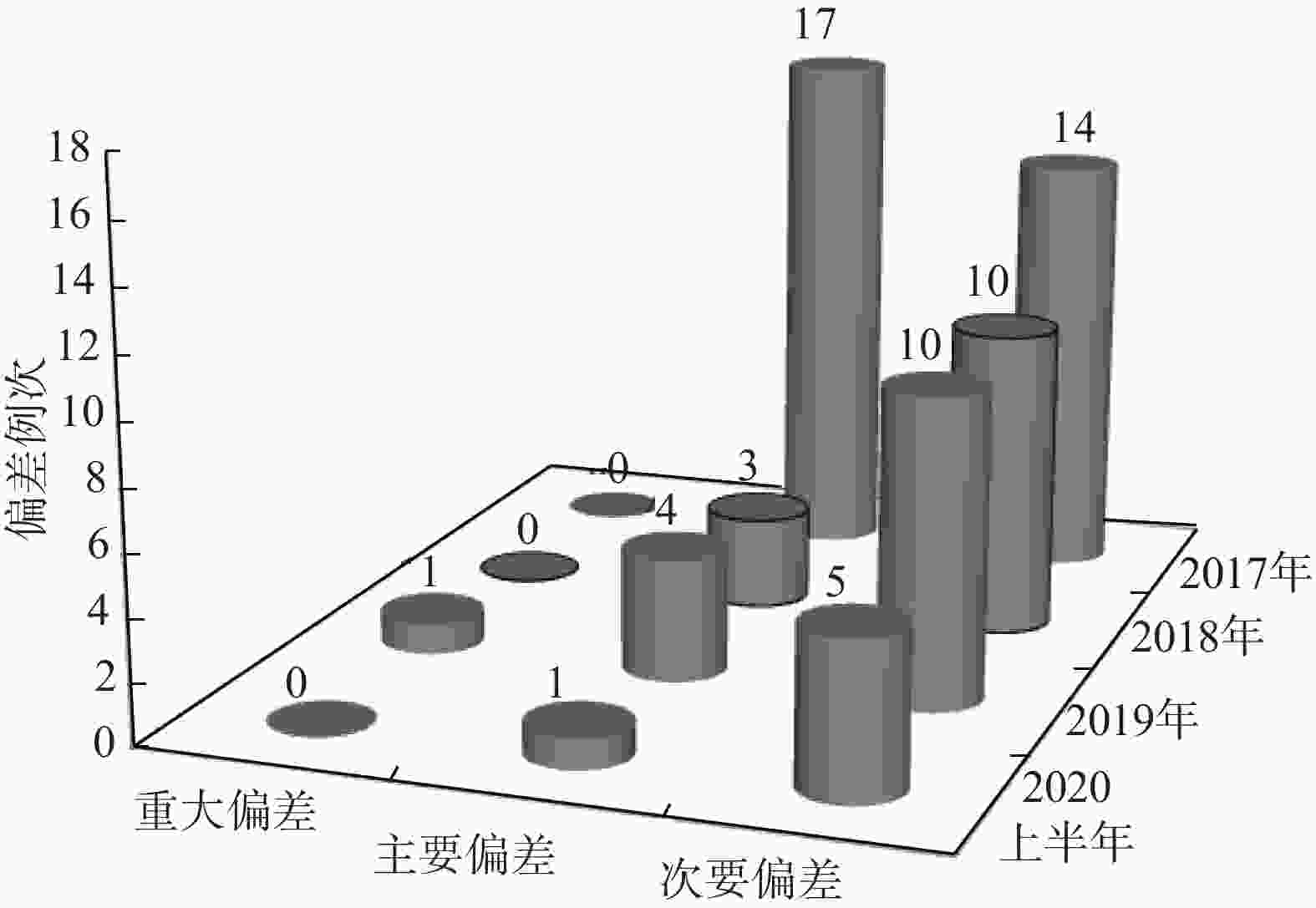
2017−2019年累计发生制剂偏差59例次,其中,2017年31例次(主要偏差17例次,次要偏差14例次,2018年13例次(主要偏差3例次,次要偏差10例次),2019年15例次(重大偏差1例次,主要偏差4例次,次要偏差10例次),见表1。
表 1 2017−2019年医院制剂发生偏差基本情况
偏差级别 偏差项目 偏差可能原因 重大偏差 醋酸地塞米松乳膏投料出现错误 c1 对新聘人员和实习轮转人员上岗前培训不到位;双人核对制度未严格执行 主要偏差 洁净区压缩空气含水量异常a1 冷冻干燥机冷媒过滤器堵塞和冷媒不足 制袋灌封间环境动态监测结果超限 a3c1 维修设备人员走动频繁,动作幅度较大;高效过滤器可能存在过滤效能退化的问题;环境动态监测的取样操作不够规范;制袋灌封的操作人员未开启层流罩 注射用水存储分配系统异常 a1c1 总空气开关出现故障;单机械密封和隔膜阀垫片老化破损 灌封时限超标b1 设备故障,维修时间长,超过经验证的灌封时限。 大容量注射剂灭菌工序异常a5 小冷电磁阀和总排水电磁阀、保险丝出现故障;发生突发停水事件。 氯化钠注射液产率偏低及可见异物异常a3 制袋灌封一体机的锁限位杆气缸故障,向上动作限位口管时导致易刮擦,产生塑料异物 普通制剂可见异物、外观性状异常及漏液a3b1 制剂原料、药包材质量问题;制备工艺缺少过滤步骤 醋酸地塞米松乳膏含量测定超标b1 醋酸地塞米松配制过程中受热时间过长,配制工艺待验证 硫酸镁口服溶液长菌a1c2 制备工艺问题,容易受配制环境和包装材料的影响 次要偏差 中间品复调a4c1 pH调节剂配制出错;原料药吸潮;称量方式不合适;液位定容不准 复方薄荷脑滴鼻液外标签利用率异常a1 制剂物料库房发放人员计算错误,请领人员未进行复核 批号、有效期打印错误a1b1c1 未落实双人核对制度 制剂灭菌工序异常a2b1 水浴式灭菌柜的小进电磁阀底座故障;灭菌过程中瓶盖被色水污染 洁净区环境动态监测结果超限 a6b5c2 功能间内操作人员较多;培养皿被污染;维修过程带入污染 产率偏低b1c2 灌装机维修后校准误差;岗位人员操作失误 可见异物b1c1 药包材质量问题;设备发生故障 组合盖破漏b1 制剂的药包材质量问题 输液制剂细菌内毒素检查偏差c1 检验用鲎试剂与内毒素工作标准品不匹配 氯化铵甘草口服溶液控制菌检查异常c2 供应商提供的包装容器PET瓶不够洁净 注:a表示2017年,b表示2018年,c表示2019年,如a1表示2017年发生1例次。 -
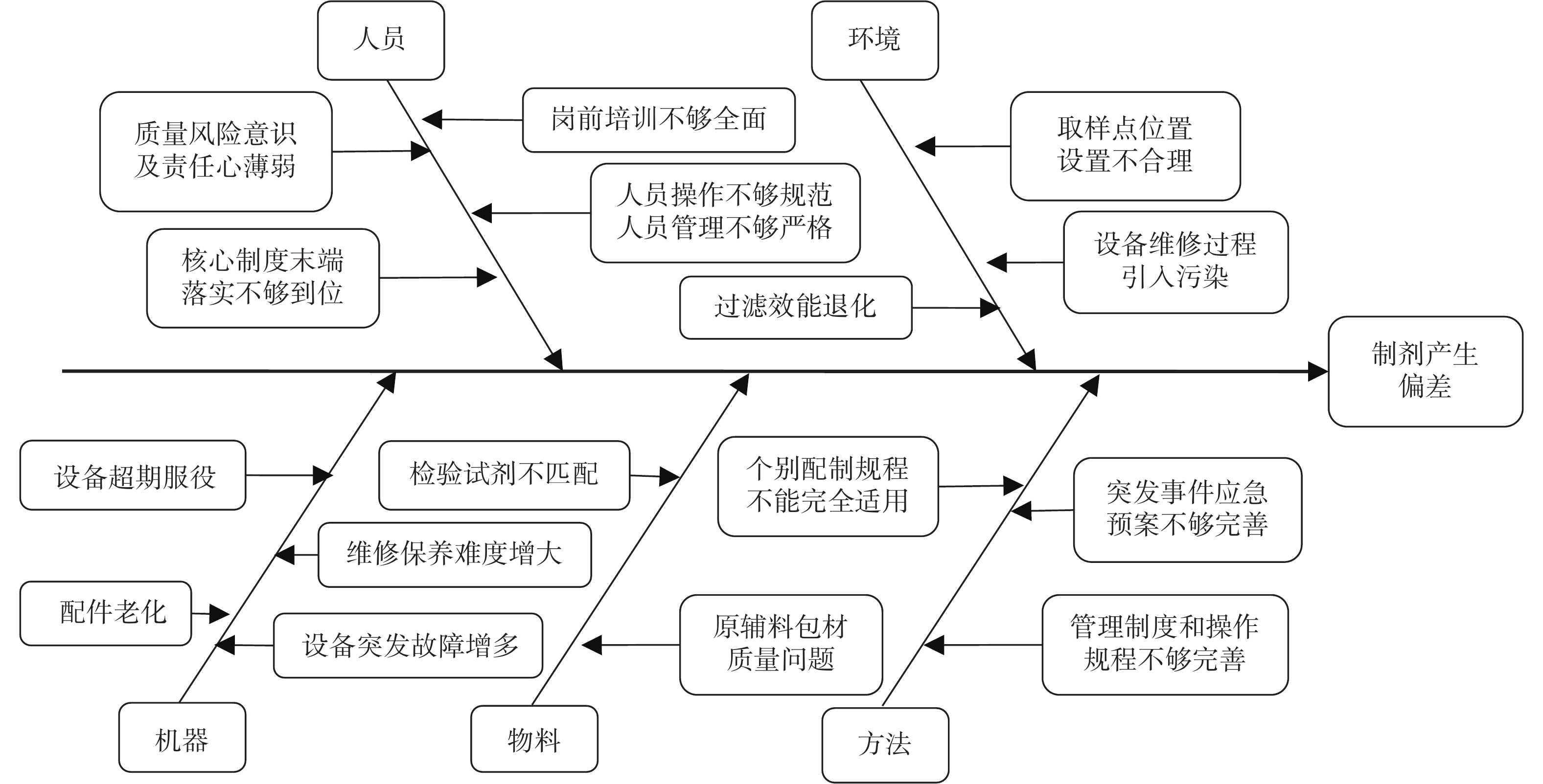
运用“头脑风暴”及“鱼骨图”管理工具,从人员因素、机器因素、物料因素、方法因素及环境因素,分析并查找近3年发生偏差的可能原因,见图1。
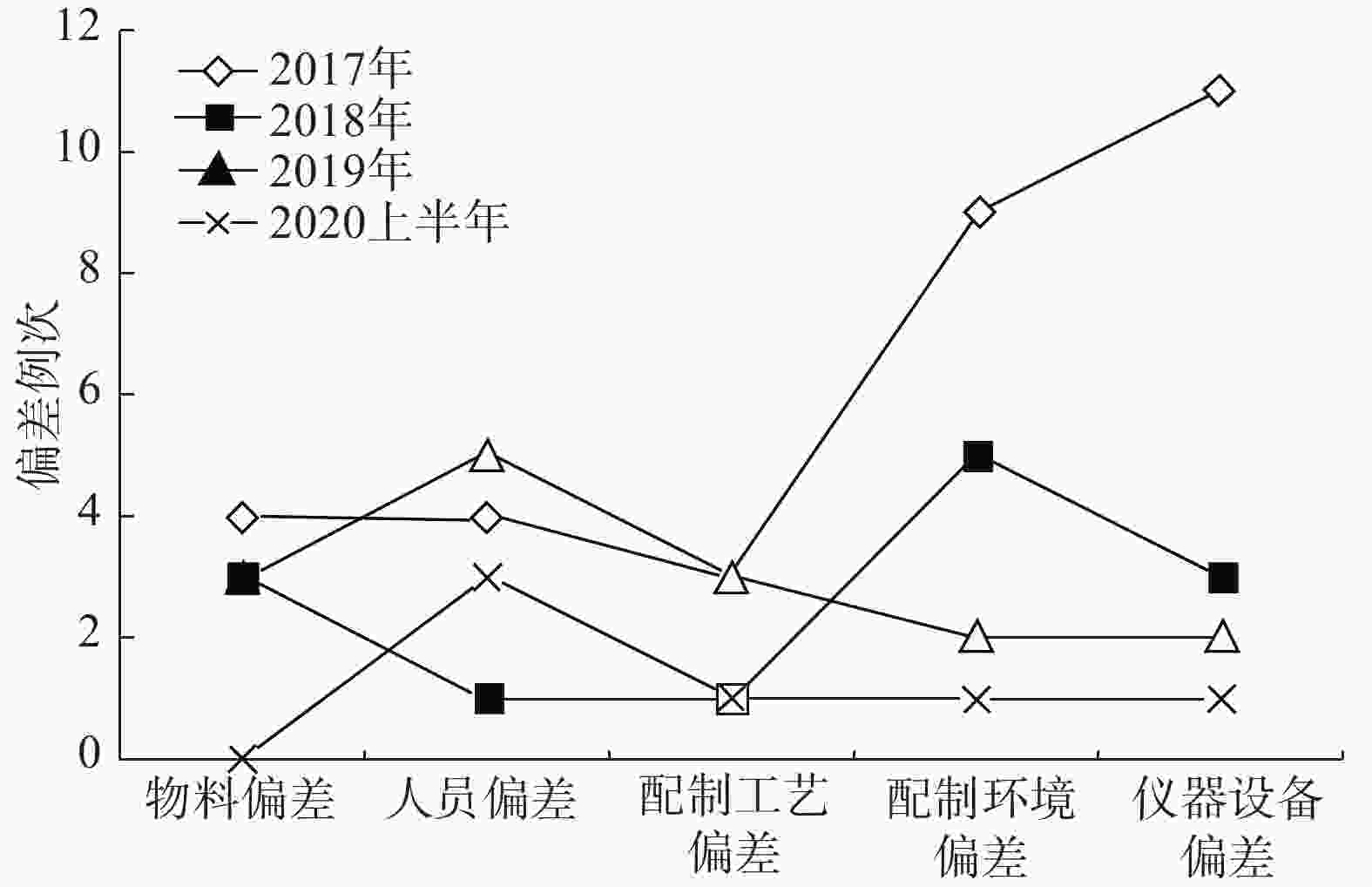
59例次制剂偏差按产生的原因进行分类,其中配制环境偏差、仪器设备偏差、人员偏差、物料偏差及配制工艺偏差的占比依次为27.1%、27.1%、16.9%、16.9%和11.9%。使用Minitab 16.0软件绘制帕雷托(Pareto)图,结果见图2。
-
针对产生偏差的主要原因,结合实际工作,运用“头脑风暴”,从“人、机、料、法、环”5个方面探讨偏差原因,累计拟定了18条纠正和预防措施,见表2。
表 2 制剂偏差原因以及纠正和预防措施
影响因素 纠正和防措施 人员 ① 加强制剂法规学习及教育引导,提高质量风险意识,增强工作责任心
② 加大岗位技能培训力度,注重新上岗人员培训及实习生的带教管理
③ 严格各岗位核心操作环节的双人核对制度落实
④ 提高一线操作人员偏差识别及应急处置能力机器 ① 结合实际适当增加主要设备的配件库存,必要时申请更新并淘汰老旧的仪器设备
② 完善仪器设备维修保养方案,加强核心部件的维护保养与定期巡检
③ 仪器设备出现故障,及时全面排查原因,尽可能缩短维修时间物料 ① 落实制剂物料(尤其易吸潮、风化、热不稳定的原辅料)库房规范化管理
② 制剂原辅料和内包材领用、发放环节,加强质量检查,发现异常情况及时报告并处置
③ 制剂配制灌装前,加强对包装容器的清洁处理
④ 对于制剂包装容器存在质量缺陷的供应商,必要时进行变更方法 ① 遵循制剂注册备案的配制工艺,必要时综合工艺验证结果及实践经验等实际情况进行修订
② 在风险评估的前提下开展工艺验证,通过验证确定相关工艺参数并进行相应调整
③ 完善制剂配制中的突发事件应急处置预案
④ 优化各岗位的标准操作规程环境 ① 合理设置洁净区环境监测取样点
② 加强洁净区操作人员卫生学知识的培训
③ 维修仪器设备时现场人员应注意避免引入污染源 -
通过制定并实施纠正和预防措施,2018年偏差的总例次较2017年显著减少,2019年偏差的总例次与2018年基本持平,2020年上半年与2018年、2019年相比,总例次有所降低。通过对比分析发现,占比较大的配制环境和仪器设备方面偏差例次下降比较明显,物料和配制工艺偏差变化不明显,而人员偏差存在较大波动,需持续重点关注。总体而言,制剂质量管理系统的运行状态相对平稳,见图3、图4。
-
制剂的配制过程由于人、机、料、法、环等的综合因素作用,会产生工艺参数不同程度的偏移,从而不同程度地影响制剂内在质量[9-11]。笔者从这5个因素分析归纳偏差产生的可能原因,结果配制环境和仪器设备是偏差产生的主要原因,人员偏差同样的原因反复出现,需重点关注。
偏差发生的原因可分为主观因素和客观因素,主观因素主要是人员的问题,可以通过提升质量风险意识,强化工作责任心,明确人员责任,加大系统培训力度等有效手段进行控制。比如,岗位培训应着重强调偏差管理的重要性,积极鼓励每一项目人员参与讨论发表意见,确保各类人员能正确执行配制工艺、质量标准、检验方法和操作规程,将偏差管理的理念融入岗位工作各个环节。客观因素则需通过制修订相应管理制度和操作规程,为可能发生的偏差做好风险评估,使偏差级别降低。无论是主观因素还是客观因素,需要特别注意的是,强化纠正与预防措施末端落实十分重要。纠正与预防措施的意义是纠正某一个体的缺陷,而且要找到缺陷的根本原因,采取预防措施,防止同类缺陷的重复发生。此外,必要时还可建立适当的奖惩机制,保证预防措施得到更彻底的贯彻执行。
综上所述,偏差管理是制剂质量管理不可或缺的一部分,把质量风险管理理念融入制剂偏差管理,前瞻性地推断未来可能发生的事件,可以最大限度地降低偏差发生的频次,并减少潜在质量安全事件的发生。就军队医疗机构而言,加强制剂偏差管理对于确保卫勤保障、为部队服务及临床用药的安全至关重要。下一步,要巩固现有的偏差管理成果,并参照《药品生产质量管理规范》《药品生产监督管理办法》等法规持续加强改进。
Analysis on 59 cases of preparation deviation in our hospital from 2017 to 2019
-
摘要:
目的 分析该院自制制剂偏差发生情况,为制剂质量持续改进明确方向,保证制剂质量合格和临床用药安全。 方法 回顾性分析2017−2019年59例次制剂偏差情况,运用头脑风暴及鱼骨图、帕雷托图等管理工具,使用Minitab软件,从“人、机、料、法、环”5个方面分析发生偏差的可能原因,制定纠正和预防措施,并评估实施的效果。 结果 在59例次制剂偏差中,重大偏差1例次(1.7%),主要偏差24例次(40.7%),次要偏差34例次(57.6%);通过制订并实施纠正与预防措施,2018年偏差的总例次较2017年显著减少,2019年偏差的总例次与2018年基本持平,其中人员因素需重点关注。 结论 制剂偏差管理取得阶段性成效,将参照《药品生产质量管理规范》《药品生产监督管理办法》等法规持续加强改进。 Abstract:Objective To provide direction for the improvement of quality control of hospital preparations and ensure the safety for clinical use by analyzing the hospital preparation deviations in recent three years. Methods A retrospective analysis on 59 minor hospital preparation deviations from 2017 to 2019 was conducted. Brainstorming, fishbone drawing and, Minitab software were used to analyze the root causes of deviations from five aspects: personnel, machine, materials, methods and environment. The preventive and corrective measures were implemented. The results were evaluated. Results 1 significant deviation (1.7%), 24 major deviation (40.7%), and 34 minor deviation (57.6%) were identified among the 59 casses of preparation deviation. With the implementation of preventive and corrective measures, the total number of deviations in 2018 was significantly reduced compared to that in 2017. The total number of deviations in 2019 was about the same as that in 2018. The human factors need to be focused. Conclusion The pharmaceutical preparation deviations in our hospital have been reduced. The further quality improvements for pharmaceutical preparations will be carried out by following the regulations of pharmaceutical production quality management standards and pharmaceutical production supervision and administration measures. -
表 1 2017−2019年医院制剂发生偏差基本情况
偏差级别 偏差项目 偏差可能原因 重大偏差 醋酸地塞米松乳膏投料出现错误 c1 对新聘人员和实习轮转人员上岗前培训不到位;双人核对制度未严格执行 主要偏差 洁净区压缩空气含水量异常a1 冷冻干燥机冷媒过滤器堵塞和冷媒不足 制袋灌封间环境动态监测结果超限 a3c1 维修设备人员走动频繁,动作幅度较大;高效过滤器可能存在过滤效能退化的问题;环境动态监测的取样操作不够规范;制袋灌封的操作人员未开启层流罩 注射用水存储分配系统异常 a1c1 总空气开关出现故障;单机械密封和隔膜阀垫片老化破损 灌封时限超标b1 设备故障,维修时间长,超过经验证的灌封时限。 大容量注射剂灭菌工序异常a5 小冷电磁阀和总排水电磁阀、保险丝出现故障;发生突发停水事件。 氯化钠注射液产率偏低及可见异物异常a3 制袋灌封一体机的锁限位杆气缸故障,向上动作限位口管时导致易刮擦,产生塑料异物 普通制剂可见异物、外观性状异常及漏液a3b1 制剂原料、药包材质量问题;制备工艺缺少过滤步骤 醋酸地塞米松乳膏含量测定超标b1 醋酸地塞米松配制过程中受热时间过长,配制工艺待验证 硫酸镁口服溶液长菌a1c2 制备工艺问题,容易受配制环境和包装材料的影响 次要偏差 中间品复调a4c1 pH调节剂配制出错;原料药吸潮;称量方式不合适;液位定容不准 复方薄荷脑滴鼻液外标签利用率异常a1 制剂物料库房发放人员计算错误,请领人员未进行复核 批号、有效期打印错误a1b1c1 未落实双人核对制度 制剂灭菌工序异常a2b1 水浴式灭菌柜的小进电磁阀底座故障;灭菌过程中瓶盖被色水污染 洁净区环境动态监测结果超限 a6b5c2 功能间内操作人员较多;培养皿被污染;维修过程带入污染 产率偏低b1c2 灌装机维修后校准误差;岗位人员操作失误 可见异物b1c1 药包材质量问题;设备发生故障 组合盖破漏b1 制剂的药包材质量问题 输液制剂细菌内毒素检查偏差c1 检验用鲎试剂与内毒素工作标准品不匹配 氯化铵甘草口服溶液控制菌检查异常c2 供应商提供的包装容器PET瓶不够洁净 注:a表示2017年,b表示2018年,c表示2019年,如a1表示2017年发生1例次。 表 2 制剂偏差原因以及纠正和预防措施
影响因素 纠正和防措施 人员 ① 加强制剂法规学习及教育引导,提高质量风险意识,增强工作责任心
② 加大岗位技能培训力度,注重新上岗人员培训及实习生的带教管理
③ 严格各岗位核心操作环节的双人核对制度落实
④ 提高一线操作人员偏差识别及应急处置能力机器 ① 结合实际适当增加主要设备的配件库存,必要时申请更新并淘汰老旧的仪器设备
② 完善仪器设备维修保养方案,加强核心部件的维护保养与定期巡检
③ 仪器设备出现故障,及时全面排查原因,尽可能缩短维修时间物料 ① 落实制剂物料(尤其易吸潮、风化、热不稳定的原辅料)库房规范化管理
② 制剂原辅料和内包材领用、发放环节,加强质量检查,发现异常情况及时报告并处置
③ 制剂配制灌装前,加强对包装容器的清洁处理
④ 对于制剂包装容器存在质量缺陷的供应商,必要时进行变更方法 ① 遵循制剂注册备案的配制工艺,必要时综合工艺验证结果及实践经验等实际情况进行修订
② 在风险评估的前提下开展工艺验证,通过验证确定相关工艺参数并进行相应调整
③ 完善制剂配制中的突发事件应急处置预案
④ 优化各岗位的标准操作规程环境 ① 合理设置洁净区环境监测取样点
② 加强洁净区操作人员卫生学知识的培训
③ 维修仪器设备时现场人员应注意避免引入污染源 -
[1] 国家卫生部. 药品生产质量管理规范(2010年修订)[S]. 北京: 人民卫生出版社, 2011. [2] 国家食品药品监督管理局药品认证管理中心. 药品GMP指南: 质量管理体系[M]. 北京: 中国医药科技出版社, 2011. [3] Pharmaceuticals for Human Use: Good Manufacturing Practice Guide for Active Pharmaceutical Ingredients Q7[EB/OL]. 2020-08-06(2000-11-20). https://database.ich.org/sites/default/files/Q7%20Guideline.pdf. [4] 钱亚楠. 药品生产的偏差处理与持续质量改进[J]. 现代医学, 2013, 41(12):958-961. [5] 陈锦珊, 郑绍忠, 杨丽娜, 等. 某军队三甲综合性医院制剂质量管理[J]. 解放军医院管理杂志, 2019, 26(2):197-198. [6] 饶小平, 韩惠强, 柯志鸿, 等. 19例次医院灭菌制剂生产偏差分析研究[J]. 安徽医药, 2019, 23(2):403-405. doi: 10.3969/j.issn.1009-6469.2019.02.053 [7] 黄燕鹏, 曾棋平, 黄艺蓉, 等. 联勤保障部队第九○九医院2015—2017年医院制剂配制和使用情况分析[J]. 药学服务与研究, 2019, 19(2):143-145. [8] 黄丽珊, 曾棋平, 黄艺蓉, 等. 联勤保障部队第九O九医院的医院制剂在为部队服务保障方面的使用情况分析[J]. 药学服务与研究, 2019, 19(5):353-356. [9] 武晓琼, 李连新. 制剂室药品生产偏差管理[J]. 解放军医院管理杂志, 2013, 20(12):1193-1194. [10] 汪达, 张宝月, 龙华燕. 药品生产偏差管理探讨[J]. 化工与医药工程, 2019, 40(4):61-64. [11] 裴欢, 孙玉凤, 邓翀. 药品生产质量管理中偏差的纠正预防措施效果评估[J]. 首都食品与医药, 2015, 22(14):10-12. -





 下载:
下载: