-
鼻渊净胶囊为纯中药内服制剂[批准文号:总制字(2016)F405004],由苍耳子、辛夷、连翘、白芷、羌活、野菊花等六味中药组成,具有散风消炎、宣通鼻窍、稀化鼻窦与气管粘稠分泌物的功效,主要用于鼻渊的治疗。由于该制剂原有质量标准制定年代久远,质量控制仅有白芷一味药材的薄层鉴别,主要药味均无含量测定项,不能较好地反映制剂质量,本课题组前期对其原有的工艺参数进行了优选[1],并进行了质量标准研究。新的质量标准增加了辛夷、连翘、羌活、野菊花四味药的薄层定性鉴别,并建立了辛夷中木兰脂素、连翘中连翘苷、白芷和羌活中欧前胡素、野菊花中蒙花苷等主要成分的HPLC含量测定[2],本研究在此基础上,建立了鼻渊净胶囊的HPLC指纹图谱,拟从多成分角度对其质量进行全面控制,进一步保证制剂的质量均一和临床用药安全。
-
Agilent 1260高效液相色谱仪,含G1329A自动进样器、G4212B DAD检测器(美国,Agilent公司);JM-B2102型电子天平(余姚市纪铭称重校验设备有限公司);FA1605型电子天平(上海横平仪表厂);KH-100B型超声波清洗器(昆山和创超声仪器有限公司)。
-
10个批次(标记为S1~S10)的鼻渊净胶囊样品(批号:150901、150902、150904、150905、150910、150913、150916、150920、150921、150923,本院制剂室自制);连翘苷(批号:110753-201314)、蒙花苷(批号:110805-200508)、木兰脂素(批号:110780-201007)、欧前胡素(批号:111730-201307)、异欧前胡素(批号:111640-201005)等对照品,购自中国食品药品检定研究院;乙腈为色谱纯;水为自制纯水;其他试剂均为国产分析纯。
-
取鼻渊净胶囊内容物适量,研碎,精密称取粉末约1 g置于具塞锥形瓶中,加入甲醇20 ml,称定重量,超声处理(功率250 W,频率40 kHz)30 min,冷却,加甲醇补足损失重量,摇匀,微孔滤膜滤过,取续滤液,即得。
-
分别取紫花前胡苷、连翘苷、蒙花苷、木兰脂素、欧前胡素和异欧前胡素对照品各10 mg,精密称定,分别置10 ml容量瓶中,加甲醇定容至刻度,摇匀。分别精密量取1 ml,置10 ml容量瓶中,加甲醇定容至刻度,摇匀,即得。
-
分别取野菊花、连翘、苍耳子、辛夷、羌活、白芷单味药材适量,按照鼻渊净胶囊的制备方法及供试品溶液的制备方法,制备各单味药的样品溶液。
-
色谱柱:Agilent SB-C18(4.6 mm×250 mm,5 μm);流动相:乙腈(A)-水(B)梯度洗脱:0~5 min,20% A;5~15 min,20%~30% A;15~35 min,30%~40% A;35~50 min,40%~50% A;50~70 min,50%~55% A;70~80 min,55% A;流速:1.0 ml/min;检测波长210 nm;进样量10 μl。
-
精密度试验:取鼻渊净胶囊S1号样品(批号:150901)胶囊内容物,按“2.1”项下方法制备供试品溶液,用“2.2.1”项下的色谱条件测定,连续进样6次,记录指纹图谱,以峰9为参照峰,计算各共有峰的相对保留时间及相对峰面积。
重复性试验:取鼻渊净胶囊S1号样品(批号:150901)胶囊内容物,共6份,按“2.1”项下方法制备供试品溶液,用“2.2.1”项下色谱条件测定,记录各共有峰的保留时间和峰面积,以峰9为参照峰,计算各共有峰的相对保留时间及相对峰面积。
稳定性试验:取同一S1号样品(批号:150901)的供试品溶液,分别在0、2、4、8、12 h依法进样测定,以峰9为参照峰,计算各共有峰的相对保留时间及相对峰面积。
-
取鼻渊净胶囊S1~S10号共10批样品,按“2.1”项下方法制备供试品溶液,用“2.2.1”项下色谱条件测定,将图谱导入“中药色谱指纹图谱相似度评价系统2004A版”进行分析。
根据10批供试品溶液的色谱峰生成参照图谱,选择参照图谱中峰面积大于500且分离度较好的峰为共有指纹峰,分析确定鼻渊净胶囊的共有指纹峰。
釆用国家药典委员会《中药色谱指纹图谱相似度评价系统2004A版》评价10批鼻渊净胶囊的图谱的相似性,并进行综合评价。
-
精密度试验结果显示各共有峰平均相对保留时间的RSD为0.62%,平均相对峰面积的RSD为1.17%,在该方法下的精密度良好;重复性试验结果显示各共有峰平均相对保留时间的RSD为0.29%,平均相对峰面积的RSD为1.15%,在该方法下重复性良好;稳定性试验结果显示各共有峰平均相对保留时间的RSD为0.90%、平均相对峰面积的RSD为1.10%,样品在12 h内稳定。
-
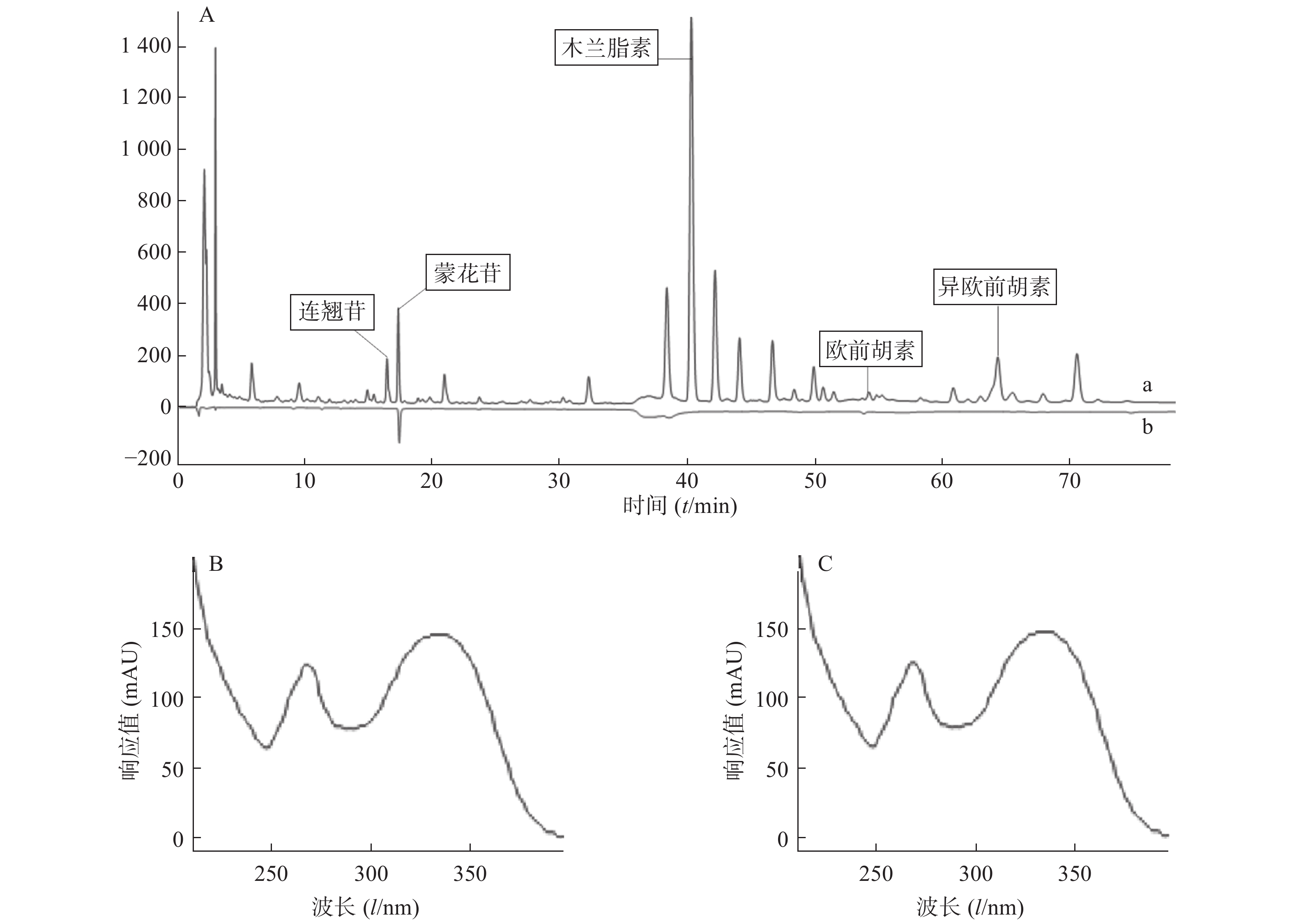
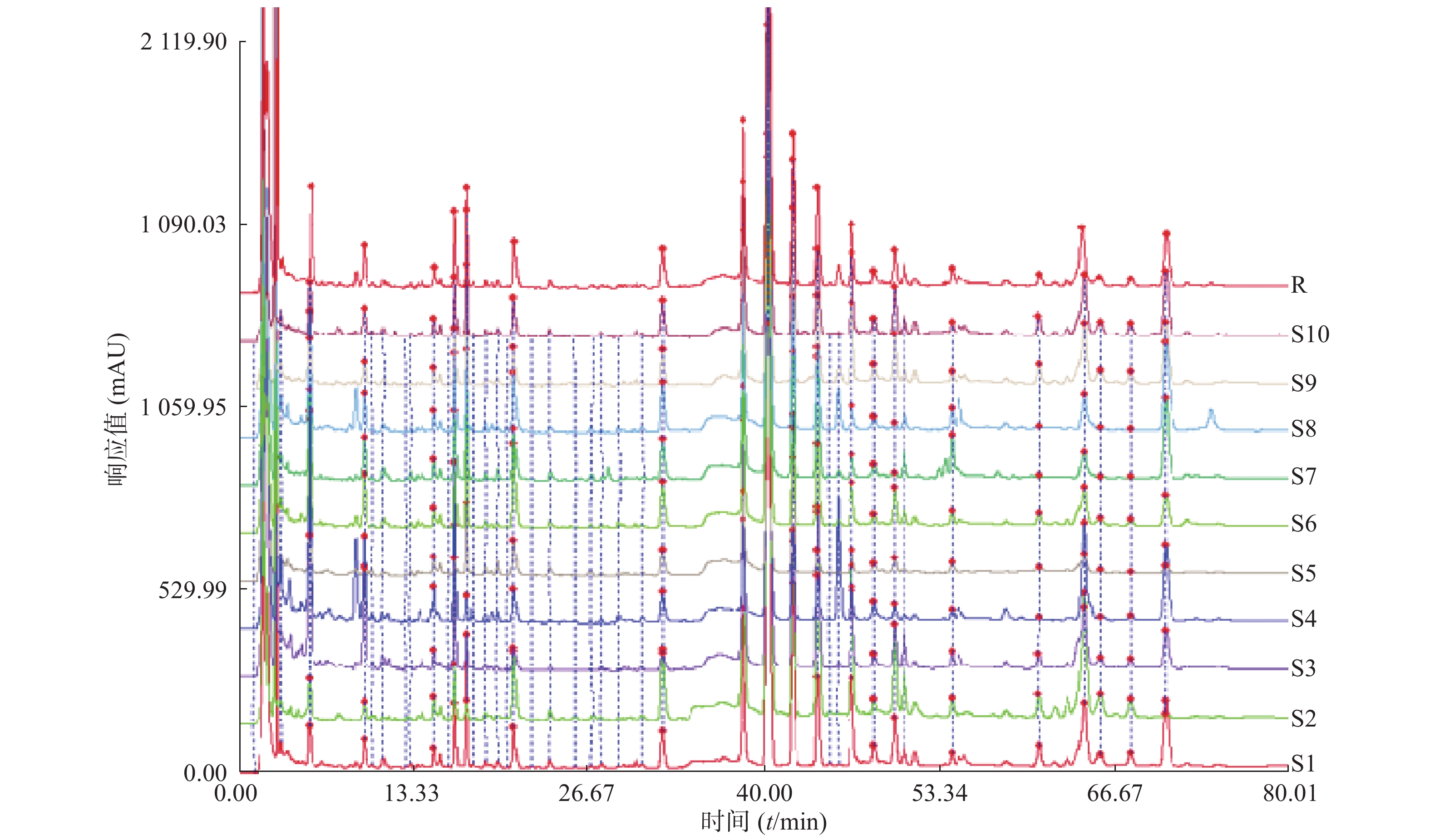
以批号150901(S1)的指纹图谱作为参照谱,多点校正,采用中位数法生成对照指纹图谱,结果见图1。
-
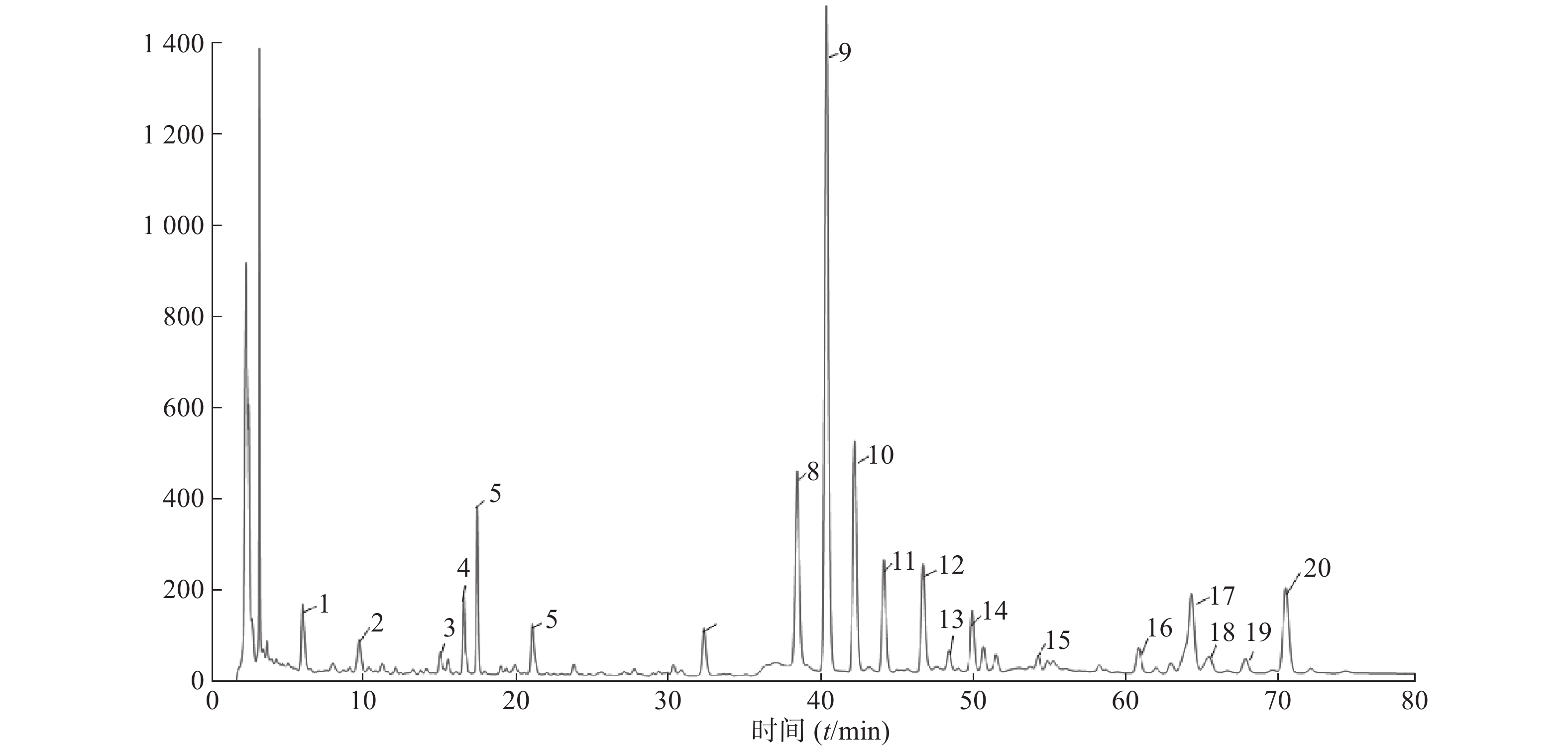
分析结果确定鼻渊净胶囊有20个共有指纹峰,其中峰9为鼻渊净胶囊的指标成分木兰脂素,该峰吸收信号最强、保留时间适中,峰形较好且稳定,故将其作为参照峰。鼻渊净胶囊指纹图谱见图2。
-
比较10批鼻渊净胶囊的色谱图,以木兰脂素峰(峰9)的保留时间和色谱峰面积为1,分别计算各共有峰的相对保留时间和相对峰面积,结果见表1和表2。
表 1 10批次鼻渊净胶囊指纹图谱共有峰的相对保留时间
峰号 批次 1 2 3 4 5 6 7 8 9 10 1 0.135 0.145 0.140 0.138 0.138 0.138 0.139 0.138 0.145 0.146 2 0.238 0.238 0.239 0.237 0.239 0.239 0.240 0.238 0.238 0.238 3 0.371 0.370 0.371 0.376 0.371 0.371 0.372 0.371 0.371 0.371 4 0.409 0.408 0.409 0.409 0.409 0.409 0.411 0.409 0.410 0.409 5 0.430 0.430 0.431 0.430 0.431 0.430 0.432 0.430 0.431 0.431 6 0.520 0.520 0.521 0.520 0.521 0.520 0.522 0.520 0.521 0.521 7 0.801 0.801 0.802 0.801 0.801 0.801 0.800 0.801 0.800 0.801 8 0.953 0.953 0.953 0.953 0.953 0.953 0.952 0.953 0.952 0.953 9 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 10 1.046 1.046 1.046 1.046 1.046 1.046 1.046 1.046 1.046 1.046 11 1.094 1.093 1.094 1.107 1.093 1.094 1.095 1.094 1.094 1.094 12 1.158 1.157 1.157 1.157 1.157 1.157 1.159 1.158 1.158 1.158 13 1.200 1.200 1.200 1.199 1.199 1.199 1.201 1.199 1.201 1.200 14 1.238 1.237 1.237 1.238 1.237 1.237 1.237 1.237 1.239 1.238 15 1.345 1.344 1.344 1.345 1.341 1.344 1.346 1.344 1.347 1.345 16 1.510 1.509 1.509 1.509 1.509 1.509 − − 1.512 1.509 17 1.596 1.595 1.596 1.583 1.595 1.596 1.585 1.581 1.599 1.595 18 1.625 1.625 1.626 1.619 1.626 1.627 − − 1.628 1.624 19 1.684 1.683 1.684 1.684 1.683 1.684 − − 1.687 1.683 20 1.748 − 1.749 1.748 1.748 1.748 1.751 1.746 1.752 1.749 表 2 10批次鼻渊净胶囊指纹图谱共有峰的相对峰面积
峰号 批次 1 2 3 4 5 6 7 8 9 10 1 0.053 0.043 0.267 0.293 0.113 0.173 0.117 0.183 0.070 0.075 2 0.046 0.022 0.146 0.163 0.025 0.124 0.082 0.076 0.044 0.046 3 0.022 0.019 0.018 0.044 0.061 0.029 0.027 0.031 0.022 0.022 4 0.077 0.040 0.122 0.189 0.054 0.111 0.094 0.107 0.072 0.074 5 0.122 0.015 0.032 0.039 0.156 0.223 0.190 0.114 0.113 0.120 6 0.066 0.089 0.038 0.073 0.156 0.198 0.102 0.127 0.063 0.063 7 0.068 0.100 0.032 0.071 0.115 0.130 0.087 0.118 0.068 0.069 8 0.308 0.420 0.392 0.319 0.347 0.370 0.359 0.327 0.296 0.308 9 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 10 0.341 0.227 0.203 1.426 0.452 0.248 0.252 0.293 0.338 0.334 11 0.163 0.274 0.230 0.095 0.095 0.209 0.235 0.178 0.170 0.162 12 0.168 0.202 0.125 0.075 0.099 0.116 0.046 0.057 0.160 0.164 13 0.031 0.016 0.026 0.045 0.037 0.025 0.028 0.029 0.033 0.033 14 0.092 0.122 0.066 0.038 0.066 0.099 0.010 0.015 0.091 0.093 15 0.024 0.027 0.028 0.023 0.046 0.039 0.029 0.069 0.020 0.019 16 0.046 0.037 0.029 0.007 0.032 0.037 − − 0.046 0.046 17 0.224 0.290 0.203 0.333 0.150 0.201 0.074 0.120 0.220 0.220 18 0.046 0.053 0.033 0.018 0.019 0.036 − − 0.049 0.048 19 0.031 0.031 0.021 0.012 0.009 0.021 − − 0.033 0.031 20 0.183 − 0.083 0.232 0.040 0.117 0.235 0.337 0.174 0.1867 -
指纹相似度在0.9~1.0之间,各批次之间的相似性较强,说明鼻渊净胶囊的制备工艺及样品分析方法稳定可行,相似度结果见表3。
表 3 10批次鼻渊净胶囊HPLC指纹图谱相似度
样品 1 2 3 4 5 6 7 8 9 10 对照图谱 相似度 0.979 0.952 0.966 0.951 0.932 0.959 0.936 0.920 0.949 0.948 1.000 -
采用对照品对照法对共有峰进行确认,取“2.1”项下配制的各对照品溶液,按照“2.2.1”项下色谱条件进行检测,在对照品溶液保留时间处,供试品溶液的色谱峰与对照品色谱峰的在线UV图一致,由此来判断共有峰化学成分的归属。通过此方法,判断4号峰为连翘苷,5号峰为蒙花苷,9号峰为木兰脂素,15号峰为欧前胡素,17号峰为异欧前胡素(见图3)。
-
采用各单味药阳性对照试验,取“2.1”项下各单味药材溶液,按照“2.2.1”项下的色谱条件进行测定。通过比较各色谱峰的保留时间和UV光谱图,对鼻渊净胶囊样品中共有峰的来源进行追溯。结果表明,峰1、2、4、6、7来自连翘,峰5来自野菊花,峰8~13来自辛夷,峰15、17、20来自白芷,其中峰17、20为羌活和白芷的共有峰。
-
在预实验中,曾尝试多种不同的溶剂系统作为流动相,分别考察了甲醇-水、乙腈-水、甲醇-磷酸、乙腈-乙酸、乙腈-磷酸,发现选用甲醇-水时,基线总是漂移;选用乙腈-水时,乙腈比甲醇的洗脱效果更明显,且加入酸溶液并不能改善峰型、基线平稳,各峰的峰型和分离度均良好,故选择乙腈-水作为流动相。经过对供试品采用DAD检测器进行全波长扫描发现,在210 nm波长下供试品溶液图谱的信息量较多、各吸收峰强度较大,故最终选择210 nm作为鼻渊净胶囊HPLC指纹图谱的检测波长。
对中成药的评价需要全面方能准确反映制剂质量。本研究采用HPLC法,建立了以木兰脂素为参照物的鼻渊净胶囊的指纹图谱,标定了21个共有指纹峰,指认了5个成分,10批次样品指纹图谱整体的相似性结果在0.9以上。在此次建立的鼻渊净胶囊HPLC-UV指纹图谱中,苍耳子药材的特征性成分表达很少,可能是因为其特征性成分在该波长下紫外吸收较少,或者是受其他成分的影响未能表达,此不足考虑在以后的研究中运用液质联用技术对其成分进行分析与检测来弥补[21-22],从而为鼻渊净胶囊的质量评价提供更全面可靠的依据。
Study on HPLC fingerprints of Biyuanjing capsules
-
摘要:
目的 建立鼻渊净胶囊的高效液相色谱(HPLC)指纹图谱。 方法 采用Agilent SB-C18(4.6 mm×250 mm,5 µm)色谱柱,乙腈-水为流动相、以1.0 ml/min流速行梯度洗脱,检测波长210 nm,柱温30 ℃,洗脱时间为80 min。采用中药色谱指纹图谱相似度评价系统(2004A版)对检测出色谱进行指纹图谱相似度评价。 结果 建立了鼻渊净胶囊的HPLC指纹图谱,确定了20个共有峰,15个峰归属到各药材,其中5个峰确认了化学成分;10批样品的指纹图谱的整体相似度与对照图谱比较,均在90%以上。 结论 所建立的鼻渊净胶囊指纹图谱有助于从整体上控制该制剂的质量。 Abstract:Objective To establish a HPLC fingerprints of Biyuanjing capsules. Methods The column was Agilent SB-C18(4.6mm×250 mm, 5 µm). The mobile phase was acetonitrile-water with gradient elution at a flow rate of 1.0 ml/min. The detection wavelength was 210 nm. The detection time was 80 min. Results The HPLC fingerprints of Biyuanjing capsules were established. Twenty common peaks were confirmed, of which, 15 peaks were belonging to each crude drug and 5 peaks were identified as chemical components. The overall similarity of the fingerprints of 10 batches of samples was above 90% comparing with the control. Conclusion This method can be used for the quality control of Biyuanjing capsules. -
Key words:
- Biyuanjing capsules /
- fingerprints /
-
phillyr /in - linarin /
- magnolin /
- imperatorin /
-
isoimperatorin
-
在中医,脑卒中属于中风范畴,“气虚血瘀、痰瘀互结、毒损脑络”是中风的核心病机[1]。雷公藤系卫矛科雷公藤属藤本植物,又名震龙根、水莽子、断肠草、红紫根,以根茎入药,首载于《神农本草经》,味苦性寒,具有清热解毒、祛风通络、舒筋活血等功效,常用于免疫和炎性疾病的治疗。现代医学研究发现,炎症反应及缺血半暗带神经元凋亡在脑缺血再灌注损伤(CIRI)进展中发挥着重要作用,可作为防治CIRI新药研究的靶点[2-4]。雷公藤甲素为雷公藤的主要活性成分之一,化学结构属于二萜内酯类化合物,具有抗炎、抗凋亡等药理学作用[5-6]。Toll样受体4/核转录因子-κB(TLR4/NF-κB)通路是CIRI后炎症反应及神经元凋亡的重要调控机制[7]。有文献[8-9]报道雷公藤甲素能够抑制TLR4/NF-κB通路对大鼠类风湿关节炎、鼻炎具有一定抑制作用。然而,雷公藤甲素是否能够通过调控TLR4/NF-κB通路抑制CIRI仍需深入研究。因此,本实验将探讨雷公藤甲素对大鼠CIRI的影响及其机制,以期为雷公藤甲素应用于CIRI防治提供理论依据。
1. 材料
1.1 动物
清洁级健康雄性7周龄Wistar大鼠144只,体质量210~240 g,购自杭州子源实验动物科技有限公司,实验动物生产许可证号SCXK(浙)2019-0004。饲养环境维持室温23~25 ℃、相对湿度45%~65%,自由饮水进食。动物实验遵守实验动物福利伦理审查指南。
1.2 实验药物与试剂
雷公藤甲素(上海源叶生物科技有限公司,纯度≥98%);丁苯酞氯化钠注射液(恩必普药业有限公司,规格100 ml∶25 mg,国药准字H20100041);生理盐水(石家庄四药有限公司,规格500 ml,国药准字H13023200);注射用异戊巴比妥钠(上海上药新亚药业有限公司,规格0.1 g,国药准字H21021725);红四氮唑(TTC)、伊文思蓝(EB)(北京博奥森生物技术有限公司);4%多聚甲醛溶液(北京索莱宝生物技术公司);末端标记法(TUNEL)染色试剂盒和肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)检测试剂盒(南京建成生物工程研究所);甲酰胺(天津科密欧化学试剂有限公司);TLR4、NF-κB、p-NF-κB、激活型半胱氨酸蛋白酶-3(cleaved Caspase-3)、B细胞淋巴瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、β-actin抗体和IgG二抗(北京博奥森生物技术有限公司);二喹啉甲酸法(BCA)蛋白浓度检测试剂盒、增强化学发光液(ECL)(武汉三鹰生物技术有限公司)。
1.3 主要仪器
TKY-BMB型石蜡包埋机(湖北康泰医疗设备有限公司);S7220型石蜡切片机(沈阳恒松科技有限公司);JY300C型电泳仪(美国Wealtec公司);Semi-Day型转膜仪(美国Bio-Rad公司);FluorChem HD2型凝胶成像仪(美国Protein Simple公司);BioTek Epoch型全波长酶标仪(美国伯腾仪器有限公司);BX53型显微镜(日本Olympus日立公司)。
2. 方法
2.1 分组、给药与CIRI大鼠模型制备
将144只Wistar大鼠按照随机数字表法平均分为假手术组、模型组、雷公藤甲素低、中、高剂量组(0.2、0.4、0.8 mg/kg)[10]和丁苯酞组(6 mg/kg)[11],每组24只。造模前3 d开始1次/d腹腔注射(ip)给药,假手术组和模型组ip给予生理盐水,注射体积均为5 ml/kg。除假手术组外,其余5组均参照杨丽等[12]报道方法构建CIRI大鼠模型。
2.2 神经功能缺失评分和脑梗死率检测
再灌注24 h后,分别随机取各组6只大鼠,参照文献[13]报道的方法进行神经功能缺失评分,无症状为0分、前肢不能伸展为1分、行走时转圈为2分、行走时跌倒为3分、不能行走或意识丧失为4分。ip戊巴比妥钠(40 mg/kg)进行麻醉后,颈椎脱臼处死,取大脑组织、-20 ℃冻存15 min后均匀厚度切为5片,2% TTC溶液恒温37 ℃避光染色30 min,每5 min翻转一次,正常组织呈红色、梗死组织呈苍白色,通过图像分析软件计算脑梗死率。
2.3 血脑屏障(BBB)通透性检测[14]
分别随机取各组6只大鼠,经尾静脉注射2% EB溶液4 ml/kg,30 min后实施麻醉,开胸后经“左心室-右心耳”灌注生理盐水至流出液清亮,取脑称重,1 ml/100 mg加入甲酰胺后60 ℃水浴24 h,4 ℃匀浆后15000 rpm离心20 min取上清液,通过酶标仪检测620 nm处吸光度值,对照标准曲线测定EB含量。
2.4 缺血半暗带皮层神经元病理学改变的观察
分别随机取各组6只大鼠,ip戊巴比妥钠(40 mg/kg)进行麻醉后,颈椎脱臼处死,取缺血侧大脑皮层组织,经4%多聚甲醛溶液固定、脱水、石蜡包埋、切片、烤片等处理后,按照HE试剂盒和TUNEL试剂盒操作说进行染色处理后,通过光学显微镜观察缺血半暗带皮层神经元病理学改变。显微镜下计数TUNEL染色切片5个视野内细胞数和凋亡细胞数,计数缺血半暗带皮层神经元凋亡率。
2.5 缺血侧大脑皮层组织生化指标检测
取各组剩余的6只大鼠,ip戊巴比妥钠(40 mg/kg)进行麻醉后,颈椎脱臼处死,剥取缺血侧大脑皮层组织。①取部分缺血侧大脑皮层组织,加入5倍量4 ℃生理盐水研磨匀浆,3 500 r/min离心5 min分离上清液,按照试剂盒操作说明通过ELISA法检测缺血侧大脑皮层组织TNF-α、IL-1β含量。②取剩余部分缺血侧大脑皮层组织,加入适量蛋白裂解液后研磨匀浆,冰上静置30 min使其充分裂解,4 ℃、12 000 r/min离心25 min分离上清液,检测总蛋白浓度并配平后,30 μg等量上样,经10 % SDS-PAGE凝胶电泳分离蛋白、转膜和5%脱脂牛奶封闭1.5 h后,加入一抗稀释液TLR4(1∶800)、NF-κB(1∶1000)、p-NF-κB(1∶1000)、cleaved Caspase-3(1∶800)、Bcl-2(1∶500)、Bax(1∶500)和内参β-actin(1∶1500)4 ℃避光孵育过夜,洗膜后二抗稀释液(1∶3 000)室温孵育1.5 h,洗膜后ECL显影,通过Image J软件分析蛋白条带灰度值。
2.6 统计学分析
运用SPSS 20.0软件进行数据统计分析,计量资料符合正态分布以(
$ \bar x \pm s $ )表示,多组间比较采用单因素方差分析,方差齐时两两比较采用LSD-t检验,方差不齐时两两比较采用Dunnett's T3检验,P<0.05为差异有统计学意义。3. 结果
3.1 各组大鼠神经功能缺失评分和脑梗死率的比较
与假手术组比较,模型组大鼠神经功能缺失评分和脑梗死率显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组神经功能缺失评分和脑梗死率显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组神经功能缺失评分和脑梗死率显著降低(P<0.05)。见图1、表1。
表 1 各组大鼠神经功能缺失评分、脑梗死率、BBB通透性的比较($ \bar x \pm s $ ,n=6)组别 神经功能缺失
评分(分)脑梗死率
(%)EB含量
(μg/g)假手术组 0.00±0.00 0.00±0.00 0.49±0.06 模型组 2.84±0.39* 48.17±7.39* 1.54±0.27* 丁苯酞组 1.31±0.17△ 16.28±2.15△ 0.79±0.09△ 雷公藤甲素低剂量组 2.50±0.34 42.93±5.74 1.42±0.23 雷公藤甲素中剂量组 1.85±0.26△ 27.54±3.48△ 1.10±0.16△ 雷公藤甲素高剂量组 1.09±0.15△# 11.38±1.65△# 0.70±0.08△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 3.2 各组大鼠BBB通透性的比较
与假手术组比较,模型组大鼠脑组织EB含量显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组脑组织EB含量显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组脑组织EB含量显著降低(P<0.05)。见表1。
3.3 各组大鼠缺血半暗带皮层神经元病理学改变的比较
假手术组大鼠皮层神经元呈圆形或椭圆形,形态饱满,着色均匀,胞核居中。模型组大鼠缺血半暗带皮层神经元呈现形态不规则,胞体萎缩呈空泡样变,着色较深,核膜边界不清,炎性细胞浸润等病理学改变。与模型组比较,雷公藤甲素各剂量组和丁苯酞组缺血半暗带皮层神经元明显改善,其中雷公藤甲素高剂量组效果优于雷公藤甲素低、中剂量组和丁苯酞组,见图2。
3.4 各组大鼠缺血半暗带皮层神经元凋亡率的比较
与假手术组比较,模型组大鼠缺血半暗带皮层神经元凋亡率显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组凋亡率显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组凋亡率显著降低(P<0.05),见表2。
表 2 各组大鼠缺血半暗带皮层神经元凋亡率的比较($ \bar x \pm s $ ,n=6)组别 凋亡率(%) 假手术组 2.68±0.35 模型组 53.07±8.42* 丁苯酞组 17.69±2.90△ 雷公藤甲素低剂量组 45.93±7.67 雷公藤甲素中剂量组 31.52±5.08△ 雷公藤甲素高剂量组 12.88±1.74△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 3.5 各组大鼠缺血侧大脑皮层组织TNF-α、IL-1β含量的比较
与假手术组比较,模型组缺血侧大脑皮层组织TNF-α、IL-1β含量显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组TNF-α、IL-1β含量显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组TNF-α、IL-1β含量显著降低(P<0.05)。见表3。
表 3 各组大鼠缺血侧大脑皮层组织TNF-α、IL-1β含量的比较($ \bar x \pm s $ ,n=6)组别 TNF-α(ng/g) IL-1β(pg/g) 假手术组 1.41±0.22 37.06±4.81 模型组 2.76±0.35* 68.42±7.79* 丁苯酞组 1.85±0.23△ 46.93±5.62△ 雷公藤甲素低剂量组 2.54±0.32 63.81±6.54 雷公藤甲素中剂量组 2.07±0.25△ 55.74±5.91△ 雷公藤甲素高剂量组 1.62±0.21△# 40.27±5.39△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 3.6 各组大鼠缺血侧大脑皮层组织TLR4、NF-κB、p-NF-κB蛋白表达的比较
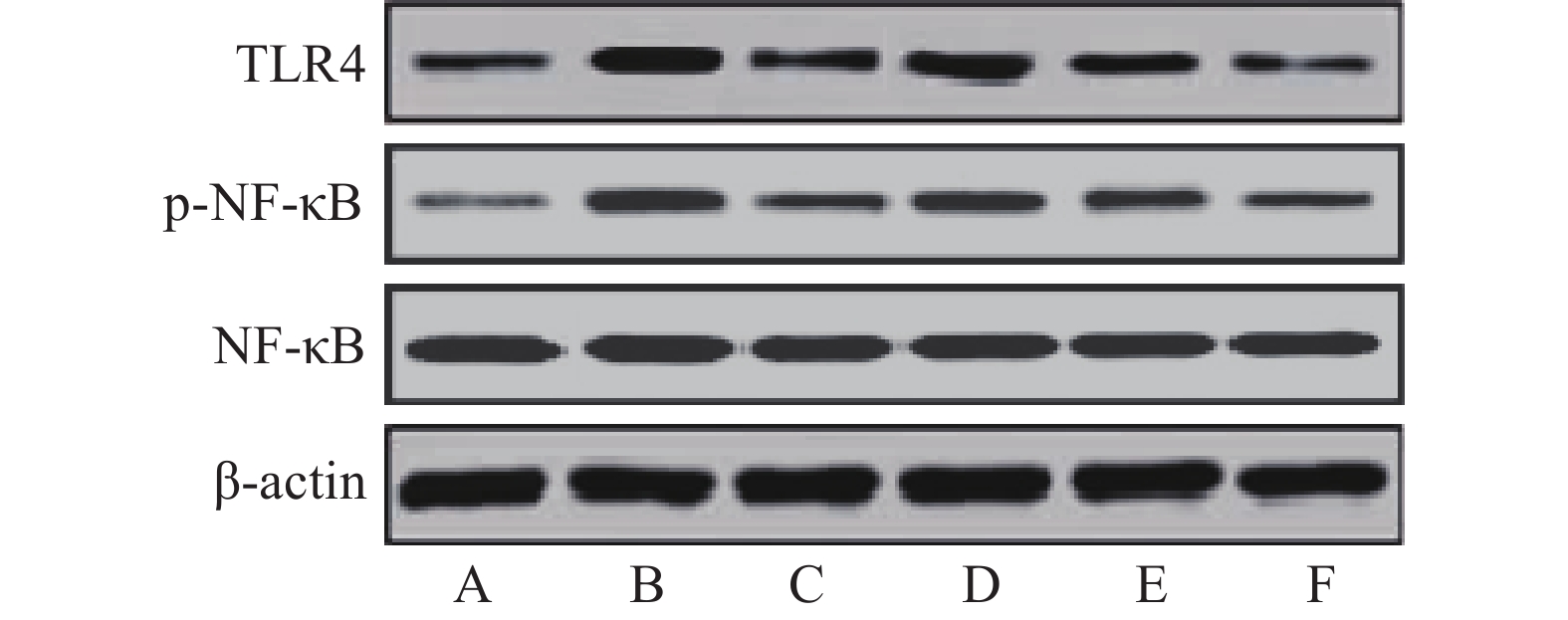
与假手术组比较,模型组大鼠缺血侧大脑皮层组织TLR4、p-NF-κB蛋白相对表达量和p-NF-κB/NF-κB比值显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组TLR4、p-NF-κB蛋白相对表达量和p-NF-κB/NF-κB比值显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组TLR4、p-NF-κB蛋白相对表达量和p-NF-κB/NF-κB比值显著降低(P<0.05),见图3、表4。
表 4 各组大鼠缺血侧大脑皮层组织TLR4、NF-κB、p-NF-κB蛋白表达及p-NF-κB/NF-κB比值的比较($\bar x \pm s$ ,n=6)组别 TLR4/β-actin NF-κB/β-actin p-NF-κB/β-actin p-NF-κB/NF-κB 假手术组 0.08±0.02 0.83±0.15 0.10±0.02 0.12±0.03 模型组 1.03±0.21* 0.78±0.14 0.81±0.15* 1.04±0.22* 丁苯酞组 0.20±0.04△ 0.84±0.15 0.29±0.06△ 0.35±0.08△ 雷公藤甲素低剂量组 0.87±0.16 0.79±0.16 0.68±0.13 0.86±0.18 雷公藤甲素中剂量组 0.65±0.13△ 0.78±0.15 0.35±0.07△ 0.45±0.10△ 雷公藤甲素高剂量组 0.16±0.03△# 0.74±0.14 0.14±0.03△# 0.19±0.04△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 3.7 各组大鼠缺血侧大脑皮层组织cleaved Caspase-3、Bcl-2、Bax蛋白表达的比较
与假手术组比较,模型组大鼠缺血侧大脑皮层组织cleaved Caspase-3、Bax蛋白相对表达量显著升高,Bcl-2相对表达量显著降低,Bax/Bcl-2比值显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组cleaved Caspase-3、Bax相对表达量显著降低,Bcl-2相对表达量显著升高,Bax/Bcl-2比值显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组cleaved Caspase-3、Bax相对表达量显著降低,Bcl-2相对表达量显著升高,Bax/Bcl-2比值显著降低(P<0.05)。见图4、表5。
表 5 各组大鼠缺血侧大脑皮层组织cleaved Caspase-3、Bcl-2、Bax蛋白表达及Bax/Bcl-2比值的比较($ \bar x \pm s $ ,n=6)组别 cleaved Caspase-3/
β-actinBcl-2/β-actin Bax/β-actin Bax/Bcl-2 假手术组 0.09±0.02 0.92±0.19 0.15±0.03 0.16±0.03 模型组 0.61±0.11* 0.18±0.04* 0.97±0.18* 5.39±1.07* 丁苯酞组 0.16±0.03△ 0.29±0.06△ 0.20±0.04△ 0.69±0.10△ 雷公藤甲素
低剂量组0.55±0.09 0.21±0.04 0.88±0.16 4.19±0.75△ 雷公藤甲素
中剂量组0.42±0.08△ 0.32±0.06△ 0.47±0.09△ 1.47±0.20△ 雷公藤甲素
高剂量组0.12±0.02△# 0.56±0.11△# 0.26±0.5△# 0.46±0.07△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 4. 讨论
线栓法是CIRI动物模型制备的经典方法,具有操作简便、重复率高、与人类临床病理接近等优点。本实验结果显示,CIRI模型大鼠呈现明显的神经功能障碍,BBB通透性异常升高,缺血半暗带大脑皮层神经元呈现形态不规则、胞体萎缩呈空泡样变、着色较深、核膜边界不清、炎性细胞浸润等病理学改变,与杨欢欢等[15]研究结果一致。本研究发现,经雷公藤甲素中、高剂量或丁苯酞预处理能够明显改善CIRI大鼠神经功能,降低脑梗死率和BBB通透性,改善缺血半暗带大脑皮层神经元病变并降低其凋亡率,并且雷公藤甲素高剂量组效果优于丁苯酞组;而雷公藤甲素低剂量组上述作用并不显著。说明雷公藤甲素具有抑制大鼠CIRI的作用,该作用具有一定的剂量依赖性。
CIRI病理机制非常复杂,其中炎症损伤和神经元凋亡发挥着关键作用。熊莉等[16]报道CIRI可诱导小胶质细胞活化而释放TNF-α、IL-1β等促炎因子,引发脑组织炎症反应发生。TNF-α和IL-1β具备炎性趋化属性,其中TNF-α可刺激促炎因子大量释放,IL-1β可诱导炎性细胞浸润,加重炎症反应[17]。Bcl-2和Bax是定位于线粒体膜的两种蛋白,二者均属于bcl蛋白家族,在细胞线粒体凋亡途径中发挥着重要作用。Bax可诱导细胞色素C由线粒体通过膜孔道进入细胞质,活化位于细胞质的Caspase-3,cleaved Caspase-3能够切割破坏膜蛋白、结构蛋白等引发细胞凋亡[18]。Bcl-2能够抑制Cyt C释放而表现为抑凋亡作用,并且Bcl-2与Bax能够结合形成无活性的二聚体。TLR4是定位于小胶质细胞的一种跨膜识别受体,TLR4能够诱导NF-κB磷酸化,p-NF-κB核转位后与DNA特定位点结合而诱导TNF-α、IL-1β等炎症因子转录与表达,进而加重炎症损伤[19]。此外,p-NF-κB可通过调控Bcl-2、Bax表达而诱导细胞凋亡[20]。Zhai Y等[21]发现抑制TLR4/NF-κB通路介导的炎症反应和凋亡可减轻大鼠CIRI。本实验结果显示,经雷公藤甲素中、高剂量或丁苯酞预处理能够明显降低CIRI大鼠缺血侧大脑皮层组织TNF-α、IL-1β含量和TLR4、cleaved Caspase-3蛋白相对表达量,降低p-NF-κB/NF-κB、Bax/Bcl-2比值,并且雷公藤甲素高剂量组效果优于丁苯酞组,而雷公藤甲素低剂量组上述作用并不显著。说明雷公藤甲素对CIRI大鼠炎症反应缺血半暗带大脑皮层神经元凋亡具有抑制作用,其机制可能与抑制TLR4/NF-κB通路活化有关,本结果与李晓蕾等[22]报道的药物抑制TLR4/NF-κB通路对局灶性脑缺血再灌注大鼠神经具有保护作用的结果相似。
综上所述,雷公藤甲素能够保护BBB通透性,减轻CIRI大鼠神经功能缺失和神经元病变,降低脑梗死率,作用机制可能与抑制TLR4/NF-κB通路及其介导的炎症反应和神经元凋亡有关。本研究结果为雷公藤甲素用于防治CIRI提供了理论依据。
-
表 1 10批次鼻渊净胶囊指纹图谱共有峰的相对保留时间
峰号 批次 1 2 3 4 5 6 7 8 9 10 1 0.135 0.145 0.140 0.138 0.138 0.138 0.139 0.138 0.145 0.146 2 0.238 0.238 0.239 0.237 0.239 0.239 0.240 0.238 0.238 0.238 3 0.371 0.370 0.371 0.376 0.371 0.371 0.372 0.371 0.371 0.371 4 0.409 0.408 0.409 0.409 0.409 0.409 0.411 0.409 0.410 0.409 5 0.430 0.430 0.431 0.430 0.431 0.430 0.432 0.430 0.431 0.431 6 0.520 0.520 0.521 0.520 0.521 0.520 0.522 0.520 0.521 0.521 7 0.801 0.801 0.802 0.801 0.801 0.801 0.800 0.801 0.800 0.801 8 0.953 0.953 0.953 0.953 0.953 0.953 0.952 0.953 0.952 0.953 9 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 10 1.046 1.046 1.046 1.046 1.046 1.046 1.046 1.046 1.046 1.046 11 1.094 1.093 1.094 1.107 1.093 1.094 1.095 1.094 1.094 1.094 12 1.158 1.157 1.157 1.157 1.157 1.157 1.159 1.158 1.158 1.158 13 1.200 1.200 1.200 1.199 1.199 1.199 1.201 1.199 1.201 1.200 14 1.238 1.237 1.237 1.238 1.237 1.237 1.237 1.237 1.239 1.238 15 1.345 1.344 1.344 1.345 1.341 1.344 1.346 1.344 1.347 1.345 16 1.510 1.509 1.509 1.509 1.509 1.509 − − 1.512 1.509 17 1.596 1.595 1.596 1.583 1.595 1.596 1.585 1.581 1.599 1.595 18 1.625 1.625 1.626 1.619 1.626 1.627 − − 1.628 1.624 19 1.684 1.683 1.684 1.684 1.683 1.684 − − 1.687 1.683 20 1.748 − 1.749 1.748 1.748 1.748 1.751 1.746 1.752 1.749 表 2 10批次鼻渊净胶囊指纹图谱共有峰的相对峰面积
峰号 批次 1 2 3 4 5 6 7 8 9 10 1 0.053 0.043 0.267 0.293 0.113 0.173 0.117 0.183 0.070 0.075 2 0.046 0.022 0.146 0.163 0.025 0.124 0.082 0.076 0.044 0.046 3 0.022 0.019 0.018 0.044 0.061 0.029 0.027 0.031 0.022 0.022 4 0.077 0.040 0.122 0.189 0.054 0.111 0.094 0.107 0.072 0.074 5 0.122 0.015 0.032 0.039 0.156 0.223 0.190 0.114 0.113 0.120 6 0.066 0.089 0.038 0.073 0.156 0.198 0.102 0.127 0.063 0.063 7 0.068 0.100 0.032 0.071 0.115 0.130 0.087 0.118 0.068 0.069 8 0.308 0.420 0.392 0.319 0.347 0.370 0.359 0.327 0.296 0.308 9 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 10 0.341 0.227 0.203 1.426 0.452 0.248 0.252 0.293 0.338 0.334 11 0.163 0.274 0.230 0.095 0.095 0.209 0.235 0.178 0.170 0.162 12 0.168 0.202 0.125 0.075 0.099 0.116 0.046 0.057 0.160 0.164 13 0.031 0.016 0.026 0.045 0.037 0.025 0.028 0.029 0.033 0.033 14 0.092 0.122 0.066 0.038 0.066 0.099 0.010 0.015 0.091 0.093 15 0.024 0.027 0.028 0.023 0.046 0.039 0.029 0.069 0.020 0.019 16 0.046 0.037 0.029 0.007 0.032 0.037 − − 0.046 0.046 17 0.224 0.290 0.203 0.333 0.150 0.201 0.074 0.120 0.220 0.220 18 0.046 0.053 0.033 0.018 0.019 0.036 − − 0.049 0.048 19 0.031 0.031 0.021 0.012 0.009 0.021 − − 0.033 0.031 20 0.183 − 0.083 0.232 0.040 0.117 0.235 0.337 0.174 0.1867 表 3 10批次鼻渊净胶囊HPLC指纹图谱相似度
样品 1 2 3 4 5 6 7 8 9 10 对照图谱 相似度 0.979 0.952 0.966 0.951 0.932 0.959 0.936 0.920 0.949 0.948 1.000 -
[1] 张玉杰, 李明春, 张华, 等. 正交设计法优化鼻渊净胶囊超临界CO2萃取工艺条件研究[J]. 中国医院药学杂志, 2016, 36(6):459-463. [2] 程艳芹, 陈延绅, 李明春. 鼻渊净胶囊的质量控制[J]. 药学服务与研究, 2018, 18(5):364-367. [3] 肖会敏, 何悦, 雷美娜, 等. 清脂胃舒佐餐茶HPLC法指纹图谱的研究及4个成分的含量测定[J]. 药学实践杂志, 2018, 36(4):324-328. doi: 10.3969/j.issn.1006-0111.2018.04.008 [4] 陈根顺, 徐丽芳, 李鹏. 草珊瑚的HPLC指纹图谱研究[J]. 中草药, 2011, 42(2):293-296. [5] 沈丽霞, 付延伟, 纪松岗, 等. 基于检测波长切换技术的复方茵陈颗粒HPLC指纹图谱研究[J]. 中国药师, 2018, 21(10):1769-1775. doi: 10.3969/j.issn.1008-049X.2018.10.016 [6] 赵丽艳, 李明春, 石永坚, 等. 复方苦黄凝胶剂的HPLC指纹图谱研究[J]. 热带医学杂志, 2020, 20(7):907-911. doi: 10.3969/j.issn.1672-3619.2020.07.011 [7] 赵晶, 曹红, 邢俊波. 川参通注射液HPLC指纹图谱的研究[J]. 药学实践杂志, 2013, 31(2):137-139. doi: 10.3969/j.issn.1006-0111.2013.02.016 [8] 张玉婷, 汪永忠, 姜辉, 等. 五味温通除痹胶囊的UPLC指纹图谱研究[J]. 现代中药研究与实践, 2019, 33(5):30-33. [9] 范建伟, 庄会芳, 李艳芳, 等. 茵栀黄颗粒的HPLC指纹图谱研究及共有峰归属分析[J]. 中国医院药学杂志, 2019, 39(13):1342-1346, 1352. [10] 罗晖明, 肖炳燚, 聂平, 等. 苍耳子药材的HPLC特征图谱研究[J]. 中国药师, 2018, 21(1):71-74. doi: 10.3969/j.issn.1008-049X.2018.01.017 [11] 王红霞, 张飞, 陈随清, 等. 中药辛夷的HPLC指纹图谱研究[J]. 中国实验方剂学杂志, 2011, 17(15):87-90. [12] 庄岩, 遆铁军, 霍金海, 等. 牛黄清感胶囊HPLC指纹图谱研究[J]. 中国中医药科技, 2019, 26(6):868-872. [13] 王月红, 游飞祥, 王磊, 等. 六经头痛片HPLC指纹图谱建立及多指标成分定量测定研究[J]. 中草药, 2017, 48(20):4167-4173. doi: 10.7501/j.issn.0253-2670.2017.20.006 [14] 李英梅, 王东, 宋爽, 等. 羌活HPLC指纹图谱研究[J]. 辽宁中医药大学学报, 2013, 15(7):68-70. [15] 陈宁, 韩永成, 刘伟, 等. 野菊花的UPLC指纹图谱研究[J]. 中国实验方剂学杂志, 2014, 20(3):83-85. [16] 梁俊, 黄良永, 杨光义. 连翘配方颗粒高效液相色谱指纹图谱[J]. 医药导报, 2015, 34(7):946-949. doi: 10.3870/yydb.2015.07.028 [17] 王佳琪, 江宇勤, 罗婷, 等. 不同等级白芷饮片HPLC指纹图谱[J]. 中成药, 2019, 41(12):2964-2969. doi: 10.3969/j.issn.1001-1528.2019.12.027 [18] 王林凤, 魏国玲. 九味羌活颗粒HPLC特征指纹图谱研究[J]. 中国药师, 2016, 19(10):1879-1882. doi: 10.3969/j.issn.1008-049X.2016.10.021 [19] 江洁怡, 胥爱丽, 李养学, 等. 白芷配方颗粒的指纹图谱研究[J]. 今日药学, 2017, 27(9):612-615, 638. doi: 10.12048/j.issn.1674-229X.2017.09.006 [20] 张远芳, 连云岚, 郝云芳, 等. 羌活与宽叶羌活的GC/HPLC指纹图谱研究[J]. 中国药事, 2019, 33(5):519-527. [21] 苏靖, 戴荣继. 液质联用技术在中药研究中的应用[J]. 生命科学仪器, 2014, 12(Z1):38-42. [22] 顾思佳, 肖畅, 周秋桂, 等. 健脾化湿解毒方的质量标准研究[J]. 湖北中医杂志, 2019, 41(8):3-6. -






 下载:
下载:







 下载:
下载: