-
细胞间隙连接(Intercellular gap junction, GJIC)是一种存在于人体所有细胞中的膜通道,由连接蛋白(connexins, Cxs)形成,并负责转移生物活性分子、代谢物和相邻细胞或细胞与细胞外环境间的盐离子,对细胞的增殖、分化及机体内环境稳定、新陈代谢、生长发育起至关重要作用[1]。实验证实小鼠骨髓、肝脏及脾脏基质中有11种不同的连接蛋白表达,但人类骨髓基质中仅仅有3种Cxs (Cx31、Cx43、Cx45)表达。多项实验均证实Cx43在支持正常造血过程中具有重要作用,而我们前期的研究发现,Cx43在多发性骨髓瘤(multiple myeloma,MM)的发病过程中具有重要作用,患者骨髓微环境中的Cx43表达水平较正常明显升高,骨髓瘤细胞与成骨细胞相互作用后可通过由Cx43组成的GJIC促进其迁移,上调Cx43表达对多发性骨髓瘤细胞的增殖及迁移均起到促进作用,Cx43表达异常与骨髓瘤融合细胞发生相关[2-3]。然而Cx43在MM细胞生存及耐药中的作用尚未阐明,尤其在多发性骨髓瘤干细胞及其与微环境中作用尚不明确。有鉴于此,本研究分离、培养MM患者及正常志愿者来源骨髓间充质干细胞(MM-MSCs、ND-MSCs),在直接共培养条件下观察MM干细胞样细胞生物学特性的变化及MM-MSCs对MM干细胞样细胞的生存及耐药的作用,并探讨其可能机制。
-
细胞株:MM细胞株RPMI 8226、U266、XG4、XG7(苏州大学生物技术研究所张学光教授惠赠);试剂:FBS、PBS、LG-DMEM完全培养液、RPMI1640培养基(美国Gibco公司);Midi MACs系统(德国Milteyni公司);Hoechst33342(美国Sigma公司);抗Cx43及GAPDH一抗(美国CST公司);RNeasy kit试剂盒、QuantiTect reverse transcriptase kit试剂盒、TopTaq Master Mix Kit 试剂盒(美国Qiagen公司);Cytometric Beads Array试剂盒(美国BD公司)。
-
参考文献[4]的方法,采用Ficoll分离MM患者及正常志愿者骨髓单个核细胞(BM-MNCs),用含10%FBS的LG-DMEM完全培养液培养,观察细胞状态,72 h后首次换液,以后根据情况每2~3 d,换液1次。待细胞生长至80%融合后,胰酶消化传代。传至第三代后收获细胞进行后续实验,剩余细胞标记后冻存于液氮罐中备用。志愿者及患者骨髓间充质干细胞(BM-MSCs)的分离、扩增和鉴定在知情同意下获得,并经医院伦理委员会批准。
-
RPMI 8226、U266采用含有10% FBS的RPMI1640培养基培养。XG4、XG7采用含有10% FBS、1 ng/ml IL-6的RPMI1640培养基培养。原代MM细胞来自6例初诊MM患者骨髓:用Ficoll分离BM-MNCs,并用Midi MACs系统纯化,留取CD38+、CD138+细胞,操作按说明书进行,分选后的细胞采用流式细胞术(FCM)检测其纯度,CD38+、CD138+细胞≥90%,采用含有10% FBS的RPMI1640培养基培养。观察细胞状态,48 h后首次换液,以后根据情况每1~2 d,换液1次。传至第三代后收获细胞进行后续实验,剩余细胞标记后冻存于液氮罐中备用。
-
取对数生长期F3代MM-MSCs及ND-MSCs,用PBS洗涤后,调整细胞浓度为2.0×106/ml,每取100 μl细胞悬液,分别加入PE标记的CD90、CD73、CD44、CD105、CD34、CD45及HLA-DR,阴性对照为PE标记的同型IgG,室温下孵育30 min,PBS洗涤2次后,FCM上机检测。
-
按文献[5]报道的方法,分别取RPMI 8226、U266、XG4、XG7及原代MM细胞,调整细胞浓度为106/ml,加入浓度为1 mg/ml的Hoechst33342,调整其终浓度为5 μg/ml,混匀后置于37 ℃水浴箱中避光孵育120 min,期间数次晃动离心管。对照组于此步骤中加入终浓度为50 μmol/L维拉帕米同时孵育。离心后PBS洗涤,用含碘化丙啶(2 μg/m1)的4 ℃预冷PBS重悬细胞,并置于冰浴中。FCM上机检测,激发波长为350 nm,采集波长为450 nm(蓝光)和675 nm(红光),通过与对照组比较,选取染色偏弱部分的细胞即为SP细胞。SP细胞分选按上述步骤准备细胞,ALTRA流式细胞仪更换鞘液并用酒精进行清洗后换为双蒸水冲洗;分别上Hoechst33342管和Hoechst33342+verapamil管进行检测,FCM选择SP分选方案,调整分选参数,全程需要振荡,分选结束后在无菌条件下分别收集主群细胞(MP)和侧群细胞(SP),备用。
-
分别收集RPMI8226、SP细胞、ND-MSCs、MM-MSCs、SP细胞+ND-MSCs、SP细胞+ND-MSCs+25 mmol/L α-GA、SP细胞+MM-MSCs和SP细胞+MM-MSCs+25 mmol/L α-GA各组细胞,用预冷的PBS洗涤细胞3次,加入细胞裂解液,置4 ℃作用30 min,12000 g/min离心10 min,收集上清液,BCA法测定蛋白浓度,加入4×SDS凝胶加样缓冲液混匀,煮沸10 min使蛋白变性。然后,行聚丙烯酰胺凝胶电泳(SDS-PAGE),并转移至PVDF膜上,封闭1 h后,分别与抗Cx43及GAPDH一抗4 ℃孵育过夜,TBS液洗涤后再与HRP标记的二抗共孵育1 h,洗涤后,应用ECL化学发光法显象和Image图象分析软件分析。
-
采用碘化吡啶(PI)法。实验分组:①SP细胞+MM-MSCs;②SP细胞+MM-MSCs+25 mmol/L 18α甘草次酸(α-GA);③对照组为RPMI 8226细胞。实验设3复孔,FCM分析其DNA含量,CellQuest软件分析结果。
-
采用甲基纤维素半固体培养法。实验分组:①SP细胞+MM-MSC组;②SP细胞+MM-MSC+25 mmol/L α-GA组。分别调整SP细胞和MM-MSC细胞浓度为4×105/ml和2.0×106/ml,与等量的2%甲基纤维素混均后,接种于6孔板,每孔总体系2 ml;置饱和湿度、37 ℃的CO2培养箱中培养,14 d取出,置倒置显微镜下记录集落数,≥50细胞为集落,≤50则为簇。
-
采用逆转录聚合酶链式反应(RT-PCR)方法。实验分组:①RPMI 8226组;②新鲜分离SP细胞组;③SP细胞+MM-MSC组;④SP细胞+MM-MSC+25 mmol/L α-GA组。收集各组细胞,操作按试剂盒说明进行。简述如下:采用RNeasy kit试剂盒提取RNA样本,取1μg RNA进行逆转录,按等量cDNA进行PCR反应。所有引物序列均由上海生物工程公司设计并合成,采用β-actin为内参。β-actin上游引物 5′-TCCTGTGGCATCCACG AAACT-3′,下游引物 5′-GAAGCATTTGC GGTGGACGAT-3′,其它引物见表1。PCR扩增条件均为:94 ℃ 5 min、94 ℃ 40 s、56 ℃ 30 s、72 ℃ 32 s,共35个循环。取4 μl PCR产物、Marker 3.5 μl分别加样于2.0%琼脂糖凝胶中电泳,电压100V电泳30~60 min,紫外投射仪观察目标条带,摄影,图象分析软件Smartview2001分析处理结果。
表 1 干细胞样基因引物序列
基因 引物序列 c-myc 5′CTTCTCTCCGTCCTCGGATTCT
3′GAAGGTGATCCAGACTCTGACCTTKlf-4 5′GCAAGTCCCCTCTCTCCATTA
3′GTAAGGTTTCTCGCCTGTGTGOct-4 5′GGAGATATGCAAAGCAGAAACC
3′CTCAAAATCCTCTCGTTGTGCSox-2 5′CGGCAACCAGAAAAACAGC
3′TCTCCGTCTCCGACAAAAGT -
采用CBA检测法。取对数生长期MM-MSCs,调整细胞数1×105/ml 接种于6孔板,培养箱静置4 h弃上清,并将不同MM细胞按1×105/ml的浓度接种该孔中,每孔2 ml,分组为:①RPMI 8226细胞;②SP细胞+MM-MSCs;③SP+MM-MSCs+α-GA(25mmol/L);④MM-MSCs。每组设3个复孔,培养24 h后收集培养上清,利用CBA技术测定上清中IL-6、IL-10、TGFβ、bFGF和IL-17的变化。
-
采用annexinV/PI标记细胞流式术分析法。取对数生长期MM-MSC细胞,调整细胞数4×105/孔接种于24孔板;RPMI8226或SP细胞,调整细胞数2×104/孔接种于24孔板,培养箱静置4 h后去上清,分组如下:①RPMI8226;②RPMI8226+硼替佐米(BTZ);③SP+BTZ;④SP+MM-MSC+BTZ;⑤SP+MM-MSC+BTZ+α-GA。所有实验组BTZ及α-GA的终浓度分别为20 nmol/L和25 mmol/L,培养24 h后收集细胞,FCM检测细胞凋亡,实验设5复孔。
-
所有数据采用Graphpad Prism 5.0 统计处理软件分析,以均数±标准差表示。组间分析采用t检验,P<0.05 为差别具有统计学意义。
-
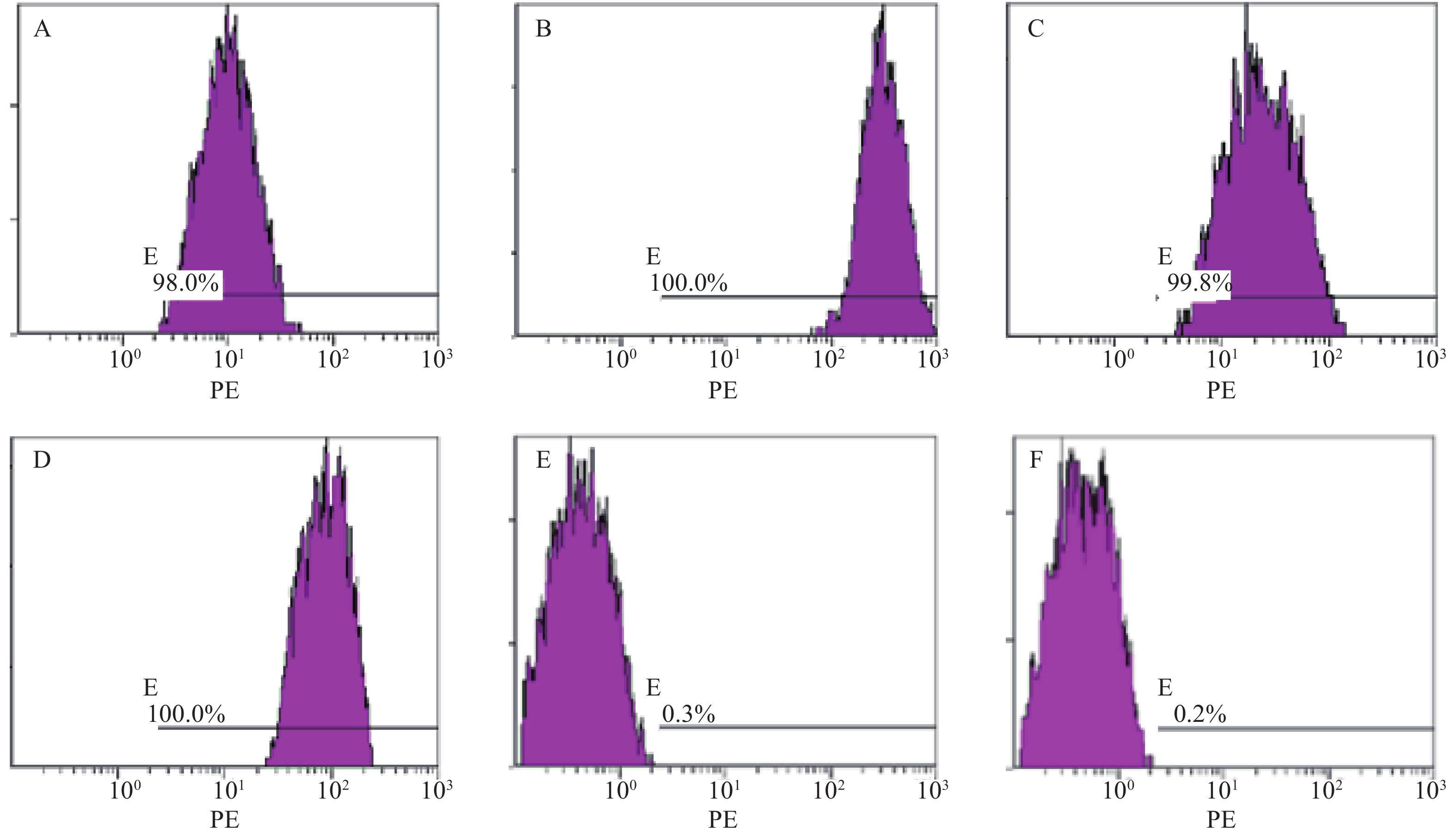
分离培养获得MM-MSCs及ND-MSCs,表面抗原提示两者均为高表达CD73(98.0%)、CD44(100%)、CD90(99.8%)和CD105(100%),基本不表达CD34(0.3%)、HLA-DR(0.2%),细胞形态两者无明显差异。见表2和图1。
表 2 BM-MSCs细胞表面抗原分析
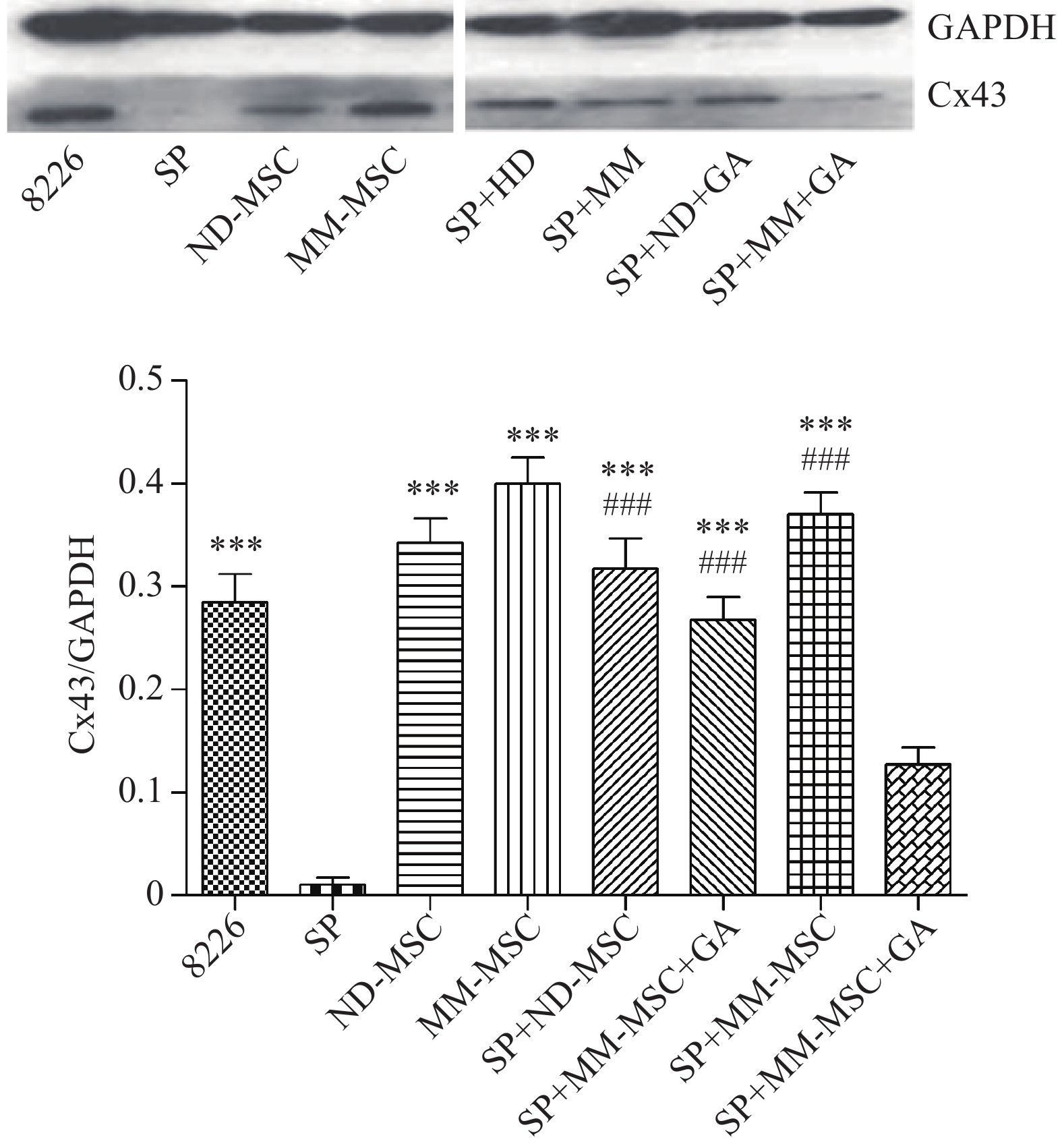
表面抗原 CD73 CD44 CD90 CD105 CD34 HLA-DR 表达率(%) 98.00 100 99.80 100 0.30 0.20 蛋白印迹试验证实SP细胞仅表达极少量的Cx43分子,而RPMI 8226细胞则表达较高水平的Cx43,两者具有显著性差异(P<0.001);MM-MSCs较ND-MSCs表达Cx43明显较多,但不具有统计学意义(P>0.05);SP细胞与MM-MSCs共培养后,其Cx43表达均有显著上调(P<0.001);阻断GJ后,SP细胞的Cx43表达则呈现明显下调(P<0.001),详见图2。
-
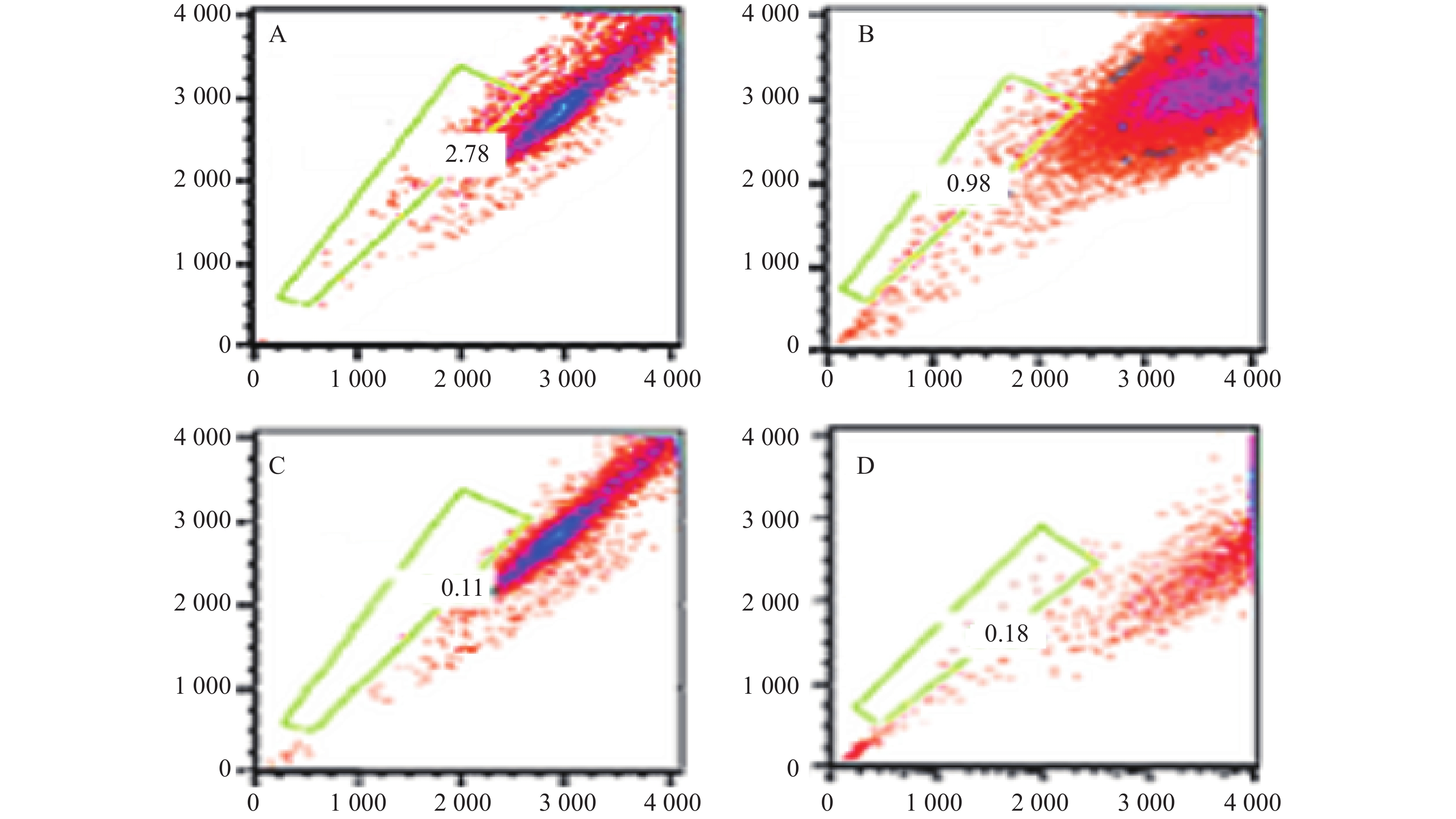
本研究对6例MM患者的原代细胞及4种MM细胞株的检测提示,采用Hoechst 33342染色后应用FCM技术可将MM细胞分为2群,即主群细胞(MP)和侧群细胞(SP)[6]。所有MM细胞均存在不同比例的SP细胞。MM细胞株中SP细胞含量分别为1.783 %、0.8256 %、0.082 %、0.177 %,而原代细胞不具备可重复性,鉴于RPMI 8266细胞中SP细胞含量较多,且稳定,此后实验采用的SP细胞均来自RPMI8226,详见图3。
-
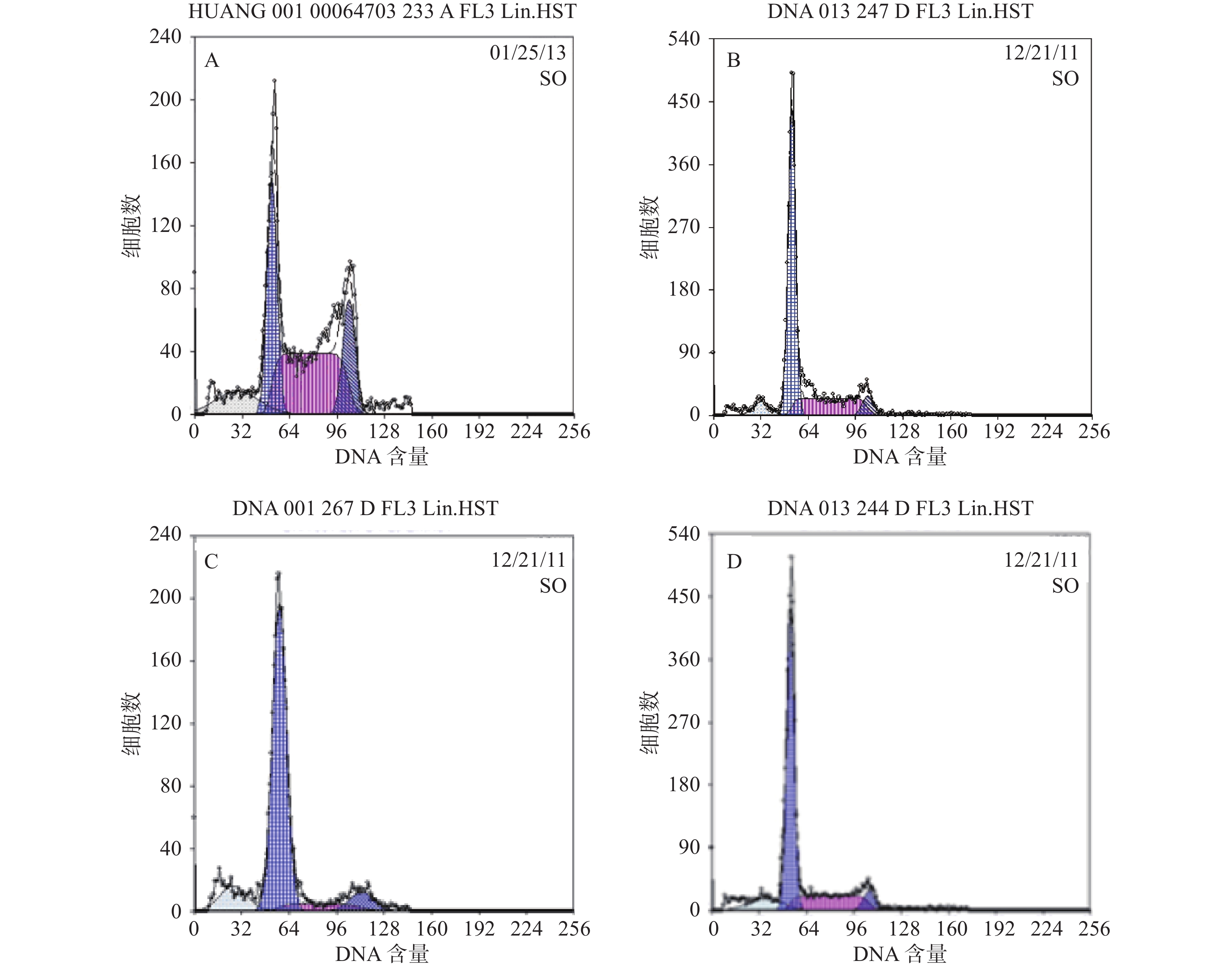
结果分析提示SP亚群中处G0期细胞比例显著高于MP亚群,分别为(44.34±1.7) %和(28.49±1.1) % ,提示SP亚群中包含更多处静止期的MM细胞。与MM-MSCs共培养后发现MM-MSCs具有促进SP亚群细胞进入G0期的作用,其G0期细胞达(82.6±0.1) % (P<0.001),而加入间隙连接抑制剂α-GA后,MM-MSCs对SP亚群的这一作用减弱,细胞进入增殖周期者增多,G0期细胞降至(63.42±3.86) % (P<0.01),详见图4。
-
我们利用克隆形成实验分析SP细胞体外形成集落的能力,SP细胞单独培养、与ND-MSCs共培养、与MM-MSCs共培养、与ND-MSCs共培养体系中加入通道阻断剂,与MM-MSCs共培养体系中加入通道阻断剂后单克隆直径、克隆形成数、克隆形成率见表3。结果显示出与MM-MSCs共培养的SP细胞有更强的克隆形成能力。加入通道阻断剂后克隆形成能力均表现出一定程度的下降,单细胞克隆直径减小,克隆形成率降低,见图5。
表 3 不同培养体系加入阻断剂前后克隆形成能力
组别 单克隆直径
(cm)克隆形成数 克隆形成率
(/2000)SP 0.28±0.16 1722±127 86%±6% SP+ND-MSCs 0.33±0.14 1858±89 93%±4% SP+MM-MSCs 0.38±0.21 1900±85 95%±4% SP+ND-MSCs+GA 0.25±0.22 1532±112 77%±6% SP+MM-MSCs+GA 0.31±0.17 1755±76 88%±4% -
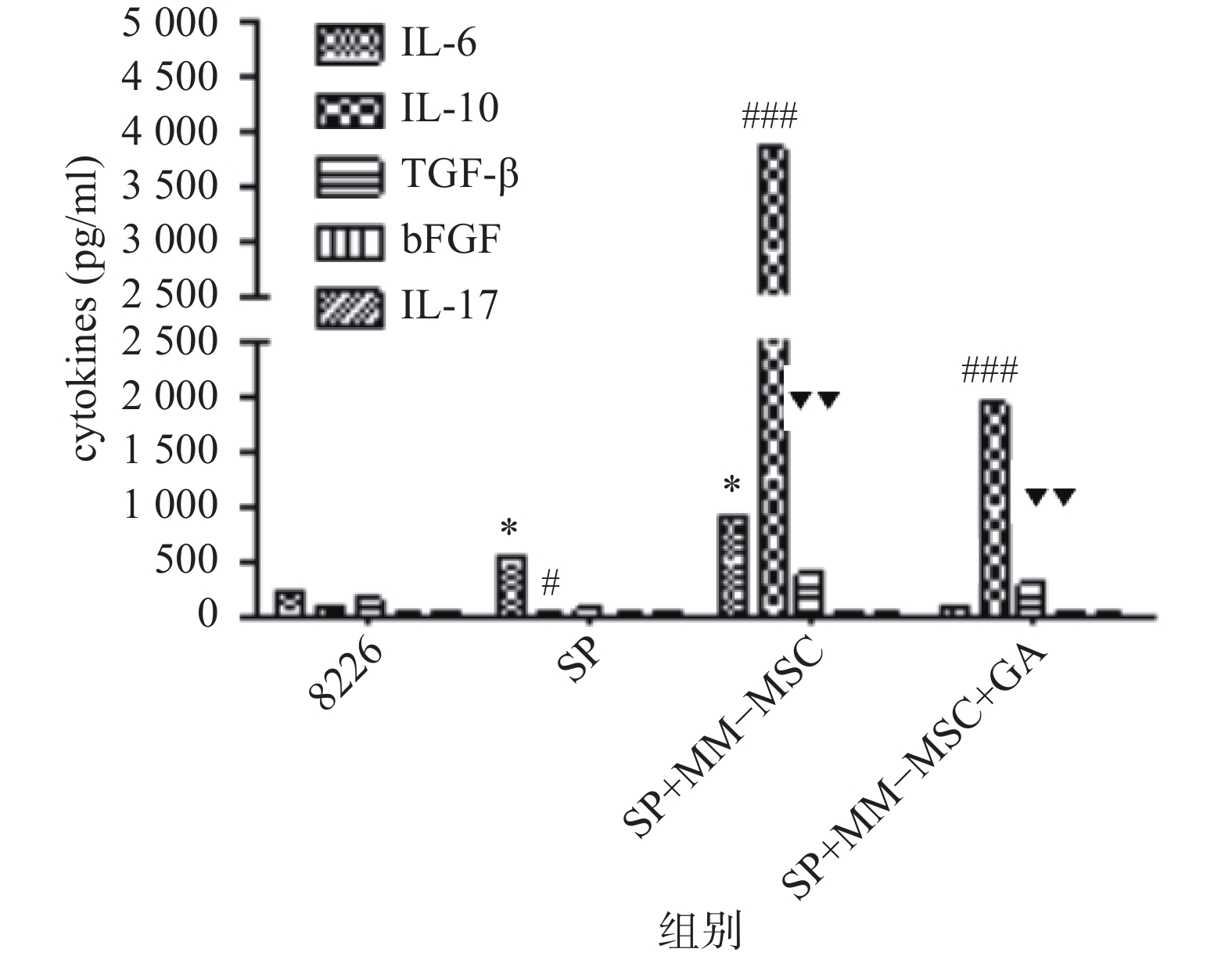
CBA分析显示,MM-MSCs单独培养24 h后,其培养上清中存在高水平的IL-6,较低水平的TGF-β、bFGF和IL-17,基本无IL-10分泌;RPMI 8266细胞培养24 h后上清中可以测得较低水平的TGF-β及少量bFGF、IL-17、IL-6及IL-10;共培养24 h后,其上清中IL-6、IL-10和TGF-β水平较前明显升高(P<0.05),尤其是IL-6和IL-10水平较单独培养时显著升高(P<0.01),bFGF和IL-17共培养前后则无明显变化;加入GJ阻断剂后,细胞因子IL-6、IL-10和TGF-β的分泌有所降低(P<0.05),见图6。
-
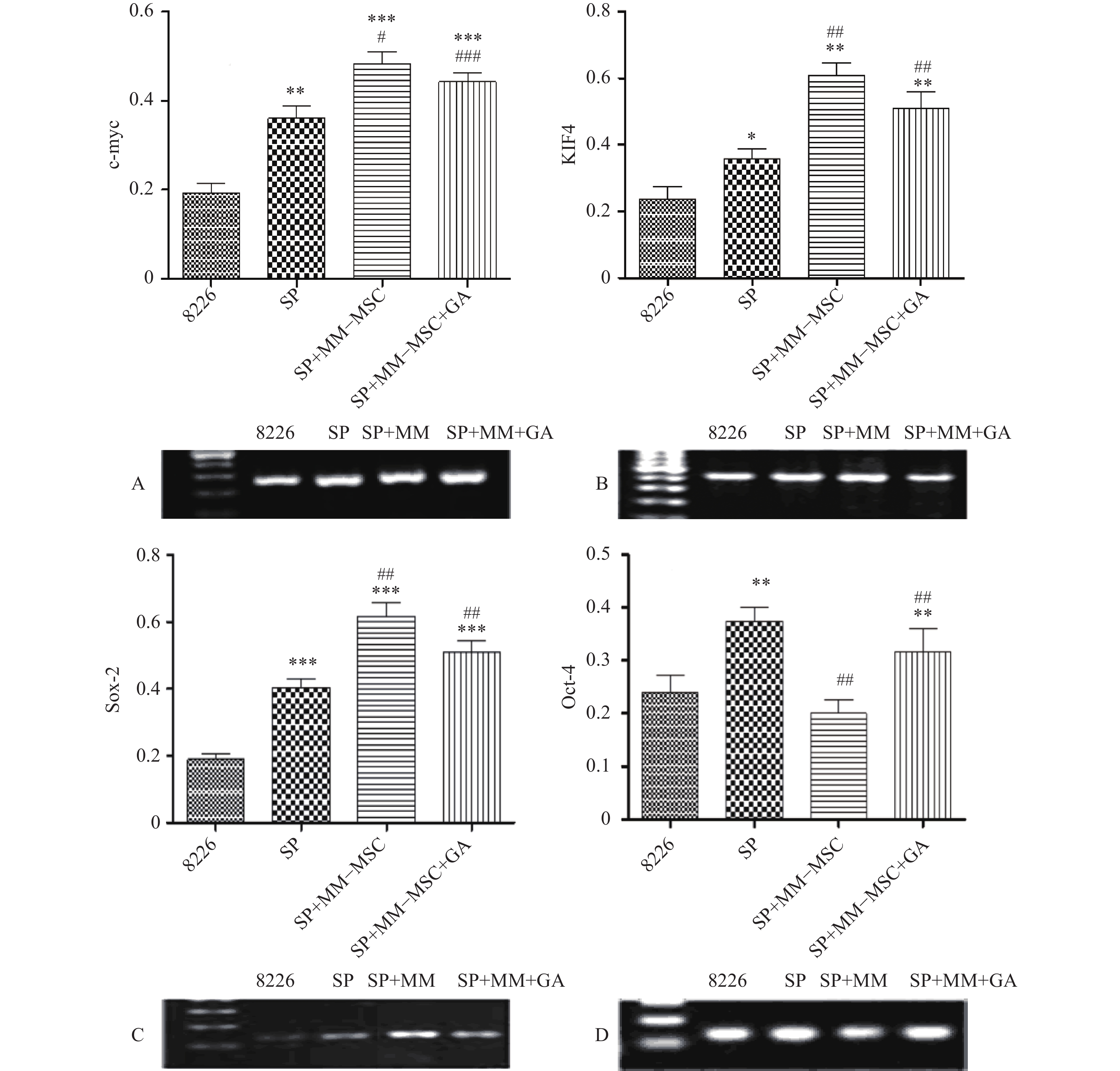
RT-PCR检测发现RPMI8266存在一定量c-myc、KIF4、SOX2和Oct-4基因表达,但SP细胞亚群中该类基因表达明显上调,两者具有显著性差异(P<0.05),将SP细胞与MM-MSC共培养后,可观察到c-myc、KIF4和SOX2基因表达的显著上调(P<0.001),而Oct-4基因表达下调,加入GJ阻断剂后,原上调的基因均有不同程度下调,但无明显区别(P>0.05),见图7。
-
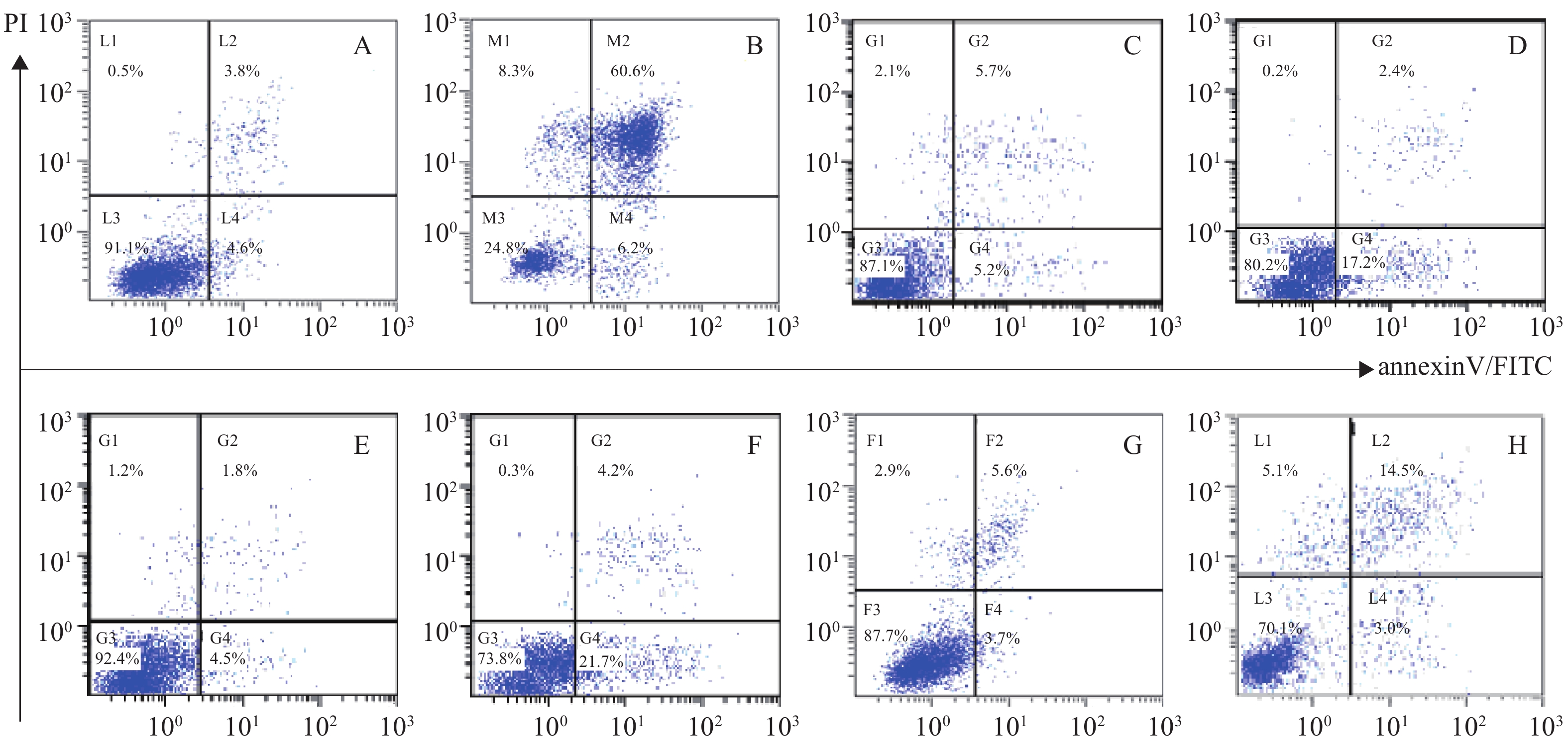
体外PI/Annexin V检测显示,RPMI 8226的MP细胞对BTZ诱导的细胞凋亡敏感,而对SP细胞敏感性较差,其凋亡率分别为(66.8±0.77)%和(25.9±0.86)%,P<0.001。与MM-MSCs直接共培养后,BTZ诱导的凋亡作用较单独培养明显减弱(P<0.05),MM-MSCs具有一定保护作用,加入GJ阻断剂后,可部分恢复MM细胞对硼替佐米的敏感性,证实MM-MSCs可保护骨髓瘤细胞免受抗肿瘤药物影响,而GJIC在其中可能起到一定作用,见图8。
-
MM是一种恶性浆细胞疾病,以肿瘤细胞与骨髓微环境中基质细胞的复杂的相互作用网络为特征,骨髓基质细胞可促进MM细胞的生存、增殖和药物抗性。骨髓间充质干细胞是骨髓基质细胞中最主要的干细胞群体,能够分化成多种细胞系,包括成纤维细胞、脂肪细胞、软骨细胞和成骨细胞。MSCs可以迁移到原发肿瘤和转移部位,这意味着这些细胞可能调节肿瘤的生长和转移。MSCs在与MM细胞相互黏附及作用过程中部分细胞特性发生改变,成为肿瘤相关BMSCs,即MM-MSCs,MM患者来源的骨髓间充质干细胞显示出功能异常,说明骨髓间充质干细胞在骨髓瘤的发生、发展中不是旁观者,它还可分泌多种细胞因子影响MM细胞的生长、生存、耐药、迁移,在疾病的发生、发展中起了重要的作用,目前成为治疗多发性骨髓瘤的新的研究热点[7-8]。
尽管近几年MM的治疗取得了长足的进步,但目前它仍然是不可治愈的,有证据表明MM细胞之间存在异质性,尤其是可能存在MM干细胞亚群,它具有自我更新及原发耐药特性,可能是MM增殖、维持MM表型及导致疾病复发的原因,但其耐药性的机制还没有得到充分的了解[5, 9]。理想的多发性骨髓瘤干细胞(MMSCs)的鉴定应依赖于MMSCs的表型,但至今MMSCs的表型尚未得到正确的定义。Goodell等通过FCM在MM细胞中分离出具有干细胞特性的SP细胞,为拓展肿瘤干细胞的研究提供了思路。目前,SP细胞和ALDH1+已经被用来鉴定MMSCs。MMSCs与骨髓微环境的复杂的相互作用维持着MMSCs的自我更新和生存。然而, MMSCs与周围骨髓微环境相互作用的分子需要进一步确认。
在过去的几年里,连接蛋白的异常表达,特别是Cx43的异常表达已经被证实与癌症复发、转移性扩散和不良预后相关。根据癌症的不同分期和类型,Cx43既可以作为肿瘤抑制因子,也可以作为癌基因、生物标记物,我们需要更好地了解Cx43在肿瘤微环境中如何参与、影响肿瘤形成和进展,从而开发基于Cx43的临床可行疗法。Cx43分子在细胞表面形成通道,可使小分子和一定量大分子物质在细胞间转移,这一特性使它们存在将化疗药物直接送入肿瘤细胞内的潜力,从而成为肿瘤治疗新的非常有吸引力的靶点。
为明确MM-MSCs与SP细胞的相互作用,首先我们采用Hoechst33342标记FCM术检测骨髓瘤细胞株及新鲜MM标本,结果证实所有检测样本中均存在SP细胞亚群,4 种 MM 细胞株检测SP 细胞含量分别为1.783 %、0.8256 %、0.082 %、0.177 %,并成功分选SP细胞比例最高的PRMI8226细胞株的SP细胞。在此基础上,通过对SP亚群细胞的多种干细胞相关基因如c-myc、KIF4、SOX2和Oct-4表达分析,发现其与RPMI 8226细胞有明显不同。直接与MM-MSCs共培养后SP细胞亚群c-myc、KIF4和SOX2基因表达显著上调 (P<0.001),而Oct-4基因表达下调,加入GJIC阻断剂后,c-myc、KIF4和SOX2基因表达尽管有所下调,但并无显著性差异。对于细胞周期的分析也证实SP细胞亚群中处G0期细胞比例显著高于MP亚群,分别为(44.34±1.7)%和(28.49±1.1)% ,提示SP细胞亚群中包含较多处静止期MM细胞,推测与该群细胞化疗敏感性差可能有关。共培养后发现MM-MSCs有促进SP亚群细胞进入G0期的作用(P<0.001),其G0期细胞达(82.6±0.1)%,而加入间隙连接抑制剂α-GA后,这一作用减弱,细胞进入周期者增多,G0期细胞为(63.42±3.86)%。体外集落形成试验证实从MM细胞分离的SP细胞本身具有较强的集落形成能力,但在MM-MSCs存在的前提下其细胞形成的体外集落细胞数更多,胞体较大且细胞折光性强,提示细胞活力较好,培养体系中加入GJ阻断剂后体外集落形成能力均现出一定程度的下降,克隆形成率降低,单细胞克隆直径减小。
前期我们的研究证实MM-MSCs与MM细胞可形成功能性GJIC,并在多发性骨髓瘤的发病中扮演重要角色[2-3, 10],为进一步观察间充质干细胞中连接蛋白Cx43组成的细胞间隙连接在多发性骨髓瘤SP细胞生存及耐药中的作用,我们通过蛋白印迹试验证实除SP细胞基本无Cx43表达外,ND-MSCs和MM-MSCs、MM细胞株及初诊患者MM细胞均表达Cx43分子,与SP细胞相比差别显著(P<0.001)。SP细胞与MM-MSCs共培养后,其Cx43分子表达显著上调(P<0.001),加入α-GA可部分下调SP细胞的Cx43表达(P<0.001)。采用CBA技术检测共培养前后培养液中细胞因子变化,发现在直接共培养时MM-MSCs细胞因子分泌谱发生变化,在原有高水平IL-6的基础上,IL-10和TGFβ水平较前明显增加(P<0.05),尤其是IL-6和IL-10较单独培养时显著增加(P<0.01),bFGF和IL-17在共培养前后水平无明显变化,采用α-GA阻断MM-MSCs与SP细胞间的GJIC后,细胞因子IL-6、IL-10和TGF-β的分泌能力下调(P<0.05)。综上,我们认为MM-MSCs通过多种途径影响SP细胞的生物学特性,增加其干细胞相关基因表达、增加静止期细胞比例、增强其体外集落形成能力、改变细胞因子分泌,而在这一过程中Cx43分子的表达及其形成的GJIC具有重要作用。
蛋白酶体抑制剂BTZ是MM治疗的一线药物,尽管BTZ较目前其他化疗药物更为有效,但原发性或获得性耐药仍是限制其疗效的主要原因,目前对于蛋白酶体抑制剂耐药的机制仍未阐明。本研究发现尽管MP和SP细胞均对BTZ敏感,但SP细胞敏感性较差,可能与其本身极低表达Cx43部分相关,其凋亡细胞分别为(66.8±0.77)%和(25.9±0.86)%,P<0.001,经与MM-MSCs直接共培养后,BTZ诱导的凋亡作用明显减弱(P<0.05),MM-MSCs具有保护作用,而在共培养体系中加入α-GA,可部分恢复MM细胞对硼替佐咪的敏感性,由此证实MM-MSCs促进MM SP细胞的生存,保护MM SP细胞免受抗肿瘤药物影响,GJIC在其中起到一定作用。我们前期实验提示,过表达MM细胞的Cx43可提高MM细胞化疗敏感性,但与MSCs共培养后敏感性降低,肿瘤细胞本身Cx43半通道有可能通过增加癌细胞对化疗药物的通透性来降低耐药性,但与微环境中MSCs相互作用后这一作用产生变化,但具体机制仍在进一步研究中。
本研究发现Cx43及其组成的GJIC不但影响MM细胞的迁移,而且也影响恶性浆细胞的药物敏感性,证实骨髓微环境中Cx43及其组成的GJIC在MM发生、发展中具有重要作用,在细胞因子分泌、肿瘤生长、细胞周期变化、基因表达等多个环节中影响MM细胞的生物学行为,基于我们及其他相关研究结果,我们证实MM细胞与MM-MSCs、造血细胞及细胞外基质通过粘附GJIC介导耐药,阻断肿瘤细胞与微环境的GJIC将有助于提高抗肿瘤效益。
Role of intercellular junctions in the biological behavior of SP cells of multiple myeloma
-
摘要:
目的 观察不同来源间充质干细胞(MSCs)中由连接蛋白43(Cx43)组成的细胞间隙连接(GJIC)及其介导的信号对多发性骨髓瘤(MM)侧群细胞(SP细胞)生物学行为的影响,并探讨其可能机制。 方法 分离培养不同来源的间充质干细胞(MSCs);应用流式细胞术分选MM细胞株RPMI 8266的SP细胞;采用RT-PCR技术及蛋白印迹(Western blot)法检测不同来源MSCs、RPMI 8266、SP细胞中Cx43基因及蛋白水平表达;直接共培养观察不同来源MSCs对SP细胞周期、Cx43蛋白表达、体外集落形成能力、干细胞相关基因表达、细胞因子分泌和耐药的变化以及加入连接通道抑制剂18α甘草次酸(α-GA)后的影响。 结果 MM-MSCs与ND-MSCs形态及表型无明显区别,与RPMI 8266细胞均表达较高水平的Cx43;与MM-MSCs共培养可使更多SP细胞进入G0期(P<0.001),SP细胞的c-myc、KIF4和SOX2基因表达显著上调,而Oct-4基因表达下调,加入α-GA后,c-myc、KIF4和SOX2均有不同程度下调,但无显著性差别;使Cx43表达上调,分别为(31.00±2)%和(39.00±2)%;使体外集落形成能力上调,加入α-GA可部分抑制该作用;RPMI 8266存在少量c-myc、KIF4、SOX2和Oct-4基因表达,SP细胞亚群中该类基因明显上调,MM-MSCs分泌高水平的白介素(IL)-6,与SP细胞共培养后,其上清液中IL-6、IL-10及TGF-β表达上调(P=0.0072,P=0.037);bFGF和IL-17则无明显变化。加入α-GA后,上清液中IL-6、IL-10和TGF-β水平降低;MM细胞对硼替佐米诱导的凋亡敏感,但SP细胞敏感性较差,与MM-MSCs共培养显著减少硼替佐米介导的细胞凋亡,加入α-GA可部分恢复MM细胞对硼替佐米的敏感性。 结论 MM-MSCs与多发性骨髓瘤SP细胞上调Cx43蛋白表达,形成更多GJIC,并通过改变MSCs细胞因子分泌谱,促进SP细胞增殖和耐药,可能是最终导致MM复发的原因之一。 Abstract:Objective To observe the effects of the intercellular gap junction (GJIC) composed of connexin 43(Cx43) in mesenchymal stem cells (MSCs) from different sources and their signals on the biological behavior of multiple myeloma (MM) lateral population cells (SP cells), and to explore its possible mechanism. Methods Mesenchymal stem cells (MSCs) from different sources were isolated and cultured. SP cells of MM cell line RPMI 8266 were sorted by flow cytometry. RT-PCR and Western blot were used to detect the expression of Cx43 gene and protein in MSCs, RPMI 8266 and SP cells from different sources. The effects of MSCs from different sources on SP cell cycle, Cx43 protein expression, colony formation ability in vitro, stem cell related gene expression, cytokine secretion and drug resistance were observed. Results There was no significant difference in morphology and phenotype between MM-MSCs and ND-MSCs. Both MM-MSCs and RPMI 8266 cells expressed a higher level of Cx43. Co-culture with MM-MSCs induced more SP cells to enter G0 phase (P<0.001). The expressions of c-myc, Kif4 and Sox2 genes in SP cells were significantly up-regulated, while the expression of Oct-4 gene was down-regulated. After adding α-GA, c-myc, Kif4 and Sox2 were down-regulated in varying degrees, but there was no significant difference. The expression of Cx43 was up-regulated by (31.00±2)% and (39.00±2)%, respectively. The colony formation ability in vitro was up-regulated, and the addition of α-GA could partially inhibit this effect. A small amount of c-myc, Kif4, Sox2 and Oct-4 genes were expressed in RPMI 8266. These genes were significantly up-regulated in SP cell subpopulation. MM-MSCs secreted high levels of interleukin (IL)-6. After co-culture with SP cells, the expressions of IL-6, IL-10 and TGF-β in the supernatant of MM-MSCs were up-regulated (P=0.0072, P=0.037). bFGF and IL-17 had no significant change. After adding α-GA, the levels of IL-6, IL-10 and TGF-β in the supernatant decreased. MM cells were sensitive to bortezomib (BTZ) induced apoptosis, but SP cells were less sensitive. Co-culture with MM-MSCs significantly reduced BTZ-mediated apoptosis. The addition of α-GA partially restored the sensitivity of MM cells to bortezomib. Conclusion MM-MSCs and multiple myeloma SP cells up-regulate the expression of Cx43 protein, form more GJIC, and promote the proliferation and drug resistance of SP cells by changing the cytokine secretion profile of MSCs, which may be one of the reasons for the recurrence of MM. -
Key words:
- multiple myeloma /
- gap junction connexin /
- tumor microenvironment
-
抗真菌感染尤其深部真菌感染是抗微生物感染的重要研究内容,也是全球范围医学研究中面临的严峻挑战。近年来,在免疫力低下和重症监护病房患者中[1],真菌感染发病率和病死率逐年增加,其中在侵袭性念珠菌病中,病死率约为40%[2]。白色念珠菌是真菌感染中最常见的病原体,可以在正常人体的皮肤、口腔、阴道和肠道等部位定植[3]。临床上,多烯类、棘白菌素类、唑类和烯丙胺类药物是治疗真菌感染最常用的药物[4],然而由于白色念珠菌的耐药性、形成生物被膜以及部分药物较大的毒副作用等问题,传统抗真菌药物的应用面临新的挑战[5]。因此,增加现有抗真菌药物的药效,降低其毒副作用,是抗真菌药物研发的重要方向。利用药物新剂型的研究降低其毒副作用是有效的药物研发途径。例如,成功上市的两性霉素B脂质体即可极大降低两性霉素B的肾脏毒性[6]。
醋酸卡泊芬净(CAS)是一种棘白菌素半合成类抗真菌药,作用于真菌细胞的细胞壁,能有效抑制细胞壁中β-1,3-D-葡聚糖的生物合成,是目前白色念珠菌系统性感染治疗中的一线推荐药物。然而,CAS价格昂贵,通过药物合用的方式,维持或增强CAS的治疗效果,降低其使用剂量,可以显著减少患者的用药成本。与此同时,降低药物剂量可以减少CAS的毒副作用。有研究显示,患者在接受高于批准剂量3倍的CAS作用下,高剂量组中65%的患者会出现肝毒性,包括肝酶升高和肝衰竭[7]。我们在前期研究中发现单硬脂酸甘油酯(GMS)与CAS联合用药具有良好的协同作用,增强CAS体外抑菌效果,如两者联用体外抑菌MIC由
0.0625 μg/ml降低到0.0313 μg/ml[8]。然而,GMS与CAS混合使用,由于溶解性差异和药代动力学不同,可能无法在体内同时达到作用部位,共同杀灭真菌,本研究通过制备醋酸卡泊芬净单硬脂酸甘油酯固体脂质纳米粒为上述问题解决提供思路,并发挥体内协同抗菌的效果。固体脂质纳米颗粒(SLNs)以固态天然或合成的类脂如卵磷脂、甘油三酯等为载体,将药物包裹或夹嵌于类脂核中制成的纳米给药系统[9],可以包载亲脂性或者亲水性药物,提高药物的稳定性[10]。具有毒性低生物相容性好、物理稳定性好、体循环中药物不易泄露的特点[11]。通过药物协同增加抑真菌作用,可以减少给药用量与给药次数,提高药物疗效;进而降低抗真菌药物的毒副反应;同时减少真菌耐药性的产生[12]。基于以上研究基础,本研究以单硬脂酸甘油酯作为载体材料制备卡泊芬净固体脂质纳米粒,考察纳米粒对卡泊芬净的协同增效作用。
1. 实验仪器和材料
1.1 菌株
标准菌株白色念珠菌SC5314由美国Georgetown大学William A Fonzi教授赠予。
1.2 实验试剂及仪器
醋酸卡泊芬净(上海源叶)(≥98%);单硬脂酸甘油酯、蛋白胨、葡萄糖、琼脂(上海生工);乙腈、泊洛沙姆188、磷酸、甲醇(中国国药);DMEM高糖培养基、PBS缓冲液(上海泰坦);酵母提取物、营养肉汤(BD公司);RPMI
1640 (美国Gibco)。马尔文粒度电位仪(英国Malvern);透射电子显微镜(日本JEOL);高效液相色谱仪(美国Thermo);超声波细胞粉碎机(宁波新芝生物);高速离心机(德国Hettich);涡旋混合器(日本LTS);电子天平(瑞士MettlerToledo);洁净工作台(上海力申);多功能功能酶标仪(瑞士TECAN)。
1.3 实验动物
ICR小鼠,雌性,体重20~22 g,由苏州华创信诺医药科技有限公司提供,动物许可证号:SCXK(苏)2020-0009。
2. 实验方法
2.1 白色念珠菌培养
将在SDA固体培养基上保存的白色念珠菌单克隆菌株转接到3 ml YEPD培养基,30 ℃,200 r/min,培养18 h,使白色念珠菌处于指数生长的平台期。将活化的菌株转移到离心管中,重悬、离心洗涤3次后加入1 ml pH=7.4 PBS(0.01 mol/L)重悬,备用。
2.2 CAS含量测定
2.2.1 色谱条件
色谱柱:Diamonsil Plus C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈∶0.1%磷酸(35∶65);流速:1 ml/min;检测波长:227 nm;柱温为25 ℃;进样量:20 μl。
2.2.2 方法学验证
专属性考察:取醋酸卡泊芬净标准液、空白SLNs溶液、CAS-SLNs溶液,经0.22 μm滤膜过滤后,按“2. 2. 1”项下色谱方法进样检测。
线性和范围:精密称取CAS并定量配置质量浓度为1、5、10、20、40、50 μg/ml的CAS溶液。按“2.2.1”项下色谱方法进行检测,横坐标为CAS浓度,纵坐标为峰面积,绘制标准曲线。
精密度:日内精密度取5、20、40 μg/ml 3个浓度的CAS溶液各3份,分别检测3次;日间精密度是取低、中、高3个浓度的CAS溶液各3份,每3 d进行检测。
溶液稳定性:同一样品在0、1、2、3、5、8、12 h分别按“2.2.1”项下色谱方法进行检测,计算RSD以考察样品溶液的稳定性。
回收率:取空白SLNs溶液,分别取5、20、40 μg/ml 3个浓度的CAS溶液,超声破乳后,经0.22 μm滤膜过滤后按“2. 2. 1”项下色谱方法进行检测,计算回收率。
2.3 CAS-SLNs的制备和表征
2.3.1 CAS-SLNs的制备
采用熔融法制备醋酸卡泊芬净固体脂质纳米粒(CAS-SLNs):称取处方量的CAS、GMS、卵磷脂(CAS、GMS、卵磷脂摩尔比为1∶20∶5)完全溶解于甲醇中,加热条件下磁力搅拌混合均匀作为油相。配置0.2%泊洛沙姆188溶液,加热至相同温度作为水相。在磁力搅拌条件下(500 r/min),将水相缓慢滴入油相,加热条件下持续搅拌30 min,得到初乳。取初乳超声10 min(250 W,1 S,1 S),4 ℃固化过夜,即得到CAS-SLNs。
2.3.2 CAS-SLNs的表征
马尔文粒度仪测定SLNs的粒径和Zeta电位,磷钨酸负染后透射电镜观察其表面形态。
2.3.3 CAS-SLNs包封率测定
使用低温超速离心法,取所制备的CAS-SLNs溶液于离心管内
15000 r/min下离心2 h,取上清液500 μl于5 ml量瓶内并定容至刻度。另取500 μl未经离心的CAS-SLNs溶液于5 ml量瓶内并定容至刻度,甲醇超声破乳,分别取以上各组溶液经0.22 μm滤膜进样检测并计算载药量和包封率。根据公式(1)计算包封率(EE)、公式(2)计算载药量(DL):$$ \mathrm{E}\mathrm{E}=\frac{{M}_{\text{投药量}-}{M}_{\text{上清液含药量}}}{{M}_{\text{投药量}}}\times 100\text{%} $$ (1) $$ \mathrm{D}\mathrm{L}=\frac{{M}_{\text{实际包载量}}}{{M}_{\text{载药纳米粒}}}\times 100\text{%} $$ (2) 2.4 体外抗真菌活性的测定
2.4.1 CAS-SLNs最低抑菌浓度(MIC)的测定
制备药敏实验板:取96孔板。第1列配置100 μl RPMI1640培养基做空白对照;第12列配置100 μl菌液做阳性对照;第2列加200 μl菌液,分组为CAS、CAS + GMS(CAS与GMS物理混合)、CAS+SLNs(CAS与空白SLNs物理混合)、CAS-SLNs,每组两行,每孔CAS含量浓度为0.313 μg/ml。2~11列进行倍比稀释,最终使得CAS浓度为3.13×10−2 μg/ml、1.57×10−2 μg/ml、7.83×10−3 μg/ml、3.91×10−3 μg/ml、1.96×10−3 μg/ml、9.78×10−4 μg/ml、4.89×10−4 μg/ml、2.45×10−4 μg/ml、1.23×10−4 μg/ml、6.13×10−5 μg/ml、3.06×10−5 μg/ml。30 ℃恒温孵育24 h,用酶标仪在λ=630 nm处测A值。100 μl RPMI 1640培养基做空白对照记为A空白,菌液做阳性对照记为A阳性,加入各实验组记为A实验,MIC定义为使白色念珠菌A630降低80%以上的最小药物浓度。
2.4.2 生物被膜抑制效果的测定
制备生物被膜板:1640培养基调节白色念珠菌浓度为3×106 CFU/ml。取96孔板,第1列加100 μl RPMI1640培养基做空白对照;第2至12列加100 μl菌液,37 ℃培养90 min。
制备药敏板:分组为CAS、CAS+GMS、CAS+SLNs、CAS−SLNs,每组两行,每孔CAS含量浓度为0.313 μg/ml。按“2.4.1”项下倍比稀释得到不同浓度的CAS。
生物被模板孵育90 min后,弃上清液,用PBS清洗,将药敏板中的CAS按浓度梯度分别加入第2至11列,37 ℃培养24 h。倒掉培养基,PBS清洗生物被膜,加入0.4%结晶紫水溶液染色。倒掉染液并用PBS冲洗,加入酒精脱色后,取适量上清至96孔板,用酶标仪在λ=630 nm处,测A值。生物被膜板可在显微镜下观察被膜形成情况。
2.5 体内抗真菌活性的测定
2.5.1 白色念珠菌系统性感染
选择ICR小鼠雌性,6~8 周龄,小鼠尾静脉注射SC5314。注射剂量为1×105 CFU/只。1 d后处死小鼠,收集肾脏组织进行PAS染色切片。小鼠体重检测:将实验动物分为对照组、CAS组、CAS-SLNs组,每组8只。注射白色念珠菌后,分别尾静脉注射生理盐水、CAS、CAS-SLNs,每只200 μl(0.2 mg/kg)。间隔24 h给药,连续给药3次。给药后连续观察20 d,每天记录小鼠体重(g)。
2.5.2 真菌载菌量测定
实验动物造模后随机分为3组:对照组、CAS组、CAS-SLNs组。模型建立后分别尾静脉注射生理盐水、CAS、CAS-SLNs,每只200 μl(0.2 mg/kg)。感染48 h后处死,将肾脏组织称重后置入PBS中研磨成匀浆,将组织匀浆稀释到合适的倍数,接种到SDA平板上,在30 ℃下培养48 h后进行菌落计数。
2.5.3 组织病理学观察
实验动物分为对照组、CAS组、CAS-SLNs组,模型建立后分别尾静脉注射生理盐水、CAS、CAS-SLNs。感染48 h后处死,并取其肾组织进行PAS染色切片,观察白色念珠菌在组织中的感染情况。
2.6 统计学分析
采用GraphPad Prism 8(GraphPad Software, San Diego, CA)计算。两组间数据的比较采用Unpaired Student’s t-test,多组间的数据比较采用One-way ANOVA。P>0.05表示差异不具有统计学意义,P<0.05表示差异显著,P<0.01表示差异非常显著,P<0.001表示差异极其显著。
3. 结果
3.1 CAS含量测定
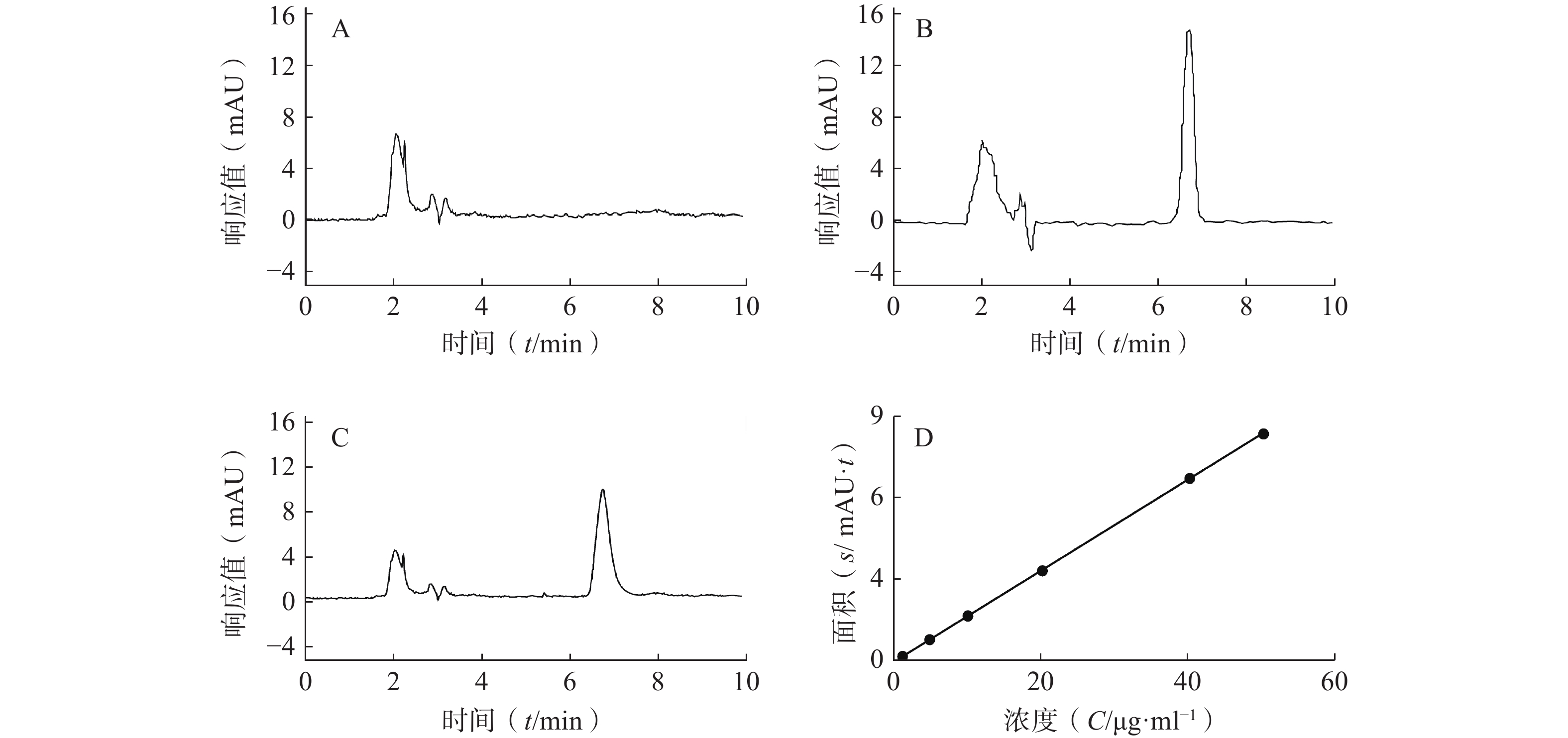
专属性:液相色谱图见图1,CAS出峰位置处无SLNs色谱法干扰,建立方法专属性良好。CAS保留时间为6.8 min,载体对CAS-SLNs测定无干扰。
线性和范围:如图1所示,方法专属性良好,以CAS浓度(C, μg/ml)为横坐标,所测得峰面积(Area)为纵坐标绘制标准曲线,回归方程为A=0.168 7C−
0.038 1 ,R2=0.999 9 ,表明CAS在1~50 μg/ml内线性关系良好。精密度:由表1可知,低、中、高浓度CAS日内精密度和日间精密度RSD值均小于5%,表明所建立方法的精密度满足要求。
表 1 CAS的HPLC方法精密度(Mean±SD, n=3)加样量(μg/ml) 日内精密度 日间精密度 测得量(μg/ml) RSD(%) 测得量(μg/ml) RSD(%) 5 4.79±0.05 1.07 4.79±0.04 0.90 20 19.64±0.17 0.87 19.90±0.26 1.32 40 38.48±0.21 0.55 38.17±0.57 1.49 稳定性:同一样品在12 h以内的RSD为1.88%,表明含量测定供试品溶液的稳定性满足要求。
回收率:由表2可知,样品在低、中、高3个浓度的回收率在95%~115%范围内,且RSD值均小于5%,表明该方法稳定可靠,可用于样品中CAS含量的测定。
表 2 CAS的HPLC方法提取回收率(Mean±SD, n=3)加样量(μg/ml) 测得量(μg/ml) 平均回收率(%) RSD(%) 5 5.29±0.12 105.78±2.41 2.28 20 20.95±0.48 104.76±2.40 2.29 40 43.39±0.59 108.48±1.47 1.35 3.2 CAS-SLNs的表征及包封率
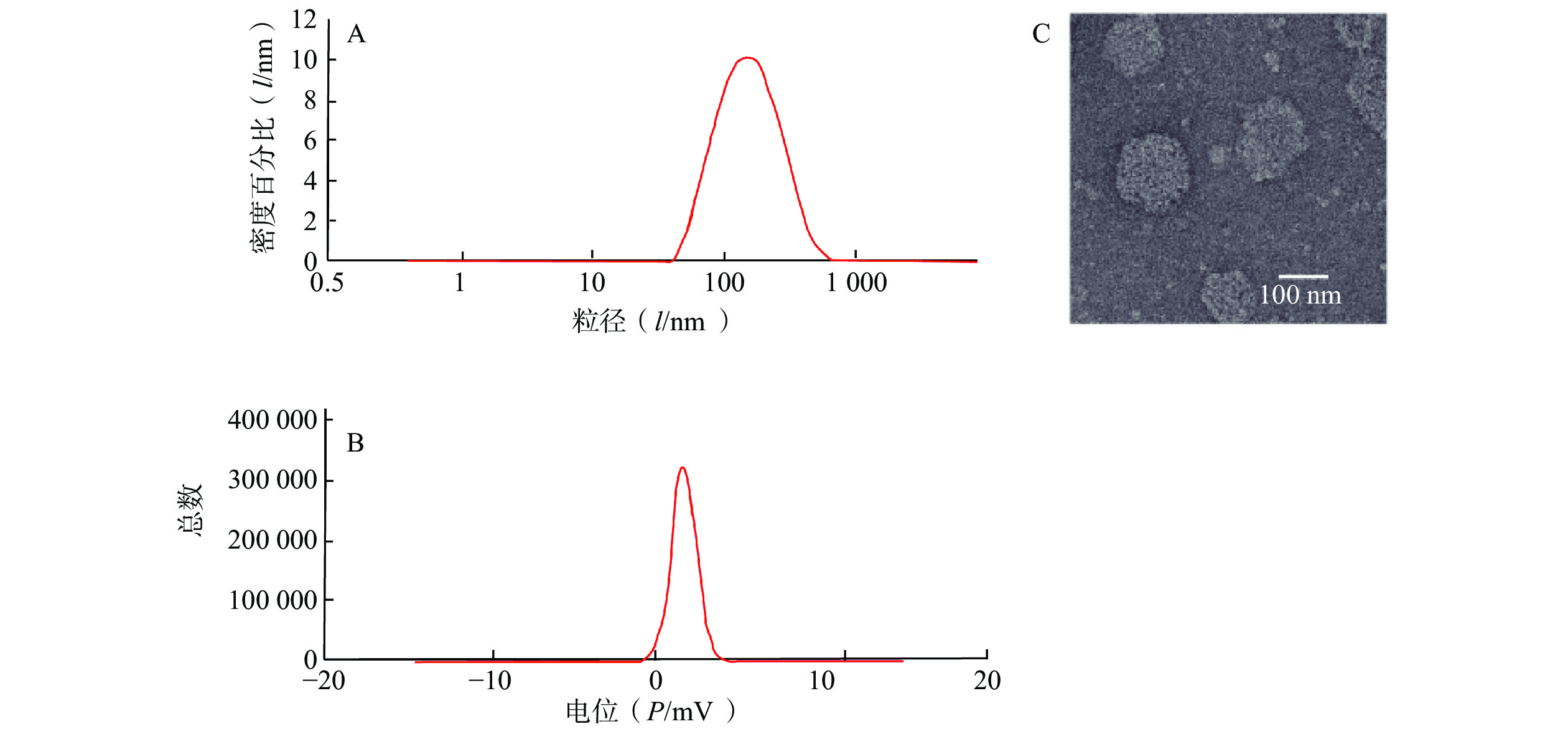
制备CAS-SLNs并对其进行表征。CAS-SLNs的粒径、Zeta电位分别为(135.97±1.73)nm,(19.33±0.37)mV。如图2所示,透射电镜照片显示CAS-SLNs为类圆形粒子,粒径约为120 nm。纳米粒包封率为(67.71±1.74)%,载药量为(7.55±0.68)%。
3.3 CAS-SLNs的体外抑菌效果
3.3.1 CAS-SLNs的最低抑菌浓度(MIC)
前期本课题组研究表明,GMS可以协同CAS抑制白色念珠菌的生长,因此我们比较了CAS-SLNs与CAS单用以及CAS+GMS合用的体外抗真菌活性。
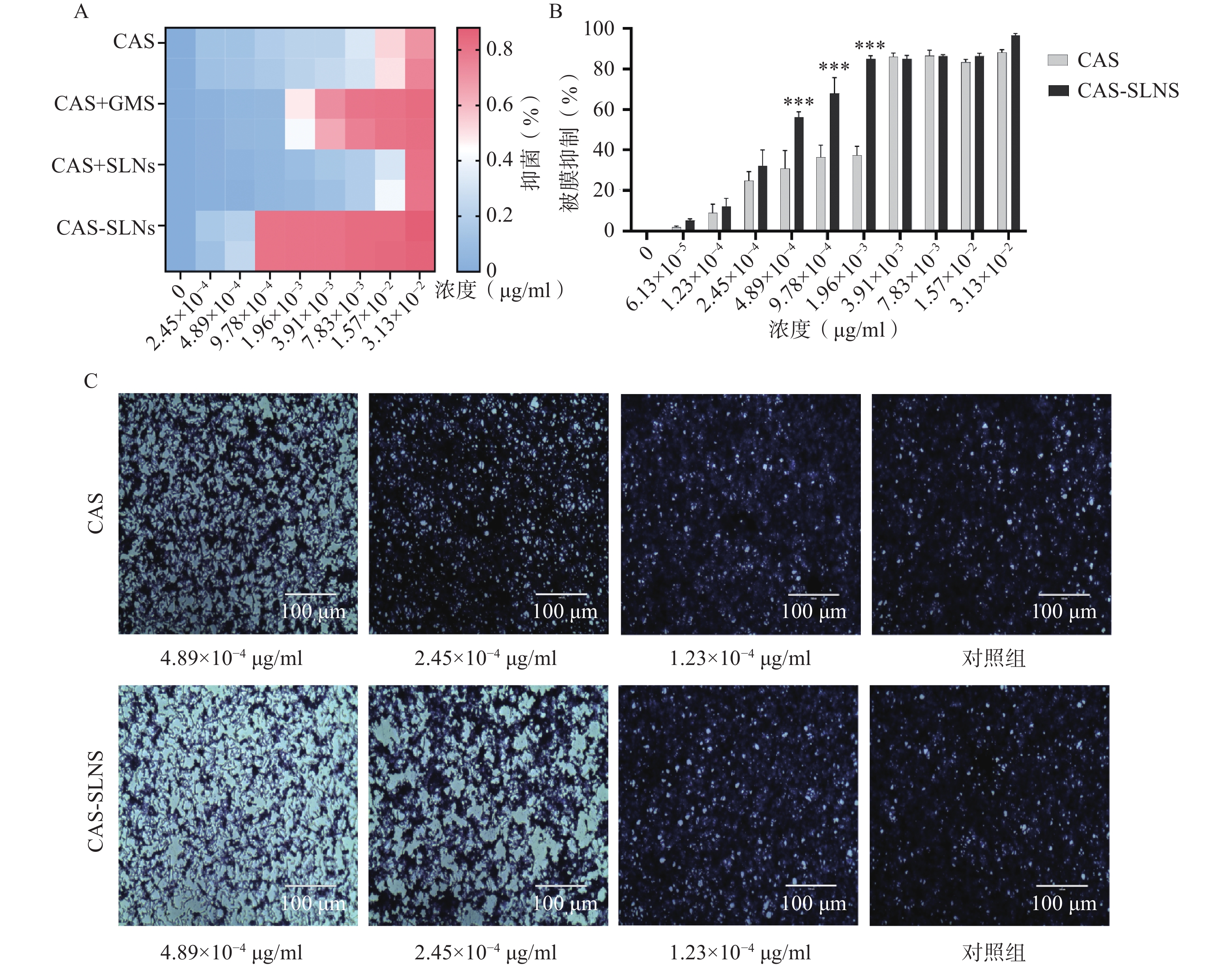
结果如表3所示,与1 μg/ml的GMS合用后,CAS的MIC从3.13×10−2 μg/ml降低到7.83×10−3 μg/ml,白色念珠菌对CAS的敏感性增加了4倍,表明CAS可以协同GMS抑制念珠菌的生长;而本课题制备的CAS-SLNs MIC为9.78×10−4 μg/ml,这与单用CAS的MIC 3.13×10−2 μg/ml相比,活性增强了32倍,这表明CAS-SLNs可以进一步发挥CAS与GMS的协同作用抑制念珠菌的生长,其抑菌活性性优于CAS和GMS物理混合组。
表 3 微量稀释法检测CAS、CAS+GMS、CAS+SLNs、CAS-SLNs抑制白色念珠菌生长的MIC ( μg/ml)菌株名称 CAS CAS+GMS CAS+SLNs CAS-SLNs C. albicans SC5314 3.13×10−2 7.83×10−3 3.13×10−2 9.78×10−4 3.3.2 CAS-SLNs生物被膜活性测定
菌丝态与酵母态混合形成的被膜是白色念珠菌耐药的重要因素,卡泊芬净单用可以显著抑制白色念珠菌被膜的形成,为了探究CAS-SLNs的优效性,采用结晶紫染色法定量检测了各组药物处理后白色念珠菌生物被膜的形成情况。结果如图3显示,CAS组在1.96×10−3、9.78×10−4、4.89×10−4 mg/ml浓度下的被膜形成抑制率分别为(37.30±4.40)%、(36.50±5.78)%、(30.70±8.96)%,CAS-SLNs组在同等的1.96×10−3、9.78×10−4 、4.89×10−4 mg/ml浓度下,被膜形成的抑制率分别为(85.03±1.59)%、(68.05±7.72)%、(56.12±2.83)%。由此可见CAS-SLNs对生物被膜形成的抑制作用与单用CAS相比显著增强。
3.4 CAS-SLNs的体内抑菌效果
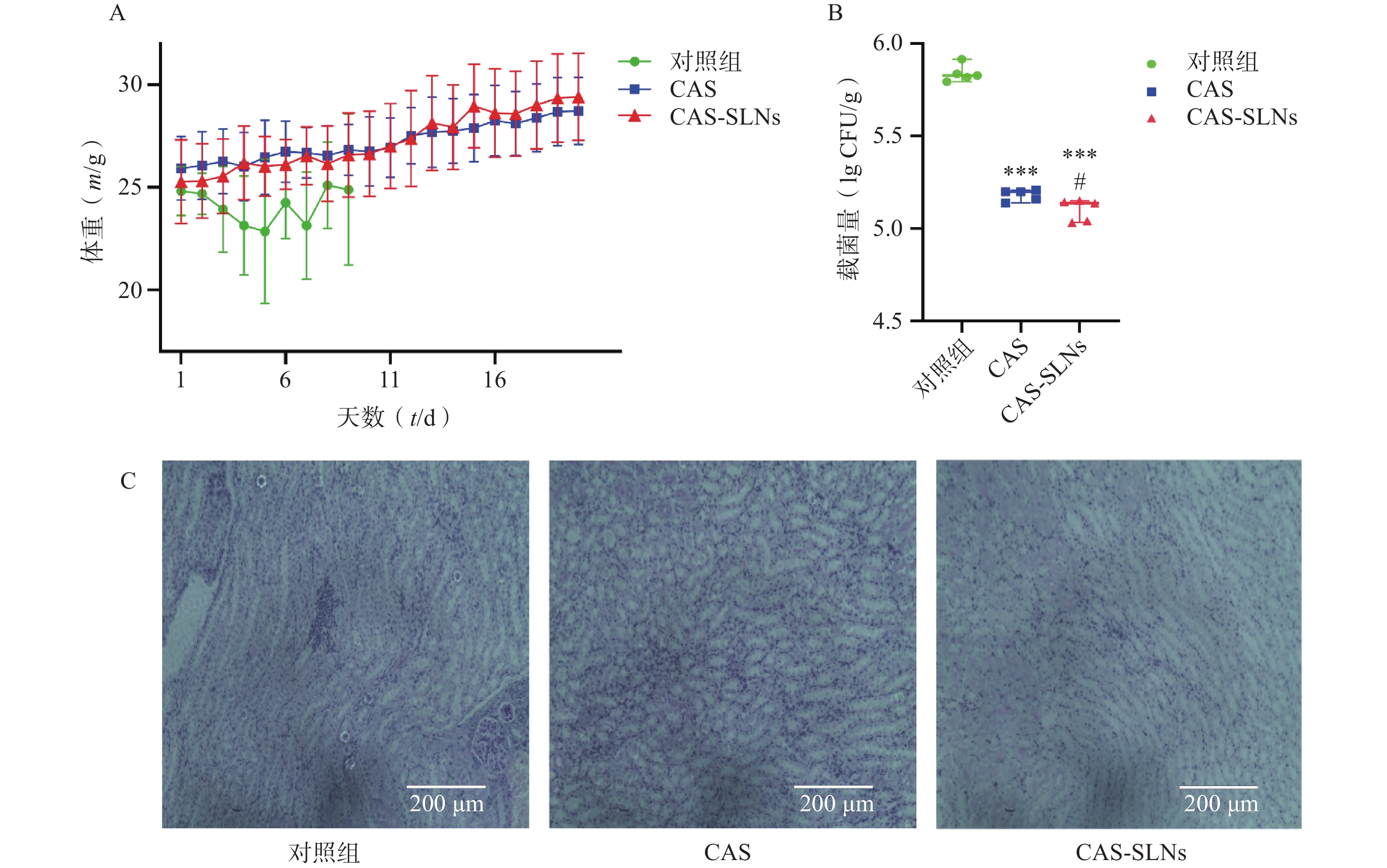
在小鼠系统性白色念珠菌感染模型中,如图4A所示,白色念珠菌感染可以导致小鼠体重的下降,而药物治疗可以恢复小鼠的体重增长。结果显示,CAS组小鼠平均体重由25.93 g增长至28.73 g,增长10.8%;而CAS-SLNs组体重由25.29 g增长至29.43 g,体重增长16.36%;对照组(对照组第10天存活率为0)与CAS-SLNs有非常显著的差异(P<0.01),CAS-SLNs组体重恢复更加显著。此外,CAS-SLNs治疗也可以显著降低小鼠肾脏的载菌量。如图4B所示,对照组、CAS组、CAS-SLNs组的载菌量分别为(5.84±0.05)CFU/g、(5.18±0.03)CFU/g、(5.10±0.06)CFU/g,与对照组肾脏载菌量有极显著差异(P<0.001),CAS-SLNs组与CAS组也有显著性差异(P<0.05)。通过PAS染色,考察小鼠肾脏的白色念珠菌感染情况,如图4C所示,在SC5314感染小鼠48 h后,对照组肾部病理切片经过PAS染色出现大量白色念珠菌。在感染小鼠经过CAS治疗后,白色念珠菌的数量明显下降。而经过同等剂量的CAS-SLNs治疗的感染小鼠肾部组织切片很少发现白色念珠菌的存在。CAS-SLNs作为以GMS为主要材料的载体包载药物CAS,其抗菌效果优于单用CAS,可以在体内发挥CAS与GMS的协同作用,体内抗菌效果显著增强。
4. 讨论
侵袭性真菌感染每年导致超过150万人死亡[13]。由于抗真菌药物耐药性的不断增多,迫切需要新的策略来对抗危及生命的真菌疾病。白念珠菌是念珠菌病的主要病原体,针对念珠菌血症的初始抗真菌治疗,美国传染病学会(IDSA)指南推荐使用棘白菌素类药物[14]。然而,抗真菌药物可能在毒性、感染复发、高成本和出现抗真菌耐药性方面存在局限性,可以采用联合用药的方式克服上述问题[15]。研究结果显示,在替代疗法中同时使用尼可霉素Z和CAS或米卡芬净[16]、以及CAS和氟康唑或伏立康唑的联用可以更好的治疗念珠菌感染[17];此外,宿主防御肽模拟物brilacidin(BRI)也可以作为CAS的增效剂,增强CAS对烟曲霉、白念珠菌、耳念珠菌和固有抗性的新型隐球菌的抗菌活性[18]。我们在前期研究发现CAS与GMS具有较强的协同抗念珠菌活性[8],GMS作为一种惰性的药用辅料,之前已报道过其作为脂质基质制备SLNs发挥协同抗金葡萄球菌和大肠埃希菌的活性[19],但抗真菌活性未有报道。因此,本研究构建了以GMS为主要材料的固体脂质纳米粒作为纳米载体包载CAS。一方面,SLNs骨架材料GMS可以协同CAS发挥抗真菌增效作用,另一方面,本课题所制备的纳米粒为水分散系统,无须有机溶剂,符合临床使用的需要。本研究结果表明CAS-SLNs相对于CAS与GMS物理混合物,MIC从7.83×10−3 μg/ml降低到9.78×10−4 μg/ml,发挥了很好的增效作用,这可能与CAS-SLNs的粒径为纳米级,具有极大的比表面积,容易被真菌摄取有关。在局部微环境中,随着载体基质的降解,药物逐步释放,在局部形成了较长时间的协同抑菌环境,从而增加了药物的抑菌活性。在可能的机制方面,有研究显示,硬脂酸可以激活三酰基甘油合成代谢途径,影响真菌的脂质代谢[20]。而棘白菌素类药物作用于白念珠菌后,白念珠菌脂质代谢的相关基因会发生改变,提示脂质代谢可能在白念珠菌抵御CAS的杀伤过程中十分重要[21]。因此,我们推测CAS-SLNs可能通过改变脂质代谢的途径,提高了CAS的敏感性,具体的信号通路和作用机制需要进一步的通过转录组学、代谢组学等方式深入研究。本研究为后续卡泊芬净的剂型改造提供了新的思路,有望为解决临床卡泊芬净药物治疗成本高的问题提供新的研究方向。
-
表 1 干细胞样基因引物序列
基因 引物序列 c-myc 5′CTTCTCTCCGTCCTCGGATTCT
3′GAAGGTGATCCAGACTCTGACCTTKlf-4 5′GCAAGTCCCCTCTCTCCATTA
3′GTAAGGTTTCTCGCCTGTGTGOct-4 5′GGAGATATGCAAAGCAGAAACC
3′CTCAAAATCCTCTCGTTGTGCSox-2 5′CGGCAACCAGAAAAACAGC
3′TCTCCGTCTCCGACAAAAGT表 2 BM-MSCs细胞表面抗原分析
表面抗原 CD73 CD44 CD90 CD105 CD34 HLA-DR 表达率(%) 98.00 100 99.80 100 0.30 0.20 表 3 不同培养体系加入阻断剂前后克隆形成能力
组别 单克隆直径
(cm)克隆形成数 克隆形成率
(/2000)SP 0.28±0.16 1722±127 86%±6% SP+ND-MSCs 0.33±0.14 1858±89 93%±4% SP+MM-MSCs 0.38±0.21 1900±85 95%±4% SP+ND-MSCs+GA 0.25±0.22 1532±112 77%±6% SP+MM-MSCs+GA 0.31±0.17 1755±76 88%±4% -
[1] BONACQUISTI E E, NGUYEN J. Connexin 43 (Cx43) in cancer: Implications for therapeutic approaches via gap junctions[J]. Cancer Lett,2019,442:439-444. doi: 10.1016/j.canlet.2018.10.043 [2] ZHANG X H, SUN Y, WANG Z Y, et al. Up-regulation of connexin-43 expression in bone marrow mesenchymal stem cells plays a crucial role in adhesion and migration of multiple myeloma cells[J]. Leuk Lymphoma,2015,56(1):211-218. doi: 10.3109/10428194.2014.913289 [3] ZHANG Y M, WANG Z Y, ZHANG L Y, et al. Impact of connexin 43 coupling on survival and migration of multiple myeloma cells[J]. Arch Med Sci,2017,13(6):1335-1346. [4] JAKUBIKOVA J, CHOLUJOVA D, HIDESHIMA T, et al. A novel 3D mesenchymal stem cell model of the multiple myeloma bone marrow niche: biologic and clinical applications[J]. Oncotarget,2016,7(47):77326-77341. doi: 10.18632/oncotarget.12643 [5] GAO M J, KONG Y Y, YANG G, et al. Multiple myeloma cancer stem cells[J]. Oncotarget,2016,7(23):35466-35477. doi: 10.18632/oncotarget.8154 [6] BEHRENS J, KAMERITSCH P, WALLNER S, et al. The carboxyl tail of Cx43 augments p38 mediated cell migration in a gap junction-independent manner[J]. Eur J Cell Biol,2010,89(11):828-838. doi: 10.1016/j.ejcb.2010.06.003 [7] BELLONI D, HELTAI S, PONZONI M, et al. Modeling multiple myeloma-bone marrow interactions and response to drugs in a 3D surrogate microenvironment[J]. Haematologica,2018,103(4):707-716. doi: 10.3324/haematol.2017.167486 [8] XU S, DE VEIRMAN K, DE BECKER A, et al. Mesenchymal stem cells in multiple myeloma: a therapeutical tool or target? Leukemia,2018,32(7):1500-1514. doi: 10.1038/s41375-018-0061-9 [9] ISSA M E, CRETTON S, CUENDET M. Targeting multiple myeloma cancer stem cells with natural products - lessons from other hematological malignancies[J]. Planta Med,2017,83(9):752-760. doi: 10.1055/s-0043-109558 [10] WANG Z Y, YUAN Y Q, ZHANG L Y, et al. Impact of cell fusion in myeloma marrow microenvironment on tumor progression[J]. Oncotarget,2018,9(57):30997-31006. doi: 10.18632/oncotarget.25742 -





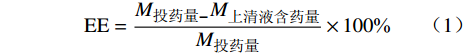

 下载:
下载:
 下载:
下载: