-
脑血管疾病是仅次于心脑血管疾病和癌症的第三大病症,其中脑缺血是常见的脑血管疾病之一。脑缺血的患病率和死亡率仍处于上升趋势,严重影响人们的健康。目前,西医对于脑缺血的主要治疗方式是溶栓和取栓,但有严格的溶栓时间窗和较大的取栓风险,并且缺血后造成神经功能的损伤没有有效的药物治疗[1]。中医药在脑缺血的预防和治疗中具有潜在作用,以气虚为本、血瘀为标作为主要病因[2]。查阅近几年文献发现,益气活血化瘀方药在防治脑缺血中表现出多方面和整体调节的优势。
参麻颈复方是临床名老中医经验方,临床应用发现具有活血通络,益气养血,宁神安脑,健筋壮骨之效。该方由首乌藤、丹参、山茱萸(制)、天麻、当归、川芎等组成,临床应用广泛。首乌藤有养血安神、祛风通络之效[3],丹参有活血调经、祛瘀止痛、凉血消痈、除烦安神之效[4],当归有补血调经、活血散寒、消肿止痛生肌、润肠通便之效[5],川芎、陈皮的补气之效辅佐以上药物活血功效运行,而且川芎具有活血化瘀之效,是传统中医防治中风选择最多的配方之一[6]。本研究评估参麻颈复方对小鼠脑缺血损伤的改善作用,并进一步探讨其对骨髓来源内皮祖细胞干预发挥防治脑缺血损伤的机制,为中药方剂治疗脑缺血提供新的思路、寻找新的靶点。
-
细胞培养箱(Thermo公司);倒置荧光显微镜(Leica 公司);Odssey红外荧光显像(Li-Cor公司);酶标仪(芬兰 Labsystens Dragon 公司);涡旋混合器(江苏天翎仪器有限公司);超净台(苏州净化设备有限公司);电子天平JA2003(上海天平仪器厂)。 参麻颈复方颗粒(岳阳医院自制制剂,批准文号:沪药制字Z05050324);尼莫地平片(天津市中央药业有限公司);BCA蛋白定量试剂盒(Thermo公司);2,3,5-氯化三苯基四氮唑(TTC,北京西浓科技有限公司);VEGF抗体(abcam公司);BDNF抗体(abcam公司);GAPDH内参抗体(abcam公司);Tubulin内参抗体(abcam公司);内皮细胞培养基(EGM-2 Single Quots,Lonza公司);波连蛋白(vitronection,BD公司)。
-
实验动物为SPF级C57BL/6雄性小鼠30只(上海吉辉实验动物饲养有限公司,许可证:SCXK(沪)2017-0012),体重为18-20 g,6-7周龄。适应性饲养1周后,将30只小鼠随机分为模型对照组(Control组)、参麻颈组(SMJ组)、尼莫地平组(NMDP组),10只/组。实验过程中对于实验小鼠的所有处理均符合伦理学规定。
-
采用电凝法制备局灶性脑缺血模型[7],用浓度为12%的水合氯醛对小鼠进行腹腔注射,剂量控制在350 mg/kg。小鼠麻醉后,仰卧位固定在手术台。借助显微镜,用显微镊沿颞肌纤维束的方向钝性分离肌肉,直到颧骨及麟骨暴露,显微镊夹住颧骨固定小鼠头部,用牙科钻重点打磨颧骨和麟骨的交叉部位,骨壳变薄并有裂缝时,停止打磨,用撬棒沿已暴露的动脉血管剥离骨片,直至小鼠左侧大脑中动脉与伴行的迷走神经分叉暴露;在显微镜下,找准纹状体外侧动脉近心端,用双极电凝器凝断左侧大脑中动脉后,将电凝器缓慢移出,显微镜下再次确认是否凝断。最后用显微镊将皮肤和肌肉归置原位,以便于缝合。小鼠完全苏醒后,观察精神状态,若出现站立不稳、左侧肢体偏瘫、提尾向一侧转圈等神经功能损害症状,即为造模成功。
参麻颈组在手术前通过灌胃方式给予6.88 g∙kg−1的参麻颈复颗粒;尼莫地平组给予2.16 mg/kg溶液灌胃;模型对照组给予等量蒸馏水灌胃,每日1次,共14 d。
-
术后第3 d,由观察者在不知分组情况下记录神经行为学表现,并采用参考文献[7]评分方法,如提尾悬空试验等[8],评估神经行为学功能评分。
提尾悬空试验:提起小鼠尾巴末端使其悬空,观察小鼠头部偏转。以小鼠身体的中线为基准,头部偏离中线超过10度记为成功的偏转,每只小鼠重复提尾悬空试验:提起小鼠尾巴末端使其悬空,观察小鼠头部偏转。以小鼠身体的中线为基准,头部偏离中线超过10度记为成功的偏转,每只小鼠测20次,并且每次测定的时间间隔不少于1 min,以保证小鼠得到充足的休息。小鼠的偏转率计算按以下公式:摆动频率(%)=(T−10)/10×100%。
T为实验小鼠头部向手术对侧偏转的次数。
平衡木试验:记录小鼠由木棍一端顺利通过平衡木80%长度所用的时间。在正式试验前对小鼠进行3次训练,正式试验时每只小鼠重复测定3次,对每只小鼠均间隔5 min后进行下一次实验。
-
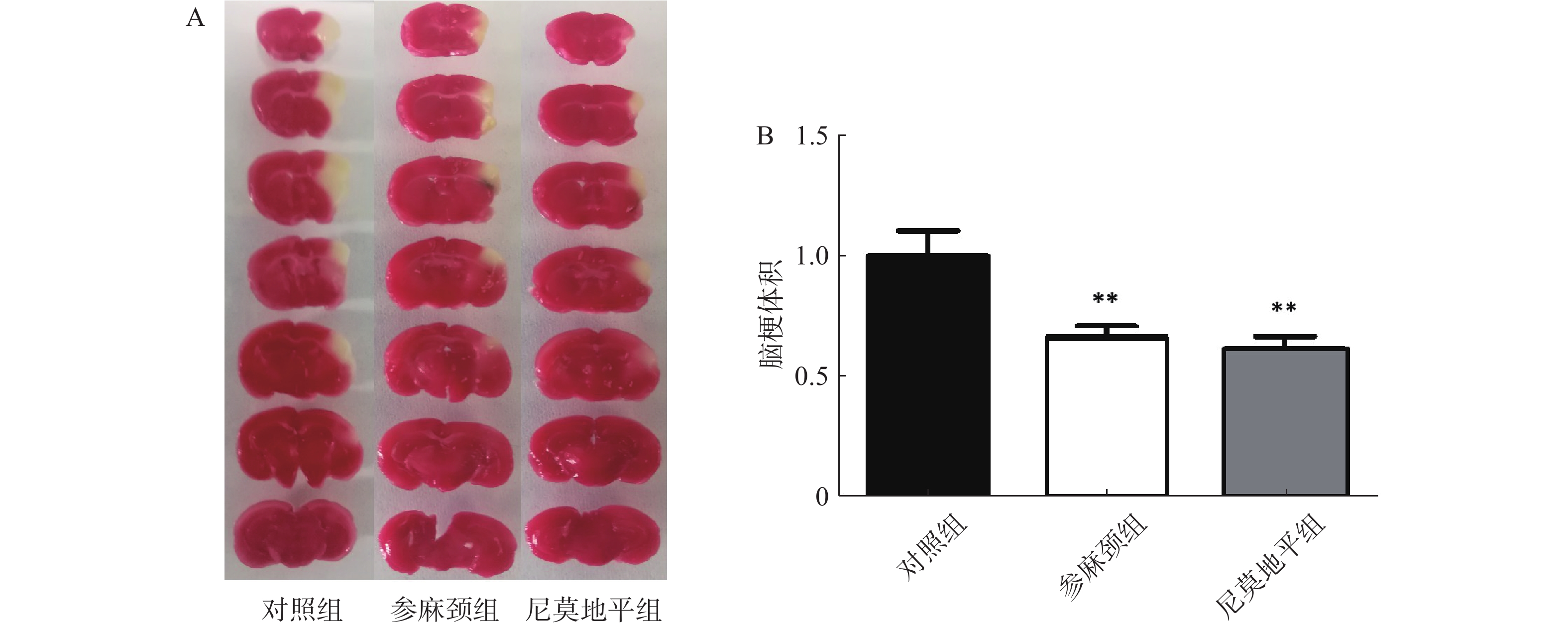
行为学评分测完后,小鼠脱颈处死,取脑组织,放1×PBS中清洗干净,将脑组织放在脑片模具中,共切7片,每片2 mm,放2%的TTC溶液中,并在37 ℃水浴锅中染色10 min,染色结束后放4%多聚甲醛固定6 h,按照脑片大小顺序排好拍照,脑片使用Image J统计软件测定小鼠的脑梗死体积。
-
取脑组织的同时,提取小鼠骨髓来源内皮祖细胞,培养至第7d时,收集和处理细胞,对细胞黏附、迁移及形成小管能力进行测定。
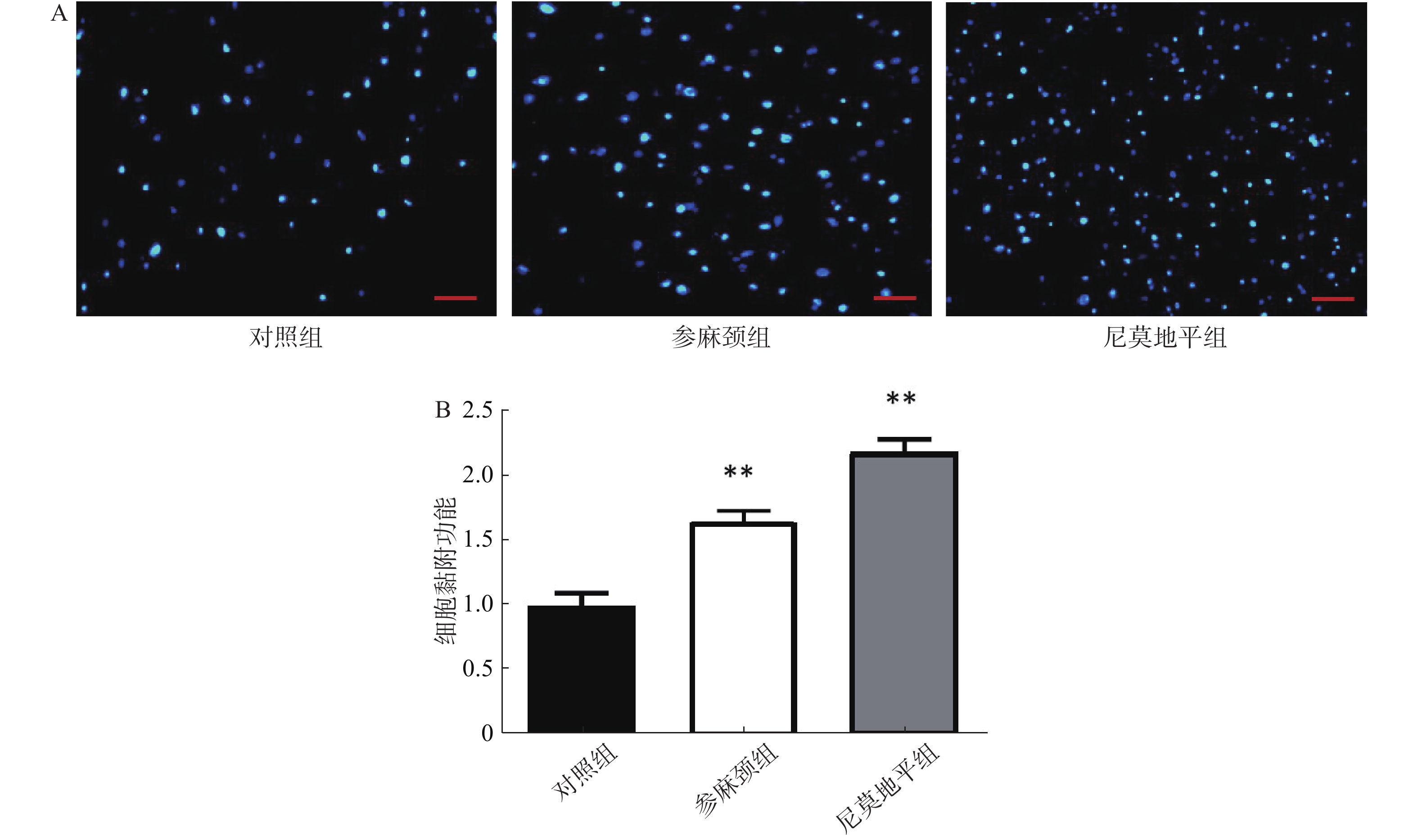
细胞黏附实验:用胰酶消化细胞,按照3×105个/ml细胞接种于预先包被人纤维粘连蛋白的96孔板中,在细胞培养箱中培养5 h后弃掉未黏附细胞,再用4%多聚甲醛固定,以Hochest 33258染料染色后于倒置显微镜下拍照。
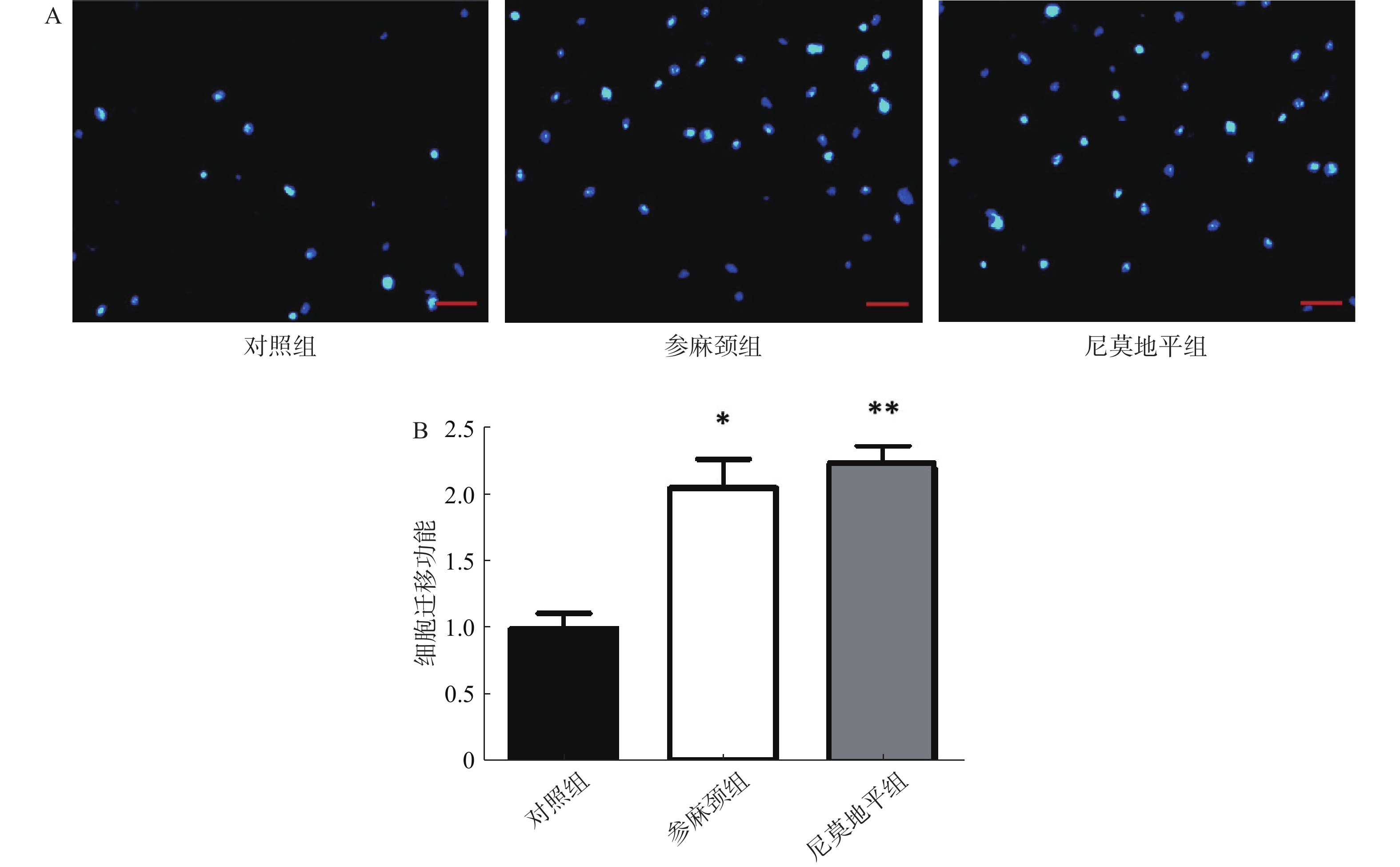
细胞迁移实验:调整细胞浓度3×105个/ml,Transwell小室置于24孔板,按分组下室加600 μl配好的下室溶液,细胞悬液接种于上室各100 μl,置培养箱内培养24 h,用PBS清洗2次,弃上清液,在2%多聚甲醛固定15 min。弃上清,PBS清洗2次,上室转移至含600 μl Hochest 33258染料的孔中,避光染色15 min。弃上清,PBS浸泡5 min,弃上清,光学显微镜下拍照,以Image J软件计算各组迁移细胞数。
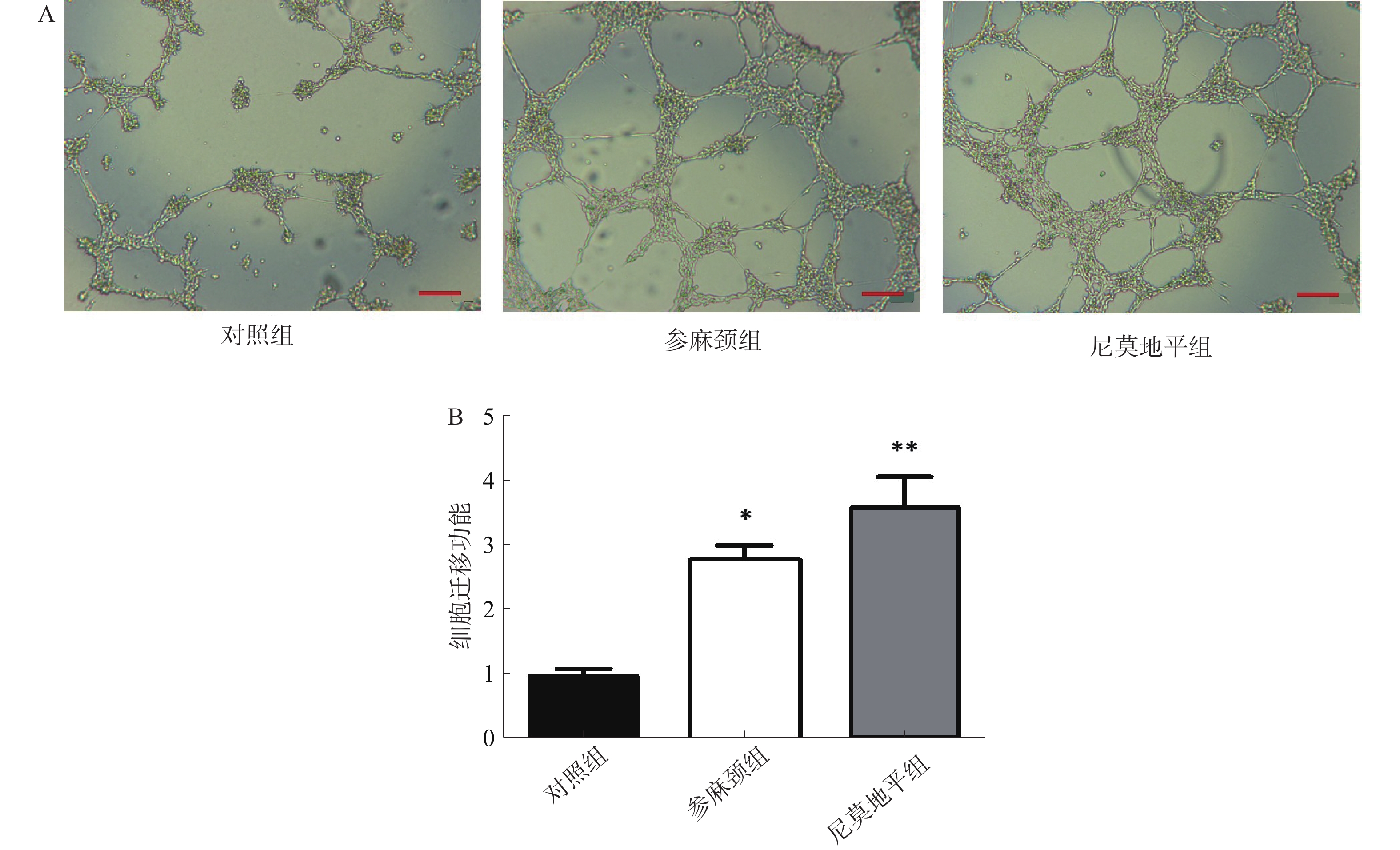
小管形成实验:调整各组细胞至3×105个/ml,每孔100 μl的细胞悬液加到铺有基质胶的孔中,最后将96孔板移至培养箱孵育6 h,在光学显微镜下拍照,以Image J软件计算各组小管形成数量。
-
细胞样本同“1.3.4”项中相同来源,六孔板放在冰枕上,用预冷PBS润洗细胞两次,弃上清液;向板内加入60 μl已配置好的细胞裂解液,在冰枕上裂解15 min,收集细胞液转移至1.5 ml EP管中,使用高速离心机在12 000 r/min,4 ℃离心15 min,将离心后的上清液收集到新的离心管中并放到−80 ℃冰箱保存。应用紫外分光光度计测量蛋白浓度后,进行蛋白定量,95 ℃ 5 min蛋白灭活后,−20 ℃保存待用。SDS-PAGE凝胶电泳:初始电压调为50 V,电泳至Marker中红色条带分离出,将电压调为 120 V,直至Marker显示跑到胶的底部时停止电泳。转膜:恒流200 mA转膜,不同目的蛋白按其分子量大小设置转膜时间。封闭:用5%脱脂牛奶封闭1 h。封闭之后用1%牛奶配置的一抗4 ℃孵育过夜。第2天,用1%牛奶配制的二抗室温孵育1 h,NC膜放到Odyssey扫膜仪上进行扫描,保存扫描照片,使用Quantity One软件统计蛋白的灰度值。
-
使用Graphpad prism 5.0分析数据。实验数据均以(
$ \bar x $ ±s)表示,两组之间的差异采用非配对T检验进行分析,多组数据间的差异采用单因素方差分析(ANOVA),P<0.05表示差异具有统计学意义。 -
小鼠造模成功后出现明显的神经功能障碍,表现为站立不稳、左前肢屈曲内收,肌张力下降。与对照组比较,尼莫地平组小鼠的神经功能有明显改(P<0.01);与对照组比较,参麻颈组小鼠的爬杆时间(P<0.05)和对侧偏转率(P<0.01)均有显著降低,表明小鼠给予参麻颈复方后,能有效保护缺血后神经功能的缺损(图1)。
-
用TTC染色后结果显示:对照组小鼠术后脑组织出现明显的梗死灶。与对照组比较,给参麻颈组小鼠脑缺血后脑梗体积显著减少(P<0.01);给予尼莫地平的小鼠与参麻颈组相比,其脑梗体积虽有减少,但无统计学差异(图2)。 -
细胞黏附实验结果显示:对照组相比于另外两组,黏附细胞数目减少。预先给予参麻颈的小鼠,在发生脑缺血后,小鼠骨髓来源内皮祖细胞黏附于96孔板中细胞数目,明显高于对照组(P<0.01);给予尼莫地平组,其细胞数目也比对照组增多(P<0.01);而尼莫地平组和参麻颈组两组的差异无统计学意义(图3)。 -
迁移实验结果显示:与参麻颈组和尼莫地平组比较,模型对照组细胞迁移至Transwell板上室下面的数目可见减少。与对照组比较,给予参麻颈复颗粒后的脑缺血小鼠,其骨髓来源内皮祖细胞迁移数显著增加(P<0.05);给予尼莫地平的小鼠与对照组比较,其迁移细胞数目增加(P<0.01);参麻颈组和尼莫地平组,两组结果有差异但无统计意义(图4)。 -
从图中可看出,对照组小鼠内皮祖细胞形成小管的数目减少。与对照组比较,参麻颈组内皮祖细胞形成小管数目有明显增加(P<0.05),尼莫地平组小管形成数目更为突出(P<0.01);尼莫地平组形成的小管状态也优于参麻颈组(图5)。
-
Western blot检测结果显示:与对照组比较,参麻颈组(P<0.01)和尼莫地平组(P<0.01)小鼠内皮祖细胞内BDNF蛋白表达增加,而参麻颈组和尼莫地平组之间结果差异无统计学意义(图6)。
-
缺血性中风是一种以动脉粥样硬化为基础的中枢系统不可逆损伤;它是由阻塞颈内动脉、椎动脉或者脑血管的血栓形成引起的,这一过程减少了血液供应,导致细胞代谢紊乱和衰老,并进一步导致血管内皮损伤[9-10]。脑缺血后导致严重的脑损伤,并造成神经功能障碍,包括偏瘫、肢体痉挛和认知障碍等,从而降低患者的生活质量[11]。目前,西医临床治疗存在局限性,使得该疾病的残疾率仍然很高,以及带来的社会经济负担也在继续增加。中医药博大精深,很多研究者一直都在致力于寻找改善脑缺血所致神经功能障碍的中医疗法。
中医典籍《伤寒杂病论》早就将活血化瘀中药或中药复方用于缺血性疾病的治疗。活血化瘀中药复方通过多靶点、多途径的作用方式发挥整体性作用。现代研究方法——代谢组学、基因组学、蛋白质组学等为中药复方作用机制的阐述提供强有力的支持。前期相关研究显示,在传统中药中,发现许多成分可以促进血管的生成,如丹参酮,川芎嗪,三七总皂苷等[12-14],这些是方剂中常用的中药,也是活血化瘀类草药的代表。而参麻颈复方中,大部分的中药具有活血化瘀作用,是否能够改善骨髓来源内皮祖细胞功能,又能否促进脑缺血损伤后的新血管的生成,需要进一步验证。
本研究中,参麻颈复方颗粒预处理后,小鼠脑缺血所致的神经行为学功能评分显著改善;TTC染色梗死体积也显著减少(P<0.01)。证明参麻颈复方颗粒对小鼠脑缺血损伤具有保护作用,可改善神经功能和减小缺血梗死体积。
越来越多的临床前研究表明[15],无论是缺血性脑卒中急性期还是慢性期,均会导致炎症和脑组织不可逆转的损伤。因此,为了减轻缺血组织的病理损伤,修复内皮功能障碍引起的血管损伤成为缺血性脑卒中治疗的主要方向。骨髓来源内皮祖细胞是内皮愈合和血管生成的关键效应因子。内皮祖细数量减少、内皮功能障碍与心血管事件风险增加息息相关[16],这与内皮祖细胞介导的血管修复受损致使血管疾病进展是一致的[17]。为了响应缺血信号和血管损伤,骨髓来源的内皮祖细胞被动员到循环中并募集到内皮损伤部位,从而形成新生血管,这也是一种自然的防御机制[18]。
第二部分实验研究了参麻颈复方颗粒对脑缺血损伤小鼠内皮祖细胞的保护作用。结果显示,小鼠脑缺血损伤后,来自骨髓的内皮祖细胞黏附在96孔板和迁移至Transwell板下室的数目有显著减少,给予参麻颈复方颗粒预处理后,黏附细胞数目(P<0.01)和迁移细胞数目(P<0.05)均有明显增加。另外,脑缺血损伤可影响血管新生的速度和质量,表现为内皮祖细胞形成小管的能力,包括形成小管的数量和小管长度。本研究的结果中,参麻颈复方颗粒显著增加脑缺血损伤小鼠的内皮祖细胞形成小管的数量和长度(P<0.05)。
神经营养因子是一组对神经系统的发育、生长、存活和分化至关重要的蛋白质[19]。脑源性神经营养因子(BDNF)是神经系统中含量最丰富、分布最广的神经营养因子。血管内皮细胞合成并分泌BDNF,并通过刺激其原肌球蛋白受体激酶B促进神经系统中的细胞分化、细胞生长、突触形成和神经发生[20-21]。重要的是,BDNF在缺血性和创伤性脑损伤后表现出许多神经保护特性[22]。BDNF通过促进新生血管、调节内皮一氧化氮生成和抑制凋亡来改善内皮细胞功能障碍[23]。
第三部分实验深入探讨了参麻颈复方颗粒保护小鼠脑缺血损伤的作用,结果显示,小鼠脑缺血后,大脑受到损伤,内皮祖细胞中BDNF蛋白表达显著降低,内皮祖细胞功能受损;参麻颈复方颗粒干预后,BDNF蛋白表达水平显著增加(P<0.01),细胞功能得以改善。这与二甲双胍上调人脐静脉内皮细胞(HUVEC)中BDNF的表达逆转高糖状态下的细胞损伤相同[23]。由于BDNF蛋白表达的增加,脑缺血小鼠的神经功能得到改善,脑梗死体积减小。
综上所述,参麻颈复方颗粒对小鼠脑缺血损伤有保护作用,这一作用可能与促进内皮祖细胞中脑源性神经因子BDNF蛋白表达,改善内皮祖细胞功能有关。我们这一研究为参麻颈复方颗粒在心血管疾病的治疗提供了新视角,并进一步验证了在心脑血管疾病治疗领域的应用,这可能减缓疾病的进展和改善预后。
Protective effect of Shenmajing formula on ischemic brain injury in mice
-
摘要:
目的 观察参麻颈复方颗粒对脑缺血损伤小鼠脑组织的保护作用,并探讨其可能机制。 方法 将SPF级C57 BL/6雄性小鼠30只随机分为模型对照组、参麻颈组、尼莫地平组,采用电凝法制备小鼠脑缺血损伤动物模型,给参麻颈组、尼莫地平组小鼠灌胃14 d,应用TTC染色法检测各组小鼠脑梗死体积,提取骨髓内皮祖细胞并测定细胞功能,用蛋白免疫印迹法(Western blot)检测内皮祖细胞中蛋白表达水平。 结果 与模型对照组比较,参麻颈组小鼠脑梗死体积明显减少,其内皮祖细胞迁移、黏附以及形成小管的能力显著改善,内皮祖细胞中BDNF蛋白表达水平明显升高。 结论 参麻颈复方颗粒对脑缺血损伤小鼠脑组织具有保护作用,可能与调节内皮祖细胞中BDNF的表达,改善骨髓来源内皮祖细胞功能密切相关。 Abstract:Objective To observe the protective effect of Shenmajing formula on brain tissue of mice with cerebral ischemic injury and explore the possible mechanism. Methods Thirty SPF-grade C57 BL/6 male mice were randomly divided into model control group, Shenmajing group and nimodipine group, and the animal models of cerebral ischemic injury in mice were prepared by electrocoagulation. The protein expression level in endothelial progenitor cells were detected by Western blot. Results Compared with the model control group, the infarct volume of mice in the Shenmajing group was significantly reduced, and the migration, adhesion and tubule formation ability of endothelial progenitor cells were significantly improved, and the expression level of BDNF protein in endothelial progenitor cells was significantly increased. Conclusion The protective effect of Shenmajing granules on brain tissue of mice with cerebral ischemic injury could be closely related to the regulation of BDNF expression in endothelial progenitor cells and improvement of endothelial progenitor cell function of bone marrow origin. -
阿尔茨海默症(Alzheimer's disease,AD)是常见的神经系统变性疾病之一,是一种持续性神经功能障碍,也是痴呆最常见的病因,其发生可导致进行性记忆减退、认知障碍、人格改变等症状。65岁以上患病率约5%,85岁以上患病率高于20%,是老年人死亡的主要原因之一[1-3]。AD的病理特征主要是老年斑(senile plaques,SP)、神经纤维缠结(neurofibrillary tangles,NFTs)和广泛神经元缺失。tau蛋白是一种微管相关蛋白,过度磷酸化tau蛋白是造成神经纤维缠结的主要原因,且AD患者病情严重程度与tau蛋白具有明显相关性。因此,tau蛋白显像剂的研究逐渐受到关注[4-5]。
近年来,研究者们研发了多种tau蛋白的PET显像剂,如“THK系列”(包括18F-THK5105、18F-THK523、18F-THK5117、18F-THK5351)[6-8],“RO系列”(包括18F-RO6958548、11C-RO6931643、11C-RO6924963)[9-11],“T系列”(包括18F-T807、18F-T808)[12]以及11C-PBB3[13]等。其中“T系列”18F-T807和18F-T808是由Simens公司开发的tau蛋白的分子探针。
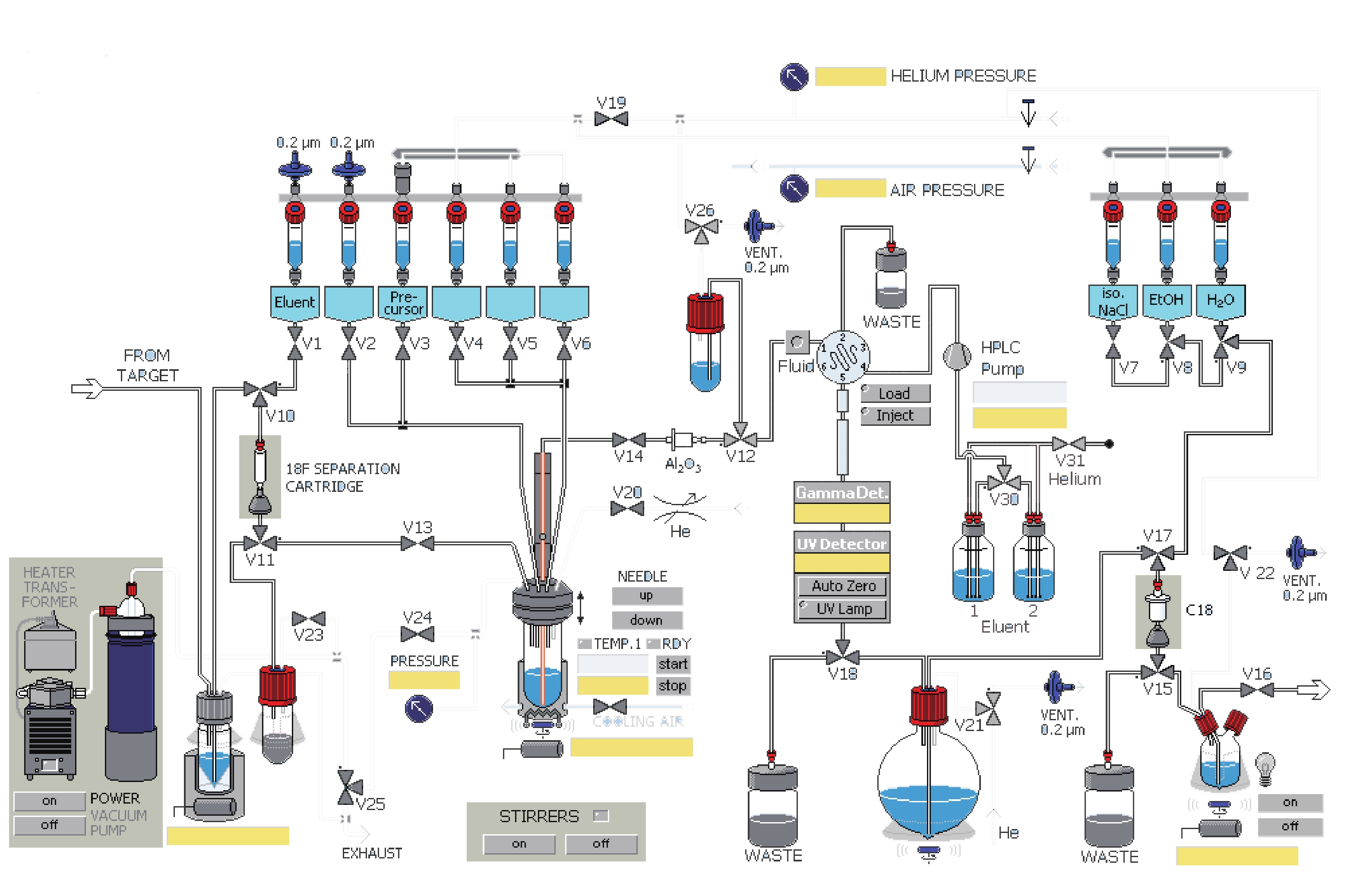
课题组在参考相关文献的基础上[14-15],使用GE公司的TRACERlab FXFN氟多功能合成模块(图1),以18F-T807前体(BOC保护)NPPI-95(1)为原料,使用改进一锅法自动合成了18F-T807(2),提高了产品产率,并开展初步的正常大鼠生物分布实验,探索其分布特征。
1. 材料与合成过程
1.1 原料、试剂与设备
18F-T807前体(BOC保护)NPPI-95(江苏华益公司);强阴离子交换固相萃取柱(QMA柱)、K222、碳酸钾水溶液、乙腈、(德国ABX公司);乙醇(国药化学试剂);盐酸(国药分析质检中心);DMSO(北京百灵威);Ultimate C18柱(美国Waters: 4.6 mm×250 mm,5 μm);富18O水(日本大阳日酸株式会社);0.22 μm MILLEX-GS液体滤膜、0.2 μm Millex-25空气滤膜(德国默克);0.7 mm×40 mm针头(西班牙BD Microlance);Wistar大鼠(北部战区总医院实验动物科)。溶剂乙醇为色谱纯,其余均为分析纯。
TRACERlab FXFN(美国GE)配备半制备VP 250×16高效液相色谱(德国MN)和紫外检测器及放射性检测器;正电子示踪剂质量控制薄层扫描仪(美国Bioscan),配塑料闪烁体晶体探测器;分析用HPLC(北京优联);GC-7900气相色谱(北京天美);CRC 25R活度计(美国Capintec),合成条件满足药品生产质量管理规范(GMP)的要求。
1.2 合成方法
表 1 TRACERlab FXFN合成器各溶剂瓶预装溶剂溶剂瓶 溶剂 1号瓶(V1) 1.5mg K2CO3溶于0.5 ml水 2号瓶(V2) 1.5 mg K222溶于1ml乙腈 3号瓶(V3) 1 mg前体溶于1.2 ml DMSO溶剂 5号瓶(V5) 1.5 ml HPLC流动相 6号瓶(V6) 1.5 ml HPLC流动相 圆底烧瓶 2 ml 84%NaHCO3水溶液和30 ml水 7号瓶(V7) 9 ml 0.9%生理盐水 8号瓶(V8) 1 ml 乙醇 9号瓶(V9) 10 ml 水 18F-T807自动化合成主要有以下几步:①18F-离子的柱分离纯化及蒸馏干燥。②T807前体的18F-离子亲核取代反应。③18F-T807的HPLC分离纯化。④18F-T807 C18柱溶剂转换与再纯化。
自动合成的具体步骤如下:
(1)共2.5 ml含18F-离子的18O水由MINItrace加速器经由18O(p, n)18F反应制备,轰击束流45μA,轰击时间40 min,18F-离子混合液由氦气作为载气经过TARGET管线传输到TRACERlab FXFN合成模块的锥形瓶内。
(2)V10、V11号阀门开启,18F-离子及18O水混合液中的18F-离子在真空泵抽取下被QMA柱(由1 ml乙醇,2 ml水活化)捕获滞留,18O水回收进入18O水回收瓶。
(3)V1、V13、V24号阀门开启,V1号瓶内的K2CO3溶液流经V1、V10、QMA柱、V11、V13,将18F-离子交换抽入反应瓶。
(4)关V1、V13号阀门,开启V2号阀门将V2号瓶内穴醚K222乙腈溶剂抽入反应管,18F-离子进入穴醚形成复合物。
(5)关V2号阀门,开启V20号阀门混合液在氦气吹拂下于85 ℃共沸蒸馏8 min,然后加热到110 ℃,在氦气吹拂下共沸蒸馏4 min除水。
(6)开启V3、V19号阀门,在氦气推动下V3号瓶内的前体流入反应管,V3、V19、V24号阀门关闭,反应管加热到140 ℃,反应10 min。
(7)反应瓶降温到50 ℃,开V24、V25号阀门恢复大气压。
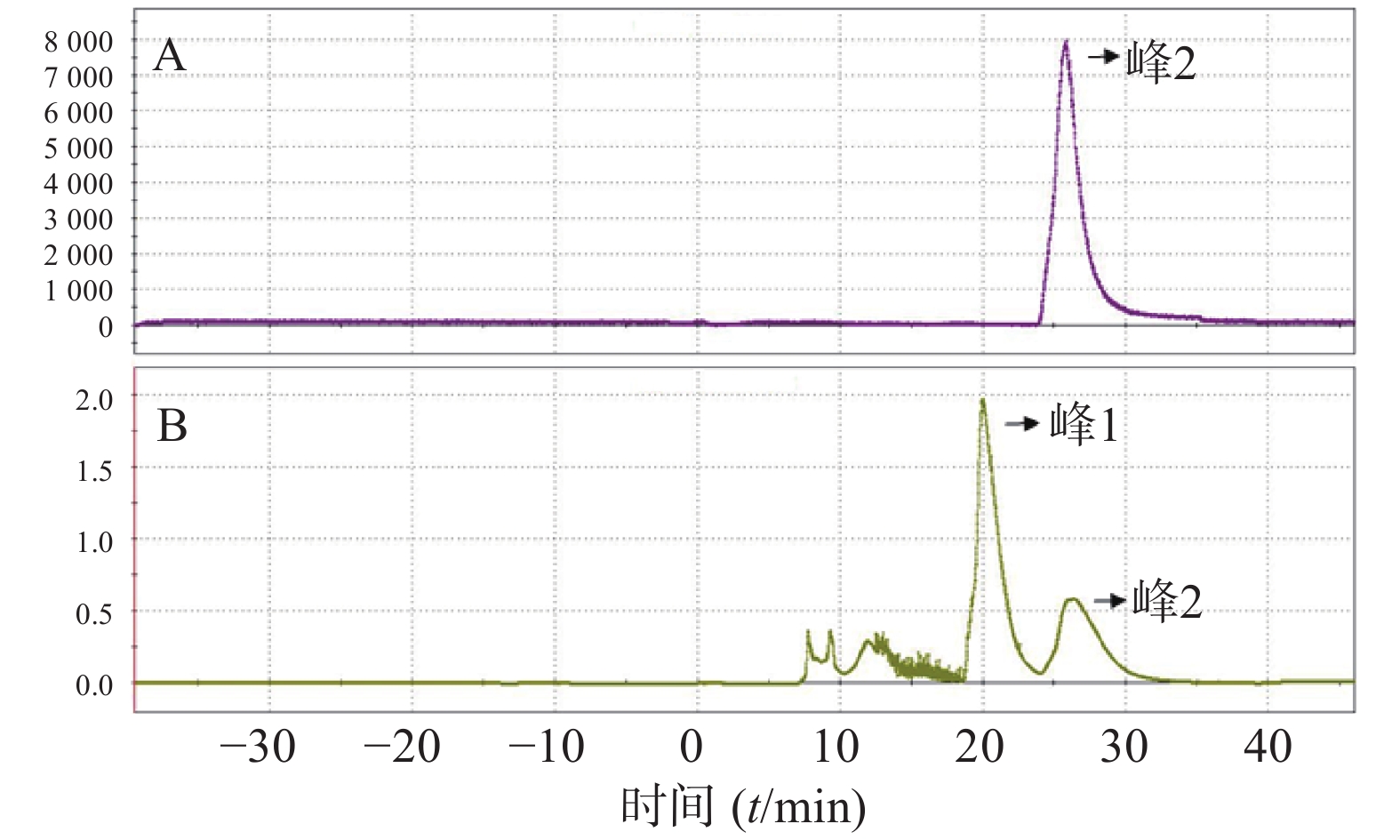
(8)反应后混合液经由V5、V6号瓶内的共3 ml HPLC流动相(25%乙醇水溶液,调整pH至2.0)冲洗到V26号阀门下的中转瓶内,然后打开V26、V12号阀门,在氦气压力下经由Fluid进入HPLC进样环,在Fluid控制下进样环旋转,产物进入HPLC半制备柱,Eluent1号瓶内流动相以5 ml/min的流速通过柱子分离。流动相以紫外(UV,λ=254 nm)和放射计数器监测。图3是18F-T807的HPLC及UV图。
(9)18F-T807溶液通过V18号阀门进入圆底瓶,圆底瓶内装有2 ml 84% NaHCO3水溶液和30 ml无菌注射用水。然后经V21、V15、V17号阀门,产物溶液通过V15、V17号阀门间的C18柱(以5 ml乙醇和10 ml水活化),产物会被捕获滞留在柱子上,然后打开V9阀门,用V9号瓶内10 ml水冲洗柱子到废液瓶(WASTE)内,然后C18柱经由V8号瓶内的1 ml乙醇冲洗进入V15阀门下的产品瓶,再经由V7号瓶内装有9 ml生理盐水再次冲洗。
(10)手动打开V22和V16号阀门,18F-T807在氦气压力下经过0.22μm液体滤膜过滤进入分装热室的收集瓶。
1.3 质量控制
对3批连续生产的产物进行了质量控制。质控项目包括澄明度、pH、核素半衰期、核素纯度、放化纯度、K222和残留溶剂、细菌内毒素、无菌测试,测试结果均符合标准要求。
1.4 正常大鼠生物分布实验
选择健康雄性Wistar大鼠30只,分为6组,每组5只,实验前6 h禁食禁水,每只通过尾静脉注入0.2 ml(约7.4 MBq)的18F-T807后,分别在5、15、30、60、90、120 min断头处死,取出脑、心、肝、肺、肾、肌肉、骨和血,去污、称重、计数,数据经衰减校正后计算放射性摄取率(每克组织的放射性摄取剂量占注射剂量的百分比)。
2. 结果与讨论
18F-T807有多种合成方法,本文在参考相关文献报道基础上,优化反应条件,改变前体用量为1 mg,同时使用HPLC分离条件为25%乙醇水溶液, pH调整至2.0,在线脱BOC保护。C18柱溶剂转换与再纯化,应用经改进的合成方法使合成产率由(20.5±6.1)%提高到(25.7±5.8)%,总反应时间为70 min。
连续3批产品,其质量控制结果如下:肉眼观察溶液无色透明,6 h后pH值为7,半衰期满足要求,不包含长半衰期核素(t1/2>5天),核素纯度大于99.5%,HPLC和TLC分析结果,即化学纯度和放化纯度合格,流动相是50%甲醇/水(HCl调节pH至2,),流速1.3 ml/min,紫外检测波长为254 nm,TLC条件为NH3H2O-甲醇-CH2Cl2 (1∶5∶94),气相色谱结果显示残留的丙酮、乙腈、DMSO等溶剂均在检测线下,细菌内毒素实验(鲎试剂法)合格,无菌检查合格。各项结果表明产品符合人体使用标准。
正常大鼠18F-T807在体内的生物分布如表2所示,可见大部分器官在给药5 min后摄取率最高,其中肾、肝、血的摄取率较高,超过5.56%ID/g(%ID/g为放射性摄取率,即各器官的每克放射性摄取值),在肌肉、骨骼摄取率相对较低,因此推断18F-T807主要是经过肝肾排出体外。18F-T807的脑、心、肺摄取率最低,120 min已降低至本底水平(1.08% ID/g),各器官的放射性摄取率随时间的推移逐渐降低,但清除较慢,在120 min 时大部分器官仍有较高的摄取率。
表 2 18F-T807在正常大鼠体内的分布($ \bar x \pm s $ ,n=5)器官 放射性摄取率(% ID/g) 5 min 15 min 30 min 60 min 90 min 120 min 脑 2.25±0.18 2.03±0.86 1.81±0.54 1.59±0.62 1.20±0.57 1.11±0.38 心 2.05±0.58 1.99±0.66 1.78±0.31 1.55±0.25 1.19±0.74 1.08±0.36 肝 5.79±2.58 5.95±1.17 5.48±0.66 5.29±0.71 4.83±0.84 4.27±0.86 肺 2.12±0.91 2.01±0.56 1.91±0.19 1.57±0.73 1.21±0.52 1.09±0.23 肾 7.36±4.01 5.11±1.21 3.89±1.99 3.63±1.82 3.17±1.68 2.99±0.98 肌肉 2.34±0.86 2.57±1.18 2.44±0.95 2.19±1.36 2.04±1.03 1.51±0.89 骨 2.58±0.91 2.67±0.75 2.02±0.68 1.99±0.82 1.52±0.46 1.27±0.55 血 5.56±0.35 5.41±0.56 4.73±0.74 4.57±1.31 4.22±0.37 4.01±0.45 3. 结论
在TRACERlab FXFN合成器上使用优化条件的一锅法自动合成了18F-T807,提高了产品产率。合成后进行的各种质量控制检测均显示产品符合质控标准。初步的正常大鼠生物分布实验,显示了其不同时间放射性摄取率的分布情况,为应用该产品开展人体显像提供了重要基础。
-
[1] HAYASHIDA K, TAKEGAWA R, SHOAIB M, et al. Mitochondrial transplantation therapy for ischemia reperfusion injury: a systematic review of animal and human studies[J]. J Transl Med, 2021, 19(1): 1-15. doi: 10.1186/s12967-020-02683-4 [2] REN D F, WANG T, SUN G F, et al. Effect of Yiqihuoxue Formula for the treatment of ischemic stroke: a retrospective study[J]. Medicine, 2020, 99(49): e23260. doi: 10.1097/MD.0000000000023260 [3] 陶丽宇, 高月求, 韦靖, 等. 首乌藤相关药理作用及临床运用的研究进展[J]. 时珍国医国药, 2018, 29(10): 2486-2488. [4] 侯娅慧, 俞春江, 郭士佳, 等. 丹参及其活性成分治疗急性脑梗死研究进展[J]. 心脑血管病防治, 2018, 18(4): 317-320. [5] 占心佾, 李钰婷. 香附、当归及白芍提取物方剂氧化损伤小鼠抗氧化功效研究[J]. 按摩与康复医学, 2019, 10(7): 47-49. [6] Kuang X, Wang LF, Yu L, et al. Ligustilide ameliorates neuroinflammation and brain injury in focal cerebral ischemia/reperfusion rats: involvement of inhibition of TLR4/peroxiredoxin 6 signaling[J]. Free Radic Biol Med, 2014, 71: 165-175. doi: 10.1016/j.freeradbiomed.2014.03.028 [7] Dong XH, Peng C, Zhang YY, et al. Chronic exposure to subtherapeutic antibiotics aggravates ischemic stroke outcome in mice[J]. EBioMedicine, 2017, 24: 116-126. doi: 10.1016/j.ebiom.2017.09.002 [8] DONG X H, PENG C, ZHANG Y Y, et al. Low-dose piperlongumine rescues impaired function of endothelial progenitor cells and reduces cerebral ischemic injury in high-fat diet-fed mice[J]. Front Pharmacol, 2021, 12: 689880. doi: 10.3389/fphar.2021.689880 [9] DIRNAGL U, IADECOLA C, MOSKOWITZ M A. Pathobiology of ischaemic stroke: an integrated view[J]. Trends Neurosci, 1999, 22(9): 391-397. doi: 10.1016/S0166-2236(99)01401-0 [10] Sato DMV, Mantovani LK, Safanelli J, et al. Ischemic stroke: process perspective, clinical and profile characteristics, and external factors[J]. J Biomed Inform, 2020, 111: 103582. doi: 10.1016/j.jbi.2020.103582 [11] SCHMIDT A, MINNERUP J. Promoting recovery from ischemic stroke[J]. Expert Rev Neurother, 2016, 16(2): 173-186. doi: 10.1586/14737175.2016.1134324 [12] LIU R Y, ZHENG Y, HAN T, et al. Angiogenic actions of paeoniflorin on endothelial progenitor cells and in ischemic stroke rat model[J]. Am J Chin Med, 2021, 49(4): 863-881. doi: 10.1142/S0192415X21500415 [13] JIANG Z Q, GAO W, HUANG L Q. Tanshinones, critical pharmacological components in Salvia miltiorrhiza[J]. Front Pharmacol, 2019, 10: 202. doi: 10.3389/fphar.2019.00202 [14] SHI J H, LI R Y, YANG S Y, et al. The protective effects and potential mechanisms of Ligusticum chuanxiong: focus on anti-inflammatory, antioxidant, and antiapoptotic activities[J]. Evid Based Complement Alternat Med, 2020, 2020: 8205983. [15] IADECOLA C, BUCKWALTER M S, ANRATHER J. Immune responses to stroke: mechanisms, modulation, and therapeutic potential[J]. J Clin Investig, 2020, 130(6): 2777-2788. doi: 10.1172/JCI135530 [16] Fan-Yen, Lee. Direct implantations of erythropoietin and autologous EPCs in critical limb ischemia (CLI) area restored CLI area blood flow and rescued remote AMI-induced LV dysfunction[J]. Biomed Pharmacother, 2019, 118: 109296. doi: 10.1016/j.biopha.2019.109296 [17] FANG J, GUO Y, TAN S, et al. Autologous endothelial progenitor cells transplantation for acute ischemic stroke: a 4-year follow-up study[J]. Stem Cells Transl Med, 2019, 8(1): 14-21. doi: 10.1002/sctm.18-0012 [18] Hu Z, Wang H, Fan G, et al. Danhong injection mobilizes endothelial progenitor cells to repair vascular endothelium injury via upregulating the expression of Akt, eNOS and MMP-9[J]. Phytomedicine, 2019, 61: 152850. doi: 10.1016/j.phymed.2019.152850 [19] MUHEREMU A, SHU L, LIANG J, et al. Sustained delivery of neurotrophic factors to treat spinal cord injury[J]. Transl Neurosci, 2021, 12(1): 494-511. doi: 10.1515/tnsci-2020-0200 [20] HAO Y, XIONG R, GONG X. Memantine, NMDA receptor antagonist, attenuates ox-LDL-induced inflammation and oxidative stress via activation of BDNF/TrkB signaling pathway in HUVECs[J]. Inflammation, 2021, 44(2): 659-670. doi: 10.1007/s10753-020-01365-z [21] XIONG L L, CHEN J, DU R L, et al. Brain-derived neurotrophic factor and its related enzymes and receptors play important roles after hypoxic-ischemic brain damage[J]. Neural Regen Res, 2021, 16(8): 1453-1459. doi: 10.4103/1673-5374.303033 [22] Li Z, Wang H, Xiao G, et al . Recovery of post-stroke cognitive and motor deficiencies by Shuxuening injection via regulating hippocampal BDNF-mediated Neurotrophin/Trk Signaling[J]. Biomed Pharmacother, 2021, 141: 111828. doi: 10.1016/j.biopha.2021.111828 [23] HAN X Q, WANG B L, SUN Y N, et al. Metformin modulates high glucose-incubated human umbilical vein endothelial cells proliferation and apoptosis through AMPK/CREB/BDNF pathway[J]. Front Pharmacol, 2018, 9: 1266. doi: 10.3389/fphar.2018.01266 -






 下载:
下载:


 下载:
下载: