-
心力衰竭(HF) 是由心脏结构和/或功能异常引起,并由客观证据证实肺部或全身充血的一种心功能障碍所致的临床综合征[1],表现为体液潴留、呼吸困难、乏力等。心衰影响全球超过约6,400万人,总体患病率约为1.5%至4%,具有发病率高、死亡率高、生活质量差、治疗费用高等特点[2]。慢性心衰主要表现为射血分数降低的心力衰竭(EF≤40%, heart failure with reduced ejection fraction, HFrEF)[3]。2022 年美国心脏协会颁发指南,确定了HFrEF治疗的一线四联药物:血管紧张素转换酶抑制剂或血管紧张素受体脑啡肽酶抑制剂、β受体阻滞剂、盐皮质激素受体拮抗剂、钠-葡萄糖协同转运蛋白2抑制剂[4]。虽然目前治疗心衰的药物有很大进展,但心衰患者生存率依然面临严峻挑战,5 年生存率仅50%左右,与肿瘤生存率相仿[5]。因此,市场呼唤全新靶点的全新药物。
急性期蛋白ORM是本课题组自主发现的一个治疗心衰的潜在药物靶点,能够有效的改善小鼠的心功能,ORM尾静脉给药后显著增加心衰小鼠的射血分数,已经申请了专利(ZL201810565267.3)。然而,由于ORM是血液制品,价格昂贵,需注射给药,存在其药物开发的困难。本课题组获得了一个全新小分子化合物 HMS-01,该小分子化合物靶向上调ORM表达,有望进一步开发为具有治疗心衰作用的新靶点药物。为进一步了解HMS-01的药动学特点,本课题组采用液相色谱-串联质谱 (LC-MS/MS) 技术[6-7],研究建立灵敏、特异的测定血浆等生物样品中HMS-01 浓度的分析方法,并开展 HMS-01 在小鼠体内的药动学研究,为后续药物研究提供理论依据。
-
Agilent 1 290 InfinityⅡ液相色谱仪(AgilentTechnologies,美国)、4 000 Q-Trap 型串联质谱仪(AB Sciex,美国);低温高速离心机(Thermo,德国);Mettler XP56 百万分之一电子天平(梅特勒-托利多,瑞士); Millipore-Q 超纯去离子水净化仪(Millipore,美国);小型摇床和涡旋混合仪(IKA,德国)。
-
HMS-01(上海青玄生物科技有限公司,纯度:98.8%,批号:200502);内标罗红霉素(上海百灵威科技有限公司,纯度:98%,批号:LOC0T99);乙腈、甲醇(Sigma-aldrich,HPLC纯试剂);甲酸(纯度:LC-MS级)和甲酸铵(Aldrich-Fluka,纯度:LC-MS级);特丁基甲醚(Aldrich-Fluka,纯度:≥99.8%)。其它有机试剂为中国医药(集团)上海化学试剂公司市售分析纯。
-
健康C57BL/6J小鼠,雄性和雌性各123只,体重18~22g,由北京华阜康生物科技股份有限公司提供,合格证号:SCXK(京)2019-0008。自由饮水。
-
设置口服(p.o.)给药3个单剂量组(30、60及150 mg/kg体重)和一个静脉(i.v.)给药(6 mg/kg体重)单剂量组。C57BL/6J小鼠246只,随机分组,每组动物数为6,雌雄各半。在动物房适应5 d后,开始动物试验。给药HMS-01前后,在异氟烷麻醉状态下眼窝静脉窦采血,每只小鼠每次采血量约50~75 μl左右(2~3小滴血),置0.2 ml肝素化离心管中。采血时间点安排为:0、0.083(仅静脉组)、0.25、0.5、1、2、4、6、8、10及24 h。
-
小鼠血浆样品(40 µl)加入804 µl特丁基甲醚(含91 nmol/L 的IS内标)进行液液萃取。经振摇(1 600 r/min,5 min)和离心(14 800 r/min,5 min)后吸取600 µl上清液至1.5 ml离心管中,在N2气下吹干(30 ℃加热),用120 µl乙腈复溶。经振摇(1 600 r/min,5 min)和离心(14 800 r/min,5 min)后取50 µl用于进样分析。
-
色谱柱为 Gemini C18 (2.0 mm×50 mm, 5 μm),流动相:溶剂A:水(含 0.04‰甲酸+5 mmol/L甲酸铵),溶剂B:乙腈(含0.04‰甲酸),洗针液:乙腈。梯度洗脱,洗脱程序如下:0~2 min,90% A+10% B;2~6 min,5% A+95% B;6~8 min,90% A+10% B。流速:0.35 ml/min,柱温:25 ℃,进样量 5 μl,运行时间 8 min。
-
离子源参数:离子源为涡轮喷射,气帘气压力为20 psi,毛细管电压为 5.5 kV,辅助加热气温度为500 ℃,雾化气压力为 40 psi,辅助加热气压力为60 psi。各化合物MRM参数见表1。
表 1 MRM模式下待测物和内标的离子化参数
化合物 去簇电压(V) 母离子(Da) 子离子(Da) 碰撞能(V) 碰撞室出口电压(V) HMS-01 106 772.5 214.2 39 16 罗红霉素 111 837.5 158.1 45 14 -
内标工作溶液配制:精密称取HMS-01对照品2.634mg,置于1.5ml EP管中,加0.675ml乙腈溶解,摇匀,得浓度为5mmol/L对照品储备液,−70 ℃存储。同时,精密称取4.366 mg的罗红霉素,置于1.5ml EP管中,加1.04 ml乙腈溶解,摇匀,得浓度为5mmol/L内标储备液,−70 ℃存储。
标准曲线溶液制备和质控溶液制备:以乙腈为溶剂,将HMS-01储备液稀释至浓度为20 µmol/L的工作液A,再采用逐级稀释法配制浓度为78.13、156.3、312.5、625、1 250、2 500、5 000、10 000 nmol/L的标准曲线工作液;再取各标准曲线工作液,以小鼠血浆为基质配制浓度为3.906 、7.81、15.6、31.25、62.5、125、250、500、1 000 nmol/L标准曲线溶液。随行质控溶液工作液HMS-01的低定量下限(LLOQ)为78.13nmol/L,其低、中、高浓度分别为160、1 600、16 000 nmol/L;质控样品LLOQ为3.906 nmol/L,低、中、高浓度分别为8、80、800 nmol/L。
-
选择性考察:取6个不同来源的小鼠空白血浆以及空白血浆配制的定量下限(LLOQ)样品按照“2.2”项下操作, 考察6个不同个体的空白小鼠血浆在对照品和内标保留时间处是否有干扰。
残留考察:运行定量上限(ULOQ)样品后,运行1个双盲样品,按 “2.2” 项下操作,至少考察3次。
-
以HMS-01与内标峰面积比分别对血浆样品中HMS-01的浓度进行线性回归(拟合方程Y=aX+b),并以浓度的倒数(1/X)为加权系数,求算回归方程。
-
定量下限血浆样品处理按照“2.2”项下操作, 进行6样本分析, 连续测定3批次, 并根据当前批次标准曲线计算每一样本的测得浓度, 计算该浓度的日内和日间精密度和准确度。
低、中、高浓度QC样品 (血浆浓度均分别为8.00、80.0和800 nmol/L) 处理按照“2.2 ”项下操作, 每个浓度进行6样本分析, 分别在第2日、3日计算实际浓度,测定批内、批间的精密度和准确度。
-
对6个批号的单个空白小鼠血浆样品进行处理,提取完成吹干后,在假定100%提取回收率的前提下,用含有低浓度(8 nmol/L)和高浓度(800 nmol/L)质控水平的HMS-01和内标(100 nmol/L)的复溶溶液复溶空白提取基质,测得的峰面积为Set1。
将包含低浓度(8 nmol/L)和高浓度(800 nmol/L)质控水平的HMS-01和内标(100 nmol/L)的复溶溶液,平行3份,测得的nmol/L峰面积为Set2。
基质效应(ME)= Set1/Set2×100%。
8、80、800 nmol/L的3个浓度的质控样品,按“2.2”项下方法处理后进样分析得待测物的峰面积为Set3,各浓度制备3个样品。
回收率(RE)= Set3/ average Set1×100%。
-
处理样品过程中的短期稳定性:小鼠血浆样品加特丁基甲醚3 h后HMS-01的稳定性以3个LQC(8 nmol/L)、3个HQC(800 nmol/L)作为一套稳定性样品。3个LQC和3个HQC样品各取2 µl,加内标4 µl和特丁基甲醚800 µl后,再加入38 µl小鼠空白血浆,在室温下放置3 h后,按“2.2”中描述的方法进行分析以考察其稳定性。
进样器上短期稳定性:小鼠血浆样品中HMS-01的进样盘放置稳定性以6个LQC(8 nmol/L)、6个HQC(800nmol/L)作为一套稳定性样品,在首次分析后继续储存在进样板上(进样器温度为8 ºC),放置11 h后用新绘标准曲线计算质控样品的浓度。
-
用小鼠血浆配制HMS-01浓度为50 µmol/L,按“2.2”项下方法进行样品前处理,乙腈复溶后得上清液备用。随后用乙腈(含91nmol/L的内标)溶液稀释该上清液,平行稀释6个样品,稀释倍数为100倍。
-
使用AB公司的Analyst软件输出原始图谱、浓度、准确度等数据。利用 EXCEL计算均值,标准偏差,变异系数等参数。HMS-01药动学参数用InnaPhase Kinetica2000TM软件(美国)用非房室模型分析处理。
-
采用Graphpad Prism 8 软件对数据进行处理和分析,结果以(均数±标准差)表示,采用t检验,P<0.05 认为差异有统计学意义,P<0.01 认为有极显著差异。
-
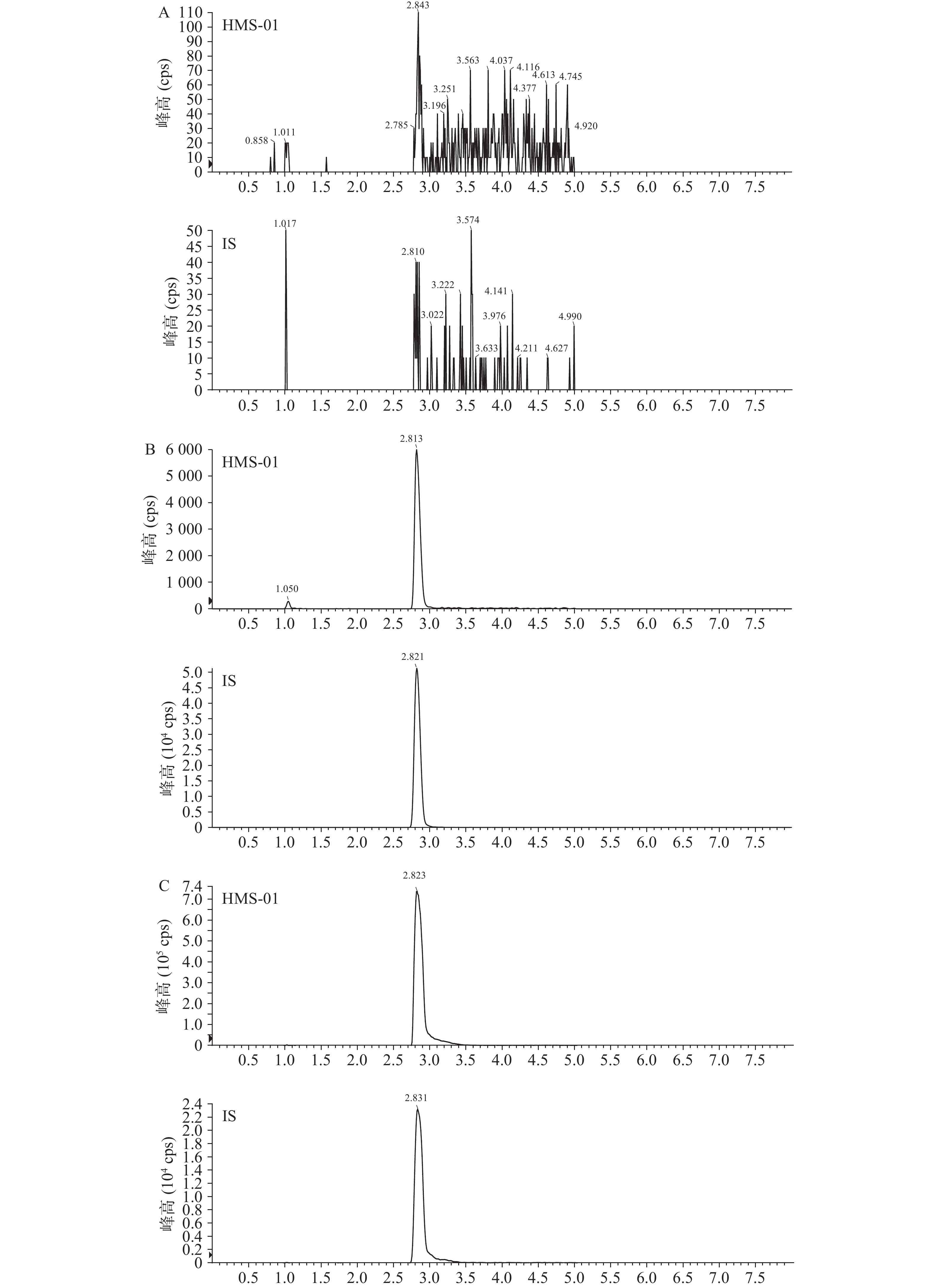
结果表明,空白小鼠血浆中的内源性物质不干扰HMS-01的测定。空白样品、LLOQ样品和给药(i.v.,HMS-01 2 030 nmol/L;i.v.,内标100 nmol/L)0.5 h血浆样品中成分色谱见图1。在本试验条件下,残留的各待测物响应值低于其定量下限各待测物响应值 20%,说明残留效应对血浆中各待测物测定的影响可以忽略不计。
-
测定小鼠血浆中HMS-01的线性范围为3.91~1 000 nmol/L。典型标准曲线回归方程为:Y = 0.021 5X + 0.007 56(r =0.999 5)。
-
定量下限血浆样品(HMS-01)为3.91 nmol/L的日内精密度为3%,准确度为105.9%;日间精密度为8.5%,准确度为115.9%。HMS-01低、中、高质控样品的精密度和准确度如表2所示。均符合生物样品测定相关要求[8]。
表 2 HMS-01 在小鼠血浆中的精密度和准确度 ( 批内n=6,批间n=18)
浓度(nmol/L) 日内精密度 日间精密度 实测浓度(nmol/L) 精密度(%) 准确度(%) 实测浓度(nmol/L) 精密度(%) 准确度(%) 8 7.838 2.04 97.98 7.783 4.92 97.29 80 76.93 0.89 96.16 85.24 9.76 106.55 800 710.3 1.41 88.75 821.5 9.96 102.69 -
内标归一化基质效应因子(待测物面积比/内标面积比)为0.92~1.12,内标归一化基质效应因子精密度CV均小于15%,说明建立的样品处理条件下基本无基质干扰。小鼠血浆中HMS-01提取回收率为 81.7%~95.1%,内标回收率为 81.4%~93.9%。提取回收率的各浓度精密度CV均小于15%,符合生物样品提取要求。
-
处理样品过程中的室温短期稳定性:各浓度的处理后样品平均实测浓度相对于理论浓度介于95.4%~109.1%。
处理后样品中HMS-01的稳定性:各浓度的处理后样品平均实测浓度相对于理论浓度介于87.4%~106.0%。
各浓度的处理后样品平均实测浓度相对于理论浓度均介于85%~115%,上述情况下待测物视为稳定。
稀释后准确度87.8%~111%,RSD 为8.5%表3,表明稀释可靠。
表 3 HMS-01在小鼠体内暴露水平与剂量的相关性
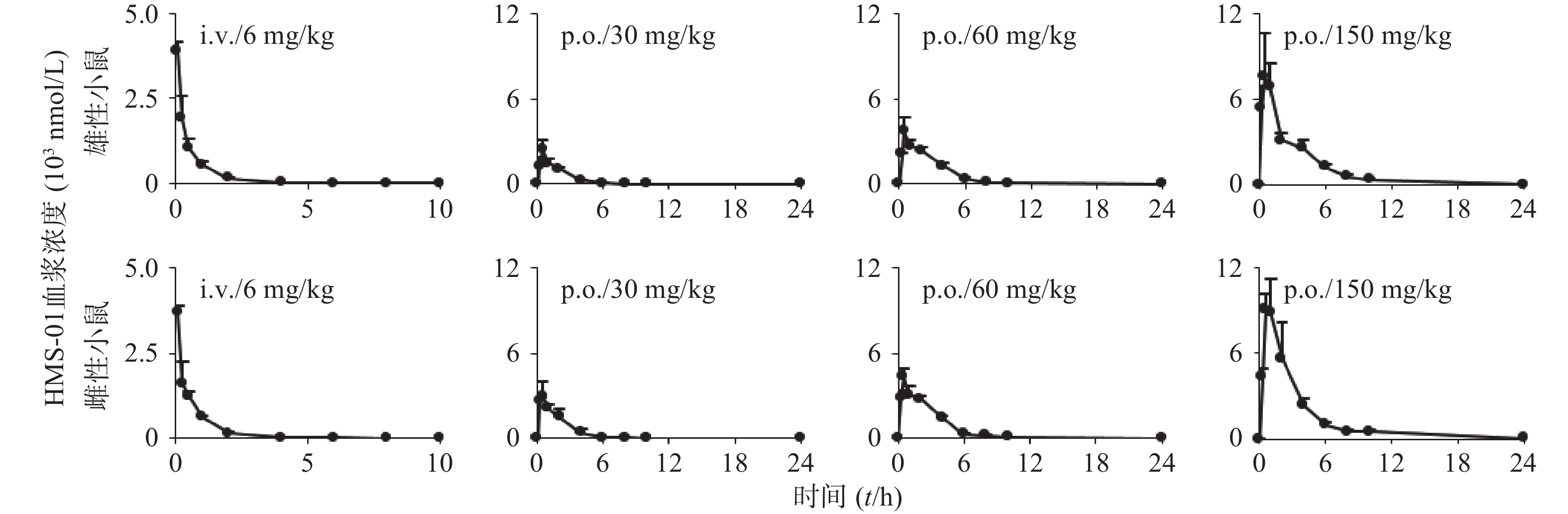
药代参数 i.v.(6 mg/kg) p.o(30 mg/kg) p.o(60 mg/kg) p.o(150 mg/kg) 雄小鼠组 雌小鼠组 雄小鼠组 雌小鼠组 雄小鼠组 雌小鼠组 雄小鼠组 雌小鼠组 Cmax(nmol) 3,910±254 3,700±184 2,420±728 3,207±704 3,770±939 4,337±536 7,933±2493 9,713±1,824 Tmax(h) − − 0.5±0 0.42±0.14 0.5±0 0.5±0 0.67±0.29 0.67±0.29 AUC0~24h (nmol·h) 1,919±79.1 1,914±142 4,566±656 6,233±733* 11,230±765 12,937±411* 23,320±4005 28,342±3300 AUC0~∞h(nmol·h) 1,923±78.1 1,917±142 4,638±654 6,301±722* 11,248±768 12,997±416* 23,346±3,999 28,375±3,289 t1/2 (h) 1.09±0.01 1.09±0.03 2.66±0.18 2.71±0.26 2.33±0.09 2.50±0.50 2.56±0.17 2.77±0.64 MRT (h) 2.07±1.35 1.86±0.75 2.82±0.26 2.41±0.21 2.96±0.15 3.09±0.49 3.42±0.30 3.32±0.16 CLtot,p
(L/(h·kg))2.75±0.10 2.85±0.31 − − − − − − VSS(L/kg) 5.62±3.48 5.17±1.64 − − − − − − F(%) − − 47.6±6.8 65.1±7.7* 58.5±4.0 67.6±2.1* 48.6±8.3 59.2±6.9 *P<0.05,与雄小鼠组比较 -
雌雄小鼠给药后不同时间点的血药浓度,相关平均时间-血药浓度曲线见图2。雌雄小鼠体内HMS-01暴露水平(AUC)分别与HMS-01剂量相关性分析结果见表3。小鼠药动学结果表明,HMS-01肠道吸收快,小鼠口服生物利用度中等(50%~70%)。HMS-01在小鼠体内的暴露水平 (AUC和cmax)随剂量的增加而增加,其中AUC随剂量的增加成线性相关。HMS-01静脉给药后,在小鼠体内的半衰期1 h左右;血浆清除率(CLtotal.p)为2.8 L/(h·kg),与小鼠肝血流量相当;表观分布容积(VSS)为5 L/kg,远大于小鼠总体液。雌雄小鼠30、60mg/kg经口服给药在AUC和F有显著差异(P<0.05),在cmax、 t1/2、CLtot,p、MRT、VSS等参数上接近,均无显著差异。
-
本文建立了快速、高效的LC-MS/MS法测定口服给药3个单剂量组和静脉给药单剂量组小鼠血浆中HMS-01浓度,经方法学验证,此方法的选择性、准确度、精密度、基质效应和稳定性均符合方法学要求,适用于小鼠体内血药浓度测定。本实验结果表明,HMS-01在小鼠体内的药动学过程有显著的性别差异,雌性小鼠鼠的生物利用度远高于雄性。考虑到心衰治疗需长期用药的现状,加上本实验中口服给药低、中、高剂量组显示HMS-01肠道吸收快,小鼠口服生物利用度尚可的特点,且HMS-01在小鼠体内的暴露水平(AUC和cmax)随剂量的增加而增加。因此,可考虑通过口服给药途径对HMS-01治疗小鼠心衰的进一步的体内研究提供依据。
Pharmacokinetic study of HMS-01 in mice
-
摘要:
目的 研究HMS-01在小鼠体内的药动学,为后续研究、提供支持。 方法 采用液相色谱-串联质谱 (LC-MS/MS) 技术,建立灵敏、特异的测定血浆等生物样品中 HMS-01 浓度的分析方法,用建立的方法开展 HMS-01 在C57BL/6J小鼠体内药动学研究。分别对其进行了3个剂量单次灌胃给药、1 个剂量单次静注给药的药动学研究,以获得基本药动学参数。 结果 小鼠药代动力学结果表明,HMS-01肠道吸收快,小鼠口服生物利用度中等(50%~70%)。HMS-01在小鼠体内的暴露水平(AUC和cmax)随剂量的增加而增加,其中AUC随剂量的增加成线性相关。HMS-01静脉给药后,在小鼠体内的半衰期不长(约1 h);血浆清除率(CLtot,p )为2.8L/(h·kg),与小鼠肝血流量相当;表观分布容积(VSS)为5 L/kg,远大于小鼠总体液。雌雄小鼠经HMS-01口服30、60mg/kg,在AUC和F有显著差异(P<0.05),在cmax、AUC0−∞、 t1/2、 CLtot,p、MRT、VSS等参数上接近,均无显著差异。 结论 HMS-01在小鼠体内的药动学过程有性别差异,雌性小鼠的血药浓度时间曲线下面积、生物利用度均高于雄性。由于口服生物利用度尚可,可考虑通过口服给药途径对HMS-01治疗小鼠心衰的进一步的体内研究提供依据。 -
关键词:
- HMS-01 /
- 药动学 /
- 小鼠 /
- 液相色谱-串联质谱法
Abstract:Objective To study the pharmacokinetics of HMS-01 in mice and provide support for subsequent studies. Methods Liquid chromatography-tandem mass spectrometry (LC-MS/MS) was used to establish a sensitive and specific method for the determination of the concentration of HMS-01 in plasma and other biological samples. The pharmacokinetics of HMS-01 in C57BL/6J mice were studied by the established method. To obtain the basic pharmacokinetic parameters, three doses of HMS-01 were given orally and one dose of HMS-01 was given intravenously. Results The pharmacokinetic results of mice showed that the intestinal absorption of HMS-01 was fast, the oral bioavailability of HMS-01 in mice was moderate (50% to 70%). The exposure levels (AUC and cmax) of HMS-01 in mice increased with the increase of dosage, while the AUC was linearly correlated with the increase of dosage. After intravenous administration of HMS-01, the half-life period in mice was about 1 h which was not long. The plasma clearance rate (CLtotal.p) was 2.8 L/h·kg, which was similar to the hepatic blood flow of mice. The apparent volume of distribution (VSS) was 5 L/kg, which was much larger than the total mouse fluid. There were significant differences in AUC and F (P<0.05), but no significant differences in parameters such as cmax,AUC0−∞,t1/2,CLtot,p,MRT,Vss in male and female mice which were given 30 and 60mg/kg HWS-01 orally. Conclusion The pharmacokinetic process of HMS-01 in mice showed gender differences, and the area under the curve of blood concentration time and bioavailability of female mice were higher than that of male mice. As oral bioavailability was reasonable, further in vivo studies on HMS-01 in mice with heart failure by oral administration could be considered to provide evidence. -
Key words:
- HMS-01 /
- pharmacokinetics /
- mice /
- LC-MS/MS method
-
类风湿关节炎(RA) 是一种以滑膜关节病变为主的慢性全身性、进行性自身免疫性疾病。疾病最早开始表现是滑膜炎,继而引发骨损伤及侵蚀,直至骨关节畸形及功能障碍[1-2],RA动物模型中广泛使用的是佐剂性关节炎模型和胶原诱导的关节炎模型。佐剂性关节炎又称弗氏佐剂性关节炎,是建立免疫性关节炎动物模型的基本方法[3]。RA发病机制还不明确,目前缺乏理想的治疗方案。临床上治疗RA主要是非甾体类抗炎药、抗风湿药物及糖皮质激素等[4],但往往因为药物的不良反应、价格等因素,难以坚持长期服药。
茵连痛风颗粒是上海中医药大学附属岳阳中西医结合医院院内制剂,由菌陈、连钱草、伸筋草组成,具有清热利湿、通络的功效。其处方是依据沪上著名夏氏外科传人夏涵教授数年临床经验方制成,用于治疗痛风性关节炎,临床具有显著疗效[5]。本实验通过弗氏完全佐剂诱导大鼠关节炎模型,观察茵连痛风颗粒对佐剂性关节炎的影响,为茵连痛风颗粒的临床应用提供科学依据。
1. 材料
1.1 药物与试剂
茵连痛风颗粒(上海中医药大学附属岳阳中西医结合医院药剂科自制,沪药制字:Z05050342,批号:1811001);塞来昔布胶囊(辉瑞制药有限公司,批号:AN8171);弗氏完全佐剂(Sigma 公司); IL-10、IL-4、前动力蛋白(PK1、2)酶联免疫分析试剂盒均购自上海威奥生物科技有限公司。
1.2 动物
SD 大鼠,雄性,体重(160±10)g,[上海斯莱克实验动物有限责任公司,实验动物生产许可证号:SCXK(沪)2017-0005]。
1.3 仪器
酶标仪(型号:DENLEY DRAGON Wellscan MK3,公司:Thermo);离心机(型号:TGL-168,公司:上海安亭科学仪器厂);数字显示隔水式电热恒温培养箱(型号:PYX-DHS,公司:上海跃进医疗器械厂);自制刻度软尺。
2. 方法
2.1 分组给药和模型建立
将48只SD雄性大鼠适应性饲养1周后,随机分为6组,每组8只。分别为正常组,模型组,塞来昔布阳性组(0.017 g/kg),茵连痛风颗粒高剂量组(15.4 g/kg),茵连痛风颗粒中剂量组(7.7 g/kg),茵连痛风颗粒低剂量组(3.8 g/kg)。除正常组外,其余各组大鼠右后足皮内注射弗氏完全佐剂 0.1 ml/足。注射弗氏完全佐剂后第8天,按照如上剂量灌胃给予相应浓度的受试药品,正常组和模型组给予等体积蒸馏水,每天给药1次,连续给药28 d。
模型鉴定:造模后各组大鼠的皮肤肿胀,皮肤温度及踝关节肿胀度与正常组之间是否有统计学差异,是模型成功与否的判定标准。
2.2 实验方法
2.2.1 大鼠一般情况和关节炎症状评分
分别在大鼠给药后7、14、28 d记录大鼠四肢关节病变程度,采用关节炎指数(AI)评分分级法评价大鼠病变程度。关节炎指数分为 5级(0~4分):0分,关节无红肿;l分,单个趾关节明显红肿;2分,发红并(或)肿胀关节>l个;3分,整个足及跖关节明显红肿;4分,严重的关节肿胀或畸形。根据未注射佐剂的余下肢体的病变程度累计积分,计算出AI(各个关节的积分累计起来,即为每只大鼠的 AI)。
2.2.2 茵连痛风颗粒对大鼠踝关节肿胀度影响
分别于造模前、给药后1 d、以及每间隔8 d,用刻度软尺测量大鼠右后踝关节周长,并观察各组动物关节病变情况。按照下列公式计算踝关节肿胀率:踝关节肿胀率=(致炎后踝关节周长-致炎前踝关节周长) /致炎前踝关节周长×100% 。
2.2.3 对大鼠甲醛致痛的影响[6]
末次给药后2 h,于大鼠左足趾皮下注射50 μl 2.5%甲醛,观察1~10 min(第I时相)和10~30 min(第II时相)的行为反应。评分标准:第I时相抬足1次,计1分;第II时相舔足、咬足或抖足1次,计2分。计算30 min内的总得分。
2.2.4 血清炎症指标检测和病理组织观察
末次给药后禁食、禁水12 h,大鼠注射10%水合氯醛(0.3 ml/100 g)进行麻醉,腹主动脉取血,离心取血清,用ELISA 法检测血清中IL-10、IL-4、PK1、PK2含量; 各组大鼠取左侧足掌肉垫,福马林固定,乙醇梯度脱水,石蜡包埋、切片和HE染色,病理组织学观察。
2.3 统计学分析
采用 SPSS 21.0 统计软件进行分析,实验数据以(
$ \bar x \pm s $ )表示,组间比较采用单因素方差分析。3. 结果
3.1 茵连痛风颗粒对大鼠一般情况及关节炎指数的影响
造模前各组大鼠毛色光亮,动作敏捷,精神状态和饮食均良好。模型组大鼠在造模后,自主活动减少、足底局部出现红肿,后期整只爪和关节均有不同程度肿胀,最初表现为足部肿胀,而后肿胀向上到达踝关节,肿胀部位皮肤发红,温度升高。随着时间延长,大鼠食欲减退,毛色暗黄,且运动功能逐渐减退。给予茵连痛风颗粒高、中、低剂量组及塞来昔布阳性组大鼠精神状态有所好转,关节肿胀度、食欲等有不同程度的缓解。表1结果表明,与模型组比较,给药7、14、28 d后,茵连痛风颗粒高、中剂量组和阳性组大鼠关节炎指数显著降低(P<0.01)。
表 1 茵连痛风颗粒对大鼠关节炎指数的影响 ($ \bar x \pm s $ ,n=8)组别 剂量(g/kg) 给药后关节炎指数 第7天 第14天 第28天 正常组 — 0.00±0.00 0.00±0.00 0.00±0.00 模型组 — 6.37±0.52## 9.63±0.74## 8.38±0.92## 阳性组 0.017 5.63±0.51** 6.50±0.93** 4.38±0.52** 高剂量组 15.4 5.50±0.53** 7.13±0.0.83** 4.13±0.64** 中剂量组 7.7 5.75±0.46** 8.13±0.0.83** 5.63±0.52** 低剂量组 3.8 5.88±0.35* 9.13±0.81 8.13±0.74 *P<0.05,**P<0.01,与模型组比较;##P<0.01,与正常组比较。 3.2 茵连痛风颗粒对大鼠踝关节肿胀度影响
表2结果显示,与同期正常组比较,模型组在给药第9天时肿胀率达峰值, 17d开始,肿胀逐日减轻,给药第9天开始,阳性组和茵连痛风颗粒高剂量组足肿胀与模型组比较,肿胀明显减轻,有显著统计学差异(P<0.01);在给药第25、28天,茵连痛风颗粒中剂组与模型组有显著性差异(P<0.05),茵连痛风颗粒低剂组无明显差异。结果显示了茵连痛风颗粒对佐剂性关节炎大鼠原发足踝关节肿胀有剂量依赖性抑制作用。
表 2 茵连痛风颗粒对大鼠踝关节肿胀率的影响 ($ \bar x \pm s $ ,n=8)组 别
踝关节周长(l/cm)给药后踝关节肿胀率(%) 第1天 第9天 第17天 第25天 第28天 正常组 2.24±0.05 2.77±0.71 3.36±1.87 3.56±4.70 3.94±6.89 4.31±7.95 模型组 2.26±0.06 28.75±6.36## 30.09±8.24## 26.51±10.43## 25.44±12.90## 23.31±13.26## 阳性组 2.27±0.08 27.00 ±0.00 22.63±1.77** 20.61±1.45** 19.33±4.31** 18.45±4.67** 高剂量 2.22±0.05 27.54 ±1.03 23.85±1.56** 20.01±0.04** 18.14±1.52** 17.85±2.40** 中剂量 2.24±0.06 28.24 ±0.67 28.68±0.92 25.19±0.88 22.26±1.52* 21.85±2.40* 低剂量 2.28±0.07 29.48 ±0.21 29.49±2.23 26.05±0.99 25.01±0.32 24.10±0.28 *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与正常组比较。 3.3 茵连痛风颗粒对大鼠甲醛致痛的影响
与模型组比较,在I时相和II时相,阳性组和茵连痛风颗粒高、中、低剂量组可显著降低甲醛致痛分值(P<0.01),表明茵连痛风颗粒具有很好的镇痛作用(表3)。
表 3 茵连痛风颗粒对大鼠甲醛致痛的影响 ($ \bar x \pm s $ ,n=8)组 别 剂量 (g/kg) 甲醛致痛分值 1~10 min(Ⅰ时相) 10~30 min(Ⅱ时相) 正常组 — 2.38±0.52 1.38±0.52 模型组 — 33.63±1.41## 14.88±1.64## 阳性组 0.017 11.38±1.06** 3.50±0.93** 高剂量组 15.4 12.13±0.99** 3.25±1.04** 中剂量组 7.7 16.00±1.60** 5.25±0.89** 低剂量组 3.8 19.38±1.19** 6.50±1.20** **P<0.01;与模型组比较; ##P<0.01,与正常组比较。 3.4 茵连痛风颗粒对IL-4、IL-10、PK1、PK2的影响
模型组大鼠IL-10,IL-4与正常组相比显著降低(P<0.01),炎性反应较明显;茵连痛风颗粒各组和阳性组均能升高IL-10,IL-4水平。同时,模型组大鼠 PK1、PK2水平与正常组相比显著升高(P<0.01),阳性组和茵连痛风颗粒各组均能降低两者水平,与模型组比较有显著差异 (P<0.01),其中,茵连痛风颗粒高剂量组更明显(表4)。
表 4 茵连痛风颗粒对大鼠血清IL-4、IL-10、PK1、PK2的影响 ($ \bar x \pm s $ ,n=8)组别 剂量 (g/kg)
IL-4
IL-10
PK1
PK2正常组 — 79.49±4.38 97.07±2.97 491.76±8.56 926.24±25.38 模型组 — 59.89±3.45## 20.99±2.78## 706.31±67.83## 1455.40±147.81## 阳性组 0.017 139.69±13.78** 98.94±6.72** 567.10±20.58** 1099.60±63.63** 高剂量组 15.4 101.45±7.05** 90.36±5.43** 365.49±27.65** 656.07±194.68** 中剂量组 7.7 95.60±4.52** 82.75±8.49** 433.91±22.29** 866.73±21.57** 低剂量组 3.8 72.50±3.09** 78.15±5.47** 529.20±12.79** 1015.51±18.36** **P<0.01,与模型组比较; ##P<0.01,与正常组比较。 3.5 病理观察
由图1可见,正常对照组足趾肉垫无炎症细胞浸润,而模型组可见大量淋巴细胞浸润。塞来昔布组可见淋巴细胞浸润程度的大幅度降低,而茵连痛风颗粒高、中、低剂量组均可降低淋巴细胞浸润,而以茵连痛风颗粒高剂量组最为显著。
4. 讨论
类风湿关节炎在中医归属“痹症”范畴,治疗以祛风除湿、散寒通络、扶正固本、清热解毒为主[7]。茵连痛风颗粒有茵陈、连钱草、伸筋草三味药材组成。茵陈作为君药,具有清利湿热、芳香舒脾、透表畅气之效;臣药连钱草,取其消石之功,防止痛风性尿路结石的产生,具有利湿通淋、清热解毒、散瘀消肿之功效;佐药伸筋草具有祛风除湿、舒筋活血之效,为治痹痛拘挛及伤损瘀肿之要药,配伍茵陈可以增强该复方利湿通络的作用。该方配伍符合中医理论对类风湿性关节炎的认识[8]。
弗氏佐剂关节炎动物模型是经典的类风湿关节炎模型,与类风湿性关节炎模型的病因、病症更接近。它能较为真实地反映类风湿关节炎的病理进程,与痛风性关节炎同属中医 “痹证”“白虎历节风”范畴,而且制备方法简便、易重复。常用于关节炎药物的药效评估[9]。IL-4、IL-10细胞因子在类风湿性关节炎患者中,起到十分重要的作用。这类细胞因子与滑膜炎性反应、增生及关节变形有着密切的关系。PK信号通路是近年新发现的调节通路,包括两种结构上关联的小分子肽PK1和PK2及相应的G蛋白偶联受体PK(PKR1和PKR2),PKs及其受体PKRs广泛分布在许多人体组织中。在免疫细胞中参与炎症发生和疼痛传递的重要环节,如PK2参与免疫调节,诱导骨髓细胞分化为单核细胞系和巨噬细胞系,并通过激活单核细胞、巨噬细胞和树突状细胞上的 PKRs,释放IL-1、IL-6、TNF-a等炎性细胞因子,触发和维持炎性疼痛,调节免疫炎症反应[10-11]。研究发现在前动力蛋白信号通路中加入PKRs激动剂可以显著降低IL-10和IL-4生成[12]。损伤组织中释放的PKs是免疫-炎症反应的一种自分泌或旁分泌的调节剂,能够刺激神经元中PKRs而增强伤害性感受器的敏感性,说明PKs信号通路在调节伤害性感受阈方面发挥重要功能,因此阻断PKs信号通路是目前治疗炎性疼痛的新策略[11]。然而,关于PK信号通路在中药镇痛方面的研究报道较少,其干预中药镇痛的具体机制有待进一步研究证实。本实验结果显示,茵连痛风颗粒可明显减轻RA大鼠足踝关节肿胀,按照人和大鼠之间的体表面积换算成大鼠的给药中剂量,并设置高、中、低3个剂量组。以高剂量组改善最为明显,并呈现剂量依赖性。同时,病理结果显示,茵连痛风颗粒高中低剂量组均可降低淋巴细胞浸润,以茵连痛风颗粒高剂量组最为显著。其作用机制可能是通过PK信号通路抑制PK1、PK2分泌,以及促进细胞因子IL-4、IL-10等分泌达到抗类风湿性关节炎的作用。为茵连痛风颗粒作用机制的阐明打下了基础。这些研究结果表明,茵连痛风颗粒对佐剂关节炎具有明显抑制作用,暗示其对类风湿关节炎的治疗前景,作用机制有待进一步研究。
-
表 1 MRM模式下待测物和内标的离子化参数
化合物 去簇电压(V) 母离子(Da) 子离子(Da) 碰撞能(V) 碰撞室出口电压(V) HMS-01 106 772.5 214.2 39 16 罗红霉素 111 837.5 158.1 45 14 表 2 HMS-01 在小鼠血浆中的精密度和准确度 ( 批内n=6,批间n=18)
浓度(nmol/L) 日内精密度 日间精密度 实测浓度(nmol/L) 精密度(%) 准确度(%) 实测浓度(nmol/L) 精密度(%) 准确度(%) 8 7.838 2.04 97.98 7.783 4.92 97.29 80 76.93 0.89 96.16 85.24 9.76 106.55 800 710.3 1.41 88.75 821.5 9.96 102.69 表 3 HMS-01在小鼠体内暴露水平与剂量的相关性
药代参数 i.v.(6 mg/kg) p.o(30 mg/kg) p.o(60 mg/kg) p.o(150 mg/kg) 雄小鼠组 雌小鼠组 雄小鼠组 雌小鼠组 雄小鼠组 雌小鼠组 雄小鼠组 雌小鼠组 Cmax(nmol) 3,910±254 3,700±184 2,420±728 3,207±704 3,770±939 4,337±536 7,933±2493 9,713±1,824 Tmax(h) − − 0.5±0 0.42±0.14 0.5±0 0.5±0 0.67±0.29 0.67±0.29 AUC0~24h (nmol·h) 1,919±79.1 1,914±142 4,566±656 6,233±733* 11,230±765 12,937±411* 23,320±4005 28,342±3300 AUC0~∞h(nmol·h) 1,923±78.1 1,917±142 4,638±654 6,301±722* 11,248±768 12,997±416* 23,346±3,999 28,375±3,289 t1/2 (h) 1.09±0.01 1.09±0.03 2.66±0.18 2.71±0.26 2.33±0.09 2.50±0.50 2.56±0.17 2.77±0.64 MRT (h) 2.07±1.35 1.86±0.75 2.82±0.26 2.41±0.21 2.96±0.15 3.09±0.49 3.42±0.30 3.32±0.16 CLtot,p
(L/(h·kg))2.75±0.10 2.85±0.31 − − − − − − VSS(L/kg) 5.62±3.48 5.17±1.64 − − − − − − F(%) − − 47.6±6.8 65.1±7.7* 58.5±4.0 67.6±2.1* 48.6±8.3 59.2±6.9 *P<0.05,与雄小鼠组比较 -
[1] BOZKURT B, COATS A J, TSUTSUI H, et al. Universal definition and classification of heart failure: areport of the heart failure society of America, heart failure association of the European society of cardiology, Japanese heart failure society and writing committee of the universal definition of heart failure[J]. J Card Fail, 2021, 23(3): 2021Mar1;S1071-2021Mar1;S9164(21)00050-6. [2] SEFEROVIĆ P M, VARDAS P, JANKOWSKA E A, et al. The heart failure association atlas: heart failure epidemiology and management statistics 2019[J]. Eur J Heart Fail,2021,23(6):906-914. doi: 10.1002/ejhf.2143 [3] MCDONAGH T A, METRA M, ADAMO M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure[J]. Eur Heart J,2021,42(36):3599-3726. doi: 10.1093/eurheartj/ehab368 [4] HEIDENREICH P A, et al. 2022 AHA/ACC/HFSA guideline for the management of heart failure: executive summary: areport of the American college of cardiology/American heart association joint committee on clinical practice guidelines[J]. J Am CollCardiol,2022,79(17):1757-1780. doi: 10.1016/j.jacc.2021.12.011 [5] JONES N R, ROALFE A K, ADOKI I, et al. Survival of patients with chronic heart failure in the community: a systematic review and meta-analysis[J]. Eur J Heart Fail,2019,21(11):1306-1325. doi: 10.1002/ejhf.1594 [6] ZHANG T T, WANG Y L, JIN B, et al. Plasma pharmacokinetics of isorhapontigenin, a novel derivative of stilbenes, in mice by LC-MS/MS method[J]. J Asian Nat Prod Res,2019,21(9):895-904. doi: 10.1080/10286020.2018.1540602 [7] ZHANG J L, SI H F, SUN J C, et al. Determination of myrislignan levels in BALB/c mouse plasma by LC-MS/MS and a comparison of its pharmacokinetics after oral and intraperitoneal administration[J]. BMC Vet Res,2021,17(1):275. doi: 10.1186/s12917-021-02990-y [8] 国家药典委员会. 中华人民共和国药典2020年版. 四部[S]. 北京: 中国科技出版社, 2020: 466-468. -







 下载:
下载:



 下载:
下载: