-
乳腺癌是发生在乳腺上皮组织的恶性肿瘤,居女性癌症发病率的首位,是引起女性死亡的主要原因之一[1]。乳腺癌最常用的联合化疗可降低复发率,但引起的肿瘤细胞多药耐药和严重的不良反应限制了其临床疗效。中医药已被广泛用于癌症的治疗,可通过提高肿瘤对药物的敏感性、调节机体免疫功能,增强化疗效果,改善患者预后[2]。其优势主要体现在中药作用多靶点、多途径而产生广泛的生物活性和较低的毒性,现已被用作乳腺癌在内的多种癌症的替代疗法[3]。
苦参(Sophora flavescens)味苦性寒,始载于《神农本草经》,具有清热燥湿、杀虫、利尿的功效。苦参的主要化学成分包括生物碱、黄酮类、苯丙素、萜类、甾体、有机酸和挥发油等。其中苦参生物碱占3%,苦参黄酮占1.5%,是苦参的两类特征性成分,具有抗炎和抗肿瘤等药理作用,对急性髓系白血病、鼻咽癌、宫颈癌、乳腺癌、结直肠癌、膀胱癌、胰腺癌等均显示出较好的抗肿瘤活性[4]。
目前关于苦参抗乳腺癌的研究多局限于探索苦参中某种活性成分作用于特定靶点或通路的抗乳腺癌的机制,未从整体角度阐释苦参抗乳腺癌的作用机制。因此,本研究基于网络药理学的方法,从中药作用的整体理论和中医药现代化的研究思路,探究苦参抗乳腺癌的作用,初步构建其主要活性成分作用于多靶点、多通路的作用机制网络,为开发基于苦参的抗乳腺癌新药和临床用药提供参考[5-6]。
-
中药系统药理学分析平台(TCMSP);中医药百科全书数据库(ETCM);通用蛋白质数据库(UniProt);人类基因数据库(Genecards);生物信息学和化学信息学数据库(Drugbank);人类孟德尔遗传数据库(OMIM);治疗靶点数据库(TTD);蛋白质互作平台(STRING10.5);生物学信息注释数据库 (DAVID 6.8)。数据库检索日期为2021年12月。
-
应用TCMSP数据库检索关键词“苦参”的所有活性成分,选择“ingredient”,设置阈值标准为:口服生物利用度(OB)≥30% ,且类药性(DL)≥0.18,并结合ETCM数据库和国内外文献,筛选出苦参的活性成分。
-
从PubChem 数据库获得筛选出的苦参活性成分的2D结构式导入Swiss Target Prediction数据库,预测苦参活性成分的靶点,物种选择Homo sapiens,导入结构式,筛选与苦参活性化合物相关的作用靶点。通过 UniProt数据库,将检索得到的所有靶点蛋白校正为其标准名称。
-
将搜索关键词设置为“breast cancer”,使用GeneCards、Drugbank、OMIM、TTD数据库对癌症的靶点进行搜索,将Drugbank、OMIM、TTD数据库中的乳腺癌相关基因进行合并、去重后,得到乳腺癌的靶点[7]。
-
将以上四个数据库获取的乳腺癌靶基因与苦参活性成分靶基因输入Venny 2.1.0软件,取交集作为苦参抗乳腺癌的靶点,筛选出苦参抗乳腺癌的潜在靶点。
-
将上述靶点及主要活性成分导入 Cytoscape 3.7.2 软件,构建苦参抗乳腺癌的苦参-核心活性成分-靶点网络图。用Cytoscape 3.7.2 软件中“Networkanalyzer”功能,对网络拓扑属性进行分析,得到苦参抗乳腺癌的主要活性成分。
-
将上述得到的主要靶基因上传到STRING数据库,设置物种为“Homo sapiens”,进行检索,利用STRING数据库对PPI网络图进行分析,得到相关靶点参数。将该参数上传至Cytoscape 3.7.2 软件,构建苦参蛋白互作网络(PPI)图。
-
将苦参抗乳腺癌靶点输入DAVID 6.8平台,结合Hiplot平台分别进行GO功能富集分析与KEGG通路富集分析,依据P<0.01,筛选苦参抗乳腺癌的靶点富集的生物功能及信号通路。
-
根据苦参抗乳腺癌的苦参-核心活性成分-靶点网络图,选择核心活性成分与主要靶点进行分子对接。从PubChem数据库下载苦参核心活性成分的SDF文件,在PDB数据库寻找各主要靶点的PDB文件,利用Schrodinger 2018软件进行分子对接。
-
人乳腺癌MCF-7细胞购自中国科学院上海细胞库。以含10% FBS的DMEM高糖培养基添加100 U/ml青霉素和100 µg/ml链霉素,5% CO2的37˚C 培养箱培养,取对数生长期的细胞用于后续实验。
-
苦参提取物(原药材生药量=20∶1,批号:20220710,西安瑞迪生物科技有限公司);胎牛血清(批号:10099-141)、胰蛋白酶(批号:2323491)购自GIBCO;DMEM高糖培养基(批号:8122184,Hyclone);CCK8试剂盒(批号:C0039)、Hoechst 33342荧光染料(批号:C1029)购自碧云天生物技术有限公司;4%多聚甲醛(批号:CR2110036)、Androgen Receptor(AR)抗体(批号:GB11253)、cy3-山羊抗兔二抗(批号:GB21303)、DAPI染料(批号:G1012)、抗荧光淬灭封片剂(批号:G1401)购自Servicebio。
-
取对数生长期的MCF-7细胞,调整细胞密度至1×105/ml,接种于96孔板中,每孔100 μl,培养过夜待细胞贴壁后,加入不同浓度的苦参提取物(0、1.25、2.5、5、10、20、40 mg/ml),每组设置6个复孔。空白组加入相应的无细胞培养基,相同处理。药物作用24 h后,显微镜下观察并拍照;吸弃原培养基,PBS洗涤2次,每孔加入100 μl含有10 μl的CCK8的新鲜培养基,于5% CO2的37˚C 培养箱中继续培养2 h后,多功能酶标仪测定450 nm波长处OD值,根据OD值计算细胞的存活率:细胞存活率=[(给药组OD值−空白组OD值)/(对照组OD值−空白组OD值)]×100%。
-
取对数生长期的MCF-7细胞,调整细胞密度至1×105/ml,接种于6孔板中,培养过夜待细胞贴壁后,加入不同浓度的苦参提取物处理,药物作用48 h后,吸弃原培养基,PBS洗涤2次,每孔加入1 ml含有100 μl Hoechst 33342染色液的新鲜培养基,室温染色20 min后,PBS洗涤3次,荧光显微镜下观察并拍照,并使用Image J软件进行荧光定量分析。
-
取对数生长期的MCF-7细胞,调整细胞密度至1×105/ml,接种于6孔板细胞爬片上,培养过夜待细胞贴壁后,加入不同浓度的苦参提取物处理,药物作用48 h后,吸弃原培养基,PBS洗涤3次,每孔加 1 ml 4%的多聚甲醛,固定细胞15 min,弃去固定液,PBS 洗涤 3 次,加入细胞破膜液破膜30 min,PBS洗涤3次,每次5 min。每孔加入 1 ml 的 5% BSA溶液,置于摇床上室温封闭 30 min,弃去封闭液,加入 AR一抗(1∶500稀释),4 ℃孵育过夜,PBS洗涤3次,每次5 min。 加入荧光素标记的cy3-山羊抗兔二抗,摇床上室温孵育 1 h, PBS 洗涤 3 次,每次5 min。 加入1 μg/ml DAPI,室温孵育10 min,PBS 洗涤 3 次,每次5 min。 待玻片稍干后,用抗荧光淬灭封片剂封片。荧光显微镜下观察并分别采集AR染色、DAPI染色及两者合并图像,并使用Image J软件进行荧光定量分析,每孔至少随机选取3个不同视野。
-
在TCMSP数据库中检索苦参共得到113个化合物,根据OB≥30%、DL≥0.18,结合ETCM数据库和国内外文献,最终确定结构明确的化合物36种,见表1。
表 1 苦参中36种活性化合物基本信息
分子编号 化合物名称 分子式 OB(%) DL MOL006596 大豆素 C20H18O5 97.27 0.76 MOL000456 菜豆素 C20H18O4 78.20 0.73 MOL001484 高丽槐素 C16H12O5 75.18 0.54 MOL004941 甘草素 C15H12O4 71.12 0.18 MOL000392 刺芒柄花素 C16H12O4 69.67 0.21 MOL006565 异苦参碱 C15H24N2O 68.68 0.25 MOL003648 山槐素 C16H12O5 65.83 0.54 MOL003627 槐果碱 C15H22N2O 64.26 0.25 MOL005944 苦参碱 C15H24N2O 63.77 0.25 MOL006627 12,13-去氢苦参碱 C15H22N2O 62.23 0.25 MOL006571 安纳基林 C15H20N2O 62.01 0.24 MOL006626 勒奇黄烷酮 G C20H20O6 60.97 0.40 MOL003680 槐定碱 C15H24N2O 60.07 0.25 MOL006566 12,13-去氢苦参碱 C15H22N2O 58.34 0.25 MOL006649 5α-羟基苦参碱 C15H24N2O2 55.42 0.28 MOL006630 去甲藤黄素 C15H10O6 54.93 0.24 MOL006628 白羽扇豆碱 C15H24N2O 52.71 0.24 MOL006623 苦参新醇 T C25H30O7 51.28 0.64 MOL006650 三叶豆紫檀苷丙二酸酯 C25H24O13 48.69 0.52 MOL006652 三叶豆紫檀苷 C22H22O11 48.53 0.74 MOL006604 异黄腐醇 C21H22O5 48.09 0.39 MOL005100 橙皮素 C16H14O6 47.74 0.27 MOL006613 苦参素 C16H14O5 47.62 0.38 MOL000098 槲皮素 C15H10O7 46.43 0.28 MOL003347 贯叶金丝桃素 C35H52O4 44.03 0.60 MOL003673 怀特酮 C20H18O5 42.80 0.36 MOL006622 苦参新醇 O C27H30O13 42.41 0.76 MOL001040 柚皮素 C15H12O5 42.36 0.21 MOL003676 槐胺碱 C15H20N2O 42.16 0.25 MOL006582 5α,9α-二羟基苦参碱 C15H24N2O3 40.93 0.32 MOL003542 8-异戊烯醇去甲基淫羊藿苷 C20H18O6 38.04 0.39 MOL006569 14β-羟基苦参碱 C15H24N2O2 37.26 0.29 MOL000006 木犀草素 C15H10O6 36.16 0.25 MOL006561 14α-羟基苦参碱 C15H24N2O2 35.73 0.29 MOL006570 9α-羟基槐胺碱 C15H22N2O2 35.23 0.29 MOL006563 9α-羟基苦参碱 C15H24N2O2 32.04 0.29 -
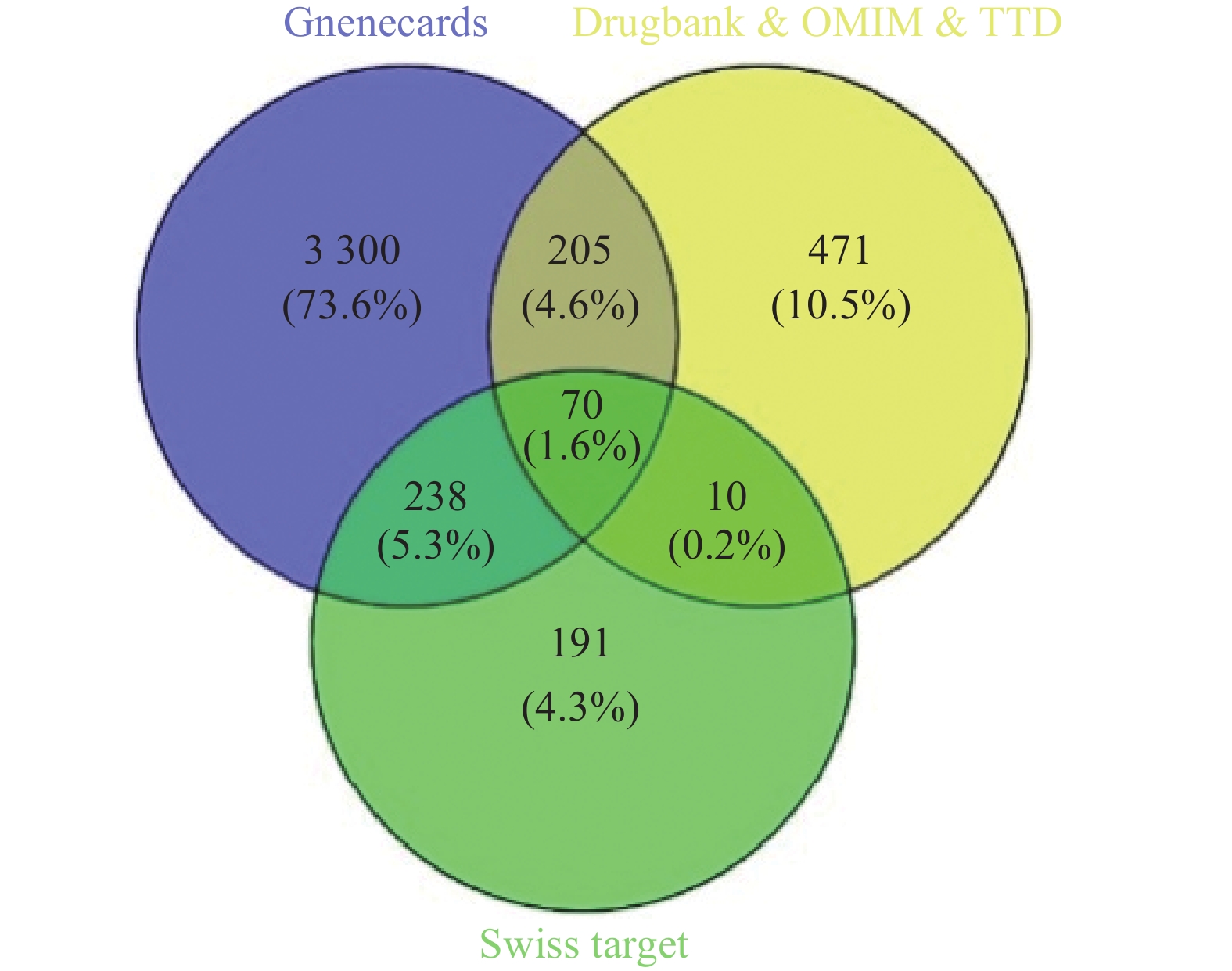
通过Swiss Target Prediction数据库预测共得到苦参活性成分的药物靶点509个,分别从TTD数据库、Drugbank数据库和OMIM数据库获取乳腺癌疾病靶点137个、244个和506个,去除重复项得到756个疾病靶点。从GeneCards数据库获得乳腺癌疾病靶点15230个,保留分值≥4.38(2倍中位数)的疾病靶点3813个,合并4个数据库检索结果并删去重复项,得到275个乳腺癌相关靶点。采用Venny 2.1软件,绘制苦参活性成分靶点与乳腺癌疾病靶点韦恩图,得到70个共有靶点(图1)。
-
根据Cytoscape 3.7.2软件绘制的苦参抗乳腺癌“中药-活性成分-靶点”网络图的参数,筛选化合物Degree(度)值>5的节点,共筛选出24种核心活性成分,对应67个靶点,构建苦参抗乳腺癌的“中药-核心活性成分-靶点”网络图,如图2所示,每个参与互作的蛋白节点用一个圆圈表示,圆圈面积越大、颜色越深表示其Degree值越大,在药物-核心活性成分-靶点网络中,总共包括92个节点(其中包含1个药物节点、24个化合物节点和67个靶点节点)和 630 条边。按照Degree(度)值>5排列活性成分,从中可见木犀草素、槲皮素、菜豆素、甘草素等的Degree值最大,是苦参抗乳腺癌的核心活性成分。
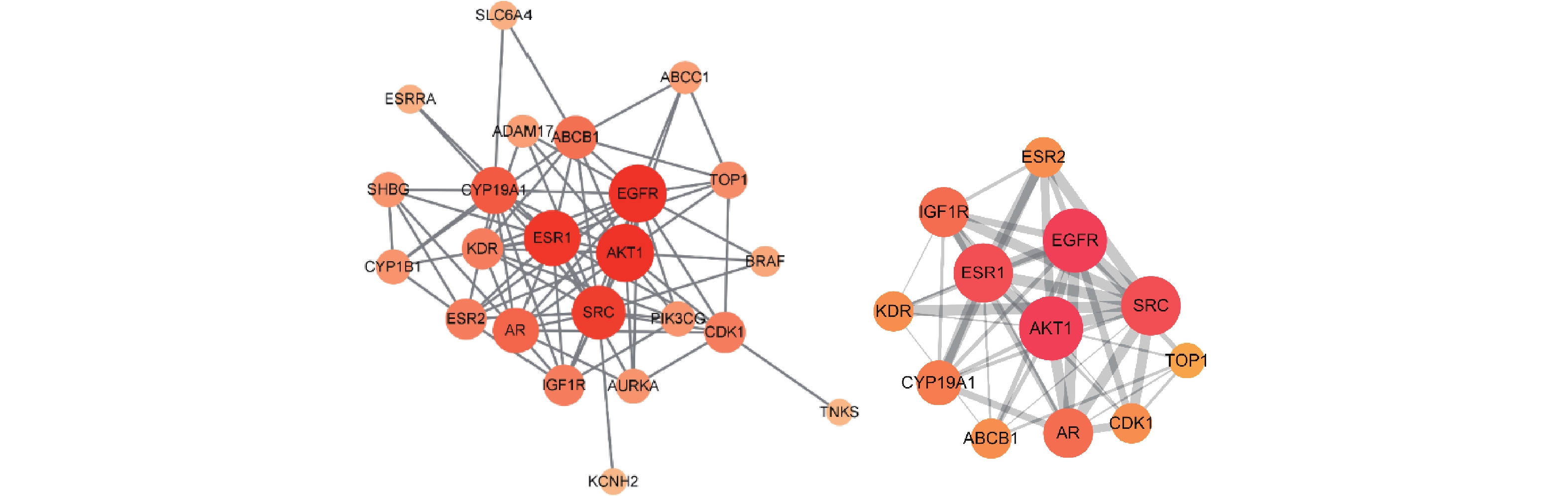
为了更好地理解苦参抗乳腺癌的作用机制,按照Degree>5排列主要靶点,筛选出苦参抗乳腺癌的主要疾病靶点25个。用STRING数据库分析该网络参数,导入Cytoscape软件构建苦参蛋白互作网络(PPI)图,以明确生物分子间相互作用相关的重要靶蛋白(图3)。筛选出前12位的主要核心靶蛋白为EGFR、AKT1、ESR1、SRC、CYP19A1、AR、ABCB1、CDK1、ESR2、KDR、IGF1R和TOP1,各核心靶点的拓扑参数见表2。
表 2 核心靶点及其拓扑参数
靶点 蛋白名称 度 介数 紧密度 EGFR 表皮生长因子受体 16 1.28×10−1 7.86×10−1 AKT1 丝氨酸/苏氨酸蛋白激酶 1 16 1.28×10−1 7.86×10−1 ESR1 雌激素受体 α 15 1.45×10−1 7.59×10−1 SRC 非受体酪氨酸激酶 Src 14 1.58×10−1 7.33×10−1 CYP19A1 细胞色素P450酶 19A1 11 0.95×10−1 6.47×10−1 AR 雄激素受体 10 0.32×10−1 6.47×10−1 ABCB1 ATP结合盒B亚家族成员1 9 0.65×10−1 6.11×10−1 CDK1 周期素依赖性激酶1 8 0.97×10−1 5.95×10−1 ESR2 雌激素受体β 8 0.18×10−1 5.95×10−1 KDR 血管内皮生长因子受体2 8 0.12×10−1 5.95×10−1 IGF1R 胰岛素样生长因子1受体 8 0.08×10−1 5.95×10−1 TOP1 DNA拓扑异构酶1 6 0.08×10−1 5.64×10−1 -
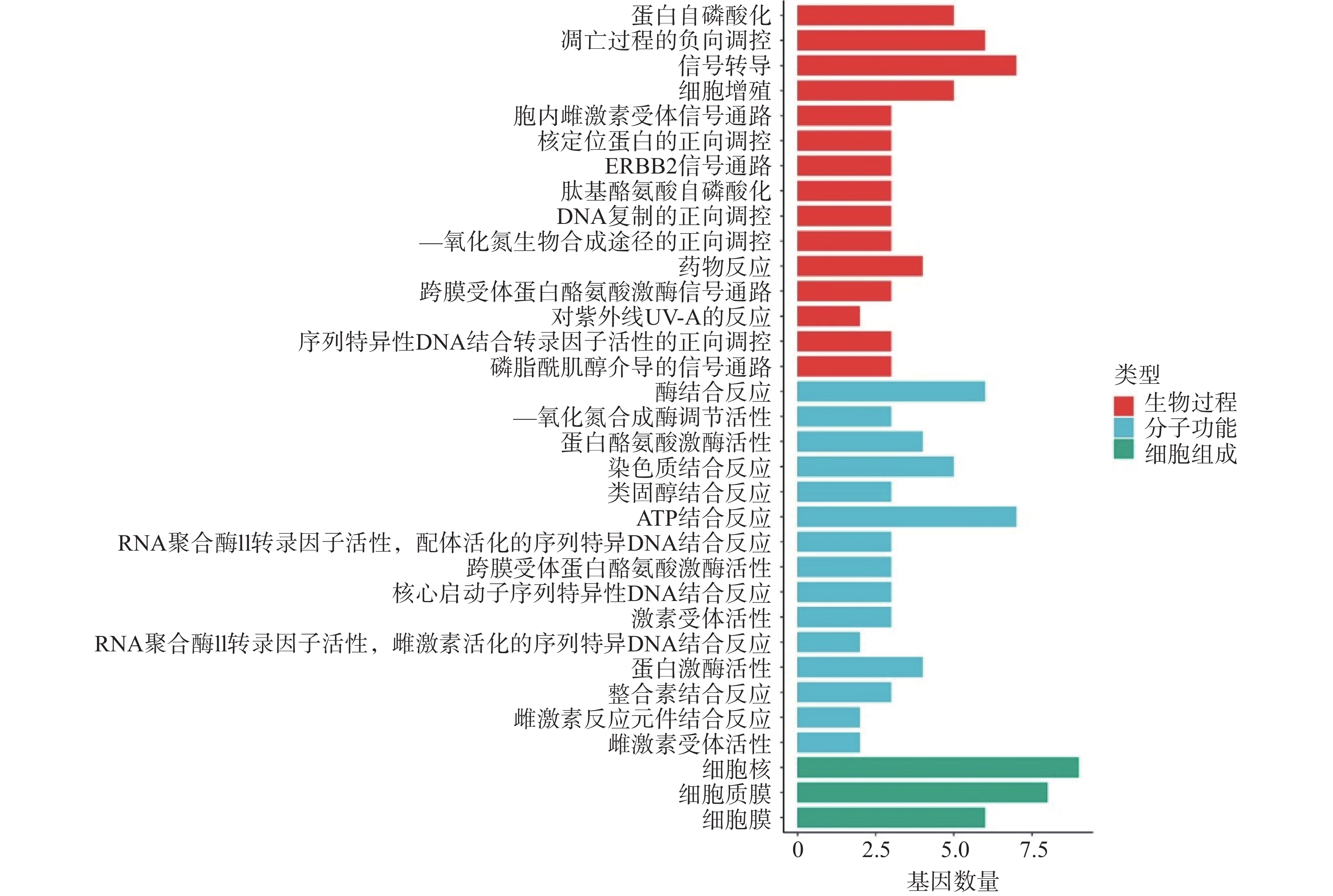
利用DAVID数据库对筛选出的12个关键靶点进行GO 功能富集分析,依据P<0.01,选出GO条目49个,其中生物过程(BP)29个,分子功能(MF)17个,及细胞组成(CC)3个。利用Hiplot在线平台对每个种类的前15个条目进行可视化分析。结果显示,苦参抗乳腺癌靶点的生物过程主要涉及蛋白自磷酸化、凋亡过程的负向调控、信号转导、细胞增殖、胞内雌激素受体信号通路等。分子功能涉及酶结合反应、一氧化氮合成酶调节活性、蛋白酪氨酸激酶活性、染色质结合反应、类固醇结合反应等。细胞过程涉及细胞核、细胞质膜和细胞膜(图4)。
-
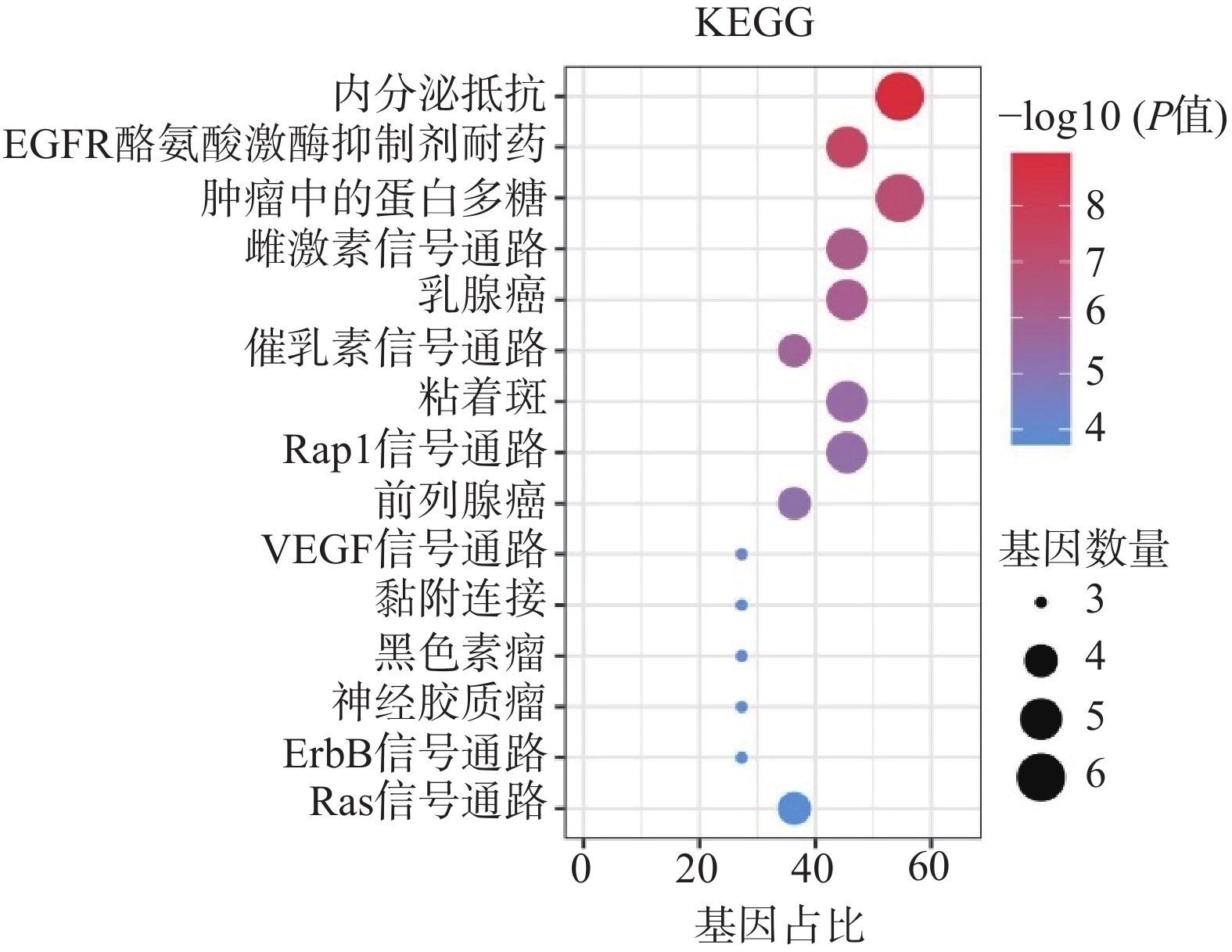
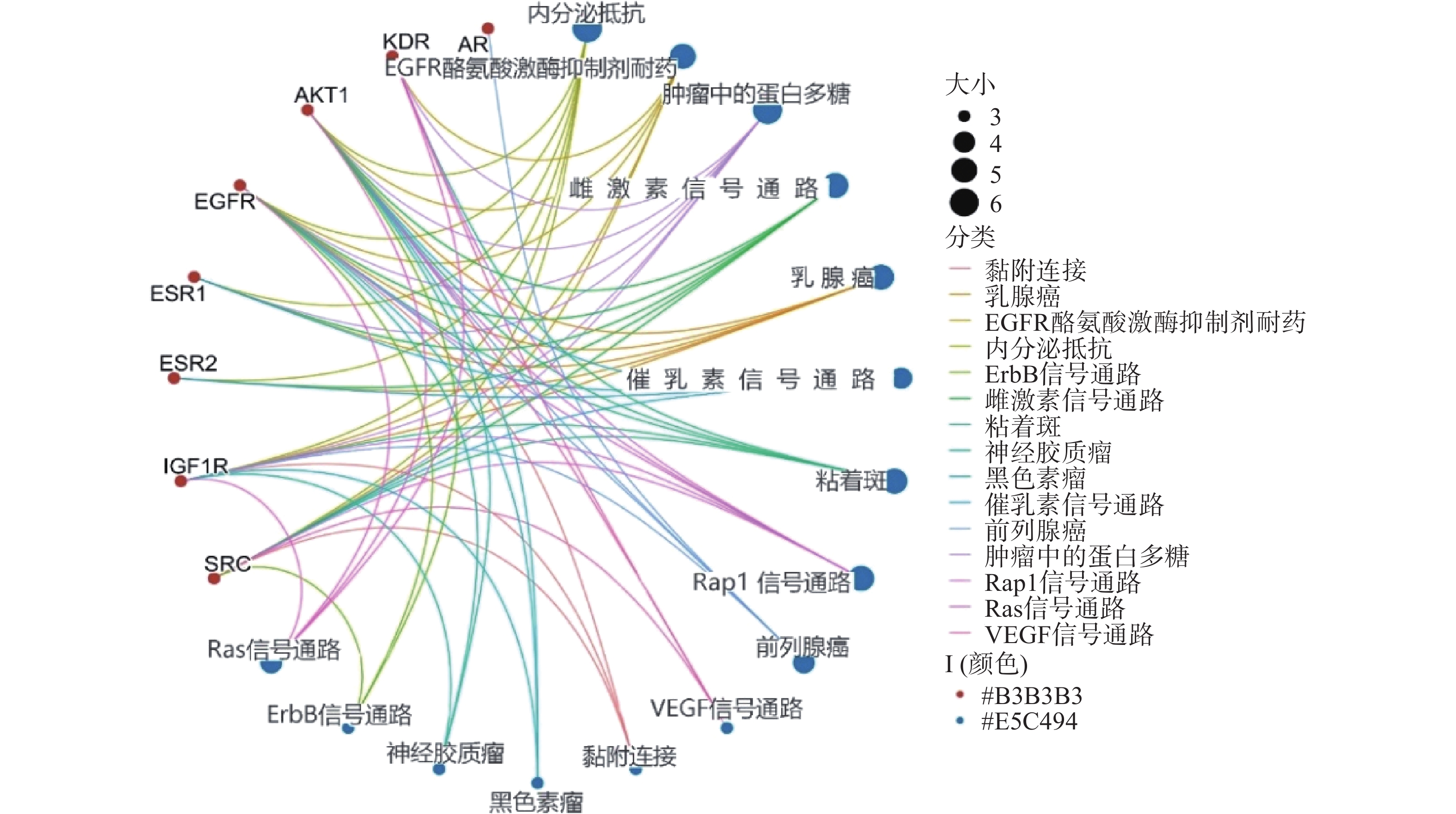
采用Hiplot在线平台对苦参关键作用靶点的KEGG信号通路进行富集分析,依据P<0.01筛选KEGG信号通路,以Gene Ratio代表目标基因中属于这个pathway的基因的数量在背景基因中所占的百分比,P 值以及调控通路上的基因个数来衡量 KEGG 富集程度,其中气泡颜色代表 P 值的大小,Gene Ratio代表富集的程度大小,气泡大小代表该通路中目标基因的数量,对前15个通路进行可视化分析,同时绘制苦参抗乳腺癌的基因-概念网络图。图5所示,按照P值从小到大富集的通路为内分泌抵抗、EGFR酪氨酸激酶抑制剂耐药、肿瘤中的蛋白多糖、雌激素信号通路、乳腺癌、催乳素信号通路、黏着斑、Rap1信号通路、前列腺癌、VEGF信号通路、黏附连接、黑色素瘤、神经胶质瘤、ErbB信号通路、Ras信号通路;各信号通路对应的靶点包括SRC、IGF1R、ESR2、ESR1、EGFR、AKT1、KDR和AR(图6)。
-
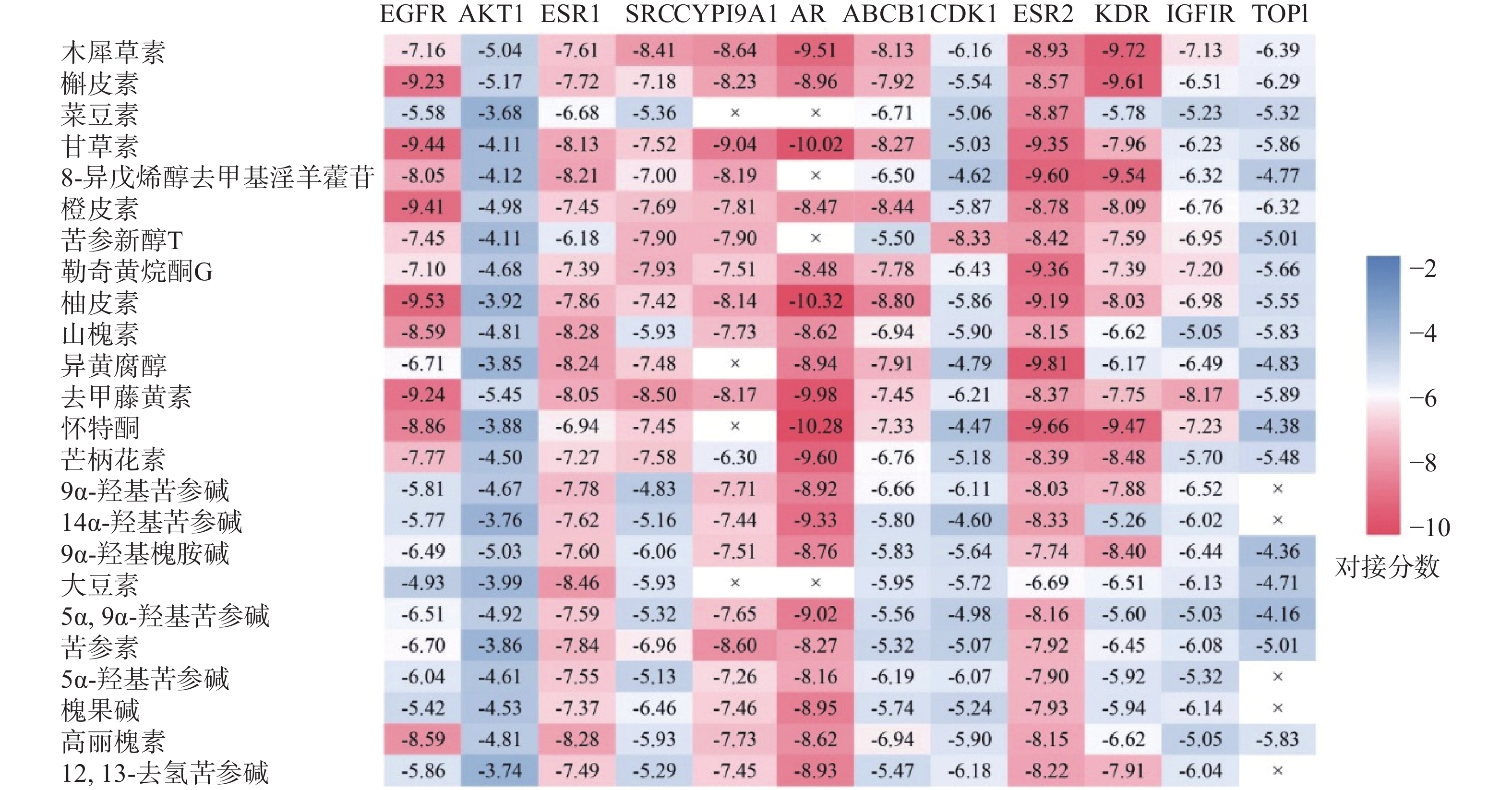
将24种核心活性成分的分子配体与12个靶点进行分子对接,得到275组分子对接数据。各靶点与核心活性成分对接能力的交叉数据如图7所示,图中红色越深,表示结合自由能越高,对接能力越强。结果显示活性成分与靶点EGFR、ESR1、CYP19A1、AR和ESR2等的对接能力较好。苦参中三种活性成分:甘草素、柚皮素和怀特酮与关键靶点AR结合的对接分数均大于10,结合能力较其他活性成分和靶点更强。
-
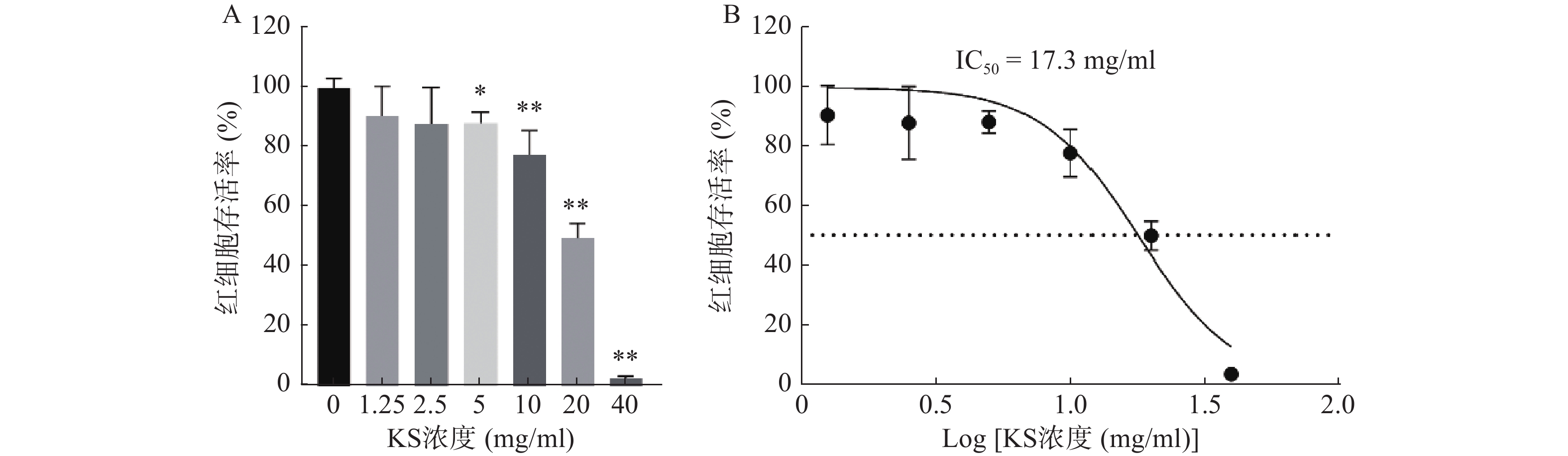
CCK8检测结果显示,MCF-7细胞的存活率随着苦参提取物(KS)浓度的增大而降低,呈现药物浓度依赖性,当KS浓度达到20 mg/ml时,MCF-7细胞的存活率约为49%(图8A);绘制KS对MCF-7细胞作用的IC50曲线,计算IC50值约为17.3 mg/ml(图8B)。
-
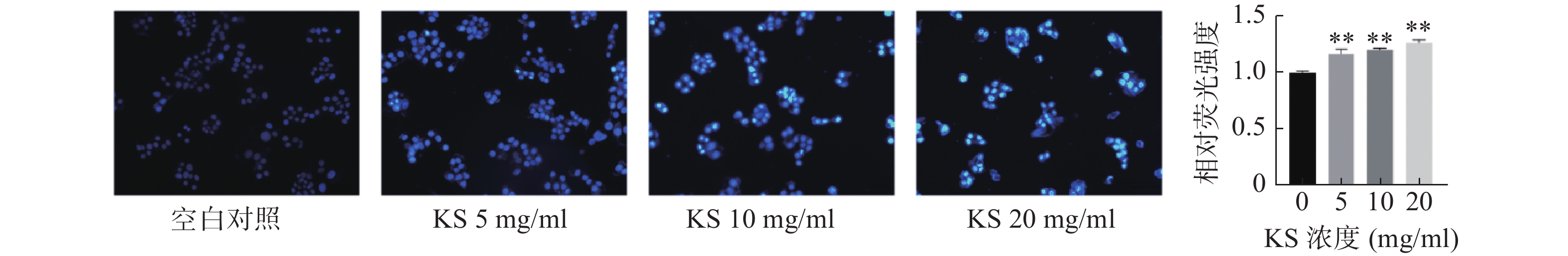
采用Hoechst33342荧光染色观察细胞凋亡形态变化,空白对照组的MCF-7细胞生长状态良好,细胞膜和细胞核形态正常,细胞核呈现均匀的淡蓝色弥散的荧光,未观察到明显凋亡的细胞形态;KS各浓度组Hoechst33342荧光强度较空白对照组显著增强(P<0.01),细胞形态发生变化,细胞数量略有减少,细胞呈不规则膨胀或皱缩,部分细胞膜破裂,细胞核呈碎块状致密浓染,且当KS浓度为20 mg/ml时,细胞凋亡特征最为明显,凋亡数量明显增加,荧光强度最强呈现蓝白色,表明 KS可诱导乳腺癌MCF-7细胞凋亡(图9)。
-
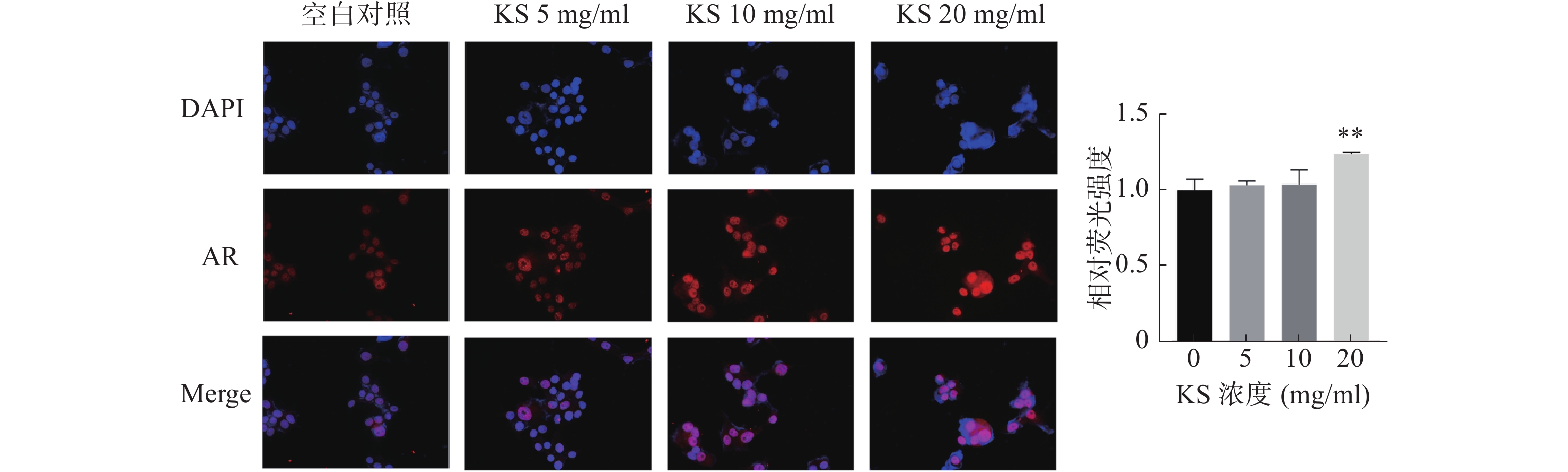
为验证苦参作用靶点的分子对接结果,采用免疫荧光染色检测MCF-7细胞内AR蛋白定位和表达水平。采用DAPI对细胞核进行染色,发现AR定位在细胞核内。与对照组相比,20 mg/ml 的KS浓度组,AR荧光强度显著最强(P<0.01),提示KS可显著上调AR蛋白的表达水平,与分子对接的结果一致(图10)。
-
乳腺癌在《妇人大全良方》《本草纲目》等中医古籍属“乳岩”“乳石痈”的范畴,由于肝伤失其条达,气血瘀滞,热毒结滞于乳中而发病。热毒是导致恶性肿瘤发生发展的主要原因,脏腑经络、气血津液受热毒侵犯是恶性肿瘤发生发展的关键[8]。扶正和祛邪是中药在肿瘤综合治疗过程中的两个重要环节,祛邪类药物主要以清热解毒、软坚散结、活血化瘀等功效为主,具有诱导细胞分化、促进细胞凋亡、逆转多药耐药、抗侵袭转移等多方面的作用[9]。因此,清热解毒属祛邪的范畴,可作为乳腺癌的主要治法之一。苦参具有清热燥湿、杀虫、利尿之功效,在传统医学中主要用于治疗湿热黄疸、泻痢、皮肤瘙痒等病症。现代药理学研究表明,苦参具有抗氧化、抗炎、抗心律失常、平喘、抗溃疡和抗肿瘤等多种药理活性[10]。在抗肿瘤方面的研究显示,苦参及其制剂在抗肿瘤、减轻化疗不良反应和逆转肿瘤耐药方面均发挥重要作用。
本研究构建的苦参-核心活性成分-靶点网络发现苦参抗乳腺癌的核心成分有24种,主要为黄酮类和生物碱类。靶点EGFR、AKT1、ESR1、SRC、CYP19A1、AR、ABCB1、CDK1、ESR2、KDR、IGF1R和TOP1在苦参抗乳腺癌中发挥了重要作用。EGFR 属于受体酪氨酸激酶的 ErbB 家族成员,几乎在所有亚型的乳腺癌患者中常过度表达[11]。本研究发现苦参最核心的作用靶点为EGFR。EGFR表达增加与乳腺癌的发生发展有关,可通过激活Ras-Raf-MEK-ERK、PI3K-Akt-mTOR 和 Src-STAT3 通路来发挥作用[12-13]。有研究显示EGFR介导的β-连环蛋白核蓄积对于AKT1抑制诱导的乳腺癌转移至关重要[14]。AKT1属于AKT家族成员,是本研究显示的苦参作用的关键靶点之一。有研究表明AKT1和细胞周期蛋白D1(Cyclin D1)之间存在交叉调节,两者在不同亚型乳腺癌中的表达呈正相关性,且在Luminal A、Luminal B和三阴性乳腺癌中的相关性最强[15-16]。基于二代测序分析显示,AKT1基因突变与原发性乳腺癌相比在转移性乳腺癌中显著富集,并被明确为可调控的靶点[17-18]。目前,已有多种靶向AKT的小分子抑制剂正在进行临床试验,可能为包括三阴性乳腺癌在内的难治性乳腺癌患者带来新的希望[19]。但AKT1抑制乳腺癌转移的具体机制和下游信号通路尚不完全清楚[20-21]。而单纯的AKT抑制剂作为抗癌药物可能带来争议,如药物开发难度大价格昂贵,对靶点的选择特异性问题导致的不良反应包括高血糖、腹泻、皮疹及可能出现的其他不利因素[22-23]。而AKT抑制剂 Capivasertib(AZD5363)在AKT1突变肿瘤患者中表现出显著的临床意义,特别是对于ER阳性的乳腺癌患者[24];同样,AKT抑制剂GDC-0068在三阴性乳腺癌中与紫杉醇联用也延长了患者的无进展生存期[25]。本研究中显示的苦参中核心活性成分对AKT1的靶向性可能为乳腺癌患者治疗药物的开发带来新的思路。
内分泌治疗在ER阳性乳腺癌患者的治疗中占有举足轻重的地位,该疗法包括选择性雌激素受体调节剂(SERMs),选择性雌激素受体抑制剂(SERDs)和芳香化酶抑制剂(AIs)。ESR1基因是编码ER的基因,在ER阳性乳腺癌中存在ESR1基因突变、扩增和融合,但扩增和融合的频率远低于点突变且与耐药的相关性仍不明确[26]。药物靶点本身的突变通常是肿瘤逃避药物作用的优先机制,ESR1突变已成为内分泌抵抗的关键机制,近年来研究发现ESR1配体结合域(LBD)的突变是 ER阳性转移性乳腺癌耐药的常见驱动因素[27]。这些LBD点突变可通过不依赖激素的ER转录活性,直接导致乳腺癌对AI的抗性并降低对他莫昔芬和氟维司群的敏感性[28]。而雄激素受体(AR)在ER阳性的乳腺癌中的作用一直以来都存在争议,最新的研究显示,AR通过改变ER和关键转录共激活因子的基因组分布,在内分泌抵抗的ER阳性乳腺癌中发挥抑癌作用,并支持AR激动剂作为ER阳性乳腺癌的治疗策略[29]。此外,研究者采用中药方剂治疗三阴性乳腺癌患者,发现AR阳性的三阴性乳腺癌患者预后优于AR阴性患者[30]。但目前尚无AR激动剂被用于乳腺癌的治疗,且苦参作为具有多靶点作用的中药,与AR特异性抑制剂的作用机制存在一定差异。本研究发现内分泌抵抗是苦参抗乳腺癌最核心的通路,分子对接的结果显示主要活性成分与靶点AR的结合能最高。在体外细胞实验中,发现苦参提取物可显著抑制ER表达阳性的人乳腺癌MCF-7细胞增殖,诱导细胞凋亡,上调AR蛋白的表达,进一步验证了分子对接的结果,提示苦参对AR的上调可能成为治疗乳腺癌新的治疗策略,为乳腺癌新的治疗方案提供理论依据。
综上所述,本研究通过网络药理学发现苦参核心成分的主要靶点包括AKT1、ESR1、CYP19A1和AR等,提示苦参可能通过多靶点增强乳腺癌对内分泌治疗的敏感性。分子对接的结果显示苦参核心成分与AR的结合能力最强,体外实验也验证了苦参对AR表达的上调作用,提示苦参对AR的上调可能成为治疗乳腺癌新的治疗策略。但本研究还存在一定的局限性,如本研究以单味中药苦参作为研究对象分析其抗乳腺癌的活性成分和作用机制,而以苦参为主要组分的中药复方或中成药在临床中的应用更为常见,其他辅助中药也可能会发挥协同抗乳腺癌的作用。此外,本研究以网络药理学的方法分析苦参抗乳腺癌的作用机制,这些研究结果还需要更多的基础实验和临床研究来进一步验证。
Potential mechanism of Sophora flavescens against breast cancer via network pharmacology and molecular docking
-
摘要:
目的 采用网络药理学和分子对接的方法分析苦参抗乳腺癌的主要活性成分及潜在分子机制。 方法 采用TCMSP、ETCM数据库和查阅国内外文献收集筛选苦参化学成分,通过Swiss Target Prediction 数据库对有效活性成分的靶点进行预测,通过GeneCards、TTD、Drugbank、OMIM收集乳腺癌相关靶点,根据Venny 2.1.0软件筛选出苦参抗乳腺癌疾病靶点;采用Cytoscape软件构建苦参-核心活性成分-靶点网络图,用 STRING数据库分析共有靶点,构建PPI网络图,通过DAVID数据库和Hiplot平台对关键靶点蛋白进行GO功能富集分析和KEGG通路富集分析,并采用Schrodinger软件对活性成分与靶点进行分子对接,同时采用分子生物学方法对关键靶点进行验证。 结果 从苦参中共筛选出结构明确的活性成分36个,筛选出70个苦参抗乳腺癌的疾病靶点,其中EGFR、AKT1、ESR1、SRC、CYP19A1、AR、ABCB1等12个核心靶点参与乳腺癌中内分泌抵抗、EGFR酪氨酸激酶抑制剂耐药、雌激素等信号通路,且核心成分与关键靶点AR之间的结合能最高。体外细胞实验显示,苦参提取物可抑制乳腺癌细胞的增殖,诱导细胞凋亡,上调AR蛋白的表达。 结论 苦参通过多成分作用于多靶点和多个信号通路,调节复杂的生物过程发挥抗乳腺癌的作用,苦参对AR蛋白的上调可能成为治疗乳腺癌新的治疗策略。 Abstract:Objective To analyze the main active components and potential molecular mechanism of Sophora flavescens against breast cancer based on network pharmacology and molecular docking. Methods The chemical constituents were collected and screened by TCMSP, ETCM database and literature review. The targets of active ingredients were predicted by Swiss Target Prediction database. Breast cancer-related targets were collected by GeneCards, TTD, Drugbank and OMIM. The anti-breast cancer targets of Sophora flavescens were screened by Venny 2.1.0 software. Cytoscape software was used to construct the network diagram of Sophora flavescens-key active ingredients-targets. STRING database was used to analyze the common targets, and PPI network diagram was constructed. GO function enrichment analysis and KEGG pathway enrichment analysis of key target proteins were performed by DAVID database and Hiplot online platform. Schrodinger software was used to calculate the molecular docking between the active ingredients and targets. Molecular biological methods were used to verify the key targets. Results A total of 36 active components with clear structures were screened from Sophora flavescens. 70 anti-breast cancer targets of Sophora flavescens were screened out. 12 core targets including EGFR, AKT1, ESR1, SRC, CYP19A1, AR and ABCB1 participate in endocrine resistance, EGFR tyrosine kinase inhibitors and estrogen signaling pathways in breast cancer. Moreover, the docking score between the core component and the key target AR is the highest. In vitro experiments showed that the extract of Sophora flavescens can inhibit the proliferation of breast cancer cells, induce cell apoptosis and up-regulate AR protein expression. Conclusion It was revealed that Sophora flavescens plays an anti-breast cancer role by regulating complex biological processes through multiple components acting on multiple targets and signaling pathways. The upregulation of AR protein by Sophora flavescens may become a new therapeutic strategy for the treatment of breast cancer. -
Key words:
- Sophora flavescens /
- breast cancer /
- network pharmacology /
- molecular docking /
- androgen receptor
-
山楂为蔷薇科植物山里红Crataegus pinnatifida Bge. var. major N. E. Br. 或山楂 Crataegus pinnati- fida Bge. 的干燥成熟果实,焦山楂为其炒制品[1]。现代药理研究证明,焦山楂抑菌作用强于生山楂,而某些特定菌群与消化功能密切相关[2]。而山楂炒焦后产生新的物质—类黑素,类黑素是在食品热处理过程中形成的。目前,类黑素的抗菌活性已得到证实。大多数类黑素对微生物作用的研究都是在特定的微生物生长培养基中进行的,这些研究表明类黑素可以刺激微生物生长[3],也可以抑制微生物生长[4-5]。肠道菌群与人体健康密切相关,药物和功能食品可能通过调节肠道微生物来改善胃肠功能,帮助消化[6-7]。双歧杆菌和大肠杆菌是典型的有益菌和有害菌,双歧杆菌常被加入酸奶饮品中帮助消化。乙酸是双歧杆菌的主要代谢物质,随着乙酸的增多,pH值降低从而抑制大肠杆菌的生长繁殖。本实验通过研究山楂,焦山楂以及焦山楂炒制过程中产生的类黑素对大肠杆菌、双歧杆菌以及其代谢物乙酸的影响,探究“山楂炒焦长于消食导滞”的作用机制。
1. 材料与方法
1.1 材料
1.1.1 实验仪器
低温培养箱(美墨尔特有限公司,德国),生物安全柜(赛默飞世尔科技公司,美国),高压灭菌锅(三洋公司,日本),纯水机(密理博公司,美国),厌氧罐(北京陆桥技术股份有限公司,北京);紫外可见分光光度计(上海佑科仪器仪表有限公司,上海);7890B型气相色谱仪(安捷伦科技有限公司,美国);HP-FFAP型毛细管柱(货号:19091F-413,安捷伦科技有限公司,美国);GM900型非接触红外测温仪(深圳聚茂源科技有限公司,深圳)。
1.1.2 实验试剂
MRS固体培养基、PYG液体培养基、厌氧产气袋和厌氧指示剂(北京陆桥技术股份有限公司);蛋白胨、酵母粉(英国OXOID公司);乙酸(98.85%,国药集团化学试剂有限公司,中国);其余试剂均为分析纯。
1.1.3 山楂和实验菌株
净山楂饮片(四川同善堂中药饮片有限责任公司,批号:180501);双歧杆菌(GDMCC1.1258)、大肠杆菌(ATCC25922)(中国科学院微生物研究所)。
1.2 方法
1.2.1 焦山楂的炮制
参照2015版《中国药典》一部山楂项下制备焦山楂。取生山楂150 g,中火(380~420)℃炒制10 min,至药材表面呈焦黄或焦褐色,内部颜色加深,并具有焦香气味,取出,常温封存,即得。
1.2.2 生山楂,焦山楂和类黑素浸膏的制备
(1)生山楂和焦山楂浸膏的制备
取生山楂和焦山楂各100 g进行水浸提,料液比为1:15,浸提8 h,浸提2次。生山楂和焦山楂浸提液分别在4 ℃下以3 600 r/min离心10 min,取上层清液各1 000 ml。将500 ml上层清液进行蒸发浓缩至胶状,停止加热,余温使其自然干燥,得生山楂浸膏13.75 g,焦山楂浸膏14.02 g。
(2)焦山楂中类黑素的提取
取焦山楂100 g,按照“1.2.2”项中⑴的方法提取得到1 000 ml上层清液。取500 ml上层清液蒸发浓缩得棕褐色浓缩液50 ml,进行大孔树脂吸附,室温吸附流速1.5 ml/min,60%乙醇作为洗脱剂,洗脱至色谱柱上无棕色为止,收集洗脱液500 ml。洗脱液蒸发浓缩至胶状,停止加热,余温使其自然干燥,得焦山楂类黑素浸膏13.12 g。
(3)类黑素的紫外检测
取类黑素浸膏1 g,蒸馏水溶解定容至100 ml,取10 ml溶液,分别定容至50 ml;因波长420 nm处是类黑素的特征吸收波长,测其特征吸收下的吸光度值,焦山楂类黑素浸膏吸光度值为0.492,说明焦山楂中类黑素提取成功。
1.2.3 山楂炮制品及类黑素对肠道菌群生长繁殖的影响
(1)双歧杆菌测试菌菌液的制备
以接种环自双歧杆菌标准菌种管挑取菌种,划线接种至MRS固体培养基,36 ℃厌氧培养48 h,挑取单菌落接种至PYG液体培养基,36 ℃厌氧培养48 h,以生理盐水调整浓度至1.0麦氏浓度,作为受试菌初始菌液,按10:1浓度加入试验体系。
(2)大肠杆菌测试菌液的制备
以接种环自大肠杆菌标准菌种管挑取菌种,划线接种至LB固体培养基(配方:蛋白胨10 g,酵母粉5 g,氯化钠10 g,琼脂粉15 g,加入1 L蒸馏水,以5 mol/L氢氧化钠调节pH至7.0,121 ℃高压灭菌15 min备用),36 ℃有氧培养24 h,挑取单菌落接种至LB液体培养基(配方:蛋白胨10 g,酵母粉5 g,氯化钠10 g,加入1 L蒸馏水,以5 mol/L氢氧化钠调节pH至7.0,121 ℃高压灭菌15 min备用),36 ℃有氧培养6 h,以生理盐水调整浓度至0.5麦氏浓度,作为受试菌初始菌液,按10:1浓度加入试验体系。
(3)样本药液的处理
准确称取生山楂,焦山楂和类黑素浸膏各10 g,加入100 ml去离子水,超声振荡处理,期间手动震摇数次,直至样本完全溶解,配制10%母液,并经115 ℃高压灭菌处理15 min后4 ℃保存备用。
(4)乙酸含量测定
①样本前处理:将经过微生物培养的溶液1 ml,经过高速离心机4 000 r/min离心,之后再过0.2 µm有机相滤头于进样瓶,样品量大于0.5 ml,或者使用内插管,上机测定。
②标准溶液及标准曲线:称取60.05 g乙酸于100 ml容量瓶,用一级水定容至刻度,摇匀,作为储备标准溶液,浓度为101.33 mmol/L。将标准储备溶液依次稀释1、3、10、20、100、200倍得标准工作溶液。
③色谱条件:洗针液为甲醇,进样量0.5 µl,进样口温度240 ℃;压力6.1219 psi;分流比10:1,流量为1.0 ml;升温程序:初始温度:100 ℃,保持0 min;梯度一:以5 ℃/min升到120 ℃,保持0 min;梯度二:以20 ℃/min升到200 ℃,保持10 min;总运行时间:18 min;检测器(FID)温度:240 ℃;空气流量:300 ml/min;氢气流量:33 ml/min;尾吹氮气流量:20 ml/min;数据采集频率/峰宽:20 Hz/0.01 min。
1.3 统计学方法
使用SPSS 22.0进行独立样本t检验,数据以平均数±标准差(
$\bar x \pm s$ )表示,P<0.05认为存在显著性差异。2. 结果
2.1 乙酸标准曲线的建立
乙酸浓度在0.51~101.33 mmol/L线性关系良好。以乙酸峰面积(Y)为纵坐标,乙酸含量(X)为横坐标,绘制标准曲线,得到线性回归方程为Y=3.670 5X−4.300 8,r=0.999 0,残留标准误差为6.644 2,如图1所示。
2.2 山楂饮片及类黑素对双歧杆菌体外生长的影响
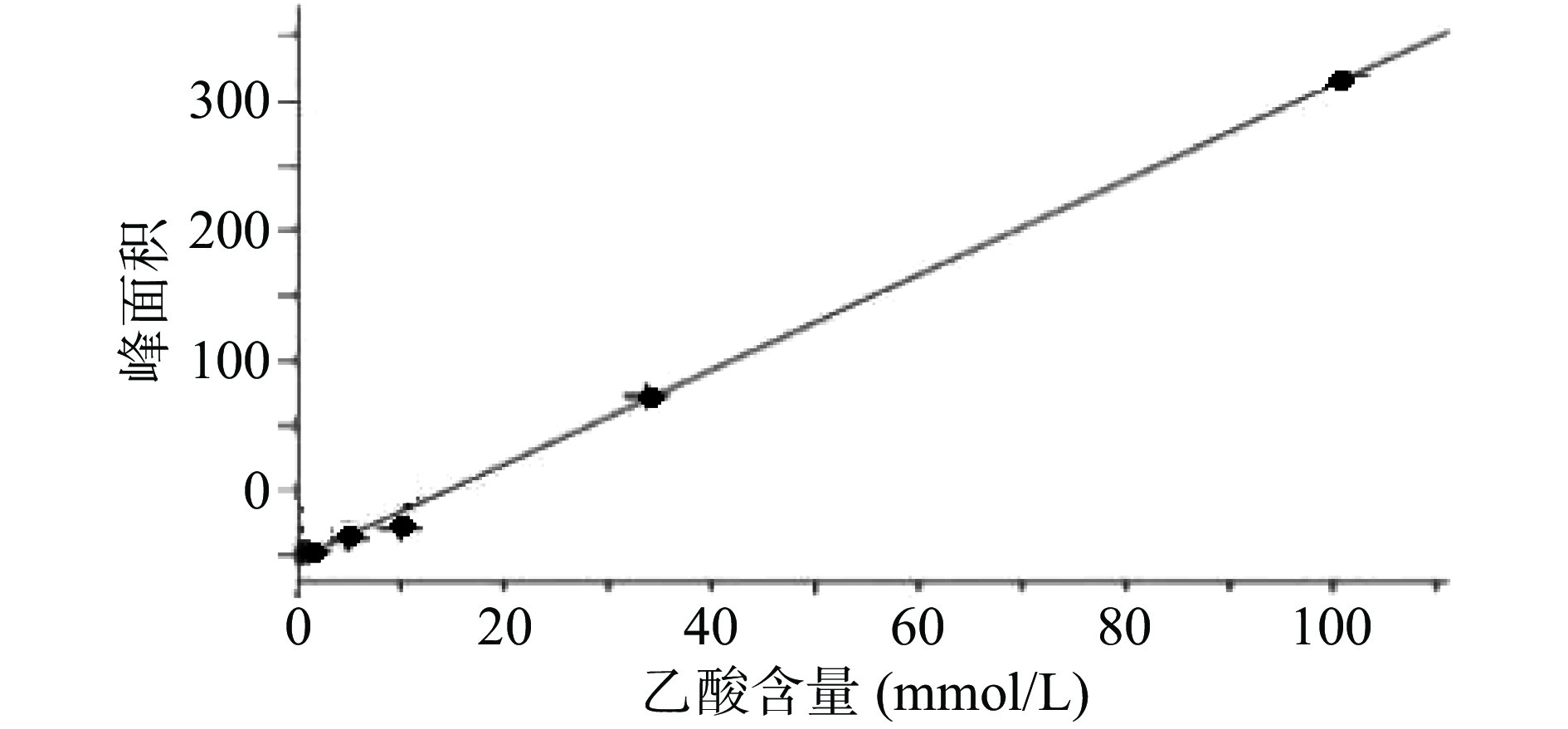
生山楂和焦山楂加速生长期双歧杆菌的生长繁殖,达稳定期后,由于生山楂中多种物质被分解,菌群产生大量代谢废物,于衰亡期加速双歧杆菌的衰亡;由于焦山楂中多种物质被分解,菌群产生大量代谢废物,于衰亡期加速双歧杆菌的衰亡;但因焦山楂中存在类黑素且其他物质较少,衰亡速率慢于生山楂组;类黑素加速生长期双歧杆菌的生长繁殖,但由于无其他物质,其生长速率慢于生山楂组,但在衰亡期中明显改变双歧杆菌生长规律,使生长期延长(生长速率变缓),双歧杆菌衰亡延后,如图2。
2.3 山楂饮片及类黑素对大肠杆菌体外生长的影响
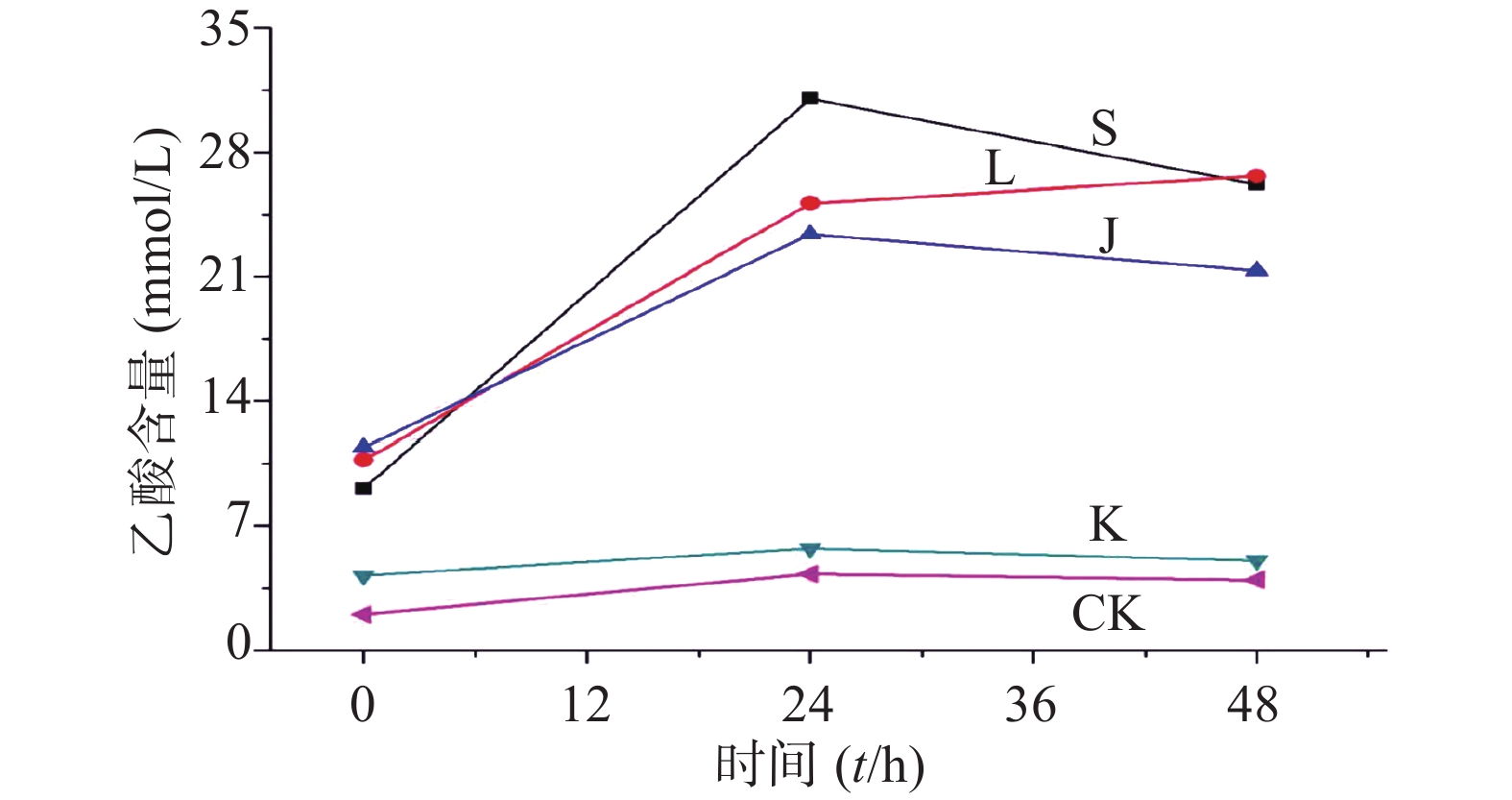
生山楂促进大肠杆菌生长期前期的生长繁殖,但由于代谢废物的逐渐增加,乙酸堆积,使生长速率逐渐变缓;焦山楂促进大肠杆菌生长期前期的生长繁殖,但由于类黑素及代谢废物的影响使生长期变短,稳定期提前;类黑素对大肠杆菌生长期前期无明显影响,但生长期后期明显促进大肠杆菌的生长繁殖,如图3所示。
3. 讨论
3.1 焦山楂炮制工艺研究
《中国药典》一部中对焦山楂炮制方法为:取净山楂,中火条件下炒至药材表面焦褐色,内部焦黄色,并具有焦香气味。因无可控工艺参数,焦山楂炮制过程中易出现饮片表面以及内部颜色不均一,山楂炒制成品质量不稳定等情况。结合课题组前期实验,采用分别100、150、200和250 g净山楂为炮制对象,中火条件为(340~380)℃、(380~420)℃和(420~460)℃,炮制时间为8、10、12和14 min;不同质量同一批号的净山楂在不同的中火条件下炮制不同的时间,采用非接触式红外测温仪检测炒制温度,并以炒锅初温和山楂药材炒制末温辅助控温。实验筛选出150 g净山楂中火条件(380~420)℃下炒制10 min,可得到质量稳定,颜色均一的焦山楂。
3.2 焦山楂类黑素提取工艺研究
类黑素的提取方法主要是水浸提法,Borrelli等[8]在90 ℃条件下,采用1:6料液比,对咖啡中的类黑素进行水提;Langner等[9]在室温条件下采用1:12料液比,水浸提1 h,提取到土豆类黑素粗制品。类黑素成分复杂,提纯困难。目前,主要的纯化方法有大孔树脂、超滤和凝胶层析等方法。何健[10]等发现X-5大孔树脂是曲霉型豆豉类黑素的最佳吸附树脂。秦礼康等[11]利用S-8树脂分离得到豆豉两个类黑素组分。本实验在水浸提法的基础上进行改良,最终获得最优提取工艺。结果显示类黑色素在420 nm处有较强吸收[12]。
3.3 气相色谱条件的筛选
实验采用气相色谱法检测菌群代谢物乙酸的含量。参照文献[13-14],结果显示其色谱条件对于本样品分析效果不佳;在柱温选择中,恒温法对乙酸检测效果不理想,峰形不稳定,因此实验采取梯度升温。经反复试验,最终获得正文中的检测参数,分离效果好,可作为本实验乙酸检测条件。
-
表 1 苦参中36种活性化合物基本信息
分子编号 化合物名称 分子式 OB(%) DL MOL006596 大豆素 C20H18O5 97.27 0.76 MOL000456 菜豆素 C20H18O4 78.20 0.73 MOL001484 高丽槐素 C16H12O5 75.18 0.54 MOL004941 甘草素 C15H12O4 71.12 0.18 MOL000392 刺芒柄花素 C16H12O4 69.67 0.21 MOL006565 异苦参碱 C15H24N2O 68.68 0.25 MOL003648 山槐素 C16H12O5 65.83 0.54 MOL003627 槐果碱 C15H22N2O 64.26 0.25 MOL005944 苦参碱 C15H24N2O 63.77 0.25 MOL006627 12,13-去氢苦参碱 C15H22N2O 62.23 0.25 MOL006571 安纳基林 C15H20N2O 62.01 0.24 MOL006626 勒奇黄烷酮 G C20H20O6 60.97 0.40 MOL003680 槐定碱 C15H24N2O 60.07 0.25 MOL006566 12,13-去氢苦参碱 C15H22N2O 58.34 0.25 MOL006649 5α-羟基苦参碱 C15H24N2O2 55.42 0.28 MOL006630 去甲藤黄素 C15H10O6 54.93 0.24 MOL006628 白羽扇豆碱 C15H24N2O 52.71 0.24 MOL006623 苦参新醇 T C25H30O7 51.28 0.64 MOL006650 三叶豆紫檀苷丙二酸酯 C25H24O13 48.69 0.52 MOL006652 三叶豆紫檀苷 C22H22O11 48.53 0.74 MOL006604 异黄腐醇 C21H22O5 48.09 0.39 MOL005100 橙皮素 C16H14O6 47.74 0.27 MOL006613 苦参素 C16H14O5 47.62 0.38 MOL000098 槲皮素 C15H10O7 46.43 0.28 MOL003347 贯叶金丝桃素 C35H52O4 44.03 0.60 MOL003673 怀特酮 C20H18O5 42.80 0.36 MOL006622 苦参新醇 O C27H30O13 42.41 0.76 MOL001040 柚皮素 C15H12O5 42.36 0.21 MOL003676 槐胺碱 C15H20N2O 42.16 0.25 MOL006582 5α,9α-二羟基苦参碱 C15H24N2O3 40.93 0.32 MOL003542 8-异戊烯醇去甲基淫羊藿苷 C20H18O6 38.04 0.39 MOL006569 14β-羟基苦参碱 C15H24N2O2 37.26 0.29 MOL000006 木犀草素 C15H10O6 36.16 0.25 MOL006561 14α-羟基苦参碱 C15H24N2O2 35.73 0.29 MOL006570 9α-羟基槐胺碱 C15H22N2O2 35.23 0.29 MOL006563 9α-羟基苦参碱 C15H24N2O2 32.04 0.29 表 2 核心靶点及其拓扑参数
靶点 蛋白名称 度 介数 紧密度 EGFR 表皮生长因子受体 16 1.28×10−1 7.86×10−1 AKT1 丝氨酸/苏氨酸蛋白激酶 1 16 1.28×10−1 7.86×10−1 ESR1 雌激素受体 α 15 1.45×10−1 7.59×10−1 SRC 非受体酪氨酸激酶 Src 14 1.58×10−1 7.33×10−1 CYP19A1 细胞色素P450酶 19A1 11 0.95×10−1 6.47×10−1 AR 雄激素受体 10 0.32×10−1 6.47×10−1 ABCB1 ATP结合盒B亚家族成员1 9 0.65×10−1 6.11×10−1 CDK1 周期素依赖性激酶1 8 0.97×10−1 5.95×10−1 ESR2 雌激素受体β 8 0.18×10−1 5.95×10−1 KDR 血管内皮生长因子受体2 8 0.12×10−1 5.95×10−1 IGF1R 胰岛素样生长因子1受体 8 0.08×10−1 5.95×10−1 TOP1 DNA拓扑异构酶1 6 0.08×10−1 5.64×10−1 -
[1] SIEGEL R, MILLER K, WAGLE N S, et al. Cancer statistics, 2023[J]. CA Cancer J Clin, 2023, 73: 17-48. doi: 10.3322/caac.21763 [2] ZHANG X Y, QIU H, LI C S, et al. The positive role of traditional Chinese medicine as an adjunctive therapy for cancer[J]. Biosci Trends, 2021, 15(5): 283-298. doi: 10.5582/bst.2021.01318 [3] GREENLEE H, DUPONT-REYES M J, BALNEAVES L G, et al. Clinical practice guidelines on the evidence-based use of integrative therapies during and after breast cancer treatment[J]. CA Cancer J Clin, 2017, 67(3): 194-232. doi: 10.3322/caac.21397 [4] CHEN M H, GU Y Y, ZHANG A L, et al. Biological effects and mechanisms of matrine and other constituents of Sophora flavescens in colorectal cancer[J]. Pharmacol Res, 2021, 171: 105778. doi: 10.1016/j.phrs.2021.105778 [5] 李梢. 基于生物网络调控的方剂研究模式与实践[J]. 中西医结合学报, 2007, 5(5): 489-493. [6] 林玲, 吴勤研, 宋熙薇. 基于网络药理学的康艾注射液抗非小细胞肺癌作用机制分析[J]. 药学与临床研究, 2021, 29(2): 86-91. [7] WANG Y X, ZHANG S, LI F C, et al. Therapeutic target database 2020: enriched resource for facilitating research and early development of targeted therapeutics[J]. Nucleic Acids Res, 2020, 48(D1): D1031-D1041. [8] 李华华, 杨峰, 裴俊文, 等. 杨峰教授在清热解毒理论指导下运用复方苦参注射液治疗恶性肿瘤经验[J]. 中医研究, 2021, 34(7): 74-76. [9] 李佳鑫, 王冰, 于淼. 基于“扶正祛邪”治则的中药抗肿瘤作用机制的研究进展[J]. 中草药, 2021, 52(18): 5751-5757. [10] LI J J, ZHANG X, SHEN X C, et al. Phytochemistry and biological properties of isoprenoid flavonoids from Sophora flavescens Ait[J]. Fitoterapia, 2020, 143: 104556. doi: 10.1016/j.fitote.2020.104556 [11] MASUDA H, ZHANG D W, BARTHOLOMEUSZ C, et al. Role of epidermal growth factor receptor in breast cancer[J]. Breast Cancer Res Treat, 2012, 136(2): 331-345. doi: 10.1007/s10549-012-2289-9 [12] BURNESS M L, GRUSHKO T A, OLOPADE O I. Epidermal growth factor receptor in triple-negative and basal-like breast cancer: promising clinical target or only a marker?[J]. Cancer J, 2010, 16(1): 23-32. doi: 10.1097/PPO.0b013e3181d24fc1 [13] NAKAI K, HUNG M C, YAMAGUCHI H. A perspective on anti-EGFR therapies targeting triple-negative breast cancer[J]. Am J Cancer Res,2016,6(8):1609-1623. [14] LI W, HOU J Z, NIU J, et al. Akt1 inhibition promotes breast cancer metastasis through EGFR-mediated β-catenin nuclear accumulation[J]. Cell Commun Signal, 2018, 16(1): 82. doi: 10.1186/s12964-018-0295-1 [15] GAO F, ALWHAIBI A, SABBINENI H, et al. Suppression of Akt1-β-catenin pathway in advanced prostate cancer promotes TGFβ1-mediated epithelial to mesenchymal transition and metastasis[J]. Cancer Lett, 2017, 402: 177-189. doi: 10.1016/j.canlet.2017.05.028 [16] CHEN K, JIAO X M, ROCCO A D, et al. Endogenous cyclin D1 promotes the rate of onset and magnitude of mitogenic signaling via Akt1 Ser473 phosphorylation[J]. Cell Rep, 2020, 32(11): 108151. doi: 10.1016/j.celrep.2020.108151 [17] GEELEN C T, SAVAS P, TEO Z L, et al. Clinical implications of prospective genomic profiling of metastatic breast cancer patients[J]. Breast Cancer Res, 2020, 22(1): 1-13. doi: 10.1186/s13058-019-1178-0 [18] DOSSOU A S, BASU A. The emerging roles of mTORC1 in macromanaging autophagy[J]. Cancers, 2019, 11(10): 1422. doi: 10.3390/cancers11101422 [19] SCHMID P, ABRAHAM J, CHAN S, et al. Capivasertib plus paclitaxel versus placebo plus paclitaxel as first-line therapy for metastatic triple-negative breast cancer: the PAKT trial[J]. J Clin Oncol, 2020, 38(5): 423-433. doi: 10.1200/JCO.19.00368 [20] LI C W, XIA W Y, LIM S O, et al. AKT1 inhibits epithelial-to-mesenchymal transition in breast cancer through phosphorylation-dependent Twist1 degradation[J]. Cancer Res, 2016, 76(6): 1451-1462. doi: 10.1158/0008-5472.CAN-15-1941 [21] LIU H, RADISKY D C, NELSON C M, et al. Mechanism of Akt1 inhibition of breast cancer cell invasion reveals a protumorigenic role for TSC2[J]. Proc Natl Acad Sci U S A, 2006, 103(11): 4134-4139. doi: 10.1073/pnas.0511342103 [22] HANKER A B, KAKLAMANI V, ARTEAGA C L. Challenges for the clinical development of PI3K inhibitors: strategies to improve their impact in solid tumors[J]. Cancer Discov, 2019, 9(4): 482-491. doi: 10.1158/2159-8290.CD-18-1175 [23] VERNIERI C, CORTI F, NICHETTI F, et al. Everolimus versus alpelisib in advanced hormone receptor-positive HER2-negative breast cancer: targeting different nodes of the PI3K/AKT/mTORC1 pathway with different clinical implications[J]. Breast Cancer Res, 2020, 22(1): 33. doi: 10.1186/s13058-020-01271-0 [24] HYMAN D M, SMYTH L M, DONOGHUE M T A, et al. AKT inhibition in solid tumors with AKT1 mutations[J]. J Clin Oncol, 2017, 35(20): 2251-2259. doi: 10.1200/JCO.2017.73.0143 [25] KIM S B, DENT R, IM S A, et al. Ipatasertib plus paclitaxel versus placebo plus paclitaxel as first-line therapy for metastatic triple-negative breast cancer (LOTUS): a multicentre, randomised, double-blind, placebo-controlled, phase 2 trial[J]. Lancet Oncol, 2017, 18(10): 1360-1372. doi: 10.1016/S1470-2045(17)30450-3 [26] RAO G H, PIEROBON M, KIM I K, et al. Inhibition of AKT1 signaling promotes invasion and metastasis of non-small cell lung cancer cells with K-RAS or EGFR mutations[J]. Sci Rep, 2017, 7(1): 7066. doi: 10.1038/s41598-017-06128-9 [27] LEI J T, GOU X X, SEKER S, et al. ESR1 alterations and metastasis in estrogen receptor positive breast cancer[J]. J Cancer Metastasis Treat, 2019, 5: 38. [28] JESELSOHN R, BUCHWALTER G, ANGELIS C D, et al. ESR1 mutations—a mechanism for acquired endocrine resistance in breast cancer[J]. Nat Rev Clin Oncol, 2015, 12(10): 573-583. doi: 10.1038/nrclinonc.2015.117 [29] HICKEY T E, SELTH L A, CHIA K M, et al. The androgen receptor is a tumor suppressor in estrogen receptor-positive breast cancer[J]. Nat Med, 2021, 27(2): 310-320. doi: 10.1038/s41591-020-01168-7 [30] YU L H, YU Q H, XU C C, et al. The expression of androgen receptor in triple-negative breast cancer and the effect of a traditional Chinese medicine formula on disease-free survival[J]. Gland Surg, 2022, 11(11): 1772-1783. doi: 10.21037/gs-22-508 -





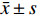
 下载:
下载:
 下载:
下载: