-
药物性肝损伤(DILI)是指由各类处方或非处方的化学药物、生物制剂、传统中药、天然药、保健品、膳食补充剂及其代谢产物或辅料所诱发的肝损伤[1]。药物性肝损伤是临床上不明原因肝损伤的重要病因。全面了解不同药物导致肝损伤的风险因素、临床特征和预后,有助于临床医生及药师及时识别、诊断和管理。国内公众对安全、合理用药的认知和意识普遍较薄弱,因此,药物性肝损伤的防治在中国已成为不容忽视的问题。由于我国人口基数庞大、临床用药种类繁杂,以及人群药物代谢酶的基因多态性,DILI的发病率有逐年上升的趋势[2]。其发病机制复杂,病理变化广泛,临床表现无特异性,且由于缺乏具有诊断意义的辅助检查手段及发病率低的原因,确诊药物性肝损伤比较困难[3]。本文旨在通过对259例DILI不良反应报告进行回顾性分析,从而为减少药物性肝损伤、提升临床用药安全提供依据。
-
收集本院2011至2021年药品不良反应报告,对其中发生药物性肝损伤的报告共259例进行统计分析。
-
本研究对纳入的不良反应报告依据因果关系评分量表(RUCAM)进行病例评价。将药物与肝损伤的因果关系分为5级:﹥8分为极可能,6~8分为很可能,3~5分为可能,1~2分为不太可能,0分为可排除[4]。
肝损伤分类:根据丙氨酸氨基转移酶(ALT),碱性磷酸酶(ALP)上升的程度,以及两者比值(R)进行分类。①肝细胞损伤型:ALT≥3 ULN,且R≥5;②胆汁淤积型:ALP≥2 ULN,且 R≤2;③混合型:ALT≥3 ULN,ALP≥2 ULN,且 2<R<5。④肝脏生化学检查异常:若 ALT 和 ALP 达不到上述标准,则称为“肝脏生化学检查异常”。R=(ALT 实测值/ALT ULN)/(ALP 实测值/ALP ULN),ULN为正常值上限[5]。
-
对药物性肝损伤的ADR报告按照患者年龄、体重、DILI分型、给药途径、药物种类、他汀类药物及剂量、抗菌药分类、转归、不良反应发生时间等进行分类登记、汇总。
-
应用Excel软件进行数据收集,SPSS 22进行统计分析。分析各分类病例数、构成比、累计构成比。依据帕累托分类原则,将影响因素分成3类:A类为主要因素,累计构成比0~<80%;B类为次要因素,累计构成比80%~90%(不含);C类为一般因素,累计构成比为90%~100%。
-
共259例药物性肝损伤患者,评价为极可能的病例22例(8.49%)、评价为很可能的病例有144例(55.60%)、评价为可能的病例93例(35.91%),均有明确肝功能异常指征且无原发性肝脏疾病,符合药物性肝病指南的诊断标准。其中,男性172人,女性87人;平均年龄(57±18.03)岁;患者平均体重(66.76±10.70)kg;合并疾病中脑血管疾病(36.29%)、心血管疾病(20.85%)、肿瘤(14.29%)较为常见。根据肝损伤分类标准,最常见的为肝细胞损伤型,共98例(37.84%);胆汁淤积型共63例(24.32%),混合型共54例(20.85%),肝脏生化学检查异常共44例(18.99%)。详见表1。
表 1 药物性肝损伤患者一般情况
特征 例数 占比(%) 性别 男 172 66.41 女 87 33.59 合并疾病 脑血管疾病 94 36.29 心血管疾病 54 20.85 肿瘤 37 14.29 感染 36 13.9 自身免疫相关疾病 11 4.25 肾功能不全 7 2.7 其他 19 7.34 分型 肝细胞损伤型 98 37.84 胆汁淤积型 63 24.32 混合型 54 20.85 肝脏生化学检查异常 44 18.99 将259例药物性肝损伤的患者按不同年龄段降序排列,并分别计算构成比和累计构成比,其中65岁以上老年人占比最高(30.50%),年龄﹥45岁者累计构成比为195例(75.29%),为主要因素,详见表2。
表 2 药物性肝损伤患者年龄分布
年龄(岁) 例数 构成比(%) 累计构成比(%) 因素类型 >65 79 30.50 30.50 A 56~65 68 26.25 56.75 A 46~55 48 18.53 75.28 A 36~45 30 11.58 86.87 B 26~35 22 8.49 95.37 C 15~25 11 4.25 99.61 C <15 1 0.39 100 C 合计 259 -
引起药物性肝损伤的主要药物、构成比及累计构成比情况详见表3,其中心血管系统用药物(44.02%)、抗感染药物(23.94%)和抗肿瘤药物(11.58%)为导致DILI的主要因素(A类);其他10类药品为次要因素或一般因素(B类和C类)。
表 3 引起药物性肝损伤的药物及其分布
药物种类 代表药物 例数 构成比
(%)累计构成比
(%)因素类型 心血管疾病用药 阿托伐他汀、瑞舒伐他汀、普伐他汀、非诺贝特、米力农、胺碘酮、托伐普坦 114 44.02 44.02 A 抗感染药物 头孢他啶、头孢曲松、头孢哌酮舒巴坦等 62 23.94 67.95 A 抗肿瘤药物 吉西他滨、环磷酰胺、甲氨蝶呤、卡培他滨、盐酸多柔比星脂质体、
顺铂、多西他赛、奥沙利铂30 11.58 79.54 A 神经系统疾病用药 卡马西平、普瑞巴林、丙戊酸钠、丙戊酰胺、依达拉奉 18 6.95 86.49 B 消化系统疾病用药 美沙拉秦、柳氮磺吡啶、泮托拉唑、奥美拉唑 8 3.09 89.58 B 抗凝药 依诺肝素钠、那曲肝素钙、低分子肝素钙 7 2.70 92.28 C 内分泌疾病用药 苯溴马隆、二甲双胍、甲巯咪唑 7 2.70 94.98 C 镇痛药 洛索洛芬、氨酚烷胺 3 1.16 96.14 C 营养支持药物 中长链脂肪乳(C4-24)、脂肪乳氨基酸葡萄糖 3 1.16 97.30 C 免疫系统药物 环孢素 2 0.77 98.07 C 造影剂 碘克沙醇 2 0.77 98.84 C 中成药 康莱特、血必净 2 0.77 99.61 C 生物制品 重组人干扰素b 1 0.39 100.00 C 合计 259 -
心血管系统药物引起的肝损伤共114例,其中他汀类调脂药物占绝大部分,共105例。其中阿托伐他汀钙40 mg及以上占比最高,达到46.49%,共53例,与瑞舒伐他汀10 mg均为A类因素;阿托伐他汀钙20 mg或10 mg为B类次要因素;普伐他汀钠片40 mg以及其他药物如胺碘酮、托伐普坦、米力农、尼可地尔为一般因素(C类),详见表4。
表 4 心血管系统药物引起药物性肝损伤的品种分布
药物及剂量 例数 构成比
(%)累计构成比
(%)因素
类型阿托伐他汀钙40 mg及以上 53 46.49 46.49 A 瑞舒伐他汀钙10 mg 25 21.92 68.41 A 阿托伐他汀钙20 mg 20 17.54 85.95 B 阿托伐他汀钙10 mg 6 5.26 91.21 B 盐酸胺碘酮 3 2.63 93.84 C 托伐普坦 3 2.63 96.47 C 米力农 2 1.75 98.22 C 尼可地尔 1 0.89 99.10 C 普伐他汀钠片40 mg 1 0.89 100 C 合计 114 -
抗感染药物引起DILI的比例仅次于心血管系统用药,达到23.94%,共62例。按照抗感染药物分类进行统计发现,抗菌药物中头孢菌素类(29.03%)、碳青霉烯类(19.35%)、抗真菌类(17.74%)、喹诺酮类(11.29%)为主要因素(A类),利奈唑胺及万古霉素为次要因素(B类),其他如四环素类、抗病毒药物,阿奇霉素为一般因素(C类),见表5。
表 5 抗感染药物引起药物性肝损伤的品种分布
抗感染药物品种分类 代表药物 例数 构成比
(%)累计构成比
(%)因素类型 头孢菌素 头孢他啶、头孢曲松、头孢哌酮舒巴坦、头孢呋辛、头孢唑林钠、头孢美唑 18 29.03 29.03 A 碳青霉烯类 亚胺培南、美罗培南、比阿培南 12 19.35 48.38 A 抗真菌类 伏立康唑 11 17.74 66.12 A 喹诺酮类 左氧氟沙星、莫西沙星 7 11.29 77.41 A 噁唑酮类 利奈唑胺 4 6.45 83.86 B 糖肽类 万古霉素 4 3.23 87.09 B 四环素类 米诺环素、替加环素 2 3.23 90.32 C 抗病毒药 膦甲酸钠、更昔洛韦 2 1.61 91.93 C 大环内酯类 阿奇霉素 1 1.62 100 C 合计 62 -
在259例药物性肝损伤ADR报告中,出现不良反应的平均时间为6.84 d;1~3 d(41.31%)及4~6 d(28.57%),为主要因素(A类);1~2周为次要因素(B类),其余天数为一般因素(C类),见表6。
表 6 药物性肝损伤不良反应出现时间
发生不良反应时间 例数 构成比(%) 累计构成比(%) 因素类型 1~3 d 107 41.31 41.31 A 4~6 d 74 28.57 69.88 A 1~2周 53 20.46 90.35 B 2~4周 16 6.18 96.53 C >1个月 9 3.47 100.00 C 合计 259 DILI病程多在1周左右,停药或经治疗后多数可缓解。其中,持续1~2周的有82例(31.66%),4~6 d的69例(26.64%),为主要因素;持续1~3 d为次要因素,其他为一般因素。详见表7。
表 7 药物性肝损伤不良反应持续时间
持续时间 例数 构成比(%) 累计构成比(%) 因素类型 1~2周 82 31.66 31.66 A 4~6 d 69 26.64 58.30 A 1~3 d 58 22.39 80.69 B 2~4周 25 9.65 90.35 C 持续 23 8.88 99.23 C >1个月 2 0.77 100.00 C 合计 259 -
259例患者经停药或及时治疗后好转124例(47.88%),治愈96例(37.07%),持续37例(14.29%),死亡1例,不详1例。
-
本研究发现中老年患者应用心血管系统药物、抗感染药物或抗肿瘤药物时发生药物性肝损伤风险较大,主要影响因素总结如下。
一是年龄因素。中国正快速进入老龄化社会,老年人群是慢性疾病的主要群体,其需要长期服用多种药物,从而大大增加了药物性肝损伤的风险。本研究结果提示45~75岁是发生药物性肝损伤的主要年龄段,其中,65岁以上老年人占比最高。究其原因,一方面因老年患者的肝功能减弱,药物清除功能减弱,对毒性应激、免疫反应和组织修复过程迟缓[6];另一方面,老年患者通常合并疾病较多,联合用药情况普遍,故而发生药物性肝损伤的几率大,且多与剂量相关[7]。
二是药物种类因素。药物引起DILI主要与药物剂量、肝脏药物代谢、药物亲脂性、药物相互作用、特殊化学成分、线粒体危害、肝胆转运抑制等机制相关[8]。本研究的患者主要为住院患者,通过统计分析发现住院期间容易导致肝损伤的药物主要为心血管疾病常用药物、抗感染药物及抗肿瘤药物等。该类药物在医院患者中使用人群基数较大,部分药物使用疗程较长。
心血管系统药物引起的DILI中,他汀类的占比最高。有研究发现,他汀类使用期间经常会发生轻度至中度无症状血清转氨酶水平升高,其中多为胆汁淤积性肝损伤,且DILI发生率与剂量正相关[9]。也有一些文献指出与他汀类相关的DILI占3.4%,少见但有可能很严重[10,11]。一般患者停药后会自行恢复,再次暴露容易出现类似肝损伤情况,医护人员对该类患者应开展严密监测[12]。
引起肝损伤的抗感染药物占比为23.94%,其中头孢菌素类、碳青霉烯类、抗真菌类是引起肝损伤的主要因素。已有文献证明抗生素是最常引起DILI的一类药物[13]。究其原因,主要是目前我国抗菌药的使用比例较高,且存在使用目的盲目、剂量较大及疗程长等药物滥用问题。因此,一方面要加强对抗菌药物的管理,实现临床合理用药;另一方面要增强抗菌药物不良反应监测,对药物性肝损伤早发现早干预[14]。
-
本研究中可见大多数DILI预后良好,因此临床一旦发生疑似药物肝损伤的情况时应尽早停药,给予无肝损害不良反应的替代药物,严重者应给予保肝药物治疗。医生在处方药物前应评估患者药物性肝损伤的风险水平,对于药物性肝损伤高风险的患者,需充分权衡获益及风险,尽可能避免肝毒性药物,同时叮嘱患者注意服药习惯。患者应严遵照医嘱用药,避免超剂量、超疗程用药和混合、重复用药。此外,临床药师应加入治疗决策团队,以确保符合药物配伍原则避免配伍禁忌,避免药物间相互作用导致药物性肝损伤风险增加。对于安全窗口较窄或特定的高风险药物,必要时可开展血药浓度监测,规范化的血药浓度监测可减少不合理用药造成的毒性。
综上所述,药物性肝损伤是一种可以预防、可以控制的疾病。中老年患者应用心血管系统药物、抗感染药物或抗肿瘤药物时,需要在6 天内监测患者肝功能变化,如有异常应及时停药或给予治疗,从而避免药物性肝损伤的进展。
Adverse reaction analysis of drug-induced liver injury
-
摘要:
目的 对药物性肝损伤不良反应报告进行分析,探讨药物性肝损伤的特点及相关规律,为临床安全用药提供借鉴。 方法 对本院2011年至2021年间上报至医院不良反应监测系统的259例药物所致肝损伤进行帕累托分析。 结果 259例ADR报告中,药物性肝损伤最常见类型为肝细胞损伤型(37.84%),引发药物性肝损伤的年龄段主要在46岁以上,共195例(75.28%)。药物种类主要有心血管疾病用药(44.02%)、抗感染药(23.94%)及抗肿瘤药(11.58%)。其中,心血管药物中阿托伐他汀钙40 mg及以上占比最高,共53例(46.49%);抗感染药物中主要为头孢菌素类(29.03%)、碳青霉烯类(19.35%)、抗真菌类(17.74%)、喹诺酮类(11.29%)。不良反应发生时间主要在用药6 d及以内(69.88%),不良反应持续时间多为1至2周(31.66%)。多数患者好转(47.88%)或治愈(37.07%)。 结论 对于中老年患者,应用心血管系统药物、抗感染药物或抗肿瘤药物时,需要至少在6 d及以内监测患者肝功能变化,如有异常应及时停药或给予治疗,从而避免药物性肝损伤的进展。 Abstract:Objective To analyze the adverse reaction reports (ADRs) of drug-induced liver injury in recent ten years, explore the characteristics and related rules of drug-induced liver injury, and provide reference for clinical safe drug use. Methods ADRs in our hospital from 2011 to 2021 which belonged to drug-induced liver injuries were collected, and Pareto analysis was carried on. Results In 259 ADR reports, the most common type of drug-induced liver injury was hepatocellular injury (37.84%). The age of drug-induced liver injury was mainly over 46 years, totaling 195 (75.28%). Drugs were mainly distributed in cardiovascular system medicine (44.02%), anti-infective medicine (23.94%)and anti-tumor medicine (11.58%). Among the cardiovascular drugs, atorvastatin calcium 40mg and over 40mg were the highest proportion, with 53 cases (46.49%). The main anti-infectious drugs were cephalosporins (29.03%), carbapenem (19.35%), antifungal (17.74%)and quinolones (11.29%). Adverse reactions occurred within 6 days (69.88%), the duration of adverse reactions was 1-2 weeks (31.66%), and most patients were improved (47.88%) or cured (37.07%). Conclusion For middle-aged and elderly patients, when the application of cardiovascular system drugs, anti-infective drugs or anti-tumor drugs, it is necessary to monitor the liver function changes of patients for at least 6 days. If there are abnormalities, the drugs should be stopped or given treatment in time, to avoid the progress of drug-induced liver injury. -
Key words:
- drug-induced liver injury /
- adverse drug reactions /
- Pareto analysis /
- medication safety
-
舰艇官兵由于个人空间狭小,工作压力大,气候潮湿,环境嘈杂等因素,睡眠状态易受到影响[1]。因此,较容易出现睡眠障碍,由此可引发各类负性情绪[2]。冯晨曦[3]等观察到在以青壮年为主的海勤人员远航中,焦虑和抑郁情绪明显高于航前。睡眠质量还会影响官兵的生存质量[4],不利于训练、执勤等任务完成的质量[5]。在舰艇出海训练期间,做到提高官兵睡眠质量,又不干扰正常训练是非常有意义的。本研究利用解郁安神中药香囊挥发油的有效成分,通过嗅闻吸入的无创方式,明显改善了舰艇官兵的睡眠质量,现报告如下。
1. 对象与方法
1.1 研究对象
在海军某舰艇部队出海训练前1周筛选出有睡眠障碍(匹茨堡睡眠质量指数量表PSQI评分≥8[6]且焦虑评分量表SAS评分≥50[7])的官兵59人,他们中无精神类疾病及过敏体质。随机分为香囊试验组20人、正念冥想组20人和空白对照组19人。所选官兵均为男性,在年龄、学历、婚姻、岗位、人员素质等方面差别无统计学意义(P>0.05)。三组官兵在治疗前的PSQI评分与SAS评分无统计学差异,具有可比性。
1.2 用药方法
试验组使用自制解郁安神中药香囊(石菖蒲、柏子仁、当归、荆芥、薰衣草等)。将香囊放置于床头,晚睡前打开香囊袋,将鼻口置于距香囊口约10 cm距离,深嗅3 min,每2周为官兵更换1次香囊,治疗8周。正念冥想训练主要借鉴正念认知疗法 [8-9]。的8周课程结构,每周在指导音频带领下集中训练1次,每次2 h,包括训练和体验分享,其余时间根据课后作业自行训练。空白对照组与香囊试验组和正念冥想组保持相同作息,工作活动。统计比较三组官兵治疗前后的PSQI和SAS评分差值。
1.3 观察指标
PSQI量表评分,总分≥8表示有睡眠障碍,分值越高表明睡眠障碍越严重。疗效评价标准[10]:根据匹茨堡睡眠质量指数量表PSQI评分减分率进行评价,痊愈:PSQI评分减分率在75%以上;显效:减分率在50%~74% 之间;有效:减分率在25%~49% 之间;无效:减分率在25%以内。SAS量表评分,评分<50分无焦虑,≥50分轻度焦虑,≥60分中度焦虑,≥70分重度焦虑[8]。
1.4 统计学方法
采用 SPSS 21.0软件进行数据统计分析,计量资料以均数±标准差(
$\bar x $ ±s)表示。三组PSQI评分与SAS评分前后差值采用单因素方差分析及SNK检验,所有检验均以P<0.05为检验标准。2 实验结果
2.1 量表分析
空白对照组PSQI与SAS评分分别升高27.93%、15.56%,提示睡眠障碍和焦虑有不同程度加重,正念冥想组与香囊试验组官兵PSQI评分分别下降24.64%和25.47%,SAS评分分别下降15.27%和15.58%,说明睡眠障碍与焦虑的症状得到明显改善(表1),三组官兵两个量表评分结果经方差分析,P< 0.05,差异有统计学意义。经SNK检验,香囊试验组与正念冥想组在降低PSQI和SAS评分上作用相当,两组降低程度无统计学差异(表2、3、4)。
表 1 3组试验官兵治疗前后PSQI和SAS量表评分情况(分,$\bar x $ ±s)组别 例数 PSQI评分 SAS评分 治疗前 治疗后 治疗前后差值 治疗前 治疗后 治疗前后差值 正念冥想组 20 10.60±1.85 7.90±2.19 2.70±0.90 58.40±4.93 49.30±4.84 9.10±1.76 香囊试验组 20 10.55±1.91 7.95±1.53 2.60±1.07 58.30±4.72 49.40±4.65 8.90±1.81 空白对照组 19 10.74±1.83 13.74±2.86 −3.00±1.49 58.16±4.68 67.21±3.78 −9.05±1.93 F 142.18 592.08 P 0 0 表 2 3组试验官兵治疗前后PSQI评分差值组别 例数 α=0.05 的子集 1 2 空白对照组 19 −3 香囊试验组 20 2.6 正念冥想组 20 2.7 P 1 0.795 表 3 3组试验官兵治疗前后SAS评分差值组别 例数 α=0.05 的子集 1 2 空白对照组 19 −9.0526 香囊试验组 20 8.9 正念冥想组 20 9.1 P 1 0.74 表 4 3组试验官兵PSQI评分结果[例(%)]组别 例数 痊愈 显效 有效 无效 总有效率 正念冥想组 20 0(0) 0(0) 11(55) 9(45) 11(55) 香囊试验组 20 0(0) 0(0) 11(55) 9(45) 11(55) 空白对照组 19 0(0) 0(0) 0(0) 19(100) 0(0) 2.2 不良反应观察
三组实验官兵均能坚持完成治疗项目,治疗期间均未发生明显不良反应。
3. 讨论
最新研究证据表明,战时剥夺睡眠是军人执行军事战斗任务之后罹患创伤后应激障碍、抑郁和焦虑障碍的重要危险因素[11]。本研究空白对照组的结果与吴刚[12]等发现焦虑和抑郁是海勤人员长航过程中易发生的两种负性情绪, 且与睡眠质量密切相关的报告相吻合。姜萍[13]研究显示,舰艇官兵借助药物催眠,极易产生副作用,长期服药还会产生耐受性和依赖性,停药后会出现戒断症状,因此,催眠药不宜长期服用[14]。
正念冥想是近年来研究非药物治疗睡眠障碍的热点,目前许多研究也都证明正念对慢性失眠有较好的疗效[9]。Black等[15]在一项随机对照临床试验中发现:与接受睡眠卫生教育的对照组相比,参加冥想训练的受试者的匹兹堡睡眠质量指数降低更明显。国内王晓明等[16]研究发现受试者的正念冥想水平和睡眠质量呈现显著正相关,冥想训练可以通过降低受试者焦虑水平有效改善睡眠质量。本研究中正念冥想组官兵SAS量表评分变化也证实了这一点。正念训练的效果受到治疗师自身经验与技术的影响,国外实证类文献在报告正念疗效时,会提到正念训练师的培训资质,而目前大多数的国内文献都没有提到培训师的资质以及培训经历[9],这可能是正念冥想在实践应用中的一个缺陷。
本研究中香囊试验组采用了自行研制的解郁安神中药香囊,借鉴传统中药香囊具有平衡阴阳、开泄腠理、宣畅肺卫、调节脏腑功能的作用[17],查阅古籍药方及参考现代药理研究进展,本方选用石菖蒲、柏子仁、荆芥、当归、薰衣草等药材研制成粉末制成,通过药材中的挥发油达到改善睡眠治疗的作用。现代药理研究证实,石菖蒲、柏子仁、当归、薰衣草都具有镇静催眠作用[18-21],荆芥油具有祛痰作用,能缓解密闭船舱内潮湿的气体环境对官兵呼吸道的刺激[22]。通过合理调整中药配比,可以达到宣畅肺卫、解郁清心、安神助眠的作用。试验结果表明解郁安神香囊对失眠障碍的治疗有明显效果,作用与正念冥想相当,但香囊在舰艇上使用更加简单实用、安全可靠。与西药相比,香囊作用相对温和,无不良反应,不影响日常训练。
4. 小结
解郁安神中药香囊在治疗睡眠障碍,改善睡眠质量方面具有明显疗效,并且简单实用、安全有效、使用方便,在治疗过程中无明显的不良反应,且有简单价廉的优势,是改善舰艇官兵睡眠障碍切实可行的方法,值得在军队中进行推广。
-
表 1 药物性肝损伤患者一般情况
特征 例数 占比(%) 性别 男 172 66.41 女 87 33.59 合并疾病 脑血管疾病 94 36.29 心血管疾病 54 20.85 肿瘤 37 14.29 感染 36 13.9 自身免疫相关疾病 11 4.25 肾功能不全 7 2.7 其他 19 7.34 分型 肝细胞损伤型 98 37.84 胆汁淤积型 63 24.32 混合型 54 20.85 肝脏生化学检查异常 44 18.99 表 2 药物性肝损伤患者年龄分布
年龄(岁) 例数 构成比(%) 累计构成比(%) 因素类型 >65 79 30.50 30.50 A 56~65 68 26.25 56.75 A 46~55 48 18.53 75.28 A 36~45 30 11.58 86.87 B 26~35 22 8.49 95.37 C 15~25 11 4.25 99.61 C <15 1 0.39 100 C 合计 259 表 3 引起药物性肝损伤的药物及其分布
药物种类 代表药物 例数 构成比
(%)累计构成比
(%)因素类型 心血管疾病用药 阿托伐他汀、瑞舒伐他汀、普伐他汀、非诺贝特、米力农、胺碘酮、托伐普坦 114 44.02 44.02 A 抗感染药物 头孢他啶、头孢曲松、头孢哌酮舒巴坦等 62 23.94 67.95 A 抗肿瘤药物 吉西他滨、环磷酰胺、甲氨蝶呤、卡培他滨、盐酸多柔比星脂质体、
顺铂、多西他赛、奥沙利铂30 11.58 79.54 A 神经系统疾病用药 卡马西平、普瑞巴林、丙戊酸钠、丙戊酰胺、依达拉奉 18 6.95 86.49 B 消化系统疾病用药 美沙拉秦、柳氮磺吡啶、泮托拉唑、奥美拉唑 8 3.09 89.58 B 抗凝药 依诺肝素钠、那曲肝素钙、低分子肝素钙 7 2.70 92.28 C 内分泌疾病用药 苯溴马隆、二甲双胍、甲巯咪唑 7 2.70 94.98 C 镇痛药 洛索洛芬、氨酚烷胺 3 1.16 96.14 C 营养支持药物 中长链脂肪乳(C4-24)、脂肪乳氨基酸葡萄糖 3 1.16 97.30 C 免疫系统药物 环孢素 2 0.77 98.07 C 造影剂 碘克沙醇 2 0.77 98.84 C 中成药 康莱特、血必净 2 0.77 99.61 C 生物制品 重组人干扰素b 1 0.39 100.00 C 合计 259 表 4 心血管系统药物引起药物性肝损伤的品种分布
药物及剂量 例数 构成比
(%)累计构成比
(%)因素
类型阿托伐他汀钙40 mg及以上 53 46.49 46.49 A 瑞舒伐他汀钙10 mg 25 21.92 68.41 A 阿托伐他汀钙20 mg 20 17.54 85.95 B 阿托伐他汀钙10 mg 6 5.26 91.21 B 盐酸胺碘酮 3 2.63 93.84 C 托伐普坦 3 2.63 96.47 C 米力农 2 1.75 98.22 C 尼可地尔 1 0.89 99.10 C 普伐他汀钠片40 mg 1 0.89 100 C 合计 114 表 5 抗感染药物引起药物性肝损伤的品种分布
抗感染药物品种分类 代表药物 例数 构成比
(%)累计构成比
(%)因素类型 头孢菌素 头孢他啶、头孢曲松、头孢哌酮舒巴坦、头孢呋辛、头孢唑林钠、头孢美唑 18 29.03 29.03 A 碳青霉烯类 亚胺培南、美罗培南、比阿培南 12 19.35 48.38 A 抗真菌类 伏立康唑 11 17.74 66.12 A 喹诺酮类 左氧氟沙星、莫西沙星 7 11.29 77.41 A 噁唑酮类 利奈唑胺 4 6.45 83.86 B 糖肽类 万古霉素 4 3.23 87.09 B 四环素类 米诺环素、替加环素 2 3.23 90.32 C 抗病毒药 膦甲酸钠、更昔洛韦 2 1.61 91.93 C 大环内酯类 阿奇霉素 1 1.62 100 C 合计 62 表 6 药物性肝损伤不良反应出现时间
发生不良反应时间 例数 构成比(%) 累计构成比(%) 因素类型 1~3 d 107 41.31 41.31 A 4~6 d 74 28.57 69.88 A 1~2周 53 20.46 90.35 B 2~4周 16 6.18 96.53 C >1个月 9 3.47 100.00 C 合计 259 表 7 药物性肝损伤不良反应持续时间
持续时间 例数 构成比(%) 累计构成比(%) 因素类型 1~2周 82 31.66 31.66 A 4~6 d 69 26.64 58.30 A 1~3 d 58 22.39 80.69 B 2~4周 25 9.65 90.35 C 持续 23 8.88 99.23 C >1个月 2 0.77 100.00 C 合计 259 -
[1] DEVARBHAVI H, AITHAL G, TREEPRASERTSUK S, et al. Drug-induced liver injury: Asia Pacific Association of Study of Liver consensus guidelines[J]. Hepatol Int, 2021, 15(2):258-282. doi: 10.1007/s12072-021-10144-3 [2] 袁琳娜, 那恒彬译, 李武. 《2021年亚太肝病学会共识指南: 药物性肝损伤》摘译[J]. 临床肝胆病杂志, 2021, 7(6):1291-1294. [3] TESCHKE R, UETRECHT J. Mechanism of idiosyncratic drug induced liver injury(DILI): unresolved basic issues[J]. Ann Transl Med, 2021, 9(8):730. doi: 10.21037/atm-2020-ubih-05 [4] TESCHKE R. Idiosyncratic DILI: Analysis of 46, 266 Cases Assessed for Causality by RUCAM and Published From 2014 to Early 2019[J]. Front Pharmacol, 2019, 10:730. doi: 10.3389/fphar.2019.00730 [5] 中国医药生物技术协会药物性肝损伤防治技术专业委员会, 中华医学会肝病学分会药物性肝病学组, 茅益民. 中国药物性肝损伤诊治指南(2023年版)[J]. 胃肠病学, 2023, 28(7):397-431. [6] ANDRADE R J, CHALASANI N, BJORNSSON E S, et al. Drug-induced liver injury[J]. Nat Rev Dis Primers, 2019, 5:1-22. doi: 10.1038/s41572-018-0051-2 [7] LUCENA M I, SANABRIA J, GARCÍA-CORTES M, et al. Drug-induced liver injury in older people[J]. Lancet Gastroenterol Hepatol, 2020, 5(9):862-874. doi: 10.1016/S2468-1253(20)30006-6 [8] 李彩萍. 药物性肝损伤作用机制的研究进展[J]. 中国药物与临床, 2023, 23(6):405-408. [9] LICATA A, GIAMMANCO A, MINISSALE M G, et al. Liver and statins: a critical appraisal of the evidence[J]. Curr Med Chem, 2018, 25(42):5835-5846. [10] BJÖRNSSON E, JACOBSEN E I, KALAITZAKIS E. Hepatotoxicity associated with statins: reports of idiosyncratic liver injury post-marketing[J]. J Hepatol, 2012, 56(2):374-380. doi: 10.1016/j.jhep.2011.07.023 [11] ZAMOR P J, RUSSO M W. Liver function tests and statins[J]. Curr Opin Cardiol, 2011, 26(4):338-341. doi: 10.1097/HCO.0b013e328347036f [12] MEURER L, COHEN S M. Drug-induced liver injury from statins[J]. Clin Liver Dis, 2020, 24(1):107-119. doi: 10.1016/j.cld.2019.09.007 [13] BJÖRNSSON E S. Drug-induced liver injury: an overview over the most critical compounds[J]. Arch Toxicol, 2015, 89(3):327-334. doi: 10.1007/s00204-015-1456-2 [14] CHALASANI N P, MADDUR H, RUSSO M W, et al. ACG clinical guideline: diagnosis and management of idiosyncratic drug-induced liver injury[J]. Am J Gastroenterol, 2021, 116(5):878-898. doi: 10.14309/ajg.0000000000001259 -






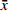
 下载:
下载:
 下载:
下载: 

