-
吉西他滨(gemcitabine, GEM)是一种脱氧胞苷拟似物和核苷还原酶抑制剂,属嘧啶类抗肿瘤代谢物,主要作用于DNA合成期和G1期的肿瘤细胞,并阻止细胞由G1期进入S期,使DNA断裂,而使细胞死亡[1]。GEM抗瘤谱较广,可用于晚期非小细胞肺癌、乳腺癌、胰腺癌的一线治疗,也可用于恶性淋巴瘤、卵巢癌、鼻咽癌的治疗。尽管GEM的抗肿瘤疗效确切,但其在杀灭肿瘤细胞的同时对正常细胞有较大的损伤,导致用药期间药物不良反应(adverse drug reaction,ADR)的发生。GEM最常见的不良反应包括骨髓抑制、胃肠道反应、过敏反应、水肿、流感样症状等[2]。临床应用过程中发现,GEM单药或联合其他化疗药物对于多种晚期或转移性的癌种具有较好的治疗效果,但是ADR的发生率在联合用药治疗组中的发生率显著增加[3-5]。ADR会使患者因无法耐受而使得治疗效果下降,严重的ADR甚至会妨碍化疗方案的顺利实施。现回顾性分析我院2008年9月至2018年9月期间使用吉西他滨化疗并发生ADR的患者,探究其发生的特点及规律,旨在为临床规避不良反应发生并合理使用吉西他滨提供指导。
-
利用医院信息系统检索我院2008年9月至2018年9月使用吉西他滨进行化疗患者的病例共750份,并通过调取药品不良反应监测管理系统上报的吉西他滨相关ADR报告共312份。
-
采用回顾性分类统计法,根据ID号检索相应的病例,利用EXCEL 2016软件详细记录病人的一般资料,包括性别、年龄、身体质量指数(BMI)、个人史(高血压、糖尿病、吸烟史、饮酒史、肝基础疾病)、卡氏功能状态(KPS)评分值、化疗方案、原患癌种及ADR累及器官/系统等信息,并根据记录结果进行与ADR的相关性分析。
-
采用SPSS 18.0软件进行统计学检验。计数资料用率表示,组间比较采用χ2检验,P<0.05表示差异有统计学意义。
-
对患者一般资料中与ADR发生相关的因素进行分析,详见表1。
表 1 ADR与患者一般资料的相关性分析
一般因素 例数 ADR ADR发生率
(%)χ2 P 发生 未发生 性别 男性 446 164 282 36.77 10.560 0.001 女性 304 148 156 48.68 年龄 18~49 226 90 136 39.82 6.183 0.045 50~69 469 207 262 44.14 70~90 55 15 40 27.27 BMI <18 63 25 38 39.68 0.86 18~25 550 232 318 42.18 0.291 >25 137 55 82 40.15 5 由表1可见,ADR发生率与患者的性别具有相关性(P=0.001),女性可能为ADR发生的危险因素。同时,ADR在三个年龄组间差异有统计学意义(P=0.045),提示50~69岁是吉西他滨相关的ADR发生的高危年龄段。吉西他滨相关的ADR发生率在不同的BMI组间差异无统计学意义(P=0.865),提示BMI与ADR发生无显著相关性。
-
对患者个人史中与ADR发生相关的病史和行为因素进行分析,详见表2。
表 2 ADR与患者个人史的相关性分析
个人史 例数 ADR ADR发生率
(%)χ2 P 发生 未发生 高血压 是 113 50 63 44.25 0.384 0.536 否 637 262 375 41.13 糖尿病 是 76 34 42 44.74 0.343 0.558 否 674 278 396 41.25 吸烟史 是 207 84 123 40.58 0.123 0.726 否 543 228 315 41.99 饮酒史 是 124 50 74 40.32 0.100 0.752 否 626 262 364 41.85 肝脏基础疾病 是 76 72 4 94.74 98.288 0.000 否 674 240 434 35.61 由表2可知,吉西他滨相关的ADR发生率在有无糖尿病、高血压、吸烟史、饮酒史患者组间差异无统计学意义(P值均大于0.05),表明这4项因素与ADR的发生无显著性差异。吉西他滨相关的ADR发生率在有无肝脏基础疾病组间差异具有统计学意义(P=0.000),有肝脏基础疾病的患者ADR发生率高达94.74%。
-
对患者KPS评分值与ADR的发生率进行相关性分析,详见表3。由表3可见,吉西他滨相关的ADR发生率在不同的KPS组间差异具有统计学意义(P=0.001),KPS评分为80分和70分的患者ADR发生率较高,分别为46.30%、53.42%,提示KPS越低,ADR发生率越高。
表 3 ADR与KPS评分值的相关性分析
KPS值 例数 ADR ADR发生率
(%)χ2 P 发生 未发生 90 353 123 230 34.84 13.774 0.001 80 324 150 174 46.30 70 73 39 34 53.42 -
对患者不同化疗方案与ADR的发生率进行相关性分析,详见表4。由表4可见,吉西他滨相关的ADR发生率在不同化疗方案组间的差异具有统计学意义(P=0.004)。312例ADR中,患者的给药方式均为静脉滴注,其中13例为单药用药,267例为二联用药,其余均为三联或四联用药,其中与铂类联用的次数最多,但ADR发生率相对较低,为40.58%,与紫杉醇类联用的ADR发生率较高,为61.54%。
表 4 ADR与化疗方案的相关性分析
化疗方案 例数 发生
ADRADR发生率
(%)χ2 P GEM 61 13 21.31 20.780 0.004 GEM+铂类 515 209 40.58 GEM+单抗 14 5 35.71 GEM+铂类+单抗 28 16 57.14 GEM+氟尿嘧啶类 87 45 51.72 GEM+氟尿嘧啶类+单抗 16 9 56.25 GEM+紫杉醇类 13 8 61.54 其他 16 7 43.75 -
对患者原发病情况与ADR发生率进行相关性分析,详见表5。
表 5 ADR与原患癌种的相关性分析
癌种 例数 发生ADR ADR发生率(%) χ2 P 肺癌 260 88 33.85 25.739 0.001 乳腺癌 99 51 51.52 胸腺癌 8 5 62.50 消化系统恶性肿瘤 119 45 37.82 头颈部恶性肿瘤 115 42 36.52 血液系统恶性肿瘤 29 17 58.62 泌尿系统恶性肿瘤 25 11 44.00 生殖系统恶性肿瘤 84 48 57.14 骨与软组织肉瘤 11 5 45.45 合计 750 312 41.60 由表5可见,吉西他滨的ADR发生率在不同的癌种间的差异具有统计学意义(P<0.01)。肺癌的ADR发生例数最多,但其ADR发生率最低。吉西他滨相关的ADR在消化系统恶性肿瘤(包括食管癌、胆管癌、肝癌、结直肠癌、胰腺癌等等)中发生率也较低。乳腺癌、血液系统恶性肿瘤、生殖系统恶性肿瘤的ADR发生率较高,这可能与吉西他滨的适用癌种、特定癌种的特定发病性别有关。除此之外,吉西他滨相关的ADR在胸腺癌中的发生率最高,占比62.50%,提示胸腺癌是ADR发生的高危因素。
-
吉西他滨相关的ADR涉及多个器官/系统,其中以血液系统居多,共96例次,以骨髓抑制最明显。其次是消化系统的损害,出现最多的是严重的恶心呕吐、便秘,分别为16例次、15例次,详情见表6。
表 6 ADR累及器官/系统及临床表现分布
累及器官/系统 例次 构成比(%) 临床症状 消化系统 62 17.17 腹泻(10)、便秘(15)、口腔溃疡(1)、肝功能异常(10)、严重恶心呕吐(16)、口干(3)、嗳气(1)、打嗝(1)、反酸烧心(1)、口腔溃疡(1)、便血(3) 循环系统 8 2.22 低血压(1)、心律失常(1)、心悸(4)、心前区不适(2) 血液系统 96 26.59 骨髓抑制(白细胞、粒细胞、血小板下降)(69)、贫血(25)、鼻腔出血(2) 泌尿系统 5 1.39 尿失禁(2)、无尿(2)、出血性膀胱炎(1) 呼吸系统 44 12.19 咳嗽咳痰(16)、胸闷胸痛(7)、气喘(4)、痰中带血(2)、流感样症状(2)、发热(11)、寒颤(1)、干渴、咽部不适(1) 神经系统 52 14.40 神经毒性(2)、头晕头痛(40)、耳鸣(1)、癫痫(2)、右颈部胀痛(1)、左侧额部阵发性闷痛(1)、腰背痛(3)、嗜睡(2) 皮肤及附件 47 13.02 面色潮红(10)、皮疹(13)、皮肤瘙痒(19)、红色斑丘疹(2)、手足脱皮(1)、皮肤发黑(2) 局部损害 8 2.22 颜面水肿(3)、四肢水肿(5) 全身性损害 39 10.80 全身肌肉酸痛(11)、极度疲乏(27)、全身多发出血点(1) 合计 361 100 注:括号中的数字为发生该不良反应症状的例次。 -
回顾性研究分析了患者的性别、年龄对GEM相关ADR的影响,探讨了ADR的临床表现与累及器官的特点[6]。本研究发现患者的肝脏基础疾病史、KPS评分、化疗方案、原患癌种对GEM相关的ADR均会产生影响,同时发现了2例新的不良反应(癫痫)。
-
312份ADR报告中,女性患者多于男性患者,该结果与王颖等人的研究结果不一致[6],可能原因是女性的身体素质较男性差,对ADR更敏感。ADR的发生年龄大多集中在中老年人群中,其中50~69岁患者共有207例次,占到312份ADR报告绝大多数。流行病学研究显示[7],恶性肿瘤发病率在0~39岁年龄段发病率较低,其后随着年龄的增长快速升高,中老年是肿瘤高发的年龄阶段。同时,中老年患者大多合并多种基础疾病,用药种类较多,且自身的药物代谢速度下降,血浆蛋白结合率降低,这些都增加了ADR的发生率。故中老年人的用药应当更加遵循个体化用药原则[8],合理选择药物种类、剂型、剂量、给药途径等,用药期间密切监测患者的不良反应,必要时暂停用药。
本研究结果显示有肝基础疾病的患者ADR发生率较高,这主要是由于消除GEM[9]的机制是通过胞嘧啶核苷脱氨酶(CDA)脱氨形成无活性的代谢产物2’,2’-双氟脱氧胞嘧啶核苷,这种脱氨作用发生在肝脏、血液以及正常细胞和肿瘤细胞内。有肝脏基础疾病的患者会减弱GEM在体内的消除,使得药物蓄积,产生更大的毒副作用。在化疗方案执行前,应详细询问患者的病史,对肝功能状况进行全面评估。对于有肝基础疾病的患者应当减少GEM的剂量,并密切监测肝功能,可给予保肝药防止进一步的肝损害。对于已发生的药物性肝损害,应及时停止用药,加强支持治疗如卧床休息,并给予治疗药物如硫普罗宁、多烯磷脂酰胆碱、辅酶A等[10]。
KPS是患者的功能状态评分标准,用于评价患者化疗前的健康状况,健康状况越好,对于化疗药物的耐受性越好,临床上建议医师对每一个化疗的患者进行KPS评分。
-
312例ADR报告中,联合用药达299例,其中与紫杉醇类药物联用的ADR发生率最高,为61.54%,其次为与铂类和单抗类的三联用药,为57.14%。紫杉醇类药物是具有抗癌活性的二萜生物碱类化合物,其主要通过作用于细胞微管,抑制细胞的分裂和增殖[11]。紫杉醇类药物常见的ADR是骨髓抑制、胃肠道毒性、心脏毒性、超敏反应等,其与吉西他滨都具有明显的骨髓抑制[10],两者合用可能导致较严重的骨髓抑制。由于本研究中吉西他滨和紫杉醇类药物联合用药的病例数少,故两者联用是否会发生较高的ADR有待进一步的研究。
联合用药在化疗过程中是增加ADR发生率的重要因素之一,因此,在吉西他滨联合其他化疗药物治疗时,应当加强对不良反应的监测,尤其是对于年龄在50~69岁之间、有肝脏基础疾病,既往发生过严重不良反应的患者,应降低药物的剂量强度或预防性使用促髓细胞因子药[12]等措施。
-
吉西他滨相关的ADR累及的器官/系统,首要的为血液系统,最常见的表现为骨髓抑制,这与之前的报道相一致[6, 13]。骨髓抑制为其主要的剂量限制性毒性,随着剂量的增加和疗程的推进,其血液学毒性会加重,临床主要表现为白细胞、中性粒细胞、血小板计数的下降以及贫血[14]。临床应用吉西他滨化疗过程中有过多次重度骨髓抑制的报道[15-16],故应定期监测患者的血常规,建议一周2次,一旦出现严重的骨髓抑制,应及时减低剂量甚至停药,同时注意预防和治疗感染,可应用重组人粒细胞集落刺激因子纠正白细胞、粒细胞的减少,重组人白细胞介素-11、血小板生长因子等药物升高血小板,当男性患者血红蛋白小于110 g/L,女性患者小于100 g/L时使用重组人促红细胞生成素改善贫血状况[17]。
其次累及的为消化系统,主要表现为恶心呕吐、便秘,但其极少产生剂量限制性毒性,通常使用止吐药物如托烷司琼、甲氧氯普胺等就能得到控制。GEM、紫杉醇类和氟尿嘧啶类药物是低度致吐类化疗药,奥沙利铂、卡铂是中度致吐类药物,顺铂是高度致吐类药物[18],联合用药会较单一用药更容易产生胃肠道不良反应,且312份ADR报告中绝大部分患者为联合用药。16例出现严重恶心呕吐的病例中,有7例与顺铂联用,5例与卡铂联用,2例与氟尿嘧啶联用,2例与紫杉醇联用,在给予止吐药物治疗后均有好转。临床上建议在使用吉西他滨化疗之前,尤其是与顺铂、卡铂、奥沙利铂这些具有中高度致吐性的化疗药合用时,应当预防性地给予止吐药物。便秘是肿瘤患者化疗后常见的并发症之一,症状较轻者可通过饮食护理缓解症状,严重者可给予乳果糖或开塞露治疗[19]。
本研究中有2例患者出现癫痫,这是既往研究中没有的[6, 13, 16],属于新发的不良反应,需要引起特别的关注。胡巧织[20]等人报道过一例紫杉醇引起癫痫大发作的病例,其致痫机制可能是由于降低惊厥阈值,导致局灶性或全面性癫痫发作[21],但GEM的致痫机制有待进一步的研究。本文中的两例患者均是GEM单药治疗的患者,详细询问患者的病史,均否认有高血压、脑血管疾病史、癫痫病史,只有1例患者有癫痫家族史,在给予抗癫痫药物治疗后,症状均有所缓解。临床应用吉西他滨时,应当详细询问病史,如有癫痫病史、脑部疾病史、家族史等的患者,应当慎重,对于已发生的癫痫需及时做出处理,避免产生永久性的损害。
-
通过调取医院信息系统中使用GEM化疗患者的750例病例,并综合分析312份出现ADR的病例,发现GEM相关的ADR个体化差异大并受多种因素影响。其中50~69岁是不良反应的高发年龄段,同时女性的ADR发生率高于男性;有肝脏基础疾病、KPS评分低的患者应当减少给药剂量;联合用药的ADR显著高于单药治疗,尤其是与紫杉醇类药物联用;胸腺癌中发生GEM相关的ADR相对较高;研究中新出现2例癫痫,需要在以后的用药中加以关注。临床医生在化疗前应当详细询问患者的病史,对其情况进行评估,对于存在高危因素的患者做到提前预防。作为临床药师,应当协同医生充分发挥自己的职责,化疗期间密切监护不良反应,及时反馈不良反应情况,并提出合理的用药建议,提高用药的安全性和有效性。
Analysis of adverse reactions in 312 cases of gemcitabine
-
摘要:
目的 收集我院吉西他滨不良反应(ADR)的资料,分析其发生的特点和规律,为临床合理用药提供依据。 方法 从医院信息系统导出我院2008年9月至2018年9月期间使用吉西他滨化疗的患者病例,提取其相关的ADR报告,进行汇总和统计分析,统计采用SPSS 18.0进行。 结果 750份病例中,吉西他滨相关的ADR有312份,其中女性患者ADR发生率较男性患者高(48.68%比36.77%);50~69岁年龄段的ADR发生率最高(44.14%);卡氏功能状态(KPS)评分越低的患者对化疗药物越敏感,越容易发生ADR;联合用药方案中,吉西他滨+紫杉醇类化疗方案的ADR发生率最高(61.54%);胸腺癌的ADR发生率最高(62.50%),其次为血液系统肿瘤和生殖系统肿瘤(分别为58.62%和57.14%);ADR累及器官/系统主要以血液系统毒性为主,常见的是骨髓抑制,其次为消化系统损害,主要表现为恶心呕吐。 结论 吉西他滨相关的ADR个体化差异大,并受多种因素的影响,应当根据个体情况使用化疗药物,提高临床安全合理用药。 Abstract:Objective Based on the data of gemcitabine adverse reactions (ADR), the characteristics and patterns of ADR occurrence were analyzed. The guidance for the rational clinical use of gemcitabine was provided. Methods From our information system, the patients treated by gemcitabine chemotherapy from September 2008 to September 2018 were selected and their related ADRs were summarized and statistically analyzed by using SPSS 18.0. Results Among the 750 cases, there were 312 ADRs related to gemcitabine treatment, of which the incidence of ADR was higher in female patients than in male patients (48.68% vs 36.77%) and the highest incidence in the age group of 50-69 years (44.14%). The patients with lower status (KPS) scores were more sensitive to chemotherapeutic drugs, and more likely to develop ADR. During the combination therapy, gemcitabine+paclitaxel chemotherapy had the highest incidence of ADR (61.54%) and the highest incidence of ADR in thymic carcinoma (62.50%), followed by hematological and reproductive system tumors (58.62% and 57.14%, respectively); ADR involvement in organs/systems is mainly caused by hematological toxicity. The bone marrow suppression is common, followed by digestive system damage. The major clinical symptoms were nausea and vomit. Conclusion Gemcitabine-related ADR has a large individualized difference and is affected by many factors. Chemotherapy should be used according to individual conditions to improve clinical safety and rational use of drugs. -
Key words:
- gemcitabine /
- adverse drug reaction /
- chemotherapy
-
药品的调剂发放是门诊药房药师工作中非常重要的组成部分,门诊药师的药学服务工作也都围绕着药品的调剂发放展开。随着医药科技发展,门诊处方量不断增加,以及药品集中采购带来的药品更替增加,都给门诊药品的调剂发放带来了巨大的压力。
笔者所在医院是一所大型综合性医院,工作日平均门诊量在10 000人次左右,日均处方4 000张以上,每个发药窗口日均处方量500张以上,窗口药师工作压力巨大,极易出错。“军卫一号”发药系统自1997年在本院开始使用至今,软件老旧,功能不足。为适应我院的实际情况,提高工作效率,改善工作质量,特开发了“门诊发药辅助系统”。该系统充分利用各类条形码便捷输入的特点,在药品核对、处方权管理、效期管理、用药交待等多个环节辅助药师工作,可以有效降低差错,提高效率,增强药品管控能力。现将本系统的设计与使用情况做简要介绍。
1. 系统设计
1.1 系统环境
以医院信息系统(HIS)为数据基础,结合MS SqlServer 2008数据库管理系统作为数据储存平台,以Windows XP以上操作系统为开发及运行平台,Delphi和DotNet作为开发语言,构建了客户端(C/S)形式的应用程序。
1.2 系统结构
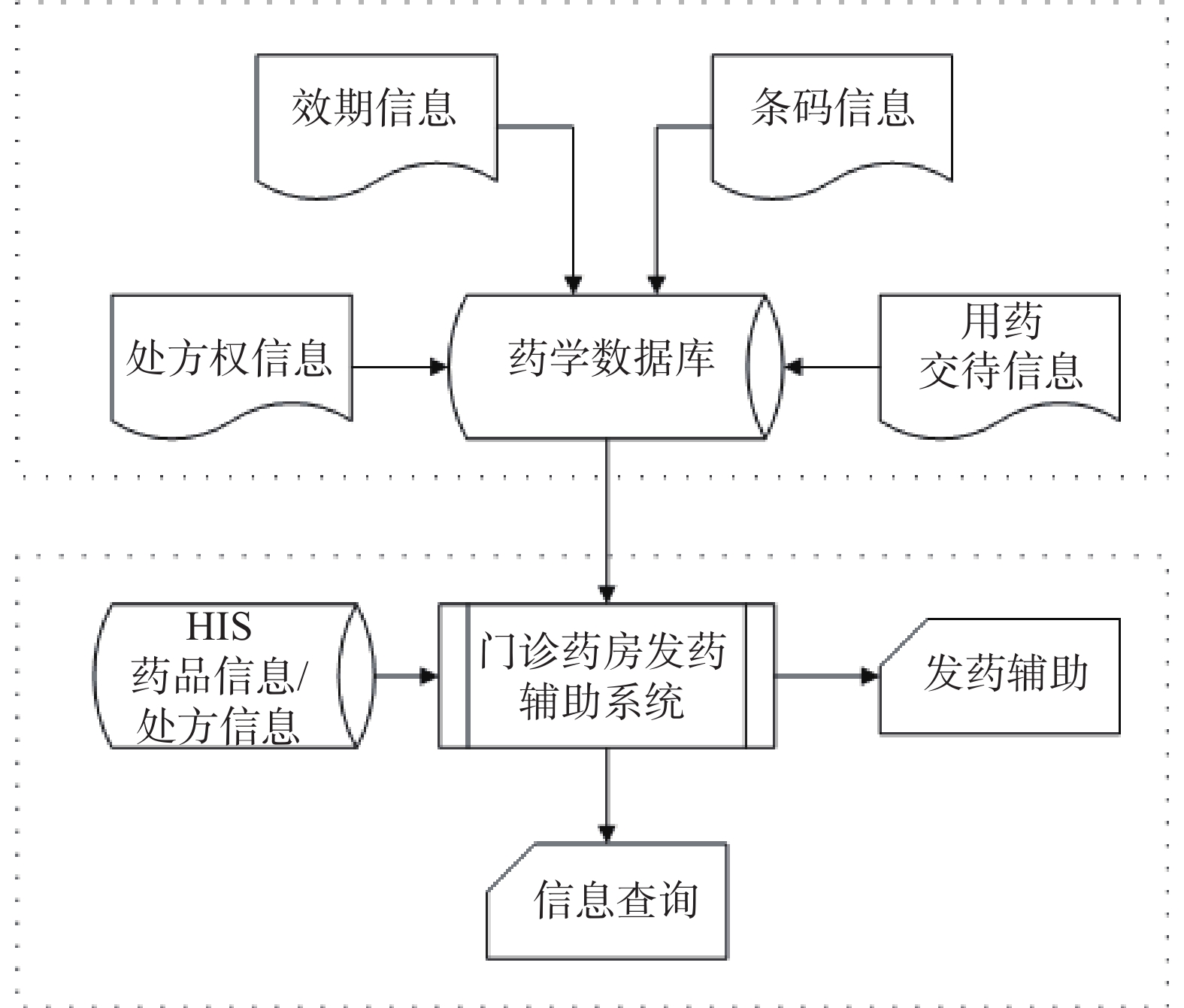
系统主要分后台数据维护和前台发药辅助两部分。后台数据维护部分负责对条形码、处方权、效期等提示信息进行维护,前台发药辅助部分提供即时的信息显示和查询功能。详细结构见图1。
2. 系统功能
条形码识别是该系统构建的核心。药品包装上的条形码一般有商品码和监管码两种[1]。2012年开始国家提出了对药品电子监管信息平台的建设工作,2016年国家又出台了《关于推动食品药品生产经营者完善追溯体系的意见》,虽然药品追溯体系的建立一波三折,但是至今国家药品监管码仍然已经覆盖了超过80%的中国药品企业和95%的国家重点关注品种[2]。本系统采用商品码和监管码并行查询的方式,对患者、处方和药品进行识别。
2.1 数据维护部分
条码信息、处方权信息和效期信息统一由数据维护程序录入系统。①药师通过程序的条码录入模块查询HIS储存的药品信息,然后扫描药盒上的商品码和监管码,把条码与相应的药品匹配。②负责管理处方权登记的药师可通过程序的处方权管理模块搜索HIS中储存的医生信息,在程序中设置医生所拥有的处方权限。③负责库存管理药师可通过程序的效期管理模块查询药品信息,并对药品的效期信息进行维护。
用药交待模块的数据直接从门诊用药咨询登记系统读取,平时由门诊咨询药师在咨询登记过程中根据咨询的情况随时维护,保证资料库中有最新、最简洁、最常用的药品信息直接为前台药师提供帮助。
2.2 发药辅助部分
由于原“军卫一号”发药系统的源代码无法修改,并且在现有的工作条件下,窗口药师工作繁忙,无法抽出时间进行过多的输入操作,所以系统把患者ID、条形码监管码等信息输入统一在一个输入口,通过系统后台监控药师扫码过程,做到功能无缝切换。药师只需扫描一次条码,系统即可查询并显示该患者当日所有就诊科室开具的多个处方信息。
2.2.1 药品核对
药品核对部分的工作流程见图2。
原有的发药流程中,药师只能依据经验,逐一核对患者的取药单据、电脑信息、处方和药品。引入新的“门诊发药辅助系统”后,药师只需扫描患者手中收据或者取药凭条上包含患者ID号信息的条码,发药系统搜索定位到该患者处方。此时辅助系统接收到扫描信息,自动完成输入焦点切换、查询并显示处方明细等一系列操作。药师直接扫描药品包装上的商品码或监管码进行药品核对。对于品种正确的药品,系统弹出显示框放大该药品信息,药师进一步核对药品数量。如果处方中没有该药品,则系统弹出提示告知药师确认。以往的药品核对工具只能对药品品种进行核对,缺乏对药品数量的敏感性[3]。该系统通过放大及颜色刺激的方式对数量做出提示,既可避免逐盒扫描药品对发药速度的影响,又可在一定程度上降低人工核对导致的数量差错。
显示的处方明细中以不同的字体颜色和底色向药师提示不同的情况。背景灰色表示该药品未录入条码,背景黄色表示该药品已扫码发放,红色字体表示该药品信息有异常。协助药师快速了解处方药品情况,提高发药效率。
2.2.2 处方权管理
处方权限的提示集成在扫码显示的处方明细界面中。显示的信息包括了医生的姓名及所在科室。文字为绿色则提示该医生有麻精药品处方权限,可以开具特殊药品处方,进一步点击医生姓名可显示HIS中储存的医生签名图片;文字为红色则提示该医生没有进行过麻精药品处方权限登记,如果开具特殊药品,需要有权限的医师在处方上再次签字确认。由于门诊医生人数众多,流动量大,该功能可帮助药师快速确定医生权限,不需要查阅处方权登记本,把更多精力放在对处方合理性的审核上。
2.2.3 效期管理
药品的效期提示同样集成在处方明细界面中,直接以颜色作为标识。如果辅助系统查询到处方中的某种药品包含近效期药品,则以醒目的绿色字体提示药师,药师需要仔细核对药品每个最小包装,确认是否可以正常发放。
2.2.4 用药交待
药品辅助咨询的信息以提示框的形式在处方明细界面供药师查询显示。药品信息以蓝色字体显示,则提示该药品包含提示信息。药师双击该药名即可弹出提示框显示该药品的储存方式、注意事项、用法用量、相互作用等需要提示患者的信息或者患者经常提问的信息,进一步强化药师的药学服务能力。
3. 应用效果
为考察发药辅助系统的实际应用效果,并对系统功能的进一步改进提供帮助,笔者针对门诊药师重点关注的调配差错、发药效率和对药师的影响等方面进行调查分析。
3.1 对调配差错影响
门诊药房作为与患者直接沟通的窗口,差错的出现对于患者影响的意义巨大,直接影响患者是否能安全有效的使用药物,影响患者对医院药学服务的信任程度。但是由于药品数量多,药师工作压力大,且存在药名相似、包装相似、一品多规等多种干扰因素,总是难以避免产生人为的调剂差错。据统计,美国每年用药差错中58%是由于药名、包装相似引起的品种差错[4],国内的报告中品种差错也达到了40%左右[5-6]。使用该系统后,对于品种差错,系统会自动提示错误,相当于在发药环节增加了计算机核对步骤,由原来的双核对增加到了三核对,同时高亮的已发药品显示还能帮助药师检查是否有漏发、多发的情况,可以有效降低药师发药的差错。在辅助系统稳定工作1年后,笔者对系统使用前后1年内的发药差错情况进行统计分析,差错数据来源除由患者找回的发药差错外,还包括在盘点过程中发现账物不符并排除其他情况后推断为发药差错的差错。其中数量差错包括多发、少发、漏发等情况,品种差错包括由于药名相似、剂型相似或包装相似等引起的差错,其他为患者拿错,遗落等原因引起的差错,所有差错均是经核实并登记的发药差错。结果如表1。
表 1 发药辅助系统使用前后发药差错对比差错类型 系统使用前 系统使用后 例数 占比(%) 例数 占比(%) 数量差错 41 49 15 60 品种差错 33 39 4 16 其他 10 12 6 24 总计 84 100 25 100 总差错率(‰)(差错数/年处方数) 0.107 0.027 3.2 对发药效率的影响
启用发药辅助系统后,药师在发药过程中增加了扫码环节,单个药品核对用时有所增加。但经过笔者对所在单位门诊发药高峰时段(10:00-11:30)使用发药辅助系统前后单个患者平均取药时间进行统计。结果显示使用发药辅助系统后,患者取药消耗的时间反而有所减少。高峰时段患者总取药时间中位数由原来的8 min 52 s,缩短到了现在的6 min 21 s。综合考虑药师发药时的各种情况,在当前调配量过剩的情况下,虽然发药扫码过程消耗了额外的时间,但是药师在系统的辅助下,只要逐品种扫码发放药品,核对数量,不需要额外花精力去确认药品是否漏发或发重,可以更快的核对处方、核对药品,在患者多科室看病,开具药品品种较多时,效果尤其明显。处方权提示和用药交代提供的内容帮助药师更快的应对发药过程中出现的情况,有效的提高了总体工作效率。
3.3 药师评价
通过对门诊药师开展系统使用情况的问题调研,反馈的情况统计如表2。
表 2 发药辅助系统药师反馈意见汇总(n=32)药师反馈意见 赞同人数 赞同人数占比(%) 系统可减少差错 30 94 系统可提高效率 23 72 有助于增强事件处理能力 20 63 增加了工作量 3 9 系统有助于药师工作 32 100 药师普遍认为该辅助系统有助于减少差错、降低发药药师的工作压力。通过对反馈问题的深入了解,主要不认可的问题在于部分年龄比较大的药师,经验丰富,工作更依赖于自身经验,对于新引入的计算机软件有一定的排斥心理,需要更多的时间逐渐适应系统操作。另外有个别药品外包装既没有商品码,也没有监管码,无法识别,只能人工核对药品信息。
4. 讨论
2015年国家食药总局就要求“2016年1月1日后生产的药品制剂应做到全部赋码”,2019年4月19日,国家药品监督管理局正式发布了《药品信息化追溯体系建设指导》和《药品追溯码编码要求》两项药品信息化追溯体系标准,编码规则确定了20位溯源码前7位为药品标识码或者符合ISO相关国际标准,但至今仍有部分药品既无监管码也没有商品码。笔者对所在医院门诊药房现有919种药品进行了统计,有58%的药品包装有商品码,有73%的药品包装印有监管码,条码总计覆盖了79%的药品。按药品消耗量计算,可扫码药品占门诊总发药量的93.8%。不能扫码的药品主要为医院制剂、针剂和部分瓶装普药。如果把这些药品全部纳入扫码,需要额外做大量的工作。对于医院制剂,可以与制剂部门沟通在药品包装上加印自制的条形码,其他药品需要在实际工作中仔细核对,进一步结合工作研究出既不影响效率又能提高准确率的方案。
应用该发药辅助系统后,总的差错数量大幅减少,数量差错也有明显减少,但品种差错仍然存在。主要原因是虽然辅助系统提供了多一层核对,但是药师过于依赖该系统,弱化了自身的核对,造成错误。同时高强度的工作也是导致药师注意力不集中,出现发药差错的影响因素。
门诊发药辅助系统功能涵盖了药师发药工作的多个环节,功能全面。系统以发药核对为核心功能,既整合了处方权管理、效期管理和药学服务等功能模块,同时各个模块之间又相对独立,可根据需求逐步添加。处方权管理模块在麻精药品管理中引入了信息化控制,能够进一步规范麻精药品的使用,确保制度落实。咨询辅助模块在协助药师回答患者问题的同时,也强化了药师的业务能力,有助于提高药师地位。药师咨询能力的提升,也有助于减少医患纠纷的发生[7]。
市售的大型发药系统虽然发药准确率可达到万分之二,但是设备引进及维护费用巨大,且对药房环境条件、药品剂型、包装等有诸多限制[8]。整个扫码发药过程中只需要在每个窗口添加条码扫描设备,维护简单,无需过多的硬件或资金投入。该程序的使用,用较低的成本优化了药学服务,提高了发药准确率,对药学服务的发展具有重要意义。
-
表 1 ADR与患者一般资料的相关性分析
一般因素 例数 ADR ADR发生率
(%)χ2 P 发生 未发生 性别 男性 446 164 282 36.77 10.560 0.001 女性 304 148 156 48.68 年龄 18~49 226 90 136 39.82 6.183 0.045 50~69 469 207 262 44.14 70~90 55 15 40 27.27 BMI <18 63 25 38 39.68 0.86 18~25 550 232 318 42.18 0.291 >25 137 55 82 40.15 5 表 2 ADR与患者个人史的相关性分析
个人史 例数 ADR ADR发生率
(%)χ2 P 发生 未发生 高血压 是 113 50 63 44.25 0.384 0.536 否 637 262 375 41.13 糖尿病 是 76 34 42 44.74 0.343 0.558 否 674 278 396 41.25 吸烟史 是 207 84 123 40.58 0.123 0.726 否 543 228 315 41.99 饮酒史 是 124 50 74 40.32 0.100 0.752 否 626 262 364 41.85 肝脏基础疾病 是 76 72 4 94.74 98.288 0.000 否 674 240 434 35.61 表 3 ADR与KPS评分值的相关性分析
KPS值 例数 ADR ADR发生率
(%)χ2 P 发生 未发生 90 353 123 230 34.84 13.774 0.001 80 324 150 174 46.30 70 73 39 34 53.42 表 4 ADR与化疗方案的相关性分析
化疗方案 例数 发生
ADRADR发生率
(%)χ2 P GEM 61 13 21.31 20.780 0.004 GEM+铂类 515 209 40.58 GEM+单抗 14 5 35.71 GEM+铂类+单抗 28 16 57.14 GEM+氟尿嘧啶类 87 45 51.72 GEM+氟尿嘧啶类+单抗 16 9 56.25 GEM+紫杉醇类 13 8 61.54 其他 16 7 43.75 表 5 ADR与原患癌种的相关性分析
癌种 例数 发生ADR ADR发生率(%) χ2 P 肺癌 260 88 33.85 25.739 0.001 乳腺癌 99 51 51.52 胸腺癌 8 5 62.50 消化系统恶性肿瘤 119 45 37.82 头颈部恶性肿瘤 115 42 36.52 血液系统恶性肿瘤 29 17 58.62 泌尿系统恶性肿瘤 25 11 44.00 生殖系统恶性肿瘤 84 48 57.14 骨与软组织肉瘤 11 5 45.45 合计 750 312 41.60 表 6 ADR累及器官/系统及临床表现分布
累及器官/系统 例次 构成比(%) 临床症状 消化系统 62 17.17 腹泻(10)、便秘(15)、口腔溃疡(1)、肝功能异常(10)、严重恶心呕吐(16)、口干(3)、嗳气(1)、打嗝(1)、反酸烧心(1)、口腔溃疡(1)、便血(3) 循环系统 8 2.22 低血压(1)、心律失常(1)、心悸(4)、心前区不适(2) 血液系统 96 26.59 骨髓抑制(白细胞、粒细胞、血小板下降)(69)、贫血(25)、鼻腔出血(2) 泌尿系统 5 1.39 尿失禁(2)、无尿(2)、出血性膀胱炎(1) 呼吸系统 44 12.19 咳嗽咳痰(16)、胸闷胸痛(7)、气喘(4)、痰中带血(2)、流感样症状(2)、发热(11)、寒颤(1)、干渴、咽部不适(1) 神经系统 52 14.40 神经毒性(2)、头晕头痛(40)、耳鸣(1)、癫痫(2)、右颈部胀痛(1)、左侧额部阵发性闷痛(1)、腰背痛(3)、嗜睡(2) 皮肤及附件 47 13.02 面色潮红(10)、皮疹(13)、皮肤瘙痒(19)、红色斑丘疹(2)、手足脱皮(1)、皮肤发黑(2) 局部损害 8 2.22 颜面水肿(3)、四肢水肿(5) 全身性损害 39 10.80 全身肌肉酸痛(11)、极度疲乏(27)、全身多发出血点(1) 合计 361 100 注:括号中的数字为发生该不良反应症状的例次。 -
[1] OTTAIANO A, CAPOZZI M, DE DIVITIIS C, et al. Gemcitabine mono-therapy versus gemcitabine plus targeted therapy in advanced pancreatic cancer: a meta-analysis of randomized phase Ⅲ trials[J]. Acta Oncol,2017,56(3):377-383. doi: 10.1080/0284186X.2017.1288922 [2] AAPRO M S, MARTIN C, HATTY S. Gemcitabine: a safety review[J]. Anticancer Drugs,1998,9(3):191-201. doi: 10.1097/00001813-199803000-00001 [3] HAMADA C, OKUSAKA T, IKARI T, et al. Efficacy and safety of gemcitabine plus S-1 in pancreatic cancer: a pooled analysis of individual patient data[J]. Br J Cancer,2017,116(12):1544-1550. doi: 10.1038/bjc.2017.128 [4] TOMITA Y, SAITO T, OKADOME M, et al. The safety and efficacy of cisplatin plus gemcitabine in recurrent ovarian cancer[J]. Int J Clin Oncol,2014,19(4):662-666. doi: 10.1007/s10147-013-0599-5 [5] SUYAMA T, UEDA T, FUKASAWA S, et al. Combination of gemcitabine and paclitaxel as second-line chemotherapy for advanced urothelial carcinoma[J]. Jpn J Clin Oncol,2009,39(4):244-250. doi: 10.1093/jjco/hyp003 [6] 王颖, 邱爽, 崔向丽. 112例吉西他滨不良反应分析[J]. 药物安全与合理应用, 2014, 23(17):2085-2088. [7] 陈万青, 郑荣寿, 曾红梅, 等. 2011年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2015, 24(01):1-10. doi: 10.3969/j.issn.1000-8179.20142170 [8] 杨堆进. 老年患者合理用药的研究进展[J]. 临床合理用药杂志, 2018, 11(9):174-177. [9] DERISSEN E J B, HUITEMA A D R, ROSING H, et al. Intracellular pharmacokinetics of gemcitabine, its deaminated metabolite 2', 2'-difluorodeoxyuridine and their nucleotides[J]. Br J Clin Pharmacol,2018,84(6):1279-1289. doi: 10.1111/bcp.13557 [10] 张艳华, 刘红. 抗肿瘤药物的严重不良反应与防治[J]. 药物警戒, 2010, 7(12):40-43. [11] 马力, 时俊峰, 童宁. 紫杉醇类药物的不良反应研究[J]. 中国药房, 2018, 29(21):3014-3017. doi: 10.6039/j.issn.1001-0408.2018.21.30 [12] 王喆元, 吴洪斌, 凌云华, 等. 我院2009年57例抗肿瘤药物不良反应报告分析[J]. 上海医药, 2010, 31(11):512-515. doi: 10.3969/j.issn.1006-1533.2010.11.012 [13] 吴洪斌, 潘丽琴, 刘加葳. 吉西他滨的不良反应及其防治[J]. 药物不良反应杂志, 2003, 5(3):176-177. doi: 10.3969/j.issn.1008-5734.2003.03.015 [14] 许晓东, 徐志英. 吉西他滨致骨髓抑制的临床观察[J]. 北方药学, 2013, 10(11):20-21. [15] 李捷, 欧阳学农, 陈曦. 吉西他滨合用顺铂致严重过敏反应及重度骨髓抑制1例[J]. 药物流行病学杂志, 2005, 14(6):371-372. doi: 10.3969/j.issn.1005-0698.2005.06.021 [16] 郑刚, 李成建, 王景禄. 吉西他滨不良反应[J]. 中国误诊学杂志, 2007, 7(10):2414. doi: 10.3969/j.issn.1009-6647.2007.10.271 [17] 张玫, 丁金萌, 卢佳姝. 313例铂类化疗药物常见不良反应分析[J]. 世界最新医学信息文摘, 2017, 17(99):179-181. [18] 陈强, 林小燕, 施纯玫. 肿瘤内科速查手册第2版[M]. 北京: 化学工业出版社, 2015: 71. [19] 袁卫华, 刘小渊. 肿瘤化疗后便秘56例的护理[J]. 中国误诊学杂志, 2012, 12(8):1993. [20] 胡巧织, 龚巧燕, 边桂芝, 等. 注射用紫杉醇脂质体致癫痫大发作1例[J]. 中国药物警戒, 2016, 13(6):378-379. [21] 史丽敏, 余俊先. 药物相关性癫痫的发作机制分析[J]. 中国医院用药评价与分析, 2011, 11(1):65-67. 期刊类型引用(2)
1. 罗敏,陈欢,赵福坤,苏穆,王远敏. 决策树支持下SmartDose在神经外科万古霉素个体化用药中的应用. 遵义医科大学学报. 2023(06): 605-611 .  百度学术
百度学术2. 杨浩,熊雄,刘长江. 骨科术后患者万古霉素峰谷浓度的影响因素及群体药动学预测比较. 中国医院药学杂志. 2023(24): 2722-2728 .  百度学术
百度学术其他类型引用(2)
-





 下载:
下载:

 下载:
下载: 

