-
脑中风是由于脑部血管突然破裂或因血管阻塞导致血液不能流入大脑而引起脑组织损伤的一类疾病[1]。大多数患者在治疗后会遗留不同程度的神经功能缺损,比如偏瘫、嘴歪眼斜、智力障碍、语言认知功能丧失等[2]。因而开发神经恢复剂,修复损伤神经功能尤为重要。修复受损神经功能的途径之一是促进被破坏或受损害的神经重塑[3]。神经重塑通过诱导神经元分化,促进突起向外生长,与其他神经元建立连接,重构皮层,从而修复损伤的神经功能[4]。
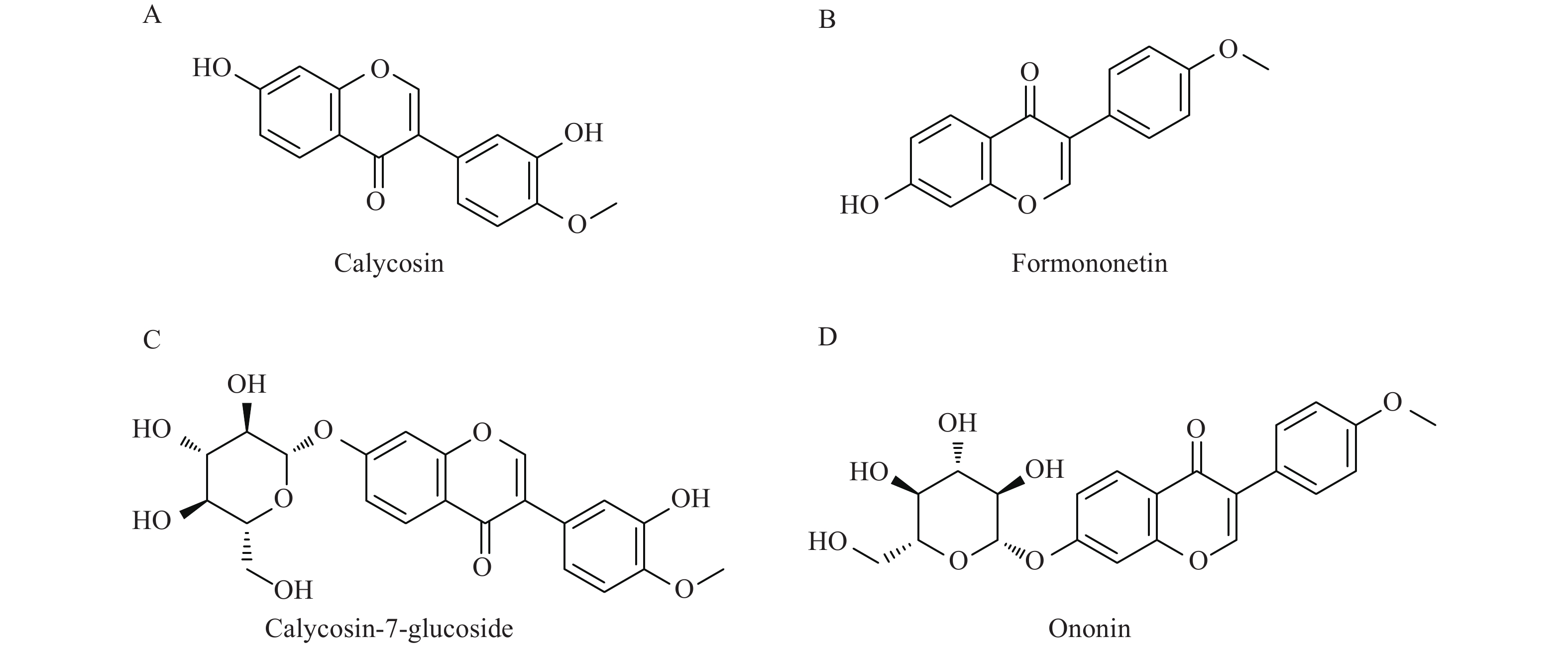
黄芪异黄酮类化合物主要包括毛蕊异黄酮、刺芒柄花素、毛蕊异黄酮苷、芒柄花苷,结构如图1所示[5]。毛蕊异黄酮、刺芒柄花素、毛蕊异黄酮苷、芒柄花苷对急性脑缺血具有神经保护作用,对缺血后脑损伤神经功能的恢复作用未见报道[6-8]。
PC 12细胞是来源于成年大鼠肾上腺髓质嗜铬细胞瘤的细胞系,培养PC 12细胞可动态观察其神经分化的过程[9],因此可将PC 12细胞作为筛选促神经分化、恢复损伤神经功能药物的理想模型。本项研究工作使用PC 12细胞,观察毛蕊异黄酮、刺芒柄花素、毛蕊异黄酮苷、芒柄花苷是否具有诱导细胞神经分化的能力。神经生长因子(nerve growth factor, NGF)具有明确的促进神经元分化作用[10],在本研究中用作阳性对照。
-
毛蕊异黄酮、毛蕊异黄酮苷、芒柄花苷(纯度≥98%,上海源叶生物科技有限公司);刺芒柄花素(纯度≥98%,成都普瑞法科技开发有限公司);二甲基亚砜(dimethyl sulfoxide,DMSO,Sigma公司);多聚-L-赖氨酸(Biosharp公司);胎牛血清(ScienCell公司);特级马血清(索莱宝公司);丙酮酸钠和RPMI 1640培养基(Gibco公司);磷酸盐缓冲液(博光公司);4',6-二脒基-2-苯基吲哚(DAPI)和Triton X-100(碧云天);4%多聚甲醛(武汉赛维尔生物科技有限公司);重组大鼠β-神经生长因子(NGF,R & D公司);β微管蛋白(β III-tubulin,Abcam公司);Alexa Fluor TM 568兔抗小鼠IgG(H+L)(Invitrogen公司)。
6孔板培养皿和10 ml培养皿(美国Corning公司);倒置荧光显微镜 (DMI3000 B,德国Leica公司);精密电子天平(美国Ohaus公司)。
-
PC 12细胞购自上海中国科学院细胞库,经复苏后,加入含10%马血清、5%胎牛血清、1%丙酮酸钠、100 U/ml青霉素和100 μg/ml链霉素的RPMI 1640培养基,放置于培养箱(37 ℃,95%空气,5%CO2)中传代培养,每2 d传代1次。
-
将PC 12细胞以5×104 /ml的密度涂覆在多聚-L-赖氨酸包被过的6孔板中,放置于培养箱中孵育过夜。24 h后,换分化培养基(含1%马血清、1%胎牛血清、1%丙酮酸钠、100 U/ml青霉素和100 μg/ml链霉素),加不同浓度NGF(0.3~100.0 ng/ml)、毛蕊异黄酮、刺芒柄花素、毛蕊异黄酮苷、芒柄花苷(0.01~10.00 μmol/L)继续培养。每天更换一次上述化合物和分化培养基,连续3 d。培养5 d后在显微镜下观察各组PC 12细胞突起向外生长的情况。将长度超过一个细胞体的神经突记为阳性细胞[11]。在每孔中随机选择5个视野,分别计算神经突细胞的百分比,然后计算平均值。
-
PC 12细胞处理方式同“1.3”项,培养5 d后用免疫荧光染色方法检测β III-tubulin蛋白的表达。各组PC 12细胞经4%多聚甲醛固定20 min、Triton X-100透化15 min、5%脱脂牛奶封闭1 h、一抗β III-tubulin(1:100)4 ℃孵育过夜、二抗(1:500)室温孵育1 h、DAPI室温染色20 min后在荧光显微镜下观察β III-tubulin和DAPI的表达情况。在每孔中随机选择5个视野,分别统计β III-tubulin表达的阳性细胞数目,然后计算平均值。
-
采用Graphpad软件分析,数据采用(均值±标准误)表示,组间数据采用方差分析,以P<0.05表示有显著性差异,P<0.01表示有极显著性差异。
-
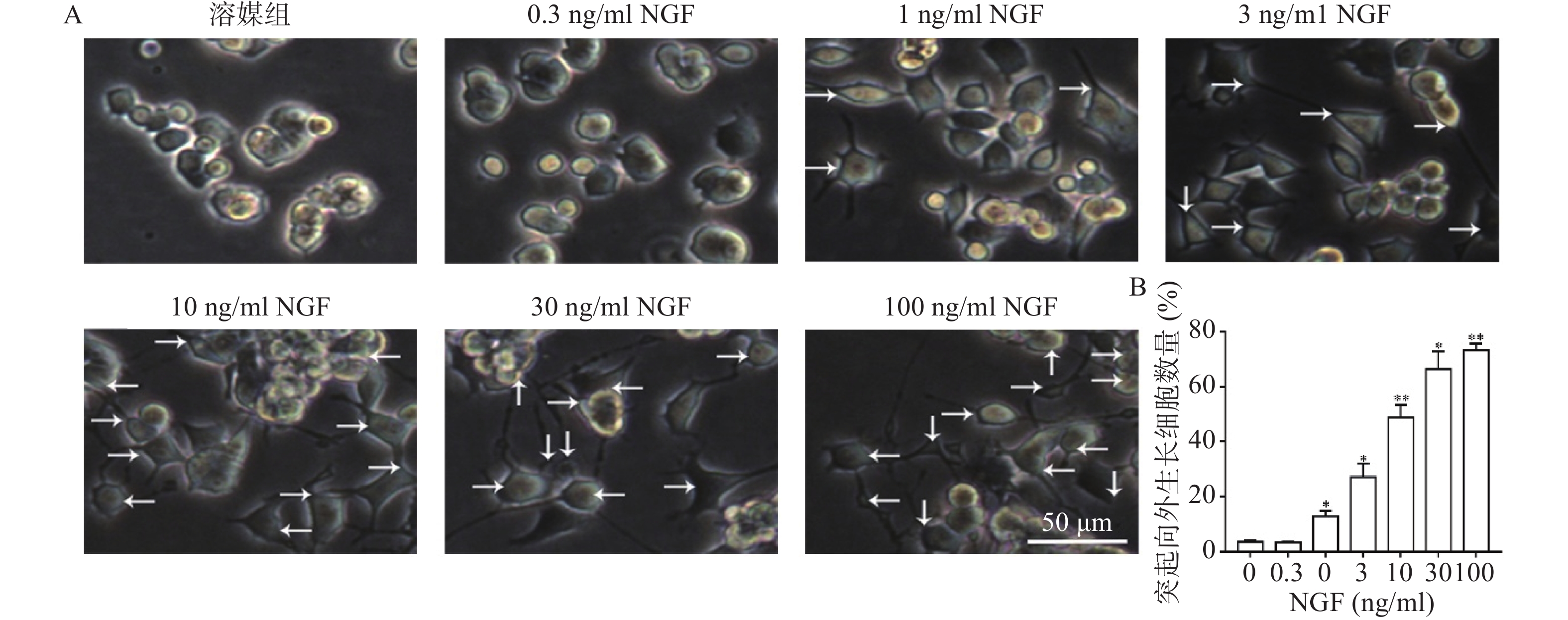
如图2所示,与溶媒组相比,0.3 ng/ml NGF对PC 12细胞突起向外生长无促进作用。与溶媒组相比,NGF(1~100 ng/ml)显著促进PC 12细胞突起向外生长,且具有浓度依赖性。
-
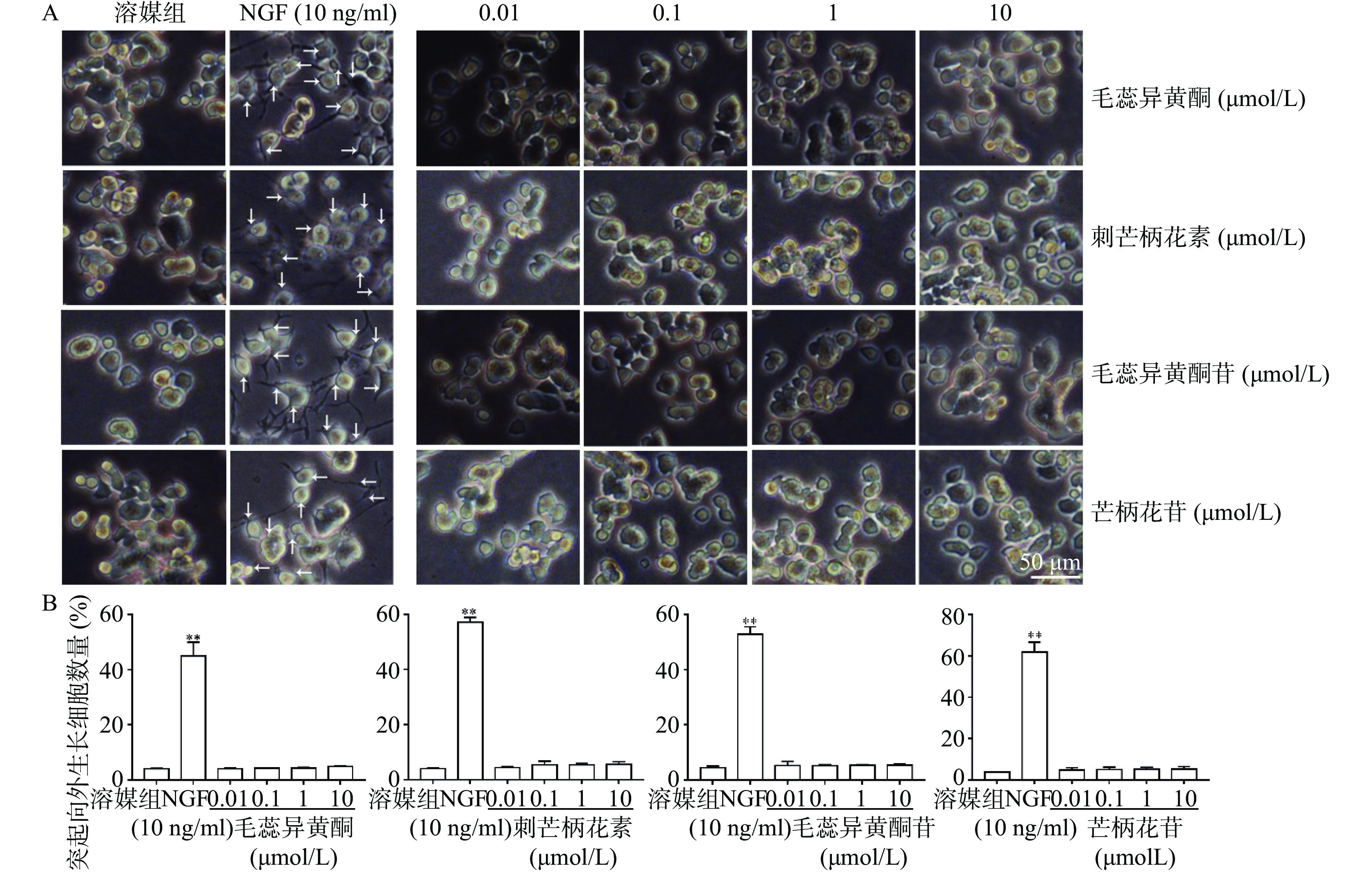
如图3所示,与溶媒组相比,10 ng/ml NGF能显著促进PC 12细胞突起向外生长。与溶媒组相比,毛蕊异黄酮、刺芒柄花素、毛蕊异黄酮苷、芒柄花苷(0.01~10 μmol/L)对PC 12细胞突起向外生长无促进作用。
-
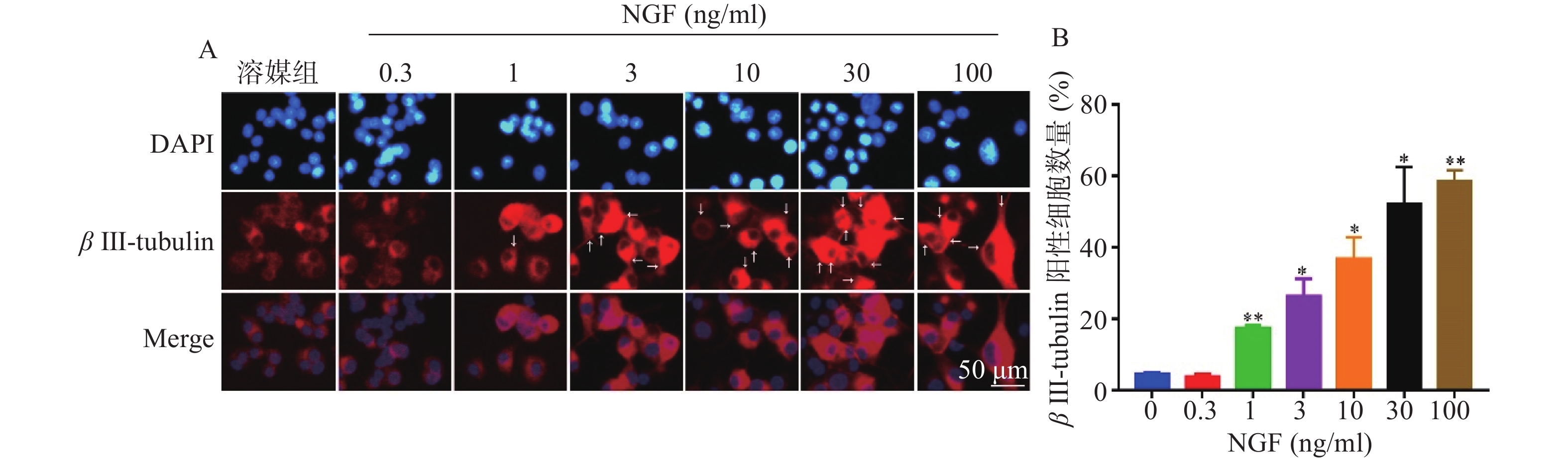
如图4所示,与溶媒组相比,0.3 ng/ml NGF对PC 12细胞中β III-tubulin蛋白表达无影响。与溶媒组相比,NGF(1~100 ng/ml)显著促进PC 12细胞中β III-tubulin蛋白的表达,且具有浓度依赖性。
-
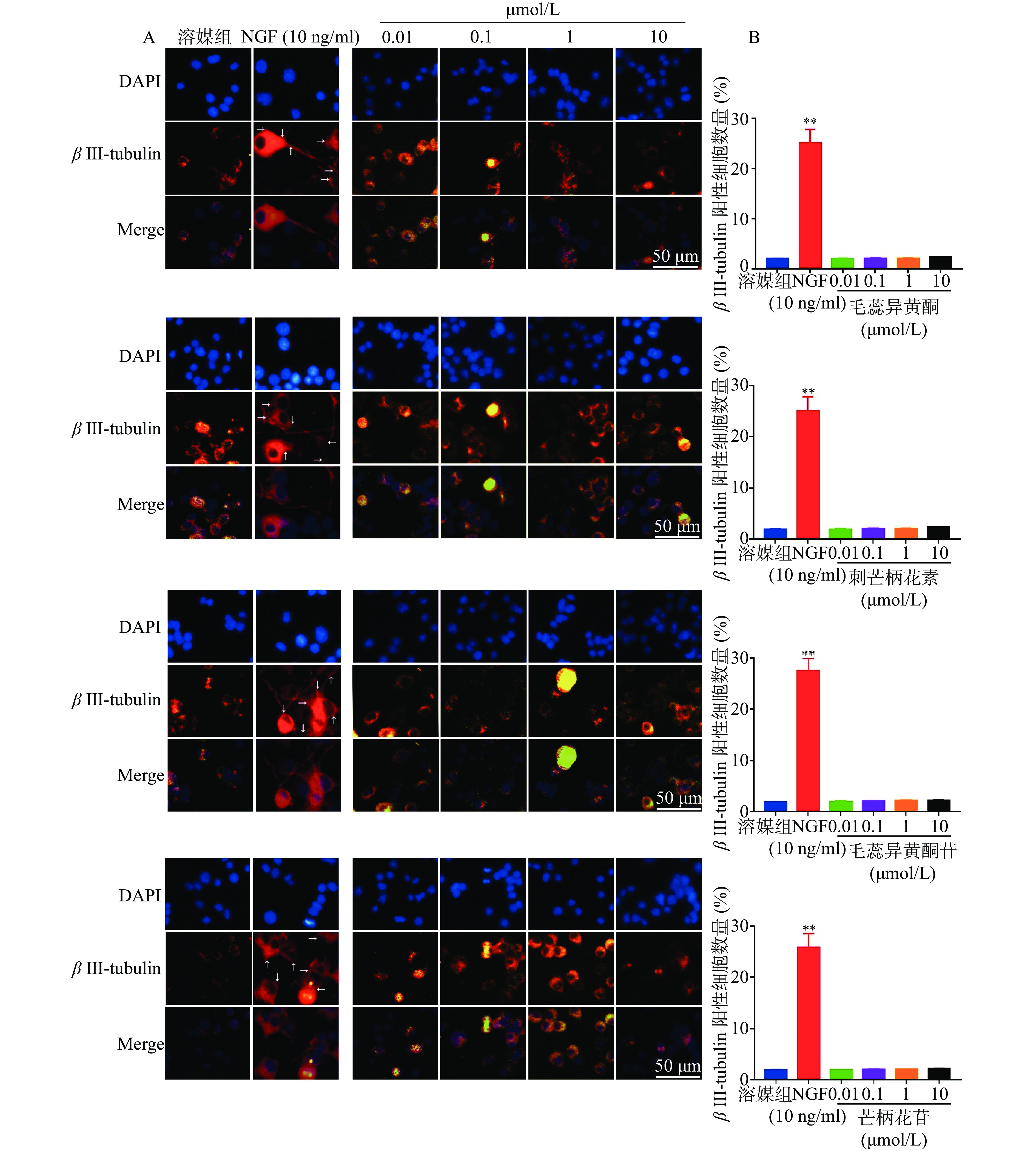
如图5所示,与溶媒组相比,10 ng/ml NGF能显著增加PC 12细胞中β III-tubulin蛋白的表达。与溶媒组相比,毛蕊异黄酮、刺芒柄花素、毛蕊异黄酮苷、芒柄花苷(0.01~10.00 μmol/L)对PC 12细胞中β III-tubulin蛋白表达无影响。
-
已有文献报道毛蕊异黄酮、刺芒柄花素、毛蕊异黄酮苷和芒柄花苷对急性脑缺血具有神经保护作用,通过抗自噬、抗凋亡、抗炎等发挥作用[7-8, 12-15]。毛蕊异黄酮、刺芒柄花素、毛蕊异黄酮苷和芒柄花苷对神经元分化、缺血后脑损伤神经功能的作用很少提及。本研究初步探讨了毛蕊异黄酮、刺芒柄花素、毛蕊异黄酮苷和芒柄花苷对PC 12细胞神经分化的影响,发现其未能诱导PC 12细胞分化。
在特定因素刺激下,神经元的突起向外生长,促进受损神经元的分化,重新建立神经网络,恢复受损的神经功能[16]。β III-tubulin在微管元件中只表示神经元,是神经细胞分化的表型标志物,增加其表达可改变神经元骨架,促进突起向外生长[17-18]。在本研究中,我们主要以PC 12细胞突起向外生长和β III-tubulin蛋白表达作为主要的分化指标。
在本研究中,用NGF(阳性对照)、毛蕊异黄酮、刺芒柄花素、毛蕊异黄酮苷、芒柄花苷分别刺激PC 12细胞,观察药物对细胞突向外生长的影响。利用免疫荧光染色来观察药物对PC 12细胞β III-tubulin蛋白表达的影响。通过以上两方面的初步研究,我们发现毛蕊异黄酮、刺芒柄花素、毛蕊异黄酮苷、芒柄花苷均没有促进PC 12细胞突起向外生长和β III-tubulin蛋白表达。
综上得出结论:毛蕊异黄酮、刺芒柄花素、毛蕊异黄酮苷、芒柄花苷对PC 12细胞分化无促进作用。
The effect of four compounds of astragalus isoflavones on the differentiation of PC 12 cells
-
摘要:
目的 探究毛蕊异黄酮、刺芒柄花素、毛蕊异黄酮苷、芒柄花苷对PC 12细胞分化的影响。 方法 培养PC 12细胞,与不同浓度的神经生长因子(NGF)、毛蕊异黄酮、刺芒柄花素、毛蕊异黄酮苷、芒柄花苷共处理5 d,1次/d,连续3次,观察PC 12细胞突起向外生长的情况。同时,用免疫荧光染色检测上述化合物对β微管蛋白(β III-tubulin)表达的影响。 结果 与对照组相比,毛蕊异黄酮、刺芒柄花素、毛蕊异黄酮苷和芒柄花苷(0.01~10.00 μmol/L)未能促进PC 12细胞突起向外生长和β微管蛋白的表达。 结论 毛蕊异黄酮、刺芒柄花素、毛蕊异黄酮苷、芒柄花苷不能促进PC 12细胞分化。 Abstract:Objective To investigate the effects of calycosin, formononetin, calycosin-7-glucoside and ononin on PC 12 cells differentiation. Methods PC 12 cells were cultured and treated with different concentrations of nerve growth factor (NGF), calycosin, formononetin, calycosin-7-glucoside and ononin for 5 days, once a day, 3 times in a row. The neurite outgrowth of PC 12 cells was observed and the expression of β III-tubulin were measured by immunofluorescence. Results Compared with the vehicle group, neurite outgrowth and the expression of β III tubulin in PC 12 cells had not promoted by calycosin, formononetin, calycosin-7-glucoside and ononin (0.01-10.00 μmol/L). Conclusion PC 12 cells differentiation could not be induced by calycosin, formononetin, calycosin-7-glucoside and ononin. -
Key words:
- calycosin /
- formononetin /
- calycosin-7-glucoside /
- ononin /
- PC 12 cells /
- cell differentiation
-
啤酒花(Humulus lupulus L.)别名忽布、香蛇麻、蛇麻花、啤瓦古丽(维吾尔语),为桑科葎草属植物,是我国新疆药食兼用的特色资源植物。同时,啤酒花还是啤酒酿造的重要原料之一,其不仅赋予了啤酒独特的风味,还延长了啤酒的保质期。人类使用啤酒花已有2000多年的历史,早在公元前2世纪,古巴比伦就曾栽培使用啤酒花。13世纪,啤酒花开始作为草药使用。1516年,德国颁布法令,将啤酒花限定为啤酒的唯一苦味添加剂[1]。啤酒花的花序中含有黄酮类、树脂类、多酚、多糖等多种化学成分,这些成分使其具有抗菌、抗肿瘤、抗氧化、降血糖、降血压,以及雌激素样等药理作用[2]。近年来,啤酒花在抗骨质疏松领域研究较多,展现出广阔的前景,现就有关情况作概要介绍。
1. 化学成分
1.1 树脂类
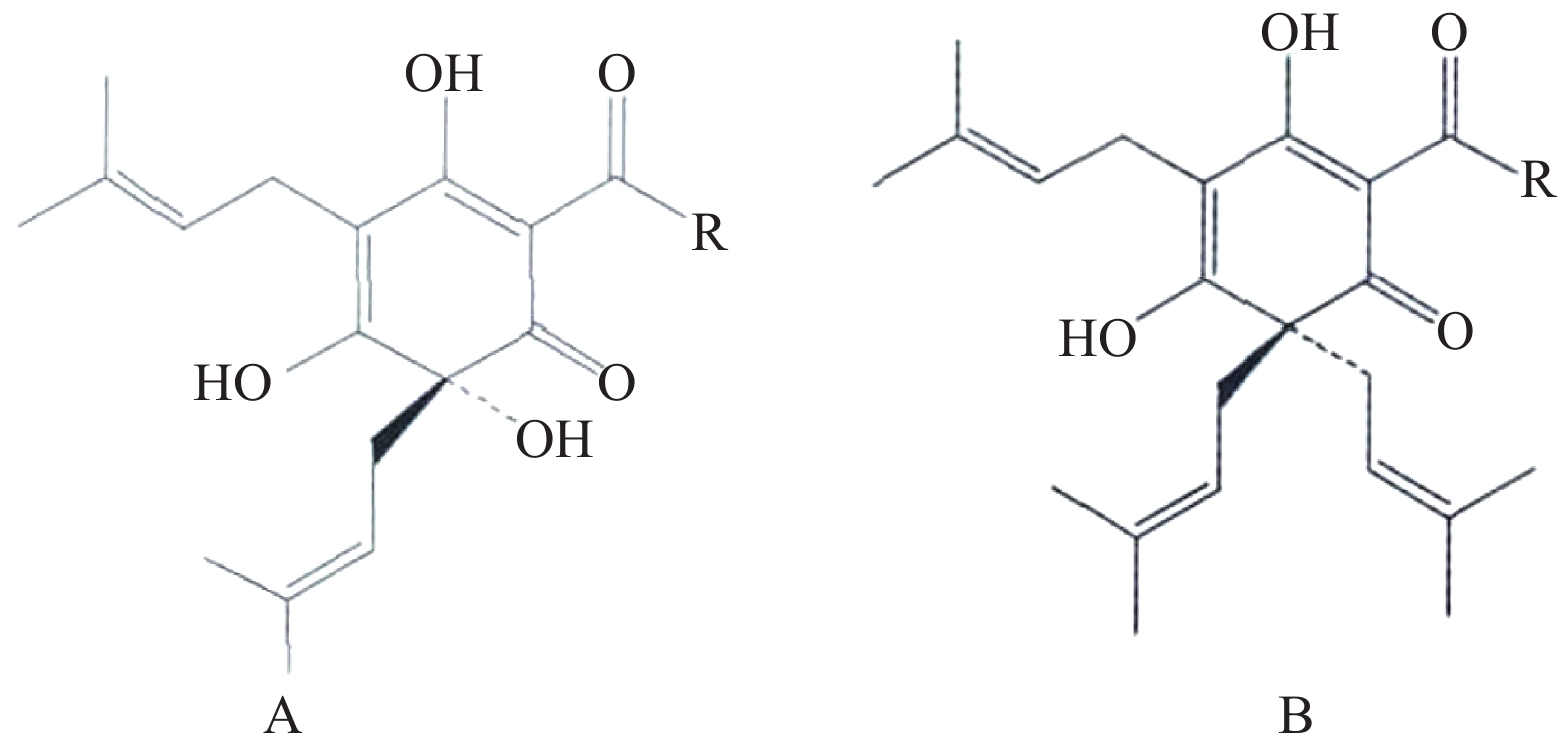
树脂类化合物为啤酒花中的主要成分,具有广泛的生物活性。欧洲酿造协会(EBC)根据不同有机溶剂中树脂类成分的溶解度差异,将其分为软树脂和硬树脂[3]。其中,α-酸和β-酸是啤酒花中最具代表性的软树脂类成分,也是啤酒花独特味道的主要来源。α-酸主要包括葎草酮(图1A)及其同系物,β-酸主要包括蛇麻酮(图1B)及其同系物[4]。在啤酒花中,β-酸含量较α-酸低,易被氧化形成β-软树脂。α-酸在一定条件下易转化为异α-酸,此类成分为啤酒中的主要苦味成分[5]。
1.2 黄酮类
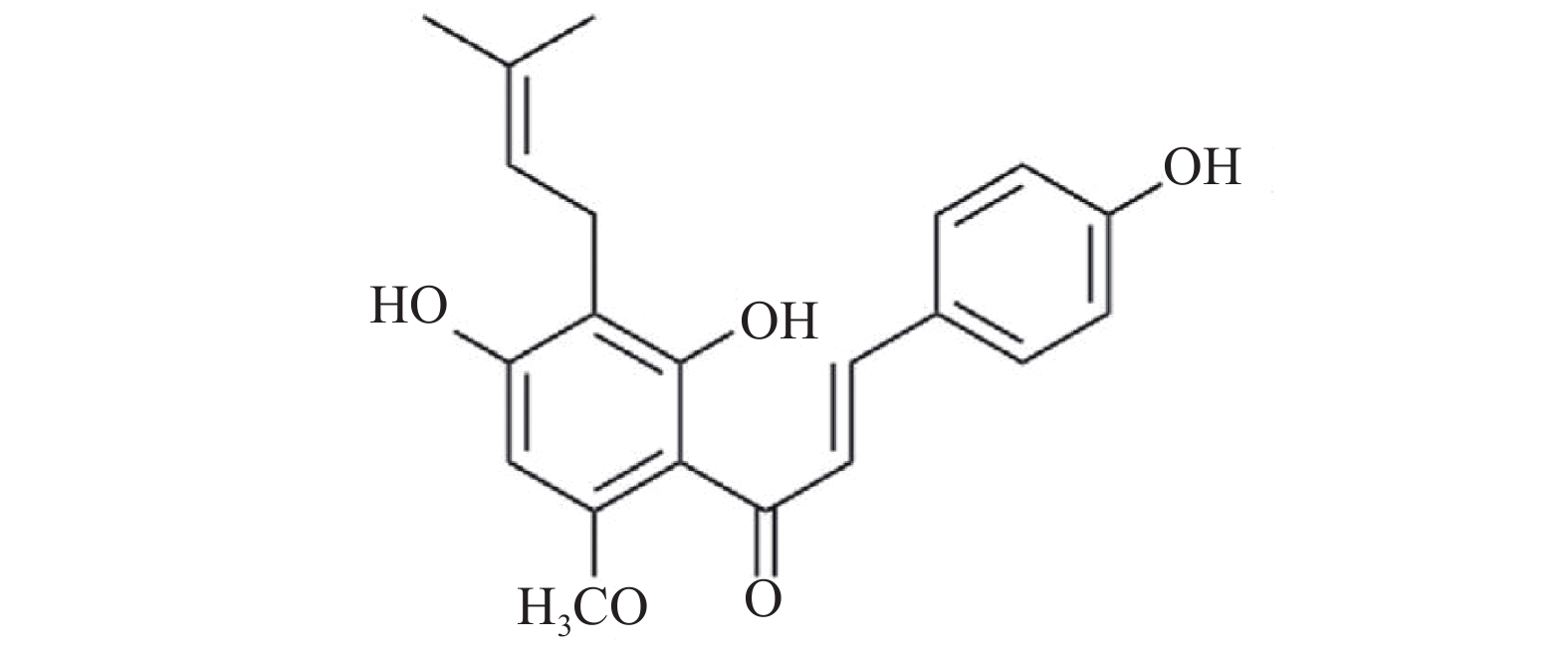
以黄腐酚(图2)为代表的黄酮类成分是啤酒花中重要的化学成分。根据母核结构的不同,可将其分为黄酮类、查尔酮类及黄烷类[6]。黄腐酚为啤酒花特有的异戊烯基类黄酮,最早被Power等[7]分离鉴定得到,主要集中在啤酒花蛇麻腺中,目前因其广泛的药理活性而备受关注。
1.3 挥发油类
啤酒花中的挥发油类成分均由啤酒花的蛇麻腺分泌,是啤酒花香味的来源。啤酒花挥发油主要含有石竹烯、香叶烯、葎草烯、法呢烯等及其脂、酮、醇类化合物[8]。早期研究普遍认为,萜烯类在啤酒花风味中起关键作用,但近年来研究表明,亲水性较强的萜烯醇类对啤酒花风味贡献更为突出[9]。
2. 抗骨质疏松作用
骨质疏松症是以骨量降低和骨微结构破坏为特点的全身性骨代谢疾病。在欧洲,啤酒花提取物用于治疗绝经后骨质疏松症。近年来,啤酒花在防治骨质疏松方面的作用受到广泛关注,其可能通过发挥雌激素样作用、缓解氧化损伤、调节骨形成-骨吸收平衡等途径维持骨稳态,来防治骨质疏松。
2.1 雌激素样作用
雌激素缺失是骨质疏松发病的主要因素之一[10]。啤酒花中的黄酮类成分8-异戊二烯基柚皮素(8-PN),是脱甲基黄腐酚的一种异构物,也是目前分离得到的最有效的植物雌激素[11]。早在2002年,Miligan等[12]即发现天然和人工合成的8-PN在人雌激素受体转染的酵母菌以及雌激素反应的人Ishikawa Var-I细胞中均显示出相似的生物活性,8-PN与两种构型的雌激素受体(ER-α、ER-β)均展现出良好的结合能力。体外筛选实验发现,其雌激素活性高于包括香豆素在内的多种常用植物雌激素。作为啤酒花中最具代表性的黄酮类成分黄腐酚同样具有显著的植物雌激素样作用。研究发现,在去卵巢小鼠中,30和90 mg/(kg·d)的黄腐酚均可显著抑制去卵巢小鼠雌激素缺失所致的体重增加,提高雌激素(E2)水平,抑制碱性磷酸酶(ALP)、抗酒石酸酸性磷酸酶(TRAP)等骨转换指标的高表达,并改善去卵巢小鼠的骨微结构破坏,增强骨密度,防治骨质空洞[13]。
啤酒花中的多种树脂类成分同样具有雌激素样作用。Holick等[14]在为期14周的临床试验中发现,树脂类成分、小檗碱、维生素D和维生素K配伍应用,可调节绝经后妇女的骨代谢水平,降低骨转换标志物骨钙素(OCN),并显著提高患者血清25-羟基维生素D含量,减少骨质丢失。Keiler等[15]以去卵巢大鼠为研究对象,观察标准酒花提取物对大鼠骨丢失的防治作用,结果显示,标准酒花提取物可显著减少大鼠胫骨干骺端破骨细胞的数量,并防止雌二醇消耗导致的骨小梁厚度减少,防治雌激素缺失所致的骨质疏松。
2.2 缓解氧化损伤
雌激素或雄激素缺失会降低骨骼防御氧化应激的能力,从而造成骨质流失,因此,高氧化应激水平与性激素缺乏同为诱发骨质疏松的重要原因[16]。黄酮类化合物大多有酚羟基以及较大的空间位阻,因此,多具有不同程度的抗氧化活性。吴婕等[17] 在研究黄腐酚与其他食品中成分的抗氧化作用时发现,黄腐酚与食品酸味剂柠檬酸、柠檬酸钠、维生素C对DPPH体系均存在协同抗氧化活性。Suh等[18]发现黄腐酚可通过激活氧化应激的关键通路Nrf2来降低MC3T3-E1成骨细胞的氧化损伤,同样证实了黄腐酚具有抗氧化作用。
2.3 维持骨稳态
成骨细胞的骨形成与破骨细胞的骨吸收在骨代谢中共同发挥作用,以维持骨稳态[19]。研究表明,在成骨细胞MC3T3-E1水平上,黄腐酚可显著上调ALP和成骨标记基因骨形成蛋白(BMP-2)、骨涎蛋白(BSP)的表达,并通过调控p38 MAPK和ERK信号通路相关机制,激活转录因子RUNX2,促进骨形成[20]。本课题组前期研究发现,黄腐酚既可以促进原代成骨细胞的增殖、ALP活性以及骨矿化水平,又可以提高骨形成相关蛋白BSP、BMP-2 和骨桥蛋白(OPN)的表达水平[13]。在抑制破骨细胞骨吸收方面,黄腐酚可通过破坏RANK与TRAF6之间的结合,抑制破骨细胞生成过程中NF-κB和Ca2+/NFATc1信号通路,并抑制破骨细胞生成相关标记基因,如组织蛋白酶K(CtsK)、活化T细胞核因子1(NFATc1)以及TRAP的表达,从而抑制骨吸收[21]。
啤酒花树脂类成分同样可以调节骨代谢平衡。蛇麻酮可显著促进成骨细胞增殖,提高ALP活性,促进骨矿化结节,并促进骨形成相关蛋白OCN、BSP和BMP-2的表达。葎草酮也可显著促进成骨细胞活性,并提高骨形成相关蛋白OCN、OPN、BSP和BMP-2的表达。在破骨细胞水平上,蛇麻酮和葎草酮均可降低破骨细胞数目,抑制破骨相关蛋白CtsK、金属基质蛋白酶9(MMP-9)的表达[22]。此外,本课题组前期还发现啤酒花乙醇提取物可显著促进成骨细胞的增殖、ALP活性及骨矿化结节,促进骨形成相关蛋白OPN和BMP-2的表达;并显著抑制破骨相关蛋白TRAP、CtsK、和MMP-9的表达,以维持骨代谢平衡,防止骨吸收大于骨形成所致的骨质流失[23]。
3. 相关产品及应用
啤酒酿制是啤酒花最为传统的一种应用方式,人体中的黄腐酚及相关异戊二烯黄酮类成分主要通过喝啤酒摄入[24]。近年来,啤酒花作为一种特色中药,其药食两用的特性得到了越来越多的关注。相关的健康产品,如美国西楚(Citra)、捷克萨兹(Saaz)的啤酒花颗粒、澳大利亚澳萃维(Nature's Way)啤酒花胶囊、芬兰麦诺美(Menomax)啤酒花浓缩片等层出不穷。现代研究已发现一些啤酒花相关产品在抗骨质疏松方面具有良好的活性。Ban等[25]采用去卵巢大鼠骨质疏松模型,研究Lifenol®的啤酒花提取物防治骨质疏松的作用,结果发现,该产品可显著改善去卵巢所致的大鼠体重增加,调节血脂和脂肪聚集,降低血流速度,改善大鼠潮热,并显著增加大鼠股骨的骨密度,改善骨质疏松。有直接证据表明,喝啤酒可以预防骨质疏松症。Kondo[26]以去卵巢大鼠为骨质疏松模型,研究啤酒对骨质疏松症的影响。结果发现,啤酒能显著抑制去卵巢引起的大鼠股骨骨丢失,且这种抑制作用在单用酒精或不加啤酒花酿造的啤酒中均没有呈现,表明啤酒中抗骨质疏松的活性成分来自啤酒花。此外,Ferk等[27]发现,人类连续饮用黄腐酚饮料14 d后,体内的氧化性嘌呤含量显著降低,氧化损伤程度得到缓解,且血清雌激素及骨钙素水平相对下降,骨代谢紊乱得到显著改善。
4. 我国啤酒花资源现状
学术界对啤酒花的起源地尚无定论,部分学者认为,啤酒花起源于中国[28-29]。在我国,啤酒花的发源地位于黑龙江省东南部的尚志市。1960年,国家轻工业部决定把新疆农场建成国家啤酒花生产基地,并从山东青岛、东北一面坡引进啤酒花。后经过40年的努力,啤酒花种植面积已达185.2公顷,成为新疆地区的主要经济作物之一。
我国的野生啤酒花种群主要分布在新疆的天山和阿尔泰山山脉附近。新疆地区由于光照充足,昼夜温差大,非常适宜啤酒花种植业的发展,并逐渐形成了范围广、规模大、生境类型多,且其成熟期差异明显的野生种质[3]。然而,近些年,啤酒花的资源开发及生产状况不容乐观。由于新疆地区种植的啤酒花主要是从美国、德国引进的品种,在异地栽培时间过长,生长性能下降,病虫害严重,品种退化严重,导致药材品质下降。再就目前常见的优质香型、香型、苦型和高α-酸型啤酒花的不同品种来看,α-酸含量高者大于8%(高α-酸型),低者3%~4%(苦型、香型),α-酸与β-酸比值高者大于2.0(高α-酸型),低者低于1.0(优质香型)。由此看来,重点活性成分苦味酸类在不同类型啤酒花中的含量、比例组成差异极大[4]。这就使得我们应加强从源头上的育种研究,改进抗病性,增加产量和苦味酸类成分的含量,利用栽培品种和育种系(或野生啤酒花)在合适条件下复合优良性状。
5. 展望
现代药理学研究分别从体内和体外实验明确了啤酒花及其活性成分的抗骨质疏松作用。黄腐酚、蛇麻酮和葎草酮均能够促进骨形成和抑制骨吸收,但其抗骨质疏松的深层次机制仍有待阐明。啤酒花对女性绝经后骨质疏松具有防治作用,但对老年性骨质疏松的作用尚不明确。因此,笔者认为阐明啤酒花及其活性成分的作用机制,既是为啤酒花临床应用及转化提供理论基础,亦可为拓展啤酒花的应用范围提供依据。此外,我国啤酒花资源丰富,但种质资源、遗传背景、亲缘关系不清,导致药材品质参差不齐。因此,摸清啤酒花种质资源家底,构建种质资源库;探讨不同基因在种群中的分布频率,弄清种群间的亲缘关系,建立药材的质量标准,方能为啤酒花活性研究和开发提供品质保障。
-
[1] XING C H, ARAI K, LO E H, et al. Pathophysiologic cascades in ischemic stroke[J]. Int J Stroke,2012,7(5):378-385. doi: 10.1111/j.1747-4949.2012.00839.x [2] 彭敏, 操瑶. 中西医结合治疗气虚血瘀型脑中风后遗症的临床效果观察[J]. 临床合理用药杂志, 2019, 12(23):44-45. [3] 劳祎林, 林吴, 媛伍, 等. 中医药疗法应用于脑梗死恢复期的研究进展[J]. 广西医学, 2019, 41(16):2102-2104. [4] 江泽珍. 生生不息的神经元[J]. 世界科学, 2019(8):22-23. doi: 10.3969/j.issn.1000-0968.2019.08.008 [5] 陈国辉, 黄文凤. 黄芪的化学成分及药理作用研究进展[J]. 中国新药杂志, 2008, 17(17):1482-1485. doi: 10.3321/j.issn:1003-3734.2008.17.006 [6] 郭超, 卞涛, 卜伟, 等. 毛蕊异黄酮通过抑制calpain-1的表达发挥抗脑缺血再灌注损伤的研究[J]. 现代生物医学进展, 2019, 19(4):631-635. [7] LI Z Z, DONG X H, ZHANG J F, et al. Formononetin protects TBI rats against neurological lesions and the underlying mechanism[J]. J Neurol Sci,2014,338(1-2):112-117. doi: 10.1016/j.jns.2013.12.027 [8] REN M, WANG X D, DU G Q, et al. Calycosin-7-O-β-D-glucoside attenuates ischemia-reperfusion injury in vivo via activation of the PI3K/Akt pathway[J]. Mol Med Rep,2016,13(1):633-640. doi: 10.3892/mmr.2015.4611 [9] 于玲, 王知斌, 王秋红, 等. 黄芪中黄酮类化合物药理作用研究进展[J]. 中医药信息, 2018, 35(2):104-108. [10] ALOE L, ROCCO M L, BALZAMINO B O, et al. Nerve growth factor: a focus on neuroscience and therapy[J]. Curr Neuropharmacol,2015,13(3):294-303. doi: 10.2174/1570159X13666150403231920 [11] CUI W, CUI G Z, LI W M, et al. Bis(12)-hupyridone, a novel multifunctional dimer, promotes neuronal differentiation more potently than its monomeric natural analog huperzine A possibly through α7 nAChR[J]. Brain Res,2011,1401:10-17. doi: 10.1016/j.brainres.2011.05.042 [12] WANG Y, REN Q Y, ZHANG X, et al. Neuroprotective mechanisms of calycosin against focal cerebral ischemia and reperfusion injury in rats[J]. Cell Physiol Biochem,2018,45(2):537-546. doi: 10.1159/000487031 [13] WANG Y, DONG X H, LI Z Z, et al. Downregulated RASD1 and upregulated miR-375 are involved in protective effects of calycosin on cerebral ischemia/reperfusion rats[J]. J Neurol Sci,2014,339(1-2):144-148. doi: 10.1016/j.jns.2014.02.002 [14] SONG L, LI X P, BAI X X, et al. Calycosin improves cognitive function in a transgenic mouse model of Alzheimer's disease by activating the protein kinase C pathway[J]. Neural Regen Res,2017,12(11):1870-1876. doi: 10.4103/1673-5374.219049 [15] LIANG K, YE Y, WANG Y, et al. Formononetin mediates neuroprotection against cerebral ischemia/reperfusion in rats via downregulation of the Bax/Bcl-2 ratio and upregulation PI3K/Akt signaling pathway[J]. J Neurol Sci,2014,344(1-2):100-104. doi: 10.1016/j.jns.2014.06.033 [16] RAO S N, PEARSE D D. Regulating axonal responses to injury: the intersection between signaling pathways involved in axon myelination and the inhibition of axon regeneration[J]. Front Mol Neurosci,2016,9:33. [17] MOSKOWITZ P F, OBLINGER M M. Sensory neurons selectively upregulate synthesis and transport of the beta III-tubulin protein during axonal regeneration[J]. J Neurosci,1995,15(2):1545-1555. doi: 10.1523/JNEUROSCI.15-02-01545.1995 [18] SQUIZZATO A, BELLESINI M, TAKEDA A, et al. Clopidogrel plus aspirin versus aspirin alone for preventing cardiovascular events[J]. Cochrane Database Syst Rev,2017,12:CD005158. -





 下载:
下载:
 下载:
下载: