-
盐酸安罗替尼(anlotinib hydrochloride, AL3818),商品名福可维,是一种以血管内皮生长因子(VEGF)受体、成纤维细胞生长因子(FGF)受体、血小板衍生生长因子(PDGF)受体、干细胞因子受体(c-kit)为靶点的新型口服多靶点酪氨酸激酶抑制剂(TKIs)[1]。2018年5月在我国批准上市,这是我国药企自主研发的1.1类新药,截止目前已获批3个适应证,分别为三线治疗非小细胞肺癌(NSCLC)、三线治疗小细胞肺癌(SCLC)以及二线治疗软组织肉瘤。安罗替尼对于治疗食管癌[2]、甲状腺髓样癌[3]和转移性肾细胞癌[4]等也有一定疗效。目前正在开展相关临床试验,以期获得药监部门批准更多的适应证。随着安罗替尼在临床上的推广应用,越来越多与其相关的药物不良反应(ADR)被报道。本文对安罗替尼上市后发表的有关其ADR的病例报道进行分析,以期为临床了解其ADR提供更多的真实数据,为更安全合理应用安罗替尼提供参考依据。
-
以“安罗替尼”或“福可维”为关键词检索中国知网、万方和维普数据库,以“anlotinib”或“AL3818”为关键词检索Web of Science、Pubmed、Wiley Online Library数据库,检索时段为2018年5月至2020年6月,收集公开发表的与安罗替尼上市后相关ADR的病例报道。
-
纳入标准:根据《药品不良反应报告和监测管理办法》,评价ADR与安罗替尼关联性为肯定、很可能或可能的病例报道。排除标准:①重复文献;②病例报道主要以观察个案疗效为主的文献;③对ADR描述不详细的文献;④临床试验;⑤综述。
-
采用回顾性研究方法,详细阅读纳入研究的文献,提取患者的性别、年龄、既往病史、用药原因、合并用药情况(仅记录主要治疗药物)、用药剂量、出现ADR的时间、ADR名称及临床表现、针对ADR的处理方法及转归等信息,根据《监管活动医学词典》(MedDRA 22.1版)对ADR累及的系统/器官进行分类统计。
-
共检索到89篇相关的病例报道文献,经过筛选得到符合要求的文献共18篇,合计纳入20个病例。对纳入的文献进行信息提取汇总,详细结果见表1。
表 1 安罗替尼致ADR案例报道统计表
序号 性别 年龄/岁 用药原因 合并用药 ADR名称 ADR处置 转归 再暴露 1[5] 男 50 NSCLC PD-1抑制剂 头晕、头痛、视物模糊、高血压 停药;甲钴胺片、羟考酮控释片、氨氯地平 好转 未使用 2[6] 男 59 NSCLC 无 食欲减退、乏力、低钠血症 停药;补钠、限水、托伐普坦 好转 未使用 3[7] 女 75 NSCLC 吉非替尼 皮下出血 停药 好转 未使用 4[8] 女 70 SCLC 无 头晕、高血压 停药 好转 未使用 5[9] 女 55 卵巢癌 无 肿瘤溶解综合征、头晕、视物模糊、尿隐血及蛋白尿 停药;水化、碱化尿液 好转 未使用 6[10] 男 39 NSCLC 无 手足综合征、高血压、高脂血症 减量至10 mg,5 d后停药;特比萘芬软膏、替米沙坦、阿托伐他汀钙片 好转 未使用 7[11] 女 36 NSCLC 无 高血压、急性心肌梗死 停药;抗血小板、调脂、改善循环 好转 未使用 8[12] 男 52 NSCLC 无 咳嗽、咯血 蛇毒血凝酶、云南白药 好转 未停药 9[12] 女 48 NSCLC 无 乏力、食欲减退、转氨酶升高、胆红素升高 腺苷蛋氨酸 好转 未停药 10[12] 男 74 NSCLC 无 头晕、乏力、高血压、蛋白尿 减量至10 mg;控制血压 好转 未停药 11[13] 女 67 NSCLC 替吉奥 过敏性紫癜 停药;抗感染、激素,保肾、利尿、补充白蛋白 好转 未使用 12[14] 女 76 卵巢癌 无 乏力、高血压、手足综合征 停药;卡托普利、氨氯地平 好转 未诱发ADR 13[15] 男 73 SCLC 无 间质性肺炎 停药;抗感染、激素、支持治疗 好转 未使用 14[16] 男 73 NSCLC 无 高血压 奥美沙坦、硝苯地平 好转 未停药 15[17] 男 68 NSCLC 无 高血压 硝苯地平、缬沙坦 好转 未停药 16[18] 男 69 NSCLC 无 口腔黏膜炎、支气管胸膜瘘 停药;抗感染、支持治疗 死亡 无 17[19] 女 61 NSCLC 无 头痛、恶心 停药 好转 未使用 18[20] 男 58 NSCLC 无 口腔黏膜炎、手足综合征、高脂血症、高血压、主动脉夹层 停药;手术、抗凝、控制血压 好转 未使用 19[21] 女 61 胶质母细胞瘤 无 血小板降低、高血压 停药;硝苯地平 好转 未使用 20[22] 女 66 胆管癌 无 咳嗽、胸闷、手足综合征、高血压 停药;抗过敏、美洛昔康片、控制血压 好转 未诱发ADR -
纳入研究的20个病例中,男性10例,女性10例,男女比例为1∶1。患者的平均年龄为61.5岁,年龄中位数为63.5岁(最小年龄36岁,最大年龄76岁)。
-
使用安罗替尼治疗NSCLC的病例数最多,其中超说明书用药4例(20.0%),见表1。
-
所有20例病例的起始给药方案均采用说明书推荐的给药方案,即口服安罗替尼12 mg/d,连续服药2周,停药1周。2例(10.0%)因发生不良反应减量至10 mg/d。
-
使用安罗替尼的20例患者中,4例(20.0%)出现1种ADR,7例(35.0%)出现2种ADR,3例(15.0%)出现3种ADR,5例(25.0%)出现4种ADR,1例(5.0%)出现5种ADR,出现ADR共52例次。除6例次发生时间不详外,其余46例次ADR发生时间见表2。
表 2 用药后出现ADR的时间分布情况
ADR出现时间(t/d) 例次 构成比(%) 1~7 6 13.0 8~14 11 23.9 15~21 3 6.5 22~30 3 6.5 31~60 16 34.8 ≥61 7 15.2 合计 46 100.0 -
安罗替尼所致的ADR累及9个系统/器官,其中以血管与淋巴系统最为常见,其次是皮肤及皮下组织、神经系统、代谢系统等,详见表3。
表 3 ADR累及系统/器官及临床表现
系统/器官 临床表现(例次) 总例次 构成比(%) 血管与淋巴管 高血压(11) 11 21.15 皮肤及皮下组织 手足综合征(4)、皮下出血(1)、过敏性紫癜(1) 6 11.54 神经系统 头晕(4)、头痛(2) 6 11.54 代谢及营养类 食欲减退(3)、高脂血症(2)、低钠血症(1) 6 11.54 呼吸系统、胸及纵隔疾病 咳嗽(2)、咯血(1)、间质性肺炎(1)、支气管胸膜瘘(1) 5 9.61 胃肠系统 口腔黏膜炎(2)、恶心(1) 3 5.77 心脏 胸闷((1)、急性心肌梗死(1)、主动脉夹层(1) 3 5.77 眼睛 视物模糊(2) 2 3.85 其他 蛋白尿(2)、血尿(1)、转氨酶升高(1)、胆红素升高(1)、血小板降低(1)、乏力(4) 10 19.23 合计 52 100.00 -
20例病例中,大部分患者经处理后好转,1例(5.0%)停药且对症处理后死亡,见表1。
-
安罗替尼在我国上市3年,上市时间短,与其相关的ADR病例报道数量较少,本文对18篇文献进行信息提取,仍提取到说明书未提及的ADR,包括过敏性紫癜、支气管胸膜瘘、急性心肌梗死和主动脉夹层。
-
目前与安罗替尼相关的ADR案例报道数量较少,暂时无法通过纳入研究的20个病例的基本信息分析其与ADR之间的相关性。发生ADR的患者平均年龄为61.5岁,可能与中老年患者肿瘤发病率较高有关。
-
从表2可以看到,大部分不良反应发生在用药2个月后。安罗替尼半衰期(t1/2)为(96±17)h,其较长的t1/2会使血药浓度升高导致药物积聚,连续给药后在第14天可达到最高血药浓度[23]。因此,安罗替尼说明书建议连续给药2周,停药1周。用药后第3周内ADR发生率比第1周和第2周低,可能与安罗替尼给药方案有关。但由于个体差异,ADR发生与时间的关系仍需进一步研究。
-
VEGF是安罗替尼的作用靶点之一,研究表明VEGF抑制剂与各种心血管疾病(包括高血压、缺血性心脏病、心力衰竭、QT间隔延长和血栓栓塞)发生率增加相关[24-26]。提取到的52例次ADR中,累及的系统/器官分类占比最高的为血管与淋巴系统,均为高血压。与本文提取到的结果相同,安罗替尼的临床研究中,高血压也是最常见的ADR[27]之一。高血压是VEGF抑制剂常见的ADR且存在剂量依赖性,但其机制尚不明确[28]。使用安罗替尼致高血压应及时处理,控制血压最常用的是血管紧张素转换酶抑制剂(ACEI)或血管紧张素II受体拮抗剂(ARB),若控制不佳,可以加用其他降压药(如钙离子拮抗剂、利尿剂、β受体阻滞剂等)。值得注意的是,安罗替尼通过CYP3A4酶代谢,应避免同时使用CYP3A4酶抑制剂(如维拉帕米或地尔硫䓬等)[27]。研究结果表明[29],既往存在高血压病史、高龄和超重是VEGF抑制剂诱发高血压的重要危险因素。因此,具有高危因素的患者在临床上使用安罗替尼时,医生及临床药师更应密切关注患者血压以及因高血压引起的一系列并发症,并进一步研究这些因素之间复杂的相关性[30]。
VEGF抑制剂与可逆性后部白质脑病综合征(PRES)的风险增加相关[31]。1号病例[5]考虑可能为安罗替尼导致PRES,PRES通常是可控的,但若未能及时发现,可能会导致严重和永久性的中枢神经系统损伤,甚至死亡。针对PRES尚无较为成熟的防治方案,因此临床上应用安罗替尼应警惕PRES不良反应的相关症状,及时对症处理。
-
研究表明,肾脏损伤与VEGF抑制剂有关,通常表现为蛋白尿,血尿,偶见血清肌酐升高[32]。VEGF抑制剂诱导蛋白尿的机制可能为抑制足细胞上的VEGF、诱导肾小球内皮细胞脱离和肥大以及导致肾小球血栓性微血管病等[33]。在ALTER-0303(安罗替尼治疗NSCLC Ⅲ期临床试验)研究中蛋白尿发生率为28.9%,建议尿蛋白≥2.0 g/L的患者应停用安罗替尼,直至蛋白尿<1.0 g/L,然后以较低的剂量恢复用药[27]。Zhang等[34]在一项真实世界研究中观察到使用安罗替尼后蛋白尿发生率为17.3%。本文也提取到蛋白尿2例次,血尿1例次。持续大量的蛋白尿会影响肾功能,对患有肾脏疾病和心血管疾病的患者危害更大,因此,定期监测和及时控制蛋白尿十分重要,建议对于决定开始使用安罗替尼的患者,应评估患者是否存在肾脏疾病,并在每个周期治疗前,进行尿蛋白定量检测。治疗上使用ACEI或ARB可减少蛋白尿,控制盐分摄入以及使用糖皮质激素可能会使足细胞的细胞骨架稳定从而减少蛋白尿[33]。
-
在ALTER-0303研究中,发现安罗替尼所致的皮肤及其皮下组织ADR的患者中,有数例是由于手足综合征导致的药物减量[27]。本文提取到使用安罗替尼出现6例次累及皮肤及皮下组织的ADR。迄今为止,尚未阐明酪氨酸激酶抑制剂(TKIs)导致手足综合征的确切机制,其可能机制[33]为:①毛细血管中的药物浓度增加;②血管修复受损,导致细胞凋亡和产生炎症;③干扰内皮细胞生存机制。严重的手足综合征会导致疼痛、感染甚至影响日常生活。因此,发生手足综合征的患者,应根据其严重程度予以治疗,在使用安罗替尼期间,建议患者使用软鞋垫等保护脚的压力点。对于手足综合征评级为1~2级的患者可局部使用润肤剂、抗生素或可的松软膏等处理,≥3级的应考虑停药[27,33]。
-
本文观察到16号病例[18]使用安罗替尼后发生支气管胸膜瘘,这是目前考虑与安罗替尼相关的支气管胸膜瘘ADR首例报道,且该患者因支气管胸膜瘘死亡。安罗替尼说明书未提及支气管胸膜瘘不良反应,可能由于临床试验样本量较小、研究观察周期短有关,这也提示医生和临床药师应警惕说明书未提及的ADR。安罗替尼已获批3个适应证,预计有越来越多的患者因使用安罗替尼获益。但其ADR发生率较高(尤其是心血管系统),临床使用过程中应密切监测,同时应注意在长期使用过程中出现新的或严重的ADR。
本文的不足之处在于:①安罗替尼2018年5月在中国上市,应用时间较短,目前上市后发表的相关文献较少,因此本文获得的病例数较少;②由于不同的文章采用的不良反应分级版本不同,且部分文章未对ADR进行分级,因此本文未对不良反应分级进行统计分析。
Literature review and analysis of adverse drug reactions of anlotinib
-
摘要:
目的 通过分析安罗替尼致不良反应的临床表现、发生特点、处置及转归情况,以期为临床安全合理应用安罗替尼提供有价值的参考依据。 方法 通过检索Web of Science、Pubmed、Wiley Online Library、中国知网、万方和维普数据库中有关安罗替尼上市后不良反应的病例报道,筛选后采用回顾性分析方法,对患者的基本情况、不良反应发生时间、特点、处理、转归以及累及的器官/系统等进行整理分析。 结果 共收集20例病例,男性10例,女性10例,年龄中位数为63.5岁(36~76岁)。不良反应多发生在用药后2个月内,共发生52例次,累及9个系统/器官,其中以血管与淋巴管类疾病最为常见(21.2%)。 结论 在安罗替尼临床推广应用后,心血管系统不良反应发生率较高,用药过程应密切监测,同时注意监测说明书中提及的和潜在的不良反应。 Abstract:Objective To review and analysis the clinical manifestations, occurrence rules, treatment and outcomes of adverse drug reactions caused by anlotinib in order to provide reference for safety and reasonable use of anlotinib in clinical practice. Methods The cases reports of anlotinib were searched in Web of Science, Pubmed, Wiley Online Library, CNKI, Wanfang and VIP. The basic patient information, adverse reaction time, characters, treatment, outcomes and involved systems or organs were collected and analyzed. Results A total of 20 cases were collected, 10 females and 10 males, with a median age of 63.5(36~76 years old). Adverse drug reactions mostly occurred within 2 months after the medication. 52 cases occurred in total, involving 9 systems/organs, of which blood and lymphatic system disorders (all were hypertension) were the most common (21.2%). Conclusion After the administration of anlotinib, the incidence rate of adverse reactions in the cardiovascular system is relatively high. The medication process should be closely monitored, and attention should be paid to monitoring the potential adverse reactions mentioned in the instructions. -
Key words:
- anlotinib /
- adverse drug reactions /
- retrospective analysis
-
紫茶生长于非洲肯尼亚海拔1 500~2 000 m的地区,主要成分为多酚类物质。现代药理研究表明,天然植物中的多酚具有抗肿瘤[1]、抗氧化[2]、抗菌[3]、抗衰老[4]等功效。课题组前期研究发现,紫茶提取物中多酚的纯度不高,直接影响相关制剂的开发。近年来,大孔吸附树脂的应用越来越广泛,尤其是在天然药物有效成分分离和纯化方面具有显著优势[5-8]。本实验以紫茶为研究对象,探索大孔吸附树脂对紫茶总多酚的纯化工艺,以期制备出纯度较高的紫茶总多酚,为其进一步开发利用提供理论依据。
1. 仪器与试药
UV-2550型紫外分光光度计(日本岛津);AUX220型电子分析天平(精度:0.1 mg,日本岛津);HH-2数显恒温水浴锅(江苏金坛市友联仪器研究所)。KQ-500B型超声波清洗器(昆山超声仪器有限公司)。
肯尼亚紫茶(批号:20181030,火烈鸟茶叶有限公司);没食子酸对照品(批号:110831-201605,中国食品药品检定研究院);铁氰化钾(温州市化学用料厂);ADS-17、D101、D301、AB-8、X-5型大孔吸附树脂(安徽三星树脂科技有限公司);氯化铁、盐酸、乙醇等试剂(西陇科学股份有限公司),以上试剂均为分析纯,水为纯化水。5种大孔吸附树脂的物理参数详见表1。
表 1 5种型号大孔吸附树脂物理参数型号 外观 极性 粒径(l/nm) 比表面积(m2/g) 平均孔径(l/μm) ADS-17 白色不透明球状颗粒 氢键 0.3~1.25 90~150 25~30 D101 白色半透明球状颗粒 非极性 0.3~1.25 480~520 25~28 D301 浅黄色半透明球状颗粒 中极性 0.3~1.25 550~600 48~58 AB-8 白色不透明球状颗粒 弱极性 0.3~1.25 480~520 130~140 X-5 白色不透明球状颗粒 非极性 0.3~1.25 500~600 290~300 2. 方法与结果
2.1 紫茶总多酚的含量测定
2.1.1 对照品溶液的制备
精密称取干燥至恒重的没食子酸对照品28.4 mg,置于100 ml量瓶中,加纯化水溶解并稀释至刻度,摇匀制备成母液。精密吸取1 ml母液置10 ml量瓶中,加纯化水稀释至刻度,配制成浓度为28.4 μg/ml的对照品溶液,置于冰箱中2~8 ℃避光保存。
2.1.2 供试品溶液的制备
称取紫茶粉末5.0 g,置于圆底烧瓶中,加入50%乙醇500 ml,加热回流提取30 min,放冷至室温,将药液滤过除去沉淀,滤液用50%乙醇补足减失的重量并稀释至500 ml。精密吸取1 ml稀释液,置于100 ml量瓶中,加水稀释至刻度,即得。
2.1.3 线性关系及方法学考察
分别精密吸取浓度为28.4 μg/ml的没食子酸对照品溶液0.2、0.3、0.5、0.8、1.0和1.2 ml于25 ml量瓶中,依次加入0.1 mol/L FeCl3溶液1.0 ml、1%K3[Fe(CN)6]溶液2.0 ml和0.1 mol/L HCl溶液0.5 ml,用纯化水稀释至刻度,摇匀,于室温下避光放置60 min。以相应试剂为空白,在775 nm处测定吸光度。以没食子酸质量浓度(X,μg/ml)为横坐标,以吸光度(Y)为纵坐标,绘制标准曲线,得回归方程:Y=0.769 9X+0.027 3(r=0.999 7),表明没食子酸浓度在0.227~1.363 μg/ml范围内与吸光度呈良好的线性关系。方法学考察结果表明,专属性良好,平均回收率为100.28%,RSD为2.09%;精密度和重复性试验的RSD小于3%。显示本方法准确可靠。
2.2 大孔吸附树脂的预处理
取5种不同型号的大孔吸附树脂在95%乙醇中浸泡24 h,使其充分溶胀,将浸泡后的树脂装柱,用95%乙醇以5 ml/min的体积流量冲洗,直至流出液澄清,之后用2倍体积的4%盐酸溶液浸泡3 h,用纯化水以5 ml/min的体积流量冲洗至中性,再用2倍体积的5%氢氧化钠溶液浸泡3 h,用纯化水以5 ml/min的体积流量冲洗至中性,最后用95%乙醇浸泡保存,临用时以5 ml/min体积流量的纯化水冲洗至中性。
2.3 静态吸附行为考察
2.3.1 大孔吸附树脂的筛选
取预处理后的ADS-17、D101、D301、AB-8、X-5型大孔吸附树脂约1 g,精密称定,共5份,置于50 ml具塞磨口锥形瓶中。加入质量浓度为50 μg/ml(以多酚含量计)的紫茶总多酚提取液20 ml,在30 ℃水浴的条件下振荡吸附24 h。吸附结束后,滤过,取续滤液按照“2.1”项下方法测定总多酚的含量,计算各树脂在30 ℃下对紫茶总多酚的吸附量和吸附率。然后,将上述吸附饱和的大孔树脂取出,用纯化水清洗后,分别加入70%乙醇20 ml,在30 ℃水浴的条件下振荡24 h,进行静态解吸,计算其解吸率,结果见表2。计算公式如下:
表 2 不同类型大孔树脂对紫茶总多酚的静态吸附率和解吸率树脂型号 吸附量(μg/g) 吸附率(%) 解吸量(μg/g) 解吸率(%) ADS-17 554.9 68.98 459.0 82.72 D101 621.6 77.74 341.4 54.93 D301 817.4 100.00 107.4 13.14 AB-8 701.8 82.20 598.2 86.73 X-5 727.8 89.90 600.8 81.13 吸附量=(C0−C1)V1/M
吸附率=(C0−C1)/C0
解吸量= C2 V2/M
解吸率=C2 V2/[(C0−C1)V]
其中,C0、C1为吸附前和吸附后吸附液中多酚的质量浓度,C2为解吸附后多酚的质量浓度,V1和V2分别为吸附液和解吸液体积,M为大孔树脂的质量。
由表2结果可知,大孔树脂D301对紫茶总多酚具有较强的吸附效果,其吸附率达到100%,其余4种树脂的吸附率从高到低依次是X-5、AB-8、D101、ADS-17。由此可见,不同类型的树脂对紫茶总多酚的吸附性能各不相同。这可能是由于树脂的内部结构、分子极性以及多酚的溶解度等对树脂吸附多酚能力的影响。多酚由于分子中酚羟基的存在,其分子极性较低,因而在与极性较弱或者非极性的树脂进行吸附时效果更好。采用50%的乙醇进行解吸,可以看出5种树脂的解吸率差异较大,AB-8树脂的解吸效果最好,解吸率达86.73%,X-5树脂次之。综合紫茶总多酚提取液的静态吸附和解吸试验,AB-8型树脂和X-5型树脂对紫茶总多酚的吸附效果和解吸效果均较好,而AB-8型树脂价格相对低廉,从节省成本的角度考虑,优先采用AB-8型树脂对其进行纯化。
2.3.2 静态吸附和解吸曲线的绘制
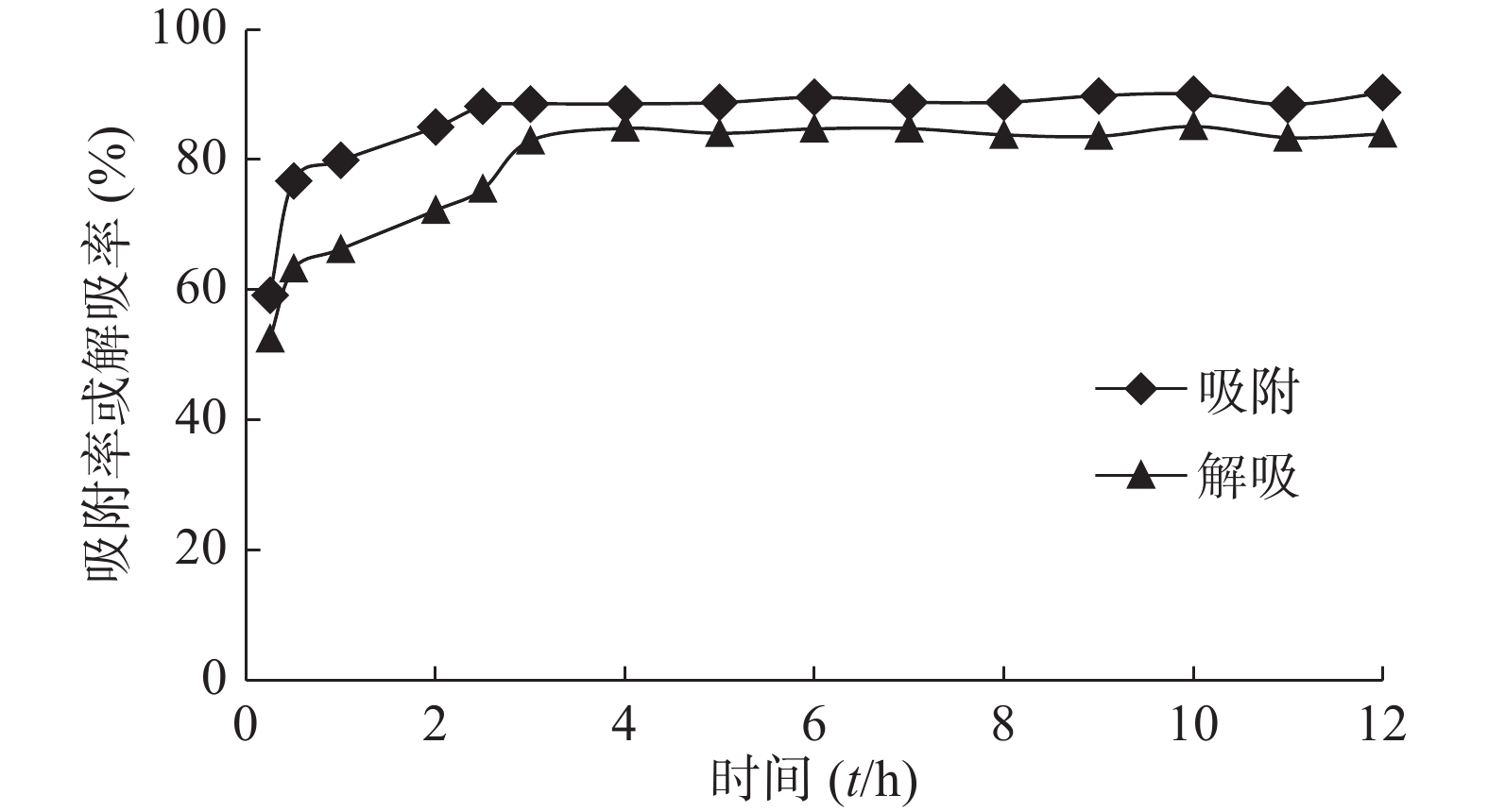
取预处理后的AB-8型大孔吸附树脂约1 g,精密称定,共15份,分别置于50 ml具塞磨口锥形瓶中,加入质量浓度为50 μg/ml的紫茶总多酚提取液20 ml,在25 ℃水浴的条件下振荡吸附12 h,每隔一段时间取出1个磨口锥形瓶,测定其总多酚的质量浓度,计算对应时间的吸附率,绘制静态吸附动力学曲线。然后,采用静态解吸试验的方法处理已吸附结束的树脂,进行静态解吸动力学试验,同样每隔一段时间取出1个磨口锥形瓶,测定其总多酚的质量浓度,计算对应时间的解吸率,绘制静态解吸动力学曲线,结果见图1。
由图1可知,在测定的时间点内,AB-8型大孔吸附树脂对紫茶总多酚的吸附量随着时间的延长而逐渐增多,经过2.5 h以后,树脂对紫茶总多酚的吸附量趋于平衡,对应的吸附率为88.27%。在0~5 h内,树脂的解吸率呈上升趋势,并在4 h达到最大值84.86%,在随后的时间里,解吸率随着时间的延长变化不大。
2.3.3 吸附液pH值对吸附率的影响
取预处理好的AB-8型大孔吸附树脂1 g,精密称定,共7份,分别置于50 ml具塞磨口锥形瓶中,分别加入质量浓度为50 μg/ml并用0.1 mol/L的盐酸和0.1 mol/L的氢氧化钠溶液调节pH值为2、3、4、5、6、7、8的紫茶总多酚提取液,在30 ℃水浴的条件下振荡吸附2.5 h,测定吸附液中紫茶总多酚的质量浓度,计算吸附率,结果见表3。
表 3 pH值对紫茶总多酚吸附率和解吸率的影响pH值 吸附量(μg/g) 吸附率(%) 2 702.4 89.79 3 712.4 90.79 4 700.3 87.77 5 706.3 89.07 6 652.5 85.71 7 641.7 83.19 8 558.4 71.54 由表3可知,吸附液pH值对紫茶总多酚的吸附率有较大影响。在pH值为2时,AB-8型大孔吸附树脂对此质量浓度下的紫茶总多酚吸附率达89.79%。因此,确定上样液的pH值为2。
2.4 动态吸附行为考察
2.4.1 泄露曲线的绘制
取预处理后的AB-8型树脂10 g,精密称定,室温下将质量浓度为250.0 μg/ml(调至pH为2)的紫茶总多酚提取液(供试品溶液用水稀释)以1.0 ml/min体积流量湿法加至树脂柱中,分段收集流出液,流出液每20 ml收集1份,测定吸光度,计算对应的总多酚含量,绘制泄露曲线。当流出液中总多酚的质量浓度达到上样液质量浓度的1/10,达到泄露点,认为此时为最佳上柱体积,结果见图2。在第2份流出液时,紫茶总多酚已经开始泄露,在第3份流出液中,总多酚的质量浓度为26.5 μg/ml,达到上样液质量浓度的1/10,因此选择上柱体积为60 ml,即3 BV。
2.4.2 上样液质量浓度的影响
取预处理好的AB-8型树脂10 g,精密称定,装入1.5 cm×20 cm的层析柱中,共5份,分别加入质量浓度为250、375、500、625、750、1 000 μg/ml的上样液(pH为2)各60 ml(3 BV),以1.0 ml/min的流速上柱,收集流出液,按“2. 1”项下方法测定总多酚含量,计算各质量浓度下的吸附率,确定最佳上样质量浓度。结果显示,各上样质量浓度下的吸附率分别为74.50%、77.56%、69.77%、60.59%、56.73%、43.61%。由此可见,上样液质量浓度对大孔吸附树脂吸附性能有显著影响,在考察范围内吸附率总体呈现出先上升后下降的趋势。当质量浓度小于375 μg/ml时,随着上样液质量浓度增加,动态吸附率呈现上升的趋势;分析原因可能是在此较低的浓度范围内,紫茶多酚有较大的机会与大孔树脂的内表面接触,进而加速扩散至树脂孔道内,形成吸附作用。而当质量浓度大于375 μg/ml时,随着质量浓度继续增加,位于孔道内的紫茶总多酚分子的扩散运动受到抑制,导致树脂对多酚的吸附能力降低。因此,选择上样液质量浓度为375 μg/ml。
2.4.3 上样液体积流量的影响
取预处理的AB-8型大孔吸附树脂10 g,精密称定,以湿法上柱法装入1.5 cm ×20 cm的层析柱中,共4份,轻敲柱壁,使柱内树脂平衡,打开下端阀门,控制体积流量使柱内纯化水流出,在液面距树脂1 cm时,将紫茶总多酚上样液(质量浓度为375 μg/ml,pH为2,上样量为3 BV)分别以1.0、2.0、3.0、4.0 ml/min的体积流量上柱,同时收集下端流出液,测定吸光度,计算吸附率,确定最佳上样体积流量。结果显示,吸附率分别为79.37%、79.78%、72.73%、64.73%,当上样体积流量为2.0 ml/min时,AB-8型大孔吸附树脂对紫茶总多酚的吸附率最大,故选择上样体积流量为2.0 ml/min。
2.4.4 径高比对动态吸附性能的影响
取预处理的AB-8型大孔吸附树脂10 g,精密称定,以湿法上柱法装入1.5 cm ×40 cm的层析柱中,分别设置径高比(柱直径与树脂填充高度比值)为1∶6、1∶9、1∶12、1∶15,将紫茶总多酚上样液(质量浓度为375 μg/ml,pH为2)分别以2.0 ml/min的体积流量上柱,对应的药液上样量分别为3、4.5、6、9 BV,收集下端流出液,测定吸光度,计算吸附率,确定最佳径高比。结果显示,吸附率分别为79.81%、78.37%、76.73%、68.54%。径高比1∶6和1∶9对吸附率影响不大。此后,在考察范围内,随着径高比值的降低,吸附率也呈现下降的趋势,可能是由于树脂层过高导致上样液穿透能力差所致。
2.4.5 洗脱剂体积分数的影响
取预处理后的AB-8型大孔吸附树脂10 g,精密称定,共5份,以湿法缓慢装入1.5 cm×20 cm的层析柱(径高比为1∶6,下同),将质量浓度为375 μg/ml上样液(调节pH为2)3 BV以2.0 ml/min的体积流量通过树脂柱,待吸附饱和后,分别用纯化水及25%、50%、75%、90%乙醇溶液各3 BV以1.0 ml/min的流速进行洗脱,收集洗脱液,测定其吸光度,计算解吸率,确定最佳洗脱剂体积分数。结果:解吸率分别为17.52%、62.96%、91.04%、81.41%、84.67%,由此可见,50%乙醇对紫茶总多酚的解吸作用最强,故选择洗脱剂的体积分数为50%。
2.4.6 洗脱剂用量的影响
取预处理后的AB-8型大孔吸附树脂10 g,精密称定,以湿法缓慢装入1.5 cm×20 cm的层析柱中,将375 μg/ml的上样液(pH为2)3 BV以2 ml/min的体积流量通过树脂柱,待吸附饱和后,用50%乙醇以1.0 ml/min的流速进行洗脱,洗脱溶剂用量分别为1、2、3、4、5 BV,收集洗脱液,测定其吸光度,计算洗脱率,确定最佳洗脱剂用量。结果:解吸率分别为54.68%、83.37%、90.29%、91.48%、91.45%,表明当50%乙醇用量在1~3 BV时,随着用量的增加,对紫茶总多酚的解吸率呈上升的趋势,随后继续增加洗脱剂的用量,解吸率不再增加,表明此时树脂上吸附的总多酚已被充分洗脱,没有必要再增加洗脱剂的用量,故确定洗脱剂的用量为4 BV。
2.4.7 洗脱剂体积流量对洗脱效果的影响
取预处理后的AB-8型大孔吸附树脂约10 g,精密称定,以湿法缓慢装入1.5 cm×20 cm的层析柱中,将375 μg/ml上样液(pH为2)3 BV以2.0 ml/min的体积流量通过树脂柱,待吸附饱和后,用50%乙醇溶液4 BV分别以1.0、2.0、4.0、6.0 ml/min的体积流量进行洗脱,计算解吸率,确定最佳体积流量。结果:对应的解吸率分别为92.47%、93.76%、91.97%、85.18%,表明紫茶总多酚的洗脱率随着洗脱体积流量的加大先升高后减小,故选择最佳洗脱体积流量为2 ml/min。
2.5 最佳工艺的验证
称取4份预处理后的大孔吸附树脂约10 g,精密称定,以湿法缓慢装入1.5 cm×20 cm层析柱中(径高比为1∶6),将紫茶提取物预先用石油醚(60~90 ℃)除去脂溶性色素,参考“2.1.2”项下方法加水稀释以制备浓度为375 μg/ml(pH为2)的紫茶总多酚溶液3 BV(总多酚质量为22.5 mg,质量分数40.2%,干膏56.0 mg),并以2 ml/min体积流量上样,待吸附饱和后,先用3 BV水去除杂质,然后用50%乙醇溶液4 BV以2 ml/min的体积流量洗脱,分别收集洗脱液,按照紫茶总多酚定量测定方法,计算总多酚洗脱量及洗脱率,再将洗脱液水浴蒸干,低温烘至恒重,计算干膏的量;精密称取干膏适量,测定总多酚的含量。结果见表4。
表 4 纯化工艺验证结果编号 加入量
(m/mg)纯化前 洗脱量
(m/mg)洗脱率
(%)纯化后 干膏量(m/mg) 质量分数(%) 干膏量(m/mg) 质量分数(%) 平均质量分数(%) RSD(%) 1 22.5 56.0 40.2 20.8 92.4 29.4 70.7 69.8 1.27 2 21.0 93.3 30.6 68.6 3 20.9 92.8 30.0 69.7 4 20.6 91.6 29.4 70.1 由纯化工艺验证结果可见,经过4次验证试验,50%乙醇洗脱条件下总多酚的平均洗脱率为92.5%,紫茶总多酚干膏量由56.0 mg减少至平均29.9 mg,质量分数从40.2%升至平均69.8%,表明建立的纯化工艺对紫茶总多酚有较好的分离、纯化效果。
3. 讨论
大孔吸附树脂是一种具有多孔立体结构和选择性吸附功能的高分子材料,目前已广泛应用于中药的活性成分如黄酮、皂苷、生物碱及多酚等成分的分离与纯化。其中,目前采用大孔树脂对多酚类成分进行纯化的有天麻总多酚[9]、白簕叶总多酚[10]、过岗龙总多酚[11]、茶梗中茶多酚[12]等,这都提示了大孔树脂精制多酚类有效成分的可行性。影响大孔树脂的分离纯化有多方面的因素,在选择合适的大孔树脂时,应综合考虑各种影响因素,如树脂的极性、比表面积以及上样液的质量浓度、洗脱液浓度等,以获得最佳的分离效果。在利用大孔树脂纯化时,应尽量滤去上样液中的沉淀,这样既能提高总多酚的纯化率,也能提高树脂的使用寿命。本研究中的样品采用50%乙醇提取后用纯化水进行稀释,当样品溶于水中时,由于多酚类物质能被大孔树脂吸附,而色素及多糖等物质不能吸附而被洗脱掉。而在改为乙醇洗脱时,树脂的吸附效果减弱,被吸附的多酚能被乙醇洗脱。
本研究通过对5种不同型号的大孔吸附树脂的吸附和解吸进行考察,确定了AB-8型大孔吸附树脂纯化紫茶总多酚的最佳工艺条件,为该产品的进一步开发奠定了基础。
-
表 1 安罗替尼致ADR案例报道统计表
序号 性别 年龄/岁 用药原因 合并用药 ADR名称 ADR处置 转归 再暴露 1[5] 男 50 NSCLC PD-1抑制剂 头晕、头痛、视物模糊、高血压 停药;甲钴胺片、羟考酮控释片、氨氯地平 好转 未使用 2[6] 男 59 NSCLC 无 食欲减退、乏力、低钠血症 停药;补钠、限水、托伐普坦 好转 未使用 3[7] 女 75 NSCLC 吉非替尼 皮下出血 停药 好转 未使用 4[8] 女 70 SCLC 无 头晕、高血压 停药 好转 未使用 5[9] 女 55 卵巢癌 无 肿瘤溶解综合征、头晕、视物模糊、尿隐血及蛋白尿 停药;水化、碱化尿液 好转 未使用 6[10] 男 39 NSCLC 无 手足综合征、高血压、高脂血症 减量至10 mg,5 d后停药;特比萘芬软膏、替米沙坦、阿托伐他汀钙片 好转 未使用 7[11] 女 36 NSCLC 无 高血压、急性心肌梗死 停药;抗血小板、调脂、改善循环 好转 未使用 8[12] 男 52 NSCLC 无 咳嗽、咯血 蛇毒血凝酶、云南白药 好转 未停药 9[12] 女 48 NSCLC 无 乏力、食欲减退、转氨酶升高、胆红素升高 腺苷蛋氨酸 好转 未停药 10[12] 男 74 NSCLC 无 头晕、乏力、高血压、蛋白尿 减量至10 mg;控制血压 好转 未停药 11[13] 女 67 NSCLC 替吉奥 过敏性紫癜 停药;抗感染、激素,保肾、利尿、补充白蛋白 好转 未使用 12[14] 女 76 卵巢癌 无 乏力、高血压、手足综合征 停药;卡托普利、氨氯地平 好转 未诱发ADR 13[15] 男 73 SCLC 无 间质性肺炎 停药;抗感染、激素、支持治疗 好转 未使用 14[16] 男 73 NSCLC 无 高血压 奥美沙坦、硝苯地平 好转 未停药 15[17] 男 68 NSCLC 无 高血压 硝苯地平、缬沙坦 好转 未停药 16[18] 男 69 NSCLC 无 口腔黏膜炎、支气管胸膜瘘 停药;抗感染、支持治疗 死亡 无 17[19] 女 61 NSCLC 无 头痛、恶心 停药 好转 未使用 18[20] 男 58 NSCLC 无 口腔黏膜炎、手足综合征、高脂血症、高血压、主动脉夹层 停药;手术、抗凝、控制血压 好转 未使用 19[21] 女 61 胶质母细胞瘤 无 血小板降低、高血压 停药;硝苯地平 好转 未使用 20[22] 女 66 胆管癌 无 咳嗽、胸闷、手足综合征、高血压 停药;抗过敏、美洛昔康片、控制血压 好转 未诱发ADR 表 2 用药后出现ADR的时间分布情况
ADR出现时间(t/d) 例次 构成比(%) 1~7 6 13.0 8~14 11 23.9 15~21 3 6.5 22~30 3 6.5 31~60 16 34.8 ≥61 7 15.2 合计 46 100.0 表 3 ADR累及系统/器官及临床表现
系统/器官 临床表现(例次) 总例次 构成比(%) 血管与淋巴管 高血压(11) 11 21.15 皮肤及皮下组织 手足综合征(4)、皮下出血(1)、过敏性紫癜(1) 6 11.54 神经系统 头晕(4)、头痛(2) 6 11.54 代谢及营养类 食欲减退(3)、高脂血症(2)、低钠血症(1) 6 11.54 呼吸系统、胸及纵隔疾病 咳嗽(2)、咯血(1)、间质性肺炎(1)、支气管胸膜瘘(1) 5 9.61 胃肠系统 口腔黏膜炎(2)、恶心(1) 3 5.77 心脏 胸闷((1)、急性心肌梗死(1)、主动脉夹层(1) 3 5.77 眼睛 视物模糊(2) 2 3.85 其他 蛋白尿(2)、血尿(1)、转氨酶升高(1)、胆红素升高(1)、血小板降低(1)、乏力(4) 10 19.23 合计 52 100.00 -
[1] SHAO L, WANG W X, SONG Z B, et al. The efficacy and safety of anlotinib treatment for advanced lung cancer[J]. Onco Targets Ther,2019,12:6549-6554. doi: 10.2147/OTT.S205674 [2] HUANG J, XIAO J X, FANG W T, et al. Anlotinib in chemotherapy-refractory metastatic esophageal squamous cell carcinoma (ESCC): a randomized, double-blind, multicenter phase Ⅱ trial[J]. J Clin Oncol,2019,37(4_suppl):95. doi: 10.1200/JCO.2019.37.4_suppl.95 [3] LI D P, TANG P Z, CHEN X H, et al. Anlotinib treatment in locally advanced or metastatic medullary thyroid carcinoma: a multicenter, randomized, double-blind, placebo-controlled phase ⅡB trial[J]. J Clin Oncol,2019,37(15_suppl):6019. doi: 10.1200/JCO.2019.37.15_suppl.6019 [4] MA J H, SONG Y, SHOU J Z, et al. Anlotinib for patients with metastatic renal cell carcinoma previously treated with one vascular endothelial growth factor receptor-tyrosine kinase inhibitor: a phase 2 trial[J]. Front Oncol,2020,10:664. doi: 10.3389/fonc.2020.00664 [5] 戴素娟, 颜娟, 谢铮铮. 安罗替尼致视物模糊伴血压升高1例[J]. 中国现代应用药学, 2019, 36(17):2214-2216. [6] 杜旭, 熊成欢, 龙光英, 等. 1例疑似安罗替尼致抗利尿激素分泌不当综合征患者的药学监护[J]. 肿瘤药学, 2019, 9(6):939-942, 951. doi: 10.3969/j.issn.2095-1264.2019.06.22 [7] 林宝琪, 彭秀凡, 陈鹏飞, 等. 安罗替尼联合吉非替尼治疗EGFR突变NSCLC导致严重皮下出血1例[J]. 肿瘤药学, 2019, 9(3):527-528. [8] 刘慧, 马云飞, 刘百龙, 等. 安罗替尼联合放疗治疗复发难治小细胞肺癌1例报告及文献复习[J]. 吉林大学学报(医学版), 2020, 46(2):394-398, 436. [9] 王文敏, 王克穷, 赵一帆, 等. 经方联合盐酸安罗替尼治疗卵巢癌晚期1例[J]. 天津中医药, 2019, 36(9):901-903. [10] 王园姬, 张文静, 焦洋, 等. 安罗替尼致多种严重药品不良反应一例[J]. 药学服务与研究, 2020, 20(2):156-159. [11] 谢婷婷, 王伟兰. 盐酸安罗替尼致急性心肌梗死1例[J]. 中国药物应用与监测, 2020, 17(1):62-63. doi: 10.3969/j.issn.1672-8157.2020.01.017 [12] 徐伟佳, 高勇, 吴雪. 临床药师对3例安罗替尼治疗晚期肺癌致不良反应的药学监护[J]. 中国药房, 2019, 30(19):2727-2731. [13] 殷实, 王红红, 王荣芽. 安罗替尼致过敏性紫癜1例护理体会[J]. 中西医结合护理(中英文), 2019, 5(7):211-213. [14] 张印印, 范凯凯, 范秀英, 等. 1例安罗替尼致患者不良反应的药学监护[J]. 世界复合医学, 2019, 5(2):56-58, 168. [15] 朱小丽. 安罗替尼致小细胞肺癌患者间质性肺病1例[J]. 中国医院药学杂志, 2020, 40(2):240-241. [16] 郝慧娟, 张旻, 张国清, 等. 不同机制所致的血管紊乱化生长的共同干预: 安罗替尼治疗右肺鳞癌合并血栓闭塞性脉管炎1例[J]. 中国肺癌杂志, 2020, 23(1):60-64. [17] 张维维, 张正伟, 李小娟, 等. 安罗替尼治疗晚期双原发肺鳞癌和下咽鳞癌1例[J]. 临床肿瘤学杂志, 2019, 24(7):665-667. doi: 10.3969/j.issn.1009-0460.2019.07.020 [18] LI D, WEI G L, LI L C, et al. Bronchopleural fistula in squamous cell lung cancer following anlotinib treatment: a case report[J]. Mol Clin Oncol,2019,11(6):595-598. [19] ZHENG Y Y, ZHOU M, ARULANANDA S, et al. Management of non-small cell lung cancer with resistance to epidermal growth factor receptor tyrosine kinase inhibitor: case discussion[J]. J Thorac Dis,2020,12(3):159-164. doi: 10.21037/jtd.2020.01.65 [20] JIANG B L, LI J H, CHEN J, et al. Aortic dissection in a patient treated with anlotinib for metastatic lung squamous cell carcinoma[J]. Thorac Cancer,2020,11(2):461-464. doi: 10.1111/1759-7714.13288 [21] LV Y, ZHANG J D, LIU F J, et al. Targeted therapy with anlotinib for patient with recurrent glioblastoma: a case report and literature review[J]. Medicine,2019,98(22):e15749. doi: 10.1097/MD.0000000000015749 [22] ZHANG A X, LIU B, XU D D, et al. Advanced intrahepatic cholangiocarcinoma treated using anlotinib and microwave ablation: a case report[J]. Medicine,2019,98(52):e18435. doi: 10.1097/MD.0000000000018435 [23] SUN Y K, NIU W, DU F, et al. Safety, pharmacokinetics, and antitumor properties of anlotinib, an oral multi-target tyrosine kinase inhibitor, in patients with advanced refractory solid tumors[J]. J Hematol Oncol,2016,9(1):105. doi: 10.1186/s13045-016-0332-8 [24] ABDEL-QADIR H, ETHIER J L, LEE D S, et al. Cardiovascular toxicity of angiogenesis inhibitors in treatment of malignancy: a systematic review and meta-analysis[J]. Cancer Treat Rev,2017,53:120-127. doi: 10.1016/j.ctrv.2016.12.002 [25] CAMERON A C, TOUYZ R M, LANG N N. Vascular complications of cancer chemotherapy[J]. Can J Cardiol,2016,32(7):852-862. doi: 10.1016/j.cjca.2015.12.023 [26] LIU B, DING F X, LIU Y, et al. Incidence and risk of hypertension associated with vascular endothelial growth factor receptor tyrosine kinase inhibitors in cancer patients: a comprehensive network meta-analysis of 72 randomized controlled trials involving 30013 patients[J]. Oncotarget,2016,7(41):67661-67673. doi: 10.18632/oncotarget.11813 [27] SI X Y, ZHANG L, WANG H P, et al. Management of anlotinib-related adverse events in patients with advanced non-small cell lung cancer: Experiences in ALTER-0303[J]. Thorac Cancer,2019,10(3):551-556. doi: 10.1111/1759-7714.12977 [28] TOUYZ R M, LANG N N, HERRMANN J, et al. Recent advances in hypertension and cardiovascular toxicities with vascular endothelial growth factor inhibition[J]. Hypertension,2017,70(2):220-226. doi: 10.1161/HYPERTENSIONAHA.117.08856 [29] HAMNVIK O P R, CHOUEIRI T K, TURCHIN A, et al. Clinical risk factors for the development of hypertension in patients treated with inhibitors of the VEGF signaling pathway[J]. Cancer,2015,121(2):311-319. doi: 10.1002/cncr.28972 [30] CHI Y, FANG Z W, HONG X N, et al. Safety and efficacy of anlotinib, a multikinase angiogenesis inhibitor, in patients with refractory metastatic soft-tissue sarcoma[J]. Clin Cancer Res,2018,24(21):5233-5238. doi: 10.1158/1078-0432.CCR-17-3766 [31] ERYILMAZ M K, MUTLU H, SALIM D K, et al. Fatal posterior revesible leukoencephalopathy syndrome associated Coma induced by bevacizumab in metastatic colorectal cancer and review of literature[J]. J Oncol Pharm Pract,2016,22(6):806-810. doi: 10.1177/1078155215611048 [32] ESTRADA C C, MALDONADO A, MALLIPATTU S K. Therapeutic inhibition of VEGF signaling and associated nephrotoxicities[J]. J Am Soc Nephrol,2019,30(2):187-200. doi: 10.1681/ASN.2018080853 [33] SCHMIDINGER M. Understanding and managing toxicities of vascular endothelial growth factor (VEGF) inhibitors[J]. EJC Suppl,2013,11(2):172-191. doi: 10.1016/j.ejcsup.2013.07.016 [34] ZHANG K, MA X Y, GAO H J, et al. Efficacy and safety of anlotinib in advanced non-small cell lung cancer: a real-world study[J]. Cancer Manag Res,2020,12:3409-3417. doi: 10.2147/CMAR.S246000 -





 下载:
下载:

 下载:
下载: 

