-
美沙拉嗪化学名为5-氨基水杨酸,是轻、中度溃疡性结肠炎有效的一线治疗药物。它直接作用于炎症黏膜,可抑制引起炎症的前列腺素合成、抑制炎症介质白三烯的形成而起抗炎作用,具有疗效好及毒副作用小等优点[1-2]。美沙拉嗪口服后在体内被迅速吸收,在肠腔及肝脏中经N-乙酰转移酶代谢为主要产物N-乙酰-5-氨基水杨酸。一般认为,其在肠腔黏膜局部浓度越大越有利于发挥作用[3]。
目前市售的美沙拉嗪药物有美沙拉嗪缓释颗粒剂(Etiasa)、美沙拉嗪肠溶片等剂型,考虑到人们的用药方便和美沙拉嗪的作用部位,课题组开发了美沙拉嗪药物的新剂型,即美沙拉嗪肠溶缓释颗粒剂,以期同时发挥药物肠溶和缓释的作用效果,均匀释放、定位起效,达到更好、更有效的治疗溃疡性结肠炎并减轻毒副作用的效果。为了考察美沙拉嗪新制剂与市售制剂的区别,本实验考察了美沙拉嗪新制剂临床前体内药动学特征,以市售制剂为参比,考察新制剂的相对生物利用度,进行药动学参数的比较评价;并且进一步考察了美沙拉嗪肠溶缓释颗粒剂的制剂学肠溶和缓释特点,评价作用部位释放情况,为该药新制剂提供系统可靠的临床前药动学数据,并为进一步的制剂工艺和处方的优化提供依据。
-
VARIAN 1200L型液相色谱-质谱联用仪(美国瓦里安公司);Dionex SUMMIT高效液相色谱仪(美国戴安公司);Jouan CR3i型多功能高速冷冻离心机(法国Jouan公司);SAVANT SPD121P SpeedVac型减压离心浓缩仪(北京塞万特公司);XS205 Dual Range型电子分析天平(梅特勒-托利多公司)。
-
美沙拉嗪标准对照品(批号:100546-200902,含量:99.8%)、乙酰美沙拉嗪标准对照品(批号100711-200401,含量:99.3%)、氯唑沙宗标准对照品均由上海市药物(中药)代谢产物研究重点实验室提供;美沙拉嗪肠溶缓释颗粒剂(1 g/袋,批号DV121102-1A)为自研制剂;美沙拉嗪缓释颗粒剂(批号:07444,规格500 mg/袋,Ethypharm生产,法国)为市售制剂;甲醇(MERK公司)、乙腈(TEDIA公司)、甲酸(ROE SCIENTIFIC INC公司)均为色谱纯试剂;醋酸铵(江苏强盛功能化学股份有限公司)为分析纯;水为去离子水(经Hi-Tech水纯化系统自制)。
-
健康、成年SD大鼠,体重180~220 g,雌、雄数量均等,年龄6~8周,购自上海斯莱克实验动物有限责任公司[许可证号SCXK(沪)2012-0005]。
-
流动相为甲醇-5 mmol/L醋酸铵水溶液(85∶15);流速为0.4 ml/min,进样量10 μl[4-5]。
电喷雾离子源,负离子模式检测,多反应监测方式进行一/二级质谱分析。质谱检测工作参数如下:美沙拉嗪、乙酰美沙拉嗪和内标氯唑沙宗Q1(Mass)分别是151.7、193.8、167.8;Q3(Mass)分别是107.9、149.7、131.7;扫描时间0.33s,SIM宽0.7,Q1峰宽3.0;Q3峰宽2.0;Needle-4500V;Shield-25 V;雾化气为空气,48psi;干燥气为空气,300 ℃,20psi;毛细管电压为−35 V;碰撞能分别是13、14、19 V,碰撞气:1.84mTorr;检测器电压为1 650 V[6-7]。
-
精密称取美沙拉嗪、乙酰美沙拉嗪和内标氯唑沙宗适量,加甲醇溶解,配制成浓度为5 mg/ml的标准储备液,然后采用相应的流动相逐级稀释,得到系列混合工作溶液和内标溶液。同法制备质控标准样品的系列混合工作溶液和内标溶液。
-
取100 μl血浆样品,加入氯唑沙宗溶液10 μl,涡旋;然后加入甲醇300 μl,涡旋3 min,离心10 min(8000 r/min);吸取上清液250 μl,再离心5 min(12000 r/min);吸取上清液100 μl待测。
-
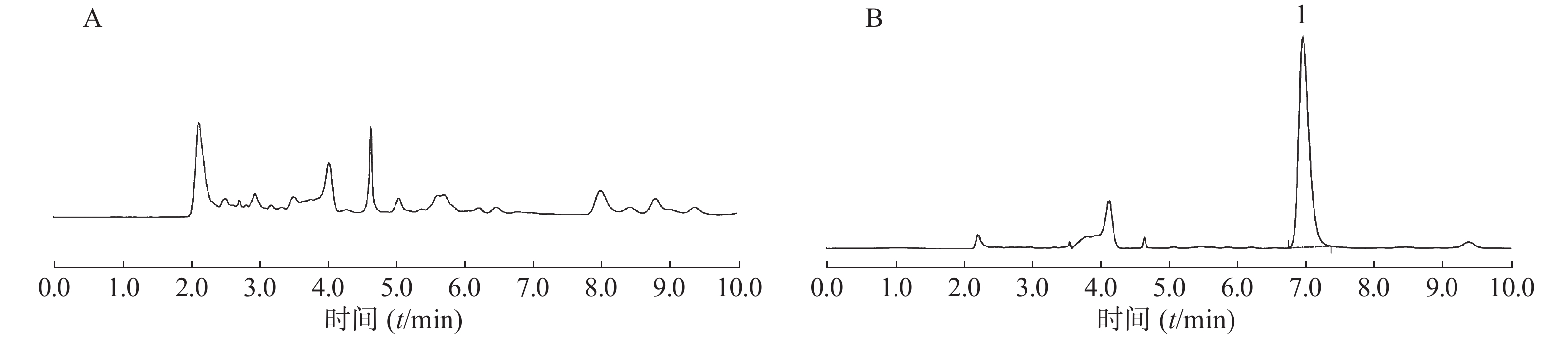
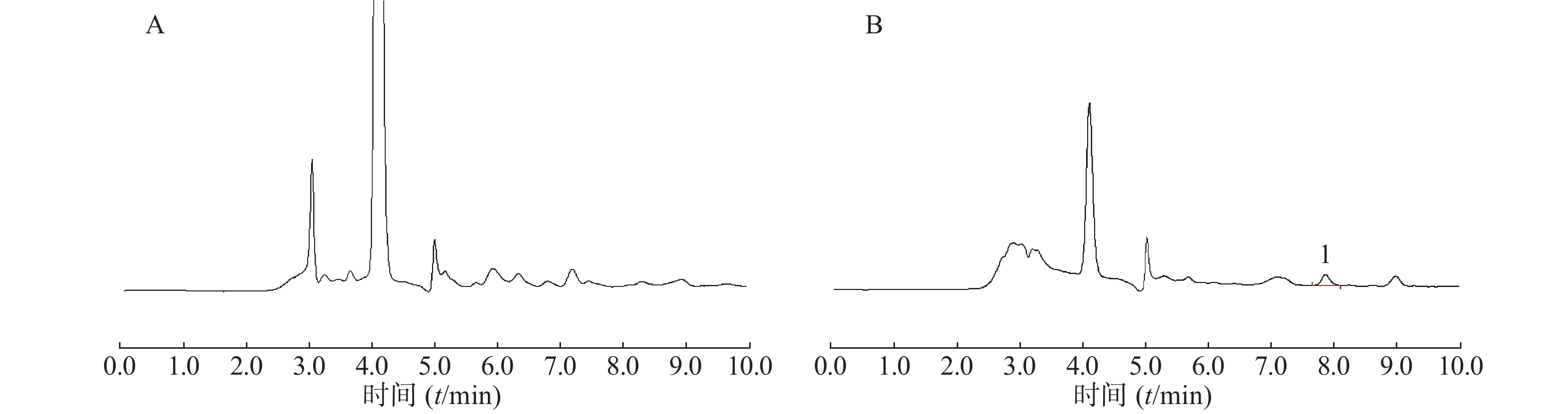
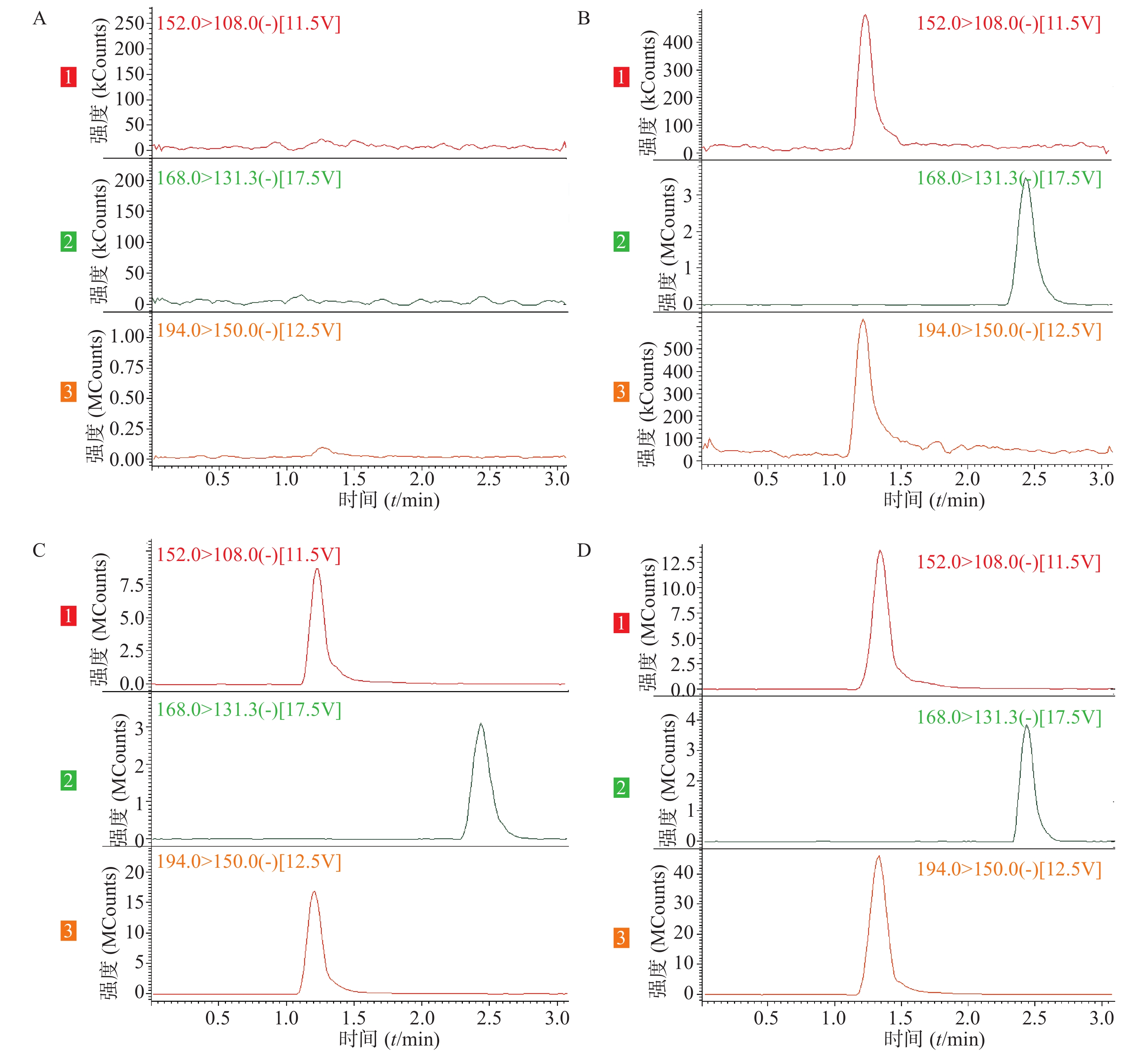
在上述分析方法下,考察样品、内标和内源性物质的干扰情况。结果表明生物样品中的内源性物质不干扰美沙拉嗪和乙酰美沙拉嗪的测定,结果见图1。
-
精密吸取美沙拉嗪和乙酰美沙拉嗪系列混合标准工作溶液,用空白血浆进行提取,配制成美沙拉嗪的浓度为0.1002、0.2004、0.501、2.004、5.01、10.02、20.04 μg/ml和乙酰美沙拉嗪的浓度为0.02012、0.0503、0.2012、1.006、5.03、10.06、20.12 μg/ml,进样分析后求得美沙拉嗪和乙酰美沙拉嗪的标准曲线方程分别为Y =0.6914C+0.0310(r=0.9993)、Y =3.1022C +0.0227(r=0.9999),线性范围为0.1002~20.04 μg/ml和0.02012~20.12 μg/ml,最低定量限分别为0.1002和0.02012 μg/ml(S/N>5)。
-
按照上述方法配制最低定量限、低、中、高4个浓度的质控标准样品,美沙拉嗪和乙酰美沙拉嗪质控标准样品浓度分别为0.1004、0.02004,0.2008、0.0501,2.008、1.002和16.064、16.032 μg/ml。结果表明,准确度和精密度满足生物基质样品测定要求。
-
在低、中、高3个浓度下,美沙拉嗪和乙酰美沙拉嗪在SD大鼠血浆中基质效应在70%~98%之间,绝对回收率在70%~90%之间,表明内源性物质对被测物质存在一定的抑制或增强的作用,但不影响样品的分析测定。
-
血浆样品在室温下放置4h、−80 ℃保存60 d,处理后在自动进样器内放置24 h,以及3次冻融循环后样品均保持稳定,RSD在15%以内。结果表明,各生物基质样品在所考察的时间和条件下稳定,对测定结果的影响可以忽略。
-
12只成年、健康SD大鼠,雌性、雄性各半,随机分成2组,每组6只;分别灌胃给予自研制剂和市售制剂各0.1 g/kg。
分别于给药前及给药后的1、2、3、4、5、6、8、12、24、36和48 h,从SD大鼠眼眶取血,置肝素化EP管中,离心,取上层血浆,置于−80 ℃冰箱保存待测。按照上述样品前处理的方法对生物基质样品进行预处理,并进样分析,计算目标药物浓度[8]。
数据处理:药动学数据以三因素方差分析和双单侧t检验进行统计分析。应用中国药科大学开发的药动学处理软件BAPP2.0程序计算有关药动学参数。
-
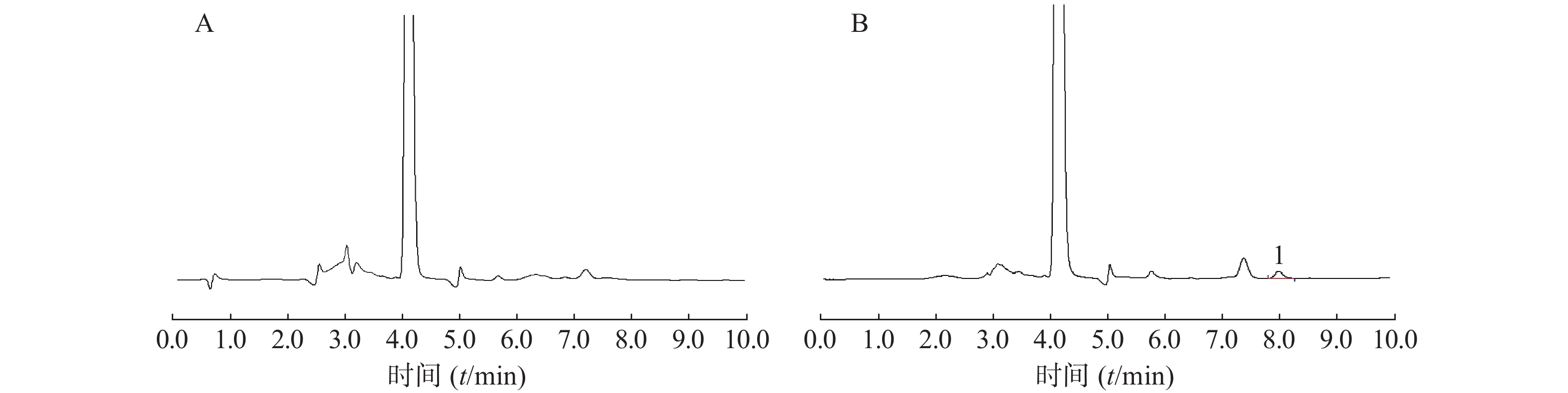
采用非房室模型法估算的以美沙拉嗪表征的两组成年、健康SD大鼠给予自研制剂和市售制剂0.1 g/kg后的体内药动学参数见表1,药时曲线见图2。
表 1 口服给药后体内以美沙拉嗪表征的药动学参数
样品 cmax
(μg/ml)tmax
(h)t1/2
(h)MRT
(h)AUC0~48
(μg·h/ml)AUC0~∞(μg·h/ml) 自研制剂 5.66±0.77 4.3±0.8 15.92±4.64 18.21±4.76 53.94±4.03 59.49±7.24 市售制剂 6.74±0.41 5.0±1.1 13.97±3.40 16.97±3.56 66.49±5.16 71.68±8.85 用梯形面积法(AUC)估算的以美沙拉嗪表征的自研制剂和市售制剂的相对生物利用度为(90.62±9.36)%,即平均生物利用度基本一致。
-
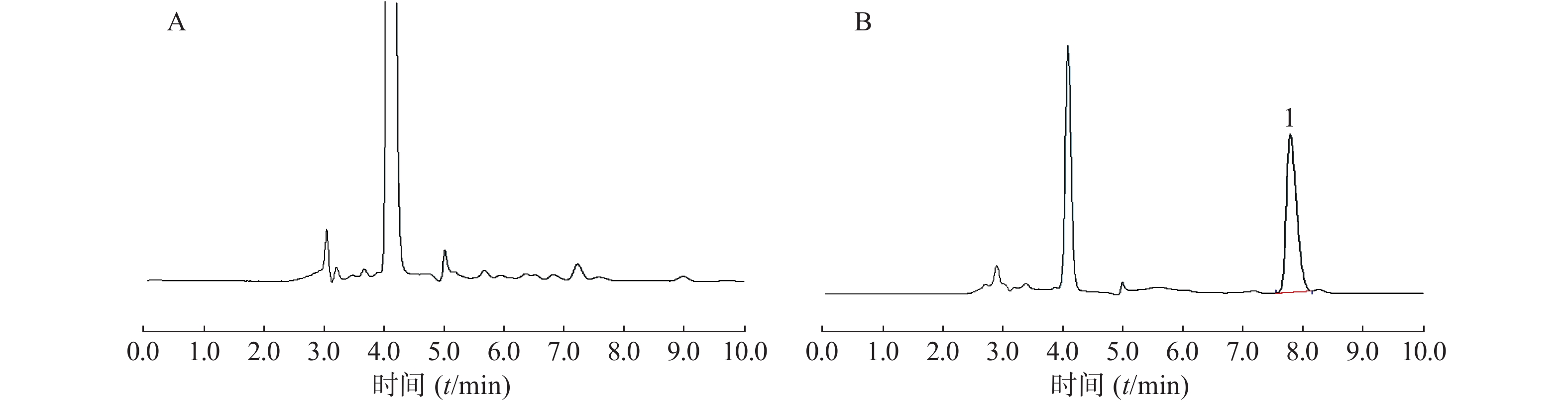
采用非房室模型法估算的以乙酰美沙拉嗪表征的两组成年、健康SD大鼠给予自研制剂和市售制剂0.1 g/kg后的体内药动学参数见表2,药时曲线见图3。
表 2 口服给药后体内以乙酰美沙拉嗪表征的药动学参数
样品 cmax
(μg/ml)tmax
(h)t1/2
(h)MRT
(h)AUC0~48
(μg·h/ml)AUC0~∞ (μg·h/ml) 自研制剂 7.93±0.75 5.7±0.8 7.32±0.51 9.93±0.30 75.05±4.91 75.56±5.02 市售制剂 10.22±1.37 6.0±0.0 6.84±1.01 10.02±0.81 94.27±8.67 94.79±8.56 采用梯形面积法(AUC)估算的以乙酰美沙拉嗪表征的自研制剂和市售制剂的相对生物利用度为(87.36±10.43)%,即平均生物利用度基本一致。
-
流动相为乙腈-20 mmol/L醋酸铵水溶液(2∶98);流速1.0 ml/min;检测波长为304 nm,柱温25 ℃。
-
精密称取美沙拉嗪适量,加甲醇溶解,配成浓度为5 mg/ml的标准储备液,采用相应的流动相来逐级稀释,得到系列混合工作溶液和内标溶液。同法制备质控标准样品的系列混合工作溶液和内标溶液。
-
将SD大鼠胃肠消化道分段内容物样品在室温下解冻,将药物颗粒数量大于5粒的内容物样品转移至100 ml烧杯中,搅拌均匀,再准确加入50 ml去离子水清洗相应的消化道分段,并溶解其内容物;药物颗粒数量小于5粒的内容物样品转移至10 ml EP离心管中,搅拌均匀,再准确加入5 ml去离子水清洗相应的消化道分段,并溶解其内容物[9-10];分别超声溶解各内容物样品20 min,取1 ml溶液12000 r/min离心10 min,分离上清液,再12000 r/min离心10 min后,分离上清液待测。
-
精密吸取适量美沙拉嗪,用空白胃内容物提取上清液,配制成美沙拉嗪浓度分别为0.5045、1.009、5.045、10.09、20.18、50.45和100.9 μg/ml的溶液,进样分析,求得标准曲线方程为Y=0.1308C+0.0053(r=0.9996),线性范围为0.5045~100.9 μg/ml,最低定量限为0.5045 μg/ml(S/N>5);用空白肠道内容物提取上清液配制成美沙拉嗪浓度分别为0.5135、1.027、5.135、10.27、20.54、51.35和102.7 μg/ml,进样分析后求得标准曲线方程为Y=0.1961C-0.0081,r=0.9999,线性范围为0.5135~102.7 μg/ml,最低定量限为0.5135 μg/ml(S/N>5)。
-
按照上述方法配制最低定量限、低、中、高4个浓度的质控标准样品,SD大鼠胃内容物美沙拉嗪质控标准样品浓度为0.502、1.004、10.04和80.32 μg/ml,SD大鼠肠内容物美沙拉嗪质控标准样品浓度为0.504、1.008、10.08、80.64 μg/ml。结果表明,准确度和精密度满足生物基质样品测定要求。
-
在最低定量限、低、中、高4个浓度下,SD大鼠胃肠道内容物中美沙拉嗪的绝对回收率在95%~99%之间,表明内源性物质对被测物质存在一定的抑制或增强的作用,但不影响样品的分析测定。
-
本实验生物基质中药物浓度大于标准曲线上限,须经稀释后再测定,故考察了稀释效应。配制高浓度的质控样品,稀释相应倍数至高浓度,按照生物样品前处理方法进样测定,代入标准曲线求得美沙拉嗪浓度,稀释效应采用测定值与理论值RE值表示。结果表明,样品经稀释后分析结果准确,能满足生物基质样品分析要求。
-
胃肠道样品在室温下放置4 h、−80 ℃长期保存60 d、处理后在自动进样器内放置36 h,以及3次冻融循环后样品均保持稳定,RSD在15%以内。结果表明,各生物基质样品在所考察的时间和条件下稳定,对测定结果的影响可以忽略。
-
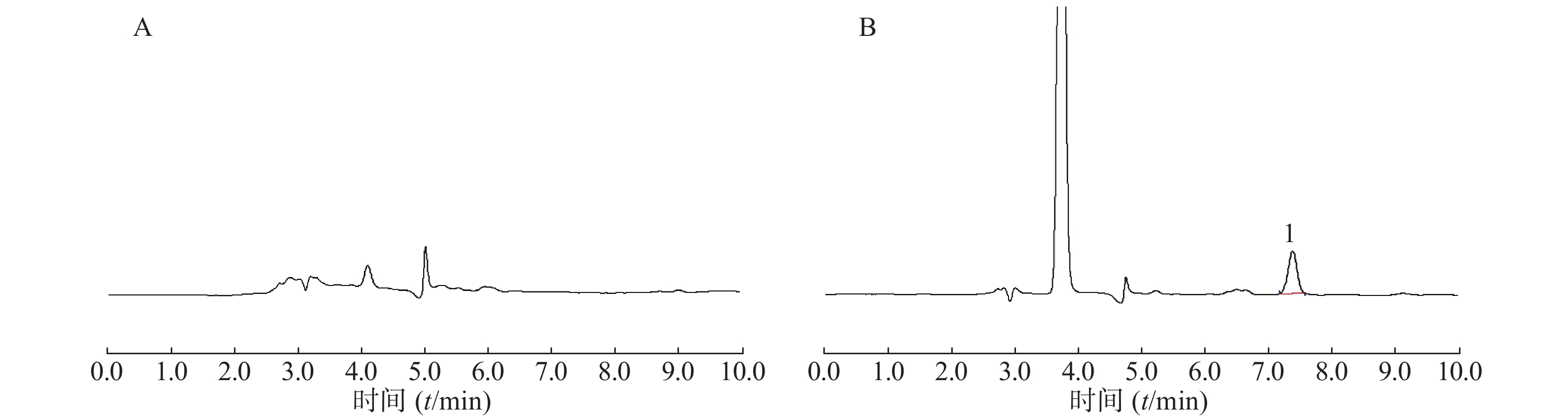
选用60只成年、健康SD大鼠,雌雄各半,实验SD大鼠禁食过夜(禁食15 h)后,随机分成2大组,分别以100 mg/kg给予自研制剂和市售制剂;每一大组又随机分成5小组,每小组6只,选取给药后2、4、6、8和12 h的大鼠胃肠消化道内分布的美沙拉嗪颗粒及药物残留量。另取6只SD大鼠(雌雄各半)作为空白对照,同样禁食过夜(禁食15 h)。分别于给药后2、4、6、8和12 h(每一时间点各6只SD大鼠),将SD大鼠乙醚麻醉,完整取出胃、十二指肠段、空肠段、回肠段和结肠段组织,分段解剖分离药物颗粒及内容物,置于−80 ℃冰箱保存待测。按胃肠消化道分段内容物样品预处理方法操作,测定胃肠消化道内容物中美沙拉嗪的浓度[11-12]。
-
本实验通过大鼠口服给药考察了美沙拉嗪肠溶缓释颗粒剂的药动学特征、相对生物利用度,并与市售制剂的药动学参数进行了比较研究,结果表明,自研制剂口服后给药后吸收和消除过程基本呈线性动力学特征。通过相对生物利用度和药动学参数的统计分析比较,提示自研制剂与市售制剂无显著性差异。
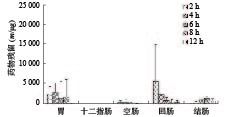
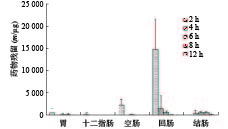
从药物颗粒分布结果看,自研制剂的微丸在SD大鼠胃肠消化道内具有一定流动性,且包衣对胃肠消化液的耐受性较好,随着SD大鼠胃肠消化道的蠕动,缓释颗粒微丸会逐步进入空肠、回肠和结肠,崩解并释放药物产生治疗作用;市售制剂微丸在SD大鼠胃肠消化道内流动性好,缓释颗粒微丸会较快进入空肠、回肠和结肠,崩解并释放药物产生治疗作用,同时,包衣在胃肠消化液中可能存在一定耐受性问题,使不同时间点胃肠消化道不同部位出现部分微丸的崩解,造成药物提前释放。
从美沙拉嗪不同部位药物含量看,自研制剂口服给药后在2~8 h时间段胃部内容物均存在高浓度分布,并随着时间的推移较快进入并存在于空肠、回肠和结肠,随后在6~12 h后,逐步在结肠达到高浓度分布,其结果有助于美沙拉嗪药物的体内吸收,以及缓释颗粒剂在作用部位的定点释放而发挥治疗效果;市售制剂SD大鼠口服后,缓释颗粒微丸会较快进入十二指肠、空肠、回肠、甚至结肠,在2~6 h时间段回肠内容物相对维持较高浓度分布,并随着时间的推移较快进入结肠,使结肠内容物中药物含量在4~12 h时间段内持续较高水平,有利于药物在作用位点及时释放以提高疗效。
Study on pharmacokinetic and gastrointestinal distribution study of mesalazine enteric-coated sustained-release granules in rats
-
摘要:
目的 评价新型制剂美沙拉嗪肠溶缓释颗粒剂在SD大鼠体内的药动学以及在胃肠道的分布情况,了解该制剂临床前药动学特征及胃肠道分布特征。 方法 采用大鼠口服给药,测定其血药浓度和胃肠道残留浓度;以美沙拉嗪缓释颗粒剂(市售制剂)为参照,评价美沙拉嗪肠溶缓释颗粒剂(自研制剂)在大鼠体内吸收和消除过程、相对生物利用度、药物在胃肠道分布情况。 结果 美沙拉嗪肠溶缓释颗粒剂在大鼠体内,与美沙拉嗪缓释颗粒剂以美沙拉嗪表征的相对生物利用度为(90.62±9.36)%。美沙拉嗪肠溶缓释颗粒剂口服给药后在2~8 h时间段,药物在胃部存在高浓度分布,随着时间的推移逐步进入并残存于空肠、回肠和结肠,6~12 h后在结肠达到高浓度分布,其结果有助于美沙拉嗪药物的体内吸收,以及缓释颗粒剂在作用部位的定点释放与发挥疗效。 结论 美沙拉嗪肠溶缓释颗粒剂吸收和消除过程基本呈线性动力学特征,药动学参数与市售制剂无显著性差异,且在胃肠道有一定流动性,包衣对消化液耐受性好,胃肠道分布特征有利于药物的体内吸收和作用部位的定点释放。 Abstract:Objective To evaluate the pharmacokinetics of the new mesalazine enteric-coated sustained-release granules in SD rats and their distribution in the gastrointestinal tract, and to understand the preclinical pharmacokinetics and gastrointestinal distribution characteristics of the preparation. Methods Rats were administered orally to determine the drug concentrations in plasma samples and in the gastrointestinal tract. The commercially available mesalazine sustained-release granule was used as a reference to self-developed one to evaluate the process of absorption and elimination in vivo, relative bioavailability, and distribution in the gastrointestinal tract. Results The relative bioavailability of mesalazine enteric-coated sustained-release granule and non-enteric-coated one characterized by mesalazine was 89.62% ± 9.36%. After oral administration of mesalazine enteric-coated sustained-release granules, the drug has a high concentration distribution in the stomach within 2-8 hours, and gradually enters and remains in the jejunum, ileum and colon over time for 6-12 hours and then reaching a high concentration distribution in the colon. This help for the absorption of mesalazine, as well as the fixed-point release of the drug to produce a therapeutic effect. Conclusion The absorption and elimination process of mesalazine enteric sustained-release granule showed linear kinetic characteristics. There was no significant difference in pharmacokinetic parameters from the commercially available formulations, and it had a certain fluidity in the gastrointestinal tract. Good gastrointestinal distribution characteristics help the absorption of drugs in the body and the targeted release of the site of action -
Key words:
- mesalazine /
- enteric sustained-release granules /
- pharmacokinetic /
- rats /
- gastrointestinal tract
-
肾移植患者中19%~35%出现了肌肉骨骼疼痛,其中由钙调神经磷酸酶抑制剂(calcineurin inhibitors,CNIs)导致的一种双侧、对称性、难治性疼痛被称为钙调神经磷酸酶抑制剂致疼痛综合征(calcineurin inhibitor-induced pain syndrome,CIPS),最常累及双下肢。CIPS由Bouteiller等首次描述,并于1991年由Lucas等在肾移植患者中首次报道[1],最终由Grotz等在2001年命名为CIPS[2]。近20年来,有关移植后疼痛综合征的报道不断出现,包括CIPS、无血管性坏死(AVN)以及反射性交感神经营养不良综合征(RSDS)等,其中CIPS越来越受到人们的关注。该综合征影响了1%~17%的肾、心脏、肺、肝脏、胰腺或骨髓移植患者[3],且均报道与他克莫司或环孢素有关,移植受者中环孢素致CIPS的发生率为1.5%~14%,而他克莫司致CIPS的发生率为2.2%[4]。为了解肾移植受者中CIPS的临床特征及其治疗方法,本研究对目前已发表的病例报告进行了汇总和统计分析。
1. 材料与方法
1.1 研究对象
通过检索PubMed和Google学术等获得可能相关的外文全文或摘要,检索关键词主要包括:calcineurin inhibitor-induced pain syndrome,post-transplant distal limb syndrome (PTDLS),symmetric bone pain syndrome (SBPS),CIPS in chronic kidney disease (CKD),CIPS in chronic kidney disease stage 5 transplantation (CKD5T)。通过检索中国知网、万方、维普等获取相关的中文全文或摘要,检索关键词:钙调神经磷酸酶抑制剂致疼痛综合征,他克莫司致疼痛综合征,环孢素致疼痛综合征,移植后疼痛综合征,移植后骨疼痛。检索时间段为1991年1月至2020年12月,纳入标准为:肾移植受者、病例报告,排除标准为:非肾移植受者、综述和重复文献。经过筛选和研究入组后,共11篇文章,包括15例病例报告和患者。
1.2 观察指标
收集患者的年龄、性别、肾移植类型和原发病,患者发生CIPS的时间、临床表现和实验室检查结果,以及针对CIPS的治疗方法和症状改善时间。
1.3 统计方法
采用SPSS22.0进行统计分析。分类变量记录为频数和百分比。正态分布的测量值表示为(
$\bar x $ ±s)以及范围,非正态分布的表示为中位数和四分位间距(IQR)。2. 结果
2.1 患者特征
对所纳入的11篇文章(均为外文文章)中的15例肾移植受者进行了定性和定量分析。表1总结了肾移植受者中CIPS的研究[5-15]。诊断时患者的平均年龄为(44.6±8.31)岁(范围为23~59岁)。在这些患者中,有8名(53.3%)男性,7名(46.7%)女性。肾移植的类型包括:尸体肾移植(n=10,66.7%),活体供体(n=3,20%)和数据缺乏(n=2,13.3%)。导致肾脏移植的原发病包括:IgA肾病(n=3,20%),肾小球肾炎(n=1,6.7%),高血压肾病(n=2,13.3%),自身免疫性疾病(类风湿关节炎、系统性红斑狼疮,n=3,20%),镇痛性肾病(n=1,6.7%),左侧肾脏发育不全(n=1,6.7%),伯杰病(n=1,6.7%),病因不明的终末期肾脏疾病(ESRD)(n=2,13.3%)和数据缺乏(n=1,6.7%)。
表 1 肾移植受者中发生CIPS的患者特征病例 年龄 性别 肾移植类型 原发病 参考文献 1 41 男 尸肾移植 不明原因的慢性肾功能衰竭 [5] 2 59 女 第二次活体肾脏移植 病因不明的ESRD [6] 3 44 男 左肾发育不全致终末期肾病的肾移植 左肾发育不全 [7] 4 53 女 原发性ABO不相容的活体肾脏移植 控制良好的类风湿性关节炎和慢性肾脏疾病 [8] 5 37 男 活体肾脏移植 伯杰病 [9] 6 48 女 尸肾移植 镇痛性肾病 [10] 7 49 男 尸肾移植 IgA肾病 [10] 8 50 男 尸肾移植 IgA肾病 [10] 9 40 女 尸肾移植 系统性红斑狼疮 [10] 10 50 女 尸肾移植 未提及 [11] 11 49 男 尸肾移植 高血压肾病 [12] 12 42 男 尸肾移植 动脉高血压 [12] 13 23 女 从一名41岁的头部外伤捐赠者那里接受了肾脏同种异体移植 狼疮性肾炎 [13] 14 43 女 第二次尸肾移植 肾小球肾炎 [14] 15 41 男 第二次尸肾移植 IgA肾病和高血压 [15] 2.2 关节受累的解剖区域
受累的关节表现包括: 双侧膝盖疼痛(n = 4, 26.7%), 双足对称性疼痛(n = 3, 20%), 双侧膝盖和双足疼痛(n = 2, 13.3%), 双足和脚踝疼痛(n = 1, 6.7%), 双侧膝盖和脚踝疼痛(n = 1, 6.7%), 双侧腕、肘、手和膝盖疼痛(n = 1, 6.7%), 双侧手、膝盖、脚踝和双足疼痛(n = 1, 6.7%), 双侧手、肘、膝盖、脚踝和双足疼痛(n = 1, 6.7%), 后背疼痛(n = 1, 6.7%)。肾移植后CIPS出现的平均时间为(2.42±3.07)个月(1例描述为肾移植后不久, 具体时间不详), 中位数为1.22个月, IQR为1~2个月。具体详见表 2。
表 2 发生CIPS的患者症状、累及关节和发生时间病例 症状表现 累及关节 症状出现时间 1 双足对称性的严重疼痛 双足 过去的9年 (发生在肾移植后不久) 2 双侧踝关节和膝盖疼痛,双侧下肢左下踝外侧踝乏力 膝盖,脚踝 第2次肾移植后6周 3 首先是左脚疼痛,然后是双脚(在脚趾两侧)和膝盖(在两个膝盖的外侧)进行性疼痛,患处伴有水肿 膝盖,双足 移植后2个月 4 高热,疲劳和关节疼痛 手肘,手腕,膝盖 移植后14 d 5 双脚突发严重的对称性疼痛,行走受限 双足 肾移植后1年 6 突发严重的双侧膝关节疼痛 膝盖 移植后第1个月 7 突发严重的双侧膝关节疼痛 膝盖 移植后第1个月 8 突发严重的双侧膝关节疼痛 膝盖 移植后第1个月 9 突发严重的双侧膝关节疼痛,双足严重的骨痛 膝盖,双足 移植后第1个月 10 膝部进行性双侧对称性疼痛且行走困难 膝盖 移植后2个月 11 运动时多个关节剧烈疼痛,并在移植后2个月使用拐杖走路 双手,膝盖,脚踝和双足 移植后1个月 12 双足疼痛,无法行走 双足 移植后6个月 13 从胸腔到腰骶的严重后背钝痛,疼痛评分为10/10。背部伸展使疼痛加重,背部弯曲和躺下缓解。坐位时,尾骨区疼痛加重;背部中线以外无疼痛辐射 后背 移植后43 d 14 双足和脚踝进行性疼痛 双足和脚踝 术后1个月 15 双侧足部疼痛和轻微的脚踝疼痛,最后延伸至膝盖;4个月后,疼痛变得难以忍受,手和肘部出现轻微疼痛 双足,脚踝,膝盖,手和肘部 肾移植后73 d 2.3 实验室指标
CNIs水平的影响在此研究中是无法估计的, 原因在于缺少实际治疗水平(谷浓度范围)的数据。CIPS发生时, CNIs水平升高或正常。7名(46.7%)患者使用环孢素作为初始免疫抑制药物, 其中6名(40%)测量了环孢素水平, 环孢素的平均全血谷浓度为(194.5±92.9) ng/ml(范围为38~278 ng/ml)。其中3名患者的环孢素谷浓度较高, 平均谷浓度为(268±12.5)ng/ml(范围为254~278 ng/ml)。8名(53.3%)患者使用他克莫司作为初始免疫抑制药物, 其中6名(40%)测量了他克莫司水平, 其平均全血谷浓度为(21.6±9.3) ng/ml(范围为5~28.2 ng/ml)。3名(20%)患者的碱性磷酸酶水平升高, 1名(6.7%)患者的碱性磷酸酶水平正常, 而11名(73.3%)患者的数据缺乏。4名(26.7%)患者的甲状旁腺激素(PTH)水平增加, 平均水平为(260±383)ng/L(范围为26~833 ng/L), 4名(26.7%)患者的PTH水平正常, 7名(46.7%)患者的数据缺乏。3名(20%)患者出现了高钙血症, 1名(6.7%)患者的血清钙水平正常, 11名(73.3%)患者的数据缺乏。2名(13.3%)患者出现低磷血症, 1名(6.7%)患者出现高磷血症, 1名(6.7%)患者血磷水平正常, 11名(73.3%)患者的数据缺乏。1名患者(6.7%)的C反应蛋白升高, 8名患者(53.3%)的C反应蛋白正常, 6名(40%)患者的数据缺乏。2名(13.3%)患者类风湿因子水平正常, 13名(86.7%)患者的数据缺乏。4名(26.7%)患者的尿酸水平正常, 11名(73.3%)患者的数据缺乏。
2.4 治疗与结局
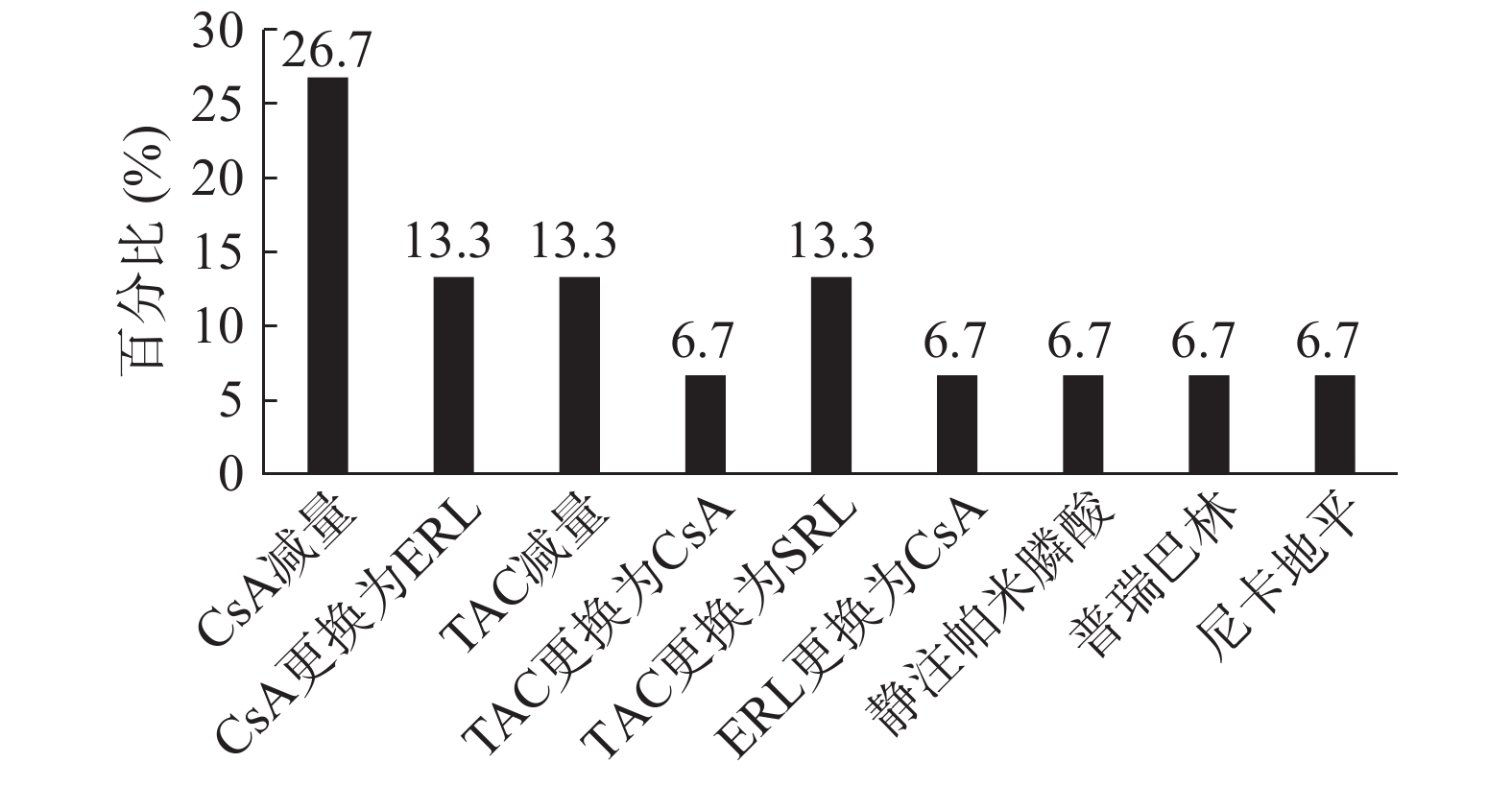
在本研究纳入的15名患者中, 4名(26.7%)患者调整了环孢素剂量, 治疗后3个月症状缓解。1名(6.7%)患者将环孢素更换为依维莫司, 出院后两周和随访4个月后, 疼痛有所改善, 后给予降钙素治疗4周后无临床获益。1名(6.7%)患者开始使用氨氯地平并不能改善其症状, 但将小剂量环孢素更换为依维莫司后, 疼痛得到明显改善。6个月后, MRI显示骨髓水肿消失, 关节周围轻度积液缓解。2名(13.3%)患者在他克莫司减量后症状改善。1名(6.7%)患者在停用他克莫司并更换为CsA1周内其症状消失, 且血清肌酐水平正常, 肾移植术后无急性排斥反应和疼痛。2名患者(13.3%)将他克莫司更换为西罗莫司后症状均改善, 但其中1例在几周后由于华法林引起的脑出血而死亡。将依维莫司更换为小剂量环孢素后2个月, 1名(6.7%)患者的症状改善, 并且未采用任何特殊治疗, 发病后7个月其疼痛症状消失。1名(6.7%)患者在开始静脉注射帕米膦酸后其活动能力有所改善。1名(6.7%)患者在合用克霉唑2 d后出现背部疼痛, 考虑克霉唑导致他克莫司水平升高, 故停用克霉唑, 并给予硝苯地平治疗, 患者背部疼痛无缓解, 但在普瑞巴林首次给药后30 min内患者疼痛评分明显降低, 并在发病后3周疼痛症状消失。1名(6.7%)患者将他克莫司更换为依维莫司后疼痛未缓解, 给予曲马多、氨酚氢可酮、芬太尼、度洛西汀、西那卡塞和双膦酸盐后患者疼痛亦无明显缓解, 但在将硝苯地平更换为尼卡地平后患者疼痛缓解, 最终在移植后9个月症状完全缓解。13名患者的症状好转时间平均为(4.43±3.31)个月, 另外2名患者未描述。CIPS有效治疗方式的分布见图 1。
3. 讨论
在本研究中, 肾移植术后出现CIPS的患者无明显性别差异且为中青年人群, 其肾移植类型多为尸体肾移植, 原发病主要为IgA肾病、自身免疫性疾病和高血压。既往研究报道CIPS主要累及下肢, 本研究显示可出现CIPS症状的部位众多, 涉及双侧手、肘、腕、膝盖、脚踝、双足以及后背。CIPS多表现为神经性症状, 如异常性疼痛和电击样疼痛, 也有相关瘙痒的报道。没有营养性皮肤变化或血管舒缩不稳的迹象。体格检查通常是正常的。
本研究中CIPS出现的时间范围为肾移植后14 d至1年, 经治疗后缓解期最短为20 d, 最长可达1年。实验室检查提示发生CIPS时CNIs的谷浓度升高或正常, 部分患者的碱性磷酸酶、甲状旁腺激素、血钙、C反应蛋白水平升高, 血磷水平异常, 而类风湿因子、尿酸水平正常。CIPS已被证实可能发生在肝、肾移植以及干细胞移植中。CNIs阻断可下调背景电流的脊髓钾离子通道, 进而通过影响动作电位传播的速度来增强兴奋性信号传导[16]。Grotz等提出了这样的假说, 即CNIs引起的血管紊乱导致骨髓血管通透性增加并伴有骨髓水肿, 后期报道的一些CIPS患者受累关节中示踪剂摄入增加和轻度骨髓水肿亦证实了这一假说。他克莫司可通过增加潜在的N-甲基-D-天冬氨酸受体(NMDAR)活性导致不受限制的伤害性输入, 并且其磷酸化状态由蛋白激酶和蛋白磷酸酶活性之间的平衡动态控制。酪蛋白激酶II的激活可增加NMDARs的磷酸化和活性, 而钙调磷酸酶可以负反馈调节大脑中NMDARs的磷酸化及其功能。尽管CNIs导致脊髓NMDAR活性增加的机制尚不完全清楚, 但在CIPS中, CNIs可能通过抑制钙调磷酸酶的活性, 使脊髓背角中NMDARs的磷酸化/去磷酸化周期转变为以磷酸化状态为主[17]。初级感觉神经元和脊髓背角神经元的中央末端之间的第一感觉突触在感觉信息的传递和转换中起着重要作用。谷氨酸是一种重要的兴奋性神经递质, 而NMDARs在与背角疼痛传导相关的脊髓突触可塑性中起着关键作用[18]。
针对CIPS的药物治疗中, 阿片类镇痛药如吗啡、芬太尼、羟考酮等通常对CIPS无效。非甾体类抗炎药可以缓解症状, 但会对肾功能产生不利影响。据报道, 核心减压可迅速改善短暂性骨髓水肿的症状, 但如果保守处理, CIPS和短暂性骨髓水肿通常会在2~4个月内改善。氯膦酸盐和降钙素的使用似乎可以通过抑制骨溶解来减轻疼痛。CNIs减量或停用也可以缓解疼痛症状。在许多情况下, CNIs交换(如从他克莫司更换为环孢素或从环孢素更换为他克莫司)是有效的。下肢疼痛时建议将腿抬高。使用不抑制细胞色素P450的钙通道拮抗剂似乎也能有效地降低骨内高压。前列环素类似物伊洛前列素可能至少在重症患者中是一种安全的治疗选择。在Tillmann等进行的一项原始研究中, 采用标准方案静注伊洛前列素治疗10名患者, 通过评分从1~10的视觉类似量表测量, 结果表明伊洛前列素可促进疼痛的缓解: 治疗前(5.6±1.5), 治疗后(2.1±1.3), P = 0.0004[19]。Taşoğlu等的病例报告中首次描述了通常能有效用于神经性疼痛的γ-氨基丁酸(GABA)类似物, 如加巴喷丁或普瑞巴林。作者介绍了一名48岁接受了肝移植手术的男性患者, 该患者出现了双脚剧烈疼痛, 且疼痛程度逐渐增加, 有时甚至累及到膝盖。而给予普瑞巴林150 mg, 每天2次, 显著减轻了他的疼痛[20]。尽管已描述了在使用双膦酸盐(30 mg)后, CIPS症状得到改善, 但目前对其有效性仍存在争议。本研究中76.9%(10/13)的肾移植受者通过将CNIs减量或将CNIs更换为同类药物中的另一种药物, 使CIPS症状得到了缓解, 其他缓解症状的方法还包括静脉注射帕米膦酸、使用普瑞巴林以及尼卡地平。而使用阿片类镇痛药、双磷酸盐、降钙素、氨氯地平或硝苯地平未能明显改善症状。
CIPS是移植受者中发生的一种难治性疼痛综合征, 受累部位广泛, 病程长短不一, 其发病机制仍有待进一步研究。CIPS的最有效治疗方法是减少CNIs的剂量和更换免疫抑制剂, 其他治疗方式包括GABA类似物、帕米膦酸钠静脉注射、钙通道阻滞剂和保守疗法等。
-
表 1 口服给药后体内以美沙拉嗪表征的药动学参数
样品 cmax
(μg/ml)tmax
(h)t1/2
(h)MRT
(h)AUC0~48
(μg·h/ml)AUC0~∞(μg·h/ml) 自研制剂 5.66±0.77 4.3±0.8 15.92±4.64 18.21±4.76 53.94±4.03 59.49±7.24 市售制剂 6.74±0.41 5.0±1.1 13.97±3.40 16.97±3.56 66.49±5.16 71.68±8.85 表 2 口服给药后体内以乙酰美沙拉嗪表征的药动学参数
样品 cmax
(μg/ml)tmax
(h)t1/2
(h)MRT
(h)AUC0~48
(μg·h/ml)AUC0~∞ (μg·h/ml) 自研制剂 7.93±0.75 5.7±0.8 7.32±0.51 9.93±0.30 75.05±4.91 75.56±5.02 市售制剂 10.22±1.37 6.0±0.0 6.84±1.01 10.02±0.81 94.27±8.67 94.79±8.56 -
[1] 马士杰, 罗小玲, 谢睿, 等. 美沙拉嗪缓释颗粒剂不同用药方式在轻-中度溃疡性结肠炎中的临床疗效[J]. 胃肠病学和肝病学杂志, 2016, 25(11):1305-1306. [2] 林德鑫. 美沙拉嗪肠溶片治疗激素抵抗型重症溃疡性结肠炎的临床疗效评价[J]. 医学理论与实践, 2019, 32(7):1001-1002. [3] 解占峰. 美沙拉嗪缓释颗粒治疗溃疡性结肠炎30例疗效观察[J]. 中国肛肠病杂志, 2018, 38(7):54-55. doi: 10.3969/j.issn.1000-1174.2018.07.025 [4] 苏诗娜, 谢清春, 梁超峰, 等. 美沙拉嗪缓释胶囊含量测定方法的研究[J]. 今日药学, 2018, 28(4):233-237. doi: 10.12048/j.issn.1674-229X.2018.04.005 [5] 苏诗娜, 吕竹芬, 梁超峰, 等. 美沙拉嗪肠溶缓释微丸的制备及体外释放度考察[J]. 广东药科大学学报, 2018, 34(2):127-136. [6] 许勇, 王闰. LC-MS/MS法测定吡非尼酮在大鼠体内的药动学参数[J]. 中南药学, 2015, 13(9):919-922. doi: 10.7539/j.issn.1672-2981.2015.09.007 [7] 吴畅烜, 缪明星, 王毅兵, 等. LC-MS法研究熊胆粉提取物中熊去氧胆酸和鹅去氧胆酸在大鼠体内药物代谢动力学[J]. 中南药学, 2016, 14(7):716-720. [8] 饶志, 秦红岩, 邵云云, 等. 液相色谱-质谱联用方法测定大鼠血浆、尿液及结肠组织中美沙拉嗪及其代谢产物N-乙酰-5-ASA的浓度[J]. 中国药学杂志, 2014, 49(14):1252-1257. [9] 陈云. 美沙拉嗪对结肠炎大鼠肠黏膜完整性的影响[J]. 现代诊断与治疗, 2014, 25(17):3881-3882. [10] 王星星, 贺沁, 赵婕, 等. 美沙拉嗪联合酪酸梭菌对溃疡性结肠炎大鼠治疗作用及机制研究[J]. 延安大学学报, 2019, 17(1):5-8. [11] 黄林雄, 战丹, 韦文俊, 等. 糖苷PAL在大鼠胃肠道吸收动力学研究[J]. 中南药学, 2009, 7(5):335-337. [12] 李楠, 冯玲玲, 蒋学华, 等. 黄芩苷磷脂复合物大鼠在体胃肠道吸收研究[J]. 中国药学杂志, 2016, 51(12):994-998. 期刊类型引用(3)
1. 张怡,高中强,孙花丽,秦丽君,张斌,张亮亮,门靖. HPLC-RID法测定磷酸奥司他韦干混悬剂中山梨醇的含量. 精细化工中间体. 2023(03): 73-76 .  百度学术
百度学术2. 李洪,周汝虹,王东,杨旭亮,何爱梅,曾长洲,伍江明,晏强. 术前超声引导下腰方肌阻滞联合全身麻醉对肾移植患者术后血清应激反应和疼痛相关指标的影响. 现代生物医学进展. 2022(18): 3489-3493+3519 .  百度学术
百度学术3. 童玲,辛华雯,余爱荣. 造血干细胞移植患者中钙神经蛋白抑制剂致疼痛综合征的文献分析. 中国药物应用与监测. 2022(06): 394-397 .  百度学术
百度学术其他类型引用(0)
-






 下载:
下载:
 下载:
下载: