-
截至2018年12月31日,安徽省中药饮片生产企业有226家,分布于安徽省内16个市区,其中,亳州市176家,阜阳市16家,占全省中药饮片生产企业总数比重分别为78%和7%。
-
2014−2018年安徽省共组织涉及中药饮片生产范围的药品GMP现场检查293家次。其中,通过GMP检查243家次,未通过GMP检查50家次,不合格率为17.10%,详见表1。
表 1 2014−2018年中药饮片GMP认证检查结果(厂家/次数)
年份 年检查总次数 认证通过 未认证通过 不合格率(%) 2014 58 51 7 12.10 2015 74 64 10 13.50 2016 49 43 6 12.20 2017 45 30 15 33.30 2018 67 55 12 17.90 总计 293 243 50 17.10 -
对50家次未通过的GMP现场检查报告进行分析,共发现严重缺陷66项,主要缺陷134项。依据《药品生产现场检查风险评定指导原则》,其中5家次GMP现场检查存在多项主要缺陷相互关联,经综合分析表明,质量管理体系中某一系统不能有效运行,合并升级为严重缺陷项。
-
依据药品GMP及中药饮片等附录对缺陷进行分类,发现严重缺陷条款数量最多的GMP章节为总则(15项),其后依次为机构与人员(11项)、质量管理(9项)、质量控制与保证(8项)等,其中,涉及中药饮片附录章节依次为原则(2项),质量管理(1项),见表2。
表 2 严重缺陷项目分布情况
GMP章节 严重缺陷
(项)涉及GMP
条款出现频次
(次)所占比例
(%,n=66)总则 15 第2、4条 151 22.73 质量管理 9 第7、9、11、12、14条 92 13.64 机构与人员 11 第18、20、25条 113 16.67 厂房与设施 5 第38、40、46条 5 7.58 物料与产品 1 第103条 1 1.52 确认与验证 2 第138、140条 2 3.03 文件管理 5 第150、159、163、175条 5 7.58 质量控制与保证 8 第217、222、223、243条 84 12.12 中药饮片附录 3 第7、51条 3 4.55 计算机化系统附录 2 第14条 2 3.03 合并升级 5 5 7.58 注:1 第2条出现频次为6次,第4条出现频次为9次;2 第12条出现频次为4次;3 第18条出现频次为6次,第20条出现频次为4次;4 第223条出现频次为4次。 对66项严重缺陷汇总分析发现,企业存在生产检验记录和数据不真实,在未通过检查的场所生产中药饮片,人员、设施、设备与企业的生产经营规模不完全适应,存在关键岗位人员兼职或者不能有效履行职责,生产记录或原始数据不能追溯,验证生产品种没有涵盖申请认证范围,物料管理混乱,许可检查中发现的缺陷项目未进行整改等问题。
-
依据GMP正文及中药饮片等附录对134项主要缺陷进行分类,发现主要缺陷条款数量最多的GMP章节为机构与人员(22项),其后依次为质量控制与保证(21项)、文件管理(19项)、中药饮片附录(19项)、确认与验证(16项)、生产管理(8项)等,其中,涉及中药饮片附录章节依次为人员(1项)、厂房与设施(5项)、物料与产品(1项)、确认与验证(6项)、文件管理(3项)、生产管理(1项)、质量管理(2项),见表3。
表 3 主要缺陷项目分布情况
GMP章节 主要缺陷(项) GMP条款 出现频次(次) 所占比例(%,n=134) 质量管理 6 第12、13、14条 6 4.48 机构与人员 22 第17、18、22、23、24、25、27条 221 16.42 厂房与设施 3 第38、44、47条 3 2.24 设备 5 第81、84、86、90条 5 3.73 物料与产品 7 第103、106、112条 7 5.22 确认与验证 16 第139、140、142、143、144、148、149条 162 11.94 文件管理 19 第150、152、155、158、159、161、164、170、173、180、183条 193 14.18 生产管理 8 第184、188、191、196条 84 5.97 质量控制与保证 21 第217、220、222、223、225、226、228、230、241、242、248、250条 215 15.67 自检 2 第309条 2 1.49 中药饮片附录 19 第11、23、24、25、34、39、40、41、43、44、47、52条 19 14.18 确认与验证附录 2 第23、25条 2 1.49 计算机化系统附录 3 第14、16条 3 2.24 取样附录 1 第5条 1 0.75 注:1 第18条出现频次为6次,第27条出现频次为7次;2 第139、140条出现频次均为4次;3 第150条出现频次为4次;4 第184条出现频次为5次;5 第223条出现频次为6次。 对134项主要缺陷汇总分析发现,企业存在以下问题:关键岗位人员职责不清;对某方面的操作知识了解不够,未能完全履行职责;开展培训的内容针对性不强,与该岗位的要求不相适应;缺乏对照品或对照药材不能对品种进行全项检验;偏差未采取有效的纠正和预防措施;未对检验方法进行确认,不能保证检验结果的准确性;工艺规程缺少关键的控制参数;生产检验记录不及时、不准确;确认与验证工作不充分等。
-
从缺陷项目的构成情况和频次可以看出,缺陷相对集中在质量管理及质量控制与保证、机构与人员、文件与生产管理、确认与验证、物料与产品5个方面。以上统计数据一定程度上反映了目前中药饮片生产企业实施新修订药品 GMP过程中普遍存在的一些问题。
-
在GMP检查过程中发现,部分中药饮片企业法人和负责人思想重视程度不够,法律意识淡薄,社会责任感不强,认为中药饮片标准不高也不会产生安全问题,忽略了饮片是用于临床的药品。这类中药饮片生产企业在执行GMP的各个环节中,违反GMP要求的情况频繁发生,如在GMP车间外生产中药饮片;不按炮制工艺进行生产;生产检验记录和数据不真实,质量把关流于形式,提升企业法人和负责人法律意识是保证中药饮片质量的基石。
-
GMP现场检查过程中,多次发现关键人员生产负责人和质量负责人实际履职能力不足,采购、验收、仓储以及检验人员不熟悉药材的分类种属,药材鉴别能力较弱,检验人员检验基本技能差。对药品生产、质量有关的关键岗位人员培训不到位,培训次数少、时间短。另外,培训目的性不强,培训形式单一,内容简单,不分层次和岗位,培训效果不理想,同时也未对培训效果进行评估。企业还未认识到在药品生产中“人、机、料、法、环”最关键的生产要素是人,只有保证有足够的训练有素的人员,才能使质量管理体系顺利运行。
-
重生产、轻管理的现象还是普遍存在,企业制订的文件缺乏可操作性,工艺规程未根据工艺验证内容进行修订,批记录设计不合理,如缺少工艺参数、设备编号、生产操作过程等信息;记录填写、修改不规范。原因是企业的负责人及质量管理人员对文件管理的重要性认识不足,特别是质量保证人员没有充分发挥其在企业生产中的管理作用,使相关受控文件没有得到有效的执行。
-
从目前来看,确认与验证仍然是企业的一个薄弱环节。检查中发现多数企业在验证工作中带有盲目性或应对性。为了认证而验证,方案及验证内容粗糙,有些仅做一组数据,没有重现性,验证的结果不能证明设备操作的可靠性和工艺规程的合理性。
-
部分企业的中药材供应商管理不完善,供应商的审计走形式,供应商档案信息过于简单,没有对直接从农户购入中药材质量进行评估并建立质量档案,不能从物料源头抓起,保证药品的质量。
-
必须全面提升企业法人和负责人法律意识,药品生产企业是药品质量的责任主体,必须履行药品生产经营的各项法律法规和技术规范,必须对自己生产经营的产品质量安全承担法律责任,在强化责任中落实“四个最严”。
2019年颁布实施的新修订的《药品管理法》对药品违法行为处罚等都作出更严格的要求。一是切实“处罚到人”。明确对严重影响质量安全的违法行为,在对违法主体依法处罚的同时,对其法人、主要责任人、直接负责的主管人员和其他责任人员也予以处罚,包括没收违法行为发生期间其所获收入、罚款、一定期限甚至终身禁业,并可以处以拘留。二是提高财产罚幅度,处罚额度全面提升。三是专条规定刑事责任。设专条强调药品违法行为构成犯罪的,要依法追究刑事责任,立场鲜明地保持对药品安全犯罪行为的强力震慑和高压态势[1]。
-
药品生产各要素中最关键的要素是人,尤其是生产负责人和质量负责人。由于中药材品种繁多、来源复杂,各地用药习惯不同,药典和地方规范炮制过程时有不同,同物异名、同名异物的现象多,因此,中药材的验收、鉴别、检验以及中药饮片的炮制生产过程是一项技术性、经验性很强的工作[2]。2010版中药饮片附录对生产和质量管理部门负责人专业、学历、从业经验、年限做出明确要求,要求质量保证和控制人员具备中药材和中药饮片质量控制和鉴别真伪优劣的实际能力,要求采购、仓储验收人员明确中药材鉴别要求以及储存养护知识。
企业应积极引进中药生产和质量管理专业人才,制定切实可行的培训计划,针对不同岗位、不同层次的人员开展培训。培训内容包含法律法规、专业知识、操作技能等,让员工明白做什么、怎么做、达到什么标准。培训是提高企业员工素质的有效途径和手段,只有积极开展注重实效的培训,使最基层的员工到高管层全体人员真正理解GMP的精髓,才能真正执行好GMP,更好地保证产品质量。
-
一个有效的文件管理体系能够很好地指导生产实践。质量管理文件的制定者需深刻理解GMP条款,基于风险管理和企业实际,反复修订文件,确保系统文件具有规范性、系统性和可操作性,文字表达应清晰易懂,确保所有执行人员能获得相关岗位工作的详细指令并遵照执行。对于工艺规程和操作规程中的关键参数,要经过充分验证,确定关键控制点,并保证生产和质量全过程的记录可追溯,确保质量体系在企业中有效运行[3]。
-
中药材质量直接影响中药产品制剂,中药饮片质量优劣直接影响临床疗效,其供应商的选择和管理就显得尤为重要。中药生产企业应对中药材供应商做好供应商审计,形成合格供应商目录,对于发现不符合要求且有作假、掺假、以次充好的,取消其供货资格。为确保药品质量,中药饮片生产企业必须建立良好的物料管理体系,从源头抓起,保证药品的质量。
-
通过对缺陷项目进行统计分析不难发现,部分缺陷项目属于“细节问题”,不被人们所重视,往往正是这些“细节问题”增加了药品质量风险事件的发生率。企业必须按照法定标准和各省、自治区、直辖市中药炮制规范制定工艺规程,并按照工艺规程编写标准操作规程和批生产记录,在生产过程中,及时填写批生产记录、数据完整、内容真实,由操作人及复核人签字,控制好生产过程中每一个环节[4]。
-
中药饮片GMP监管工作是一项对检查员工作技巧性、专业性、原则性较高的工作。这就需要充实人员,建立职业化检查员队伍,有针对性的加强培训,提高对GMP检查工作的认知水平,加深对GMP标准的理解,统一检查尺度[5]。
-
新修订的GMP已实施了10年。我国从GMP认证发展到GMP的持续符合性监管,提升的是管理理念,不变的是GMP在药品生产中的重要作用。中药饮片生产企业应提高法律意识,加强诚信建设,注重人员培训,根据中药饮片的生产特点,真正将GMP的思想贯彻到实处,提高硬件配置水平,建立规范的文件体系并控制实际执行情况,持续合规生产,最大程度地降低药品生产风险,而GMP监管应突出专业性和职业化,切实保证中药饮片质量安全。
GMP Defects in the field inspection for processed Chinese herbal medicine manufacturers in Anhui Province during 2014 to 2018
-
摘要:
目的 为提高中药饮片生产质量管理提出改进措施与建议,为中药饮片生产监管提供思路与对策。 方法 采用回顾性统计分析方法,对2014−2018年安徽省50家未通过药品生产质量管理规范(GMP)认证的中药饮片生产企业检查发现的严重缺陷及主要缺陷项目进行分析。 结果 未通过GMP认证的中药饮片生产企业存在的主要问题集中在企业法人或者负责人法律意识淡薄,关键人员履职能力不足,生产记录或者检验原始数据不能追溯,物料管理混乱,生产管理系统或者质量控制系统不能有效运行等方面。 结论 建议中药饮片生产企业应提高法律意识,加强诚信建设,注重人员培训,严格规范生产;监管部门应突出专业性和职业化,切实保证中药饮片质量安全。 -
关键词:
- 中药饮片 /
- 药品生产质量管理规范 /
- 检查 /
- 缺陷
Abstract:Objective To propose the improvement measures and suggestions for the better quality management of processed Chinese herbal medicine production and provide insights and solutions for the quality control of processed Chinese herbal medicine production. Methods A retrospective statistical analysis was used to analyze the serious defects and major defects found in 50 processed Chinese herbal medicine manufacturers that failed to pass GMP certification in Anhui province from 2014 to 2018. Results The main problems found in processed Chinese herbal medicine manufacturers that failed to pass GMP certification were the low law consciousness of the legal representative or responsibility person, poor performance of key personnel, untraceable original data of the production records or testing, orderless material managements, ineffective operation of the manufacturing management system or quality control system. Conclusion It is recommended that processed Chinese herbal medicine manufacturers should enhance legal awareness, build good faith, pay attention to personnel training and GMP compliance. The regulatory authority should exercise the professionalism to ensure the quality and reliability of processed Chinese herbal medicines. -
Key words:
- Processed Chinese herbal medicine /
- good manufacturing practice /
- inspection /
- defects
-
啤酒花(Humulus lupulus L.)别名忽布、香蛇麻、蛇麻花、啤瓦古丽(维吾尔语),为桑科葎草属植物,是我国新疆药食兼用的特色资源植物。同时,啤酒花还是啤酒酿造的重要原料之一,其不仅赋予了啤酒独特的风味,还延长了啤酒的保质期。人类使用啤酒花已有2000多年的历史,早在公元前2世纪,古巴比伦就曾栽培使用啤酒花。13世纪,啤酒花开始作为草药使用。1516年,德国颁布法令,将啤酒花限定为啤酒的唯一苦味添加剂[1]。啤酒花的花序中含有黄酮类、树脂类、多酚、多糖等多种化学成分,这些成分使其具有抗菌、抗肿瘤、抗氧化、降血糖、降血压,以及雌激素样等药理作用[2]。近年来,啤酒花在抗骨质疏松领域研究较多,展现出广阔的前景,现就有关情况作概要介绍。
1. 化学成分
1.1 树脂类
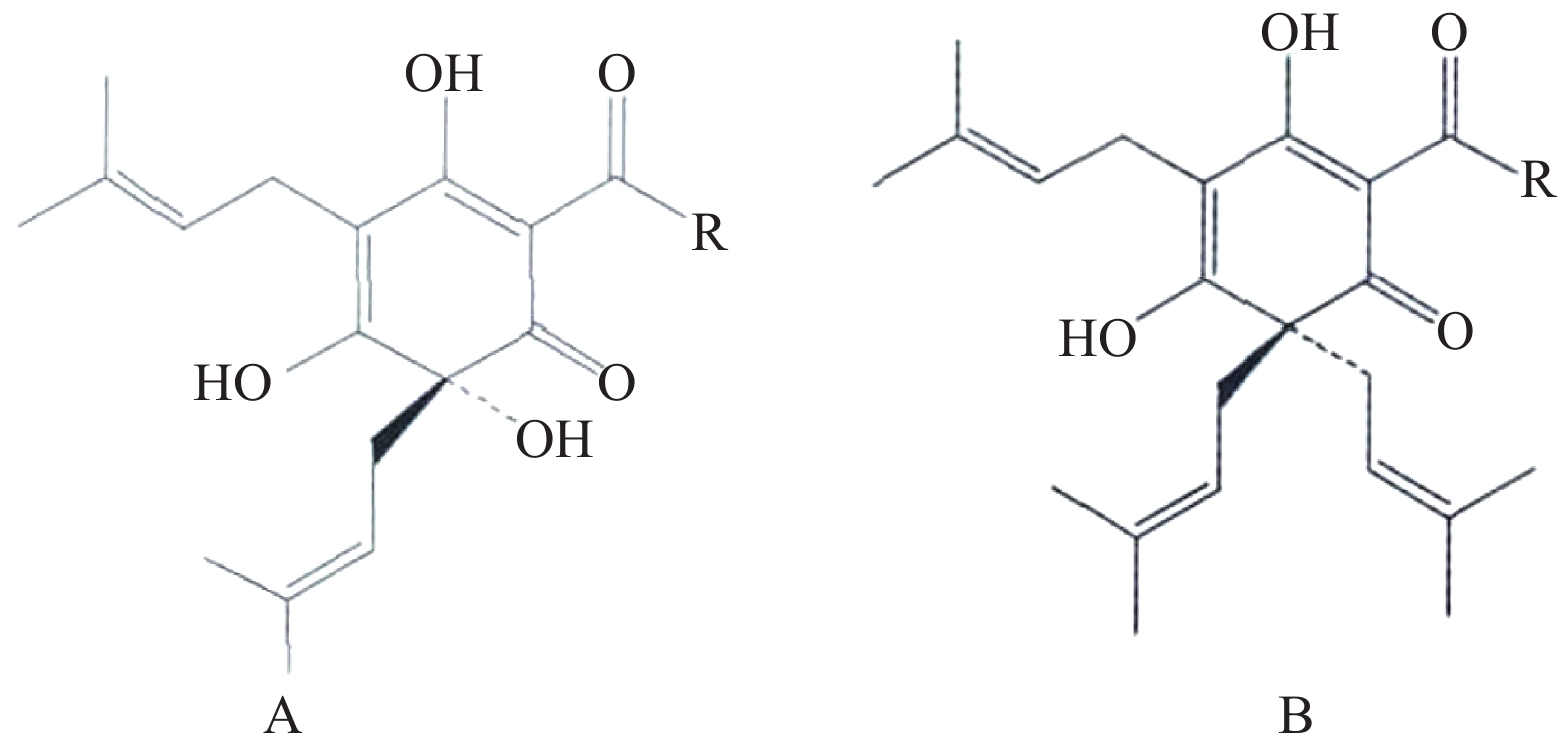
树脂类化合物为啤酒花中的主要成分,具有广泛的生物活性。欧洲酿造协会(EBC)根据不同有机溶剂中树脂类成分的溶解度差异,将其分为软树脂和硬树脂[3]。其中,α-酸和β-酸是啤酒花中最具代表性的软树脂类成分,也是啤酒花独特味道的主要来源。α-酸主要包括葎草酮(图1A)及其同系物,β-酸主要包括蛇麻酮(图1B)及其同系物[4]。在啤酒花中,β-酸含量较α-酸低,易被氧化形成β-软树脂。α-酸在一定条件下易转化为异α-酸,此类成分为啤酒中的主要苦味成分[5]。
1.2 黄酮类
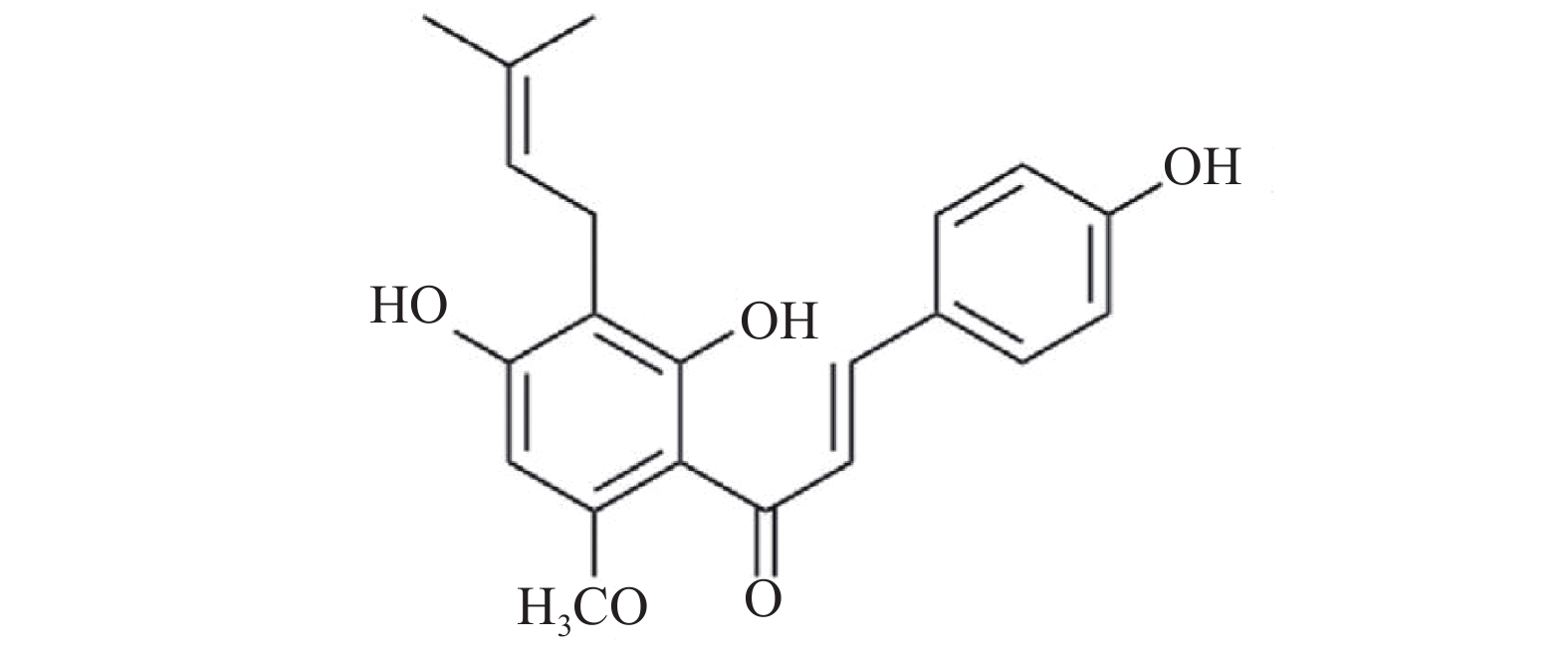
以黄腐酚(图2)为代表的黄酮类成分是啤酒花中重要的化学成分。根据母核结构的不同,可将其分为黄酮类、查尔酮类及黄烷类[6]。黄腐酚为啤酒花特有的异戊烯基类黄酮,最早被Power等[7]分离鉴定得到,主要集中在啤酒花蛇麻腺中,目前因其广泛的药理活性而备受关注。
1.3 挥发油类
啤酒花中的挥发油类成分均由啤酒花的蛇麻腺分泌,是啤酒花香味的来源。啤酒花挥发油主要含有石竹烯、香叶烯、葎草烯、法呢烯等及其脂、酮、醇类化合物[8]。早期研究普遍认为,萜烯类在啤酒花风味中起关键作用,但近年来研究表明,亲水性较强的萜烯醇类对啤酒花风味贡献更为突出[9]。
2. 抗骨质疏松作用
骨质疏松症是以骨量降低和骨微结构破坏为特点的全身性骨代谢疾病。在欧洲,啤酒花提取物用于治疗绝经后骨质疏松症。近年来,啤酒花在防治骨质疏松方面的作用受到广泛关注,其可能通过发挥雌激素样作用、缓解氧化损伤、调节骨形成-骨吸收平衡等途径维持骨稳态,来防治骨质疏松。
2.1 雌激素样作用
雌激素缺失是骨质疏松发病的主要因素之一[10]。啤酒花中的黄酮类成分8-异戊二烯基柚皮素(8-PN),是脱甲基黄腐酚的一种异构物,也是目前分离得到的最有效的植物雌激素[11]。早在2002年,Miligan等[12]即发现天然和人工合成的8-PN在人雌激素受体转染的酵母菌以及雌激素反应的人Ishikawa Var-I细胞中均显示出相似的生物活性,8-PN与两种构型的雌激素受体(ER-α、ER-β)均展现出良好的结合能力。体外筛选实验发现,其雌激素活性高于包括香豆素在内的多种常用植物雌激素。作为啤酒花中最具代表性的黄酮类成分黄腐酚同样具有显著的植物雌激素样作用。研究发现,在去卵巢小鼠中,30和90 mg/(kg·d)的黄腐酚均可显著抑制去卵巢小鼠雌激素缺失所致的体重增加,提高雌激素(E2)水平,抑制碱性磷酸酶(ALP)、抗酒石酸酸性磷酸酶(TRAP)等骨转换指标的高表达,并改善去卵巢小鼠的骨微结构破坏,增强骨密度,防治骨质空洞[13]。
啤酒花中的多种树脂类成分同样具有雌激素样作用。Holick等[14]在为期14周的临床试验中发现,树脂类成分、小檗碱、维生素D和维生素K配伍应用,可调节绝经后妇女的骨代谢水平,降低骨转换标志物骨钙素(OCN),并显著提高患者血清25-羟基维生素D含量,减少骨质丢失。Keiler等[15]以去卵巢大鼠为研究对象,观察标准酒花提取物对大鼠骨丢失的防治作用,结果显示,标准酒花提取物可显著减少大鼠胫骨干骺端破骨细胞的数量,并防止雌二醇消耗导致的骨小梁厚度减少,防治雌激素缺失所致的骨质疏松。
2.2 缓解氧化损伤
雌激素或雄激素缺失会降低骨骼防御氧化应激的能力,从而造成骨质流失,因此,高氧化应激水平与性激素缺乏同为诱发骨质疏松的重要原因[16]。黄酮类化合物大多有酚羟基以及较大的空间位阻,因此,多具有不同程度的抗氧化活性。吴婕等[17] 在研究黄腐酚与其他食品中成分的抗氧化作用时发现,黄腐酚与食品酸味剂柠檬酸、柠檬酸钠、维生素C对DPPH体系均存在协同抗氧化活性。Suh等[18]发现黄腐酚可通过激活氧化应激的关键通路Nrf2来降低MC3T3-E1成骨细胞的氧化损伤,同样证实了黄腐酚具有抗氧化作用。
2.3 维持骨稳态
成骨细胞的骨形成与破骨细胞的骨吸收在骨代谢中共同发挥作用,以维持骨稳态[19]。研究表明,在成骨细胞MC3T3-E1水平上,黄腐酚可显著上调ALP和成骨标记基因骨形成蛋白(BMP-2)、骨涎蛋白(BSP)的表达,并通过调控p38 MAPK和ERK信号通路相关机制,激活转录因子RUNX2,促进骨形成[20]。本课题组前期研究发现,黄腐酚既可以促进原代成骨细胞的增殖、ALP活性以及骨矿化水平,又可以提高骨形成相关蛋白BSP、BMP-2 和骨桥蛋白(OPN)的表达水平[13]。在抑制破骨细胞骨吸收方面,黄腐酚可通过破坏RANK与TRAF6之间的结合,抑制破骨细胞生成过程中NF-κB和Ca2+/NFATc1信号通路,并抑制破骨细胞生成相关标记基因,如组织蛋白酶K(CtsK)、活化T细胞核因子1(NFATc1)以及TRAP的表达,从而抑制骨吸收[21]。
啤酒花树脂类成分同样可以调节骨代谢平衡。蛇麻酮可显著促进成骨细胞增殖,提高ALP活性,促进骨矿化结节,并促进骨形成相关蛋白OCN、BSP和BMP-2的表达。葎草酮也可显著促进成骨细胞活性,并提高骨形成相关蛋白OCN、OPN、BSP和BMP-2的表达。在破骨细胞水平上,蛇麻酮和葎草酮均可降低破骨细胞数目,抑制破骨相关蛋白CtsK、金属基质蛋白酶9(MMP-9)的表达[22]。此外,本课题组前期还发现啤酒花乙醇提取物可显著促进成骨细胞的增殖、ALP活性及骨矿化结节,促进骨形成相关蛋白OPN和BMP-2的表达;并显著抑制破骨相关蛋白TRAP、CtsK、和MMP-9的表达,以维持骨代谢平衡,防止骨吸收大于骨形成所致的骨质流失[23]。
3. 相关产品及应用
啤酒酿制是啤酒花最为传统的一种应用方式,人体中的黄腐酚及相关异戊二烯黄酮类成分主要通过喝啤酒摄入[24]。近年来,啤酒花作为一种特色中药,其药食两用的特性得到了越来越多的关注。相关的健康产品,如美国西楚(Citra)、捷克萨兹(Saaz)的啤酒花颗粒、澳大利亚澳萃维(Nature's Way)啤酒花胶囊、芬兰麦诺美(Menomax)啤酒花浓缩片等层出不穷。现代研究已发现一些啤酒花相关产品在抗骨质疏松方面具有良好的活性。Ban等[25]采用去卵巢大鼠骨质疏松模型,研究Lifenol®的啤酒花提取物防治骨质疏松的作用,结果发现,该产品可显著改善去卵巢所致的大鼠体重增加,调节血脂和脂肪聚集,降低血流速度,改善大鼠潮热,并显著增加大鼠股骨的骨密度,改善骨质疏松。有直接证据表明,喝啤酒可以预防骨质疏松症。Kondo[26]以去卵巢大鼠为骨质疏松模型,研究啤酒对骨质疏松症的影响。结果发现,啤酒能显著抑制去卵巢引起的大鼠股骨骨丢失,且这种抑制作用在单用酒精或不加啤酒花酿造的啤酒中均没有呈现,表明啤酒中抗骨质疏松的活性成分来自啤酒花。此外,Ferk等[27]发现,人类连续饮用黄腐酚饮料14 d后,体内的氧化性嘌呤含量显著降低,氧化损伤程度得到缓解,且血清雌激素及骨钙素水平相对下降,骨代谢紊乱得到显著改善。
4. 我国啤酒花资源现状
学术界对啤酒花的起源地尚无定论,部分学者认为,啤酒花起源于中国[28-29]。在我国,啤酒花的发源地位于黑龙江省东南部的尚志市。1960年,国家轻工业部决定把新疆农场建成国家啤酒花生产基地,并从山东青岛、东北一面坡引进啤酒花。后经过40年的努力,啤酒花种植面积已达185.2公顷,成为新疆地区的主要经济作物之一。
我国的野生啤酒花种群主要分布在新疆的天山和阿尔泰山山脉附近。新疆地区由于光照充足,昼夜温差大,非常适宜啤酒花种植业的发展,并逐渐形成了范围广、规模大、生境类型多,且其成熟期差异明显的野生种质[3]。然而,近些年,啤酒花的资源开发及生产状况不容乐观。由于新疆地区种植的啤酒花主要是从美国、德国引进的品种,在异地栽培时间过长,生长性能下降,病虫害严重,品种退化严重,导致药材品质下降。再就目前常见的优质香型、香型、苦型和高α-酸型啤酒花的不同品种来看,α-酸含量高者大于8%(高α-酸型),低者3%~4%(苦型、香型),α-酸与β-酸比值高者大于2.0(高α-酸型),低者低于1.0(优质香型)。由此看来,重点活性成分苦味酸类在不同类型啤酒花中的含量、比例组成差异极大[4]。这就使得我们应加强从源头上的育种研究,改进抗病性,增加产量和苦味酸类成分的含量,利用栽培品种和育种系(或野生啤酒花)在合适条件下复合优良性状。
5. 展望
现代药理学研究分别从体内和体外实验明确了啤酒花及其活性成分的抗骨质疏松作用。黄腐酚、蛇麻酮和葎草酮均能够促进骨形成和抑制骨吸收,但其抗骨质疏松的深层次机制仍有待阐明。啤酒花对女性绝经后骨质疏松具有防治作用,但对老年性骨质疏松的作用尚不明确。因此,笔者认为阐明啤酒花及其活性成分的作用机制,既是为啤酒花临床应用及转化提供理论基础,亦可为拓展啤酒花的应用范围提供依据。此外,我国啤酒花资源丰富,但种质资源、遗传背景、亲缘关系不清,导致药材品质参差不齐。因此,摸清啤酒花种质资源家底,构建种质资源库;探讨不同基因在种群中的分布频率,弄清种群间的亲缘关系,建立药材的质量标准,方能为啤酒花活性研究和开发提供品质保障。
-
表 1 2014−2018年中药饮片GMP认证检查结果(厂家/次数)
年份 年检查总次数 认证通过 未认证通过 不合格率(%) 2014 58 51 7 12.10 2015 74 64 10 13.50 2016 49 43 6 12.20 2017 45 30 15 33.30 2018 67 55 12 17.90 总计 293 243 50 17.10 表 2 严重缺陷项目分布情况
GMP章节 严重缺陷
(项)涉及GMP
条款出现频次
(次)所占比例
(%,n=66)总则 15 第2、4条 151 22.73 质量管理 9 第7、9、11、12、14条 92 13.64 机构与人员 11 第18、20、25条 113 16.67 厂房与设施 5 第38、40、46条 5 7.58 物料与产品 1 第103条 1 1.52 确认与验证 2 第138、140条 2 3.03 文件管理 5 第150、159、163、175条 5 7.58 质量控制与保证 8 第217、222、223、243条 84 12.12 中药饮片附录 3 第7、51条 3 4.55 计算机化系统附录 2 第14条 2 3.03 合并升级 5 5 7.58 注:1 第2条出现频次为6次,第4条出现频次为9次;2 第12条出现频次为4次;3 第18条出现频次为6次,第20条出现频次为4次;4 第223条出现频次为4次。 表 3 主要缺陷项目分布情况
GMP章节 主要缺陷(项) GMP条款 出现频次(次) 所占比例(%,n=134) 质量管理 6 第12、13、14条 6 4.48 机构与人员 22 第17、18、22、23、24、25、27条 221 16.42 厂房与设施 3 第38、44、47条 3 2.24 设备 5 第81、84、86、90条 5 3.73 物料与产品 7 第103、106、112条 7 5.22 确认与验证 16 第139、140、142、143、144、148、149条 162 11.94 文件管理 19 第150、152、155、158、159、161、164、170、173、180、183条 193 14.18 生产管理 8 第184、188、191、196条 84 5.97 质量控制与保证 21 第217、220、222、223、225、226、228、230、241、242、248、250条 215 15.67 自检 2 第309条 2 1.49 中药饮片附录 19 第11、23、24、25、34、39、40、41、43、44、47、52条 19 14.18 确认与验证附录 2 第23、25条 2 1.49 计算机化系统附录 3 第14、16条 3 2.24 取样附录 1 第5条 1 0.75 注:1 第18条出现频次为6次,第27条出现频次为7次;2 第139、140条出现频次均为4次;3 第150条出现频次为4次;4 第184条出现频次为5次;5 第223条出现频次为6次。 -
[1] 袁林. 不断满足人民群众用药需求[N]. 中国医药报, 2019-09-05(1). [2] 陈伟玲. 浅谈GMP与中药饮片的质量管理[J]. 求医问药(下半月), 2012, 10(8):299-300. [3] 陆仕华, 韦莹莹, 韦广辉. 中药饮片生产企业新版GMP认证检查情况分析[J]. 时珍国医国药, 2018, 29(2):453-455. [4] 覃向阳, 赵倩. 中药饮片生产企业GMP认证后加强管理的建议[J]. 中国药业, 2012, 21(18):5-6. doi: 10.3969/j.issn.1006-4931.2012.18.004 [5] 曹秀荣, 邱博, 魏曼, 等. 湖北省实施新修订GMP认证中存在的问题及建议[J]. 医药导报, 2014, 33(4):547-549. doi: 10.3870/yydb.2014.04.044 -





 下载:
下载:
 下载:
下载: 

