-
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的自身免疫性疾病,以对称性多关节滑膜炎为主要临床表现,呈慢性、进行性及侵袭性,病情逐渐加重,最终可出现残疾,甚至累及脏器和神经系统而危及生命。目前RA 发病机制尚不明确,治疗主要是非甾体抗炎药、糖皮质激素、改善病情抗风湿药及生物制剂等对症治疗或改善病情治疗,但存在不同程度的疗效限制、治疗费用高或长期应用副作用较大等问题。昆仙胶囊作为“九五”国家中医药重点科技攻关项目成果,由昆明山海棠、枸杞子、菟丝子及淫羊藿等组成。已有的研究提示,原方中昆明山海棠有较好的抗炎镇痛与免疫调节作用,枸杞子、菟丝子与昆明山海棠配伍可有效降低其毒性,而淫羊藿与昆明山海棠配伍则可增强免疫调节作用,改善骨损伤。总之,该方有较好的抗炎镇痛、免疫调节及保护关节软骨的作用,可减轻滑膜炎症、修复关节软骨的损伤,毒副作用也相对较低[1-2]。临床研究显示,昆仙胶囊用于治疗RA患者效果显著,能有效缓解关节疼痛、晨僵症状,改善关节功能活动,不仅有较好的疗效,安全性也得到验证[3-6]。
近年来,RA发病机制的研究取得了较快进展,有关昆仙胶囊治疗RA的作用机制有待进一步挖掘研究。网络药理学是基于系统生物学的理论,对生物系统进行网络分析,选取特定信号节点(nodes)进行多靶点药物分子设计的新学科。本研究基于网络药理学技术,依托相应数据库和软件,构建“药物-成分-关键靶点-信号通路”网络,科学系统地分析昆仙胶囊对 RA 的作用机制,以期为后续的实验研究奠定基础。
-
本研究通过计算系统生物学实验室的中药系统药理学数据库和分析平台(TCMSP;http://lsp.nwu.edu.cn/tcmsp.php)检索中药枸杞子、菟丝子、淫羊藿的活性成分,利用本草组鉴(即HERB数据库,http://herb.ac.cn/)检索昆明山海棠的活性成分。再根据化合物口服生物利用度(OB)与类药性指数(DL)筛选活性成分,其中,OB 阈值设为OB≥30%, DL阈值设为DL≥0.18 [7-8] 。最终得到81种有效活性成分,并通过TCMSP数据库获取其对应的靶点。
-
以rheumatoid arthritis为关键词,检索 Genecards(https://www.genecards.org/)数据库及OMIM(https://omim.org/)数据库,收集 RA 的相关靶点。
-
为探明药物活性成分靶点与疾病靶点之间的关系,将两部分靶点通过 Venn图制作网站(http://bioinformatics.psb.ugent.be/webtools/Venn/)进行交集得出公共靶点,并导入Cytoscape3.7.2软件构建化合物-靶点网络。Cytoscape 软件的核心架构是网络,其中的每个节点代表基因或分子,而节点与节点之间的连接代表这些基因或分子之间存在相互作用,节点的度值代表网络中节点与节点相连的数目。
-
为进一步探究靶点蛋白之间的相互作用,将所得的药物与疾病的公共靶点上传至在线STRING10.5软件(http://string db.org),构建蛋白-蛋白相互作用网络模型。其参数修改物种为人(homosapiens),其他参数保持默认设置,获取PPI网络。
-
利用Cytoscape软件中的ClueGo功能对公共靶点进行GO富集分析和KEGG富集分析,其中,GO富集分析分为细胞组成、生物过程以及分子功能 3个部分。设定阈值P<0.05,保存富集分析的结果并将其可视化。
-
使用TCMSP和HERB数据库检索枸杞子、菟丝子、淫羊藿及昆明山海棠的化合物共 384个:其中枸杞子有188个化合物,菟丝子有29个化合物,淫羊藿有130个化合物,昆明山海棠有37个化合物。依据OB≥30%且DL≥0.18筛选出化合物共131个:其中,枸杞子有45个,菟丝子有11个,淫羊藿有23个,昆明山海棠有7个。去除重复后,发现昆仙胶囊中活性成分81个,再通过TCMSP获取对应的药物成分靶点913个,删除重复后得到228个。部分活性成分见表1。
表 1 昆仙胶囊部分活性成分
成分代码 化合物名称 OB(%) DL MOL000006 木犀草素(luteolin) 36.16 0.25 MOL000098 槲皮素(quercetin) 46.43 0.28 MOL000211 迈林(mairin) 55.38 0.78 MOL000296 赫达拉汀(hederagenin) 36.91 0.75 MOL000354 异鼠李素(isorhamnetin) 49.6 0.31 MOL000358 β-谷固醇(beta-sitosterol) 36.91 0.75 MOL000359 谷甾醇(sitosterol) 36.91 0.75 MOL000422 山奈酚(kaempferol) 41.88 0.24 MOL000449 豆甾醇(stigmasterol) 43.83 0.76 MOL000622 甘露聚糖(magnograndiolide) 63.71 0.19 MOL000953 胆固醇(cholesterol) 37.87 0.68 MOL001323 谷固醇α1(sitosterol alpha1) 43.28 0.78 MOL001494 甘露醇 (mandenol) 42 0.19 MOL001495 亚油酸乙酯(ethyl linolenate) 46.1 0.2 MOL001510 24-表氨酯(24-epicampesterol) 37.58 0.71 MOL001558 芝麻素(sesamin) 56.55 0.83 MOL001645 乙酸亚油酯(linoleyl acetate) 42.1 0.2 MOL001771 poriferast-5-en-3beta-ol 36.91 0.75 MOL001792 甘草苷元(liquiritigenin) 32.76 0.18 MOL001979 羊毛甾醇(lanosterol) 42.12 0.75 -
通过 Genecards 数据库得到 RA 靶点4465,通过OMIN数据库得到RA相关靶点41个。通过交集去除重复靶点,共得到RA相关靶点4 494个。
-
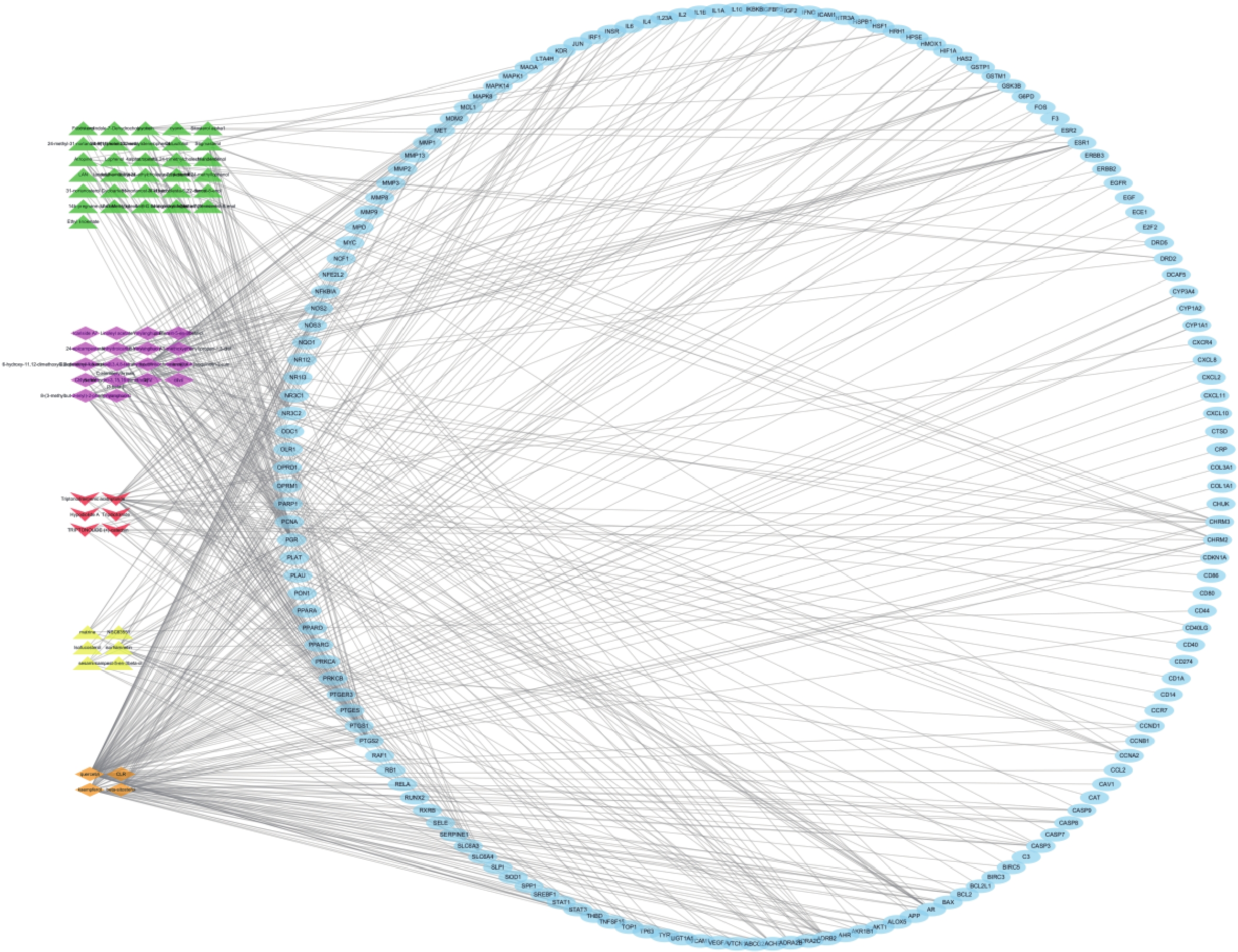
利用 Venn 图制作网站将昆仙胶囊活性成分对应的 228 个靶点与 RA 对应的4494 个靶点进行交集,获得162个共有靶点(图1)。将 162个共有靶点导入 Cytoscape 3.7.2 软件,构建“化合物-靶点”的网络图并进行可视化分析(图2)。网络图包含65个化合物节点、162个靶点节点(公共靶点)和227条边,用绿色表示枸杞子的活性成分,紫色代表淫羊藿的活性成分,红色表示昆明山海棠的活性成分,黄色代表公共活性成分,橘色代表菟丝子的活性成分,蓝色代表靶点。连接活性成分与靶点的边表示两者之间具有相互作用。依据网络拓扑学性质可知,节点较多的化合物或药物靶点在整个网络中可能起到关键的作用,因此本研究筛选节点度较大的节点进行分析。
排名前5位的活性成分分别为槲皮素、木犀草素、山奈酚、β-谷甾醇、雷公藤甲素,分别能与103个、44个、36个、32个、31个靶点蛋白发生作用。排名前5位的靶点分别为孕酮受体(PGR)、前列腺素过氧化物合酶2(PTGS2)、前列腺素过氧化物合酶1(PTGS1)、盐皮质激素受体基因(NR3C2)、雄激素受体(AR),分别能与34个、32个、19个、18个、13个化合物发生作用。
-
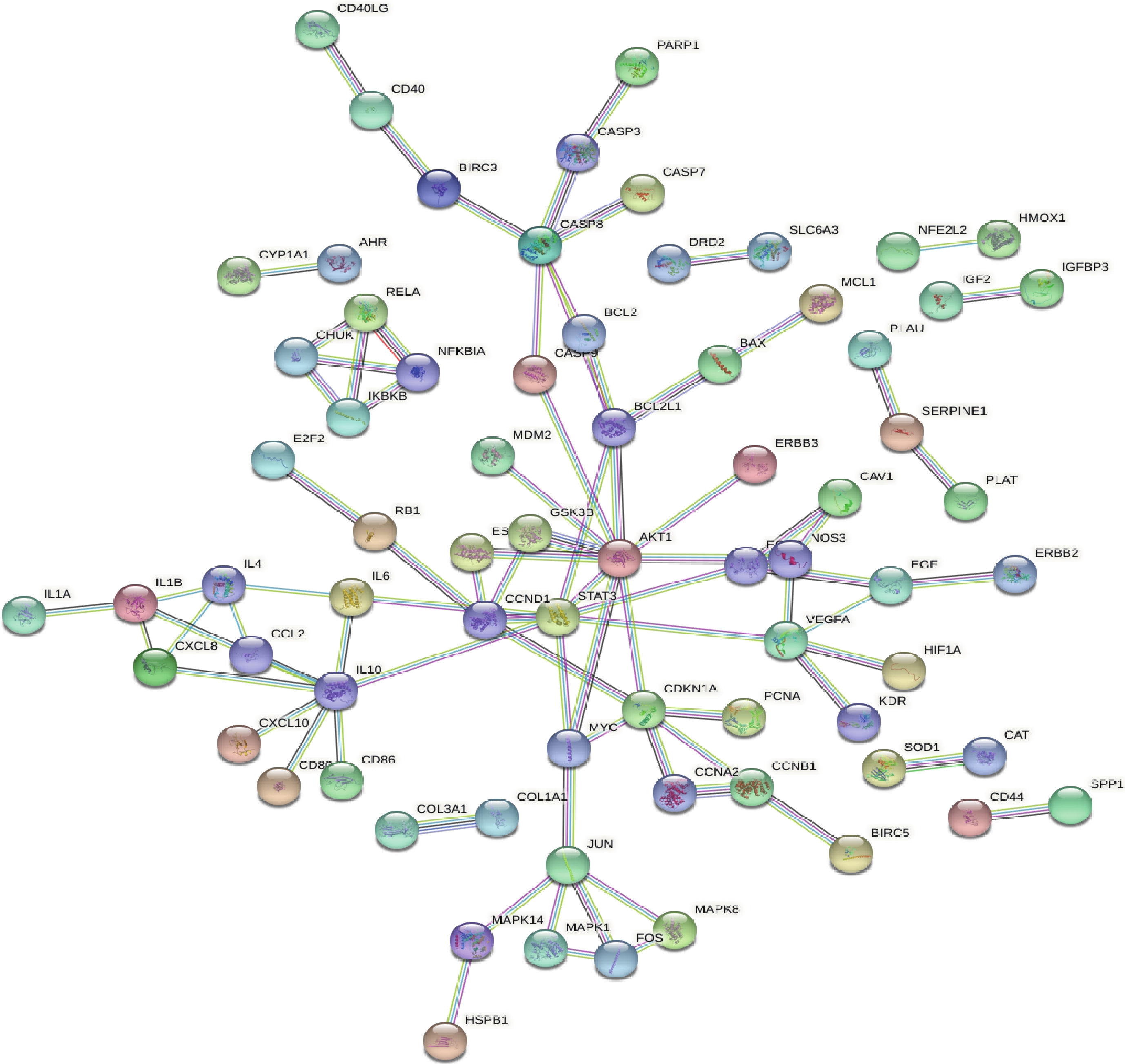
应用STRING软件构建PPI网络(图3),此网络图中通过162个公共靶点得出,共有边84条,同时得到网络中关键靶点的频次。根据“度值>均值”筛选出关键节点20个,包括:IL-6、IKBKB、FOS、EGFR、EGF、CXCL8、CHUK、CCNB1、MYC、IL4、IL1B、VEGFA、JUN、CCND1、BCL2L1、CDKN1A、CASP8、STAT3、IL10、AKT1。度值排名前5位的靶点分别是AKT1、IL10、STAT3、CASP8及CDKN1A,可能为昆仙胶囊治疗RA的关键靶点。
-
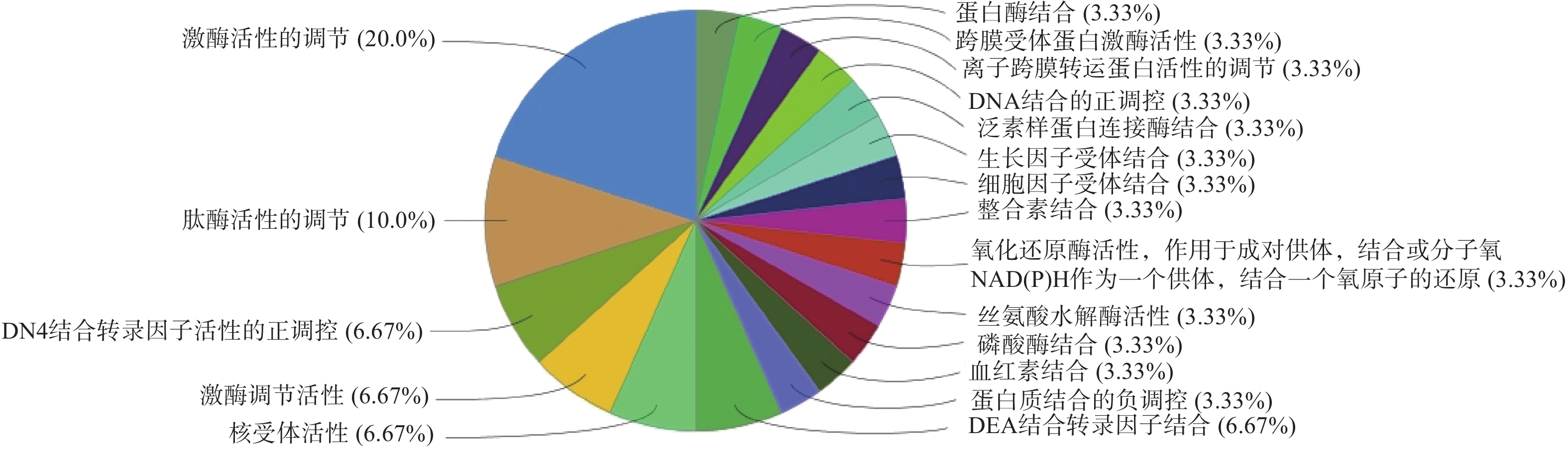
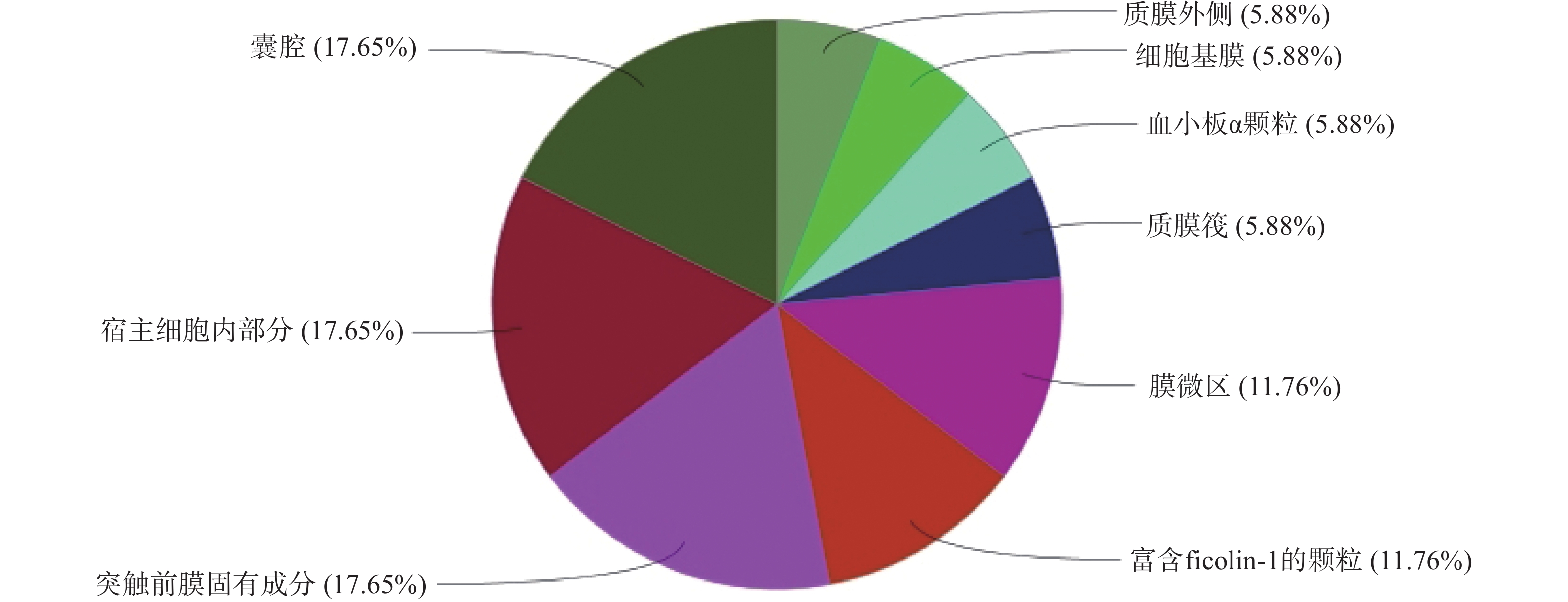
GO生物过程(图4)主要包括:活性氧代谢过程的调控、正调控血管生成、凋亡信号通路的负调控、细胞对化学应激的反应等;分子功能(图5)包括:激酶活性的调节、肽酶活性的调节、DNA结合转录因子活性的正调控、激酶调节活性等;细胞组成(图6)包括:囊腔、宿主细胞内部分、突触前膜固有成分等;KEGG富集分析(图7)主要包括:IL-17信号通路、乙型肝炎、催乳素信号通路、麻疹等,其中,IL-17信号通路的占比最高,其次为乙型肝炎。
-
RA致残率较高,是对健康危害较大的风湿病之一。昆仙胶囊由昆明山海棠、枸杞子、菟丝子及淫羊藿等中药组成,治疗RA疗效显著,但具体作用机制尚不十分明确。本研究借助网络药理学方法,获得昆仙胶囊治疗RA的主要活性分子及相关的靶点基因,进行GO 功能富集和 KEGG 功能分析,预测其治疗RA可能的物质基础和作用机制,为后续研究提供思路和依据。
从“化合物-靶点”的网络图可以看出,槲皮素、木犀草素、山奈酚、β-谷甾醇、雷公藤甲素是昆仙胶囊中治疗RA的主要活性成分。槲皮素是一种广泛存在于植物中的黄酮类化合物,临床研究提示,单用槲皮素治疗的RA患者晨僵、疼痛和活动后疼痛明显减轻,疾病活动评分(DAS)和健康评估问卷(HAQ)得分降低,有良好的治疗效果[9]。槲皮素能调节核转录因子κB(NF-κB)通路;抑制TNF-α、IL-1β、IL-17和单核细胞趋化蛋白-1(MCP-1)的水平;减少炎症细胞向关节部位募集来缓解RA的炎症[10]。槲皮素可降低基质金属蛋白酶 2(MMP-2)的表达和活性,抑制血管内皮细胞的增殖、迁移[11];促进RA成纤维样滑膜细胞(FLS)凋亡和抑制 FLS的迁移和侵袭来减轻 RA[12-13]。此外,调节破骨/成骨细胞和Th17/Treg平衡可能是槲皮素的另一种调节RA的机制[14]。木犀草素具有良好的抗炎活性,能明显降低胶原诱导性关节炎大鼠足跖的炎性肿胀程度,潜在抑制RA NLRP3炎性小体过表达、降低caspase-1、RANKL、VEGF和HIF-1α蛋白表达并增强OPG蛋白表达起到骨关节保护作用[15]。山奈酚拮抗bFGF / FGFR3 / RSK2轴可有效降低胶原诱导性关节炎小鼠的临床和组织学评分。山奈酚发挥抗关节炎作用的主要机制是抑制RA FLS增殖和迁移以及显著抑制Th17分化和破骨细胞生成[16]。β-谷甾醇是植物甾醇的重要组成成分,具有抗炎、调节人体甾体激素、抗氧化及抗肿瘤等作用[17]。研究显示,含有β-谷甾醇的白术醇提物具有显著的抗炎作用,可明显降低佐剂型关节炎大鼠血清和组织中的 TNF-α、C-反应蛋白和 IL-2 的含量[18]。研究证实,雷公藤甲素又称雷公藤内酯、雷公藤内酯醇,具有较为显著的抗炎作用,RA病人用药后关节肿痛明显减轻,有很好的治疗效果。研究提示,雷公藤甲素可通过调节细胞因子、酶类、核转录因子 B 的表达,抑制炎症因子分泌,抑制血管的生成和诱导细胞的凋亡,保护软骨和基因调控等方面发挥抗 RA 药理作用[19]。
靶点PPI网络图提示,AKT1、IL-10、STAT3、CASP8及CDKN1A等可能是昆仙胶囊治疗RA的关键靶点。现有研究提示,蛋白激酶B1(AKT1) 与RA滑膜成纤维细胞生成有关[20],IL-10 在RA 患者血清中存在异常高表达,IL-10具有多种免疫功能,可以抑制炎症和细胞免疫反应,加强与适应性免疫和清除功能相关的耐受性,抑制由单核细胞和巨噬细胞产生的促炎因子[21]。STAT3 是一个关键性 RA致病因子,能够抑制成纤维样滑膜细胞(FLS)凋亡,促进 T 细胞存活及抗体产生,受促炎因子调控而失衡的 STAT3 信号可导致慢性滑膜炎的产生,抑制STAT3 的磷酸化对缓解关节炎症状、促进 FLS凋亡意义重大[22]。Caspase-8在滑膜抗原呈递细胞中发挥功能,通过控制RIPK3的作用来调节对炎症刺激的反应,这种微妙的平衡维持了关节内的稳态[23]。RA患者滑膜组织和成纤维样滑膜细胞(HFLS)中CDKN1A下调。若CDKN1A过表达可显著抑制HFLS的增殖和侵袭,并下调肿瘤坏死因子(TNF)-α和IL-6-的表达,上调了IL-10的表达[24]。
通路富集分析结果表明,昆仙胶囊治疗 RA的作用可能主要与干预IL-17、乙型肝炎及催乳素等信号通路有关,尤其是IL-17信号通路占比最大,达到57.89%。IL-17信号通路是细胞外信号引起细胞核内反应的通道之一,ACT1作为IL-17信号通路的衔接蛋白,与其关键底物TRAF6结合,激活下游NF-κB、JNK等核内基因信号通路,诱导炎性细胞因子、趋化因子和基质金属蛋白酶的表达,继而促进RA滑膜细胞增殖和活化,参与并加重RA病情[25]。RA和牙周炎是影响全世界人群的两种常见的慢性炎症性疾病。两种条件之间的关联一直是许多研究的重点,试图探索这种关联的潜在机制。催乳激素除了促乳作用外,在免疫和炎症中具有多种作用。一些数据表明,滑膜和牙周组织中的催乳素水平显著增加,并且这种增加与疾病活动和组织破坏有关。干预催乳素相关的通路,可能给RA的治疗带来新的机遇[26]。
综上所述,昆仙胶囊可能是通过槲皮素、木犀草素、山奈酚、β-谷甾醇、雷公藤甲素等主要成分,作用于AKT1、IL-10、STAT3、CASP8及CDKN1A等多个靶点,调节IL-17信号通路、乙型肝炎及催乳素等信号通路,从而抑制炎症反应、调节免疫功能、促进FLS凋亡和抑制FLS迁移和侵袭等以治疗 RA。本研究提示,昆仙胶囊治疗 RA 呈现出多成分、多靶点、多通路协同作用优势,为后续的实验研究和临床应用提供了依据。
致谢 感谢海军军医大学中医系博士研究生蔡孟成在网络药理学方面给予的技术支持及靶点筛选方面的意见与建议。
Mechanism of Kunxian capsule in the treatment of rheumatoid arthritis based on network pharmacology
-
摘要:
目的 采用网络药理学方法,探讨昆仙胶囊治疗类风湿关节炎(RA)的分子靶点及可能的作用机制。 方法 利用中药系统药理学数据库和分析平台(TCMSP)结合本草组鉴(HERB)检索昆仙胶囊所含中药的化学成分,并依据 TCMSP 数据库的口服生物利用度(OB)和类药性指数(DL)筛选出主要有效活性成分,并获取其对应的靶点。通过 Genecards数据库与OMIM数据库筛选出 RA 的靶点,利用 Venn图制作网站获取药物与疾病的共同靶点,运用Cytoscape构建“活性成分-靶点”网络;使用 String 数据库绘制靶蛋白相互作用(PPI)网络,利用Cytoscape软件中的ClueGo功能对公共靶点进行GO富集分析和KEGG富集分析。 结果 该研究共筛选出昆仙胶囊的有效活性成分81个,作用靶点913个,去除重复得到228个。从GeneCard数据库与OMIM数据库中获得RA的靶点4494个,通过交集获得公共靶点162个。揭示了槲皮素、木犀草素、山奈酚、β-谷甾醇及雷公藤甲素等5种成分是昆仙胶囊中的主要活性成分,AKT1、IL-10、STAT3、CASP8及CDKN1A可能是该药治疗RA的关键靶点。GO及KEGG富集分析结果显示,昆仙胶囊干预RA的作用机制主要与活性氧代谢过程的调控、激酶活性的调节、IL-17信号通路等有关,涉及感染、炎症及免疫的重要生物过程和信号通路。 结论 本研究从网络药理学角度,初步探讨了昆仙胶囊治疗RA的物质基础和作用机制,提示了其多成分、多靶点、多途径的整体调节特点,为后续分子生物学实验研究提供了思路与依据。 Abstract:Objective To explore the molecular targets and associated potential pathways of Kunxian capsule in the treatment of rheumatoid arthritis (RA) based on network pharmacology. Methods The constituents of Kunxian capsule were searched by Traditional Chinese Medicine Systems Pharmacology Database, Analysis Platform (TCMSP) and a high-throughput experiment- and reference-guided database of traditional Chinese medicine(HERB).The potential active ingredients and targets were retrieved based on TCMSP database. RA related gene targets were retrieved through GeneCards database and OMIM database. Venn online software was used to obtain the common target of drugs and diseases. The “compound-target” network diagram was constructed with Cytoscape software. String database was used to draw the protein interaction (PPI) network. Gene Ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) pathway analysis of the intersection network were conducted by Bioconductor Database. Results 81 active ingredients and 913 targets were identified. 228 targets were obtained after removing the duplicates. 4494 target genes directly related to RA were obtained from the GeneCards databases and OMIM databases. 162 genes were obtained from the intersection of component-target and disease-target. It was revealed that five ingredients including quercetin, luteolin, kaempferol, β-sitosterol and triptolide are the main active ingredients in Kunxian capsule. AKT1, IL-10, STAT3, CASP8 and CDKN1A may be the main therapeutical targets. The results of GO and KEGG enrichment analysis showed that the mechanism of Kunxian capsule is mainly related to the regulation of reactive oxygen metabolism, the regulation of kinase activity, and IL-17 signaling pathway. The important biological processes and signaling pathways include infection, inflammation and immunity. Conclusion This research preliminarily explored the mechanism of Kunxian capsule in the treatment of RA by network pharmacology and suggested that the overall regulation is characterized by multi-components, multi-targets, and multi-channels. It provided some ideas for further molecular biology experiments. -
Key words:
- Kunxian capsule /
- rheumatoid arthritis /
- network pharmacology
-
表 1 昆仙胶囊部分活性成分
成分代码 化合物名称 OB(%) DL MOL000006 木犀草素(luteolin) 36.16 0.25 MOL000098 槲皮素(quercetin) 46.43 0.28 MOL000211 迈林(mairin) 55.38 0.78 MOL000296 赫达拉汀(hederagenin) 36.91 0.75 MOL000354 异鼠李素(isorhamnetin) 49.6 0.31 MOL000358 β-谷固醇(beta-sitosterol) 36.91 0.75 MOL000359 谷甾醇(sitosterol) 36.91 0.75 MOL000422 山奈酚(kaempferol) 41.88 0.24 MOL000449 豆甾醇(stigmasterol) 43.83 0.76 MOL000622 甘露聚糖(magnograndiolide) 63.71 0.19 MOL000953 胆固醇(cholesterol) 37.87 0.68 MOL001323 谷固醇α1(sitosterol alpha1) 43.28 0.78 MOL001494 甘露醇 (mandenol) 42 0.19 MOL001495 亚油酸乙酯(ethyl linolenate) 46.1 0.2 MOL001510 24-表氨酯(24-epicampesterol) 37.58 0.71 MOL001558 芝麻素(sesamin) 56.55 0.83 MOL001645 乙酸亚油酯(linoleyl acetate) 42.1 0.2 MOL001771 poriferast-5-en-3beta-ol 36.91 0.75 MOL001792 甘草苷元(liquiritigenin) 32.76 0.18 MOL001979 羊毛甾醇(lanosterol) 42.12 0.75 -
[1] 徐强, 林昌松, 王笑丹, 等. 昆仙胶囊对胶原诱导型关节炎大鼠滑膜及血清白细胞介素-8的影响[J]. 广州中医药大学学报, 2012, 29(4):415-419,490. [2] 王笑丹, 徐强, 林昌松, 等. 昆仙胶囊对大鼠诱导性关节炎滑膜及血清γ IP-10的影响[J]. 辽宁中医药大学学报, 2012, 14(7):161-164. [3] 刘畅. 昆仙胶囊治疗类风湿关节炎的临床价值分析[J]. 临床医药文献电子杂志, 2020, 7(10):154,156. [4] 陆艳. 昆仙胶囊治疗类风湿关节炎患者的疗效分析[J]. 中国药物经济学, 2018, 13(8):78-80. doi: 10.12010/j.issn.1673-5846.2018.08.024 [5] 林昌松, 杨岫岩, 戴冽, 等. 昆仙胶囊治疗类风湿关节炎多中心临床研究[J]. 中国中西医结合杂志, 2011, 31(6):769-774. [6] 周俊, 肖微, 吴锐, 等. 昆仙胶囊治疗类风湿关节炎有效性与安全性系统评价[J]. 辽宁中医药大学学报, 2016, 18(10):122-126. [7] TAO W, XU X, WANG X, et al. Network pharmacology-based prediction of the active ingredients and potential targets of Chinese herbal Radix Curcumae formula for application to cardiovascular disease[J]. J Ethnopharmacol,2013,145(1):1-10. doi: 10.1016/j.jep.2012.09.051 [8] XU X, ZHANG W, HUANG C, et al. A novel chemometric method for the prediction of human oral bioavailability[J]. Int J Mol Sci,2012,13(6):6964-6982. doi: 10.3390/ijms13066964 [9] JAVADI F, AHMADZADEH A, EGHTESADI S, et al. The effect of quercetin on inflammatory factors and clinical symptoms in women with rheumatoid arthritis: a double-blind, randomized controlled trial[J]. J Am Coll Nutr,2017,36(1):9-15. doi: 10.1080/07315724.2016.1140093 [10] JI JJ, LIN Y, HUANG SS, ZHANG HL, et al. Quercetin: a potential natural drug for adjuvant treatment of rheumatoid arthritis[J]. Afr J Tradit Complement Altern Med,2013,10(3):418-421. [11] TAN W F, LIN L P, LI M H, et al. Quercetin, a dietary-derived flavonoid, possesses antiangiogenic potential[J]. Eur J Pharmacol,2003,459(2-3):255-262. doi: 10.1016/S0014-2999(02)02848-0 [12] PAN F, ZHU L H, LV H, et al. Quercetin promotes the apoptosis of fibroblast-like synoviocytes in rheumatoid arthritis by upregulating lncRNA MALAT1[J]. Int J Mol Med,2016,38(5):1507-1514. doi: 10.3892/ijmm.2016.2755 [13] ZHAO J, CHEN B, PENG X, et al. Quercetin suppresses migration and invasion by targeting miR-146a/GATA6 axis in fibroblast-like synoviocytes of rheumatoid arthritis[J]. Immunopharmacol Immunotoxicol,2020,42(3):221-227. doi: 10.1080/08923973.2020.1742732 [14] YANG Y, ZHANG X, XU M, et al. Quercetin attenuates collagen-induced arthritis by restoration of Th17/Treg balance and activation of Heme Oxygenase 1-mediated anti-inflammatory effect[J]. Int Immunopharmacol,2018,54:153-162. doi: 10.1016/j.intimp.2017.11.013 [15] 刘杨, 吕冰清, 吴玉梅, 等. 木犀草素抑制类风湿关节炎大鼠NLRP3炎性小体活化增强关节骨保护作用研究[J]. 中华中医药杂志, 2021, 36(1):513-516. [16] LEE CJ, MOON SJ, JEONG JH, et al. Kaempferol targeting on the fibroblast growth factor receptor 3-ribosomal S6 kinase 2 signaling axis prevents the development of rheumatoid arthritis[J]. Cell Death Dis,2018,9(3):401. doi: 10.1038/s41419-018-0433-0 [17] 任建敏. 食物中植物甾醇生理活性及药理作用研究进展[J]. 食品工业科技, 2015, 36(22):389-393,399. [18] KRIPA K G, CHAMUNDEESWARI D, THANKA J, et al. Modulation of inflammatory markers by the ethanolic extract of Leucas aspera in adjuvant arthritis[J]. J Ethnopharmacol,2011,134(3):1024-1027. doi: 10.1016/j.jep.2011.01.010 [19] 李清宋, 邓晓霞, 林色奇, 等. 雷公藤甲素治疗类风湿关节炎作用机制研究进展[J]. 江西中医药, 2015, 46(6):73-76. [20] TONG S, LIU J, ZHANG C. Platelet-rich plasma inhibits inflammatory factors and represses rheumatoid fibroblast-like synoviocytes in rheumatoid arthritis[J]. Clin Exp Med,2017,17(4):441-449. doi: 10.1007/s10238-017-0449-2 [21] HERNÁNDEZ-BELLO J, OREGÓN-ROMERO E, VÁZQUEZ-VILLAMAR M, et al. Aberrant expression of interleukin-10 in rheumatoid arthritis: Relationship with IL10 haplotypes and autoantibodies[J]. Cytokine,2017,95:88-96. doi: 10.1016/j.cyto.2017.02.022 [22] MALEMUD C. Defective T-cell apoptosis and T-regulatory cell dysfunction in rheumatoid arthritis[J]. Cells,2018,7(12):223. doi: 10.3390/cells7120223 [23] DOMINGUEZ S, MONTGOMERY A B, HAINES G K, et al. The caspase-8/RIPK3 signaling axis in antigen presenting cells controls the inflammatory arthritic response[J]. Arthritis Res Ther,2017,19(1):1-16. doi: 10.1186/s13075-016-1210-z [24] GANG X, XU H, SI L, et al. Treatment effect of CDKN1A on rheumatoid arthritis by mediating proliferation and invasion of fibroblast-like synoviocytes cells[J]. Clin Exp Immunol,2018,194(2):220-230. doi: 10.1111/cei.13161 [25] STRZĘPA A, SZCZEPANIK M. IL-17-expressing cells as a potential therapeutic target for treatment of immunological disorders[J]. Pharmacol Rep,2011,63(1):30-44. doi: 10.1016/S1734-1140(11)70396-6 [26] EL-WAKEEL N, HAZZAA H, GAWISH A S. Hypothesis: Rheumatoid arthritis and periodontitis: a new possible link via prolactin hormone[J]. Med Hypotheses,2021,146:110350. doi: 10.1016/j.mehy.2020.110350 期刊类型引用(1)
1. 徐佳明,周晓芳,郭建荣. 基于UPLC-MS/MS技术监测老年患者术后血浆中苯磺酸顺阿曲库铵残留. 药学实践与服务. 2023(03): 192-196 .  本站查看
本站查看其他类型引用(0)
-






 下载:
下载: