-
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的自身免疫性疾病,以对称性多关节滑膜炎为主要临床表现,呈慢性、进行性及侵袭性,病情逐渐加重,最终可出现残疾,甚至累及脏器和神经系统而危及生命。目前RA 发病机制尚不明确,治疗主要是非甾体抗炎药、糖皮质激素、改善病情抗风湿药及生物制剂等对症治疗或改善病情治疗,但存在不同程度的疗效限制、治疗费用高或长期应用副作用较大等问题。昆仙胶囊作为“九五”国家中医药重点科技攻关项目成果,由昆明山海棠、枸杞子、菟丝子及淫羊藿等组成。已有的研究提示,原方中昆明山海棠有较好的抗炎镇痛与免疫调节作用,枸杞子、菟丝子与昆明山海棠配伍可有效降低其毒性,而淫羊藿与昆明山海棠配伍则可增强免疫调节作用,改善骨损伤。总之,该方有较好的抗炎镇痛、免疫调节及保护关节软骨的作用,可减轻滑膜炎症、修复关节软骨的损伤,毒副作用也相对较低[1-2]。临床研究显示,昆仙胶囊用于治疗RA患者效果显著,能有效缓解关节疼痛、晨僵症状,改善关节功能活动,不仅有较好的疗效,安全性也得到验证[3-6]。
近年来,RA发病机制的研究取得了较快进展,有关昆仙胶囊治疗RA的作用机制有待进一步挖掘研究。网络药理学是基于系统生物学的理论,对生物系统进行网络分析,选取特定信号节点(nodes)进行多靶点药物分子设计的新学科。本研究基于网络药理学技术,依托相应数据库和软件,构建“药物-成分-关键靶点-信号通路”网络,科学系统地分析昆仙胶囊对 RA 的作用机制,以期为后续的实验研究奠定基础。
-
本研究通过计算系统生物学实验室的中药系统药理学数据库和分析平台(TCMSP;http://lsp.nwu.edu.cn/tcmsp.php)检索中药枸杞子、菟丝子、淫羊藿的活性成分,利用本草组鉴(即HERB数据库,http://herb.ac.cn/)检索昆明山海棠的活性成分。再根据化合物口服生物利用度(OB)与类药性指数(DL)筛选活性成分,其中,OB 阈值设为OB≥30%, DL阈值设为DL≥0.18 [7-8] 。最终得到81种有效活性成分,并通过TCMSP数据库获取其对应的靶点。
-
以rheumatoid arthritis为关键词,检索 Genecards(https://www.genecards.org/)数据库及OMIM(https://omim.org/)数据库,收集 RA 的相关靶点。
-
为探明药物活性成分靶点与疾病靶点之间的关系,将两部分靶点通过 Venn图制作网站(http://bioinformatics.psb.ugent.be/webtools/Venn/)进行交集得出公共靶点,并导入Cytoscape3.7.2软件构建化合物-靶点网络。Cytoscape 软件的核心架构是网络,其中的每个节点代表基因或分子,而节点与节点之间的连接代表这些基因或分子之间存在相互作用,节点的度值代表网络中节点与节点相连的数目。
-
为进一步探究靶点蛋白之间的相互作用,将所得的药物与疾病的公共靶点上传至在线STRING10.5软件(http://string db.org),构建蛋白-蛋白相互作用网络模型。其参数修改物种为人(homosapiens),其他参数保持默认设置,获取PPI网络。
-
利用Cytoscape软件中的ClueGo功能对公共靶点进行GO富集分析和KEGG富集分析,其中,GO富集分析分为细胞组成、生物过程以及分子功能 3个部分。设定阈值P<0.05,保存富集分析的结果并将其可视化。
-
使用TCMSP和HERB数据库检索枸杞子、菟丝子、淫羊藿及昆明山海棠的化合物共 384个:其中枸杞子有188个化合物,菟丝子有29个化合物,淫羊藿有130个化合物,昆明山海棠有37个化合物。依据OB≥30%且DL≥0.18筛选出化合物共131个:其中,枸杞子有45个,菟丝子有11个,淫羊藿有23个,昆明山海棠有7个。去除重复后,发现昆仙胶囊中活性成分81个,再通过TCMSP获取对应的药物成分靶点913个,删除重复后得到228个。部分活性成分见表1。
表 1 昆仙胶囊部分活性成分
成分代码 化合物名称 OB(%) DL MOL000006 木犀草素(luteolin) 36.16 0.25 MOL000098 槲皮素(quercetin) 46.43 0.28 MOL000211 迈林(mairin) 55.38 0.78 MOL000296 赫达拉汀(hederagenin) 36.91 0.75 MOL000354 异鼠李素(isorhamnetin) 49.6 0.31 MOL000358 β-谷固醇(beta-sitosterol) 36.91 0.75 MOL000359 谷甾醇(sitosterol) 36.91 0.75 MOL000422 山奈酚(kaempferol) 41.88 0.24 MOL000449 豆甾醇(stigmasterol) 43.83 0.76 MOL000622 甘露聚糖(magnograndiolide) 63.71 0.19 MOL000953 胆固醇(cholesterol) 37.87 0.68 MOL001323 谷固醇α1(sitosterol alpha1) 43.28 0.78 MOL001494 甘露醇 (mandenol) 42 0.19 MOL001495 亚油酸乙酯(ethyl linolenate) 46.1 0.2 MOL001510 24-表氨酯(24-epicampesterol) 37.58 0.71 MOL001558 芝麻素(sesamin) 56.55 0.83 MOL001645 乙酸亚油酯(linoleyl acetate) 42.1 0.2 MOL001771 poriferast-5-en-3beta-ol 36.91 0.75 MOL001792 甘草苷元(liquiritigenin) 32.76 0.18 MOL001979 羊毛甾醇(lanosterol) 42.12 0.75 -
通过 Genecards 数据库得到 RA 靶点4465,通过OMIN数据库得到RA相关靶点41个。通过交集去除重复靶点,共得到RA相关靶点4 494个。
-
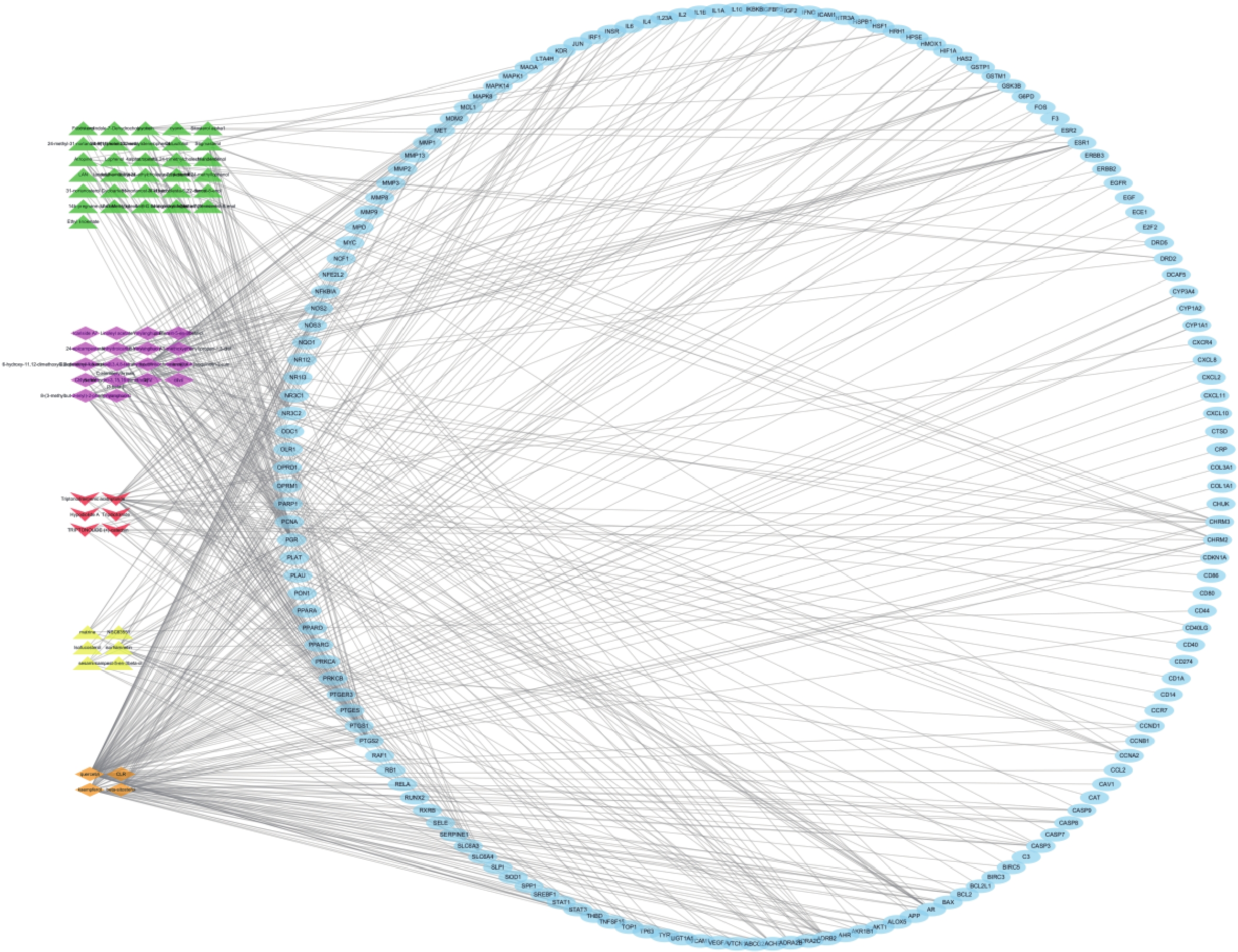
利用 Venn 图制作网站将昆仙胶囊活性成分对应的 228 个靶点与 RA 对应的4494 个靶点进行交集,获得162个共有靶点(图1)。将 162个共有靶点导入 Cytoscape 3.7.2 软件,构建“化合物-靶点”的网络图并进行可视化分析(图2)。网络图包含65个化合物节点、162个靶点节点(公共靶点)和227条边,用绿色表示枸杞子的活性成分,紫色代表淫羊藿的活性成分,红色表示昆明山海棠的活性成分,黄色代表公共活性成分,橘色代表菟丝子的活性成分,蓝色代表靶点。连接活性成分与靶点的边表示两者之间具有相互作用。依据网络拓扑学性质可知,节点较多的化合物或药物靶点在整个网络中可能起到关键的作用,因此本研究筛选节点度较大的节点进行分析。
排名前5位的活性成分分别为槲皮素、木犀草素、山奈酚、β-谷甾醇、雷公藤甲素,分别能与103个、44个、36个、32个、31个靶点蛋白发生作用。排名前5位的靶点分别为孕酮受体(PGR)、前列腺素过氧化物合酶2(PTGS2)、前列腺素过氧化物合酶1(PTGS1)、盐皮质激素受体基因(NR3C2)、雄激素受体(AR),分别能与34个、32个、19个、18个、13个化合物发生作用。
-
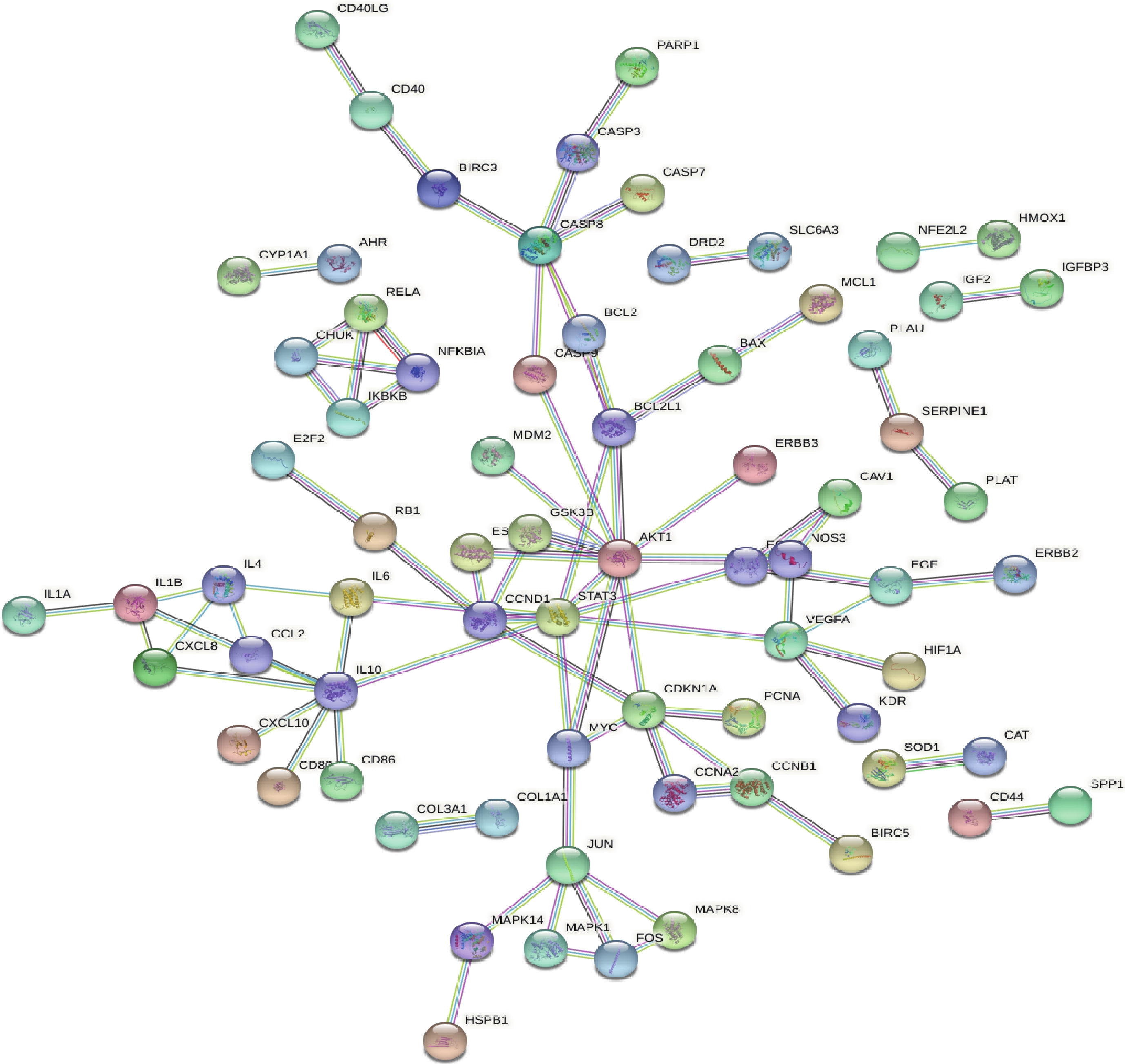
应用STRING软件构建PPI网络(图3),此网络图中通过162个公共靶点得出,共有边84条,同时得到网络中关键靶点的频次。根据“度值>均值”筛选出关键节点20个,包括:IL-6、IKBKB、FOS、EGFR、EGF、CXCL8、CHUK、CCNB1、MYC、IL4、IL1B、VEGFA、JUN、CCND1、BCL2L1、CDKN1A、CASP8、STAT3、IL10、AKT1。度值排名前5位的靶点分别是AKT1、IL10、STAT3、CASP8及CDKN1A,可能为昆仙胶囊治疗RA的关键靶点。
-
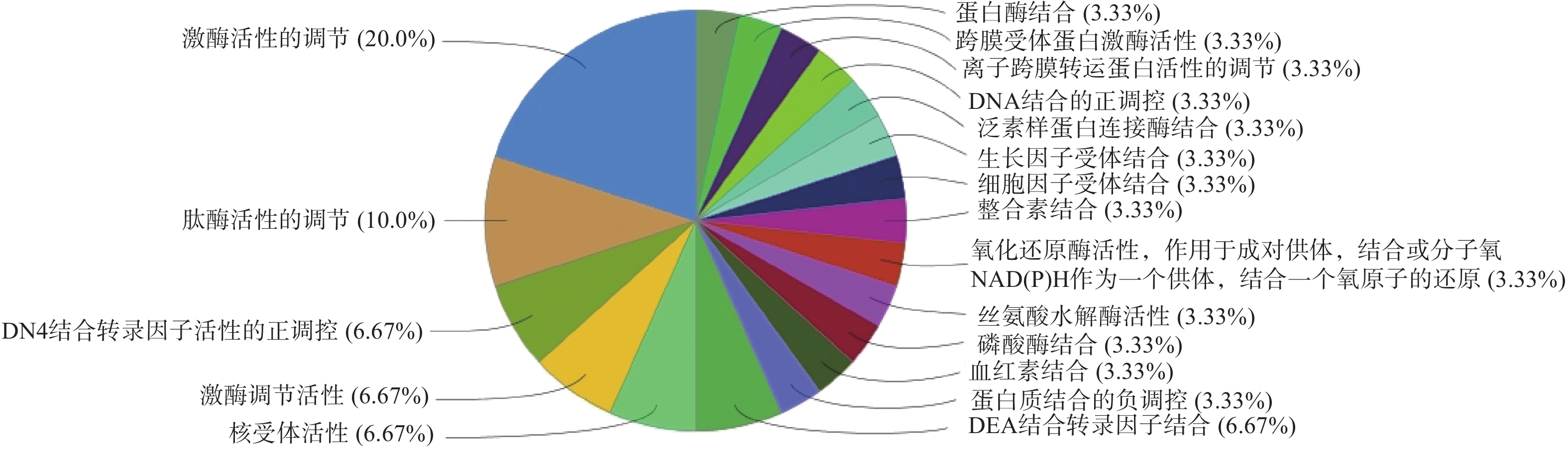
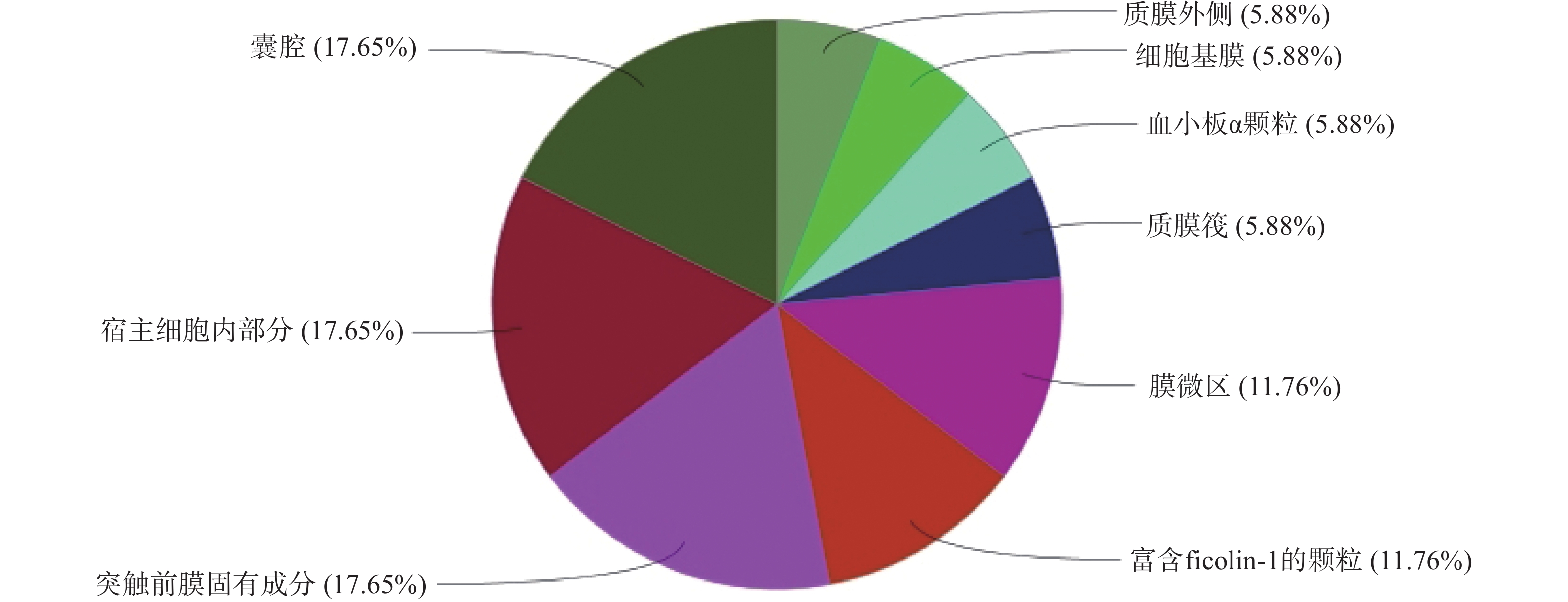
GO生物过程(图4)主要包括:活性氧代谢过程的调控、正调控血管生成、凋亡信号通路的负调控、细胞对化学应激的反应等;分子功能(图5)包括:激酶活性的调节、肽酶活性的调节、DNA结合转录因子活性的正调控、激酶调节活性等;细胞组成(图6)包括:囊腔、宿主细胞内部分、突触前膜固有成分等;KEGG富集分析(图7)主要包括:IL-17信号通路、乙型肝炎、催乳素信号通路、麻疹等,其中,IL-17信号通路的占比最高,其次为乙型肝炎。
-
RA致残率较高,是对健康危害较大的风湿病之一。昆仙胶囊由昆明山海棠、枸杞子、菟丝子及淫羊藿等中药组成,治疗RA疗效显著,但具体作用机制尚不十分明确。本研究借助网络药理学方法,获得昆仙胶囊治疗RA的主要活性分子及相关的靶点基因,进行GO 功能富集和 KEGG 功能分析,预测其治疗RA可能的物质基础和作用机制,为后续研究提供思路和依据。
从“化合物-靶点”的网络图可以看出,槲皮素、木犀草素、山奈酚、β-谷甾醇、雷公藤甲素是昆仙胶囊中治疗RA的主要活性成分。槲皮素是一种广泛存在于植物中的黄酮类化合物,临床研究提示,单用槲皮素治疗的RA患者晨僵、疼痛和活动后疼痛明显减轻,疾病活动评分(DAS)和健康评估问卷(HAQ)得分降低,有良好的治疗效果[9]。槲皮素能调节核转录因子κB(NF-κB)通路;抑制TNF-α、IL-1β、IL-17和单核细胞趋化蛋白-1(MCP-1)的水平;减少炎症细胞向关节部位募集来缓解RA的炎症[10]。槲皮素可降低基质金属蛋白酶 2(MMP-2)的表达和活性,抑制血管内皮细胞的增殖、迁移[11];促进RA成纤维样滑膜细胞(FLS)凋亡和抑制 FLS的迁移和侵袭来减轻 RA[12-13]。此外,调节破骨/成骨细胞和Th17/Treg平衡可能是槲皮素的另一种调节RA的机制[14]。木犀草素具有良好的抗炎活性,能明显降低胶原诱导性关节炎大鼠足跖的炎性肿胀程度,潜在抑制RA NLRP3炎性小体过表达、降低caspase-1、RANKL、VEGF和HIF-1α蛋白表达并增强OPG蛋白表达起到骨关节保护作用[15]。山奈酚拮抗bFGF / FGFR3 / RSK2轴可有效降低胶原诱导性关节炎小鼠的临床和组织学评分。山奈酚发挥抗关节炎作用的主要机制是抑制RA FLS增殖和迁移以及显著抑制Th17分化和破骨细胞生成[16]。β-谷甾醇是植物甾醇的重要组成成分,具有抗炎、调节人体甾体激素、抗氧化及抗肿瘤等作用[17]。研究显示,含有β-谷甾醇的白术醇提物具有显著的抗炎作用,可明显降低佐剂型关节炎大鼠血清和组织中的 TNF-α、C-反应蛋白和 IL-2 的含量[18]。研究证实,雷公藤甲素又称雷公藤内酯、雷公藤内酯醇,具有较为显著的抗炎作用,RA病人用药后关节肿痛明显减轻,有很好的治疗效果。研究提示,雷公藤甲素可通过调节细胞因子、酶类、核转录因子 B 的表达,抑制炎症因子分泌,抑制血管的生成和诱导细胞的凋亡,保护软骨和基因调控等方面发挥抗 RA 药理作用[19]。
靶点PPI网络图提示,AKT1、IL-10、STAT3、CASP8及CDKN1A等可能是昆仙胶囊治疗RA的关键靶点。现有研究提示,蛋白激酶B1(AKT1) 与RA滑膜成纤维细胞生成有关[20],IL-10 在RA 患者血清中存在异常高表达,IL-10具有多种免疫功能,可以抑制炎症和细胞免疫反应,加强与适应性免疫和清除功能相关的耐受性,抑制由单核细胞和巨噬细胞产生的促炎因子[21]。STAT3 是一个关键性 RA致病因子,能够抑制成纤维样滑膜细胞(FLS)凋亡,促进 T 细胞存活及抗体产生,受促炎因子调控而失衡的 STAT3 信号可导致慢性滑膜炎的产生,抑制STAT3 的磷酸化对缓解关节炎症状、促进 FLS凋亡意义重大[22]。Caspase-8在滑膜抗原呈递细胞中发挥功能,通过控制RIPK3的作用来调节对炎症刺激的反应,这种微妙的平衡维持了关节内的稳态[23]。RA患者滑膜组织和成纤维样滑膜细胞(HFLS)中CDKN1A下调。若CDKN1A过表达可显著抑制HFLS的增殖和侵袭,并下调肿瘤坏死因子(TNF)-α和IL-6-的表达,上调了IL-10的表达[24]。
通路富集分析结果表明,昆仙胶囊治疗 RA的作用可能主要与干预IL-17、乙型肝炎及催乳素等信号通路有关,尤其是IL-17信号通路占比最大,达到57.89%。IL-17信号通路是细胞外信号引起细胞核内反应的通道之一,ACT1作为IL-17信号通路的衔接蛋白,与其关键底物TRAF6结合,激活下游NF-κB、JNK等核内基因信号通路,诱导炎性细胞因子、趋化因子和基质金属蛋白酶的表达,继而促进RA滑膜细胞增殖和活化,参与并加重RA病情[25]。RA和牙周炎是影响全世界人群的两种常见的慢性炎症性疾病。两种条件之间的关联一直是许多研究的重点,试图探索这种关联的潜在机制。催乳激素除了促乳作用外,在免疫和炎症中具有多种作用。一些数据表明,滑膜和牙周组织中的催乳素水平显著增加,并且这种增加与疾病活动和组织破坏有关。干预催乳素相关的通路,可能给RA的治疗带来新的机遇[26]。
综上所述,昆仙胶囊可能是通过槲皮素、木犀草素、山奈酚、β-谷甾醇、雷公藤甲素等主要成分,作用于AKT1、IL-10、STAT3、CASP8及CDKN1A等多个靶点,调节IL-17信号通路、乙型肝炎及催乳素等信号通路,从而抑制炎症反应、调节免疫功能、促进FLS凋亡和抑制FLS迁移和侵袭等以治疗 RA。本研究提示,昆仙胶囊治疗 RA 呈现出多成分、多靶点、多通路协同作用优势,为后续的实验研究和临床应用提供了依据。
致谢 感谢海军军医大学中医系博士研究生蔡孟成在网络药理学方面给予的技术支持及靶点筛选方面的意见与建议。
Mechanism of Kunxian capsule in the treatment of rheumatoid arthritis based on network pharmacology
-
摘要:
目的 采用网络药理学方法,探讨昆仙胶囊治疗类风湿关节炎(RA)的分子靶点及可能的作用机制。 方法 利用中药系统药理学数据库和分析平台(TCMSP)结合本草组鉴(HERB)检索昆仙胶囊所含中药的化学成分,并依据 TCMSP 数据库的口服生物利用度(OB)和类药性指数(DL)筛选出主要有效活性成分,并获取其对应的靶点。通过 Genecards数据库与OMIM数据库筛选出 RA 的靶点,利用 Venn图制作网站获取药物与疾病的共同靶点,运用Cytoscape构建“活性成分-靶点”网络;使用 String 数据库绘制靶蛋白相互作用(PPI)网络,利用Cytoscape软件中的ClueGo功能对公共靶点进行GO富集分析和KEGG富集分析。 结果 该研究共筛选出昆仙胶囊的有效活性成分81个,作用靶点913个,去除重复得到228个。从GeneCard数据库与OMIM数据库中获得RA的靶点4494个,通过交集获得公共靶点162个。揭示了槲皮素、木犀草素、山奈酚、β-谷甾醇及雷公藤甲素等5种成分是昆仙胶囊中的主要活性成分,AKT1、IL-10、STAT3、CASP8及CDKN1A可能是该药治疗RA的关键靶点。GO及KEGG富集分析结果显示,昆仙胶囊干预RA的作用机制主要与活性氧代谢过程的调控、激酶活性的调节、IL-17信号通路等有关,涉及感染、炎症及免疫的重要生物过程和信号通路。 结论 本研究从网络药理学角度,初步探讨了昆仙胶囊治疗RA的物质基础和作用机制,提示了其多成分、多靶点、多途径的整体调节特点,为后续分子生物学实验研究提供了思路与依据。 Abstract:Objective To explore the molecular targets and associated potential pathways of Kunxian capsule in the treatment of rheumatoid arthritis (RA) based on network pharmacology. Methods The constituents of Kunxian capsule were searched by Traditional Chinese Medicine Systems Pharmacology Database, Analysis Platform (TCMSP) and a high-throughput experiment- and reference-guided database of traditional Chinese medicine(HERB).The potential active ingredients and targets were retrieved based on TCMSP database. RA related gene targets were retrieved through GeneCards database and OMIM database. Venn online software was used to obtain the common target of drugs and diseases. The “compound-target” network diagram was constructed with Cytoscape software. String database was used to draw the protein interaction (PPI) network. Gene Ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) pathway analysis of the intersection network were conducted by Bioconductor Database. Results 81 active ingredients and 913 targets were identified. 228 targets were obtained after removing the duplicates. 4494 target genes directly related to RA were obtained from the GeneCards databases and OMIM databases. 162 genes were obtained from the intersection of component-target and disease-target. It was revealed that five ingredients including quercetin, luteolin, kaempferol, β-sitosterol and triptolide are the main active ingredients in Kunxian capsule. AKT1, IL-10, STAT3, CASP8 and CDKN1A may be the main therapeutical targets. The results of GO and KEGG enrichment analysis showed that the mechanism of Kunxian capsule is mainly related to the regulation of reactive oxygen metabolism, the regulation of kinase activity, and IL-17 signaling pathway. The important biological processes and signaling pathways include infection, inflammation and immunity. Conclusion This research preliminarily explored the mechanism of Kunxian capsule in the treatment of RA by network pharmacology and suggested that the overall regulation is characterized by multi-components, multi-targets, and multi-channels. It provided some ideas for further molecular biology experiments. -
Key words:
- Kunxian capsule /
- rheumatoid arthritis /
- network pharmacology
-
小檗碱是从毛茛科植物根茎中提取的一种季胺类异喹啉类生物碱,又称黄连素,为中药黄连的主要成分,临床多用其盐酸盐。盐酸小檗碱(BBR)的药理作用主要为清热解毒,属于传统的消化系统用药,临床上常用作抗菌剂,用于治疗细菌性痢疾、肠胃炎等肠道感染[1-2]。盐酸小檗碱溶解度低, 渗透性差,在口服给药时,还存在药物释放快、半衰期短、生物利用度低等缺陷。对于需要达到一定血药浓度为疗效前提的疾病来说,盐酸小檗碱的传统剂型还无法达到理想的治疗效果[3]。
纳米乳(NE)是由油相、水相、表面活性剂、助表面活性剂组成的脂质纳米给药载体。粒径范围为1~100 nm,液滴呈大小均匀的球形,外观呈透明或半透明。纳米乳是一种热力学稳定的胶体分散体系,制备工艺简单,所需能量低甚至能够自发形成。纳米乳处方中油相和表面活性剂、助表面活性剂等组成成分的增溶效果,可以显著提升难溶性药物的溶解度。纳米乳小且均匀的粒径,可透过胃肠道的水化层,改善胃肠上皮细胞对药物的吸收。纳米给药体系具有较低的表面张力,可提高膜的通透性,促进药物吸收,提高其生物利用度[4]。纳米乳自身的独特优势,使其具有广泛的临床应用范围,可通过口服、透皮、注射等多种途径给药[5-6]。
本研究结合纳米乳剂型的优势,制备了盐酸小檗碱口服纳米乳(BBR-NE),采用伪三元相图法和星点设计-效应面法优化了制备工艺,并对其体外特性进行表征,从而解决盐酸小檗碱口服给药剂型溶解度差、生物利用度低等问题,提高药物的疗效,为小檗碱的临床应用提供新的给药剂型[4]。
1. 仪器与试药
1.1 仪器
101A-2型干燥箱(上海实验仪器总厂);AG285十万分之一电子分析天平(瑞士Mettler Toledo公司);SB100D超声波清洗器(宁波新芝生物科技股份有限公司);Agilent 1100高效液相色谱仪(美国安捷伦科技有限公司);EPPENDORF 5804R 高速冷冻离心机(德国Eppendorf有限公司);DF-101S 集热式恒温加热磁力搅拌器(巩义市英峪予华仪器厂);Zetasizer Nano ZS90 测定仪(英国马尔文公司)。
1.2 试药
盐酸小檗碱原料药(批号XC20170113,西安小草植物科技有限公司);盐酸小檗碱对照品(批号110713-201212,纯度>86.7 %,中国食品药品检定研究院);1,2-丙二醇(批号20181008,上海凌峰化学试剂有限公司);吐温-80(批号2015021,上海凌峰化学试剂有限公司);甘油(批号20191110,上海源叶生物科技有限公司);聚乙二醇400(PEG400,批号970248,上海浦东高南化工厂);聚氧乙烯氢化蓖麻油(RH-40,批号19523275L0,德国 BASF 公司);烷基糖苷0810(APG,平均聚合度1.2~1.8,批号170502,上海发凯化工有限公司);丙二醇单辛酸酯(Capryol 90,批号170857,上海嘉法狮贸易有限公司);肉豆蔻酸异丙酯(IPM,批号F20160731,国药集团化学试剂有限公司);橄榄油(批号F20180725,中国医药集团上海化学试剂公司);中链脂肪酸(MCT,批号193717,嘉法狮(上海)贸易有限公司);大豆油(批号20190801,江西金海棠药用油有限公司);蓖麻油(批号20180815,上海凌峰化学试剂有限公司);甲醇、乙腈(色谱纯,美国 TEDIA 有限公司);羟丙甲基纤维素(HPMC,批号H08827,阿拉丁生化科技股份有限公司);水为重蒸水。
2. 方法与结果
2.1 盐酸小檗碱HPLC含量测定方法的建立[7-8]
2.1.1 色谱条件
色谱柱:Hypersil BDS C18柱(4.6 mm×250 mm,5 μm),流动相:乙腈-0.05 mol/L与磷酸二氢钾(0.5 %三乙胺,磷酸调至pH=3)等度洗脱,比例:30∶70,流速1.0 ml/min,紫外检测波长345 nm,柱温25 ℃,进样量20 μl。
2.1.2 方法学考察
精密称取盐酸小檗碱对照品1.0 mg,用甲醇稀释定容于10 ml量瓶中作为储备液,用甲醇逐级稀释成系列对照品溶液,按上述色谱条件进样测定。称取适量盐酸小檗碱纳米乳于10 ml 量瓶中,加入甲醇超声破乳30 min,10000 r/min离心5 min,取1 ml上清液于10 ml 量瓶中,加甲醇定容后过0.45 μm微孔滤膜即得供试品溶液。方法学考察表明,盐酸小檗碱在1.00~100.00 μg/ml浓度范围内呈良好的线性关系,回归方程为:Y=37.059 X+16.952 (r=0.999 9)。低、中、高浓度的盐酸小檗碱对照品溶液的日内精密度分别为0.68 %、1.64 %、0.80 %,日间精密度分别为0.95 %、0.23 %、013 %,加样回收率RSD分别为1.42 %、0.70 %、1.57 %,表明该方法可用于纳米乳中盐酸小檗碱的含量测定。
2.2 盐酸小檗碱纳米乳的制备[4]
2.2.1 油相、表面活性剂和助表面活性剂的筛选
采用水滴加法制备盐酸小檗碱纳米乳。根据各类溶剂口服的安全性,筛选出以下各相备选溶剂,以BBR的溶解度为指标,确定各相最佳选择。
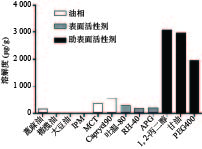
油相:Capryol 90、蓖麻油、橄榄油、大豆油、IPM、MCT;表面活性剂:吐温-80、APG、RH-40;助表面活性剂:1,2-丙二醇、PEG400、甘油。在具塞玻璃离心管中加入5 ml 上述各溶剂与过量盐酸小檗碱,置于恒温(25 ℃)振荡器振摇(100 r/min)72 h,得到以上各溶剂的饱和盐酸小檗碱溶液。取该饱和溶液于5000 r/min 条件下离心10 min,吸取1 ml上清液置于5 ml量瓶中,加甲醇稀释定容之后过0.45 μm微孔滤膜,按“2.1.1”项下色谱条件进样检测。
结果如图1所示:油相中盐酸小檗碱的溶解度从大到小依次为:Capryol 90> MCT>蓖麻油>大豆油>橄榄油>IPM;表面活性剂的顺序为:吐温-80>APG>RH-40;助表面活性剂的顺序为:1,2-丙二醇>甘油>PEG400。即盐酸小檗碱在Capryol 90、吐温-80、1,2-丙二醇中溶解度最大,故选择Capryol 90为油相,吐温-80为表面活性剂,1,2-丙二醇为助表面活性剂。
2.2.2 表面活性剂与助表面活性剂质量比(Km)的筛选
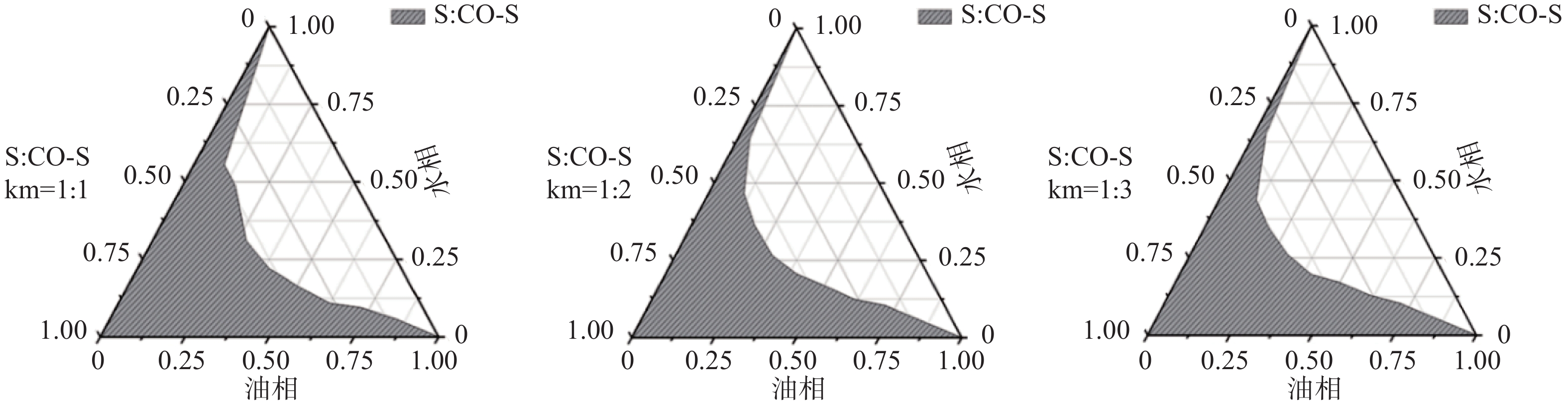
按照上述筛选的结果,将表面活性剂和助表面活性剂按照Km分别为1∶1、1∶2、1∶3、2∶1、3∶1的比例混合,再取油相与此混合表面活性剂按照1∶9、2∶8;3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1的质量比配制成混合溶液,在磁力搅拌下滴加蒸馏水。观察溶液的颜色、乳光和澄明度,判断临界点,记录体系由浑浊变澄清时的加水量,计算临界点时各组分的比例。用Origin 10.0软件绘制伪三元相图,图中各临界点连线下方的区域即为纳米乳区,比较该区域面积大小,确定表面活性剂与助表面活性剂的质量比[9-11]。结果见图2。图中阴影部分即为成乳区,且当Km为2∶1时达到最大,故将Km定为2∶1。然而在实际制备纳米乳过程中,处方中各组分的不同比例会产生交互影响作用,因此,需要进一步采用星点设计-效应面法优化盐酸小檗碱纳米乳的制备工艺。
2.2.3 星点设计-效应面法优化盐酸小檗碱纳米乳处方[4]
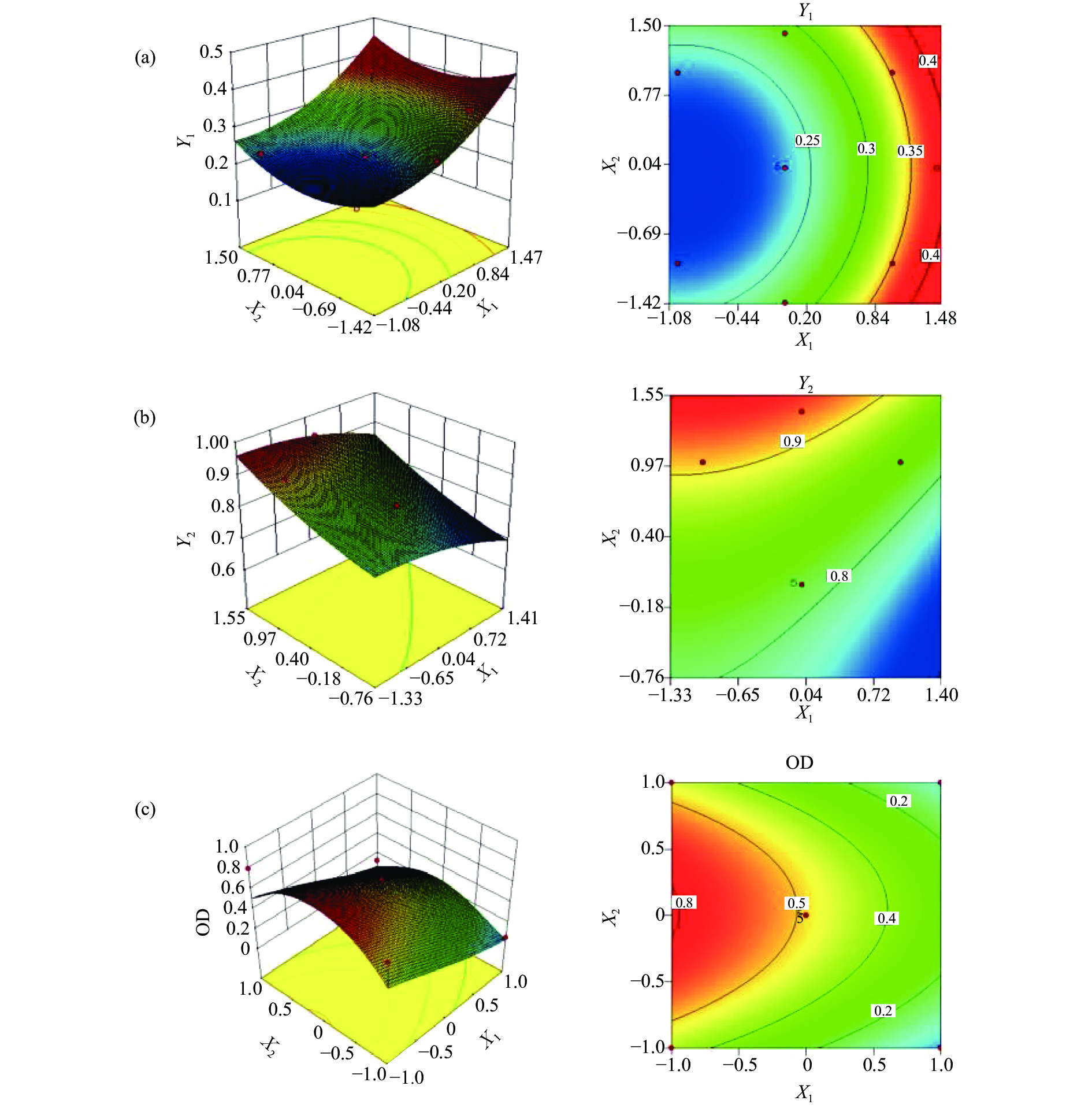
选择对纳米乳影响较大的表面活性剂与助表面活性剂质量比Km(X1)和油相质量百分数(X2)作为考察因素,以多分散系数(PDI,Y1)和载药量(Y2)为考察指标。实验过程中发现当Km≥4时,大部分处方难以成乳;当Km≤1:2时,平均粒径>100 nm,故将Km范围定在1∶1至3∶1。当含油量增至0.5 g(50 %)时,平均粒径已接近100 nm,而当含油量范围在0.2~0.5 g(20 %~50 %)时,可将粒径控制在100 nm之内。根据单因素试验结果确定了Km的取值范围和油相质量百分数,并将两个评价指标进行归一化,将每个指标换算成0~1之间的“归一值(OD)”,并求算几何平均数,得总评“归一值”。计算公式如下: OD=(d1d2d3…... dk)1/k(k为指标数)。对取值越小越好的因素(PDI)和取值越大越好的因素(载药量)采用Hassan法[9]分别进行数学转换,求归一值dmin和dmax,公式如下:dmin=(Ymax−Yi)/(Ymax−Ymin);dmax=(Yi−Ymin)/(Ymax−Ymin)。采用2因素5水平星点设计优化处方,因素水平见表1,星点设计各组实验结果见表2。
表 1 星点设计因素水平表因素 水平 −1.41 −1 0 +1 +1.41 X1(Km) 1∶1 1.29∶1 2∶1 2.71∶1 3∶1 X2(含油量/g) 0.2 0.24 0.35 0.46 0.5 表 2 星点设计各组实验结果编号 X1 X2 平均粒径
(l
/nm)Y1 Y2
(mg/g)dmin dmax OD 1 0 −1.41 46.32 0.29 0.72 0.54 0 0 2 0 0 74.06 0.23 0.81 0.85 0.367 0.558 3 −1 1 85.3 0.25 0.91 0.78 0.820 0.800 4 0 0 74.06 0.23 0.84 0.85 0.53 0.67 5 1 −1 76.58 0.35 0.72 0.21 0.01 0.04 6 1.41 0 59.8 0.36 0.76 0.12 0.15 0.13 7 1 1 101.4 0.38 0.78 0.04 0.34 0.12 8 −1.41 0 58.68 0.21 0.80 1.00 0.36 0.60 9 −1 −1 45.8 0.21 0.84 0.99 0.51 0.71 10 0 0 74.06 0.23 0.81 0.85 0.37 0.56 11 0 0 74.06 0.23 0.81 0.85 0.37 0.56 12 0 0 74.06 0.23 0.80 0.85 0.37 0.56 13 0 1.41 91.88 0.39 0.95 0.00 1.00 0.00 对X1进行二次式回归,得到方程R1=0.23+0.06 A+3.22×10−3B−2.75×10−3AB+0.03A2+0.03B2 ,(r=0.970 8),P<0.001;对X2进行二项式回归,得到方程R2=0.81−0.04A+0.06B+1.37×10−3AB−0.01A2+0.01B2,(r=0.913 5),P<0.05;对总归一值(OD)进行二项式回归,方程为OD=0.87−0.28A+0.03B−0.01AB−0.03A2−0.34B2,(r=0.910 2),P<0.05。以OD作为指标时,为使方程有效,对其进行方差分析,结果见表3。由表3可知,模型的P < 0.05,说明OD与X1、X2回归方程的非线性关系显著。回归方程的相关系数r=0.910 2,表明模型能说明91.02 %响应值的变化,拟合情况良好,回归方程具有较好的代表性,能准确预测实际情况[12]。
表 3 星点设计-效应面法优化纳米乳处方方差分析表来源 平方和 自由度 均方 F P 模型 1.48 5 0.18 5.88 0.0190 A-A 0.65 1 0.51 12.82 0.0090 B-B 7.73 1 3.600 0.15 0.7067 AB 4.40×10−5 1 0.016 8.74×10−3 0.9281 A2 6.32×10−3 1 0.37 0.13 0.7335 B2 0.83 7 0.026 16.41 0.0049 残差 0.35 3 0.058 纯误差 0.011 4 8.70×10-3 42.60 0.0017 总和 1.83 12 r 0.90 校正后r 0.82 C.V.% 35.29 信噪比 7.05 由拟合曲线可绘制X1、X2和OD值的关系,所绘制的三维效应面和二维等高线如图3所示。利用Design Expert 8.0软件的预测分析功能,根据拟合回归方程、三维效应面图和二维等高线图综合分析,得到最佳处方为X1= 0,X2=0.53,预测值OD为0.6214。故优化后的盐酸小檗碱纳米乳处方为:油相Capryol 90占体系的32.84 %,表面活性剂吐温-80占体系的33.90 %,助表面活性剂1,2-丙二醇占体系16.95 %,水相占体系15.25 %[4]。
2.2.4 最优处方的验证
对最优处方进行处方验证,结果如表4所示,预测值OD为0.6214,实际OD值为0.6510,偏差为4.76 %。表明预测值与实测值之间偏差较小,表明星点设计-效应面法(CCD-RSM)可用于筛选盐酸小檗碱纳米乳,筛选的处方预测良好、可靠。
表 4 最优处方验证结果评价指标 实测值 实际OD值 预测OD值 偏差(%) PDI 0.235±0.03 0.6510 0.6214 4.76 载药量(mg/g) 0.829 2.3 盐酸小檗碱纳米乳的体外表征[4]
2.3.1 BBR-NE载药量的测定
取适量BBR-NE于10 ml量瓶中,加甲醇超声破乳30 min,加甲醇稀释定容。4 ℃离心(10000 r/min,5 min),吸取1 ml上清液置于10 ml容量瓶中,加甲醇稀释定容后即得样品溶液。按“2.1.1”项下色谱条件进样检测,计算纳米乳的载药量。测定结果如表5。
表 5 盐酸小檗碱纳米乳的载药量测定结果($\bar x $ ±s ,n=3)批号 盐酸小檗碱(mg/g) RSD(%) 201118 0.83±0.01 0.16 201119 0.83±0.02 0.21 201120 0.83±0.01 0.17 2.3.2 BBR-NE粒径大小与分布的测定
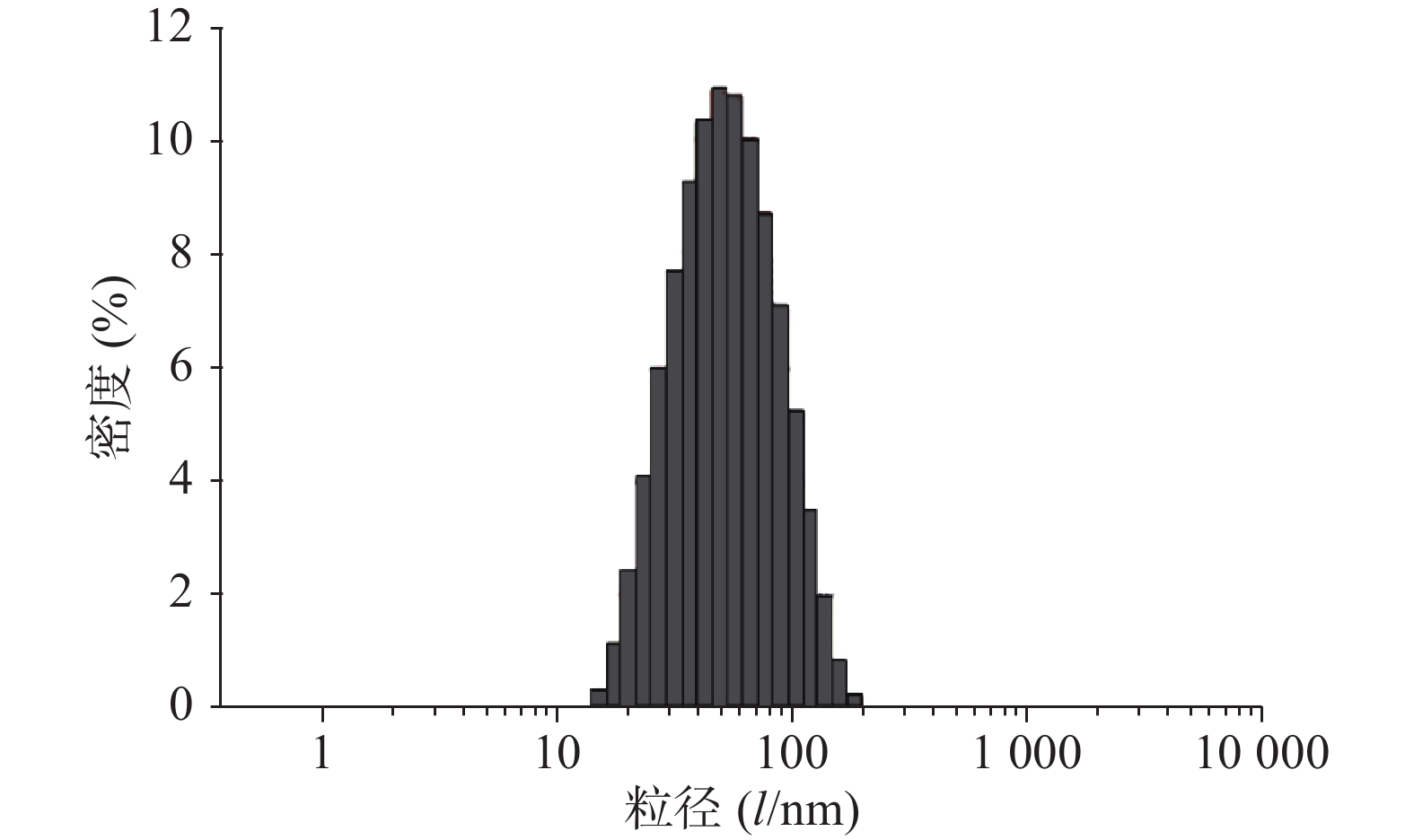
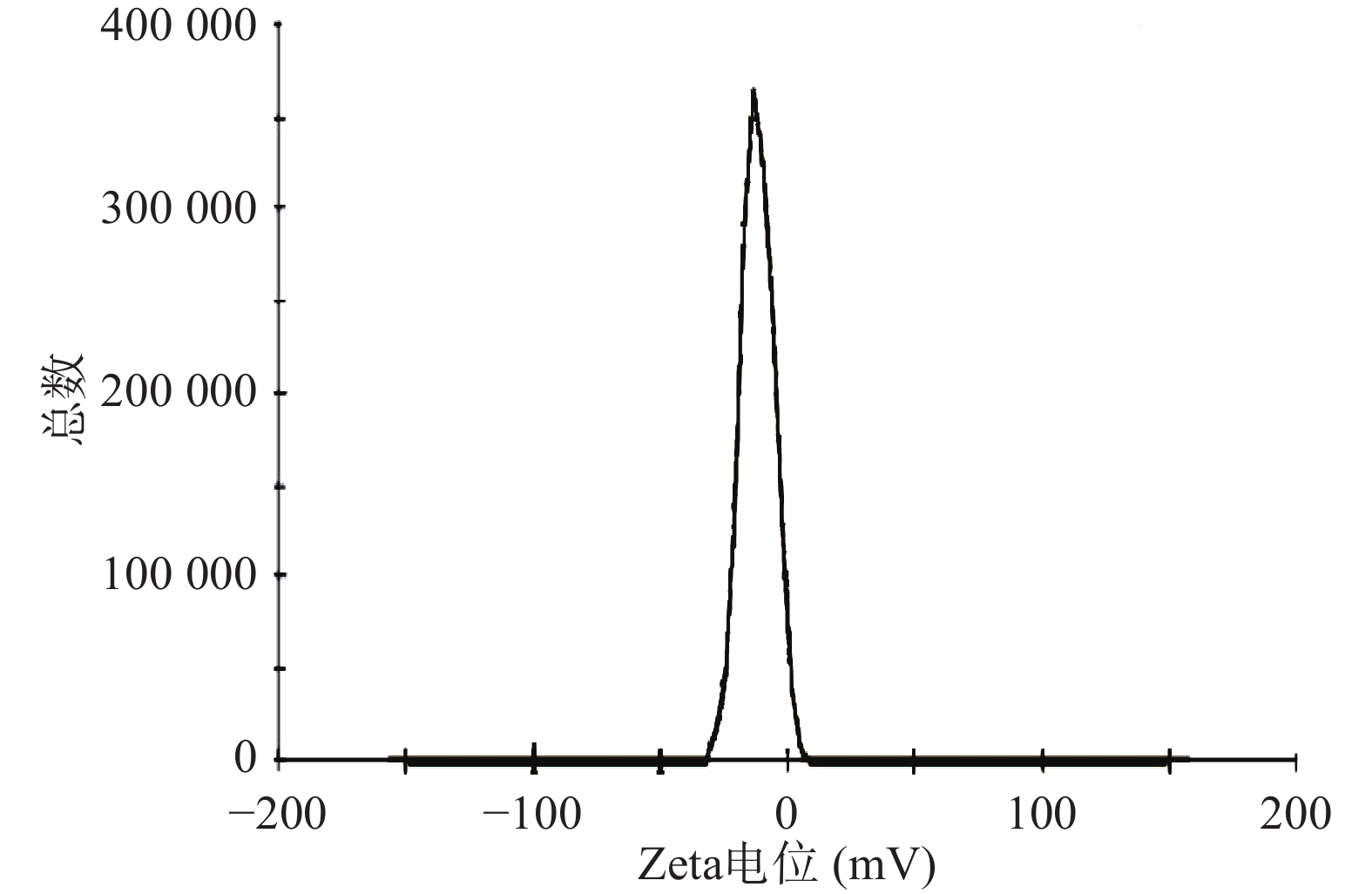
按照最优处方制备BBR-NE,稀释到适宜浓度,均匀分散后,采用马尔文激光粒度分析仪测定纳米乳的粒径大小。粒径结果如图4和图5所示。所制备的BBR-NE粒径分布范围窄且呈正态分布,平均粒径为(68.85±8)nm,PDI为(0.245±0.03),表明该制剂粒径分布及均匀性均符合纳米乳制剂要求。
2.3.3 BBR-NE的形态学考察
采用透射电镜(TEM)观察所制备的BBR-NE的形态。取适量BBR-NE滴于铜网上,自然干燥后滴加2 %磷钨酸(pH=7.4)溶液于铜网上负染3 min,晾干后置于透射电镜下观察其外观形貌。最优处方制备的纳米乳的透射电镜如图6所示。结果表明,BBR-NE呈均一圆整的球形,具明显层状结构,粒径大小约为68 nm。
2.3.4 BBR-NE体外释放度的测定[4]
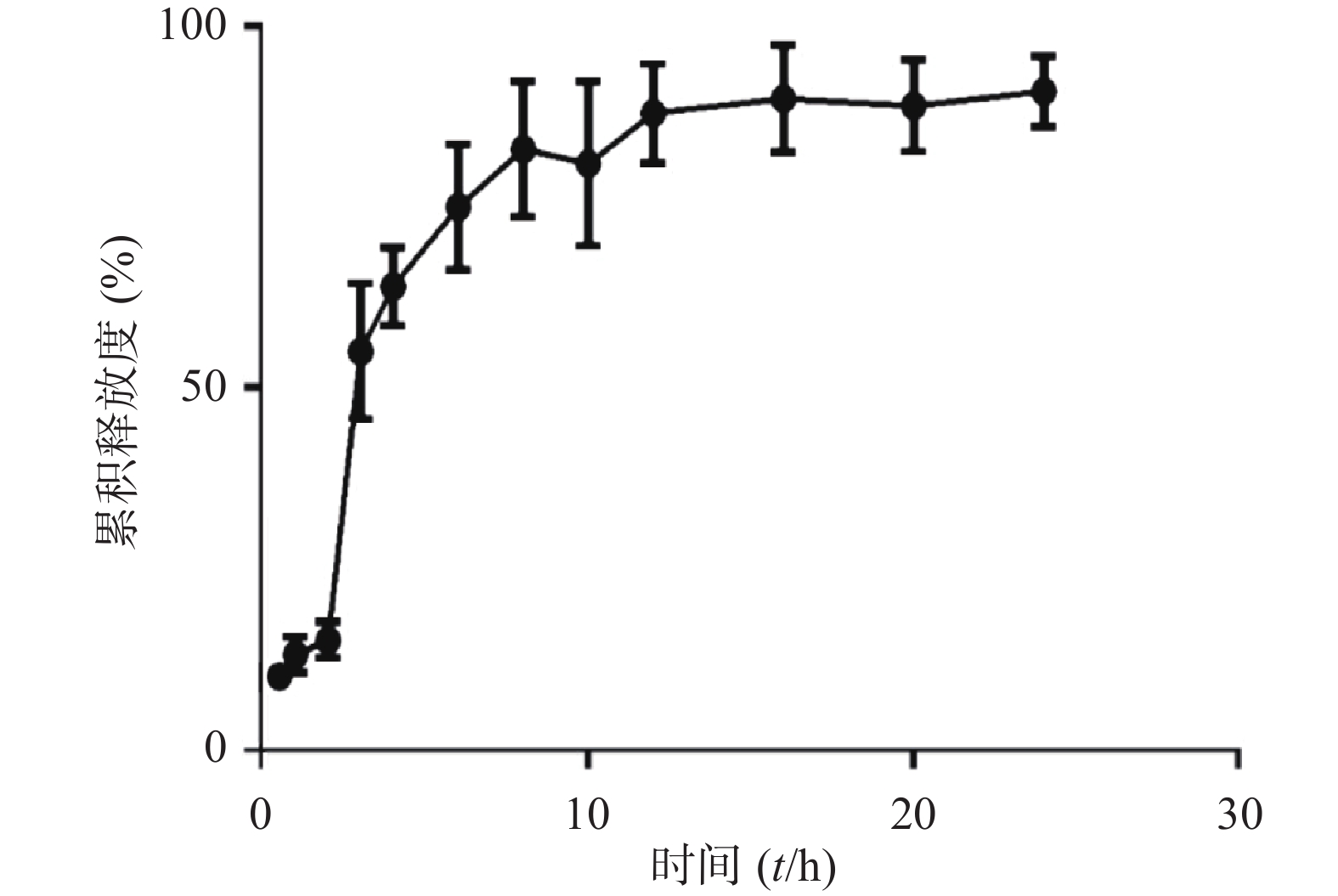
取制备好的盐酸小檗碱纳米乳2 ml,置于透析袋(分子截留值为7 000)中。于pH 1.2的人工胃液中释放2 h,再于pH 6.8的人工小肠液中释放22 h,溶出介质体积满足漏槽条件。将透析袋置于离心管中(含30 ml透析液),在恒温振荡器(37 ℃,100 r/min)中释放24 h,分别于0.5、1、2、3、4、6、8、10、12、16、20、24 h定时取样1 ml,随后立即补加等温等体积释放介质。收集的样品过0.45 μm滤膜后,按照“2.1.1”项下色谱条件进样测定,记录峰面积,计算累积释放度。释放曲线如图7所示,拟合方程如表6所示。
表 6 盐酸小檗碱纳米乳释药曲线的拟合方程释药模型 拟合方程 r 零级动力学方程 Q=29.352 t–4.123 0.816 4 一级动力学方程 ln(1–Q)=92.395 t+0.240 0.962 3 希古契(Higuchi)方程 Q=20.952 t 1/2–6.735 0.889 6 由释放曲线可以看出,BBR-NE在人工胃液中(0~2 h)累积释放度很低(<20%),进入人工小肠液后(2~24 h)释放度逐渐上升,累积释放度达到80 %以上,表明该制剂具有一定缓释效果,其释药行为符合一级动力学方程。
3. 讨论
纳米乳的处方筛选过程中,目前常采用绘制伪三元相图、正交试验设计法、星点设计-效应面法等方法。其中,伪三元相图法的精度不高,常用于初筛[13-14];正交试验设计法在因素水平较少时试验次数虽不多,但由于采用线性模型拟合,预测性较差[15];而星点设计-效应面法各因素对效应的影响拟合结果多数是非线性,可从效应面上选择最佳效应区域,适合于多因素、多水平的处方优化。
在应用伪三元相图筛选Km时,随着表面活性剂和助表面活性剂质量比的增加,形成纳米乳区域的面积逐渐增加,当Km为2∶1 时最大,而后稍有减小。这是由于加入吐温-80的比例增加,纳米乳的乳化作用增强。因此需要综合考虑选择最佳的Km值。
本研究在单因素筛选的基础上,利用星点设计-效应面法,以载药量及外观形态为考察指标,优化并确定了盐酸小檗碱纳米乳的最优处方:油相 Capryol 90占体系32.84 %,表面活性剂吐温−80占体系33.90 %,助表面活性剂1,2-丙二醇占体系16.95 %,水相占体系15.25 %,载药量为0.829 mg/g。 外观形态分析,表明所制备的BBR-NE 呈圆整均一的球体且具有明显的层状结构,平均粒径为 (68.85±8) nm,呈正态分布,多分散系数为(0.245±0.03),说明该制剂粒径大小符合纳米乳粒径要求且均匀性好[4]。由验证试验结果可知,该制备工艺稳定可行,有望为盐酸小檗碱临床应用提供一种新的给药剂型。
-
表 1 昆仙胶囊部分活性成分
成分代码 化合物名称 OB(%) DL MOL000006 木犀草素(luteolin) 36.16 0.25 MOL000098 槲皮素(quercetin) 46.43 0.28 MOL000211 迈林(mairin) 55.38 0.78 MOL000296 赫达拉汀(hederagenin) 36.91 0.75 MOL000354 异鼠李素(isorhamnetin) 49.6 0.31 MOL000358 β-谷固醇(beta-sitosterol) 36.91 0.75 MOL000359 谷甾醇(sitosterol) 36.91 0.75 MOL000422 山奈酚(kaempferol) 41.88 0.24 MOL000449 豆甾醇(stigmasterol) 43.83 0.76 MOL000622 甘露聚糖(magnograndiolide) 63.71 0.19 MOL000953 胆固醇(cholesterol) 37.87 0.68 MOL001323 谷固醇α1(sitosterol alpha1) 43.28 0.78 MOL001494 甘露醇 (mandenol) 42 0.19 MOL001495 亚油酸乙酯(ethyl linolenate) 46.1 0.2 MOL001510 24-表氨酯(24-epicampesterol) 37.58 0.71 MOL001558 芝麻素(sesamin) 56.55 0.83 MOL001645 乙酸亚油酯(linoleyl acetate) 42.1 0.2 MOL001771 poriferast-5-en-3beta-ol 36.91 0.75 MOL001792 甘草苷元(liquiritigenin) 32.76 0.18 MOL001979 羊毛甾醇(lanosterol) 42.12 0.75 -
[1] 徐强, 林昌松, 王笑丹, 等. 昆仙胶囊对胶原诱导型关节炎大鼠滑膜及血清白细胞介素-8的影响[J]. 广州中医药大学学报, 2012, 29(4):415-419,490. [2] 王笑丹, 徐强, 林昌松, 等. 昆仙胶囊对大鼠诱导性关节炎滑膜及血清γ IP-10的影响[J]. 辽宁中医药大学学报, 2012, 14(7):161-164. [3] 刘畅. 昆仙胶囊治疗类风湿关节炎的临床价值分析[J]. 临床医药文献电子杂志, 2020, 7(10):154,156. [4] 陆艳. 昆仙胶囊治疗类风湿关节炎患者的疗效分析[J]. 中国药物经济学, 2018, 13(8):78-80. doi: 10.12010/j.issn.1673-5846.2018.08.024 [5] 林昌松, 杨岫岩, 戴冽, 等. 昆仙胶囊治疗类风湿关节炎多中心临床研究[J]. 中国中西医结合杂志, 2011, 31(6):769-774. [6] 周俊, 肖微, 吴锐, 等. 昆仙胶囊治疗类风湿关节炎有效性与安全性系统评价[J]. 辽宁中医药大学学报, 2016, 18(10):122-126. [7] TAO W, XU X, WANG X, et al. Network pharmacology-based prediction of the active ingredients and potential targets of Chinese herbal Radix Curcumae formula for application to cardiovascular disease[J]. J Ethnopharmacol,2013,145(1):1-10. doi: 10.1016/j.jep.2012.09.051 [8] XU X, ZHANG W, HUANG C, et al. A novel chemometric method for the prediction of human oral bioavailability[J]. Int J Mol Sci,2012,13(6):6964-6982. doi: 10.3390/ijms13066964 [9] JAVADI F, AHMADZADEH A, EGHTESADI S, et al. The effect of quercetin on inflammatory factors and clinical symptoms in women with rheumatoid arthritis: a double-blind, randomized controlled trial[J]. J Am Coll Nutr,2017,36(1):9-15. doi: 10.1080/07315724.2016.1140093 [10] JI JJ, LIN Y, HUANG SS, ZHANG HL, et al. Quercetin: a potential natural drug for adjuvant treatment of rheumatoid arthritis[J]. Afr J Tradit Complement Altern Med,2013,10(3):418-421. [11] TAN W F, LIN L P, LI M H, et al. Quercetin, a dietary-derived flavonoid, possesses antiangiogenic potential[J]. Eur J Pharmacol,2003,459(2-3):255-262. doi: 10.1016/S0014-2999(02)02848-0 [12] PAN F, ZHU L H, LV H, et al. Quercetin promotes the apoptosis of fibroblast-like synoviocytes in rheumatoid arthritis by upregulating lncRNA MALAT1[J]. Int J Mol Med,2016,38(5):1507-1514. doi: 10.3892/ijmm.2016.2755 [13] ZHAO J, CHEN B, PENG X, et al. Quercetin suppresses migration and invasion by targeting miR-146a/GATA6 axis in fibroblast-like synoviocytes of rheumatoid arthritis[J]. Immunopharmacol Immunotoxicol,2020,42(3):221-227. doi: 10.1080/08923973.2020.1742732 [14] YANG Y, ZHANG X, XU M, et al. Quercetin attenuates collagen-induced arthritis by restoration of Th17/Treg balance and activation of Heme Oxygenase 1-mediated anti-inflammatory effect[J]. Int Immunopharmacol,2018,54:153-162. doi: 10.1016/j.intimp.2017.11.013 [15] 刘杨, 吕冰清, 吴玉梅, 等. 木犀草素抑制类风湿关节炎大鼠NLRP3炎性小体活化增强关节骨保护作用研究[J]. 中华中医药杂志, 2021, 36(1):513-516. [16] LEE CJ, MOON SJ, JEONG JH, et al. Kaempferol targeting on the fibroblast growth factor receptor 3-ribosomal S6 kinase 2 signaling axis prevents the development of rheumatoid arthritis[J]. Cell Death Dis,2018,9(3):401. doi: 10.1038/s41419-018-0433-0 [17] 任建敏. 食物中植物甾醇生理活性及药理作用研究进展[J]. 食品工业科技, 2015, 36(22):389-393,399. [18] KRIPA K G, CHAMUNDEESWARI D, THANKA J, et al. Modulation of inflammatory markers by the ethanolic extract of Leucas aspera in adjuvant arthritis[J]. J Ethnopharmacol,2011,134(3):1024-1027. doi: 10.1016/j.jep.2011.01.010 [19] 李清宋, 邓晓霞, 林色奇, 等. 雷公藤甲素治疗类风湿关节炎作用机制研究进展[J]. 江西中医药, 2015, 46(6):73-76. [20] TONG S, LIU J, ZHANG C. Platelet-rich plasma inhibits inflammatory factors and represses rheumatoid fibroblast-like synoviocytes in rheumatoid arthritis[J]. Clin Exp Med,2017,17(4):441-449. doi: 10.1007/s10238-017-0449-2 [21] HERNÁNDEZ-BELLO J, OREGÓN-ROMERO E, VÁZQUEZ-VILLAMAR M, et al. Aberrant expression of interleukin-10 in rheumatoid arthritis: Relationship with IL10 haplotypes and autoantibodies[J]. Cytokine,2017,95:88-96. doi: 10.1016/j.cyto.2017.02.022 [22] MALEMUD C. Defective T-cell apoptosis and T-regulatory cell dysfunction in rheumatoid arthritis[J]. Cells,2018,7(12):223. doi: 10.3390/cells7120223 [23] DOMINGUEZ S, MONTGOMERY A B, HAINES G K, et al. The caspase-8/RIPK3 signaling axis in antigen presenting cells controls the inflammatory arthritic response[J]. Arthritis Res Ther,2017,19(1):1-16. doi: 10.1186/s13075-016-1210-z [24] GANG X, XU H, SI L, et al. Treatment effect of CDKN1A on rheumatoid arthritis by mediating proliferation and invasion of fibroblast-like synoviocytes cells[J]. Clin Exp Immunol,2018,194(2):220-230. doi: 10.1111/cei.13161 [25] STRZĘPA A, SZCZEPANIK M. IL-17-expressing cells as a potential therapeutic target for treatment of immunological disorders[J]. Pharmacol Rep,2011,63(1):30-44. doi: 10.1016/S1734-1140(11)70396-6 [26] EL-WAKEEL N, HAZZAA H, GAWISH A S. Hypothesis: Rheumatoid arthritis and periodontitis: a new possible link via prolactin hormone[J]. Med Hypotheses,2021,146:110350. doi: 10.1016/j.mehy.2020.110350 -





 下载:
下载:


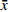

 下载:
下载: