-
牡蛎素有"海洋牛奶"的美誉,肉质新鲜丝滑,含有大量的蛋白质,为海洋双壳类暖水性软体动物,隶属于双瓣腮纲[1],是我国养殖四大贝类之一,是原中国卫生部批准的第一批既可作为食品又是药品的具有保健疗效的海产品。牡蛎中含有必需氨基酸的完全程度和质量比都高于牛奶和人乳[2],并且还含有牛磺酸、鸟氨酸以及许多生物价值极高的非必需氨基酸,是开发功能肽的优质原材料[3]。近年来的科学研究结果表明,牡蛎含有大量的氨基酸、B族维生素、多糖、功能肽以及Fe、Zn、Se等微量元素和矿物质[4]。牡蛎中蛋白质含量为39.1%~53.1%,是极好的蛋白质来源[5],同时牡蛎蛋白可通过酶解法裂解成大量具有较高生物活性的多肽[6,7]。由于牡蛎蛋白活性肽(又称牡蛎肽)是天然提取的小分子蛋白肽,有利于人体吸收并方便存储,同时具有稳定的多样化活性[8],引起了人们的广泛关注。许多研究表明牡蛎肽具有抑制肿瘤、抗氧化、降低血糖、减缓衰老和降低血管紧张素转换酶活性等生理作用[6,9]。本文重点阐述了牡蛎肽的多样化活性功能,为牡蛎及其产品的研发应用带来全新的技术支撑与开发思路。
-
老化、肿瘤和其他各种病变大多与过量自由基形成相关,有效的抗氧化作用能够解决自由基所造成的危害,有益身体健康。卢学敏[10]等发现牡蛎肽具有一定的还原能力,能够发挥清除超氧阴离子自由基的作用。欧成坤等[11]发现牡蛎肽具有对DPPH、OH、O23种自由基的清除作用。魏颖[12]的实验证明牡蛎多肽是由相对分子量小于1 000的八肽构成,这些短多肽可以控制细菌中ROS的形成。许旻[13]等人发现经过喷雾干燥后的不同剂量组牡蛎肽粉均可显著降低小鼠血清蛋白质羰基和丙二醛含量(P<0.01),而且可以明显提高动物血清中还原型谷胱甘肽和超氧化物歧化酶的浓度水平(P<0.01)。赵荣涛[14]等人利用化学方法评估蛋白酶解法所得牡蛎肽生物活性的研究发现,糜蛋白酶与风味蛋白酶所酵解的牡蛎肽,在抗氧化方面都有着突出的优势。戴梓茹[2]等人在牡蛎肽酸奶工艺的优化过程中发现牡蛎肽酸奶抗氧化能力显著增加,DPPH自由基清除率约为25%,对牡蛎肽酸奶的还原力为0.257,说明牡蛎肽可以有效增强酸奶的抗氧化功能;而彭志兰[15]等人在UVB辐射诱导的HacaT光衰老细菌模式上也发现牡蛎肽有着更高的抗光老化活力,或许与牡蛎肽有着更良好的抗氧化能力相关。
-
牡蛎肉及其提取物均具有抗疲劳保健功能[16,17]。小鼠经过牡蛎肉和牡蛎水解物饲养后,与对照组相比,力竭游泳时间明显延长,且牡蛎水解物的提高肌肉耐力作用显著优于牡蛎肉[18]。规律的有氧运动训练能有效地提高小鼠的运动耐力,陶雅浩[19]等人研究发现,运动训练联合补充牡蛎肽能够有效的促进运动训练和提高耐力。其机制可能是由于牡蛎肽可促进力竭运动时骨骼肌蛋白质的分解供能,间接减少了肝糖原和肌糖原的分解,从而相对升高了能量储备。另外,许多研究对于牡蛎肽抗疲劳的机制进行了进一步的探索。叶建仔[20]等在运动模型上证明了牡蛎提取物可以促进大鼠肝糖原、肌糖原等能源物质的积累,保证了其运动期间的葡萄糖来源补给,进而延缓了运动性疲劳的产生。王建永[21]团队证实了牡蛎多肽对线粒体具有一定的保护作用。这种多肽能降低线粒体膜渗透性,提高了大鼠骨骼肌内的氧化应激;另外,还能提高线粒体生物发生(上调线粒体PGC-1α、TFAM的表达),同时还通过对线粒体呼吸链复合体活性的调控提高ATP的生物生成,对活动性疲劳也起到了一定的积极影响。最新研究发现,以牡蛎肽为主要原料的保健酒能够增加负重小鼠的游泳时间(P<0.05),降低其运动后的血清尿素氮含量(P<0.05),这种保健作用可能与牡蛎肽增加小鼠肝糖原储备有关(P<0.05)[22]。另外,作为人体抗疲劳和耐力指标的乳酸和尿素水平受到牡蛎肽的调节[23]。
-
早在1998年,Lee[24]等酶解太平洋牡蛎产生2个具HIV-1蛋白酶控制活力的六肽,打开了牡蛎肽关于免疫调节作用的探索大门。李超柱[25]等成功分离提取具有活性的牡蛎肽,并在细胞实验中发现经牡蛎活性肽作用后的小鼠脾脏淋巴细胞上清液中细胞因子IL-2、IFN-γ分泌减少。陈晓文[26]及其团队研究表明,牡蛎肽能够增加血清溶血素浓度和免疫器官的相对重量,并能够有效提高抗体产生和控制迟发型变态反应(P<0.05)。许丹[27]等研究表明牡蛎肽可改善CTX所诱发的免疫力降低小鼠细胞因子水平紊乱、T淋巴细胞比例失调和骨髓多核细胞数,通过靶向免疫器官功能从而增强机体免疫力。方磊[28]团队的一项研究证实了牡蛎肽的低致敏特征以及抗过敏作用。在具体的机制探索上,有研究发现来自太平洋牡蛎的β-胸腺素肽通过下调NF-κB对lps诱导的RAW264.7巨噬细胞NO和PGE2的产生发挥抗炎活性[29]。
-
牡蛎对生殖功能的作用由来已久,但其具体的机制尚不清楚。可能由于牡蛎可促进有性生殖关键调控蛋白和雄激素的表达,因此提高血清雄激素水平,改善男性性行为[30]。李大炜[31]等研究表明牡蛎肽能明显改善D-半乳糖诱导的衰老大鼠生殖功能减退,有抗生殖细胞氧化、促生精和抑凋亡的功效,对睾丸组织及精子质量具有一定的保护作用。方磊[32]等人发现紫苏籽肽配合牡蛎肽能够促进TM3细胞雄性激素的生成,对男性性功能具有一定的改善效果;进一步的机制研究表明,牡蛎肽能通过改善NO-cGMP通路发挥改善性功能的作用[33]。刘瑜[34]等在老鼠试验中证明,牡蛎低聚肽可以通过改变HPG轴,有效阻止CTX导致的男子雄激素部分减少综合征的产生,进而起到提高性功能和繁殖能力的效果,从而发挥改善性功能和生殖功能的作用。张亭[35]团队研究表明,牡蛎肽可以提高骑跨频次和配对频次并减少老鼠骑跨潜伏期,可能与其增加雄性老鼠血清NO和睾酮含量,降低小鼠海绵体PDE5的含量有关。张雪妍[36]等发现牡蛎酶解物能够有效提高小鼠睾丸间质细胞的增殖活性,促进小鼠睾丸间质细胞睾酮的分泌。陈悦[37]等实验证明了小分子牡蛎多肽可以提高性腺器官重量、生殖脏器系数和精子质量,可能通过提高动物血清的胆固醇和性激素水平以及阴茎内NO的浓度,促进雄性小鼠的性能力。
-
牡蛎肽具有抑制多种肿瘤生长的作用。研究发现牡蛎肽可抑制卵巢SKOV3癌细胞的增殖[38]。李鹏[39]团队研究发现牡蛎肽能有效抑制BGC-823人胃腺癌细胞增殖和生长。进一步研究也证实,牡蛎肽通过影响bcl-2、c-myc等癌基因以及p16、p53、p21WAF1/CIP1等抑癌基因的表达平衡,可以有效诱导胃癌细胞的凋亡[40]。此外,李祺福[41]等也发现了低分子牡蛎肽能调控c-myc、Tp53等癌基因和p21WAF1/CIP1、Rb等抑癌基因,使细胞阻滞于G0/G1期,可以有效抑制A549肺腺癌细胞的增殖。Umayaparvathi[42]等人通过检测牡蛎肽对人结肠癌HT-29细胞系的毒性和凋亡状态的影响,证明了牡蛎多肽对人结肠癌HT-29细胞系有调节作用。石梦莹[43]团队证实了牡蛎肽对人类结肠癌细胞增殖的作用,他们发现牡蛎肽通过抑制VDR和e-Cadherin的转录表达,剂量依赖性地抑制SW480结肠癌细胞的体外增殖、侵袭和转化。
-
雷丹青[44]等采用牛胰蛋白酶酶解法制备所得的牡蛎肽能够明显降低糖尿病小鼠的血糖。王世华[45]等人已证明,牡蛎肽显著减小了由四氧嘧啶所引起的动物血糖水平上升的程度(P<0.01),但对正常动物血糖的改变无作用。许旻[46]的动物实验中还证实,牡蛎肽既可以减少高血糖动物的空腹血糖水平和血糖曲线的曲线下面积(AUC),也可以改变高血糖动物体重降低和多食多餐的情况。徐静[47]等还发现,牡蛎肽可以控制四氧嘧啶所诱发的血糖上升,以及减轻小鼠胰腺的损伤。
-
牡蛎蛋白质可以降低血压[48]。从牡蛎的蛋白水解物中纯化的一个肽序列(VVYPWTQRF)被观察到具有降压活性[49] 。同样,牡蛎中提取的ACE抑制肽也具有显著的降压作用。含有低分子量牡蛎肽的牡蛎提取物对自发性高血压大鼠也有抑制ACE和降低收缩压的作用[50]。从珍珠牡蛎肉中分离到的两种新肽(HLHT和GWA)具有较高的ACE抑制活性,而蛋白质水解物对SRH大鼠具有较强的降压作用[51]。另一项有趣的研究表明,牡蛎热处理后产生更多的具有ACE抑制作用的牡蛎肽[52] 。除此以外,牡蛎肽的生产工艺也有很大的进步,促进了具有ACE抑制活性牡蛎肽的制备。邱娟[53]等人运用正交试验和响应面法优化牡蛎ACE抑制肽的分步酶解工艺,成功制备得到高ACE抑制活性牡蛎肽。Shiozaki[54]等人从牡蛎肌肉中分离鉴定出了一种对ACE具有较强抑制作用的功能肽。张可佳[55]等人以太平洋牡蛎为原料,生产出的相对分子量在3 000以下的牡蛎肽,可以通过对ACE水平的控制,对自发性高血压患者产生一定的降压效果。陶雅浩[56]等人认为,有氧锻炼和补充牡蛎肽可以减少自发性高血压患者血清中AngⅡ、ET-1和VEGF浓度,在维持毛细血管内皮功能的同时降低血压。因此,牡蛎肽可以被纳入治疗高血压的功能食品。
-
王长伟[57]等人在研究牡蛎蛋白肽的制备工艺中发现牡蛎肽具有改善大鼠生长发育的功能。刘艳[58]等人在开发补锌产品的实验研究中发现牡蛎肽对螯合锌的稳定性较高,并在一定程度上促进了HL-7702人肝细胞的生长,可能对肝细胞的再生有一定的促进作用。王毅炜[59]等人发现低浓度牡蛎肽,尤其是20 mg/L的牡蛎肽对骨髓间充质干细胞成骨分化及细胞生长有促进作用。以上研究表明,牡蛎肽可能对生长发育有一定的作用,但需要进一步的研究探索。
-
卢学敏[10]等人的实验表明,牡蛎肽产生了良好的抑菌作用,可以控制枯草芽孢杆菌、哈维氏弧菌等副溶血弧菌的生长繁殖。刘赛[60]等人在对高脂食饵性鹌鹑动脉粥样硬化模型的研究中,表明了牡蛎肽能够调整血脂、控制动脉粥样硬化,其机理或许与牡蛎肽对脂质过氧化损害的控制有关。同时,牡蛎肽具有促进锌吸收作用。黄海[61]等人发现牡蛎肽-锌纳米粒对缺锌大鼠的补锌效果明显优于硫酸锌。王再扬[62]等通过类蛋白反应修饰,得到具备较强锌离子结合作用的牡蛎肽,可以促进机体对锌的吸收。另外,多项研究表明牡蛎肽能够提高小鼠的学习和记忆能力[63-65]。
-
随着现代海洋生物技术的迅速进展,牡蛎中各种成分的提取越来越完全。虽然牡蛎肽具有很高的营养价值和医用价值,但对牡蛎肽的结构和功能研究仍然十分有限;同时,大多数牡蛎肽的实验是体外研究,相关体内机制探索报道较少,不能为牡蛎肽的临床研究提供充分的参考数据。因此,我们认为加强牡蛎肽的体内研究将有利于临床试验和药物开发。除此之外,中国对牡蛎类活性多肽的研发起步较晚,与发达国家之间存在很大差异,目前牡蛎肽的市场突破还较少,亟待进一步提高与发展。在新时代大力发展中医药的洪流中,相信牡蛎肽的研发在中国也能实现新的重大突破。
Research advances in bioactivity of oyster peptides
-
摘要: 功能肽是指具有特异性生理活性或对生命活动有保护作用的复合肽类物质,又称生物活性肽。牡蛎中含有大量蛋白质,可以作为生物活性肽开发的优质材料,具有巨大的功能性食品潜力,在制药和医疗行业具有很大的应用价值。伴随着现代生物医药科技的革新,牡蛎肽萃取方法学的创新发展,牡蛎肽的生物活性和吸收率不断提高,使得对牡蛎肽生物学功能的认识不断深入,同时为其广泛应用提供了更加广阔的前景。概述牡蛎肽多样化活性的相关研究,为牡蛎肽的进一步发展应用提供新的线索和方向。Abstract: Functional peptides refer to peptides that are beneficial to life activities or have special physiological activities, also known as bioactive peptides. Oyster is rich in protein and is a good material for developing bioactive peptides, which has great potential as a functional food and great application value in pharmaceutical and medical industry. With the development of modern biotechnology and medical technology, the method innovation of oyster peptide preparation, the absorptivity and biological activity of oyster peptide have been enhanced significantly, which lead to deep recognition of the biological function of oyster peptide and offer the boarder application prospect. The researches on the diversification activities of oyster peptides were summarized in this review, which provided clues and ideas for the development of the oyster peptide applications.
-
Key words:
- Oyster peptide /
- Biological function /
- Antioxidation /
- Fatigue resistance /
- reproduction /
- Immune regulation
-
在全球范围内,缺血性脑卒中(IS)仍然是导致死亡和严重残疾的最主要原因之一[1]。在IS的治疗过程中,除因出血风险而存在禁忌外,几乎所有IS的患者都应给予抗血小板药物进行二次卒中预防[2], 阿司匹林联合氯吡格雷的双重抗血小板治疗在IS发病早期发挥着重要作用[3]。然而临床应用中,脑血管病患者在服用氯吡格雷药物治疗期间存在个体差异,一些患者在服药后出现了病情反复发作或者病情加重的现象,称为氯吡格雷抵抗(CR)[4]。研究表明,导致氯吡格雷抵抗的因素是多种多样的,尚无统一的结论。包括性别[5-6]、年龄[6]、BMI[6-7]、糖尿病[5,8]、高脂血症[8]、高同型半胱氨酸[5,8]、药物间相互作用[8](钙离子拮抗剂、质子泵抑制剂)、遗传基因多态性[9-10](参与氧化代谢的相关基因CYP2C19、与其活化有关基因ABCB1)等均会导致该药物出现抵抗现象。但亦有部分研究报道得出相反结论[11]。且研究主要集中于心血管领域,尤其是经皮冠状动脉介入(PCI)术后患者,而针对IS患者发生CR影响因素的报道相对较少。氯吡格雷属于噻吩吡啶类化学衍生物,需要在多种酶的参与下才能够生成有活性的化合物,该活性代谢产物与血小板上的二磷酸腺苷(ADP)受体P2Y12共价特异性地结合,减少ADP所刺激的血小板凝聚,阻断ADP诱导的糖蛋白与纤维蛋白原PIIb/IIIa 受体的结合,发挥抗栓的效应[12-13]。故本研究利用血栓弹力图(TEG)测定ADP数值,对脑卒中患者的基线资料及CYP2C19基因多态性进行统计分析,评估产生CR现象的影响因素,为IS临床个体化用药、预测卒中复发风险提供精准医疗方案。
1. 材料和方法
1.1 研究对象
本研究利用HIS系统选取2021年4月至2022年7月在中部战区总医院神经内科住院治疗的IS患者。(1)纳入标准:①符合《中国脑急性缺血性脑卒中诊治指南》[14]或IS的相关诊断,且经CT或MRI影像学等证实;②年龄均>18岁;③未进行静脉溶栓或取栓治疗;④均采用氯吡格雷联合阿司匹林进行抗血小板治疗。(2)排除标准:①存在出血性疾病或颅内感染者;②合并恶性肿瘤或严重心、肝、肺、肾脏器官功能衰竭者;③有认知障碍者;④依从性差者;⑤对本研究药物过敏者。该研究已获得中部战区总医院医学伦理委员会审查批准,审查号:[2021]025-01。
1.2 治疗方法
所有入组患者入院后均给予改善循环(银杏达莫)、稳定血斑块(阿托伐他汀)、护胃(泮托拉唑)等常规治疗。在常规治疗基础上给予阿司匹林(拜耳医药保健有限公司,国药准字:J20171021,规格:100 mg/片)100 mg每日一次和硫酸氢氯吡格雷[赛诺菲(杭州)制药有限公司,国药准字:H20056410,规格:75 mg/片]75 mg 每日一次,均为3个月一个疗程。同时根据基础疾病给予降血压、降血糖及调血脂治疗。
1.3 资料收集
收集所有入组患者的基线资料,包括姓名、性别、年龄、既往有无高血压病、糖尿病、冠心病、高脂血症、吸烟史(戒烟小于5年)、饮酒史(戒酒小于5年)、既往有无缺血性脑卒中病史及患者住院期间合并用药等。记录患者在住院后次日清晨空腹采集的静脉血各项检验指标,包括血常规、肝肾功能、凝血功能等。
1.4 TEG及相关参数测定
患者在服用阿司匹林联合氯吡格雷药物7~14 d,空腹采集静脉血,分别注射入柠檬酸钠抗凝管1和肝素抗凝管2中。利用TEG-5000型TEG凝血分析仪(美国Haemoscope公司)检测柠檬酸-高岭土样品,得出ADP抑制率。将血小板聚集抑制率>30%定义为氯吡格雷非抵抗,血小板聚集抑制率≤30%定义为氯吡格雷抵抗[15]。
1.5 CYP2C19 基因检测
患者入院后次日清晨空腹抽取静脉血4 ml于EDTA抗凝管中,利用全自动杂交仪系统(BR-526-24,上海百傲科技公司)对CYP2C19*1、CYP2C19*2及CYP2C19*3位点进行检测。该检测过程主要包括全血DNA的提取、PCR扩增、芯片杂交显色,利用基因芯片识读仪自动读取结果。根据CYP2C19基因多态性进行药物代谢分组[16],即:快代谢组:EM,CYP2C19*1*1,中代谢组:IM,CYP2C19*1*2、CYP2C19*1*3,慢代谢组:PM,CYP2C19*2*2、CYP2C19*2*3、CYP2C19*3*3。
1.6 统计学方法
采用SPSS 26.0统计软件进行数据分析,计量资料服从正态分布,采用(
$\bar x $ ±s)表示,组间比较采用独立样本t检验。若计量资料属于非正态分布,则以中位数和四分位数[M(P25,P75)]表示,组间比较采用Mann-Whitney U检验。计数资料以例数和百分比[例(%)]表示,组间比较采用χ2检验,将IS患者发生氯吡格雷抵抗的影响因素进一步进行多因素Logisti回归分析,以P<0.05为差异有统计学意义。2. 结果
2.1 基线资料分析
本研究共纳入缺血性脑卒中患者202例,年龄35~86岁,其中,CR组87例,NCR组115例,CR组患者合并糖尿病的比例明显高于NCR组,差异有统计学意义(P<0.05)。在性别、年龄、吸烟、饮酒、既往有无缺血性脑卒中、高血压病、冠心病、高脂血症及合并用药方面,两组间差异均无统计学意义(P>0.05),见表1。
表 1 抵抗组和非抵抗组患者基线资料比较基本信息参数 CR组(n=87,%) NCR组(n=112,%) x2/t P 年龄 64.52±1.07 62.39±0.97 −1.47 0.14 性别(男) 65(74.7) 86(74.8) 0.00 0.99 吸烟史 43(49.4) 56(48.7) 0.11 0.92 饮酒史 37(42.5) 41(35.7) 0.99 0.32 IS既往史 16(18.4) 22(19.1) 0.02 0.89 高血压 83(95.4) 106(92.2) 0.41 0.53 糖尿病 35(40.2) 22(19.6) 10.15 0.03 冠心病 7(8.0) 10(8.7) 0.03 0.87 高脂血症 40(46.0) 56(48.7) 0.15 0.70 合并用药 质子泵抑制剂 61(70.1) 84(73.0) 0.21 0.67 丁苯酞注射液 67(77.0) 83(72.2) 0.61 0.44 2.2 实验室检验指标分析
氯吡格雷抵抗组血常规的白细胞计数水平高于非抵抗组,且组间差异有统计学意义(P<0.05)。两组患者红细胞、血红蛋白、血小板计数、凝血酶原时间、D-二聚体、血糖、总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白、超敏C反应蛋白、血同型半胱氨酸、直接胆红素、总胆红素、谷草转氨酶、谷丙转氨酶的组间差异均无统计学意义(P>0.05),见表2。
表 2 两组患者实验室检测指标比较检测项目 抵抗组(n=87) 非抵抗组(n=115) 检验值 P 白细胞 6.70(5.60,8.40) 6.40(5.30,7.30) 2.14b 0.03 红细胞 4.56±0.34 4.44±0.05 −0.40a 0.69 血红蛋白 131(119,139) 134(120,143) −1.15b 0.11 血小板 187(148,227) 206(138,232) −1.62b 0.08 凝血酶原时间 11.21±0.65 11.18±0.85 −0.32a 0.92 D-二聚体 0.30±0.07 0.29±0.09 −0.78a 0.44 血糖 6.03±0.22 6.45±0.21 1.33a 0.18 总胆固醇 4.37(3.72,5.04) 4.32(3.73,5.05) −0.19b 0.85 甘油三酯 1.81±0.13 1.75±0.11 −0.36a 0.72 高密度脂蛋白 1.19(0.99,1.35) 1.14(1.00,1.32) −1.07b 0.29 低密度脂蛋白 2.41(1.94,2.80) 2.27(1.87,2.75) −0.50b 0.62 超敏C反应蛋白 1.91(1.04,5.40) 1.76(0.84,3.50) 1.65b 0.09 血同型半胱氨酸 17.32±1.18 15.81±0.61 −1.22a 0.23 直接胆红素 3.32±1.25 3.79±0.33 1.47a 0.14 总胆红素 13.33±0.47 13.71±0.42 0.60a 0.54 谷草转氨酶 23.00(19.00,28.00) 22.00(18.00,27.00) −0.89b 0.37 谷丙转氨酶 22.00(17.00,31.00) 21.00(15.00,28.79) −1.42b 0.15 注: a为 χ2 值,b为z值。 2.3 CYP2C19基因多态性分布
入选的202名患者中,CYP2C19 *1、CYP2C19 *2及CYP2C19*3等位基因的频率分别为62.26%、33.17%及4.21%,所有基因位点均符合Hardy-Weinberg平衡定律,差异无统计学意义(P>0.05),表明该群体具有代表性,详见表3。
表 3 202例IS患者 CYP2C19 基因型及等位基因的频率分布CYP2C19等位基因 等位基因数/个 基因频率/% CYP2C19 *1 253 62.62 CYP2C19 *2 134 33.17 CYP2C19 *3 17 4.21 2.4 不同CYP2C19代谢类型患者发生氯吡格雷抵抗的比较
CYP2C19 IM组患者发生氯吡格雷抵抗的比例显著高于EM组和PM组,差异具有统计学意义(P>0.05),见表4。
表 4 不同CYP2C19代谢类型的CR发生率比较(n,%)CYP2C19
代谢类型氯吡格雷
抵抗[n(%)]非氯吡格雷
抵抗[n(%)]χ2 p EM 24(27.59) 56(48.70) 9.95 0.007 IM 50(57.47) 43(37.39) PM 13(14.94) 16(13.91) 2.5 CYP2C19不同基因型血小板抑制率的比较
3组IS患者中ADP抑制率均不符合正态分布,因此采用非参数检验。EM组ADP抑制率的中位数为39.6%,IM组为26.10%,PM组为31.95%。3组血小板抑制率中位数差异具有统计学意义(P<0.05);两两比较,IM组的血小板抑制率明显低于EM组,差异具有统计学意义(P<0.05);其他组间差异无统计学意义(P>0.05),详见表5。
表 5 不同基因型血小板抑制率的比较CYP2C19基因分组 基因型数/个 血小板抑制率/% EM 39.60(26.20,53.95) CYP2C19*1*1 80 IM 26.10(15.20,53.60)* CYP2C19*1*2 81 CYP2C19*1*3 12 PM 31.95(20.65,65.40) CYP2C19*2*2 24 CYP2C19*2*3 5 χ2 6.31 P 0.04 注:3组间比较采用 Kruskal-Wallis H检验;两两比较采用 Mann- Whitney U检验;* P<0.05,与EM组比较。 2.6 发生氯吡格雷抵抗的危险因素分析
以发生CR作为因变量,将上述研究中存在统计学差异(P<0.05)的项目作为自变量进行赋值,包括合并糖尿病(未合并糖尿病者赋值0,合并糖尿病者赋值1)、CYP2C19代谢类型(IM赋值1,其余赋值0),白细胞计数为连续型数值变量,纳入二元Logistic回归模型中进行分析。结果显示,合并糖尿病、高白细胞计数水平、CYP2C19中代谢型为发生氯吡格雷抵抗的独立危险因素,见表6。
表 6 发生氯吡格雷抵抗危险因素的Logistic回归分析结果因素 B SE Wald P OR 95%CI 合并糖尿病 0.595 0.227 4.496 0.026 0.851 (0.707,1.191) 白细胞计数 0.211 0.076 7.774 0.005 1.235 (1.065,1.432) CYP2C19
中代谢型0.901 0.291 9.565 0.002 0.368 (0.197,0.686) 3. 讨论
氯吡格雷是继阿司匹林后在心脑血管中被广泛使用的抗血小板药物。有报道表明氯吡格雷联合阿司匹林在治疗缺血性脑卒中疗效优于单独使用阿司匹林,且不会增加脑卒中患者发生出血的风险[3,17]。在临床应用中仍有一些患者在服用氯吡格雷后,不能够抑制ADP诱导的血小板凝聚,也称为氯吡格雷抵抗或者氯吡格雷低反应性[4]。目前国际上关于氯吡格雷抵抗的诊断并无确切的标准[18],有文献称化学比浊法属于比较经典的血小板功能检测方法,但是由于在操作过程中步骤比较繁多且尚无统一的标准化流程,现已逐渐被其它检测方法所取代[19]。有国外研究报道将床旁快速血小板分析(Verify Now)检测系统的检测结果定义为“金标准”,但是由于该检测方法成本较高,因此在国内临床中并没有被大规模应用。而现在国内较常使用的抗血小板效果的监测方法有TEG、血小板分析仪、PL-11等,TEG检测血小板功能操作便捷、迅速、受外界影响较小等优点,现已在临床中被广泛使用[20]。
氯吡格雷本身属于无活性的前体药物,需在多种酶的参与下生成有活性的化合物,才能发挥抑制血小板聚集作用。细胞色素P450酶参与了两步氧化代谢过程。国外有研究报道[21]CYP2C19*2、CYP2C19*3等位基因的突变主要以亚洲人为主,发生在非洲和欧洲的突变率较低,携带CYP2C19*2、CYP2C19*3基因的突变可降低细胞色素P450酶的活性,使得活性代谢物的水平减少,从而导致该药物的临床疗效不佳,所以IM和PM组氯吡格雷抗血小板活性会受到CYP2C19基因多态性的影响。本研究结果显示,CYP2C19 IM组患者发生氯吡格雷抵抗的比例显著高于EM组和PM组,血小板抑制率明显低于EM组,差异均具有统计学意义,而PM组血小板抑制率虽然低于EM组,但差异无统计学意义,可能是PM组(14.36%)人群占比显著低于IM组(46.04%)和EM组(39.60%)造成的。
目前已有研究表明糖尿病患者在服用氯吡格雷后血小板抑制率较差[22-23],但其机制尚不明确。在小鼠模型中的研究结果表明,高血糖可以通过下调CYP酶影响氯吡格雷药物活化,从而导致抗血小板浓度降低[24]。Angiolillo等[25]针对冠心病合并2型糖尿病患者诱导的血小板抑制率减弱的研究中,解释其原因可能是长期的高血糖水平使血小板信号通路上调降低了抗血小板药物的药效,从而导致药物抵抗的发生。此外,糖尿病会影响肝脏代谢与胃肠道吸收,这可能会影响药物的吸收和代谢[26]。本研究结果也显示,合并糖尿病是发生氯吡格雷抵抗的独立风险因素。
本研究结果还表明高白细胞计数可能是IS患者发生CR的独立危险因素(OR=1.235,95% CI:1.065,1.432),但目前在IS患者中有关白细胞计数与CR之间关系的研究较少。有研究发现炎症标志物升高增加心血管事件的风险,血小板聚集和炎性因子之间的相互作用在急性冠脉综合征中起着非常重要的作用,而炎症调节越来越被认为是当代的治疗靶点,接受氯吡格雷联合阿司匹林双重抗血小板治疗的急性冠状动脉综合征的患者中,白细胞计数与临床疗效密切相关[27]。也有研究者在冠心病患者中发现白细胞中的3个长链非编码RNA与CR的发生有关[28]。IS随着细胞死亡和脑组织受损,分子危险信号通过激活更多的小胶质细胞和浸润白细胞进行前馈反应,释放更多的具有促炎作用的细胞因子。炎症加剧了脑细胞受损程度,使外周血中释放更多的细胞因子,这些细胞因子参与了脑卒中的进展,影响其预后[29-30]。因此,在临床中,高白细胞计数患者服用氯吡格雷时应警惕CR的发生。
本研究的局限性主要包括以下几点:①样本量相对较少;②TEG检测过程中受血凝速度、红细胞聚集状态等因素影响;③患者服药7~14 d只检测1次ADP抑制率,不能反应整体水平;④未直接检测血浆氯吡格雷及其活性代谢物水平。上述因素可能对研究结果产生偏倚,今后还需要进一步的验证。
-
[1] 方玲, 马海霞, 李来好, 等. 华南地区近江牡蛎营养成分分析及评价[J]. 食品工业科技, 2018, 39(2):301-307,313. doi: 10.13386/j.issn1002-0306.2018.02.056 [2] 戴梓茹, 吴远清, 张晨晓, 等. 牡蛎肽酸奶工艺及体外抗氧化活性研究[J]. 中国乳品工业, 2020, 48(5):25-30,54. [3] 方磊, 李国明, 徐姗姗, 等. 牡蛎生物活性肽的研究进展[J]. 食品安全质量检测学报, 2018, 9(7):1548-1553. doi: 10.3969/j.issn.2095-0381.2018.07.015 [4] 赵思远, 吴楠, 孙佳明, 等. 近10年牡蛎化学成分及药理研究[J]. 吉林中医药, 2014, 34(8):821-824. [5] LAMGHARI M, ALMEIDA M J, BERLAND S, et al. Stimulation of bone marrow cells and bone formation by nacre: in vivo and in vitro studies[J]. Bone,1999,25(2):91S-94S. doi: 10.1016/S8756-3282(99)00141-6 [6] GUO Z, ZHAO F, CHEN H, et al. Heat treatments of peptides from oyster (Crassostrea gigas) and the impact on their digestibility and angiotensin I converting enzyme inhibitory activity[J]. Food Sci Biotechnol,2020,29(7):961-967. doi: 10.1007/s10068-020-00736-4 [7] 冯晓梅, 韩玉谦, 赵志强, 等. 牡蛎活性肽的制备及其理化性质的初步研究[J]. 中国海洋药物, 2006, 25(2):22-25. doi: 10.3969/j.issn.1002-3461.2006.02.005 [8] XIE C L, KANG S S, LU C, et al. Quantification of multifunctional dipeptide YA from oyster hydrolysate for quality control and efficacy evaluation[J]. Biomed Res Int,2018,2018:8437379. [9] 郝更新, 曹文红, 郝记明, 等. 超滤法浓缩富集牡蛎蛋白抗氧化活性肽[J]. 食品工业科技, 2013, 34(11):77-80. [10] 卢学敏, 王颀林, 蓝晓燕, 等. 牡蛎活性多肽的抑菌作用与抗氧化性能研究[J]. 中国酿造, 2013, 32(2):77-80. doi: 10.3969/j.issn.0254-5071.2013.02.020 [11] 欧成坤, 杨瑞金. 牡蛎酶解产物的ACE抑制活性和清除自由基活性研究[J]. 食品工业科技, 2005, 26(3):59-62. doi: 10.3969/j.issn.1002-0306.2005.03.022 [12] 魏颖, 陈亮, 孙玉坤, 等. 牡蛎肽抗氧化和对T淋巴细胞增殖作用的影响[J]. 食品科技, 2016, 41(1):209-212. [13] 许旻, 朱良松, 熊何健, 等. 喷雾干燥法制备牡蛎肽粉的体内抗氧化活性研究[J]. 食品工业科技, 2016, 37(5):361-364. doi: 10.13386/j.issn1002-0306.2016.05.065 [14] 赵荣涛, 王宁丽, 魏鉴腾, 等. 牡蛎蛋白酶解多肽降糖及抗氧化活性评价[J]. 食品工业科技, 2018, 39(3):28-31. doi: 10.13386/j.issn1002-0306.2018.03.006 [15] 彭志兰, 冯畅, 陈贝贝, 等. 牡蛎蛋白酶解产物及其超滤组分抗皮肤光老化活性研究[J]. 食品与发酵工业, 2021, 47(13):66-71. [16] 陈垚, 吕志敏, 殷方美, 等. 枸杞子、淫羊藿的提取物与海参、牡蛎肉的冻干粉合用缓解体力疲劳作用研究[J]. 预防医学论坛, 2018, 24(4):316-319. [17] 欧慧瑜, 李瑞鹏, 郭秋平. 牡蛎复合提取物缓解体力疲劳的作用研究[J]. 食品安全质量检测学报, 2017, 8(9):3385-3389. doi: 10.3969/j.issn.2095-0381.2017.09.019 [18] 吉宏武, 苗建银, 邵海艳, 等. 近江牡蛎肉水解物的营养成分及抗疲劳作用研究[J]. 食品科技, 2010, 35(2):70-73. [19] 陶雅浩, 金其贯, 徐昊然. 牡蛎肽补充和运动训练对小鼠运动耐力的影响[J]. 食品科技, 2020, 45(3):57-63. doi: 10.13684/j.cnki.spkj.2020.03.014 [20] 叶建仔, 熊静宇, 马一明. 牡蛎提取物对大鼠运动能力及糖贮备的影响[J]. 长江大学学报(自然科学版), 2013, 10(18):80-82,1. [21] 王建永. 牡蛎多肽对运动疲劳大鼠骨骼肌线粒体功能的影响[J]. 安徽大学学报(自然科学版), 2020, 44(5):93-99. [22] 车帅, 刘楚怡, 王长伟, 等. 一种含有牡蛎肽保健酒的功能评价[J]. 中国酿造, 2021, 40(5):97-102. doi: 10.11882/j.issn.0254-5071.2021.05.018 [23] XIAO M, LIN L, CHEN H, et al. Anti-fatigue property of the oyster polypeptide fraction and its effect on gut microbiota in mice[J]. Food Funct,2020,11(10):8659-8669. doi: 10.1039/D0FO01713B [24] LEE T G, MARUYAMA S. Isolation of HIV-1 protease-inhibiting peptides from thermolysin hydrolysate of oyster proteins[J]. Biochem Biophys Res Commun,1998,253(3):604-608. doi: 10.1006/bbrc.1998.9824 [25] 李超柱, 陈艳华, 陈艳辉, 等. 牡蛎活性肽的分离及其免疫抑制作用的实验研究[J]. 海洋科学, 2013, 37(4):52-56. [26] 陈晓文, 刘文颖, 许丹, 等. 牡蛎肽对小鼠免疫功能影响的研究[J]. 中国食物与营养, 2016, 22(10):66-68. doi: 10.3969/j.issn.1006-9577.2016.10.015 [27] 许丹, 林峰, 朱小语, 等. 牡蛎肽对免疫抑制小鼠免疫功能的影响[J]. 北京大学学报(医学版), 2016, 48(3):392-397. [28] 方磊, 李国明, 徐珊珊, 等. 牡蛎肽和三文鱼皮胶原肽低致敏性和抗过敏活性研究[J]. 食品与发酵工业, 2018, 44(9):91-97. [29] HWANG D, KANG M J, JO M J, et al. Anti-inflammatory activity of β-thymosin peptide derived from Pacific oyster (Crassostrea gigas) on NO and PGE2 production by down-regulating NF-κB in LPS-induced RAW264.7 macrophage cells[J]. Mar Drugs,2019,17(2):E129. doi: 10.3390/md17020129 [30] LI M, ZHOU M, WEI Y, et al. The beneficial effect of oyster peptides and oyster powder on cyclophosphamide-induced reproductive impairment in male rats: a comparative study[J]. J Food Biochem,2020,44(11):e13468. [31] 李大炜, 刘四军, 吴庆光. 牡蛎肽对D-半乳糖致衰老大鼠睾丸组织及精子质量的影响[J]. 中医药导报, 2019, 25(11):55-58. [32] 方磊, 王雨辰, 马永庆, 等. 牡蛎肽与大豆肽、胶原肽、紫苏籽肽复配促进睾丸间质细胞生成雄性激素[J]. 现代食品科技, 2021, 37(6):28-34,81. [33] 方磊, 张瑞雪, 陈亮, 等. 牡蛎肽对TM3细胞性功能的影响[J]. 中国食品学报, 2021, 21(5):140-147. doi: 10.16429/j.1009-7848.2021.05.017 [34] 刘瑜, 张海欣, 盛卓娴, 等. 牡蛎低聚肽对CTX诱导的PADAM大鼠性功能及生殖功能的干预作用[J]. 食品工业科技, 2020, 41(17):302-307. [35] 张亭, 李迪, 乌兰, 等. 牡蛎低聚肽配伍核桃低聚肽和山药多糖对雄性小鼠性功能的影响[J]. 现代预防医学, 2018, 45(12):2141-2144,2153. [36] 张雪妍, 秦小明, 高加龙, 等. 牡蛎酶解工艺优化及其酶解产物对小鼠睾酮分泌的影响[J]. 广东海洋大学学报, 2019, 39(3):96-102. doi: 10.3969/j.issn.1673-9159.2019.03.013 [37] 陈悦, 李路, 闫朝阳, 等. 小分子牡蛎多肽对雄性小鼠性功能的影响[J]. 基因组学与应用生物学, 2019, 38(1):109-116. doi: 10.13417/j.gab.038.000109 [38] 李超柱, 陈艳辉, 陈艳华, 等. 牡蛎活性肽超滤分离工艺及其抗肿瘤活性研究[J]. 钦州学院学报, 2016, 31(10):9-12. doi: 10.3969/j.issn.1673-8314.2016.10.003 [39] 李鹏, 李祺福, 黄大川, 李筱泉, 刘敏. 僧帽牡蛎天然活性多肽BPO-1抗人胃腺癌BGC-823细胞活性研究[J]. 厦门大学学报(自然科学版), 2002, 41(5):618-622. [40] 李鹏, 李祺福, 石松林, 等. 牡蛎天然活性肽对人胃腺癌BGC-823细胞周期与基因表达的调控[J]. 中国海洋药物, 2007, 26(3):1-8. doi: 10.3969/j.issn.1002-3461.2007.03.001 [41] 李祺福, 黄大川, 石松林, 等. 牡蛎低分子活性肽BPO-L对人肺腺癌A549细胞周期和相关癌基因、抑癌基因表达的调控作用[J]. 厦门大学学报(自然科学版), 2008, 47(1):104-110. [42] UMAYAPARVATHI S, MEENAKSHI S, VIMALRAJ V, et al. Antioxidant activity and anticancer effect of bioactive peptide from enzymatic hydrolysate of oyster (Saccostrea cucullata)[J]. Biomed Prev Nutr,2014,4(3):343-353. doi: 10.1016/j.bionut.2014.04.006 [43] 石梦莹, 徐海波, 卢小路, 等. 牡蛎调控肠道肿瘤细胞维生素D受体信号通路的研究[J]. 中药药理与临床, 2015, 31(1):142-145. doi: 10.13412/j.cnki.zyyl.2015.01.045 [44] 雷丹青, 张辉, 廖共山, 等. 广西北部湾近江牡蛎降糖作用的研究[J]. 时珍国医国药, 2010, 21(12):3125-3127. doi: 10.3969/j.issn.1008-0805.2010.12.040 [45] 王世华, 于红霞, 王淑娥, 等. 牡蛎提取物对高血糖小鼠保护作用[J]. 中国公共卫生, 2006, 22(1):80-81. doi: 10.3321/j.issn:1001-0580.2006.01.041 [46] 许旻, 刘淑集, 吴靖娜, 等. 水解牡蛎粉基本成分分析及其辅助降血糖功能的评价[J]. 现代食品科技, 2017, 33(7):25-30. doi: 10.13982/j.mfst.1673-9078.2017.7.004 [47] 徐静. 牡蛎提取物的降血糖活性研究[D]. 济南: 山东大学, 2005. [48] TANAKA K, NISHIZONO S, KUGINO K, et al. Effects of dietary oyster extract on lipid metabolism, blood pressure, and blood glucose in SD rats, hypertensive rats, and diabetic rats[J]. Biosci Biotechnol Biochem,2006,70(2):462-470. doi: 10.1271/bbb.70.462 [49] WANG J P, HU J N, CUI J Z, et al. Purification and identification of a ACE inhibitory peptide from oyster proteins hydrolysate and the antihypertensive effect of hydrolysate in spontaneously hypertensive rats[J]. Food Chem,2008,111(2):302-308. doi: 10.1016/j.foodchem.2008.03.059 [50] HAO L L, WANG X C, CAO Y R, et al. A comprehensive review of oyster peptides: Preparation, characterisation and bioactivities[J]. Rev Aquacult,2022,14(1):120-138. doi: 10.1111/raq.12588 [51] LIU P, LAN X, YASEEN M, et al. Purification, characterization and evaluation of inhibitory mechanism of ACE inhibitory peptides from pearl oyster (Pinctada fucata martensii) meat protein hydrolysate[J]. Mar Drugs,2019,17(8):E463. doi: 10.3390/md17080463 [52] GOMEZ H L R, PERALTA J P, TEJANO L A, et al. In silico and in vitro assessment of Portuguese oyster (Crassostrea angulata) proteins as precursor of bioactive peptides[J]. Int J Mol Sci,2019,20(20):E5191. doi: 10.3390/ijms20205191 [53] 邱娟, 沈建东, 翁凌, 等. 利用牡蛎制备ACE抑制肽的工艺优化[J]. 食品科学, 2017, 38(16):165-172. doi: 10.7506/spkx1002-6630-201716026 [54] SHIOZAKI K, SHIOZAKI M, MASUDA J, et al. Identification of oyster-derived hypotensive peptide acting as angiotensin-I-converting enzyme inhibitor[J]. Fish Sci,2010,76(5):865-872. doi: 10.1007/s12562-010-0264-0 [55] 张可佳, 张胜男, 祁艳霞, 等. 牡蛎ACE抑制肽对原发性高血压大鼠的降压效果及其性质研究[J]. 大连海洋大学学报, 2018, 33(6):788-794. doi: 10.16535/j.cnki.dlhyxb.2018.06.017 [56] 陶雅浩, 金其贯. 有氧运动联合牡蛎肽对自发性高血压大鼠血压及血清AngⅡ、ET-1、VEGF的影响[J]. 辽宁体育科技, 2020, 42(4):67-71. doi: 10.3969/j.issn.1007-6204.2020.04.016 [57] 王长伟, 李八方, 宋文山, 等. 牡蛎蛋白肽的制备及促进生长发育功能[J]. 安徽农业科学, 2019, 47(17):161-164. doi: 10.3969/j.issn.0517-6611.2019.17.047 [58] 刘艳, 谷瑞增, 贾福怀, 等. 牡蛎肽螯合锌成分分析、结构表征及促细胞增殖作用[J]. 食品工业, 2019, 40(9):221-224. [59] 王毅炜, 李晨琳, 蒋倩, 等. 不同浓度牡蛎蛋白肽对大鼠骨髓间充质干细胞增殖和分化能力的影响[J]. 中国口腔颌面外科杂志, 2021, 19(1):6-11. doi: 10.19438/j.cjoms.2021.01.002 [60] 刘赛, 仲伟珍, 张健, 刘占涛. 牡蛎提取物对鹌鹑实验性动脉粥样硬化的抑制作用及机制[J]. 中国动脉硬化杂志, 2002, 10(2):97-100. doi: 10.3969/j.issn.1007-3949.2002.02.002 [61] 黄海, 苏柏霖, 苏军勇, 等. 牡蛎肽-锌纳米粒对大鼠促锌吸收及抗氧化效果的研究[J]. 食品科技, 2018, 43(4):76-80. doi: 10.13684/j.cnki.spkj.2018.04.016 [62] 王再扬, 曹玉惠, 赵元晖, 等. 类蛋白反应修饰的牡蛎肽锌结合物的生物利用性[J]. 中国食品学报, 2020, 20(3):46-51. doi: 10.16429/j.1009-7848.2020.03.006 [63] 林海生, 曹文红, 卢虹玉, 等. 牡蛎酶解产物改善小鼠学习记忆能力的初步研究[J]. 食品工业科技, 2012, 33(19):341-345. doi: 10.13386/j.issn1002-0306.2012.19.009 [64] 朱国萍, 章超桦, 曹文红, 等. 牡蛎酶解产物对小鼠学习记忆的影响[J]. 广东海洋大学学报, 2021, 41(4):84-92. doi: 10.3969/j.issn.1673-9159.2021.04.010 [65] 徐成, 卢虹玉, 章超桦, 等. 牡蛎酶解提取物对D-半乳糖致衰小鼠学习记忆的影响[J]. 食品工业科技, 2016, 37(2):347-351. doi: 10.13386/j.issn1002-0306.2016.02.062 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 10271
- HTML全文浏览量: 4057
- PDF下载量: 48
- 被引次数: 0




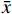
 下载:
下载:

 下载:
下载:
