-
癌症是导致人类死亡的重要原因,手术、放疗和化疗等传统的癌症治疗手段已经不能满足现代癌症治疗的需求。近年来,免疫检查点抑制剂(ICIs)的发现,掀起了肿瘤免疫治疗的热潮。目前,多种免疫检查点抑制剂已经投入临床使用,如细胞毒T淋巴细胞相关抗原4 (CTLA-4 )抗体药物伊匹单抗(ipilimumab)、PD-1抑制剂帕母单抗(pembrolizumab, keytruda)和纳武单抗(nivolumab, opdivo)以及PD-L1抑制剂阿替利珠单抗(atezolizumab)、阿利库单抗(avelumab)和德瓦鲁单抗(durvalumab)。ICIs生物制剂在疗效和特异性方面的优势已经得到充分的证明,并且已经应用于多种肿瘤的治疗,如转移性黑色素瘤、非小细胞肺癌、头颈部鳞状细胞癌和霍奇金淋巴瘤[1]。但是ICIs在临床使用中仍然存在局限性,如很多接受免疫治疗的患者都经历了胃肠道毒性、内分泌毒性以及皮肤毒性等免疫相关不良事件(immune-irAEs)。除此之外,根据免疫疗法的类型以及治疗周期,患者需要支付高额的治疗费用[2]。
人们研究发现传统中药具有“扶正驱邪”的双重抗肿瘤作用。许多中药活性成分一方面能够通过破坏癌细胞的氧化还原平衡,抑制癌细胞的增殖,诱导癌细胞周期阻滞和凋亡来“驱邪”,另一方面可以通过增强机体免疫功能来“扶正”起到治疗肿瘤的作用。近年来,研究发现许多中药活性小分子可以抑制PD1/PD-L1的表达,改善肿瘤微环境(TME)的免疫抑制[3]。本文主要就抑制肿瘤免疫微环境中PD-1/PD-L1表达的中药活性小分子进行综述,希望为免疫检查点小分子抑制剂的研究提供线索。
-
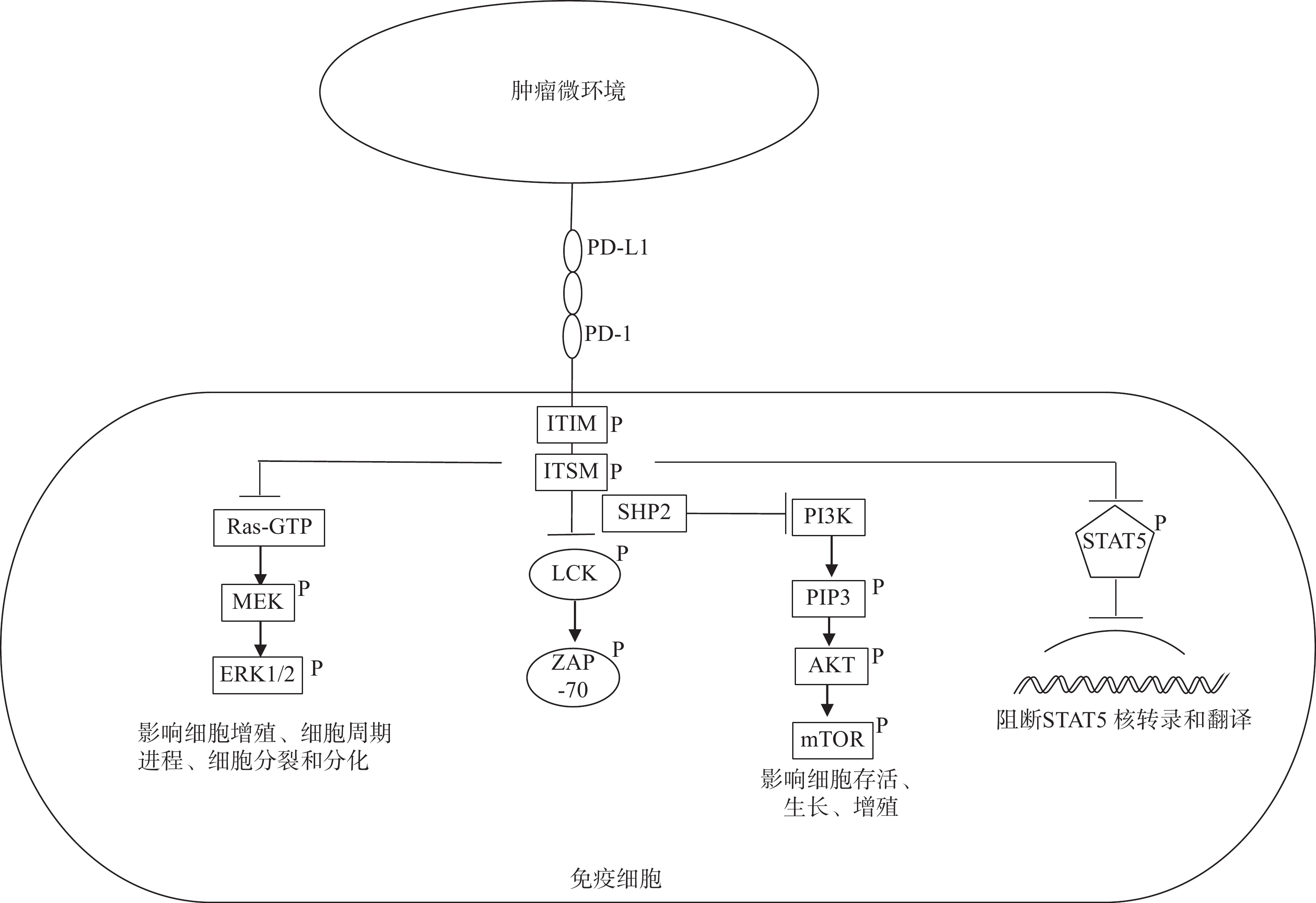
PD-1/PD-L1是T细胞活化过程中的免疫检查点。PD-1是一种细胞表面受体,主要表达于活化的T细胞,在B细胞、巨噬细胞等也有表达。人体内的PD-1蛋白由程序性死亡蛋白1(PDCD1)基因编码。PD-L1是PD-1的配体,是B7家族的成员,表达于T细胞、自然杀伤细胞、巨噬细胞、树突状细胞、B细胞、上皮细胞以及血管内皮细胞表面。在正常生理条件下,PD-1是一种重要的免疫调节分子,防止T细胞过度活化。然而在病理条件下,肿瘤细胞利用这一特点,大量表达PD-L1并且促进TME中抗原提呈细胞表达PD-L1。当这些PD-L1与免疫细胞表面的PD-1结合后,PD-1上的免疫受体酪氨酸抑制基序(ITIM ) 和免疫受体酪氨酸开关基序( ITSM)被激活,并招募蛋白酪氨酸磷酸酶2 (SHP2)靠近T细胞受体,抑制T细胞LCK和ZAP-70的磷酸化,导致下游一系列通路受到抑制。PD-1抑制的第一个关键信号是PI3K -AKT信号通路, PD-1通过招募SHP2来阻断PI3K的激活[4]。PD-1抑制的第二个重要信号是有丝分裂原活化蛋白激酶Ras–MEK–ERK信号通路,PD-1通过抑制Ras的活化抑制 Ras–MEK–ERK信号通路的激活。这两条信号通路的抑制最终导致T细胞生长和增殖受阻,影响细胞周期进展,抑制细胞分裂和分化[5]。2型先天淋巴样细胞(ILC-2s)在机体免疫防御中起重要作用,有研究表明信号转导和转录激活因子5( STAT5)的激活对ILC-2s的增殖起到重要作用,然而PD-1的激活可抑制ILC-2s中STAT5的核转录和翻译[6](图1)。
研究表明PD-1和PD-L1的表达受到多种细胞因子和转录因子的调控。在急性感染T细胞激活阶段,活化T细胞核因子(NFATC1)可以促进PD-1的转录[7]。Notch信号通路可以直接激活CD8+T细胞中PD-1的转录[8]。除此之外, IL-6和IL-12可分别激活信号转导和转录激活因子3(STAT3)与STAT4,激活的STAT3与STAT4可以结合到PD-1增强子所在的STAT结合位点,从而促进PD-1的转录[9]。IFN-α能够促进T细胞形成由STAT1、STAT2和干扰素调节因子9(IRF9)组成的干扰素刺激因子3(ISGF3)复合物,该复合物可以增强T细胞活化期间PD-1的转录。在慢性感染T细胞激活阶段,FoxO1对维持 CD8+T细胞中PD-1的高水平转录具有重要作用[10]。在巨噬细胞中,核因子κB(NF-κB)能够在巨噬细胞激活期间激活PD-1的转录。在B细胞中,NFATC1和NF-κB均可以促进PD-1的转录[11]。相反,在急性感染期间,转录因子Blimp1抑制CD8+T细胞中PD-1的转录,而在慢性感染期间,Blimp1失去抑制PD-1转录的功能,转录因子T-bet代替它行使抑制PD-1转录的职能[12]。
研究表明,在小鼠卵巢癌模型中, IFN-γ能够增加肿瘤PD-L1的表达并且促进肿瘤的生长。当干扰素-γ受体1(IFNGR1 )缺失时,肿瘤细胞中PD-L1的表达水平也得到抑制。后续研究发现,IFN-γ通过IFN-γ-JAK1/JAK2-STAT1/STAT2/STAT3-IRF1轴来调控PD-L1的表达。JAK1、JAK2、STAT1和干扰素调节因子(IRF1)沉默,均可以显著抑制PD-L1的表达[13]。在TME中多种致癌转录因子如MYC,、STAT3、 缺氧诱导因子1α(HIF1α)、缺氧诱导因子2α(HIF2α)、c-JUN、NF-κB以及NF-κB p65蛋白(RelA)可以直接影响PD-L1的表达。因此,如何抑制肿瘤微环境中PD-1/PD-L1的表达成为肿瘤免疫治疗一个重要的突破点。
-
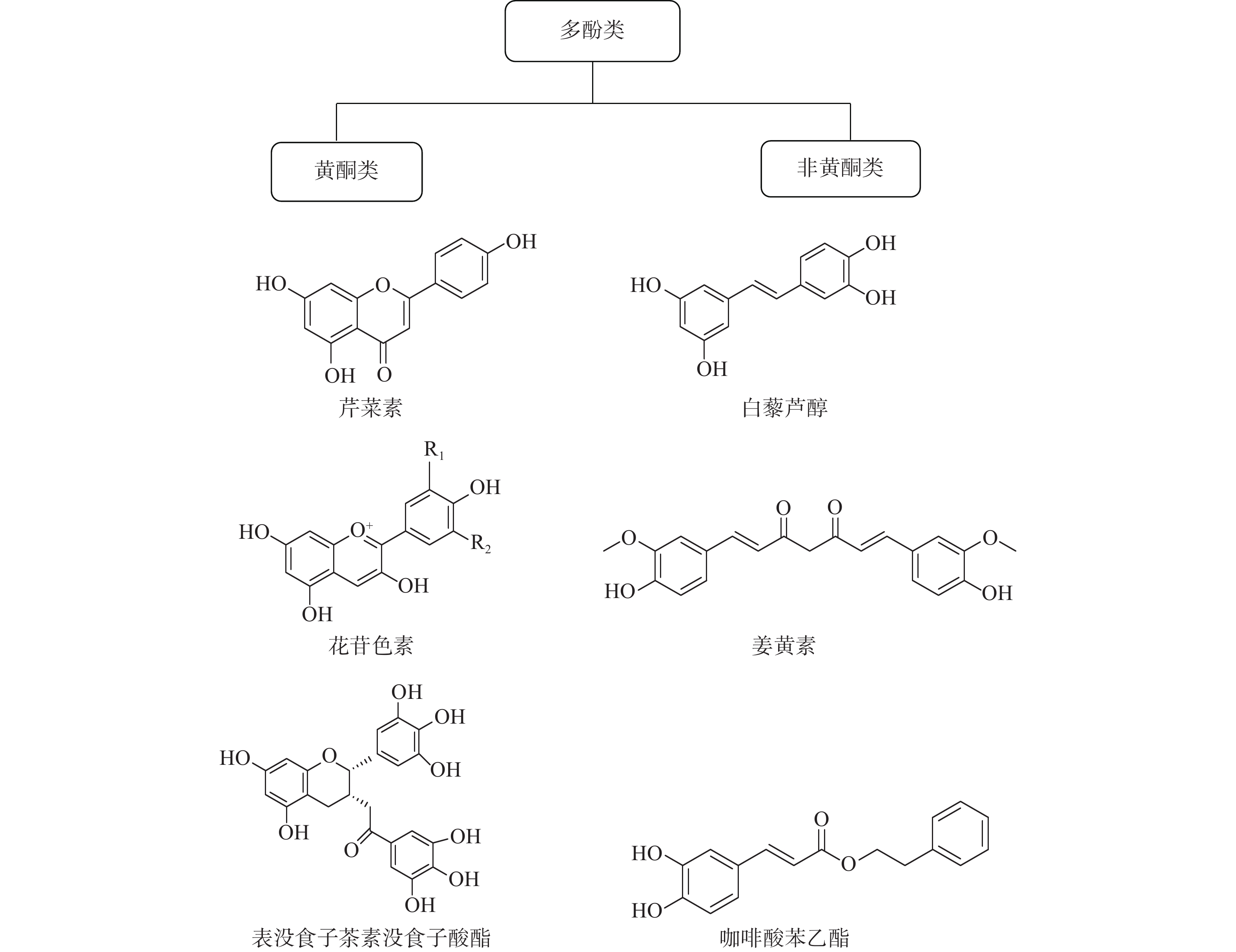
多酚是一类包含40多种化学结构的化合物,广泛存在于自然界和人们的日常生活中。我们日常食用的茶叶、葡萄酒、蔬菜、水果等物质中就富含多酚类化合物。据报道,多酚类物质具有抗炎、抗氧化、增强机体免疫力、抑制细菌以及癌细胞生长等广泛的生物学活性。研究表明,酚类化合物对人们的心血管疾病、神经退行性疾病、癌症、肥胖和糖尿病都有预防作用。多酚的化学结构中至少含有一个芳香环,并且根据不同的芳香环数目可分为黄酮类和非黄酮类化合物[14]。黄酮类化合物具有C6-C3-C6 的主链结构,可分为黄酮类、黄酮醇、双氢黄酮类、花青素等。非黄酮类化合物含有一个或多个酚环的化合物,包括酚酸、木酚素、二苯乙烯、姜黄素等(如图2)。许多的黄酮类和非黄酮类化合物可以通过调节免疫细胞、细胞因子的产生以及肿瘤细胞内在机制起到调控肿瘤免疫微环境的作用[15]。
-
芹菜素(apigenin)大量存在于蔬菜、水果、豆类和茶叶中,具有清除自由基、抗病毒、抗炎、抑制癌细胞生长等多种生物学功能。研究表明,芹菜素通过下调IFN-γ诱导人乳腺癌细胞中的STAT1激活,从而抑制PD-L1的表达和增强T细胞增殖[16]。芹菜素也可以抑制黑色素瘤细胞中STAT1的激活,显著下调IFN-γ诱导的PD-L1表达。体内实验表明,芹菜素能够显著抑制A357黑色素瘤异种移植瘤的生长,增强T细胞向肿瘤组织浸润,抑制人外周血成熟树突状细胞中PD-L1的表达[17]。由此可见,芹菜素可以通过下调PD-L1的表达起到抑制肿瘤生长,增强和恢复肿瘤浸润的免疫细胞的功能。
-
花色素苷(anthocyanin)是苯并吡喃的衍生物,广泛存在于绝大多数陆生植物的液泡中,是水溶性黄酮类色素中最重要的一种。其已经被证明具有抗氧化、抗炎、抗衰老、抗肥胖以及抗癌功能。有研究表明,花色素苷及其代谢产物可以显著抑制PD-1、PD-L1的表达,激活肿瘤微环境中的免疫应答并抑制结直肠癌的进展 [18]。肠道微生物可以提高免疫检查点抑制剂的治疗效果,目前有研究报道在小鼠MC38结肠癌模型中,使用壳聚糖和低分子柑橘果胶的越桔花色素苷组合,可以起到调节肠道微生物群和阻断PD-L1的作用。结果还显示,越桔花色素苷组合可以增加小鼠粪便中丁酸盐的浓度和比例,增强肿瘤组织中CD8+T细胞的浸润[19]。还有类似的研究发现,在结肠癌小鼠模型中,口服越桔花色素苷提取物可以显著增强抗PD-L1抗体的作用。这主要是由于花青素处理组的细菌多样性显著增加,小鼠粪便中具有免疫调节能力的梭状芽胞杆菌和约氏乳杆菌的数量也得到显著增加。这些研究都表明花色素苷可以通过改变肠道菌群协助ICIs发挥抗肿瘤的作用[20]。
-
表没食子茶素没食子酸酯 (EGCG),是茶多酚中最有效的活性成分,属于儿茶素类化合物。EGCG具有抗菌、抗炎、抗病毒、抗肿瘤等作用[21]。有研究报道,在非小细胞肺癌中,EGCG能够抑制IFN-γ和表皮生长因子(EGF)诱导的 PD-L1的表达。EGCG和绿茶提取物能够抑制A549人肺癌细胞中JAK2/STAT1信号通路,从而减少由IFN-γ诱导的PD-L1 mRNA以及蛋白质的表达水平;同时通过抑制EGF受体/AKT信号通路,使EGF诱导的PD-L1的表达降低。在腹腔注射4-甲基亚硝胺基-1-(3-吡啶基)-1-丁酮(NNK)诱导的小鼠肺癌模型中,小鼠的饮用水中加入0.3%的绿茶提取物,可以降低每只小鼠的平均肿瘤数目和70% PD-L1的阳性细胞率。在F10-OVA黑色瘤细胞和肿瘤特异性CD3+T细胞共培养模型中,EGCG能够使F10-OVA细胞的PD-L1 mRNA的表达降低,并且可以恢复肿瘤特异性CD3+T细胞IL-2 mRNA的表达[22]。这些结果表明,EGCG是PD-L1的有效抑制剂,具有抑制EGFR/Akt和IFNR/JAK2/STAT1通路的潜力。
-
姜黄素(curcumin)是一种从姜科植物姜黄的根茎中提取到的黄色色素。具有抗氧化、抗炎、抗凝、降脂、抗动脉粥样硬化、抗衰老及抑制肿瘤生长等生物活性[23]。近年来的研究表明,姜黄素对多种疾病都有疗效,其中抗肿瘤的作用最为广泛。最近有研究发现,姜黄素通过抑制舌鳞状细胞癌中STAT3通路介导的PD-L1表达,减少调节性T细胞(Tregs)和骨髓源性抑制细胞(MDSCs)的招募,部分逆转了免疫抑制[24],很有可能是潜在的肿瘤免疫治疗药物。还有文献报道,姜黄素通过下调小鼠结肠癌中NF-κB和STAT3信号通路促进肿瘤抗原特异性CD8+T细胞的产生,并增强树突状细胞(DCs)对T细胞激活[25]。尽管越来越多的证据证明姜黄素可能具有免疫调节作用,但目前仍然缺乏全面的机制研究和临床试验,因此在应用于临床之前还需要进行更深入的探讨。
-
白藜芦醇(RSV)又称 (E)-3,5,4-三羟基二苯乙烯,1993年在白藜芦的根茎中被首次发现。白藜芦醇是天然的抗氧化剂,具有清除自由基、抑制血小板非正常凝集、抗动脉粥样硬化、抗菌、抗炎、抗癌等生物活性。此外,RSV对免疫系统也有调节作用[26]。有大量的研究表明,RSV在各种类型的癌症中以直接或间接的方式调控肿瘤细胞和免疫细胞之间的联系,从而影响肿瘤微环境中的免疫应答。PD-L1是I型跨膜糖蛋白,糖基化的状态对PD-L1蛋白的稳定性和功能起着重要作用。此前有文献报道,RSV在卵巢癌细胞中通过激活糖原合成酶激酶-3β(GSK3β)抑制己糖胺生物的合成,阻断蛋白的糖基化[27]。最近,有研究发现RSV可以作为α-葡萄糖苷酶或α-甘露糖苷酶的直接抑制剂,破坏乳腺癌细胞中PD-L1的糖链修饰,促进PD-L1异常糖基化,最终阻碍PD-L1镶嵌到癌细胞膜。综上所述,RSV对PD-L1糖基化和二聚化的调节,可增强T细胞对癌细胞的杀伤活性[28]。还有研究报道,使用RSV治疗可以逆转口腔癌中甲状腺素的作用,减少PD-L1的表达和核积累[29]。不仅如此,RSV还可以诱导人和小鼠卵巢癌细胞免疫原性死亡。小鼠腹腔注射卵巢癌细胞,细胞经 RSV预处理后,可以显著抑制随后接种的异种移植瘤的生长。直接使用RSV治疗也可以抑制肿瘤的发展,并且经过RSV治疗后的移植瘤中成熟树突状细胞以及细胞毒性T细胞数量增加,转化生长因子β(TGF-β)的分泌减少,白介素12p7(IL12p7)和IFN-γ的分泌增加。与PD-L1抗体联合使用可提升其抗肿瘤作用[30]。关于RSV在肿瘤免疫中的更多机制还有待研究和发现。
-
咖啡酸苯乙酯(CAPE)是蜂胶中的主要成分之一,是一种含有儿茶酚结构的强氧化剂。免疫学研究表明,CAPE可以显著抑制丝裂原诱导的T细胞增殖、淋巴因子的产生以及NF-κB的活化。有文献发现,EB病毒(EBV)感染鼻咽癌细胞后,分别通过潜伏膜蛋白1(LMP1)和IFN-γ途径诱导PD-L1的表达。使用NF-κB抑制剂CAPE治疗后,EBV阳性鼻咽癌细胞株和过表达LMP1的正常鼻咽癌细胞株中PD-L1的表达显著降低[31]。结果表明,CAPE通过抑制NF-κB通路下调LMP1诱导的PD-L1的表达,说明CAPE是有潜力的免疫检查点抑制剂。
-
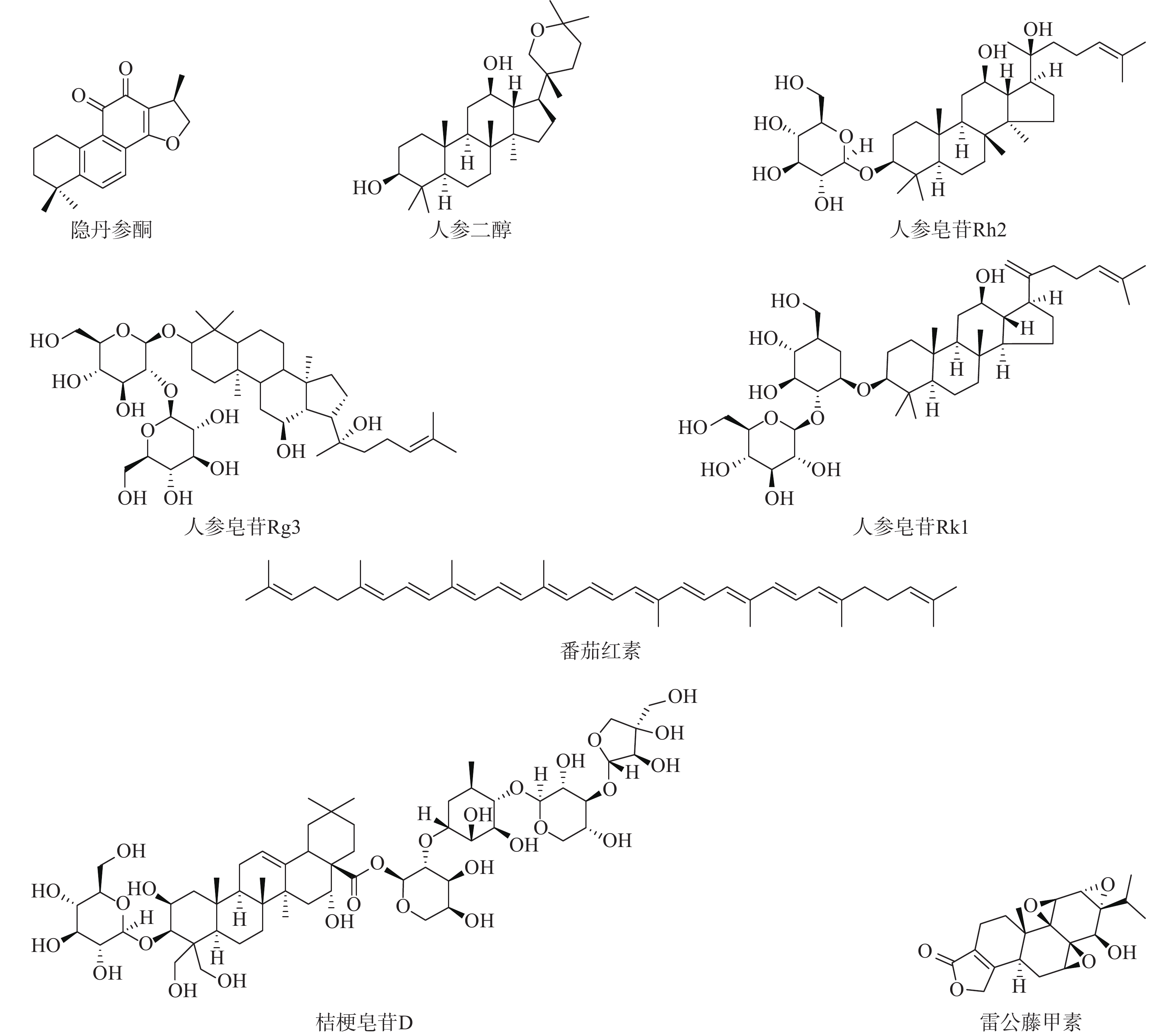
萜烯是一系列萜类化合物的总称,分子式为异戊二烯的整数倍的烯烃类化合物。根据异戊二烯的数目,萜烯可以分为单帖、倍半萜、二萜、二倍半萜、三萜、四萜、多聚萜等组成(如图3)。萜烯普遍存在于植物体和海洋生物体中,具有广泛的生物活性,包括降血糖、降血压、抗炎、抗病毒和抗肿瘤等[32]。
-
番茄红素(lycopene)是一种亮红色的类葫芦卜素(四萜),天然存在于红色和粉色的水果和蔬菜中,如西红柿。研究表明,番茄红素不仅具有抗癌抑癌的功能,而且在预防心血管疾病、动脉粥样硬化、增强机体免疫力以及延缓衰老等方面都有显著作用[33]。近期有研究表明,在Lewis肺癌小鼠模型中,番茄红素联合PD-1抗体使用可以显著降低肿瘤的体积和重量。此外,番茄红素还可以协助PD-1抗体提高荷瘤小鼠IL-1和IFN-γ的表达水平,降低IL-4和IL-10的表达水平;并且番茄红素可以通过激活JAK2/STAT3信号通路和抑制AKT磷酸化,降低IFN-γ诱导的肺癌细胞PD-L1的表达[34]。研究结果提示,番茄红素在高表达PD-L1和IFN-γ的肿瘤患者中可能发挥重要作用,其机制是通过激活JAK2信号通路来抑制IFN-γ诱导的PD-L1的表达,这与往常的作用机制不同,需要进一步的研究来确定番茄红素的作用方式。
-
隐丹参酮(cryptotanshinone)又称隐丹参醌,是一种从丹参根中提取的醌类二萜化合物,具有抗炎、抗菌、抗氧化、抗肿瘤等广泛的生物活性。有研究发现隐丹参酮不仅能抑制肺癌细胞增殖,还能促进抗肿瘤免疫。在小鼠Heap1-6肝癌模型中,隐丹参酮可以显著抑制小鼠肿瘤的生长,并且其与PD-L1抗体联合使用可以诱导长期抗Heap1-6的特异性免疫,达到完全治愈荷瘤小鼠的作用。隐丹参酮治疗的Heap1-6小鼠的免疫图谱显示,隐丹参酮可以激活肿瘤浸润的巨噬细胞和树突状细胞,诱导抗肿瘤T细胞应答,促进肿瘤组织中效应CD8 T细胞、记忆CD8 T细胞的浸润[35]。因此,隐丹参酮与PD-L1的联合使用可以促进CD8 T细胞毒作用并且诱导肿瘤特异性免疫,为人类肝细胞癌提供了一种有效的免疫治疗方案。
-
雷公藤甲素(triptolide)又称雷公藤内酯,是从中药雷公藤的根、叶、花和果实中提取的一种环氧二萜内酯化合物,是雷公藤提取物的主要活性成分之一。体内外研究表明,雷公藤甲素对乳腺癌、胰腺癌、肺癌等多种癌症都具有良好的抗肿瘤活性[36]。已有大量的研究报道,在多种癌细胞中,雷公藤甲素可以有效调节IFN-γ诱导的PD-L1的表达。比如,Liang等发现雷公藤甲素可以抑制乳腺癌细胞株中IFN-γ诱导的PD-L1的表达[37];Zhang等证实雷公藤甲素不仅可以抑制IFN-γ诱导的胶质瘤细胞PD-L1的表达,还能逆转胶质瘤细胞诱导的CD4+T细胞的抑制作用[38];Kuo等报道雷公藤甲素能够减少口腔癌细胞中IFN-γ的分泌,抑制IFN-γ相关的JAK2-STAT1信号通路,降低PD-L1的表达和抑制肿瘤的生长[39]。综上所述,在多种癌症中,雷公藤甲素与IFN-γ诱导的PD-L1的表达存在相关性,提示雷公藤甲素在肿瘤免疫治疗中具有不可估量的潜力。
-
皂苷(saponins)是苷元为三萜或螺旋甾烷类化合物的一类糖苷,主要存在于陆地高等植物中,包括人参、远志、桔梗、柴胡等。它们的主要特征是溶血活性和起泡性[40]。人参皂苷是从中药人参中提取的一种三萜皂苷。最近有研究发现12种人参皂苷中有8种人参皂苷在最大浓度(1μmol/L)时对PD-1/PD-L1相互作用的抑制率达到35%,其中Rg3和化合物K的抑制作用最强[41]。此外,还有研究报道人参皂苷Rg3通过抑制PD-L1、AKT和NF-κB p65,诱导对顺铂耐药的人肺癌细胞株(A549)的凋亡[42]。人参皂苷Rk1通过抑制肺癌细胞(A549)中NF-κB和B淋巴细胞瘤-2 (Bcl-2)诱导细胞凋亡并且抑制PD-L1表达[43]。人参二醇是人参根中提取的三萜皂苷元单体化合物。研究发现人参二醇通过抑制结肠癌细胞中低氧诱导因子(HIF)-1α的合成以及STAT3的激活,抑制PD-L1的表达和肿瘤细胞的增殖[44]。综上所述,皂苷在肿瘤免疫中的作用是不容忽视的。
-
近年来,肿瘤免疫治疗在实验室研究和临床应用中蓬勃发展,已逐渐替代传统癌症治疗方法。其中PD-1/PD-L1作为最具潜力的免疫检查点一直备受关注,如何更加有效的抑制PD-1/PD-L1已成为肿瘤免疫治疗热点。然而,目前市面上的PD-1/PD-L1抑制剂均为大分子单抗类生物制剂,此类制剂存在对组织和肿瘤的渗透性差、免疫原性强、价格昂贵等缺点。新型的小分子药物以吸收快、副作用小、免疫原性低等优势,已成为PD-1/PD-L1免疫检查点抑制剂的新的研究方向。中药作为中国传统中医文化的宝藏,是我国劳动人民通过长期的生活实践和医疗实践取得的成果。近年来研究发现,许多中药活性小分子具有抗肿瘤作用,但其具体的作用机制还需要进行深入探讨。
本文介绍了免疫共抑制分子PD-1/PD-L1的分子作用机制和常见的中药活性小分子及其在肿瘤免疫中的作用。由于PD-1/PD-L1主要通过抑制PI3K -AKT和Ras–MEK–ERK信号通路的激活,从而抑制T细胞生长和增殖,使得肿瘤细胞逃逸于细胞免疫;PD-1/PD-L1还可通过抑制ILC-2s中STAT5的核转录和翻译影响ILC-2s的增殖,减弱机体对肿瘤细胞的免疫防御能力。然而,研究发现很多中药活性小分子与PD-1/PD-L1的表达及功能密切相关,它们不仅可调控STAT以及NF-κB等信号通路来抑制PD-1/PD-L1的表达;还可调节肠道菌群,丰富菌群多样性来抑制PD-1/PD-L1的作用。此外,中药活性小分子还可影响PD-1/PD-L1的翻译后修饰与亚细胞定位。例如,通过破坏PD-L1的糖基化修饰和二聚化阻碍其转运到癌细胞膜表面,从而改善肿瘤微环境中的免疫抑制。尽管如此,仍然还有许多中药活性小分子的作用机制没有完全地阐明,需要进一步的研究和探索。
Research progress on active ingredients from traditional Chinese medicine as inhibitors of PD-1/PD-L1 of cancer immune checkpoint
-
摘要: 肿瘤免疫治疗已成为新型的癌症治疗手段,有望彻底消除肿瘤。免疫检查点抑制剂,特别是程序性死亡受体-1(PD-1)和程序性死亡受体-配体1(PD-L1)抗体在多种实体瘤的治疗中取得很好的临床疗效,但是生物制剂存在免疫原性强、价格昂贵等缺点,因此,寻找免疫检查点小分子抑制剂成为未来肿瘤免疫疗法的新挑战。本文将综述近年发现的抑制PD-1/PD-L1表达的中药活性小分子及其对肿瘤免疫微环境的调控作用。
-
关键词:
- 中药活性小分子 /
- 肿瘤免疫微环境 /
- 程序性死亡受体-1 /
- 程序性死亡受体-配体1
Abstract: Tumor immunotherapy has become a new cancer treatment which has been expected to eliminate tumors. Immune checkpoint inhibitors, especially programmed death-1 (PD-1) and programmed death-ligand 1 (PD-L1) antibodies, have achieved significant clinical efficacy in the treatment of solid tumors. But biologics possess disadvantages such as strong immunogenicity and high cost. Therefore, the discovery of small molecule drugs as immune checkpoint inhibitors may overcome the shortcomings of biologics and become a new challenge for future tumor immunotherapy. The active small molecules from traditional Chinese medicine that inhibit the expression of PD-1/PD-L1 and their regulatory effects on the tumor immune microenvironment were reviewed in this paper. -
肝纤维化是肝脏对慢性肝损伤的过度修复反应,是一个动态可逆的过程。阻断肝纤维化持续进展是防治肝病向肝硬化甚至肝细胞癌发展的重要策略。目前研究认为,肝星状细胞(HSCs)转化为活化的肌成纤维细胞(MFBs)是细胞外基质 (ECM)的主要来源,也是肝纤维化的主要驱动力[1]。除此之外,大量研究发现,肝巨噬细胞在肝纤维化过程中同样发挥重要作用。
1. 肝巨噬细胞
肝巨噬细胞是肝脏中一个高度异质的非实质细胞群,占肝脏细胞的10%~15%,主要由枯否细胞 (KCs) 和单核细胞衍生的各种浸润巨噬细胞 (MoMFs) 组成,具有显著异质性。巨噬细胞的异质性以多种来源、多种细胞类型特异性标志物和极化表型为特征。此外,肝巨噬细胞具有显著的可塑性,能够快速响应组织环境的变化,呈现不同的细胞表型。肝巨噬细胞被认为是肝脏抵御病原体的第一道防线,参与包括炎症反应、纤维化形成以及纤维化消退在内的肝纤维化所有阶段[2]。因此,肝内巨噬细胞是肝纤维化的核心调控者,肝纤维化治疗的重要靶细胞。
1.1 KCs
KCs是体内最大的常驻巨噬细胞群,包括卵黄囊来源的KCs和骨髓来源的KCs。KCs可以识别内源性细胞碎片和外源性病原体,感知肝脏损伤进而发生活化。因此,KCs对于肝脏稳态的维持、免疫反应的启动和肝损伤的恢复至关重要。
1.2 MoMFs
MoMFs充当免疫反应协调者并补充巨噬细胞群以维持肝脏中的稳态。在小鼠体内,MoMFs分为两个亚群:Ly6Chi和Ly6Clo单核细胞。Ly6Chi单核细胞参与炎症反应并产生促炎作用,而Ly6Clo单核细胞则具有组织修复功能。
2. 肝巨噬细胞在肝纤维化中的作用
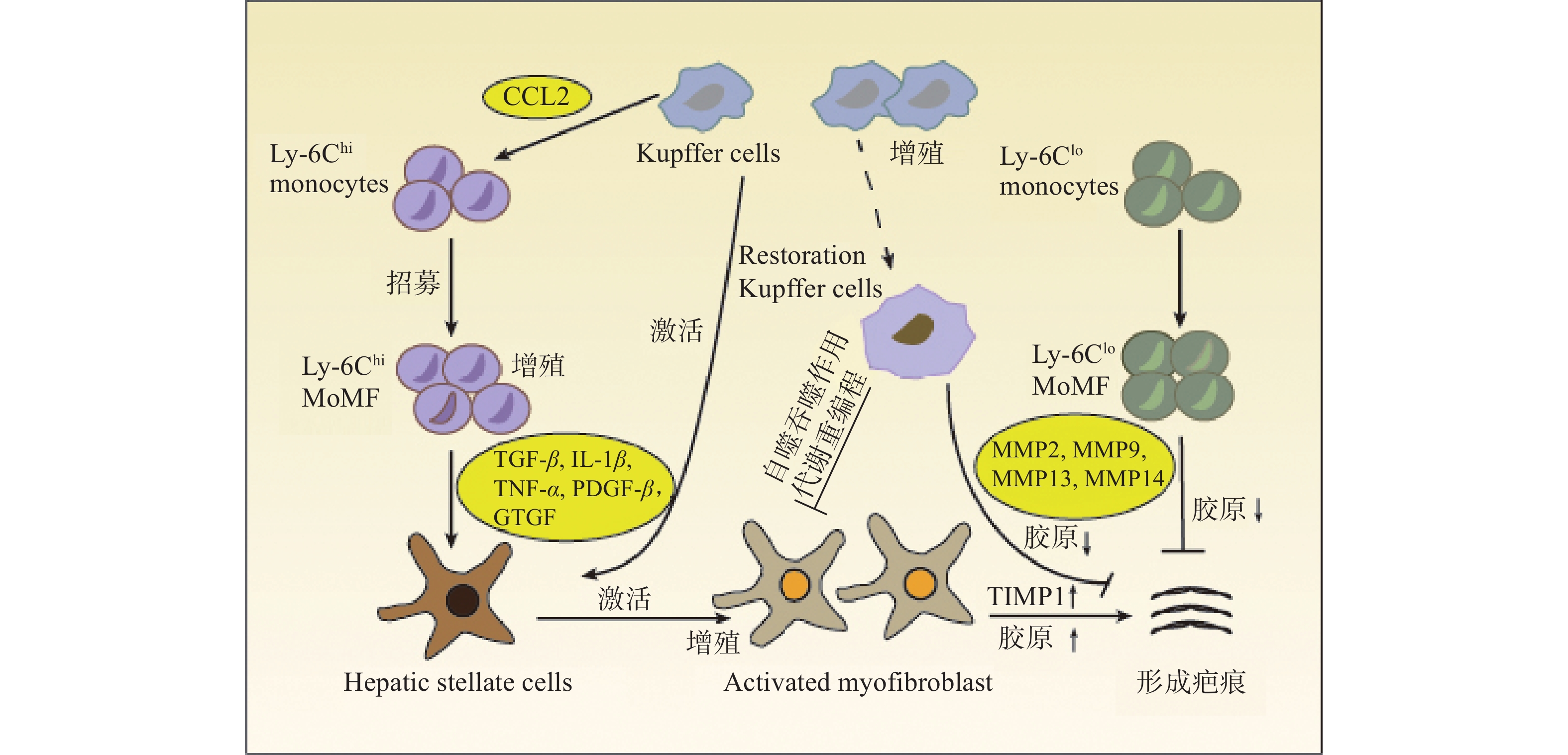
在肝损伤早期,损伤或死亡的肝细胞能够释放损伤相关分子模式 (DAMP),并与肝巨噬细胞相互作用,从而促进肝巨噬细胞的活化、极化和募集。活化的肝巨噬细胞能够分泌大量促炎因子和促纤维化细胞因子,参与炎症反应并促进HSCs的活化和纤维化应答[3](图1)。
2.1 肝巨噬细胞与HSCs的相互作用
HSCs位于肝细胞和肝窦内皮细胞之间的窦周间隙,在正常和受损的肝组织中具有不同的生理功能。正常的生理条件下,HSCs被称为静息的HSCs (qHSCs),负责储存肝脏中的维生素A。当肝损伤后,qHSCs被炎症介质激活,进而分化为 MFBs,分泌大量的ECM并产生纤维瘢痕,导致肝纤维化[4]。肝巨噬细胞能够与HSCs相互作用,重塑免疫微环境和ECM,该相互作用对于肝脏炎症应答和纤维化应答至关重要。
肝巨噬细胞能够分泌与HSCs活化有关的各种细胞因子和趋化因子,如转化生长因子β (TGF-β),肿瘤坏死因子α (TNF-α),白细胞介素1β (IL-1β) 和趋化因子配体2 (CCL2) 等。肝巨噬细胞产生的IL-1β和TNF-α能够激活NF-κB信号通路,增强MFBs的增殖[5]。激活素A (ACTA) 是TGF-β超家族成员之一,能够促进KCs中TNF-α和TGF-β1的表达,诱导HSCs转化为促纤维化表型,提高α-平滑肌肌动蛋白 (α-SMA) 表达水平和迁移能力[6]。此外,肝脏在受到丙型肝炎病毒 (HCV) 感染后,肝巨噬细胞能够分泌趋化因子配体5 (CCL5) ,引起HSCs中炎症小体和纤维化标志物α-SMA与TGF-β的激活[7]。
除细胞因子和趋化因子外,肝巨噬细胞还能够产生其他与HSCs串扰的分子。例如,MoMFs能够通过分泌颗粒蛋白激活qHSCs,促进其转化为MFBs,引起ECM的积累和肝纤维化的形成[8]。HMGB1是一种响应组织损伤而产生的DAMP,主要由肝细胞和KCs分泌,研究表明,HMGB1能够与HSCs中的晚期糖基化终末产物受体(RAGE)结合,激活pMEK1/2、pERK1/2和p-c-Jun通路,增加Ⅰ型胶原蛋白的沉积[9]。
此外,HSCs也可作用于肝巨噬细胞,影响其功能。紫藤凝集素阳性Mac-2结合蛋白 (WFA+-M2BP) 是一种肝纤维化的血清指示剂,可由HSCs分泌。据报道,WFA+-M2BP能够促进KCs表达M2BP,而KCs分泌的M2BP反过来又会进一步加强HSCs的激活。由此说明,在肝纤维化的发展过程中,巨噬细胞和HSCs之间存在正反馈调节[10]。
2.2 巨噬细胞极化
巨噬细胞具有显著的异质性,可以在不同的组织微环境中极化成不同的表型,从而发挥不同作用。通常,巨噬细胞极化的表型可以分为经典活化 (M1) 型和选择活化 (M2) 型。M2型可以进一步分为M2a、M2b、M2c和M2d亚型。
在被脂多糖 (LPS) 和干扰素-γ(IFN-γ) 刺激后,M1型巨噬细胞发生活化,分泌大量促炎细胞因子,如IL-1β、TNF-α、诱导型一氧化氮合酶 (iNOS) 等,从而发挥促炎作用。因此,M1型巨噬细胞在肝损伤起始阶段起重要作用,能够释放促炎因子,加剧炎症反应并促进肌成纤维细胞增殖,最终导致肝纤维化[11]。
M2型巨噬细胞的极化主要由白细胞介素4 (IL-4) 和白细胞介素13 (IL-13)等细胞因子诱导发生,能够分泌抗炎因子,如白细胞介素10 (IL-10) 、TGF-β、精氨酸酶1 (Arg-1) 等,具有抑制炎症、促进组织重塑、预防寄生虫感染以及调节免疫等生物学功能。在肝纤维化的发展过程中,M2型巨噬细胞产生抗炎作用,能够促进伤口的愈合和再生。然而,当肝损伤持续存在时,M2型巨噬细胞释放的TGF-β、血小板衍生生长因子 (PDGF) 、血管内皮生长因子 (VEGF) 等生长因子,会促进MFBs的增殖和活化,加重肝纤维化[12]。
调节巨噬细胞极化可以发挥抗肝纤维化作用。脯氨酸-丝氨酸-苏氨酸-磷酸酶相互作用蛋白2 (PSTPIP2) 能够调节STAT1和NF-κB信号通路,抑制M1型巨噬细胞极化,改善肝脏炎症和肝纤维化[13]。白细胞介素22 (IL-22) 能够调节STAT3、Erk、Akt信号通路的传导,促进巨噬细胞从M1型转变为M2型,从而减缓肝纤维化的进展[14]。
此外,肝巨噬细胞和其他细胞群之间的相互作用对肝巨噬细胞的表型转换也至关重要。自然杀伤 (NK) 细胞在调节巨噬细胞极化方面发挥关键作用,研究发现,DX5+NKp46+ NK细胞能够产生IFN-γ促进M1巨噬细胞极化,在预防非酒精性脂肪性肝炎 (NASH) 进展为肝纤维化方面发挥重要作用[15]。中性粒细胞 (PMN) 能够促进巨噬细胞转变为具有肝脏修复功能的巨噬细胞,有助于肝脏炎症和肝纤维化的自发消退[16]。
2.3 肝巨噬细胞的募集和浸润
肝巨噬细胞浸润与慢性炎症和肝纤维化密切相关。在趋化因子和相应受体的介导下,巨噬细胞能够募集到损伤部位,参与炎症和肝纤维化的发展。例如,Ly6Chi MoMFs能够依赖趋化因子受体2 (CCR2) 募集到肝损伤区域,发挥促炎和促纤维化作用。微蛋白 (PSMP) 是一种新型趋化因子,能够促进炎性巨噬细胞的浸润,分泌更多的促炎细胞因子,加剧肝纤维化应答[17]。骨髓细胞上表达的触发受体1 (TREM-1) 可促进KCs的募集和浸润以及促炎细胞因子的产生[18]。
阻碍肝巨噬细胞的浸润与募集有助于肝纤维化的消退。配对免疫球蛋白样2型受体α (PILRα) 是一种抑制性受体,主要在骨髓细胞中表达,在炎症过程中能够抑制肝巨噬细胞与PMN的浸润。研究证实,PILRα能够调节整合素信号传导,阻碍巨噬细胞迁移到受损的肝组织,从而减轻肝脏炎症并缓解肝纤维化[19]。
此外,研究还发现一种新的TREM2+ CD9+瘢痕相关巨噬细胞 (SAMacs) 亚群,其来源于MOMFs,在肝纤维化过程中表现出促纤维化表型[20],可能成为未来肝纤维化治疗的重要靶细胞。
2.4 肝巨噬细胞与肝细胞的相互作用
在肝纤维化进展中,肝细胞能够分泌一系列DAMP和细胞外囊泡 (EVs) ,可与肝巨噬细胞相互作用,诱导巨噬细胞转变为促炎表型。线粒体DNA (mtDNA) 是一种内源性DAMP,能够激活先天免疫反应[21]。肝细胞衍生的mtDNA能够激活NF-κB信号通路,诱导KCs分泌TNF-α和白细胞介素6 (IL-6) ,引起肝脏炎症和纤维化应答[22]。M1型巨噬细胞分泌的EVs能够激活肝细胞中NLRP3炎性体信号通路,而应激的肝细胞可分泌含有微小RNA-192-50 (miR-192-5p) 和血清CD40L配体 (CD40L) 的EVs,促进M1型巨噬细胞极化[23]。因此,肝细胞和巨噬细胞之间通过释放DAMP和EVs相互作用,促进了肝内炎症反应与肝纤维化进展。
2.5 肝巨噬细胞与代谢重编程
细胞代谢重编程是细胞为满足能量需求,通过改变代谢模式促进细胞增殖和生长的机制,包括糖代谢、脂代谢、氨基酸代谢等。
肝巨噬细胞的代谢重编程与巨噬细胞极化紧密联系,影响肝纤维化的进展和消退[24]。c-Rel是NF-κB转录因子家族成员之一,参与巨噬细胞代谢重编程。研究发现,c-Rel能够与6-磷酸果糖激酶-2的启动子结合,诱导巨噬细胞极化和HSCs活化,从而加重炎症反应与肝纤维化[25]。此外,肝脏中铁的代谢失调也与晚期肝纤维化有关。肝内铁的积累能够激活MiT/TFE转录因子,促进M1型巨噬细胞的活化,加重肝纤维化[26]。
膜联蛋白A5是膜联蛋白家族的成员之一,能够与M2型丙酮酸激酶(PKM2)相互作用,将肝巨噬细胞中的糖酵解转换为氧化磷酸化,促进巨噬细胞从M1型转换到M2型,从而改善炎症和肝纤维化[27]。因此,调节肝巨噬细胞的免疫代谢是肝纤维化的潜在治疗策略。
2.6 肝巨噬细胞自噬和吞噬作用
自噬是将机体中异常表达的蛋白质和受损的细胞器转移到溶酶体中进行降解,对细胞稳态的维持、细胞存活、分化和生长至关重要。大量研究证实,巨噬细胞自噬对肝脏具有保护作用。例如,KCs的自噬能够抑制细胞活性氧 (ROS) 介导的白细胞介素1α (IL-1α) 和IL-1β的分泌,从而缓解肝脏炎症和纤维化[28]。日本血吸虫卵抗原 (SEA) 诱导的巨噬细胞自噬能够抑制肝脏病理的发展[29]。白细胞介素7 (IL-7) 能够通过激活AMP活化蛋白激酶 (AMPK) 抑制SEA诱导的巨噬细胞自噬,促进炎症细胞对肝脏的浸润,增强MFBs活性,从而加重SEA感染引起的肝纤维化[30]。此外,LC3相关的吞噬作用 (LAP) 是一种非典型的自噬形式,能够将Ly6Chi MoMFs变为Ly6Clo MoMFs。研究表明,LAP可抑制全身炎症,发挥抗肝纤维化作用[31]。
吞噬作用是细胞摄取较大固体颗粒或大分子复合体的过程。肝巨噬细胞能够通过吞噬和清除肝脏中死亡的细胞调节肝脏炎症和纤维化。在肝损伤中,巨噬细胞能够吞噬坏死的肝细胞,诱导Wnt3a的表达并激活Wnt通路,从而促进肝再生。肝脏巨噬细胞的吞噬作用,减弱了受损肝细胞中线粒体衍生的DAMP的释放,从而抑制肝脏瘢痕的形成[32]。因此,调节肝巨噬细胞的自噬和吞噬功能可成为一种新的抗肝纤维化策略,值得进一步研究。
2.7 其他肝巨噬细胞在肝纤维化中的作用
除了KCs和MoMFs,其他浸润性巨噬细胞群也与肝纤维化有关。SOCS蛋白是巨噬细胞炎症活性的调节因子,在肝纤维化期间,脾巨噬细胞能够通过上调肝巨噬细胞中的SOCS3信号传导来促进CCL2的分泌,从而促进循环单核细胞的浸润,加剧肝纤维化的发展[33]。
2.8 其他机制
肝纤维化的发展与多种细胞和分子机制相关。除肝巨噬细胞外,HSCs、肝细胞、肝窦内皮细胞、胆管细胞和脾细胞也参与了肝纤维化的发展,这些细胞之间的相互作用,能够调控细胞内信号传导,从而影响肝纤维化进展和消退。此外,肝内肝窦的形成和重塑是肝纤维化的关键特征,抑制血管生成也能够减缓肝纤维化的进展。
3. 靶向肝巨噬细胞治疗肝纤维化
肝巨噬细胞在肝损伤、肝纤维化进展和消退中发挥双重作用。目前研究证实,多种药物能够通过调控肝巨噬细胞的功能发挥抗肝纤维化的作用。因此,基于巨噬细胞在肝纤维化中的作用,人们开发了相关的趋化因子抑制剂、细胞通路拮抗剂,期望为肝纤维化提供新的治疗策略。
3.1 临床前研究
3.1.1 巨噬细胞极化的调节
调节巨噬细胞极化可以治疗肝纤维化。例如,槲皮素能够调控Notch1通路,抑制M1型巨噬细胞极化,缓解炎症反应,从而抑制肝纤维化进展[34];壳寡糖能够通过调控JAK2/STAT1和JAK1/STAT6信号通路,抑制巨噬细胞极化为M1型,增加M2型巨噬细胞数量,从而发挥抗肝纤维化作用[35]。此外,研究还发现,在肝纤维化期间,脾切除能够激活ERK1/2信号通路,促进MOMFs转换为抗炎的Ly6CloMOMFs,从而减轻肝脏炎症和肝纤维化应答[36]。
3.1.2 抑制巨噬细胞的募集和浸润
抑制巨噬细胞募集和浸润有助于肝纤维化的消退。姜黄素能够通过抑制KCs的激活减少趋化因子分泌,降低Ly6ChiMOMFs的浸润,从而缓解肝纤维化[37]。鉴于CCL2/CCR2和CCL5/CCR5信号通路在巨噬细胞募集中的关键作用,人们研发出了相关的趋化因子受体拮抗剂,如CCR2拮抗剂RS102895、CCR2/CCR5双拮抗剂 (CVC) 。研究发现,在酒精性肝纤维化模型中,CVC能够明显抑制体内巨噬细胞的募集,展现出较好的的抗纤维化活性[38]。
3.1.3 诱导巨噬细胞自噬
巨噬细胞自噬是一种针对慢性肝损伤和纤维化的保护机制,通过诱导巨噬细胞自噬能够治疗肝纤维化。MJN110是一种单酰基甘油脂肪酶 (MAGL) 抑制剂,在CCl4和BDL诱导的肝纤维化模型中,MJN110的干预能够促使巨噬细胞自噬通量和自噬体生物合成增加、减少肝巨噬细胞数量,从而减缓肝纤维化进展,促进肝纤维化消退[39]。
3.2 临床研究
大多数基于肝巨噬细胞的疗法仅在肝纤维化的动物模型中进行了评估,而相关的临床研究数据较少。CVC是CCR2和CCR5双重拮抗剂,两项临床实验数据显示,CVC在伴有纤维化的NASH中具有显著的抗纤维化作用,并且耐受性良好[40]。此外,有研究人员在人体上进行了自体巨噬细胞治疗的安全性评估实验,结果表明,该疗法在肝硬化患者中是安全可行的,这为未来研究其在肝硬化和其他纤维化疾病中的疗效提供了依据[41]。
4. 结论与展望
肝纤维化是由各种病因所致慢性肝损伤的修复反应,其特征是ECM在肝内的过度沉积。鉴于肝巨噬细胞在调节肝纤维化反应中的关键作用,人们开发出了针对肝巨噬细胞治疗肝纤维化的新策略。基于抑制KCs活化的靶向疗法已被研究,这些疗法主要通过抑制细胞内炎症信号通路,如NF-κB、ASK1、JNK和p38等信号通路,从而治疗肝纤维化[42]。Loomba等人开发了Selonsertib,一种ASK1信号通路的抑制剂,研究证实,Selonsertib对肝细胞代谢和巨噬细胞活化有影响。在一项随机2期试验中,Selonsertib能够降低NASH和肝纤维化患者的肝脏中胶原蛋白含量和小叶炎症程度,并且能够改善肝细胞凋亡和坏死[43]。此外,肝纤维化治疗的重点是减少MoMFs向肝脏的募集。MoMFs向受损肝脏的募集依赖于活化的肝细胞分泌的几种趋化因子,如趋化因子配体1 (CCL1) ,CCL2,CCL5[44]。因此,调节趋化因子的信号传导也是一种治疗策略,这些疗法主要包括针对趋化因子或受体的单克隆抗体、阻止趋化因子结合的受体拮抗剂、适体分子和阻断趋化因子诱导的细胞内信号传导的小分子抑制剂等[5]。研究发现,使用CCR2敲除能够减弱小鼠MoMFs募集,抑制MFBs活化并减轻肝纤维化[45]。此外,MoMFs可分为导致肝脏损伤的Ly6Chi MOMFs和具有肝脏修复功能的Ly6Clo MOMFs。因此,另一种潜在的策略是通过将Ly6Chi MOMFs转换为Ly6Clo MOMFs来恢复正常的肝功能。研究证实,在CCl4诱导的肝纤维化模型和MCD饮食诱导的NASH模型中,CCL2抑制剂mNOX-E36能够抑制Ly6Chi MOMFs的早期流入,同时能够将Ly6Chi MOMFs转换为Ly6Clo MOMFs,促进肝纤维化的消退[46]。
尽管肝巨噬细胞在肝纤维化发病机制中的作用机制和相关治疗策略已经取得了突破性进展,然而,通过巨噬细胞靶向肝纤维化疗法仍然存在局限性。需要解决的问题如下:肝巨噬细胞的这些表型其临床意义是什么,是否有可能对肝巨噬细胞进行基因改造以解决肝纤维化,如何达到只靶向致病表型而不破坏正常的生理表型?此外,大多数关于肝巨噬细胞的作用和潜在机制的研究都是在啮齿动物模型中进行的,由于啮齿动物和人类之间的肝巨噬细胞存有差异,这些发现与人类的相关性仍需要进一步研究。
-
[1] TANG J, YU J X, HUBBARD-LUCEY V M, et al. Trial watch: the clinical trial landscape for PD1/PDL1 immune checkpoint inhibitors[J]. Nat Rev Drug Discov,2018,17(12):854-855. doi: 10.1038/nrd.2018.210 [2] CHIN M H W, GENTLEMAN E, COPPENS M O, et al. Rethinking cancer immunotherapy by embracing and engineering complexity[J]. Trends Biotechnol,2020,38(10):1054-1065. doi: 10.1016/j.tibtech.2020.05.003 [3] GIANNONE G, GHISONI E, GENTA S, et al. Immuno-metabolism and microenvironment in cancer: key players for immunotherapy[J]. Int J Mol Sci,2020,21(12):4414. doi: 10.3390/ijms21124414 [4] PATSOUKIS N, BROWN J, PETKOVA V, et al. Selective effects of PD-1 on Akt and Ras pathways regulate molecular components of the cell cycle and inhibit T cell proliferation[J]. Sci Signal,2012,5(230):ra46. [5] BOUSSIOTIS V A. Molecular and biochemical aspects of the PD-1 checkpoint pathway[J]. N Engl J Med,2016,375(18):1767-1778. doi: 10.1056/NEJMra1514296 [6] TAYLOR S, HUANG Y F, MALLETT G, et al. PD-1 regulates KLRG1+ group 2 innate lymphoid cells[J]. J Exp Med,2017,214(6):1663-1678. doi: 10.1084/jem.20161653 [7] OESTREICH K J, YOON H, AHMED R, et al. NFATc1 regulates PD-1 expression upon T cell activation[J]. J Immunol,2008,181(7):4832-4839. doi: 10.4049/jimmunol.181.7.4832 [8] MATHIEU M, COTTA-GRAND N, DAUDELIN J F, et al. Notch signaling regulates PD-1 expression during CD8(+) T-cell activation[J]. Immunol Cell Biol,2013,91(1):82-88. doi: 10.1038/icb.2012.53 [9] AUSTIN J W, LU P Y, MAJUMDER P, et al. STAT3, STAT4, NFATc1, and CTCF regulate PD-1 through multiple novel regulatory regions in murine T cells[J]. J Immunol,2014,192(10):4876-4886. doi: 10.4049/jimmunol.1302750 [10] STARON M M, GRAY S M, MARSHALL H D, et al. The transcription factor FoxO1 sustains expression of the inhibitory receptor PD-1 and survival of antiviral CD8+ T cells during chronic infection[J]. Immunity,2014,41(5):802-814. doi: 10.1016/j.immuni.2014.10.013 [11] BALLY A P R, LU P Y, TANG Y, et al. NF-κB regulates PD-1 expression in macrophages[J]. J Immunol,2015,194(9):4545-4554. doi: 10.4049/jimmunol.1402550 [12] KAO C, OESTREICH K J, PALEY M A, et al. Transcription factor T-bet represses expression of the inhibitory receptor PD-1 and sustains virus-specific CD8+ T cell responses during chronic infection[J]. Nat Immunol,2011,12(7):663-671. doi: 10.1038/ni.2046 [13] GARCIA-DIAZ A, SHIN D S, MORENO B H, et al. Interferon receptor signaling pathways regulating PD-L1 and PD-L2 expression[J]. Cell Rep,2017,19(6):1189-1201. doi: 10.1016/j.celrep.2017.04.031 [14] ABBASZADEH H, KEIKHAEI B, MOTTAGHI S. A review of molecular mechanisms involved in anticancer and antiangiogenic effects of natural polyphenolic compounds[J]. Phytother Res,2019,33(8):2002-2014. doi: 10.1002/ptr.6403 [15] COSTEA T, VLAD O C, MICLEA L C, et al. Alleviation of multidrug resistance by flavonoid and non-flavonoid compounds in breast, lung, colorectal and prostate cancer[J]. Int J Mol Sci,2020,21(2):401. doi: 10.3390/ijms21020401 [16] COOMBS M R P, HARRISON M E, HOSKIN D W. Apigenin inhibits the inducible expression of programmed death ligand 1 by human and mouse mammary carcinoma cells[J]. Cancer Lett,2016,380(2):424-433. doi: 10.1016/j.canlet.2016.06.023 [17] XU L, ZHANG Y, TIAN K, et al. Apigenin suppresses PD-L1 expression in melanoma and host dendritic cells to elicit synergistic therapeutic effects[J]. J Exp Clin Cancer Res,2018,37(1):261. doi: 10.1186/s13046-018-0929-6 [18] MAZEWSKI C, KIM M S, GONZALEZ DE MEJIA E. Anthocyanins, delphinidin-3-O-glucoside and cyanidin-3-O-glucoside, inhibit immune checkpoints in human colorectal cancer cells in vitro and in silico[J]. Sci Rep,2019,9(1):11560. doi: 10.1038/s41598-019-47903-0 [19] LIU X R, WANG L Y, JING N, et al. Biostimulating gut microbiome with bilberry anthocyanin combo to enhance anti-PD-L1 efficiency against murine colon cancer[J]. Microorganisms,2020,8(2):175. doi: 10.3390/microorganisms8020175 [20] WANG L Y, JIANG G Q, JING N, et al. Bilberry anthocyanin extracts enhance anti-PD-L1 efficiency by modulating gut microbiota[J]. Food Funct,2020,11(4):3180-3190. doi: 10.1039/D0FO00255K [21] DU G J, ZHANG Z Y, WEN X D, et al. Epigallocatechin Gallate (EGCG) is the most effective cancer chemopreventive polyphenol in green tea[J]. Nutrients,2012,4(11):1679-1691. doi: 10.3390/nu4111679 [22] RAWANGKAN A, WONGSIRISIN P, NAMIKI K, et al. Green tea catechin is an alternative immune checkpoint inhibitor that inhibits PD-L1 expression and lung tumor growth[J]. Molecules,2018,23(8):2071. doi: 10.3390/molecules23082071 [23] TOMEH M A, HADIANAMREI R, ZHAO X B. A review of curcumin and its derivatives as anticancer agents[J]. Int J Mol Sci,2019,20(5):1033. doi: 10.3390/ijms20051033 [24] LIAO F, LIU L, LUO E, et al. Curcumin enhances anti-tumor immune response in tongue squamous cell carcinoma[J]. Arch Oral Biol,2018,92:32-37. doi: 10.1016/j.archoralbio.2018.04.015 [25] ALVAREZ M, SIMONETTA F, BAKER J, et al. Indirect impact of PD-1/PD-L1 blockade on a murine model of NK cell exhaustion[J]. Front Immunol,2020,11:7. doi: 10.3389/fimmu.2020.00007 [26] MALAGUARNERA L. Influence of resveratrol on the immune response[J]. Nutrients,2019,11(5):946. doi: 10.3390/nu11050946 [27] GWAK H, KIM S, DHANASEKARAN D N, et al. Resveratrol triggers ER stress-mediated apoptosis by disrupting N-linked glycosylation of proteins in ovarian cancer cells[J]. Cancer Lett,2016,371(2):347-353. doi: 10.1016/j.canlet.2015.11.032 [28] VERDURA S, CUYÀS E, CORTADA E, et al. Resveratrol targets PD-L1 glycosylation and dimerization to enhance antitumor T-cell immunity[J]. Aging,2020,12(1):8-34. doi: 10.18632/aging.102646 [29] LIN C C, CHIN Y T, SHIH Y J, et al. Resveratrol antagonizes thyroid hormone-induced expression of checkpoint and proliferative genes in oral cancer cells[J]. J Dent Sci,2019,14(3):255-262. doi: 10.1016/j.jds.2019.01.013 [30] ZHANG Y K, YANG S F, YANG Y, et al. Resveratrol induces immunogenic cell death of human and murine ovarian carcinoma cells[J]. Infect Agents Cancer,2019,14(1):27. doi: 10.1186/s13027-019-0247-4 [31] FANG W F, ZHANG J W, HONG S D, et al. EBV-driven LMP1 and IFN-γ up-regulate PD-L1 in nasopharyngeal carcinoma: implications for oncotargeted therapy[J]. Oncotarget,2014,5(23):12189-12202. doi: 10.18632/oncotarget.2608 [32] QIN Y, QUAN H F, ZHOU X R, et al. The traditional uses, phytochemistry, pharmacology and toxicology of Dictamnus dasycarpus: a review[J]. J Pharm Pharmacol,2021,73(12):1571-1591. doi: 10.1093/jpp/rgab141 [33] KIM M J, KIM H. Anticancer effect of lycopene in gastric carcinogenesis[J]. J Cancer Prev,2015,20(2):92-96. doi: 10.15430/JCP.2015.20.2.92 [34] JIANG X F, WU H, ZHAO W, et al. Lycopene improves the efficiency of anti-PD-1 therapy via activating IFN signaling of lung cancer cells[J]. Cancer Cell Int,2019,19:68. doi: 10.1186/s12935-019-0789-y [35] HAN Z, LIU S, LIN H S, et al. Inhibition of murine hepatoma tumor growth by cryptotanshinone involves TLR7-dependent activation of macrophages and induction of adaptive antitumor immune defenses[J]. Cancer Immunol Immunother,2019,68(7):1073-1085. doi: 10.1007/s00262-019-02338-4 [36] GUO Y K, JI W, LU Y Y, et al. Triptolide reduces salivary gland damage in a non-obese diabetic mice model of Sjögren’s syndrome via JAK/STAT and NF-κB signaling pathways[J]. J Clin Biochem Nutr,2021,68(2):131-138. doi: 10.3164/jcbn.20-15 [37] LIANG M, FU J. Triptolide inhibits interferon-gamma-induced programmed death-1-ligand 1 surface expression in breast cancer cells[J]. Cancer Lett,2008,270(2):337-341. doi: 10.1016/j.canlet.2008.05.025 [38] ZHANG L, YU J S. Triptolide reverses helper T cell inhibition and down-regulates IFN-γ induced PD-L1 expression in glioma cell lines[J]. J Neurooncol,2019,143(3):429-436. doi: 10.1007/s11060-019-03193-0 [39] KUO C S, YANG C Y, LIN C K, et al. Triptolide suppresses oral cancer cell PD-L1 expression in the interferon-γ-modulated microenvironment in vitro, in vivo, and in clinical patients[J]. Biomed Pharmacother,2021,133:111057. doi: 10.1016/j.biopha.2020.111057 [40] LEE J, HAN Y, WANG W Y, et al. Phytochemicals in cancer immune checkpoint inhibitor therapy[J]. Biomolecules,2021,11(8):1107. doi: 10.3390/biom11081107 [41] YIM N H, KIM Y S, CHUNG H S. Inhibition of programmed death receptor-1/programmed death ligand-1 interactions by ginsenoside metabolites[J]. Molecules,2020,25(9):2068. doi: 10.3390/molecules25092068 [42] JIANG Z S, YANG Y F, YANG Y L, et al. Ginsenoside Rg3 attenuates cisplatin resistance in lung cancer by downregulating PD-L1 and resuming immune[J]. Biomed Pharmacother,2017,96:378-383. doi: 10.1016/j.biopha.2017.09.129 [43] HU M L, YANG J, QU L L, et al. Ginsenoside Rk1 induces apoptosis and downregulates the expression of PD-L1 by targeting the NF-κB pathway in lung adenocarcinoma[J]. Food Funct,2020,11(1):456-471. doi: 10.1039/C9FO02166C [44] WANG Z, LI M Y, ZHANG Z H, et al. Panaxadiol inhibits programmed cell death-ligand 1 expression and tumour proliferation via hypoxia-inducible factor (HIF)-1α and STAT3 in human colon cancer cells[J]. Pharmacol Res,2020,155:104727. doi: 10.1016/j.phrs.2020.104727 -





 下载:
下载:
 下载:
下载: