-
海马为海龙科动物线纹海马(Hippocampus kelloggi Jordan et Snyder)、刺海马(H. histrix Kaup)、大海马(H. kuda Bleeker)、三斑海马(H. trimaculatus Leach)或小海马(海蛆)(H. japonicus Kaup)的干燥体。性温,味甘、咸,归肝、肾经,具有温肾壮阳,散结消肿的功效[1]。现代研究表明,海马含有氨基酸、甾体、脂肪酸、微量元素和磷脂等化学成分,具有抗炎、抗氧化、抗肿瘤、性激素样作用和增强机体免疫力等多种药理活性[2]。目前,我国中药材市场上的海马品种众多,且不同品种的海马化学成分和药理作用存在差异,因此深入研究不同品种海马的外观及内在差异,使海马资源得到合理利用显得十分重要。何旭辉等[3]发现不同品种海马在鳃盖的嵴纹和头冠处有较明显的区别,使用微性状鉴别法能够简单快捷的区分出不同品种的海马。陈璐[4]通过海马的本草考证、鉴别及药用品种、化学成分检查项等研究,建立了稳定可控的海马质量评价方法,为《中国药典》中海马内容的补充提供了参考依据。闫珍珍等[5]从营养价值和功能性成分方面分析,三斑海马具有高蛋白、低脂肪的特征,且雌海马氨基酸营养价值优于雄性;除尿苷含量低于雄性外,雌海马的胆甾醇和次黄嘌呤含量均高于雄性,该研究发现为特异性开发海马产品提供了科学依据。陈梦等[6]使用DNA条形码分子鉴定技术表明COI、16 S rRNA、ATP6序列作为条形码均可以鉴定三斑海马及其他混伪品海马药材,为保障海马临床用药安全提供了新的技术手段。三斑海马作为我国较为常见的一种海马,资源丰富,在浙江、广东、海南等沿海地区均有分布[7]。为进一步明确三斑海马的化学成分,更合理地开发利用海马资源,本文以三斑海马为研究对象,对其化学成分进行研究,从三斑海马乙醇提取物中分离鉴定了8个化合物(图1),分别为:L-苯丙氨酸(化合物1,图1A)、丙氨酸(化合物2,图1B)、肌苷(化合物3,图1C)、胆固醇(化合物4,图1D)、N-乙酰基酪胺(化合物5,图1E)、尿嘧啶(化合物6,图1F)、D-甘露醇(化合物7,图1G)、河豚素(化合物8,图1H)。其中,N -乙酰基酪胺 、D-甘露醇、河豚素为首次从三斑海马中分离得到。
-
实验用海马药材购自安徽亳州药材市场,经海军军医大学辛海量教授鉴定为海龙科动物三斑海马(Hippocampus trimaculatus Leach)的干燥体。
-
Bruker DRX-600 MHz 核磁共振仪(TMS内标,德国Bruker公司);1290高效液相色谱仪(美国Agilent公司);柱层析硅胶、GF254薄层色谱硅胶(青岛海洋化工厂);Sephadex LH-20葡聚糖凝胶(GE Pharmacia公司);ACE 3 C18-PFP色谱柱(3.0 mm×150 mm, 3.0 μm, 美国Agilent公司);其余试剂为分析纯。
-
干燥三斑海马药材1.74 kg,剪碎后10倍量95%乙醇浸泡过夜,85 ℃加热回流提取3次,每次2 h,10倍量70%乙醇加热回流提取2次,每次2 h,合并提取液,65 ℃减压浓缩至无醇味。提取物经硅胶柱色谱分离,依次用石油醚、石油醚-乙酸乙酯(20:1、10:1、5:1)、乙酸乙酯、乙酸乙酯-甲醇(10:1、5:1、1:1)、甲醇洗脱,薄层色谱检测,合并相同流份后,得到H-1~H-9共9个组分。
H-1~H-3组分合并后经硅胶柱色谱(乙酸乙酯-甲醇 10:1、5:1、2:1)分离,葡聚糖凝胶柱色谱纯化得到化合物1(11 mg)。H-4~H-6组分合并,经硅胶柱色谱(石油醚-乙酸乙酯 10:1、5:1、1:1)分离,合并较纯斑点,再经反相C18柱,葡聚糖凝胶柱色谱(40%甲醇)纯化2次,硅胶柱色谱分离得到化合物2 (19 mg)和 化合物3(39 mg)。H-7和H-8组分合并后甲醇溶解,溶解部分经反相C18柱分离,收集7-1至7-7共7个组分。7-1经硅胶柱色谱(乙酸乙酯-甲醇 1:1)分离,反相体系分离,葡聚糖凝胶柱色谱(40%甲醇)纯化2次,再经硅胶柱色谱纯化,培养结晶析出白色固体,得到化合物8(9 mg)。7-2经硅胶柱色谱(乙酸乙酯-甲醇1:1)分离,葡聚糖凝胶柱色谱(45%甲醇)纯化2次,得到化合物4(15 mg)和化合物5(7 mg)。7-4经硅胶柱色谱(乙酸乙酯-甲醇 1:1)分离,再经反相C18柱色谱(10%甲醇),葡聚糖凝胶柱色谱,硅胶柱色谱(二氯甲烷-甲醇 2:1)纯化,得到化合物7(6 mg)。H-9组分经硅胶柱色谱(乙酸乙酯-甲醇 1:1),反相C18柱色谱(10%甲醇),葡聚糖凝胶柱色谱分离后,合并较纯斑点,析出固体过滤,得到化合物6(9 mg)。三斑海马提取分离过程见图2。
-
化合物1为白色粉末,分子式为C9H11NO2。1H NMR (600 MHz, D2O) δ : 7.38 (2H, dd, J=7.4, 6.8 Hz, H-3', 5'), 7.33 (1H, t, J=6.9 Hz, H-4'), 7.27 (2H, dd, J=7.4, 6.8 Hz, H-2', 6'), 3.93 (1H, dd, J=7.9, 5.2 Hz, H-2), 3.24 (1H, m, H-3a), 3.06 (1H, m, H-3b); 13C NMR (150 MHz, D2O) δ : 36.4 (C-3), 56.1 (C-2), 127.7 (C-4′), 129.1 (C-3′, 5′), 129.4 (C-2′, 6′), 135.1 (C-1′), 173.9 (C-1)。该化合物核磁共振数据与参考文献[8]基本一致,确定化合物为L-苯丙氨酸(L-phenylalanine)。
化合物2为白色固体,分子式为C3H7NO2。1H NMR (600 MHz, D2O) δ : 3.70 (1H, q, J=6.4 Hz, H-2), 1.40 (3H, d, J=6.4 Hz, H-3); 13C NMR (150 MHz, D2O) δ : 16.1 (C-3), 50.6 (C-2), 175.8 (C-1)。该化合物核磁共振数据与参考文献[9]基本一致,确定化合物为丙氨酸(alanine)。
化合物3为白色固体,分子式为C10H12N4O5。1H NMR (600 MHz, D2O) δ : 3.76 (1H, m, H-5'), 3.54 (1H, m, H-5'), 4.21 (1H, m, H-3'), 4.36 (1H, m, H-2'), 6.00 (1H, d, J=5.7 Hz, H-1'), 8.12 (1H, s, H-2), 8.24 (1H, s, H-8); 13C NMR (150 MHz, D2O) δ : 61.3 (C-5′), 70.4 (C-3′), 74.1 (C-2′), 85.5 (C-4′), 88.4 (C-1′), 124.2 (C-5), 140.2 (C-2), 146.1 (C-8), 148.4 (C-4), 158.4 (C-6)。该化合物核磁共振数据与参考文献[10]基本一致,确定化合物为肌苷(inosine)。
化合物4为针状结晶,分子式为C27H46O。1H NMR (600 MHz, CDCl3) δ : 5.37 (1H, m, H-6), 3.55 (1H, m, H-3), 0.68 (3H, s, H-18); 13C NMR (150 MHz, CDCl3) δ : 11.9 (C-18), 18.7 (C-21), 19.4 (C-19), 21.1 (C-11), 22.5 (C-26), 22.8 (C-27), 23.8 (C-15), 24.3 (C-23), 28.0 (C-25), 28.2 (C-12), 29.7 (C-2), 31.7 (C-8), 31.9 (C-7), 35.8 (C-20), 36.2 (C-22), 36.5 (C-10), 37.3 (C-1), 39.5 (C-24), 39.8 (C-16), 42.3 (C-13), 42.3 (C-4), 50.2 (C-9), 56.2 (C-17), 56.8 (C-14), 71.8 (C-3), 121.7 (C-6), 140.8 (C-5)。该化合物核磁共振数据与参考文献[11]基本一致,确定化合物为胆固醇(cholesterol)。
化合物5为褐色固体,分子式为C10H13NO2。1H NMR (600 MHz, DMSO-d6) δ : 6.96 (2H, d, J=1.8 Hz, H-2, 6), 6.68 (2H, d, J=1.8 Hz, H-3, 5), 2.73 (2H, m, H-8), 2.55 (2H, m, H-7), 1.74 (3H, s, CH3); 13C NMR (150 MHz, DMSO-d6) δ : 24.6 (CH3), 38.2 (C-7), 43.6 (C-8), 115.6 (C-3, 5), 129.8 (C-2, 6), 156.4 (C-4), 176.7 (C-10)。该化合物核磁共振数据与参考文献[12]基本一致,确定化合物为N-乙酰基酪胺(N-acetyltyramine)。
化合物6为类白色固体,分子式为C4H4N2O2。1H NMR (600 MHz, DMSO-d6) δ : 5.45 (1H, d, J=7.5 Hz, H-5), 7.40 (1H, d, J=7.5 Hz, H-6), 10.81 (1H, br s, NH), 11.00 (1H, br s, NH); 13C NMR (150 MHz, DMSO-d6) δ : 100.7 (C-5), 142.6 (C-6), 151.9 (C-2), 164.8 (C-4)。该化合物核磁共振数据与参考文献[13]基本一致,确定化合物为尿嘧啶(uracil)。
化合物7为白色固体,分子式为C6H14O6。1H NMR (600 MHz, D2O) δ : 3.80 (2H, m), 3.73 (2H, m), 3.70 (2H, m), 3.61 (2H, m); 13C NMR (150 MHz,D2O) δ : 63.2 (C-1, 6), 69.3 (C-3, 4), 70.9 (C-2, 5)。该化合物核磁共振数据与参考文献[14]基本一致,确定化合物为D-甘露醇(D-mannitol)。
化合物8为白色固体,分子式为C4H8SO2Cl2。1H NMR (600 MHz, DMSO-d6) δ : 3.36 (2H, t, J=6.6 Hz), 3.19 (2H, t, J=6.6 Hz); 13C NMR (150 MHz, DMSO-d6) δ : 35.4, 47.5。该化合物核磁共振数据与参考文献[15]基本一致,确定化合物为河豚素 (tetrodoine)。
-
近年来,海洋生物因其次生代谢产物具有独特的结构骨架和特殊的药理活性受到了广泛关注,海马作为常见的海洋动物,同时也是经济价值较高的名贵中药,药用历史悠久、疗效显著,备受关注。研究发现,海马中含有多种化学成分,包括胆固醇、胆甾-4-烯-3-酮、胆甾-5-烯-3β, 7α-二醇等甾体化合物;苯丙氨酸、丙氨酸、鸟氨酸、牛磺酸等多种氨基酸;SHP-1、HTP-1、HKPLP等多肽类成分;十四酸、EPA、DHA等脂肪酸类成分,以及核酸类、糖蛋白、肌酸酐等。药理研究表明,海马提取物可改善肾阳虚模型动物的体征,提高性激素水平;可通过调节NF-κB和MAPK信号通路抑制炎症因子的释放从而发挥抗炎作用;可通过清除自由基发挥抗氧化作用;还可增强小鼠巨噬细胞的吞噬能力,提高免疫力等;此外,海马提取物对骨质疏松的防治具有一定的作用,为动物药抗骨质疏松研究提供了新方向[2,7,16-19]。
本研究从三斑海马中分离得到了8个化合物,其中N-乙酰基酪胺、D-甘露醇、河豚素为首次从三斑海马中分离得到,进一步明确了三斑海马的化学成分。赵晓喆等[20]采用核磁代谢组学技术在三斑海马甲醇提取物中指认出33种化学成分,其中包括丙氨酸、苯丙氨酸和肌苷。陈璐[4]通过HPLC-MS分析得到海马化学成分中含有核酸类成分3种,即尿嘧啶、次黄嘌呤、黄嘌呤;此外,从海马中分离鉴定出的甾体类化合物以胆固醇为主,占总胆甾醇的59.02%~95.99%。José等[21]从溶藻弧菌的菌株M3-10中分离到了N-乙酰基酪胺,发现其具有较高的细菌群体感应抑制剂的活性,并且N-乙酰基酪胺可逆转阿霉素耐药白血病P388细胞的耐药性[22],提示在中药海马中N-乙酰基酪胺可能通过独特的途径参与发挥抗菌抗炎作用。甘露醇是临床常用的脱水剂,在治疗脑水肿、降低颅内压等方面发挥重要作用,具有清除自由基、抗氧化等活性[23],可能参与中药海马的抗氧化过程。基于海马显著的药效活性,深入探究海马的药效物质基础,对中药海马进一步的开发和应用具有非常重要的意义。
Study on chemical constituents of Hippocampus trimaculatus Leach
-
摘要:
目的 研究三斑海马的化学成分。 方法 采用乙醇提取和硅胶柱色谱、Sephadex LH-20葡聚糖凝胶柱色谱、反相C18柱色谱等方法对三斑海马化学成分进行分离纯化,通过理化性质、波谱数据和文献对比,对得到的化合物进行结构鉴定。 结果 从三斑海马中分离得到8个化合物,分别鉴定为:L-苯丙氨酸(1)、丙氨酸(2)、肌苷(3)、胆固醇(4)、N-乙酰基酪胺(5)、尿嘧啶(6)、D-甘露醇(7)、河豚素(8)。 结论 化合物5、7、8为首次从三斑海马中分离得到。 Abstract:Objective To study the chemical constituents of Hippocampus trimaculatus Leach. Methods After extracted with ethanol, Hippocampus trimaculatus Leach was isolated and purified by silica gel column chromatography, Sephadex LH-20 gel column chromatography, and reversed-phase C18 column chromatography. The structures of compounds were identified by physical and chemical properties, spectral data and literature comparison. Results Eight compounds were isolated from Hippocampus trimaculatus Leach and identified as L-phenylalanine (1), alanine (2), inosine (3), cholesterol (4), N-acetyltyramine (5), uracil (6), D-mannitol (7), tetrodoine (8), respectively. Conclusion Compounds 5, 7, 8 are isolated from Hippocampus trimaculatus Leach for the first time. -
在全球范围内,缺血性脑卒中(IS)仍然是导致死亡和严重残疾的最主要原因之一[1]。在IS的治疗过程中,除因出血风险而存在禁忌外,几乎所有IS的患者都应给予抗血小板药物进行二次卒中预防[2], 阿司匹林联合氯吡格雷的双重抗血小板治疗在IS发病早期发挥着重要作用[3]。然而临床应用中,脑血管病患者在服用氯吡格雷药物治疗期间存在个体差异,一些患者在服药后出现了病情反复发作或者病情加重的现象,称为氯吡格雷抵抗(CR)[4]。研究表明,导致氯吡格雷抵抗的因素是多种多样的,尚无统一的结论。包括性别[5-6]、年龄[6]、BMI[6-7]、糖尿病[5,8]、高脂血症[8]、高同型半胱氨酸[5,8]、药物间相互作用[8](钙离子拮抗剂、质子泵抑制剂)、遗传基因多态性[9-10](参与氧化代谢的相关基因CYP2C19、与其活化有关基因ABCB1)等均会导致该药物出现抵抗现象。但亦有部分研究报道得出相反结论[11]。且研究主要集中于心血管领域,尤其是经皮冠状动脉介入(PCI)术后患者,而针对IS患者发生CR影响因素的报道相对较少。氯吡格雷属于噻吩吡啶类化学衍生物,需要在多种酶的参与下才能够生成有活性的化合物,该活性代谢产物与血小板上的二磷酸腺苷(ADP)受体P2Y12共价特异性地结合,减少ADP所刺激的血小板凝聚,阻断ADP诱导的糖蛋白与纤维蛋白原PIIb/IIIa 受体的结合,发挥抗栓的效应[12-13]。故本研究利用血栓弹力图(TEG)测定ADP数值,对脑卒中患者的基线资料及CYP2C19基因多态性进行统计分析,评估产生CR现象的影响因素,为IS临床个体化用药、预测卒中复发风险提供精准医疗方案。
1. 材料和方法
1.1 研究对象
本研究利用HIS系统选取2021年4月至2022年7月在中部战区总医院神经内科住院治疗的IS患者。(1)纳入标准:①符合《中国脑急性缺血性脑卒中诊治指南》[14]或IS的相关诊断,且经CT或MRI影像学等证实;②年龄均>18岁;③未进行静脉溶栓或取栓治疗;④均采用氯吡格雷联合阿司匹林进行抗血小板治疗。(2)排除标准:①存在出血性疾病或颅内感染者;②合并恶性肿瘤或严重心、肝、肺、肾脏器官功能衰竭者;③有认知障碍者;④依从性差者;⑤对本研究药物过敏者。该研究已获得中部战区总医院医学伦理委员会审查批准,审查号:[2021]025-01。
1.2 治疗方法
所有入组患者入院后均给予改善循环(银杏达莫)、稳定血斑块(阿托伐他汀)、护胃(泮托拉唑)等常规治疗。在常规治疗基础上给予阿司匹林(拜耳医药保健有限公司,国药准字:J20171021,规格:100 mg/片)100 mg每日一次和硫酸氢氯吡格雷[赛诺菲(杭州)制药有限公司,国药准字:H20056410,规格:75 mg/片]75 mg 每日一次,均为3个月一个疗程。同时根据基础疾病给予降血压、降血糖及调血脂治疗。
1.3 资料收集
收集所有入组患者的基线资料,包括姓名、性别、年龄、既往有无高血压病、糖尿病、冠心病、高脂血症、吸烟史(戒烟小于5年)、饮酒史(戒酒小于5年)、既往有无缺血性脑卒中病史及患者住院期间合并用药等。记录患者在住院后次日清晨空腹采集的静脉血各项检验指标,包括血常规、肝肾功能、凝血功能等。
1.4 TEG及相关参数测定
患者在服用阿司匹林联合氯吡格雷药物7~14 d,空腹采集静脉血,分别注射入柠檬酸钠抗凝管1和肝素抗凝管2中。利用TEG-5000型TEG凝血分析仪(美国Haemoscope公司)检测柠檬酸-高岭土样品,得出ADP抑制率。将血小板聚集抑制率>30%定义为氯吡格雷非抵抗,血小板聚集抑制率≤30%定义为氯吡格雷抵抗[15]。
1.5 CYP2C19 基因检测
患者入院后次日清晨空腹抽取静脉血4 ml于EDTA抗凝管中,利用全自动杂交仪系统(BR-526-24,上海百傲科技公司)对CYP2C19*1、CYP2C19*2及CYP2C19*3位点进行检测。该检测过程主要包括全血DNA的提取、PCR扩增、芯片杂交显色,利用基因芯片识读仪自动读取结果。根据CYP2C19基因多态性进行药物代谢分组[16],即:快代谢组:EM,CYP2C19*1*1,中代谢组:IM,CYP2C19*1*2、CYP2C19*1*3,慢代谢组:PM,CYP2C19*2*2、CYP2C19*2*3、CYP2C19*3*3。
1.6 统计学方法
采用SPSS 26.0统计软件进行数据分析,计量资料服从正态分布,采用(
$\bar x $ ±s)表示,组间比较采用独立样本t检验。若计量资料属于非正态分布,则以中位数和四分位数[M(P25,P75)]表示,组间比较采用Mann-Whitney U检验。计数资料以例数和百分比[例(%)]表示,组间比较采用χ2检验,将IS患者发生氯吡格雷抵抗的影响因素进一步进行多因素Logisti回归分析,以P<0.05为差异有统计学意义。2. 结果
2.1 基线资料分析
本研究共纳入缺血性脑卒中患者202例,年龄35~86岁,其中,CR组87例,NCR组115例,CR组患者合并糖尿病的比例明显高于NCR组,差异有统计学意义(P<0.05)。在性别、年龄、吸烟、饮酒、既往有无缺血性脑卒中、高血压病、冠心病、高脂血症及合并用药方面,两组间差异均无统计学意义(P>0.05),见表1。
表 1 抵抗组和非抵抗组患者基线资料比较基本信息参数 CR组(n=87,%) NCR组(n=112,%) x2/t P 年龄 64.52±1.07 62.39±0.97 −1.47 0.14 性别(男) 65(74.7) 86(74.8) 0.00 0.99 吸烟史 43(49.4) 56(48.7) 0.11 0.92 饮酒史 37(42.5) 41(35.7) 0.99 0.32 IS既往史 16(18.4) 22(19.1) 0.02 0.89 高血压 83(95.4) 106(92.2) 0.41 0.53 糖尿病 35(40.2) 22(19.6) 10.15 0.03 冠心病 7(8.0) 10(8.7) 0.03 0.87 高脂血症 40(46.0) 56(48.7) 0.15 0.70 合并用药 质子泵抑制剂 61(70.1) 84(73.0) 0.21 0.67 丁苯酞注射液 67(77.0) 83(72.2) 0.61 0.44 2.2 实验室检验指标分析
氯吡格雷抵抗组血常规的白细胞计数水平高于非抵抗组,且组间差异有统计学意义(P<0.05)。两组患者红细胞、血红蛋白、血小板计数、凝血酶原时间、D-二聚体、血糖、总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白、超敏C反应蛋白、血同型半胱氨酸、直接胆红素、总胆红素、谷草转氨酶、谷丙转氨酶的组间差异均无统计学意义(P>0.05),见表2。
表 2 两组患者实验室检测指标比较检测项目 抵抗组(n=87) 非抵抗组(n=115) 检验值 P 白细胞 6.70(5.60,8.40) 6.40(5.30,7.30) 2.14b 0.03 红细胞 4.56±0.34 4.44±0.05 −0.40a 0.69 血红蛋白 131(119,139) 134(120,143) −1.15b 0.11 血小板 187(148,227) 206(138,232) −1.62b 0.08 凝血酶原时间 11.21±0.65 11.18±0.85 −0.32a 0.92 D-二聚体 0.30±0.07 0.29±0.09 −0.78a 0.44 血糖 6.03±0.22 6.45±0.21 1.33a 0.18 总胆固醇 4.37(3.72,5.04) 4.32(3.73,5.05) −0.19b 0.85 甘油三酯 1.81±0.13 1.75±0.11 −0.36a 0.72 高密度脂蛋白 1.19(0.99,1.35) 1.14(1.00,1.32) −1.07b 0.29 低密度脂蛋白 2.41(1.94,2.80) 2.27(1.87,2.75) −0.50b 0.62 超敏C反应蛋白 1.91(1.04,5.40) 1.76(0.84,3.50) 1.65b 0.09 血同型半胱氨酸 17.32±1.18 15.81±0.61 −1.22a 0.23 直接胆红素 3.32±1.25 3.79±0.33 1.47a 0.14 总胆红素 13.33±0.47 13.71±0.42 0.60a 0.54 谷草转氨酶 23.00(19.00,28.00) 22.00(18.00,27.00) −0.89b 0.37 谷丙转氨酶 22.00(17.00,31.00) 21.00(15.00,28.79) −1.42b 0.15 注: a为 χ2 值,b为z值。 2.3 CYP2C19基因多态性分布
入选的202名患者中,CYP2C19 *1、CYP2C19 *2及CYP2C19*3等位基因的频率分别为62.26%、33.17%及4.21%,所有基因位点均符合Hardy-Weinberg平衡定律,差异无统计学意义(P>0.05),表明该群体具有代表性,详见表3。
表 3 202例IS患者 CYP2C19 基因型及等位基因的频率分布CYP2C19等位基因 等位基因数/个 基因频率/% CYP2C19 *1 253 62.62 CYP2C19 *2 134 33.17 CYP2C19 *3 17 4.21 2.4 不同CYP2C19代谢类型患者发生氯吡格雷抵抗的比较
CYP2C19 IM组患者发生氯吡格雷抵抗的比例显著高于EM组和PM组,差异具有统计学意义(P>0.05),见表4。
表 4 不同CYP2C19代谢类型的CR发生率比较(n,%)CYP2C19
代谢类型氯吡格雷
抵抗[n(%)]非氯吡格雷
抵抗[n(%)]χ2 p EM 24(27.59) 56(48.70) 9.95 0.007 IM 50(57.47) 43(37.39) PM 13(14.94) 16(13.91) 2.5 CYP2C19不同基因型血小板抑制率的比较
3组IS患者中ADP抑制率均不符合正态分布,因此采用非参数检验。EM组ADP抑制率的中位数为39.6%,IM组为26.10%,PM组为31.95%。3组血小板抑制率中位数差异具有统计学意义(P<0.05);两两比较,IM组的血小板抑制率明显低于EM组,差异具有统计学意义(P<0.05);其他组间差异无统计学意义(P>0.05),详见表5。
表 5 不同基因型血小板抑制率的比较CYP2C19基因分组 基因型数/个 血小板抑制率/% EM 39.60(26.20,53.95) CYP2C19*1*1 80 IM 26.10(15.20,53.60)* CYP2C19*1*2 81 CYP2C19*1*3 12 PM 31.95(20.65,65.40) CYP2C19*2*2 24 CYP2C19*2*3 5 χ2 6.31 P 0.04 注:3组间比较采用 Kruskal-Wallis H检验;两两比较采用 Mann- Whitney U检验;* P<0.05,与EM组比较。 2.6 发生氯吡格雷抵抗的危险因素分析
以发生CR作为因变量,将上述研究中存在统计学差异(P<0.05)的项目作为自变量进行赋值,包括合并糖尿病(未合并糖尿病者赋值0,合并糖尿病者赋值1)、CYP2C19代谢类型(IM赋值1,其余赋值0),白细胞计数为连续型数值变量,纳入二元Logistic回归模型中进行分析。结果显示,合并糖尿病、高白细胞计数水平、CYP2C19中代谢型为发生氯吡格雷抵抗的独立危险因素,见表6。
表 6 发生氯吡格雷抵抗危险因素的Logistic回归分析结果因素 B SE Wald P OR 95%CI 合并糖尿病 0.595 0.227 4.496 0.026 0.851 (0.707,1.191) 白细胞计数 0.211 0.076 7.774 0.005 1.235 (1.065,1.432) CYP2C19
中代谢型0.901 0.291 9.565 0.002 0.368 (0.197,0.686) 3. 讨论
氯吡格雷是继阿司匹林后在心脑血管中被广泛使用的抗血小板药物。有报道表明氯吡格雷联合阿司匹林在治疗缺血性脑卒中疗效优于单独使用阿司匹林,且不会增加脑卒中患者发生出血的风险[3,17]。在临床应用中仍有一些患者在服用氯吡格雷后,不能够抑制ADP诱导的血小板凝聚,也称为氯吡格雷抵抗或者氯吡格雷低反应性[4]。目前国际上关于氯吡格雷抵抗的诊断并无确切的标准[18],有文献称化学比浊法属于比较经典的血小板功能检测方法,但是由于在操作过程中步骤比较繁多且尚无统一的标准化流程,现已逐渐被其它检测方法所取代[19]。有国外研究报道将床旁快速血小板分析(Verify Now)检测系统的检测结果定义为“金标准”,但是由于该检测方法成本较高,因此在国内临床中并没有被大规模应用。而现在国内较常使用的抗血小板效果的监测方法有TEG、血小板分析仪、PL-11等,TEG检测血小板功能操作便捷、迅速、受外界影响较小等优点,现已在临床中被广泛使用[20]。
氯吡格雷本身属于无活性的前体药物,需在多种酶的参与下生成有活性的化合物,才能发挥抑制血小板聚集作用。细胞色素P450酶参与了两步氧化代谢过程。国外有研究报道[21]CYP2C19*2、CYP2C19*3等位基因的突变主要以亚洲人为主,发生在非洲和欧洲的突变率较低,携带CYP2C19*2、CYP2C19*3基因的突变可降低细胞色素P450酶的活性,使得活性代谢物的水平减少,从而导致该药物的临床疗效不佳,所以IM和PM组氯吡格雷抗血小板活性会受到CYP2C19基因多态性的影响。本研究结果显示,CYP2C19 IM组患者发生氯吡格雷抵抗的比例显著高于EM组和PM组,血小板抑制率明显低于EM组,差异均具有统计学意义,而PM组血小板抑制率虽然低于EM组,但差异无统计学意义,可能是PM组(14.36%)人群占比显著低于IM组(46.04%)和EM组(39.60%)造成的。
目前已有研究表明糖尿病患者在服用氯吡格雷后血小板抑制率较差[22-23],但其机制尚不明确。在小鼠模型中的研究结果表明,高血糖可以通过下调CYP酶影响氯吡格雷药物活化,从而导致抗血小板浓度降低[24]。Angiolillo等[25]针对冠心病合并2型糖尿病患者诱导的血小板抑制率减弱的研究中,解释其原因可能是长期的高血糖水平使血小板信号通路上调降低了抗血小板药物的药效,从而导致药物抵抗的发生。此外,糖尿病会影响肝脏代谢与胃肠道吸收,这可能会影响药物的吸收和代谢[26]。本研究结果也显示,合并糖尿病是发生氯吡格雷抵抗的独立风险因素。
本研究结果还表明高白细胞计数可能是IS患者发生CR的独立危险因素(OR=1.235,95% CI:1.065,1.432),但目前在IS患者中有关白细胞计数与CR之间关系的研究较少。有研究发现炎症标志物升高增加心血管事件的风险,血小板聚集和炎性因子之间的相互作用在急性冠脉综合征中起着非常重要的作用,而炎症调节越来越被认为是当代的治疗靶点,接受氯吡格雷联合阿司匹林双重抗血小板治疗的急性冠状动脉综合征的患者中,白细胞计数与临床疗效密切相关[27]。也有研究者在冠心病患者中发现白细胞中的3个长链非编码RNA与CR的发生有关[28]。IS随着细胞死亡和脑组织受损,分子危险信号通过激活更多的小胶质细胞和浸润白细胞进行前馈反应,释放更多的具有促炎作用的细胞因子。炎症加剧了脑细胞受损程度,使外周血中释放更多的细胞因子,这些细胞因子参与了脑卒中的进展,影响其预后[29-30]。因此,在临床中,高白细胞计数患者服用氯吡格雷时应警惕CR的发生。
本研究的局限性主要包括以下几点:①样本量相对较少;②TEG检测过程中受血凝速度、红细胞聚集状态等因素影响;③患者服药7~14 d只检测1次ADP抑制率,不能反应整体水平;④未直接检测血浆氯吡格雷及其活性代谢物水平。上述因素可能对研究结果产生偏倚,今后还需要进一步的验证。
-
[1] 国家药典委员会. 中华人民共和国药典(一部)2020年版 [S]. 北京: 中国医药科技出版社, 2020: 305. [2] 陈梦, 陈建真, 葛宇清, 等. 海马化学成分及药理活性研究进展[J]. 中草药, 2017, 48(19): 4089-4099. doi: 10.7501/j.issn.0253-2670.2017.19.029 [3] 何旭辉, 张成中, 黄宝康, 等. 以微观性状鉴别为基础的海马分类研究[J]. 中国海洋药物, 2021, 40(4): 18-26. doi: 10.13400/j.cnki.cjmd.2021.04.003 [4] 陈璐. 中药海马的鉴别与质量标准研究 [D]. 上海: 第二军医大学, 2015. [5] 闫珍珍, 张东, 林听听, 等. 雌雄灰海马和三斑海马营养价值与功能性成分对比分析[J]. 食品科学, 2019, 40(16): 206-212. doi: 10.7506/spkx1002-6630-20180920-234 [6] 陈梦, 朱玲燕, 黄真, 等. 三斑海马及其混伪品的DNA条形码分子鉴定研究[J]. 中草药, 2019, 50(22): 5554-5562. doi: 10.7501/j.issn.0253-2670.2019.22.025 [7] 闫珍珍. 灰海马和三斑海马生物化学成分的化学生态学初步研究 [D]. 上海: 上海海洋大学, 2019. [8] 蔡健, 梁曼颖, 王健娇, 等. 长棘海星中含氮类化学成分研究[J]. 中国海洋药物, 2021, 40(4): 45-49. doi: 10.13400/j.cnki.cjmd.2021.04.007 [9] 吕娜, 沈连刚, 李广志, 等. 康复新液化学成分研究[J]. 中国现代中药, 2017, 19(4): 488-490. doi: 10.13313/j.issn.1673-4890.2017.4.003 [10] 高允, 梁柳春, 王瑞, 等. 美洲大蠊化学成分的研究[J]. 中成药, 2018, 40(2): 375-378. doi: 10.3969/j.issn.1001-1528.2018.02.025 [11] 荆文光, 符江, 刘玉梅, 等. 水蛭的化学成分[J]. 中国实验方剂学杂志, 2014, 20(19): 120-123. doi: 10.13422/j.cnki.syfjx.2014190120 [12] WU L X, XU X D, CHEN X, et al. Indole and tyramine alkaloids produced by an endophytic actinomycete associated with Artemisia annua [J]. Chem Nat Compd, 2017, 53(5): 999-1001. doi: 10.1007/s10600-017-2184-z [13] 罗萍, 舒燕, 朱丽, 等. 黄草乌内生真菌接骨木镰孢菌B10.2次生代谢产物研究[J]. 天然产物研究与开发, 2020, 32(6): 1000-1005. doi: 10.16333/j.1001-6880.2020.6.013 [14] Lodonjav M, 罗国勇, 周敏, 等. 食用林地菇的化学成分(英文)[J]. 应用与环境生物学报, 2014, 20(4): 629-632. [15] 王小逸, 付宏征, 林文翰. 河豚的化学成分研究(Ⅰ)[J]. 中国海洋药物, 1999, 18(1): 7-10. [16] CHEN L, WANG X Y, HUANG B K. The genus Hippocampus: a review on traditional medicinal uses, chemical constituents and pharmacological properties[J]. J Ethnopharmacol, 2015, 162: 104-111. doi: 10.1016/j.jep.2014.12.032 [17] 陈慧侬, 韦丽君, 苏月明. 淫羊海马散治疗绝经后骨质疏松症75例[J]. 广西中医药, 2008, 31(6): 17-18. doi: 10.3969/j.issn.1003-0719.2008.06.009 [18] 王晓钰. 中药海马的鉴定及抗骨质疏松活性研究 [D]. 福州: 福建中医药大学, 2015. [19] 赖立勇, 徐圣焱, 夏天爽, 等. 基于抗氧化机制的中药及其化学成分在骨质疏松中的应用[J]. 海军军医大学学报, 2022, 43(8): 943-950. [20] 赵晓喆, 赵思俊, 田俊生, 等. 基于1H-NMR代谢组学比较不同品种海马化学成分差异性[J]. 中草药, 2018, 49(3): 536-543. doi: 10.7501/j.issn.0253-2670.2018.03.005 [21] REINA J C, PÉREZ-VICTORIA I, MARTÍN J, et al. A quorum-sensing inhibitor strain of Vibrio alginolyticus blocks qs-controlled phenotypes in Chromobacterium violaceum and Pseudomonas aeruginosa[J]. Mar Drugs, 2019, 17(9): 494. doi: 10.3390/md17090494 [22] KUNIMOTO S, XU C Z, NAGANAWA H, et al. Reversal of resistance by N-acetyltyramine or N-acetyl-2-phenylethylamine in doxorubicin-resistant leukemia P388 cells[J]. J Antibiot, 1987, 40(11): 1651-1652. doi: 10.7164/antibiotics.40.1651 [23] 王芳, 张建虹. 甘露醇药理机制及在脑血管患者中的临床应用[J]. 临床合理用药杂志, 2022, 15(23): 178-181. doi: 10.15887/j.cnki.13-1389/r.2022.23.055 -





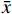
 下载:
下载:

 下载:
下载:



