-
马兜铃酸(AAs)是存在于马兜铃科植物中结构相似的硝基菲羧酸类化合物,广泛存在于马兜铃属和细辛属植物中。含AAs成分的中药,如青木香、关木通、细辛、马兜铃等都有明确的肾毒性[1-2]。马兜铃酸肾病(AAN)是因服用含有AAs成分的药物而造成的急、慢性肾小管间质疾病,表现为肾小管变性、萎缩、坏死和广泛的肾间质纤维化[3],临床上以夜尿增多、贫血、消化道症状、高血压就诊者居多,易被漏诊和误诊。AAN急性肾损害患者大部分预后良好,慢性肾损害患者预后较差。笔者所在单位是全军肾病中西医结合治疗中心,每年均收治一定数量的AAN患者,但尚未进行全面的回顾性分析。本文就此开展研究,旨在分析AAN临床特点和规律,避免误诊漏诊,提高临床确诊率。
-
依据2004—2022年该中心收治的因服用含有AAs引起药品不良反应(ADR)报表中患者信息,对患者病历进行回顾性调查。
-
采用Excel 2007进行数据统计调查,内容包括患者性别、年龄、引起AAN临床表现、引起AAN药品、引起AAN药品服用时间、原患疾病、实验室检查等。计量描述以(
$ \bar{x}\pm s $ )表示,计数以频数(构成比/%)表示。 -
拟定评判ADR标准为:①明确有口服AAs成分药物史,临床诊断以间质性肾炎为主要诊断的AAN;②无长期或近期使用引起间质性肾损害的药物史,如解热镇痛药、抗菌药物、利尿剂等;③可排除临床系统性疾病伴发的肾小管间质病变、肾小球疾病、感染相关性间质性肾炎、肾动脉狭窄、高血压肾病及糖尿病肾病等;④典型病理形态学为寡细胞性肾间质纤维化及肾小管萎缩。最终确定AAN患者111例。
-
111例AAN患者中,男性31例,女性80例,女性多于男性(2.58∶1)。年龄最小者31岁,最大者 88岁,平均年龄(63.70 ± 11.67)岁,大于50岁的101例(90.99%),详见表1。
表 1 111例AAN患者年龄、性别分布情况
性别 年龄(岁) 合计 30~39 40~49 50~59 60~69 70~79 80~89 男 1 1 5 4 13 7 31 女 2 6 28 28 13 3 80 合计 3 7 33 32 26 10 111 构成比(%) 2.70 6.31 29.73 28.83 23.42 9.01 100.00 -
111例AAN患者中,服用AAs成分药物时间最长的30年,最短20 d,平均服药时间(8.08±6.94)年。107例(96.40%)服用超过1年,其中1~5年病例数最多,超过5年次之,10年以上的累计占36.04%,详见表2。
表 2 111例服用含有AAs成分药物持续时间
序号 服用时间(年) 数量(例) 构成比(%) 1 <1.0 4 3.60 2 1.0~<5 41 36.94 3 ≥5.0~<10 26 23.42 4 ≥10.0~<15 21 18.92 5 ≥15~<20 8 7.21 6 ≥20 11 9.91 合计 111 100.00 -
111例AAN患者中,服用冠心苏合丸和龙胆泻肝丸共106例(95.50%)。111例患者按药品说明书规定剂量服用62例(55.86%),随意服用45例(40.54%),不详4例(3.60%),111例中单用药103例(92.79%)、联合用药8例(7.21%), 详见表3。
表 3 111例AAN患者服用药物情况及原患疾病
序号 药物名称 例数 构成比(%) 原患疾病 1 冠心苏合丸 78 70.27 冠心病(38)、心前区不适(9)、风湿性心脏病(1)、急性心肌梗死(1)、间断胸闷+气短(1)、
口干+心慌(1)、心动过速(1)、心功能Ⅲ级(1)、心慌+气短(1)、心脏病(1)、不详(23)2 龙胆泻肝丸 22 19.82 祛火(7)、身体不适(5)、乙肝(3)、护肝(1)、酒后去肝火(1)、口腔溃疡(1)、
皮肤过敏(1)、眼干(1)、子宫肌瘤(1)、清肝明目(1)3 冠心苏合丸+龙胆泻肝丸 6 5.41 冠心病(3)、不详(3) 4 木通(中药饮片) 2 1.80 心前区不适(1)、不详(1) 5 耳聋丸 1 0.90 内耳眩晕症(1) 6 冠心苏合丸+冠心泰丸 1 0.90 不详(1) 7 龙胆泻肝丸+蛇王贝毒胶囊 1 0.90 不详(1) 合计 111 100.00 -
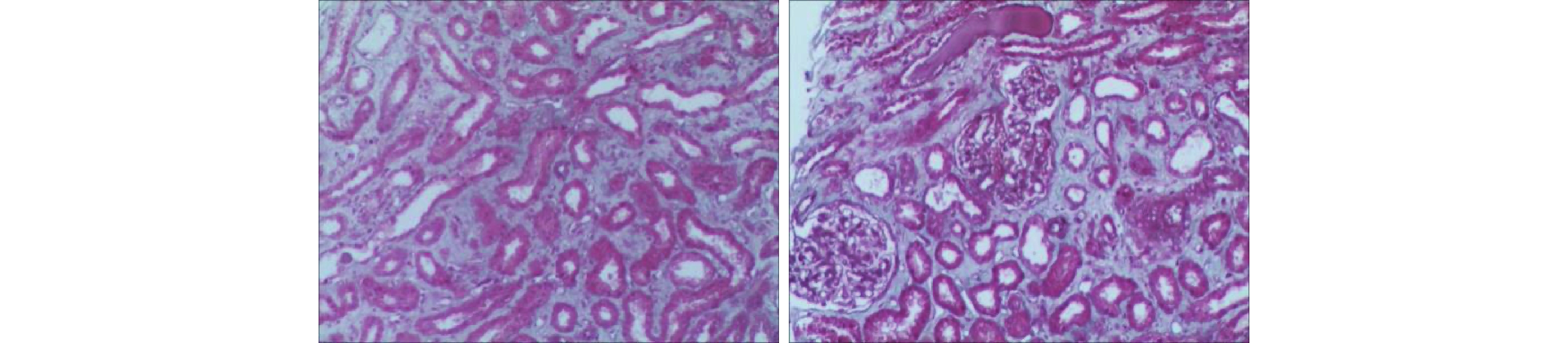
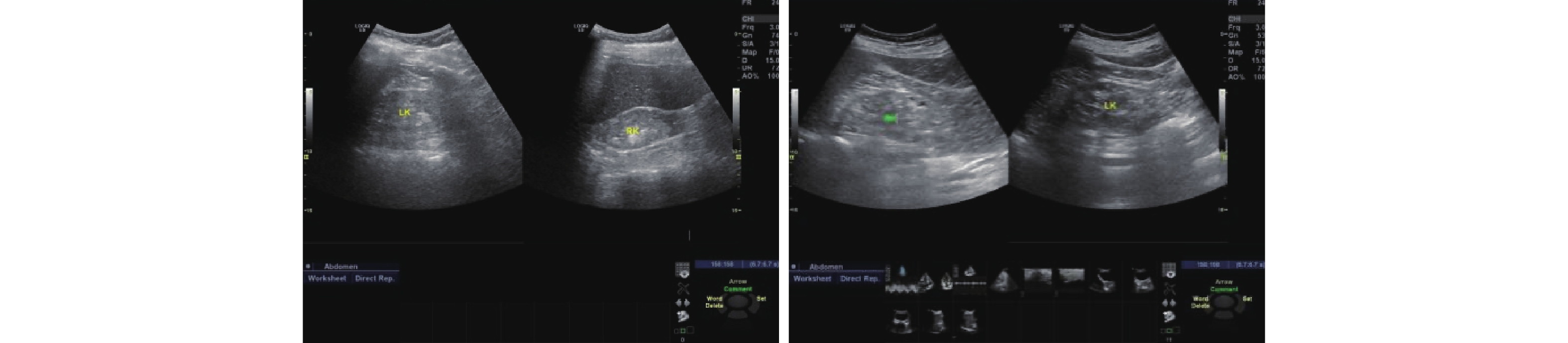
111例AAN患者中,实验室检查:血肌酐升高108例,结果范围为83~1600 μmol/L(514.31±206.48 μmol/L);尿素氮升高106例,结果范围为3.01~65.79 mmol/L(20.23±8.96 mmol/L);血红蛋白降低103例,结果范围为40~168 g/L(84.89±15.56 g/L),无检查结果7例;24 h尿蛋白区间0.1~4.1 g/d(0.48±0.35 g/d),多数为低比重尿,蛋白尿及潜血(±)~(+++)不等。超声检查肾脏均不同程度受损,呈肾体积缩小(大小不对称)、结构不清晰、弥漫性改变、血流不丰富等,详见图1。肾病理形态学多为肾小管上皮细胞脱落变性、肾小管萎缩,有不同程度的肾小管间质损害,典型的为寡细胞性肾间质纤维化,详见图2。多数患者起病隐匿,进展程度不一,与年龄、服药时间不成正比。临床上肾功能呈进行性损害,多数不可逆、预后较差,多表现纳差、夜尿增多,乏力、面色苍白、水肿不明显,多伴有贫血,贫血程度与肾功能减退程度不平行。临床均以AAN或因服用AAs药物引起的间质性肾炎和伴有进行性肾功能减退等原因收住院治疗。
-
111例AAN患者中,女性多于男性(2.58∶1),与有关报道[4]基本相似,可能因男女解剖和生理上有一定区别,女性较男性更易受药物影响[5]。其次,可能与绝经后女性因体内雌激素水平下降,易患更年期综合征、心血管疾病等,使用冠心苏合丸、龙胆泻肝丸治疗上述疾病会引起AAN的机会增加有关。本研究AAN患者年龄大于50岁共101例,占比90.99%。有报道指出,50~90岁人肾小球滤过率可下降50%,65岁后肝血流量为青年人的40%~50%[6],中老年患者肝、肾功能的降低会影响药物代谢,使半衰期延长,导致药物在体内蓄积,增加患AAN的风险。最新研究证明,肾脏血流动力学的改变及肾小管上皮细胞损伤后重吸收功能的异常也是AAN的致病机制[7]。
-
111例AAN患者中,服用含AAs药物最长的30年,最短20 d,107例服用超过1年。有研究发现,关木通临床等倍剂量提取物用药持续3周,可明显引起肾损害,证明肾毒性马兜铃酸累积阈剂量与给药剂量具有相关性[8]。中药中的很多成分是小分子物质,肾功能减退时肾脏排泄减少,加重残存肾单位药物负荷,药物在体内蓄积造成肾损害[9]。本研究发现,发生AAN的原因可能与长时间、超剂量服用AAs药物有关,使AAs在肾脏最主要的蓄积场所产生蓄积效应[10],引起肾功能减退,进一步加重肾功能损伤。
-
111例AAN患者中,涉及药物有7个品种,冠心苏合丸和龙胆泻肝丸共106例(95.50%)。本研究调查发现,患者服用冠心苏合丸和龙胆泻肝丸多在90 年代中后期,当时两药成分中含有AAs植物青木香和关木通,长期或短期服用可引起AAN。原国家食品药品监督管理局因青木香和关木通能引起AAN,于2003年将处方中的关木通换为木通,2004年将青木香替换为土木香,有效制止了青木香、关木通制剂引起的肾损害[11]。冠心苏合丸常用于冠心病、心绞痛的临床治疗,功效是宽胸、理气、止痛,用于寒凝气滞、心脉不通所致的胸闷、心前区疼痛的症状。龙胆泻肝丸具有泻肝胆实火、清下焦湿热的功效,主治肝胆实火上炎所致的头痛、目赤、胁痛、耳鸣等,以及肝胆湿热下注所引起的外阴瘙痒、小便淋浊、妇女带下等症。本研究调查发现,患者对中药毒副作用普遍存在认知偏差,认为中药没有毒副作用或毒副作用较小,多数患者为自我药疗,服药较随意,存在滥用现象。提示中药制剂应在中医理论指导下辨证施治,不可盲目擅自服用,避免引起药源性损害。
-
本研究调查发现,患者服用AAs时间与肾功能受损情况不相关,服用时间的长短与个体差异有关,与年龄、服药时间不成正比。如78岁男性,服用冠心苏合丸2年,血肌酐1600 μmol /L,尿素氮43.8 mmol/L。81岁男性,服用冠心苏合丸30年,血肌酐721 μmol /L,血尿素氮25.9 mmol /L。61岁男性服用冠心苏合丸6年,血肌酐83 μmol /L,尿素氮6.7 mmol /L。55岁女性,服用含有木通中药汤剂20 d,血肌酐377 μmol /L,尿素氮17.2 mmol/L。AAN目前尚无特异性诊断标准,当服用含有AAs中草药制剂而出现无法解释的进行性发展相对较快的肾脏病时,需对AAN的可能性进行排查[10]。有研究显示,在早期肾小管损伤检测中,黄醇结合蛋白、β2微球蛋白、胱抑素C、尿-乙酰-β氨基葡萄糖苷酶等较血肌酐和尿素氮有一定检测优势[12-13]。提示临床对出现贫血、肾功能损害及肾脏大小改变等的患者,应追问其服药史,以求尽快确诊救治。
-
AAs是一种广泛存在的毒性物质[14],其引起肾损害毒性最大的是马兜铃酸Ⅰ[15-16]。文献通过对急性AAN患者随访1~7年,其中一半的患者因肾衰竭需要透析治疗,另外一半患者进展成4期慢性肾脏病,持续性损伤发展为终末期肾病[17]。AAN的特点是肾功能损害进展迅速,即便停止使用含AAs成分药物,病情依然进展[18]。目前尚无有效针对AAN的治疗方法[10]。有报道低剂量糖皮质激素可延缓AAs诱导的肾功能减退[19];前列腺素E1对AAs诱导的急性肾脏微血管损伤可能有一定的治疗作用[20];AAs诱导的慢性肾损伤通过同基因间充质干细胞移植有治疗肾间质纤维化的作用[21];此外中药大黄附子汤[22]、丹参酮I可减轻AAs诱导的肾损伤等。以上方法因缺乏长期研究及病例数较少,尚难以对AAN疗效作出客观性评价[23]。在本研究中,临床通过中西医结合药物治疗,中药治疗为行益气养血固肾、活血化瘀、和胃降逆、通腑泄浊等辨证治疗,如百令胶囊、肾衰宁片、尿毒清颗粒、肾康注射液、中药汤剂等保肾降氮治疗,丹参川芎嗪注射液、冠心宁注射液、舒血宁注射液等活血化瘀治疗,叶酸、铁剂、促红细胞生成素等纠正贫血,硝苯地平、缬沙坦等降压治疗,对达到尿毒症期的患者行血液透析治疗,多数患者病情好转或稳定出院。
-
多数AAN患者因纳差、夜尿增多、乏力等原因就诊,实验室检查后,多有不同程度的血尿肌酐、尿素氮升高等肾功能损害表现,临床初诊多诊断为慢性肾功能不全、血肌酐升高、肾功能衰竭等,易造成漏诊、误诊。分析原因:①AAN临床表现不典型,最初表现以纳差、乏力、夜尿增多为主,如果检查不全面,易造成误漏诊;②接诊医师对AAN的临床表现及发病特点认识不足,实验室检查血肌酐、尿素氮升高,就草率诊断为肾功能不全、肾功能衰竭、血肌酐升高等;③非专科医师对AAs毒副作用认识不够,接诊医师对AAN的病因、鉴别诊断要点不熟悉或忽视;④医生问诊时对患者服用药物询问不详细,忽略患者曾服用含有AAs的药物;⑤AAN多发生于50岁以上的中、老年人,以女性居多,存在个体差异,有肾脏实质性疾病的患者反应更为敏感[24],初诊中要重点关注特殊人群。
AAs可通过一种或者多种机制导致不同程度的肾损伤[7]。肾损失患者个体差异较大,与服用AAs药物时间长短、剂量不相关,且AAN进展迅速,即使停止使用含AAs药物后病情依然进展。因此,进一步加强药物警戒工作,防范含有AAs成分药物引起的严重肾功能损害具有重要意义。临床诊疗过程中应重视对AAN的诊断,掌握AAN临床特点和规律,在中医药理论指导下辨证施治,进行早期的诊断和有效的干预,有条件的可进行治疗药物监测(TDM),有助于尽快确诊救治,避免误诊漏诊,减少AAN的发生或延缓其发展。
Analysis of 111 cases of aristolochic acids nephropathy
-
摘要:
目的 分析含有马兜铃酸成分的药物引起马兜铃酸肾病的临床特点和规律。 方法 回顾性研究 111例服用含马兜铃酸成分的药物致肾损害患者的临床资料,分析马兜铃酸肾病的临床特点、服药及治疗方法等。 结果 111例患者中,女性多于男性(2.58∶1),大于50岁的101例(90.99%);年龄(63.70±11.67)岁;平均用药时间(8.08±6.94)年;涉及冠心苏合丸和龙胆泻肝丸共106例(95.50%);血肌酐升高108例,尿素氮升高106例,血红蛋白降低103例,多见低比重尿、轻中度蛋白尿和潜血;B 超检查示肾脏均不同程度受损。肾脏病理活检为肾小管损害。多数患者起病隐匿,进展程度不一,与年龄、服药时间不成正比,临床上肾功能呈进行性损害, 多数不可逆、预后较差。 结论 肾损害患者个体差异较大,肾损伤与服用马兜铃酸药物时间长短、剂量不平行;马兜铃酸肾病进展迅速,且停止服用含马兜铃酸药物后病情依然进展。加强药物警戒工作,实施早期的诊断和有效的干预,有助于减少马兜铃酸肾病的发生,延缓其发展。 Abstract:Objective To analyze the clinical characteristics and regularity of aristolochic acid nephropathy (AAN) induced by drugs containing aristolochic acid. Methods The clinical data of 111 patients with AAN induced by aristolochic acid were reviewed. The clinical features, medication and treatment of AAN were analyzed. Results Among 111 patients, there were more females than males (2.58∶1), 101 cases (90.99%) were over 50 years old; the mean age was (63.70±11.67) years old;the average duration of medication was (8.08±6.94) years. The drugs involved were Guanxinsuhe pill and Longdanxiegan pill in 106 cases (95.50%). Serum creatinine increased in 108 cases, urea nitrogen increased in 106 cases and hemoglobin decreased in 103 cases, most of which were hypogravity urine, mild to moderate proteinuria and occult blood. Ultrasonic examination revealed that the kidneys were damaged to varying degrees. Pathological biopsy of kidney showed renal tubular damage. Most patients had an insidious onset and varying degrees of progression, which were not proportional to the age and the duration of taking the medicine. In clinical, the renal function was progressively damaged, most of which were irreversible and with a poor prognosis. Conclusion Patients with renal impairment differed greatly individually, and the renal damage was not paralleled with the medication duration and dose of drugs containing aristolochic acid.AAN progressed rapidly, and the disease still progressed even after stopping taking drugs containing aristolochic acid. Strengthening pharmacovigilance, implementing early diagnosis and effective intervention could help to reduce the occurrence of AAN and attenuate its development. -
2型糖尿病(T2DM)是一种以持续性高血糖为主要症状,以胰岛素抵抗为病理生理特征的异质性疾病。近年来,尽管一些研究显示糖尿病发病率逐渐放缓,但T2DM的患病率持续上升。目前全球糖尿病患者超过4.25亿,其中90%为T2DM[1],我国糖尿病患者超1.4亿,位居世界首位[2]。胰高糖素样肽-1(GLP-1)是一种主要由肠道L细胞所产生的激素。艾塞那肽是一种GLP-1受体激动剂(GLP‐1RA),它以葡萄糖浓度依赖的方式增强胰岛素分泌同时抑制胰高糖素分泌,并能够延缓胃排空,通过中枢性的食欲抑制减少进食量,从而达到降低血糖作用[3]。艾塞那肽属于短效GLP-1RA,其半衰期只有2.4 h,需每天2次注射给药,在一定程度上影响患者的用药依从性[4]。艾塞那肽微球(商品名为Bydureon®)是一种长效GLP‐1RA,每周一次给药,与短效GLP‐1RA相比,可提高患者的依从性和生活质量。
美国食品药品监督管理局(FDA)于2012年1月2日批准艾塞那肽微球上市,用于改善T2DM患者的血糖控制。2018年1月4日,原中国食品药品监督管理总局(CFDA)批准该药正式在中国上市,国内获批适应证为用于改善T2DM患者的血糖水平,适用于单用二甲双胍、磺脲类以及二甲双胍合用磺脲类血糖仍控制不佳的患者。2020年《中国2型糖尿病防治指南》[5]和2021年美国糖尿病学会(ADA)指南[6]推荐:GLP-1RA 类药物在合并动脉粥样硬化性心血管疾病(ASCVD)及其高风险的患者、慢性肾病的部分患者中可无须考虑患者的HbA1c水平和二甲双胍的使用而直接使用。2022年ADA/EASD共识报告[7]中指出,在ASCVD或其高风险人群中,GLP-1RA类药物优先于钠-葡萄糖协同转运蛋白2抑制剂。
作为国内首个每周给药一次的GLP-1药物,艾塞那肽微球通过缓释微球技术持续提供稳态艾塞那肽血液浓度水平,从而大大降低给药频率,降低胃肠道不良作用,并增加药物的稳定性和提高患者依从性,为广大T2DM患者提供全新的治疗选择。随着艾塞那肽微球的广泛使用,药物不良事件(ADE)报告也逐渐增多。本文通过对FDA不良事件报告系统(FAERS)收集到的数据进行挖掘和筛选,分析艾塞那肽微球可疑的ADE信号,为国内临床合理安全用药提供参考。
1. 资料和方法
1.1 资料来源
本研究全部资料来源于FAERS收集的艾塞那肽微球相关ADE报告。本研究提取数据为艾塞那肽微球上市时间(2012年1月2日)至2023年3月31日。
1.2 数据提取和统计
以“艾塞那肽微球”为目标药物,检索关键词为“exenatide microspheres for injection”、“LY05006”、“AC
2993 LAR”及“bydureon”。采用Excel表格统计患者基本信息,包括性别、年龄、ADE上报国家和上报人员、ADE 严重程度和类型等。采用《监管活动医学词(26.0版本)》中的首选系统器官分类(SOC)和首选术语(PT)对ADE进行描述、分类和统计。1.3 数据挖掘
采用比值失衡测量法的报告比值比法(ROR)和综合标准法(MHRA)对艾塞那肽微球相关ADE 进行数据挖掘[8-9],其具体计算公式及阈值见表1。
表 1 ROR和MHRA法的计算公式及相应阈值方法
名称计算公式 阈值 ROR法 ROR=a/c/(b/d) a≥3,ROR值的95%CI下限>1,则提示生成1个
信号ROR 95%CI=
${\mathrm{e}}^{\left[{\mathrm{ln}}({\mathrm{ROR}})\pm 1.96\sqrt {\frac{1}{a} + \frac{1}{b} + \frac{1}{c} + \frac{1}{d}}\right]} $MHRA法 PRR=a/(a+b)/[c/(c+d)] a≥3,PRR值>2,χ2值>4,则提示生成1个信号 χ2 =(ad−bc)2(a+b+c+d)/[(a+b)(c+d)(a+c)(b+d)] 注:a:目标药物的目标事件报告数;b:目标药物的其他事件报告数;c:其他药物的目标事件报告数;d:其他药物的其他事件报告数;95%CI:95%置信区间;PRR:比例报告比值比。 2. 结果
2.1 艾塞那肽微球相关ADE报告年度分布
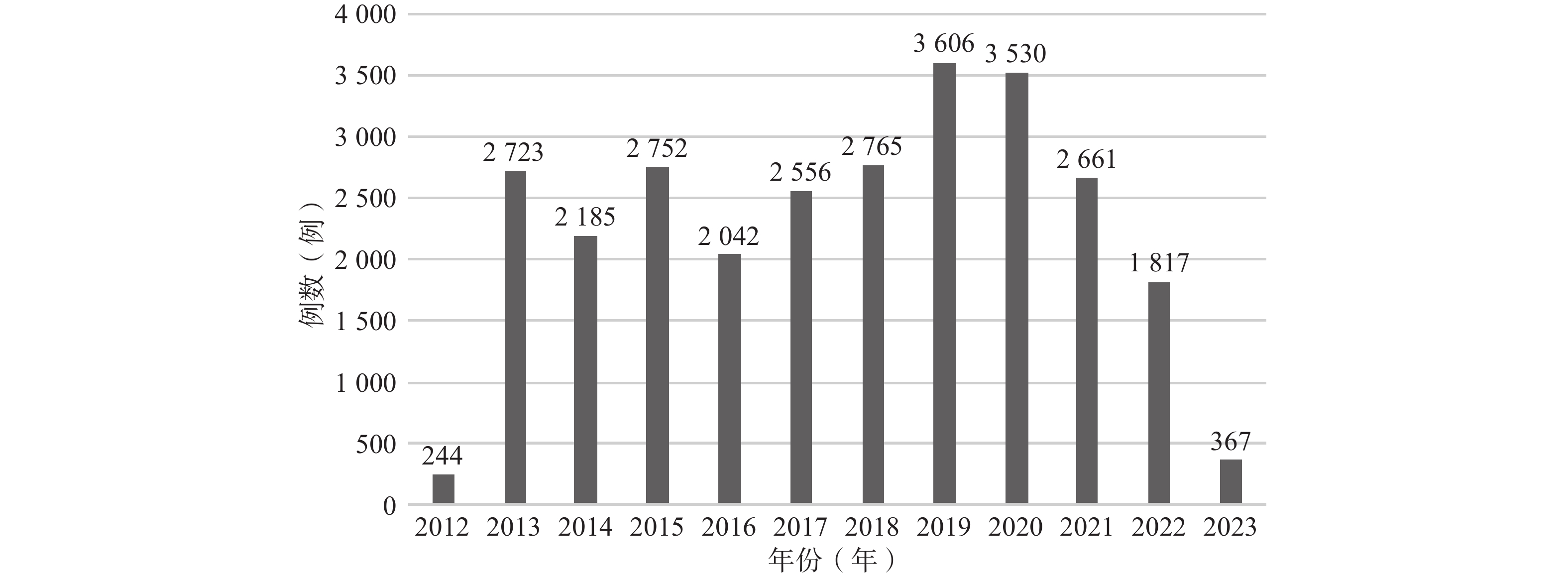
2012年1月2日至2023年3月31日,FDA共收到艾塞那肽微球相关ADE报告27 248 份,具体年度份数的分布如图1所示。
2.2 艾塞那肽微球相关ADE报告相关患者性别和年龄分布
艾塞那肽微球相关ADE报告27 248份共涉及27 248例患者,患者的性别和年龄分布情况见表2。
表 2 艾塞那肽微球相关ADE涉及患者性别及年龄分布参数 分类 例数(例) 占比(%) 性别 男 11 814 43.36 女 14 328 52.58 未知 1 106 4.06 合计 27 248 100.00 年龄 18-64岁 186 0.68 ≥65岁 339 1.24 未知 26 723 98.07 合计 27 248 100.00 2.3 艾塞那肽微球相关ADE报告上报人员和上报国家分布
统计结果显示,艾塞那肽微球相关ADE报告上报人员以消费者为主(18 435例,占67.66%)。上报国家共 51个,报告数以美国最高(26 295例,占96.5%),其次为日本(117例,占0.4%),具体见表3。
表 3 艾塞那肽微球相关ADE报告上报人员和上报国家分布参数 分类 例数(例) 占比(%) 上报人员 消费者 18 435 67.66 医务人员 2 947 10.82 其他 1 237 4.54 未知 4 629 16.99 合计 27 248 100.00 上报国家 美国 26 295 96.50 日本 117 0.43 英国 114 0.42 法国 104 0.38 澳大利亚 74 0.27 其他 514 1.89 未知 30 0.11 合计 27 248 100.00 2.4 艾塞那肽微球相关ADE中的严重不良事件
在上报的27 248份报告中,报告了4 719例次严重ADE,包括住院、死亡、危及生命、残疾等,具体见表4。
表 4 艾塞那肽微球严重不良事件分布严重不良事件类型 例数(例) 占比(%) 住院 1 462 30.98 死亡 246 5.21 危及生命 146 3.10 残疾 112 2.37 其他 12 56.33 未知 95 2.01 合计 4 719 100.00 2.5 艾塞那肽微球相关ADE中累及的系统和器官
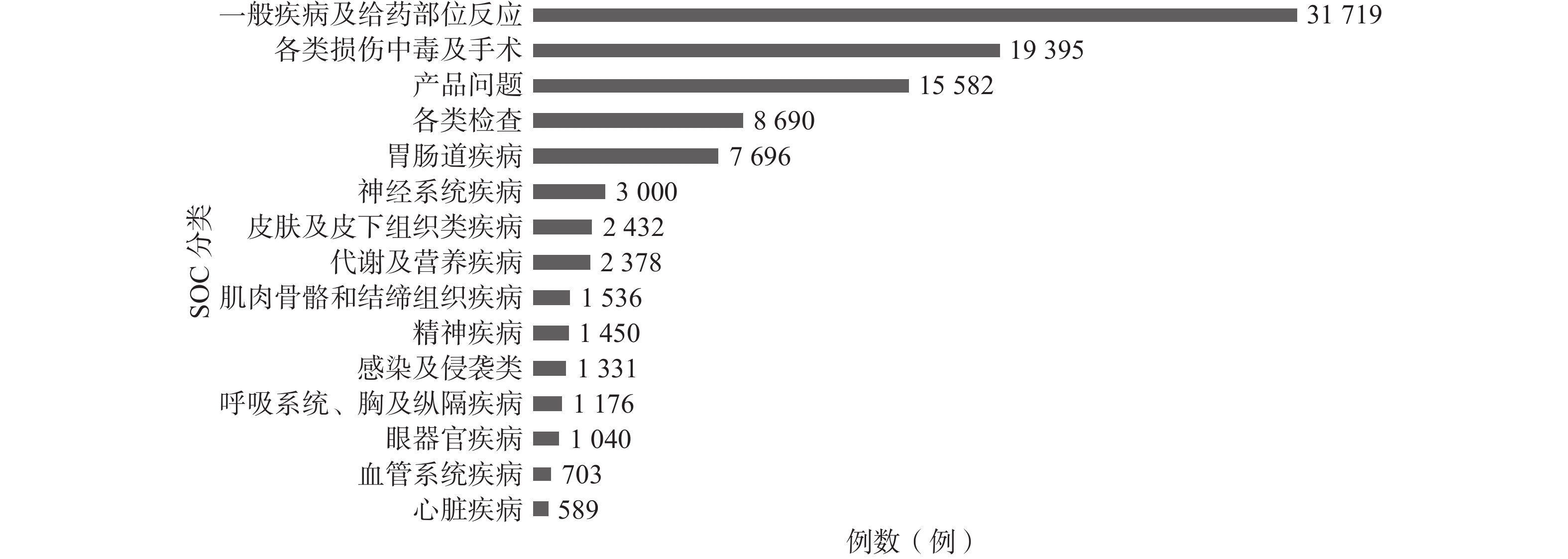
在上报的27 248份报告中,共发生101 469例次ADE。ADE共涉及27个SOC,以给药部位反应为主,具体见图2。
2.6 基于PT术语的信号挖掘
对以艾塞那肽微球为首要怀疑药物的ADE报告进行筛选,PT 报告总数为2 474个,较为常见的 ADE报告数为注射部位不适、血糖升高、体质量降低等,结果见表5。
表 5 艾塞那肽微球相关ADE报告数排序(前50位)序号 PT 报告数/例(个) 序号 PT 报告数/例(个) 1 注射部位出血 5 262 26 注射部位硬结 164 2 注射部位痛 4 586 27 注射部位发热 159 3 注射部位肿块 3 529 28 肿块 156 4 注射部位结节 2 869 29 注射部位不适 146 5 血葡萄糖升高 2 572 30 注射部位疤痕 104 6 体质量降低 2 269 31 皮肤肿块 104 7 注射部位瘙痒 1 590 32 糖化血红蛋白异常 100 8 注射部位瘀青 1 239 33 饥饿感 98 9 注射部位红斑 1 061 34 胃排空障碍 94 10 注射部位肿胀 743 35 体质量波动 94 11 糖化血红蛋白升高 682 36 注射部位刺激 86 12 血葡萄糖降低 553 37 注射部位炎症 79 13 胰腺炎 416 38 挫折承受力降低* 79 14 血葡萄糖异常 391 39 糖化血红蛋白降低 73 15 糖尿病控制不佳 347 40 脂肪酶升高* 68 16 注射部位反应 342 41 食欲障碍 52 17 注射部位损伤 322 42 注射部位血肿 52 18 结节 305 43 注射部位脓肿 50 19 注射部位变色 300 44 注射部位感染 49 20 血葡萄糖波动 221 45 注射部位分泌物 48 21 注射部位皮疹 202 46 超重 43 22 身高降低* 198 47 注射部位结痂 39 23 嗳气 195 48 注射部位蜂窝织炎 37 24 注射部位荨麻疹 193 49 注射部位囊泡 32 25 注射部位凹陷 178 50 血胆固醇异常* 28 注:*表示说明书未列入的ADE。 经ROR法和MHRA法双重筛选,最终获得阳性信号163个。按信号强度( ROR值的 95% CI下限)对前50位PT进行排序,结果见表6。相关性较高的ADE为注射部位不适、获得性混合型高脂血症、糖化血红蛋白异常等。另外,挖掘到未列入药品说明书的ADE共7种。
表 6 艾塞那肽微球相关ADE信号强度排序(前50位)序号 PT 报告数/
例(个)PRR ROR(95% CI) 序号 PT 报告数/
例(个)PRR ROR(95% CI) 1 注射部位结节 2 869 247.06 254.22(242.57-266.43) 26 注射部位脓肿 50 14.02 14.03(10.58-18.60) 2 注射部位凹陷 178 76.69 76.82(65.44-90.19) 27 血葡萄糖波动 221 13.75 13.78(12.05-15.76) 3 获得性混合型高脂血症* 3 71.01 71.02(20.81-242.33) 28 结节 305 13.59 13.63(12.16-15.28) 4 糖化血红蛋白异常 100 66.40 66.47(53.79-82.14) 29 注射部位蜂窝织炎 37 13.49 13.49(9.72-18.72) 5 注射部位囊肿 27 62.44 62.46(41.64-93.69) 30 糖尿病控制不佳 347 13.29 13.33(11.98-14.84) 6 注射部位肿块 3 529 60.93 63.09(60.86-65.40) 31 注射部位肉芽肿 5 12.73 12.73(5.23-31.02) 7 血胰高血糖素增高 4 55.50 55.51(19.51-157.89) 32 胃肿块* 18 12.71 12.71(7.95-20.32) 8 注射部位变形 8 53.65 53.66(25.66-112.21) 33 血葡萄糖异常 391 12.15 12.20(11.03-13.49) 9 注射部位损伤 322 49.86 50.01(44.54-56.16) 34 血管损伤* 23 10.53 10.53(6.96-15.93) 10 注射部位出血 5 262 46.12 48.59(47.19-50.03) 35 注射部位炎症 79 10.17 10.18(8.14-12.72) 11 给药部位结节 3 36.58 36.58(11.22-119.29) 36 注射部位痛 4 586 10.03 10.46(10.15-10.78) 12 注射部位关节痛 5 35.30 35.30(14.15-88.07) 37 注射部位感染 49 9.63 9.63(7.26-12.79) 13 给药部位凹陷 3 33.53 33.53(10.33-108.90) 38 身高降低* 198 9.36 9.38(8.14-10.80) 14 腹壁肿块* 5 32.45 32.45(13.05-80.72) 39 注射部位瘀青 1 239 9.06 9.16(8.65-9.69) 15 身高异常* 7 30.62 30.62(14.20-66.03) 40 注射部位不适 146 8.97 8.98(7.62-10.58) 16 糖化血红蛋白降低 73 29.73 29.75(23.46-37.74) 41 注射部位刺激 86 8.95 8.96(7.23-11.09) 17 注射部位结痂 39 25.44 25.45(18.41-35.17) 42 血葡萄糖升高 2 572 8.78 8.99(8.64-9.35) 18 注射部位疤痕 104 22.78 22.80(18.71-27.79) 43 皮肤肿块 104 8.76 8.77(7.22-10.65) 19 腹部脂肪堆积* 3 21.56 21.56(6.75-68.87) 44 嗳气 195 7.90 7.91(6.86-9.12) 20 糖化血红蛋白升高 682 16.99 17.10(15.83-18.47) 45 血葡萄糖降低 553 7.71 7.75(7.12-8.43) 21 注射部位腐烂 11 16.96 16.96(9.28-31.01) 46 注射部位硬结 164 7.66 7.67(6.57-8.96) 22 注射部位分泌物 48 16.02 16.02(12.01-21.38) 47 胃排空障碍 94 7.53 7.54(6.15-9.25) 23 注射部位瘙痒 1 590 15.25 15.48(14.72-16.28) 48 注射部位肿胀 743 6.51 6.55(6.09-7.05) 24 注射部位变色 300 14.67 14.71(13.10-16.51) 49 肿块 156 6.28 6.29(5.37-7.37) 25 体质量指数异常 4 14.12 14.12(5.21-38.27) 50 注射部位红斑 1 061 5.54 5.58(5.25-5.93) 注:*表示说明书未列入的ADE。 3. 讨论
本研究利用FAERS数据库中艾塞那肽微球的ADE报表数据,应用比值失衡法对艾塞那肽微球上市后发生的ADE进行分析和挖掘,为减少结果偏倚,本研究采用ROR法与MHRA法两种方法进行数据挖掘。艾塞那肽微球相关ADE信号较强且较多地集中在给药部位反应、血糖控制不佳、胃肠道系统反应等方面,与药品说明书中ADE大致相同。
本研究结果显示,艾塞那肽微球较强的ADE为注射部位反应包括结节、凹陷、肿块,关联较强的ADE为胃肠道药物不良反应、血糖控制不佳,提示临床使用艾塞那肽微球时应重点关注注射部位反应、胃肠道反应如嗳气、胃排空障碍以及血糖波动等相关ADE。GLP-1RA一方面通过增加胰岛β细胞胰岛素分泌和减少α细胞胰高血糖素分泌来改善糖代谢[10];另一方面通过抑制食欲和减少食物摄入来减轻体质量[11]。由此造成胃排空障碍、嗳气等一系列ADE,并同时作用于中枢神经系统,造成食欲下降。既往研究结果显示,相比其他半衰期较短的GLP-1RA(如艾塞那肽、利拉鲁肽等),艾塞那肽微球不仅在持续血糖控制和减轻体重各方面具有更好的疗效[12-14],而且胃肠道相关ADE的发生率显著降低[15]。
艾塞那肽微球是长效制剂,每周给药1次。艾塞那肽微球从微球中逐渐释放药物可以帮助患者减少皮下注射次数。由于缓释制剂的便利性,可以改善患者的依从性和提高生活质量,与短效GLP-1 RA相比,可以更好地控制血糖。这可能与艾塞那肽微球制剂中血浆艾塞那肽的浓度在白天更稳定有关,可能有助于患者胰岛β细胞功能的改善[13, 16]。
注射用艾塞那肽微球给药前需要混合药物和填充注射器,对使用方法有一定的要求,如注射给药应在腹部、大腿或上臂区域皮下注射,在同一区域注射时,每周应选择不同的部位,减少注射部位ADE的发生[17]。注射部位反应如结节、凹陷、肿块、出血等 ADE的报告数与信号强度均排在前列。提示在临床使用艾塞那肽微球时,专业医疗人员应当注意加强对患者药物注射的用药教育,保障患者用药的有效性和安全性。
本研究经ROR法和MHRA法双重筛选,最终获得阳性信号163个,其中发现有10个未在说明书中出现的ADE信号。说明书中提示急性胰腺炎包括致死性和非致死性出血或坏死性胰腺炎的发生与使用艾塞那肽有关[18]。本研究发现了胰腺炎阳性信号,提醒医务人员应注意使用该药应密切关注患者是否发生急性胰腺炎的症状和体征,包括持续性严重腹痛并可放射到背部或伴有恶心和呕吐。如果怀疑出现胰腺炎应立即停药。对确诊胰腺炎患者,则不应重新开始注射用艾塞那肽微球治疗。
本研究属于上市后ADE信号研究,即使有大样本量的数据,仍然存在一定局限性。首先FAERS是自发上报系统,因此存在重复报告、错报、漏报等情况[19]。如在本研究中,超过90%的患者年龄信息未知,对于ADE年龄的分布估计有一定的影响。其次尽管同时使用ROR法与MHRA法两种方法,但是仍然不能排除假阳性信号出现,而且FAERS数据库中ADE项的信息填写可能过于主观,如对于同一个ADE,不同的报告者可能采用不同的描述,即使通过术语标准化仍然无法消除这一问题,导致单个PT的ROR、PRR值的计算可能存在误差。最后FAERS数据库中数据来源主要是欧美国家,而亚洲人群的数据,尤其是中国患者的数据少,因此需要考虑研究发现的ADE信号是否符合中国人群现状。本研究虽然用 2 种方法进行综合评价,检出阳性信号并非必然的因果关系,仍需进一步临床研究加以证实。
-
表 1 111例AAN患者年龄、性别分布情况
性别 年龄(岁) 合计 30~39 40~49 50~59 60~69 70~79 80~89 男 1 1 5 4 13 7 31 女 2 6 28 28 13 3 80 合计 3 7 33 32 26 10 111 构成比(%) 2.70 6.31 29.73 28.83 23.42 9.01 100.00 表 2 111例服用含有AAs成分药物持续时间
序号 服用时间(年) 数量(例) 构成比(%) 1 <1.0 4 3.60 2 1.0~<5 41 36.94 3 ≥5.0~<10 26 23.42 4 ≥10.0~<15 21 18.92 5 ≥15~<20 8 7.21 6 ≥20 11 9.91 合计 111 100.00 表 3 111例AAN患者服用药物情况及原患疾病
序号 药物名称 例数 构成比(%) 原患疾病 1 冠心苏合丸 78 70.27 冠心病(38)、心前区不适(9)、风湿性心脏病(1)、急性心肌梗死(1)、间断胸闷+气短(1)、
口干+心慌(1)、心动过速(1)、心功能Ⅲ级(1)、心慌+气短(1)、心脏病(1)、不详(23)2 龙胆泻肝丸 22 19.82 祛火(7)、身体不适(5)、乙肝(3)、护肝(1)、酒后去肝火(1)、口腔溃疡(1)、
皮肤过敏(1)、眼干(1)、子宫肌瘤(1)、清肝明目(1)3 冠心苏合丸+龙胆泻肝丸 6 5.41 冠心病(3)、不详(3) 4 木通(中药饮片) 2 1.80 心前区不适(1)、不详(1) 5 耳聋丸 1 0.90 内耳眩晕症(1) 6 冠心苏合丸+冠心泰丸 1 0.90 不详(1) 7 龙胆泻肝丸+蛇王贝毒胶囊 1 0.90 不详(1) 合计 111 100.00 -
[1] LI X L, GUO X Q, WANG H R, et al. Aristolochic acid induced genotoxicity and toxicogenomic changes in rodents[J]. World J Tradit Chin Med, 2020, 6(1):12-25. doi: 10.4103/wjtcm.wjtcm_33_19 [2] 梁爱华, 高月, 张伯礼. 含马兜铃酸中药的安全性问题及对策[J]. 中国食品药品监管, 2017(11):17-20. [3] ANGER E E, YU F, LI J. Aristolochic acid-induced nephroto-xicity: molecular mechanisms and potential protective approaches[J]. Int J Mol Sci, 2020, 21(3):1157. doi: 10.3390/ijms21031157 [4] 冯欣. 马兜铃酸肾病120例分析[J]. 中国误诊学杂志, 2008, 8(17):4249-4250. [5] 任春霞, 余自成. 药物性急性肾损伤的研究进展[J]. 中国新药与临床杂志, 2019, 38(5):257-262. [6] 陈新谦, 金有豫, 汤光. 新编药物学[M]. 18 版. 北京: 人民卫生出版社, 2018.20-21. [7] 侯改灵, 黄岩杰, 杨晓青, 等. 从临床表现和致病机制再认识马兜铃酸类中药的肾毒性[J]. 中药药理与临床, 2019, 35(2):162-166. [8] 高月, 肖小河, 朱晓新, 等. 马兜铃酸的毒性研究及思考[J]. 中国中药杂志, 2017, 42(21):4049-4053. [9] 冯雪, 方赛男, 高雨鑫, 等. 中药肾毒性国内外研究现状[J]. 中国中药杂志, 2018, 43(3):417-424. [10] 王吉耀, 葛均波, 邹和建. 实用内科学[M]. 16版. 北京: 人民卫生出版社, 2022.1791-1792. [11] 史文慧, 郭蓉, 李俊, 等. 144例严重药品不良反应报告分析[J]. 中国医院用药评价与分析, 2023, 23(7):885-888. [12] GU Y Z, VLASAKOVA K, TROTH S P, et al. Performance assessment of new urinary translational safety biomarkers of drug-induced renal tubular injury in tenofovir-treated Cynomolgus monkeys and beagle dogs[J]. Toxicol Pathol, 2018, 46(5):553-563. doi: 10.1177/0192623318775023 [13] LIU C C, HSIEH T J, WU C F, et al. Urinary melamine excretion and increased markers of renal tubular injury in patients with calcium urolithiasis: a cross-sectional study[J]. Environ Pollut, 2017, 231:1284-1290. doi: 10.1016/j.envpol.2017.08.091 [14] 杨亚蕾, 王艳丽, 桂新景. 关木通的回顾性合理用药分析[J]. 中国现代应用药学, 2020, 37(23):2925-2931. [15] 贠凯祎, 徐志超, 宋经元. 含马兜铃酸中药及其检测研究进展[J]. 中国科学:生命科学, 2019, 49(3):238-249. [16] 田婧卓, 刘素彦, 高月, 等. 论含马兜铃酸中药的风险评估、安全用药与科学监管——马兜铃酸种类不同毒性各异, 检控马兜铃酸Ⅰ/Ⅱ是关键[J]. 中国中药杂志, 2022, 47(14):3693-3700. [17] 费菲. 马兜铃酸肾损害: 从科学问题到临床意义的多轮审视: 北京大学肾脏疾病研究所副所长杨莉谈马兜铃酸肾病的机制研究和临床诊疗策略[J]. 中国医药科学, 2018, 8(24):1-3. [18] 代小雨, 周莉, 付平. 马兜铃酸肾病: 流行病学、诊断及治疗进展[J]. 中国中西医结合肾病杂志, 2015, 16(3):268-270. [19] MA D H, ZHENG F L, SU Y, et al. Influence and analysis of low-dosage steroid therapy in severe aristolochic acid nephropathy patients[J]. Nephrology, 2016, 21(10):835-840. doi: 10.1111/nep.12684 [20] SUN D, LIU C X, MA Y Y, et al. Protective effect of prostaglandin E1 on renal microvascular injury in rats of acute aristolochic acid nephropathy[J]. Ren Fail, 2011, 33(2):225-232. doi: 10.3109/0886022X.2010.541586 [21] LI W, JIANG H, FENG J M. Isogenic mesenchymal stem cells transplantation improves a rat model of chronic aristolochic acid nephropathy via upregulation of hepatic growth factor and downregulation of transforming growth factor β1[J]. Mol Cell Biochem, 2012, 368(1):137-145. [22] SHUI G X, SANG D, YIN X, et al. Dahuang Fuzi Decoction attenuates renal fibrosis and ameliorates mitochondrial dysfunction in chronic aristolochic acid nephropathy[J]. Evid Based Complement Alternat Med, 2017, 2017:1-8. [23] FENG C C, XIE X F, WU M J, et al. Tanshinone I protects mice from aristolochic acid I-induced kidney injury by induction of CYP1A[J]. Environ Toxicol Pharmacol, 2013, 36(3):850-857. doi: 10.1016/j.etap.2013.07.017 [24] 郑浪. 含马兜铃酸中药的研究进展[J]. 中药与临床, 2020, 11(1):74-80. -





 下载:
下载:
 下载:
下载: