-
肝区疼痛是肝癌患者最为常见的症状之一,初诊发生率为25%,晚期发生率为60%~80%,其中1/3为重度疼痛[1]。随着对癌痛治疗的不断深入,阿片类药物具有高效、多种途径使用、不良反应少、耐受性好及可调整剂量的优势 [2]。然而,60%~90%的癌症患者使用阿片类镇痛药会出现阿片类药物相关性便秘(OIC) [3]。便秘症状有时超过了疼痛本身,严重影响患者的生活质量,甚至有患者因无法忍受OIC而停止使用阿片类药物,从而放弃治疗 [4]。对于晚期肝癌患者,便秘则尤为致命,因便秘不缓解会导致肠道代谢产物无法及时排出,毒素被肠道吸收易引起机体自身中毒,患者可出现烦躁不安、恶心、腹胀、食欲下降等症状,甚至引发肝性脑病,从而加重疾病进展[5]。晚期肝癌患者普遍门静脉压力增高,在用力屏气排便时极易诱发消化道出血,从而可能危及生命。
对于OIC的治疗,欧洲姑息治疗协会建议优先考虑将泻药作为预防措施[6]。泻药是常见的治疗OIC的药物之一。传统泻药可分为缓泻剂和强效泻药,乳果糖是强效泻药的一种。然而,很多患者使用传统泻药的治疗效果并不理想。此外,过度使用传统泻药可能导致患者产生耐受性,并引起一系列不良反应,如脱水、腹胀和皮炎等,这些反应也可能会使患者放弃治疗[7]。
根据中医理论,便秘以潜在病因大致分为实证和虚症。中医内科学将便秘分为实秘和虚秘。针对肝癌晚期OIC患者与其他癌症OIC患者的不同,选择神阙穴进行穴位贴敷与消化器官位置比邻,敷贴能激发各经气作用全身发挥培元固本、回阳救脱、和胃理肠的治疗作用。而消胀通便膏在“枳术丸”及“调胃承气汤”基础之上,结合肝癌患者中医证型,经过临证反复验证优化而成,可外贴神阙穴,缓解肝癌患者OIC。因此,本研究以口服乳果糖为对照,评估消胀通便膏治疗肝癌晚期OIC的疗效,以期进一步指导临床实践。
-
选取2021年6月至2022年12月在海军军医大学第三附属医院中西医结合科(本院)诊治的120名晚期肝癌合并OIC患者作为研究对象。采用随机数字表法将患者分为对照组与试验组,每组各60例。本研究经所在医院伦理委员会批准(伦理批准号:EHBHKY2023-H016-P001),每位患者均签署知情同意书。
-
①符合罗马Ⅳ OIC诊断标准[8]; ②巴塞罗那肝癌临床分期晚期及终末期的肝癌患者[9]; ③使用阿片类药物≥7 d; ④预计生存期>3个月; ⑤年龄>18岁;⑥意识清晰并签署知情同意书。
-
①有严重心肺功能、严重凝血功能障碍的患者;②合并肠道疾病的患者;③不能配合者和精神病患者;④神阙穴附近存在皮肤破损;⑤对所用药物产生过敏反应者;⑥正在参与其他临床试验。
-
①因病情变化无法参与完整疗程或用挽救性泻药;②在研究期间患者自行更换药物;③患者自行退出。
-
两组患者均在住院期间接受健康宣教:①三阶梯止痛相关知识;②逐步形成合理的排便习惯;③适量饮水,保证饮食中摄入足够的膳食纤维和优质蛋白;④保持每日适量的运动;⑤维持情绪稳定并积极乐观。
-
在常规治疗的基础上选择乳果糖口服溶液(进口药品注册证号:H20171057,荷兰Abbott Biologicals B.V.公司)缓解便秘情况,口服治疗,起始剂量每日30 ml,维持剂量每日10 ml至25 ml,症状缓解后停药[10]。
-
在常规治疗的基础上选择神阙穴进行消胀通便膏穴位贴敷,将枳实、生白术、厚朴、生大黄、芒硝、冰片、大腹皮,用药比例为6∶6∶6∶6∶3∶1∶6,打磨成粉,每次取10 g,用食醋调和涂抹在无纺布自粘敷料上贴敷神阙穴。从出现OIC症状起贴,根据子午流注理论择卯时(5点至7点)开始敷贴[11]。每日一贴,每贴4 h,7 d为一个疗程,贴敷前后清洗脐部皮肤,若贴敷期间患者出现腹泻即停药。患者在出院后可使用自研穴位贴敷药剂家庭定量制备装置(专利号:ZL202121038992.9)方便制取。
-
主要评价指标为便秘症状改善情况、生活质量评价以及治疗后综合评价(经济成本、及腹泻发生次数以及阿片类药物使用剂量是否有变化)。
-
便秘症状中包括排便间隔、粪便性状、排便时间、排便困难程度。采用问卷调查的方式收集资料。运用便秘患者症状自评量表(PAC-SYM)分别在治疗前、治疗第14天、治疗第28天进行评估。
PAC-SYM的Cronbach’a系数为0.91,各维度Cronbach’a系数为0.81~0.90,具有较好的内部一致性效度[12]。PAC-SYM由粪便性状、直肠症状和腹部症状3个部分共12个条目构成,对排便次数减少、排便费力、排便疼痛、排便不尽感、粪质坚硬、粪量少、胃痛、腹部痉挛疼痛腹部胀满、有便意但难以排出、直肠出血或撕裂、直肠烧灼感等症状进行评估。每个条目采用Likert5点评分法进行评价,按症状严重程度由无到非常严重分别计为 0~4 分。总分为各条目得分的平均分,得分越高便秘症状越严重。
-
运用癌症治疗功能评价系统之肝胆量表(FACT-Hep)(第四版)来评价治疗晚期肝癌患者便秘问题后的生活质量。分别在治疗前、治疗第14天、治疗第28天进行评估。FACT-Hep的各维度Cronbach’a系数为0.798~0.878,具有较好的内部一致性效度[13]。FACT-Hep内含5个方面的评分:身体状况(PWB)、社交/家庭状况(SWB)、感情状况(EWB)、功能状况(FWB)、肝胆特意模块(HEP),其条目数分别为7、7、6、7、19,每条条目计分为0、1、2、3、4分。总分为所有条目相加,得分越高则生活质量越低,反之则生活质量越高。
-
治疗后综合评价包括经济成本、治疗过程中发生腹泻的次数以及阿片类药物使用剂量是否有变化。
-
采用 SPSS 21.0 统计软件进行数据分析。对于计量资料(即连续变量)需先对正态性检验,对于正态分布的数据采用平均值±标准差,非正态分布的应采用中位数法,两组间比较采用t 检验,计数资料以相对数表示,组间比较采用χ2检验。 以P<0.05为差异有统计学意义。
-
共纳入120例患者,干预期间脱落14例患者,9例患者因病情变化无法参与完整疗程,5例患者使用挽救性泻药。最终对照组52人、试验组54人完成调查。两组患者基本资料比较差异无统计学意义(P>0.05),见表1。
表 1 两组患者一般资料比较
项目 对照组 试验组 t/χ2 P 性别 − − 0.406 0.524 男 33 31 − − 女 19 23 − − 年龄(岁) 59.75±15.81 61.43±15.49 −0.551 0.583 文化程度 − − 2.944 0.229 初小 3 6 − − 中学 28 34 − − 专科及以上 21 14 − − 婚姻状况 − − 0.597 0.440 已婚 36 41 − − 离婚或丧偶 16 13 − − 独居 − − 0.366 0.545 是 10 13 − − 否 42 41 − − -
在治疗后14 d时,两种治疗方法对缓解便秘症状并没有显著的差异。然而,当治疗时间延长至28 d时,观察到两组之间的差异具有统计学意义。
在本次研究的对照组中,有5位患者因为逐渐对乳果糖产生耐受性而需要采用灌肠等挽救性治疗方法,导致这些患者退出了研究。这表明乳果糖在疗效上在初期表现出了显著的效果,但随着时间的推移,其疗效逐渐减弱。与之相比,消胀通便膏外贴在长期治疗中表现出更好的效果,如表2所示。
表 2 两组患者便秘自评量表治疗前、治疗后对比
治疗天数 对照组 试验组 t/χ2 P 治疗前 2.57±0.72 2.49±0.74 0.551 0.583 治疗后14 d 1.86±0.62 1.64±0.66 1.715 0.089 治疗后28 d 1.45±0.56 1.05±0.37 4.323 <0.001 -
从生活质量的角度来看,试验组表现出明显优势,使用消胀通便膏外贴相对于口服乳果糖对患者的生活质量影响更小。
缓解患者OIC能确保止痛药物的规范使用,采用脐部贴敷这种易于接受的方式有效降低治疗方式对生活的干扰,较好改善了患者的生活质量。这些因素共同作用,进一步提高了患者的生活质量,见表3。
表 3 两组患者治疗前、治疗后生活质量比较
治疗天数 对照组 试验组 t/χ2 P 治疗前 100.42±12.59 99.89±16.46 0.187 0.852 治疗后14 d 91.67±12.57 89.39±15.65 0.827 0.41 治疗后28 d 91.85±9.81 84.35±10.48 3.797 <0.001 -
从经济成本方面,试验组的经济成本明显低于对照组,这使得患有终末期肿瘤的患者能够将有限的资源更专注于提高生活质量和缓解躯体症状,减轻了治疗的财务压力。
以腹泻发生率来说,在研究周期中对照组的腹泻发生率显著高于试验组。这表明乳果糖在不同患者中的效果存在不可控的差异。特别是对于肿瘤终末期的患者,由于腹泻引起的体液丢失和电解质紊乱可能导致更为严重的后果,这种差异更加凸显了试验组的优势。
对比两组止痛药物的使用剂量,研究结果显示试验组阿片类药物的使用剂量相较于对照组呈现出放缓的增长趋势。这一变化可能归因于试验组患者便秘症状的缓解以及生活质量的提升,这两者共同作用,在一定程度上缓解了患者的疼痛感,见表4。
表 4 两组患者治疗后综合评价对比
评价项目 对照组 试验组 t/χ2 P 经济成本(元) 146.39±21.70 95.50±4.81 16.81 <0.001 发生腹泻的次数 4.83±3.02 2.56±1.42 4.981 <0.001 阿片类药物使用
剂量增加(例数)42 35 21.736 <0.001 -
中医普遍认为阿片类药物主要提取自传统中草药“罂粟壳”,其性温燥烈,具有辛香走窜的特点。长期摄入该类药物,容易导致机体燥热内郁、影响气血运行,导致便秘症状[14-15]。按照WHO癌痛三阶梯止痛原则进行癌痛规范化治疗,对癌症患者躯体功能、认知、情绪以及生活质量都有极大的改善。因此,阿片类药物在晚期癌症疼痛患者中必不可少。而肝癌患者有其特殊性,中医认为肝癌属于中医学的“积聚”、“臌胀”、“胁痛”等范畴。在《黄帝内经·灵枢》中记载:“肝脉急甚为恶言,微急为肥气,在胁下如覆杯”,可见肝癌与其他癌症有显著的区别,在辩证施治上亦有不同。对患者来说,一但发生便秘又会引起消化道出血、肝性脑病等症状,因此肝癌患者发生便秘的危险性与严重性远高于其他癌症患者[16]。
本研究选用的消胀通便膏是在“枳术丸”及“调胃承气汤”基础之上,结合肝癌患者中医证型所优选。穴位贴敷法的机理有两种主要观点。首先,穴位贴敷法利用经络的敏感性,可以将药物效应扩大,特别适合于薄角质皮肤区域;其次,穴位贴敷法的药物能够透过皮肤角质层,迅速扩散到全身,达到治疗目的,消胀通便膏中的生大黄、大腹皮、枳实等成分具有通便、促进肠道蠕动等作用[17]。在腧穴理论指导下,选择神阙穴作为穴位贴敷法的应用穴位,其穴位位于脐部,为全身经络之海,经络之总枢,贴敷其中可激发全身各经络之气。根据子午流注理论选择卯时进行穴位贴敷用药,卯时大肠经最旺,开穴之时用药效果最好。
综上所述,消胀通便膏在晚期肝癌OIC的患者中具有显著的缓解症状、改善生活质量和降低经济成本的作用。其具有操作简便,患者接受度、配合度高等特点,值得临床推广应用。
Application of eliminating flatulence and laxative cream in advanced hepatocellular carcinoma patients with opioid-associated constipation
-
摘要:
目的 探讨消胀通便膏在晚期肝癌阿片类药物相关性便秘(OIC)中的应用情况。 方法 选取2021年6月至2022年12月在海军军医大学第三附属医院诊治的120名晚期肝癌合并OIC患者作为研究对象。采用随机数字表法将患者分为对照组(乳果糖+常规治疗)与试验组(消胀通便膏+常规治疗),比较两组排便情况、生活质量以及治疗后的综合评价(包括经济成本、腹泻发生次数以及阿片类药物使用剂量是否有变化)。 结果 干预28 d后,两组患者在缓解OIC方面均有较好的效果(P<0.05),对于晚期肝癌患者生活质量、经济成本及腹泻次数方面,试验组均显著优于对照组(P<0.05)。 结论 在治疗晚期肝癌患者OIC中,使用外敷消胀通便膏和口服乳果糖液均可缓解便秘症状。其中,消胀通便膏更易被患者接受,且在生活质量和经济成本方面更优,对提高患者满意度和安全性是一个更佳的选择。 -
关键词:
- 阿片类药物相关性便秘 /
- 晚期肝癌 /
- 穴位贴敷 /
- 中药膏剂
Abstract:Objective To evaluate the curative effect ofeliminating flatulence and laxative cream on patients with advanced hepatocellular carcinoma and opioid-associated constipation(OIC). Methods 120 patients with advanced liver cancer complicated with OIC who were treated at the Third Affiliated Hospital of Naval Medical University from June 2021 to December 2022 were selected as the study subjects. The patients were divided into a control group(lactulose+conventional treatment)and an experimental group(eliminating flatulence and laxative cream + conventional treatment)using a randomized numerical table method. Two groups were compared in terms of defecation, quality of life, and comprehensive post-treatment evaluation(economic cost, number of occurrences of diarrhea, and whether or not there was a change in the dosage of opioids used). Results After 28 d of intervention, both groups showed better results in relieving OIC(P<0.05), and the experimental group was significantly better than the control group in terms of the quality of life of patients with advanced hepatocellular carcinoma, the economic cost and the number of diarrhea(P<0.05). Conclusion In the treatment of OIC in patients with advanced hepatocellular carcinoma, constipation could be relieved by using both topicaleliminating flatulence and laxative cream and oral lactulose solution. Among them, antieliminating flatulence and laxative cream was more acceptable to patients and superior in terms of quality of life and economic cost, which could be a better choice for improving patient satisfaction and safety. -
结直肠癌,又称大肠癌,好发于大肠黏膜,是常见消化系统恶性肿瘤,早期症状不明显不易发现,晚期则表现贫血、体重减轻等。由于现代生活节奏加快及各种不良饮食、作息、环境和遗传等因素的影响,使得我国的发病率逐年增加[1]。据《中国肿瘤登记年报》内容显示:2015年我国肿瘤登记地区结直肠癌发病率和病死率分别为17.1/10万和7.9/10万,发病率男女性别比和城乡比分别为1.5和1.4,病死率分别为1.6和1.4。与年报数据接近的《中国死因监测数据集》显示,2017年我国结直肠癌病死率为6.9/10万[2]。虽然,目前已有各种化疗、外科手术、中医治疗等诊治方法,但是仍然存在早期诊查率低、预后差等问题,患者术后5年的生存率仍没有得到较大的改善,故针对结直肠癌的诊疗研究亦成为现在的热点[3]。
卡培他滨(Cap)是结直肠癌辅助化疗及一线治疗药物,通常与多西他赛、奥沙利铂、爱必妥等联合应用,常见结直肠癌化疗方案是联合奥沙利铂。Cap是前体药,体内转化成氟尿嘧啶,并在肿瘤组织中代谢为5-氟尿嘧啶,从而抑制核苷酸的合成,发挥抗肿瘤作用。肿瘤组织中5-氟尿嘧啶的浓度是血液中的100倍以上,靶向性好,不良反应轻微,且大部分患者都可耐受[4]。手足综合征(HFS)是服用Cap后出现的常见药物不良反应,多为1~2级,少数达到3级。临床主要表现为进展性症状变化,早期症状主要发生在手掌和足底,出现不同程度的瘙痒,指尖、手掌和足底充血,之后会持续发展为手掌和足底的暗红和肿胀,随后产生水泡,最终发展为脱皮,极大影响患者用药依从性及生存质量,成为后期持续治疗效果不佳的严重因素之一[5]。Cap导致HFS的发病机制尚不清楚,但病理特征表现为不同程度的细胞点片坏死、轻度的海绵状水肿、血管扩张、表皮与真皮交界处有炎性渗出。有研究表明[6-8],显微镜镜下观察到血管舒张和水肿,类似于炎症反应,而炎症发生时,活跃的炎症因子主要有白介素类中的IL-1β、IL-6、IL-10、IL-12、IL-17、IL-23,肿瘤坏死因子(TNF-α)、干扰素(IFN-γ)、C-反应蛋白(CPR)以及趋化性细胞因子(CCL-5)。因此,本研究对出现HFS的结直肠癌患者血浆中的主要炎症因子进行考察,推测其中涉及到的炎症因子,建立炎症因子含量变化与HFS发生的相关性,为Cap发生HFS的防治提供一定参考。
1. 材料和方法
1.1 一般资料
选取2018年9月至2019年2月海军军医大学附属长征医院普外科接受卡培他滨化疗方案的35例结直肠癌患者作为本次研究对象。纳入标准:①年龄≥18周岁;②经临床确诊为结直肠癌的患者;③接受了以Cap为基础的化疗;④预计生存期≥3个月,无主要器官的功能障碍;⑤有化疗指证,包括心肝肾等脏器功能正常,骨髓造血功能正常;⑥治疗前病情评估应有完整的体格检查和实验室检查,包括全血细胞计数、生化功能检查等;⑦生活质量:首次出现先写中文名(KPS)评分≥60分;⑧自愿签署知情同意书。排除标准:①孕、哺乳期患者;②5年内患过其他恶性肿瘤者;③经临床确定,对FU类药物过敏或严重代谢不良的患者;④有严重感染的患者;⑤经临床确定,患有其他会影响实验结果的恶性疾病;⑥不符合纳入标准,未按规定用药,无法判断疗效,或资料不全等影响疗效或安全性判断者。HFS事件评价标准:根据美国卫生及公共服务部2009年出版的常见不良反应事件评价标准4.0(CTCAE v4.0)分级,1级:轻微皮肤改变或皮肤炎(红斑、水肿、角化过度、不痛);2级:皮肤改变(剥落、水泡、出血、肿胀、角化过度),疼痛,影响工具性日常生活活动;3级:重度皮肤改变(剥落、水泡、出血、水肿、角化过度),疼痛,个人自理能力受限。自患者服用Cap后进行临床观察,直到患者出现HFS后停止,收集患者出现HFS时的血液样本,采用EDTA-3K抗凝管采集血样,储存于−80 ℃冰箱冻存。本研究经过海军军医大学附属长征医院伦理委员会批准,35例患者基本信息及HFS信息见表1。
表 1 患者一般资料及HFS分级情况例数 性别 年龄(岁) 肿瘤部位 HFS分级 男 女 均值 中位数 直肠 结肠 未发生 1级 2级 3级 35 23 12 55.9 61 14 21 12 16 3 4 (65.7%) (34.3%) — — (29.9%) (70.1%) (34.2%) (45.7%) (8.5%) (11.4%) 1.2 仪器和耗材
Human IL-6 ELISA kit试剂盒、 Human IL-1β ELISA kit试剂盒、Human IL-10 ELISA kit试剂盒、Human IL-12p70 ELISA kit试剂盒、Human IL-17/IL-17A ELISA kit试剂盒、Human IL-23 ELISA kit试剂盒、Human IFN-γ ELISA kit试剂盒、Human CRP ELISA kit试剂盒、Human TNF-α ELISA kit试剂盒以及Human RANTES ELISA kit试剂盒均购自国润医疗供应链服务(上海)有限公司。酶标仪(Biotek,型号:800TSI)购自美国伯腾仪器(北京代表处)有限公司。37 ℃孵箱(型号:FYL-YS-151L,温度:0 ℃~100 ℃)由北京福意电器有限公司提供。
1.3 炎症因子指标检测方法
参照试剂盒说明书测定35例结直肠癌患者服用卡培他滨后血浆中各炎症因子包括白介素类中的IL-1β、IL-6、IL-10、IL-12、IL-17、IL-23, TNF-α,IFN-γ,CPR和CCL-5含量水平。将血液样本4 000 r/min离心15 min, 收集血浆样本,按照试剂盒说明书测定各炎症因子的含量。
1.4 统计学方法
使用 Microsoft Excel 软件进行统计结果分析,采用Graphpad Prism 8.3.0作图。
2. 结果
2.1 标准曲线
IL-23标准曲线的浓度为2 000、1 000、500、250、125、62.5、31.25 pg/ml;IFN-γ、IL-17、TNF-α、IL-12标准曲线的浓度为1 000、500、250、125、62.5、31.25、15.6 pg/ml;CCL-5、IL-1β的标准曲线的浓度为500、250、125、62.5、31.25、15.6、7.8 pg/ml;IL-6、CRP的标准曲线的标准品浓度为200、150、50、25、12.5、6.25、3.125 pg/ml;IL-10的标准曲线的浓度为50、25、12.5、6.25、3.125、1.56、0.78 pg/ml。各炎症因子标准曲线呈现良好线性关系,可为样本的检测提供阳性对照,见表2。
表 2 炎症因子线性范围及标准曲线炎症因子 线性范围pg/ml 标准曲线 r IL-23 0~2 000 Y=594.66X−23.268 0.994 8 IFN-γ 0~1 000 Y=384.31X+7.9709 0.999 3 IL-17 Y=1379X−12.849 0.997 9 TNF-α Y=352.02X+5.7229 0.999 7 IL-12 Y=448.55X+8.5172 0.994 6 CCL-5 0~500 Y=168.42X−12.215 0.997 2 IL-1β Y=206.82X−4.5823 0.999 6 IL-6 0~200 Y=67.278X−6.6851 0.996 7 CRP Y=90.523X -3.228 0.990 5 IL-10 0~50 Y=27.541X−0.403 0.997 5 2.2 样本实测
35例服用Cap后未发生与发生各级HFS的两类结直肠癌患者,其血浆中各炎症因子含量水平见表3。结果显示,不同级别的HFS各炎症因子含量存在一定的差异性,提示Cap诱发HFS会导致血浆中不同炎症因子相互作用发生级联反应。其中,TNF-α 的含量水平在发生HPS呈整体下调状态,且明显低于未发生者的含量水平。其余炎症因子含量水平变化则无规律可循(图1)。
表 3 不同分级HFS患者中的各炎症因子含量测定结果(pg/ml,$\bar x $ ±s)炎症因子 未发生 1级 2级 3级 浓度平均值 标准差 浓度平均值 标准差 浓度平均值 标准差 浓度平均值 标准差 IL-1β 83.64 203.67 60.98 180.17 8.96 5.03 303.17 303.50 IL-6 19.57 52.35 12.29 31.84 4.68 0.34 22.60 25.96 IL-10 8.280 17.19 10.53 26.67 0.17 0.11 0.10 0.03 IL-12 67.80 148.40 99.40 282.18 22.87 9.42 195.11 250.89 IL-17 316.96 807.82 413.09 1118.61 76.79 46.93 905.52 1361.64 IL-23 218.06 566.46 190.55 542.33 12.11 5.95 663.67 911.80 IFN-γ 89.87 248.25 77.82 209.39 17.36 5.01 274.05 392.16 CRP 52.99 85.03 65.77 91.81 6.91 3.49 157.98 114.55 TNF-α 221.01 461.14 58.98 186.95 2.67 2.51 2.64 1.54 CCL-5 98.11 30.01 87.84 20.60 101.78 19.20 85.93 15.49 注:未发生HFS 12例;1级HFS 16例;2级HFS 3例;3级HFS 4例 3. 讨论
随着结直肠癌发病率的上升,Cap的临床应用越来越广泛,其带来的不良反应也急剧增加,其中,HFS严重影响患者生活质量以及用药依从性,更甚者则终止治疗,故必须对Cap诱发HFS进行药学监护[9-10]。临床常见的监护策略主要有减少给药剂量、中断药物治疗以及使用其他药物(如塞来昔布胶囊200 mg,po,bid +尿素乳膏涂抹患处,tid)干预HFS严重程度等方法。肿瘤坏死因子(TNF-α)是机体重要的炎性细胞因子之一,具有多生物学效应及生理病理性功能,且TNF-α在HFS发生的不同程度时血浆中含量有显著变化,推测TNF-α 血浆中含量水平越低发生HFS的程度越严重,并在进行药学监护时具有一定参考价值。
本实验以HFS为主要研究方向,对患者血浆中炎症因子进行检测,结果发现Cap诱发不同程度HFS血浆中的炎症因子含量有一定的差异性。由于临床化疗治疗医生很少让患者的HFS进展到2、3级再进行处理,所以患者例数较少,数据不能支撑比较。但对未发生与1级HFS比较发现,1级HFS患者血浆中IL-1β、IL-6、IL-23、IFN-γ、TNF-α、CCL-5的含量明显低于未发生HFS患者;而IL-10、IL-12、IL-17、CRP血浆中含量明显高于未发生HFS患者,且TNF-α浓度水平变化较为明显。目前,Cap诱发HFS的发生机制尚不清楚,可能是多途径炎症因子相互作用的结果。因此,关注定血浆炎症因子含量水平变化,在一定程度上可以反应Cap诱导HFS的严重程度,通过测定血浆中炎症因子含量的变化,有利于防治Cap诱发HFS情况,并对临床有重要的指导意义。
-
表 1 两组患者一般资料比较
项目 对照组 试验组 t/χ2 P 性别 − − 0.406 0.524 男 33 31 − − 女 19 23 − − 年龄(岁) 59.75±15.81 61.43±15.49 −0.551 0.583 文化程度 − − 2.944 0.229 初小 3 6 − − 中学 28 34 − − 专科及以上 21 14 − − 婚姻状况 − − 0.597 0.440 已婚 36 41 − − 离婚或丧偶 16 13 − − 独居 − − 0.366 0.545 是 10 13 − − 否 42 41 − − 表 2 两组患者便秘自评量表治疗前、治疗后对比
治疗天数 对照组 试验组 t/χ2 P 治疗前 2.57±0.72 2.49±0.74 0.551 0.583 治疗后14 d 1.86±0.62 1.64±0.66 1.715 0.089 治疗后28 d 1.45±0.56 1.05±0.37 4.323 <0.001 表 3 两组患者治疗前、治疗后生活质量比较
治疗天数 对照组 试验组 t/χ2 P 治疗前 100.42±12.59 99.89±16.46 0.187 0.852 治疗后14 d 91.67±12.57 89.39±15.65 0.827 0.41 治疗后28 d 91.85±9.81 84.35±10.48 3.797 <0.001 表 4 两组患者治疗后综合评价对比
评价项目 对照组 试验组 t/χ2 P 经济成本(元) 146.39±21.70 95.50±4.81 16.81 <0.001 发生腹泻的次数 4.83±3.02 2.56±1.42 4.981 <0.001 阿片类药物使用
剂量增加(例数)42 35 21.736 <0.001 -
[1] TACHI K, AGYEI-NKANSAH A, ARCHAMPONG T. Hepatocellular carcinoma in Ghana: a retrospective analysis of a tertiary hospital data[J]. Pan Afr Med J, 2020, 36:43-50. [2] SURESH N V, HARRIS J, CHORATH K, et al. Clinical practice guidelines in the management of breakthrough cancer pain: a systematic review using the appraisal of guidelines for research and evaluation(AGREE II)instrument[J]. Pain Manag Nurs, 2022, 23(4):411-417. doi: 10.1016/j.pmn.2022.02.010 [3] 陈泽刚, 赵春妮, 张林松. 便秘通对癌症患者阿片类药物相关便秘的疗效及安全性研究[J]. 中国全科医学, 2019, 22(25):3144-3148. [4] SCARBOROUGH B M, SMITH C B. Optimal pain management for patients with cancer in the modern era[J]. CA Cancer J Clin, 2018, 68(3):182-196. doi: 10.3322/caac.21453 [5] 侯玉丽, 郭鸿雁, 王忠, 等. APRI与血氨联合对肝硬化并肝性脑病的诊断价值评估[J]. 北京医学, 2018, 40(4):289-292,385. [6] National Health Commission of the People’s Republic of China. 癌症疼痛诊疗规范(2018年版)[J]. 临床肿瘤学杂志, 2018, 23(10):937-944. [7] MIA S H, MICHAEL I B, STEPHANIE A, et al. Oxycodone for cancer-related pain[J]. Cochrane Database Syst Rev, 2022, 6(6):CD003870. [8] 方秀才. 罗马Ⅳ诊断标准在慢性便秘诊断中的应用[J]. 中华胃肠外科杂志, 2016, 19(12):1321-1323. doi: 10.3760/cma.j.issn.1671-0274.2016.12.001 [9] LI J W, GOH B B G, CHANG P E, et al. Barcelona Clinic Liver Cancer outperforms Hong Kong Liver Cancer staging of hepatocellular carcinoma in multiethnic Asians: real-world perspective[J]. World J Gastroenterol, 2017, 23(22):4054. doi: 10.3748/wjg.v23.i22.4054 [10] 李虹义, 魏振军, 刘端祺. 阿片类药物相关性便秘的诊疗[J]. 中国肿瘤临床, 2015, 42(12):603-607. doi: 10.3969/j.issn.1000-8179.20141909 [11] 邹玲, 代金刚. 基于“子午流注”理论解析中医时辰导引及其应用[J]. 中医药学报, 2021, 49(7):6-9. [12] 宋玉磊, 林征, 林琳, 等. 中文版便秘患者症状自评量表的信度与效度研究[J]. 护理学杂志, 2012, 27(7):73-76. doi: 10.3870/hlxzz.2012.07.073 [13] 万克艳, 李微, 杨铮, 等. 基于FACT-Hep量表的肝癌患者生活质量影响因素分析[J]. 广东医学, 2015, 36(18):2889-2893. [14] 薛楚, 刘思雪, 黄芳. 罂粟科植物罂粟、延胡索和岩黄连镇痛作用的研究进展[J]. 药学研究, 2019, 38(5):290-294. [15] 袁伟琛, 李慧杰, 齐元富. 中医药治疗恶性肿瘤相关性便秘研究进展[J]. 山东中医药大学学报, 2022, 46(6):776-781. [16] 张强, 邵明义, 王琳琳, 等. 中医药治疗原发性肝癌研究述评[J]. 河南中医, 2021, 41(3):454-457. [17] 张天宏, 刘秀凤, 王华, 等. 姜砂半夏纳米贴治疗疾病终末期患者恶心呕吐疗效及对肿瘤患者QOL影响[J]. 药学实践与服务, 2023, 41(6):380-384. -





 下载:
下载:
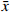
 下载:
下载: 

