-
肝癌(HCC)是常见的恶性肿瘤之一,尤其在我国特别高发,全球HCC患者超过半数在中国。2022年我国HCC发病率达36.77/10万人,位于恶性肿瘤第4位;总体病死率达31.65/10万人,居恶性肿瘤第2位[1]。HCC已然成为我国一项社会公共卫生问题,严重危害国民健康,给国民经济和社会发展带来沉重负担[2-4]。目前手术及肝移植可以临床治愈早期HCC,但多数患者诊断时已是晚期[5]。尽管免疫检查点抑制剂和小分子多靶点酪氨酸激酶抑制剂联合治疗法为晚期HCC患者带来了希望,但患者的中位生存期仅提高至19.2个月[6]。中医药治疗晚期HCC有其独特的优势,可以增强化疗、靶向、免疫治疗疗效,减轻毒副作用,改善症状,延长患者总生存期。因此运用中医药探索晚期HCC患者的治疗方案,对阻止该疾病的进一步发展,延长患者生存期具有重要的意义。
八宝丹起源于明代,至今有近400年的应用历史,是原国家食品药品监督管理总局允许使用天然麝香的特效药之一。八宝丹成分包含天然牛黄、天然麝香、蛇胆、羚羊角、珍珠、三七等。既往研究已证实,八宝丹可用于急慢性肝炎、胆囊炎等肝胆系统疾病,具有清热利湿、祛黄解毒的功效[7-8],并且八宝丹对HCC、胰腺癌、胆囊癌等消化系统肿瘤性疾病疾也有治疗效果[9-10]。本团队前期研究发现,八宝丹可以通过抑制慢性炎症介导的肝纤维化进而抑制HCC的发生,但八宝丹对于晚期HCC的治疗作用机制尚未明确[11]。因此探寻八宝丹对晚期HCC的作用机制可为中医药治疗HCC提供证据。
二乙基亚硝胺(DEN)诱导的大鼠模型是一个成熟的原发性HCC模型。DEN模型中HCC的发展过程与人类HCC相似,是一种非常合适研究HCC的生物工具[12]。本研究利用DEN大鼠观察八宝丹对HCC的影响,发现其能有效延缓HCC进展,但是作用机制尚不明确。由于八宝丹成分复杂多样,需要多组学分析技术探明八宝丹中有效药物成分与疾病的互作关系,因此本研究基于网络药理学和UPLC-MS方法,筛选八宝丹治疗HCC的有效化合物和潜在治疗靶点,构建“疾病-基因-药物”的多层次网络,揭示八宝丹调控疾病进展的潜在机制,为八宝丹的“老药新用”和HCC晚期患者的临床用药提供新思路。
-
八宝丹胶囊(批号Z10940006,厦门中药厂有限公司)、甲醇(A452-4,Fisher)、乙腈(A998-4,Fisher)、甲酸(A117-50,Fisher);DEN(245437, Sigma-Aldrich);高效液相色谱仪(ACQUITY UPLC I-Class HF,Water)、色谱柱(ACQUITY UPLC HSS T3,100 mm×2.1 mm, 1.8 μm, Water)、PDA检测器(ACQUITY Premier PDA eλ,Water);高分辨液质联用质谱仪(Thermo-Obritrap-QE,Thermo)。
-
将32只SD大鼠(6~8周龄,180~200 g,雄性,SPF级)随机分为 4 组,每组8只,分别为:对照组、八宝丹组、DEN 诱导组(DEN组)、DEN+八宝丹组。DEN组和DEN+八宝丹组连续饲喂12周DEN溶液(95 μg/ml), 对照组和八宝丹组饲喂灭菌水。八宝丹组不进行DEN诱导,从第12周开始予以八宝丹给药。DEN 诱导组,DEN饮水喂养大鼠持续12周,诱导HCC的发生,然后使用生理盐水灌胃,1次/2 d ,持续4周。DEN+八宝丹组,DEN诱导HCC发生后,八宝丹按照0.5 g/kg的剂量对实验动物进行灌胃,1次/2 d,持续4周(图1A)。实验结束后处死部分大鼠获取肝脏组织标本,剩余部分停药后继续观察生存期。
-
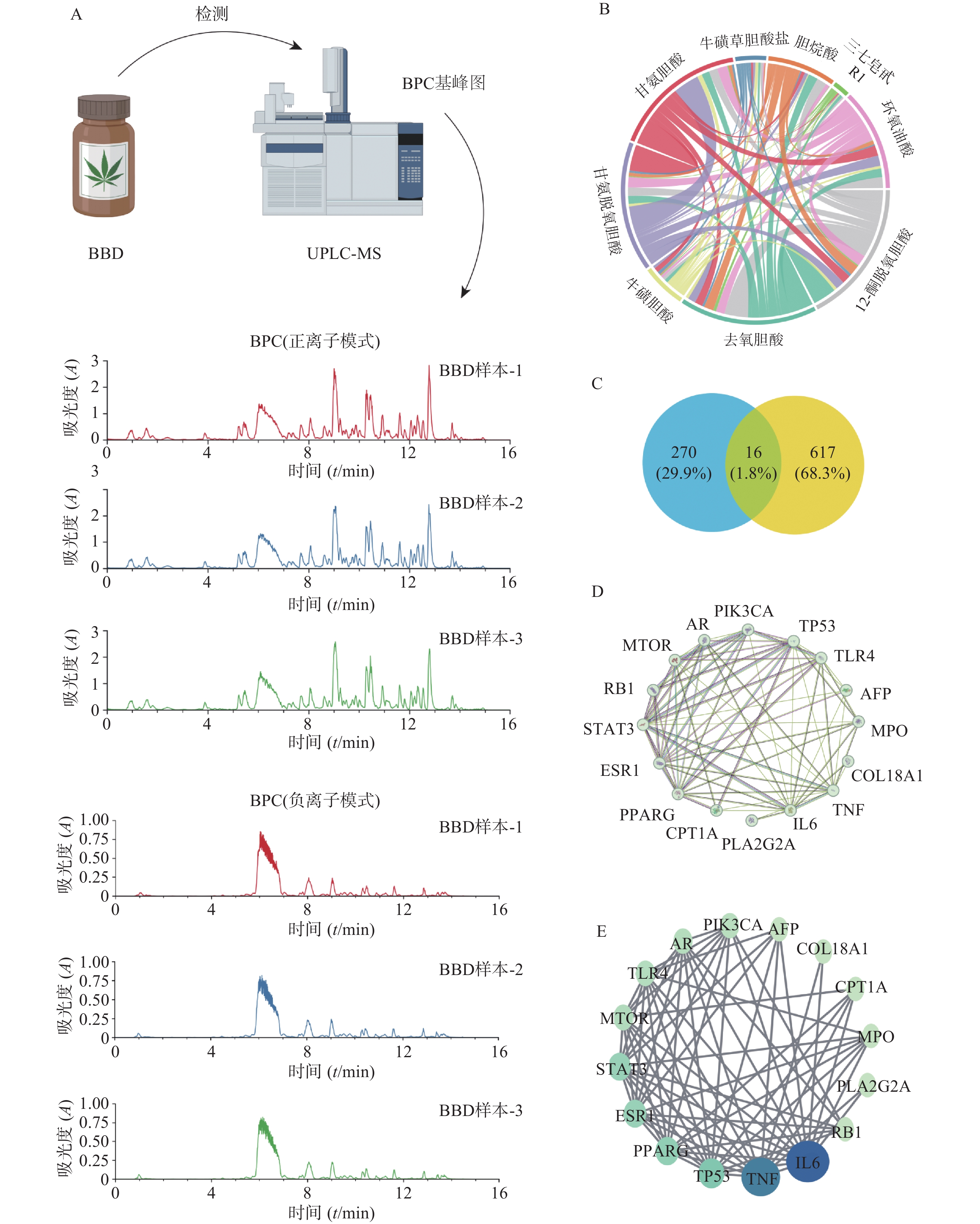
将八宝丹取出,用液氮研磨均匀后,称取约98.3 mg样本于1.5 ml离心管中;加入983 μl 甲醇-水溶液(V/V=3∶1,含混合内标,4 μg/ml),涡旋震荡1 min,加入钢珠;放入−40 ℃冰箱中预冷2 min后,在研磨机中研磨(60 Hz,2 min);冰水浴超声提取60 min,−40 ℃下静置30 min;离心10 min(12 000 r/min,4 ℃),取全部上清液过0.22 μm的有机相滤膜;4 ℃下静置过夜,离心10 min(12 000 r/min,4 ℃),取上清液过0.22 μm的有机相滤膜置于内衬管的LC-MS进样小瓶中进行分析。本次实验的分析仪器为ACQUITY UPLC I-Class HF超高效液相串联QE高分辨质谱仪组成的液质联用系统。色谱条件:色谱柱(ACQUITY UPLC HSS T3,100 mm×2.1 mm, 1.8 μm);柱温:45 ℃;流动相:水(含0.1%甲酸)和乙腈,梯度洗脱信息详见表1;流速:0.35 ml/min;进样体积:5 μl;PDA扫描范围210~400 nm。质谱条件:离子源(HESI,样品质谱信号采集分别采用正负离子扫描模式);数据采集模式为DDA;扫描方式为Full MS/dd-MS2(TOP 8);质谱参数详见表2。
表 1 八宝丹梯度洗脱信息
时间(t/min) 水(含0.1%甲酸)(%) 乙腈(%) 0 95 5 2 95 5 4 70 30 8 50 50 10 20 80 14 0 100 15 0 100 15.1 95 5 16 95 5 表 2 Thermo-Obritrap-QE质谱参数信息
参数 正离子 负离子 喷雾电压(U/V) 3 800 −3 000 毛细管温度(T/°C) 320 320 辅助气体加热器温度(T/ ℃) 350 350 鞘气流量(Arb) 35 35 辅助气体流速(Arb) 8 8 S透镜射频水平 50 50 质量范围(m/z) 100~1 200 100~1 200 全质谱分辨率 70 000 70 000 串联质谱分辨率 17 500 17 500 质谱仪二级碎裂能量 10,20,40 10,20,40 -
八宝丹 UPLC-MS数据由上海欧易生物医学科技有限公司提供,根据八宝丹化学成分在210 nm 和 254 nm波长下的紫外吸收图初步确定其结构类型。质谱数据经Progenesis QI v3.0 软件(Nonlinear Dynamics, Newcastle, 英国)处理(基线过滤、峰识别、积分、保留时间校正、峰对齐和归一化)获得八宝丹的质谱峰表。
-
八宝丹的质谱峰表中化合的鉴定基于精确质量数、二级碎片以及同位素分布,并结合TCM数据库(上海欧易生物医学科技有限公司,中国)进行鉴定。在本研究中,质谱峰表中对各鉴定物质进行评分,满分80分,其中,一级质谱精确分子量匹配,20分;二级质谱碎片匹配,20分;同位素分布匹配,20分;保留时间匹配,20分。将化合物相对峰面积的总含量定为100%,得到定性定量结果数据矩阵,并规定峰面积的比值大于1%,总分大于55,一级分子量误差在1.4×10−6以内的化合物作为八宝丹的有效成分进行后续分析。
-
根据前期筛选出的有效化学成分导入 PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库查找与有效活性成分相对应的Smiles号,并将Smiles号导入 Swiss Target Prediction(http://swisstargetprediction.ch/)和SuperPred(https://prediction.charite.de/subpages)数据库进行有效活性成分对应靶点的预测,保留结合可能性1%以上或文献报道过与化合物相关的作用靶点。根据各成分相关基因富集情况,利用R(version 3.6.1)构建各组分之间互作网络。
-
使用 GeneCards(https://www.genecards.org/)数据库、OMIM(https://omim.org/)数据库和Therapeutic Target Database(https://db.idrblab.net/)筛选HCC对应靶点,以“Hepatocellular carcinoma”为关键词进行筛选。并根据文献比对,保留与HCC相关的靶点用于后续研究。
-
根据前期有效成分相关靶点筛选和HCC相关靶点的选择,取交集进行后续分析。将共同靶点的数据导入STRING数据库(https://cn.string-db.org/)构建蛋白互作网络,再利用Cytoscape3.9.0软件,以介数中心数为参考,筛选出关键调控蛋白。
-
将有效成分和HCC之间的共有靶点导入 DAVID(https://david.ncifcrf.gov/)数据库,设置物种为人,P<0.01,分别勾选 GO 分析中的生物过程、细胞组成 、分子功能以及Pathway 中的 KEGG 进行富集分析,提取结果后,应用微生信(http://www.bioinformatics.com.cn/)平台将富集分析结果可视化。
-
将有效成分和HCC之间的共有靶点依次导入GEPIA2 (http://gepia2.cancer-pku.cn/)中,以182例TCGA数据库中保留的临床HCC患者的RNA测序数据为基础,分析共有靶点与患者生存期的相关性。
-
大鼠被处死后,用磷酸盐缓冲盐水和 4% 多聚甲醛进行经心灌注。取肝脏组织进行病理评估。石蜡包埋后肝脏切成 5 µm 厚的切片。染色时将HCC组织石蜡切片,60 ℃烘烤固片30 min;脱蜡至水,并按照生产商的方案用苏木精-伊红染色,最后镜下观察各组织病理学情况。
-
使用 GraphPad Prism 9.0 软件进行方差分析,每次实验的定量数据以平均值±标准差表示,组间差异采用t检验。Kaplan-Meier 分析用于进行生存期分析。采用对数秩检验比较各组存活时间。以P<0.05为差异有统计学意义。
-
在实验观察期间,对照组和八宝丹组的大鼠均存活,而DEN组平均生存期为17.1周,DEN+八宝丹组平均生存期为23周,是DEN组的1.35倍(图1B)。同时观察肝脏大体发现,对照组和八宝丹组肝脏组织未见异常;DEN 组肝脏组织中均出现大量肉眼可见肿瘤结节;而DEN+八宝丹组肝脏组织中虽然出现了部分肉眼可见的肿瘤结节,但大体形态上相较于DEN组损伤较轻(图1C)。通过对肿瘤结节的最大直径和数量测量统计发现DEN+八宝丹组肿瘤负荷和最大肿瘤直径显著小于DEN组(图1D)。同时,对各肝脏组织进行病理学评估和H&E染色结果发现,八宝丹组和正常肝脏组织组织排列紧密,未出现肝脏损伤,而DEN组出现明显的组织空泡化,组织间排列弥散,肝脏损伤严重。尽管DEN+八宝丹组大鼠肝脏组织相较于八宝丹组和正常对照大鼠出现了明显的炎症浸润和肝纤维化,但是,相较于DEN组的肝脏组织损伤较轻且组织排列较为紧密(图1E)。H&E染色结果表明,八宝丹对大鼠肝脏未发现实质性病理损伤,并且缓解了同期DEN大鼠的肝脏病理状态。上述结果表明,八宝丹能延缓DEN大鼠的生存期并减少肿瘤负荷,但是具体机制尚不明了。
-
为进一步探索八宝丹对HCC的影响机制,本研究首先对八宝丹进行UPLC-MS中药化学成分检测。中药成分鉴定流程如图2A所示,将八宝丹颗粒进行溶解、研磨、过滤和提纯后上机检测。紫外吸收图谱发现,210 nm处皂苷类成分在该波长下有强吸收,254 nm处含有苯环、双键等结构的成分在该波长下有强吸收。然后通过基峰色谱图反应样品的整体信息,3次重复性检测结果可知该检测方法离子相应响度、保留时间重复性良好,由此说明本次实验仪器稳定、数据可靠。原始数据经Progenesis QI软件处理和TCM数据库进行定性后,共发现851个中药成分,保留9个主要活性成分供后续研究,分别是牛磺草胆酸盐、12-酮脱氧胆酸、去氧胆酸、牛磺胆酸、甘氨脱氧胆酸、甘氨胆酸、三七皂苷R1、环氧油酸和3α,7α-二羟基-12-羰基-5β-胆烷酸。将主要活性成分信息分别导入PubChem和Swiss Target Prediction数据库,共获得285个潜在作用靶点,并绘制出化合物之间的互作网络,发现八宝丹中主要化学成分之间关系密切,相互存在多个共有靶点(图2B)。在Therapeutic Target Database、GeneCards、OMIM数据库和文献中共筛选出与HCC相关的靶点637个,保留八宝丹与HCC共有相关性靶点16个(图2C)作为潜在调控分子。将潜在调控分子导入STRING数据库构建蛋白与蛋白间互作网络(图2D),再利用Cytoscape3.9.0软件,以介数中心数(网络中所有最短路径中经过该节点的路径的数目占最短路径数的比例)为参考,将潜在调控分子进行排序,介数中心数越大,圆形的直径越大,颜色越蓝,说明在该网络中的关联度就越高,反之圆形的直径越小,颜色越绿(图2E)。其中,潜在调控分子介数中心数排名前5的分别是:白介素-6(IL-6)、肿瘤坏死因子(TNF)、细胞肿瘤抗原p53(TP53)、过氧化酶增殖因子活化受体-γ(PPARG)和雌激素受体1(ESR1)。
-
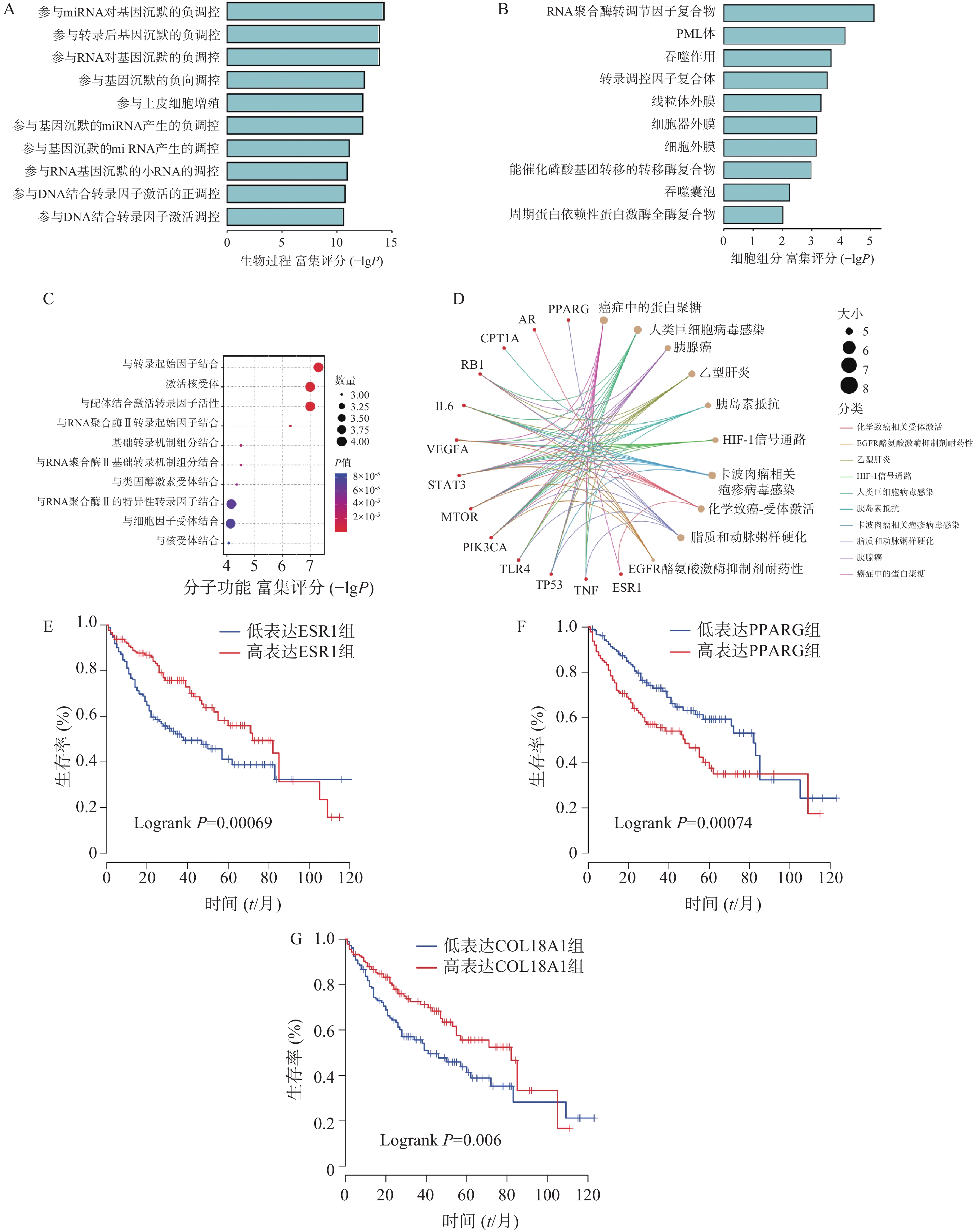
为探索八宝丹调控HCC的潜在作用机制,本研究基于DAVID数据库将上述16个共有相关靶点进行GO及KEGG富集分析。GO富集分析显示802个生物过程、11个细胞组成、43个分子功能,KEGG通路富集分析共90条通路,展示排名前10的富集条目。
图3A提示八宝丹在生物过程中通过沉默细胞中mRNA的转录,抑制上皮样细胞的增殖和转录因子的结合调控HCC;图3B提示八宝丹有效化学成分在细胞层面上通过结合各种细胞器或细胞膜受体发挥作用;图3C提示八宝丹有效化学成分能调控转录因子的结合、细胞因子的分泌及细胞核的状态。图3D提示八宝丹调控HCC是通过多通路、多靶点之间的相互作用。最后在TCGA数据库中查询了共有相关靶点与HCC患者的临床相关性,在182例临床样本的调查中发现,3个基因的高表达提示着患者的总生存期较短,分别为ESR1 (Logrank P=0.000 69)、PPARG(Logrank P=0.000 74)和COL18A1(Logrank P=0.006),详见图3E~G,P值由Kaplan-Meier生存曲线和log-rank检验确定。
-
HCC是一种典型的炎症相关癌症,近90%的HCC与病毒性肝炎、过度酒精摄入、非酒精性脂肪肝或酒精性脂肪肝引起的长期炎症相关。在HCC慢性炎症微环境中,先天免疫细胞和成纤维细胞被募集并激活至损伤部位分泌细胞因子和生长因子,有利于肿瘤细胞的增殖或抵消凋亡[6]。研究表明,NF-κB和JAK-STAT两条经典通路是促进HCC的关键炎症信号通路,抑制炎症通路的激活能有效抑制住HCC进一步进展[13]。八宝丹作为传统中药复方,临床上已发现对HCC、胰腺癌、胆囊癌等消化系统肿瘤性疾病疾也有着积极的治疗效果,但是具体机制尚不明了。本团队前期研究发现,八宝丹可以通过抑制炎症细胞因子分泌和减少肝前体细胞上TRL4的表达,从抑制肝前体细胞的肿瘤转化,进而抑制肿瘤发生[11]。因此本研究团队假设八宝丹减缓了原发性HCC的肿瘤进展。
在本研究中,通过观察八宝丹对DEN诱癌大鼠的影响,发现八宝丹可以延长DEN大鼠的生存期,并且缓解DEN导致的肝脏肿瘤负荷。但是,目前尚未有具体的机制阐明这一现象。为探索是八宝丹中何种中药成分发挥了作用,利用UPLC-MS技术检测出化学成分851个,鉴定出主要活性成分9个,其中大部分是人体胆汁酸中主要成分,也发现具有强抗炎作用的三七皂苷R1[14],主要活性成分之间关系密切。共筛选出285个潜在作用靶点。在与HCC相关靶点取交集后,筛选出八宝丹调控HCC的16个潜在靶点。利用上述靶点构建了八宝丹“化学成分-潜在靶点”网络模型以及PPI网络,将潜在作用靶点进行排序,发现了HCC小鼠模型已验证能加速HCC的发展并影响肿瘤的侵袭性免疫信号IL-6和TNF[15];HCC中的显性突变驱动因子TP53和RB1[16];与HCC炎症相关的信号分子STAT3;与肿瘤细胞增殖相关的分子MTOR和AFP[17]。
GO富集分析结果提示,八宝丹调控HCC在生物过程上参与miRNA对基因的沉默负调控、转录后miRNA对基因的沉默负调控、RNA对基因的沉默负调控等;在细胞组分上富集到RNA聚合酶Ⅱ转录调节因子复合物、吞噬作用相关受体、细胞膜受体等词条;在分子功能上富集到与转录起始因子结合,激活核受体,与配体结合激活转录因子活性等。KEGG信号通路提示,八宝丹参与了癌症中的蛋白聚糖、乙型肝炎、HIF-1信号通路、化学致癌受体激活、EGFR络氨酸激酶抑制剂耐药等通路。TCGA数据库中发现,ESR1、PPARG和COL18A1高表达与HCC患者总生存期密切相关。据报道,PPARG高表达可激活WNT/CTNNB1信号通路,从而维持肿瘤细胞干性特征,促进癌症进展[18]。人类HCC临床样本调查和组织染色也证实,ESR1可通调控miR-141-3p /GSN信号影响原发性HCC进展[19];肌成纤维细胞分泌的胶原α-1(ⅩⅤⅢ)链(COL18A1)可促进肿瘤转移,加速HCC进展[20]。因此TCGA结果提示,八宝丹可能是通过调控ESR1、PPARG和COL18A1来延长原发性HCC患者的生存期。
综上所述,本研究证实了八宝丹对治疗原发性HCC的积极影响,并且发现9种八宝丹的有效活性成分。还利用网络药理学的研究方法,分析揭示八宝丹可能是通过多靶点、多通路来调控原发HCC,并结合已有的研究进行分析验证,提出新的视角与思路,为后续的实验研究提供参考。
Potential mechanism of Babao Dan in the treatment of hepatocellular carcinoma based on network pharmacology
-
摘要:
目的 基于网络药理学探讨八宝丹对原发性肝癌(HCC)影响的潜在机制。 方法 首先利用二乙基亚硝胺诱导的原发性HCC大模型,观察八宝丹对HCC的影响;然后利用超高效液相色谱-串联质谱法(UPLC-MS)检测八宝丹中的有效成分,再在Swiss Target Prediction数据库等预测八宝丹有效成分的潜在作用靶点。运用GeneCards、OMIM和Therapeutic Target Database筛选HCC对应靶点,取交集后获得八宝丹与HCC的共同靶点。使用Cytoscape软件和STRING数据库绘制蛋白与蛋白间互作网络,筛选出八宝丹调控HCC的关键分子。利用DAVID数据库对有效作用靶点进行GO及KEGG富集分析。最后在TCGA数据库验证关键分子与HCC患者的临床相关性。 结果 八宝丹可延缓HCC大鼠肿瘤进展。UPLC-MS检测出八宝丹中化学成分851个,主要活性成分9个,作用靶点285个;筛选出HCC靶点637个,八宝丹调控HCC的靶点16个。GO富集分析显示802个生物过程、11个细胞组成、43个分子功能,KEGG通路共90条。TCGA相关性分析发现3个关键分子与HCC患者生存期相关。 结论 通过HCC大鼠模型发现,八宝丹可显著延长HCC大鼠的生存周期并减少肿瘤负荷,通过UPLC-MS及网络药理学方法初步预测八宝丹调控HCC的作用机制,表明八宝丹具有多成分、多通路、多靶点作用原发性HCC的特点,为进一步相关实验研究提供参考。 -
关键词:
- 原发性肝癌 /
- 八宝丹 /
- 网络药理学 /
- 超高效液相色谱-串联质谱 /
- 作用机制
Abstract:Objective To explore the potential mechanism of Babao Dan on primary liver cancer based on network pharmacology. Methods First, the diethylnitrosamine-induced hepatocellular carcinoma rat(HCC)model was used to observe the effects of Babao Dan. Then, the effective components in Babao Dan were detected by UPLC-MS, and the potential target sites of these effective components were predicted in the Swiss Target Prediction databases, etc. The corresponding target sites for HCC were screened using GeneCards, OMIM and Therapeutic Target Database, and the common target sites between Babao Dan and HCC were obtained after getting the intersection. The protein-protein interaction network was drawn by Cytoscape software and the STRING database, and the key molecules regulating HCC by Babao Dan were screened out. The effective target sites were subjected to GO analysis in the DAVID database and enrichment analysis in the Pathway’s KEGG. Finally, the clinical relevance of key molecules to liver cancer patients was verified by the TCGA database. Results Babao Dan could slow down the tumor development. 851 chemical components were detected in BaBao Dan by UPLC-MS , 9 major active components and 285 target sites were identified. 637 hepatocellular carcinoma-related targets were screened out, and 16 targets of Babao Dan regulating HCC were identified. GO enrichment analysis showed 802 biological processes, 11 cell compositions, and 43 molecular functions, while KEGG pathway enrichment analysis identified a total of 90 pathways. Correlation analysis of TCGA identified three key molecules associated with the survival of liver cancer patients. Conclusion In the primary rat liver cancer model, Babao Dan was found to significantly prolong the survival of cancer-induced rats and reduce tumor burden. The initial prediction of the mechanism by which Babao Dan regulating liver cancer was made through UPLC-MS analysis and network pharmacology methods, indicating that Babao Dan has the characteristics of multi-component, multi-pathway, and multi-target regulation of primary liver cancer, which could provide a reference for further relevant experimental research. -
Key words:
- hepatocellular carcinoma /
- Babao Dan /
- network pharmacology /
- UPLC-MS /
- mechanism of action
-
西红花为名贵药材,来源于鸢尾科植物番红花Crocus sativus L.的干燥柱头。原产于地中海地区、希腊、小亚细亚和伊朗,后经西藏传入国内,故又名藏红花[1]。《本草纲目》中记载番红花“主治心忧郁积、气闷不散,活血,亦治惊悸”[2]。2020版《中国药典》描述西红花具有活血化瘀、凉血解毒、解郁安神的功效[3]。越来越多的现代药理研究表明,西红花具有抗肿瘤、抗血小板聚集与凋亡、抗心血管细胞凋亡、降血脂和降血糖等活性[4–6],在健康和医疗领域具有重要作用。
世界卫生组织国际癌症研究机构(IARC)发布的最新数据,2020年全球癌症新发患者病例数超过1 930万例,癌症死亡患者接近1 000万例[7]。天然活性成分是抗肿瘤药物研发的重要来源[8]。有研究表明,西红花中特有的西红花酸、西红花苷等具有抗肿瘤活性[9],已有学者在西红花治疗结直肠癌、乳腺癌等的抗肿瘤作用方面进行了相关研究[10-11],但其主要活性成分及抗肿瘤作用机制仍需进一步探索。
网络药理学[12]将系统生物学、生物信息学、计算生物学、网络科学和靶向药理学相结合,从系统层次和生物网络的整体角度探讨成分—靶标—通路的相互作用关系,为中药多靶点、多成分、系统性、整体性的作用机制研究提供了有力的技术支撑,从而指导新药研发和临床诊疗。因此,本研究应用网络药理学结合反向分子对接的方法,对西红花的抗肿瘤作用成分及靶点机制进行研究,为深入探索西红花抗肿瘤药效物质基础及作用机制提供参考。
1. 方法
1.1 西红花化学成分获取
利用TCMSP平台获取西红花化学成分,口服生物利用度(oral bioavailability,OB)和类药性(drug-likeness,DL) 是药物筛选的关键参数,一般设置OB≥30%和DL≥0.18的化学成分作为候选药效成分,并结合文献报道[13–15]补充4个西红花化学成分。
1.2 西红花活性成分和肿瘤疾病相关靶点整理
应用TCMSP平台和PharmMapper[16]工具获取西红花活性成分的作用靶点,并借助UniProt数据库将靶点转换为对应基因。以“tumor”、“cancer”为关键词,在GeneCards(https://www.genecards.org/)、OMIM数据库(https://www.omim.org/)和TTD数据库(http://db.idrblab.net/ttd/)进行检索。将得到的疾病靶点和药物靶点取交集,作为药物作用于疾病的预测靶点。
1.3 “成分-靶点”网络的构建
根据预测的西红花药效成分、交集靶点,使用Cytoscape 3.9.1软件建立“成分-靶点”的网络图。
1.4 蛋白质相互作用网络(protein-protein interaction,PPI)的构建与分析
将药物疾病交集靶点输入String数据库构建PPI网络进行初步筛选,再将PPI网络导入Cytoscape 3.9.1中,以半数degree为参考标准,选取关键靶点。
1.5 基因功能注释和富集通路分析
将筛选获得的37个核心靶点录入Metascape平台(http://metascape.org/gp/index.html),物种设置为人,选择Custom Analysis,设置P<0.01,进行基因本体(gene ontology,GO)功能富集分析及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。
1.6 分子对接
将筛选出的西红花主要活性成分通过PubChem下载SDF格式;利用RCSB PDB数据库下载关键蛋白靶点,优先选择有配体、结构相对完整的晶体结构,并采用AutoDock Tools对获取的PDB蛋白分子进行除水、加氢、计算电荷预处理;使用AutoDock Vina进行分子对接,计算结合能;选取最优构象,使用PyMOL软件做出3D结合模式图。
2. 结果
2.1 西红花化学成分获取
通过TCMSP获得70个西红花化学成分,设置OB≥30%且DL≥0.18进行筛选,再添加文献检索相关成分,共获得9个西红花活性成分,见表1。
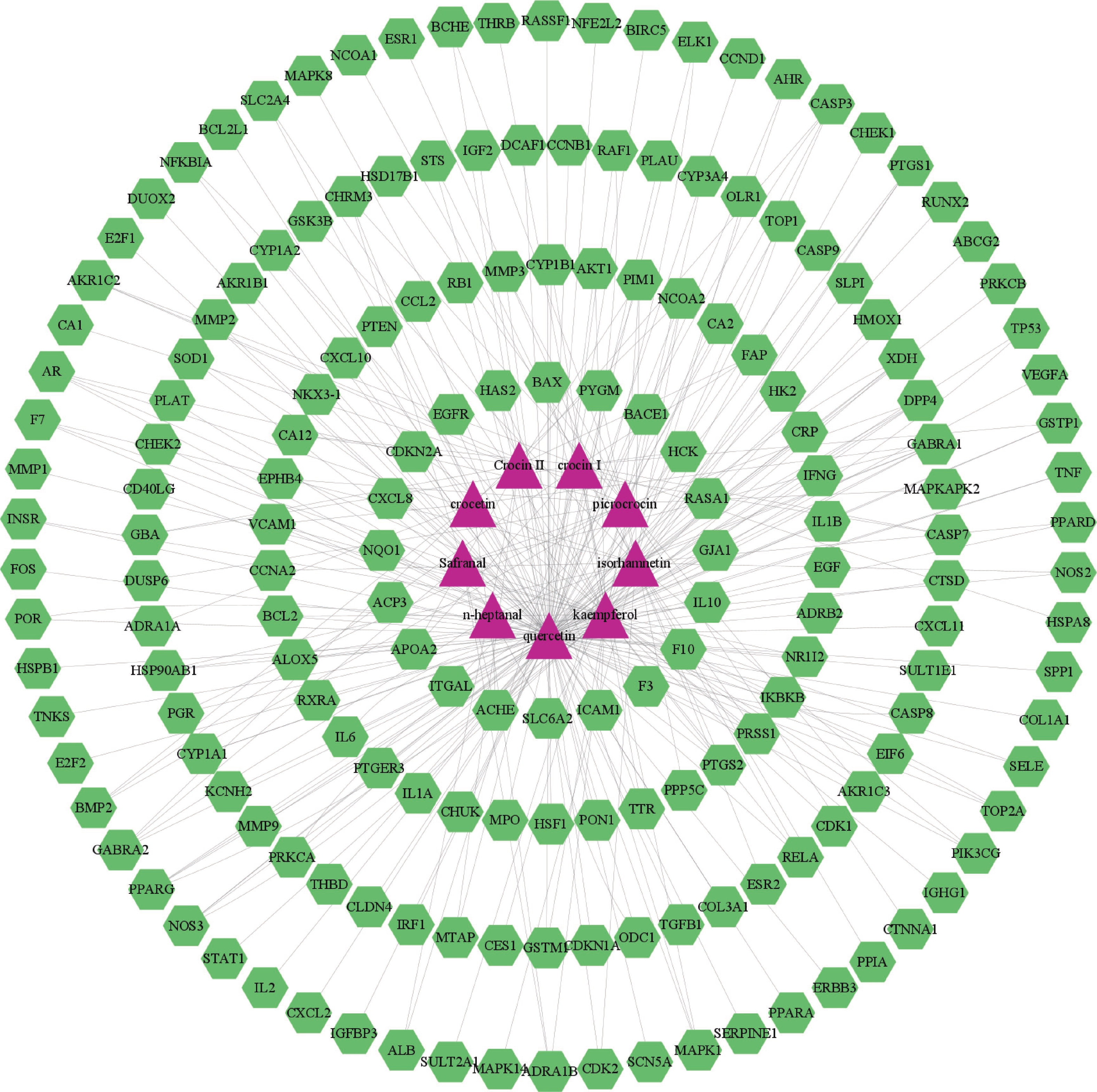
表 1 西红花活性成分序号 化合物编号 化合物英文名 中文名 OB (%) DL 1 MOL001389 n-heptanal 庚醛 79.74 0.59 2 MOL001406 crocetin 西红花酸 35.3 0.26 3 MOL000354 isorhamnetin 异鼠李素 49.6 0.31 4 MOL000422 kaempferol 山柰酚 41.88 0.24 5 MOL000098 quercetin 槲皮素 46.43 0.28 6 MOL001405 crocin Ⅰ 西红花苷Ⅰ 2.54 0.12 7 MOL001407 crocin Ⅱ 西红花苷Ⅱ 1.65 0.21 8 MOL000720 safranal 藏红花醛 39.56 0.04 9 MOL001409 picrocrocin 苦番红花素 33.71 0.04 2.2 西红花活性成分和肿瘤疾病靶点
将TCMSP平台和PharmMapper获取结果进行整理,并借助UniProt数据库进行靶基因匹配,获得201个潜在靶点。以“tumor”和“cancer”为关键词,在GeneCards、OMIM和TTD数据库进行预测整理,剔除重复,筛选得到5896个潜在疾病靶点。将得到的疾病靶点和药物靶点取交集,共得到可作为药物作用于疾病的179个预测靶点。
2.3 “成分-靶点”网络的构建与分析
将西红花的9个活性成分与预测到的179个潜在靶点导入Cytoscape 3.9.1软件,构建“药物-活性成分-靶点”网络(图1),网络中绿色代表药物作用于疾病的靶点,蓝色代表西红花活性成分,全图包括189个节点、299条边,其中degree值排名靠前的活性成分为槲皮素、山柰酚、异鼠李素、苦番红花素和西红花苷Ⅰ,这些可能是西红花发挥抗肿瘤作用的潜在活性成分。
2.4 蛋白相互作用PPI的构建与分析
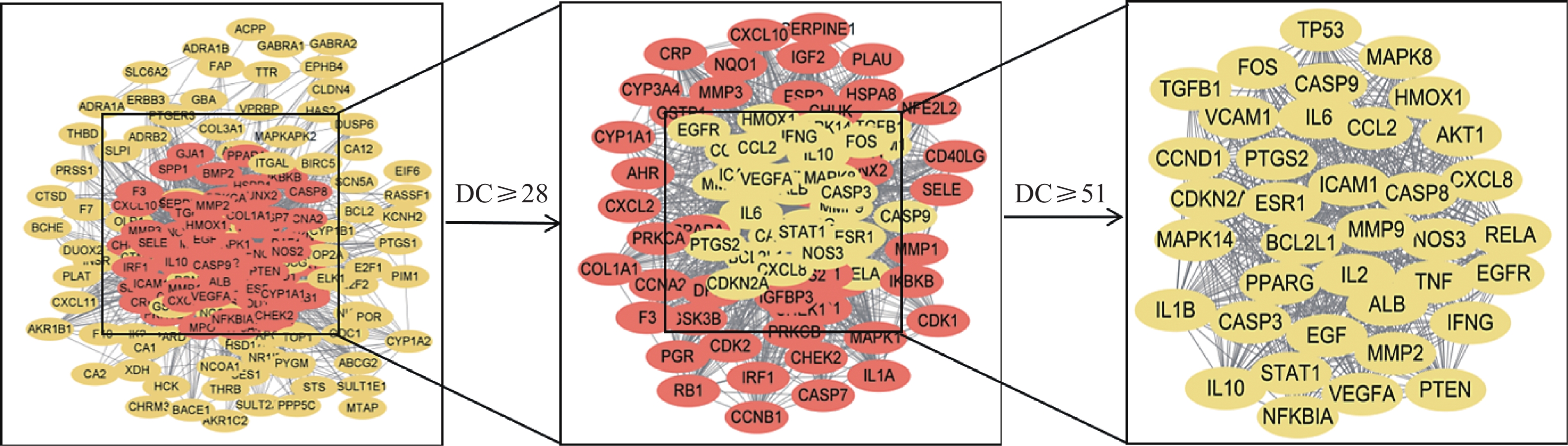
将疾病与活性成分的潜在靶点导入String数据库,采用Cytoscape 3.9.1软件绘制PPI网络图,依据degree值进行排序,以大于半数degree值为标准进行两次筛选,获取核心靶点37个(图2)。度值排名前5的靶点分别为EGF、MMP9、NFKBIA、IL-1B和IL-10,提示这些靶点可能是西红花发挥抗肿瘤作用的关键潜在靶点。
2.5 基因功能注释和富集通路分析
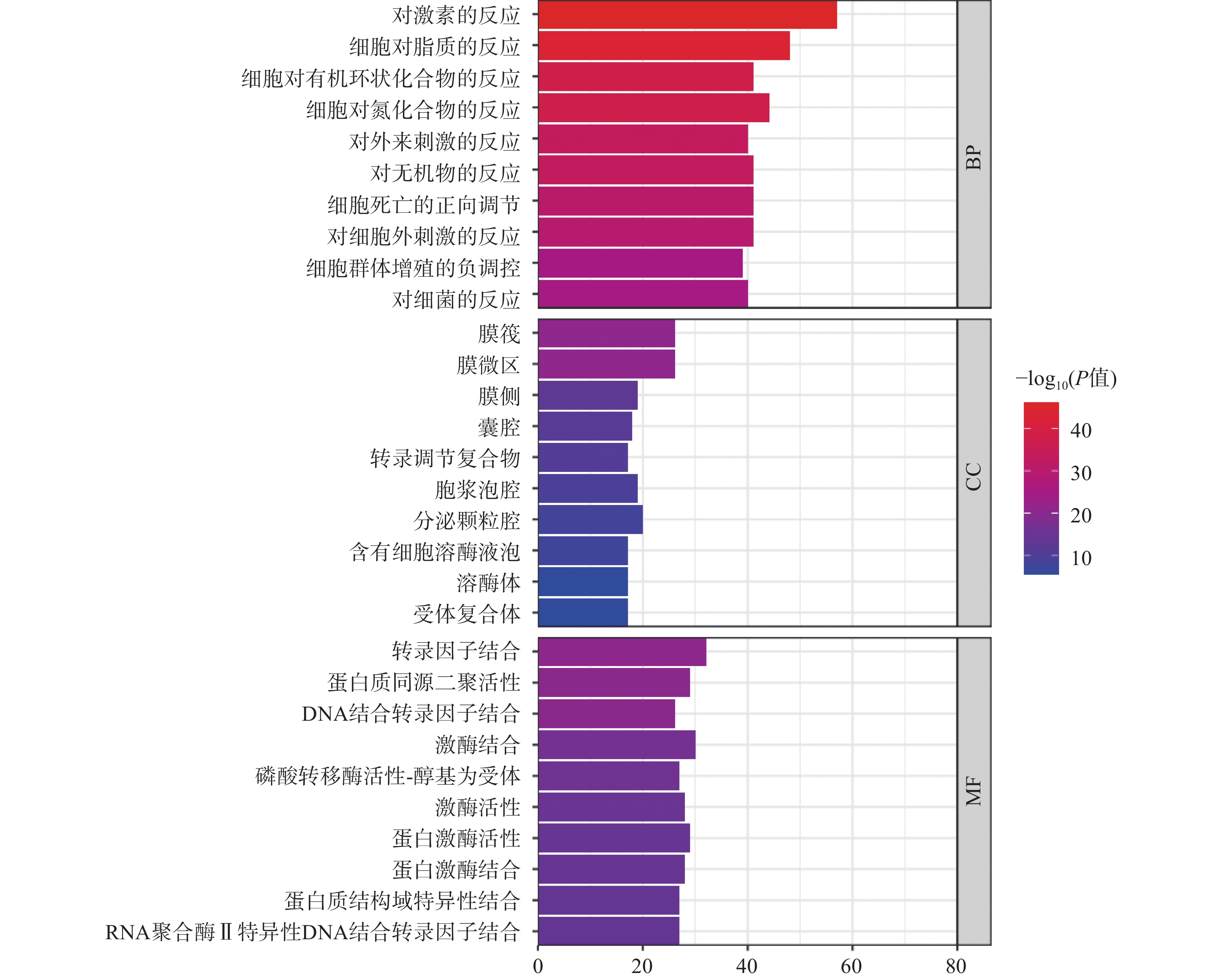
GO分析常用于注释基因和基因产物生物功能,分析包括生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组成(cellular component,CC)三部分。此次GO富集分析共得到BP富集结果193个、CC富集结果83个和MF富集结果123个,选取排名前10的条目绘制GO功能分析图(图3)。如图3所示,BP主要涉及对激素的反应、对脂质的反应、对异源刺激的反应等;CC主要涉及膜筏、膜微区、囊腔、细胞质囊泡腔等;MF主要涉及转录因子结合、DNA结合转录因子结合、RNA聚合酶Ⅱ特异性DNA结合转录因子结合等。通过比较发现,细胞生物过程富集的基因数较多,说明西红花可能主要通过调节生物过程发挥抗肿瘤作用。
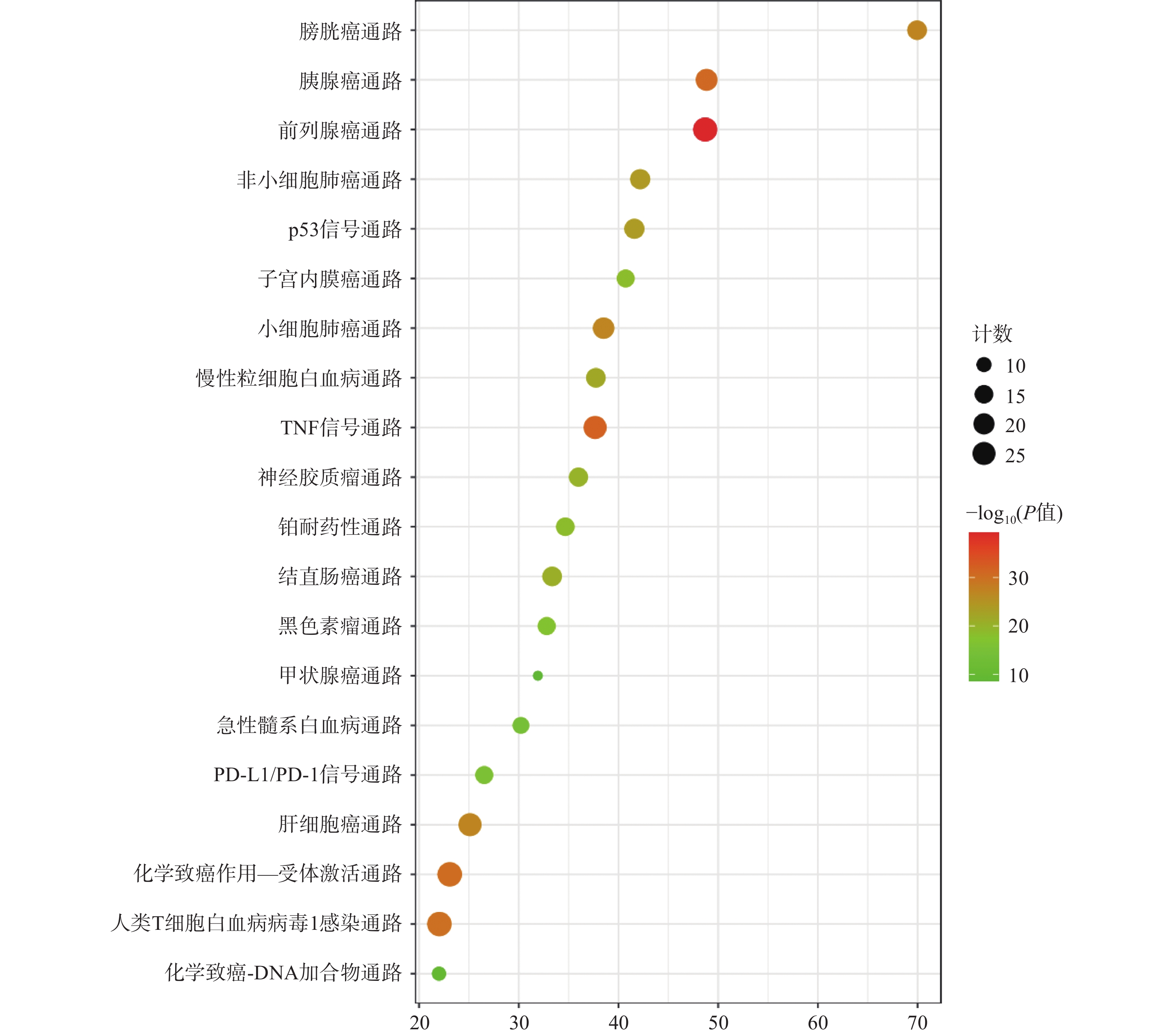
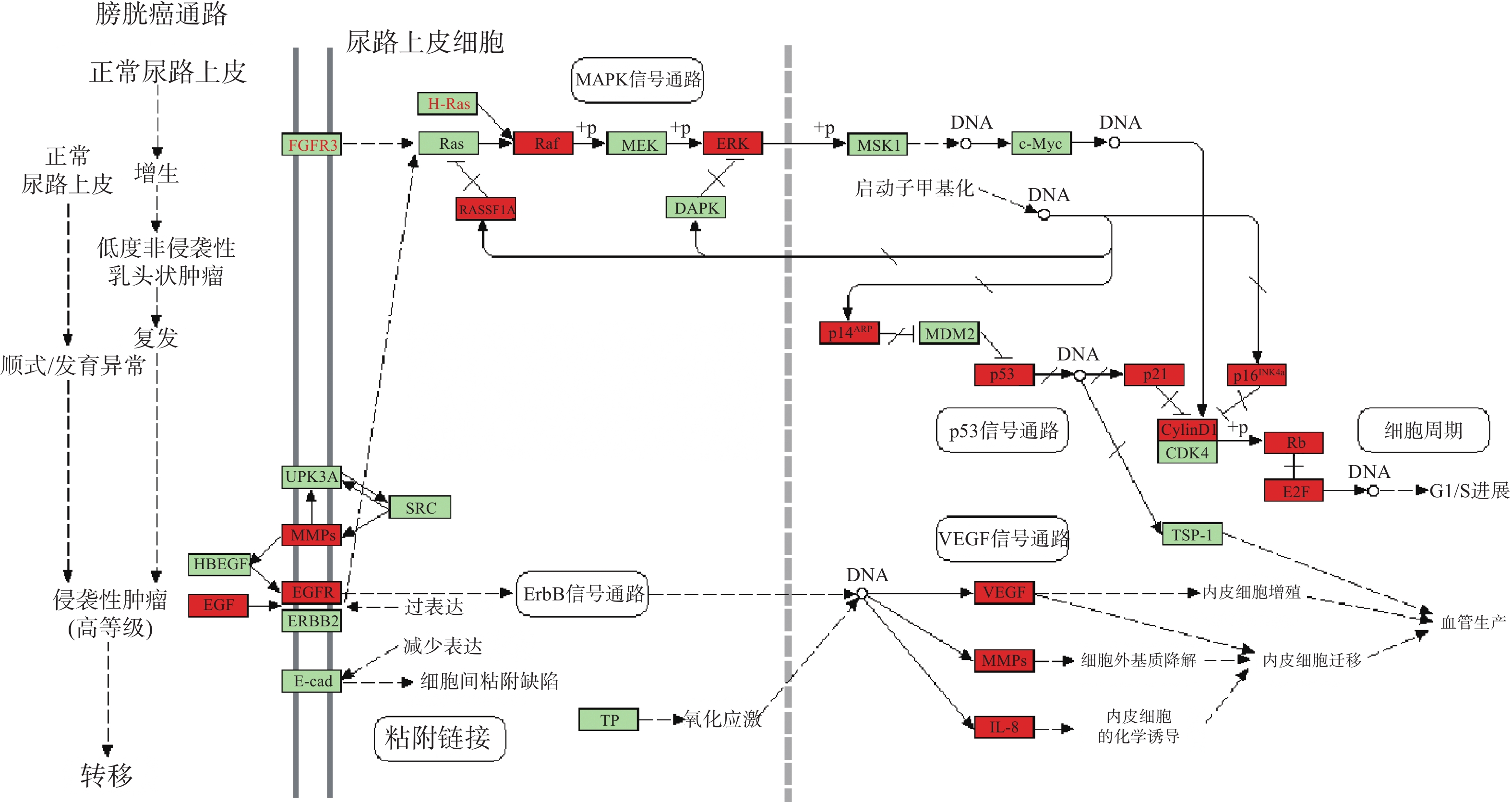
KEGG分析共富集到194条信号通路,其中34条癌症相关通路,并对前20条通路绘制气泡图(图4)。依据KEGG分析,西红花可能通过p53信号通路、TNF通路发挥抗肿瘤作用,可能对膀胱癌、胰腺癌、前列腺癌、非小细胞肺癌等肿瘤具有治疗作用,西红花靶点-通路相互作用网络见图5,红色三角形代表与肿瘤相关的信号通路,蓝色矩形代表关键靶点。其中,西红花通过膀胱癌信号通路调控EGF、MMPs、Raf、VEGF、ERK等基因发挥抗肿瘤作用(图6),红色矩形代表西红花可能干预的关键靶点。
2.6 分子对接
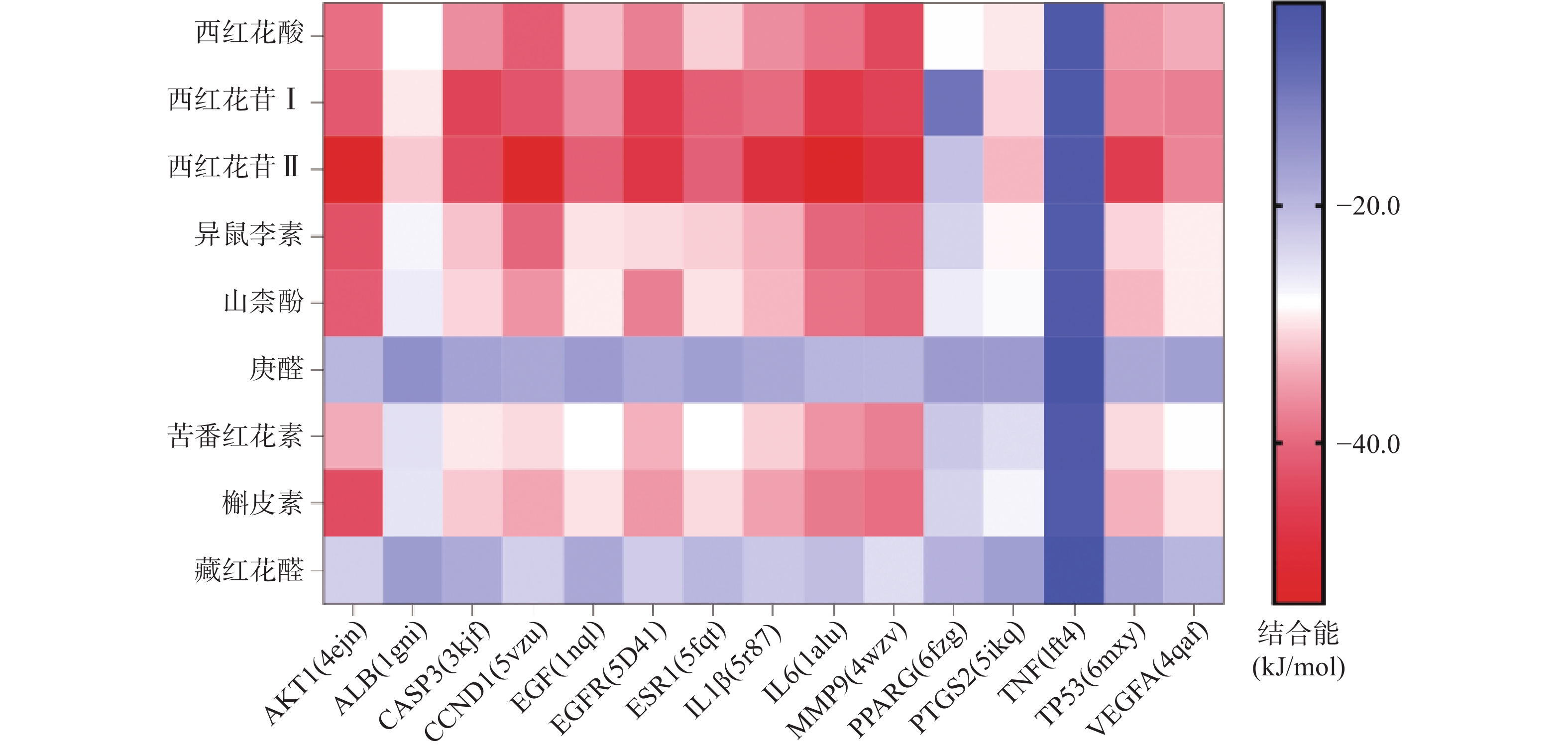
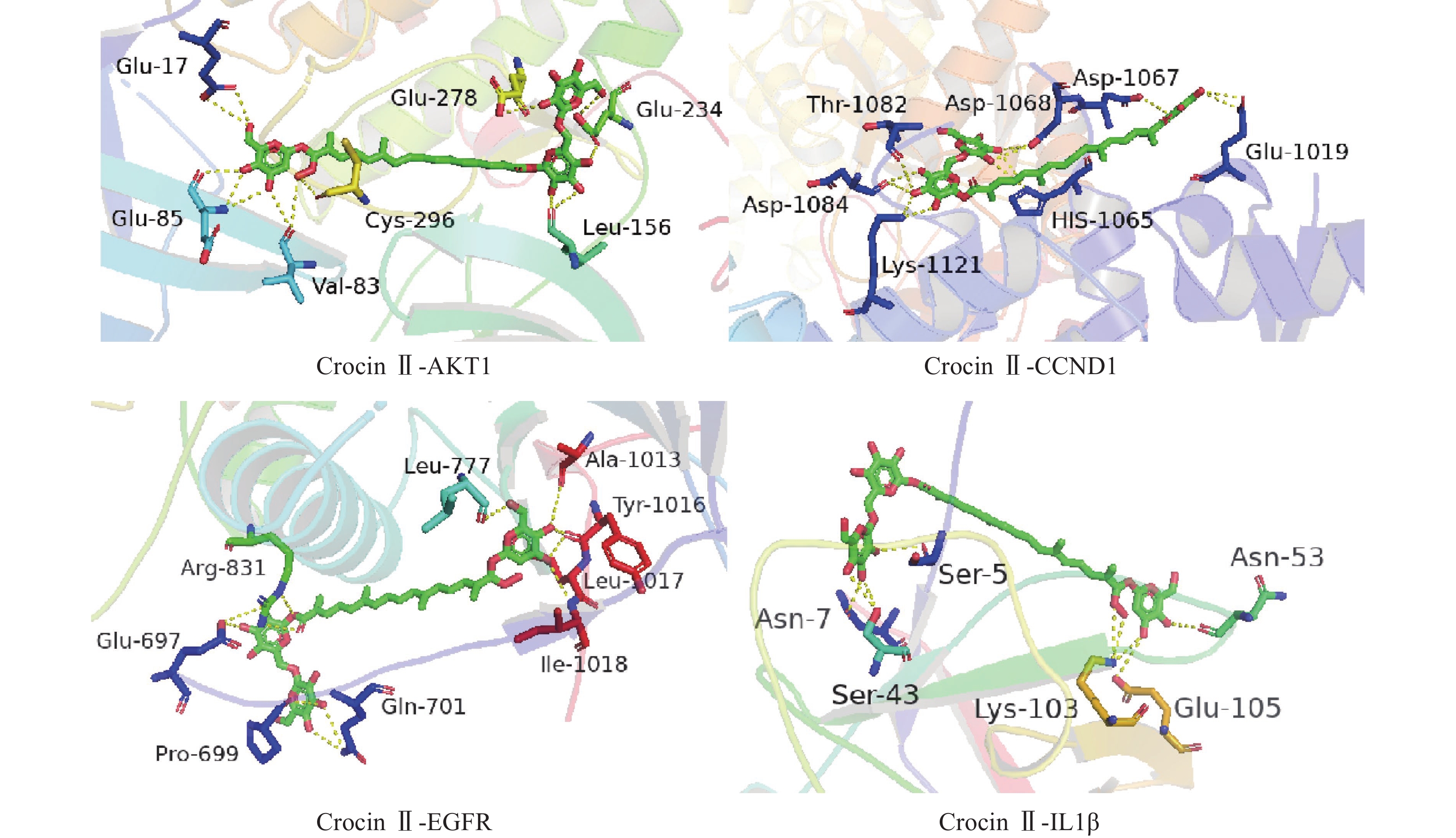
将前15个潜在核心靶点与西红花活性成分进行分子对接。结合能(affinity)<0表明配体分子能够与受体蛋白自发结合,结合能≤−17.78 kJ/mol表明配体与受体有一定的结合活性,结合能≤−20.92 kJ/mol 表明配体与受体有较好的结合活性,结合能≤−29.29 kJ/mol 表明配体与受体有强的结合活性[17],且结合能越低,表明对接的效果越好,结合的构象越稳定[18]。经AutoDock Vina对接,将得到的结合能数据使用热图展示(图7)。本研究结合自由能小于−20.92kJ/mol 的活性成分有102个,占75.6%;小于−29.29kJ/mol 的活性成分有73个,占54.1%,可见这些核心化合物与受体结合活性较高,结构相对稳定。选取结合能力最好的4个组合用Pymol软件进行可视化处理(图8)。
3. 讨论
肿瘤的发生和发展是多基因、多步骤的结果。中药多成分、多靶点的特点使其在肿瘤治疗方面有独特的优势。大量的临床实践表明,中药在治疗肿瘤中能够改善症状、提高患者生存质量、延长生存期等,有着其他治疗药物及手段不可替代的作用[19-20]。以中药黄芪为例,不仅可以通过Wnt5/β-catenin信号通路抑制肿瘤生长[21],同时具有通过PD-L1下调诱导耐药黑色素瘤的干性抑制和化疗敏感性增强的作用,可以减少化疗药物用量[22],还能充当免疫佐剂,提高患者免疫力,改善生存质量[23]。网络药理学最大的优势在于可以运用系统生物学的分析,为中药多成分、多靶点、多通路的机制研究提供有力的技术支撑[12],其分析理念和技术路径又与中医药治疗疾病的整体观相契合,已用于多种中药和中药复方作用机制的研究,如灯盏细辛、半枝莲等中药和茵陈蒿汤、桃红四物汤等中药复方,利用网络药理学的方法得到治疗机制的详细阐述和证明[24–27],为中药药理作用机制的探索提供了很好的参考。
本研究发现西红花中多种成分,如西红花酸、西红花苷等可与IL-6、AKT1、CCND1、IL-1β、MMP9、EGFR、TP53靶点产生适度结合,提示这些靶点可能是西红花中活性成分发挥抗肿瘤作用的关键靶点。研究发现,AKT1是PI3K-AKT-mTOR信号通路中的重要靶点,被磷酸化激活后可以促进细胞的增殖与存活,与肿瘤细胞的生长密切相关[28]。多项研究表明,通过抑制AKT1可以治疗肺癌、结肠癌、卵巢癌等多种实体癌[29]。EGFR与一些全球发病率和致死率高的癌症发病机制直接或间接相关,包括肺癌、乳腺癌和结直肠癌等[30]。当EGFR过度表达时,细胞表面会出现过量的受体,诱导正常的细胞转化为癌细胞,并为癌细胞持续生存提供条件[31]。CCND1是细胞周期家族的一员[32],公认的原癌基因,在甲状旁腺瘤、乳腺癌、肝癌及食管、肺、头颈部鳞状细胞癌的发生、发展过程中均起着重要作用[33-34]。西红花苷是由西红花酸和龙胆二糖或葡萄糖结合形成的二萜苷类化合物,西红花苷Ⅰ和西红花苷Ⅱ的差别在于分子中糖苷基数目的多少 [35]。西红花酸已具有抗肿瘤作用,以其为苷元形成的西红花苷同样也表现出较好的抗肿瘤活性,其中西红花苷Ⅱ的表现最好。西红花苷可以通过P53途径下调细胞周期蛋白d1和p21的表达,诱导细胞凋亡和细胞周期停滞,从而抑制肿瘤生长[36]。分子对接的结果与GO富集分析、KEGG通路富集分析结果一致,验证了网络药理学分析结果的正确性。
Buyun等学者在肝癌Hep3B和HepG2细胞中使用西红花苷抑制了IL-6对STAT3以及细胞周期蛋白D1的激活,验证了西红花对肝癌细胞的抗增殖,凋亡和阻断入侵作用[37]。在转移性乳腺癌的研究中,Ali等研究人员在体内和体外实验中均证明了西红花苷可以通过VEGF和MMP9下调发挥抗肿瘤作用,而且对乳腺癌的转移扩散有较好的抑制作用[38]。这些研究成果在一定程度上验证了利用网络药理学探究发现的西红花抗肿瘤作用机制的可行性。
综上所述,本研究利用网络药理学结合分子对接技术,探究西红花抗肿瘤作用的活性成分、作用靶点及信号通路。发现西红花抗肿瘤的作用具有多成分、多靶点、多通路、多机制的特点,其中以西红花苷为代表的西红花特有化学成分显示出了良好的抗肿瘤活性,可以在多条肿瘤发生通路中发挥作用,为西红花治疗肿瘤的深入研究提供了理论基础。但这些结果受限于各个数据库信息的片面性,而且只关注了成分,没有考量到成分的含量及其之间是否存在相互作用,预测的结果存在一定的片面性和局限性,需要进一步进行体内、外实验验证。
-
表 1 八宝丹梯度洗脱信息
时间(t/min) 水(含0.1%甲酸)(%) 乙腈(%) 0 95 5 2 95 5 4 70 30 8 50 50 10 20 80 14 0 100 15 0 100 15.1 95 5 16 95 5 表 2 Thermo-Obritrap-QE质谱参数信息
参数 正离子 负离子 喷雾电压(U/V) 3 800 −3 000 毛细管温度(T/°C) 320 320 辅助气体加热器温度(T/ ℃) 350 350 鞘气流量(Arb) 35 35 辅助气体流速(Arb) 8 8 S透镜射频水平 50 50 质量范围(m/z) 100~1 200 100~1 200 全质谱分辨率 70 000 70 000 串联质谱分辨率 17 500 17 500 质谱仪二级碎裂能量 10,20,40 10,20,40 -
[1] ZHENG R S, CHEN R, HAN B F, et al. Cancer incidence and mortality in China, 2022[J]. Zhonghua Zhong Liu Za Zhi, 2024, 46(3):221-231. [2] RUMGAY H, ARNOLD M, FERLAY J, et al. Global burden of primary liver cancer in 2020 and predictions to 2040[J]. J Hepatol, 2022, 77(6):1598-1606. [3] TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA A Cancer J Clin, 2015, 65(2):87-108. doi: 10.3322/caac.21262 [4] SIEGEL R L, MILLER K D, WAGLE N S, et al. Cancer statistics, 2023[J]. CA A Cancer J Clin, 2023, 73(1):17-48. [5] BROWN Z J, TSILIMIGRAS D I, RUFF S M, et al. Management of hepatocellular carcinoma: a review[J]. JAMA Surg, 2023, 158(4):410-420. [6] GILLES H, GARBUTT T, LANDRUM J. Hepatocellular carcinoma[J]. Crit Care Nurs Clin N Am, 2022, 34(3):289-301. doi: 10.1016/j.cnc.2022.04.004 [7] 张虎平, 马艳品. 八宝丹胶囊联合替诺福韦治疗乙型病毒性肝炎的临床研究[J]. 临床医学工程, 2021, 28(9):1221-1222. doi: 10.3969/j.issn.1674-4659.2021.09.1221 [8] 任军帮, 沈有秀, 张永刚, 等. 八宝丹胶囊治疗急性胆囊炎患者的临床研究[J]. 中国临床药理学杂志, 2023, 39(12):1689-1693. [9] 胡玮晔, 高司成, 朱小涵, 等. 八宝丹治疗肝脏疾病的临床与基础研究[J]. 中西医结合肝病杂志, 2023, 33(3):281-283. doi: 10.3969/j.issn.1005-0264.2023.003.024 [10] 徐意, 李伟, 楼妙姿, 等. 八宝丹胶囊治疗原发性肝癌化疗栓塞术后综合征临床研究[J]. 新中医, 2020, 52(16):104-106. [11] LIANG L, YANG X, YU Y, et al. Babao Dan attenuates hepatic fibrosis by inhibiting hepatic stellate cells activation and proli-feration via TLR4 signaling pathway[J]. Oncotarget, 2016, 7(50):82554-82566. [12] SCHULIEN I, HASSELBLATT P. Diethylnitrosamine-induced liver tumorigenesis in mice[J]. Methods Cell Biol, 2021, 163:137-152. [13] HOU J J, ZHANG H Y, SUN B C, et al. The immunobiology of hepatocellular carcinoma in humans and mice: basic concepts and therapeutic implications[J]. J Hepatol, 2020, 72(1):167-182. doi: 10.1016/j.jhep.2019.08.014 [14] HU K R, LI C J, YU T J, et al. Global analysis of qualitative and quantitative metabolism of Notoginsenoside R1 in rat liver-brain-gut axis based on LC-IT-TOF/MS combing mMDF strategy[J]. Phytomedicine, 2022, 104:154261. doi: 10.1016/j.phymed.2022.154261 [15] SEEHAWER M, HEINZMANN F, D’ARTISTA L, et al. Necroptosis microenvironment directs lineage commitment in liver cancer[J]. Nature, 2018, 562(7725):69-75. [16] ZUCMAN-ROSSI J, VILLANUEVA A, NAULT J C, et al. Genetic landscape and biomarkers of hepatocellular carcinoma[J]. Gastroenterology, 2015, 149(5): 1226-1239. [17] LEONE V, ALI A, WEBER A, et al. Liver inflammation and hepatobiliary cancers[J]. Trends Cancer, 2021, 7(7):606-623. doi: 10.1016/j.trecan.2021.01.012 [18] TO J C, CHIU A P, TSCHIDA B R, et al. ZBTB20 regulates WNT/CTNNB1 signalling pathway by suppressing PPARG during hepatocellular carcinoma tumourigenesis[J]. JHEP Rep, 2021, 3(2):100223. [19] XIAO Y, LIU G D, SUN Y, et al. Targeting the estrogen receptor alpha(ERα)-mediated circ-SMG1.72/miR-141-3p/Gelsolin signaling to better suppress the HCC cell invasion[J]. Oncogene, 2020, 39:2493-2508. doi: 10.1038/s41388-019-1150-6 [20] Qu C, He L, Yao N, et al. Myofibroblast-specific Msi2 knockout inhibits HCC progression in a mouse model[J]. Hepatology, 2021, 74(1):458-473. doi: 10.1002/hep.31754 -





 下载:
下载:


 下载:
下载: